中国海洋湖沼学会主办。
文章信息
- 杜美荣, 李凤雪, 方建光, 高亚平, 房景辉, 蒋增杰, 王同勇. 2019.
- DU Mei-Rong, LI Feng-Xue, FANG Jian-Guang, GAO Ya-Ping, FANG Jing-Hui, JIANG Zeng-Jie, WANG Tong-Yong. 2019.
- 桑沟湾养殖生态系统微食物环对长牡蛎(Crassostrea gigas)碳需求的贡献
- CONTRIBUTION OF MICROBIAL LOOP TO CARBON DEMAND OF CRASSOSTREA GIGAS IN SANGGOU BAY AQUACULTURE ECOSYSTEM
- 海洋与湖沼, 50(6): 1334-1342
- Oceanologia et Limnologia Sinica, 50(6): 1334-1342.
- http://dx.doi.org/10.11693/hyhz20190500087
文章历史
-
收稿日期:2019-05-07
收修改稿日期:2019-07-08
2. 青岛海洋科学与技术国家实验室 海洋渔业科学与食物产出过程功能实验室 青岛 266000;
3. 威海市文登区水产技术推广站 威海 264400
2. Function Laboratory for Marine Fisheries Science and Food Production Processes, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266000, China;
3. Weihai Wendeng Fishery Technology Extension Station, Weihai 264400, China
我国是水产养殖大国, 鱼、虾、贝、藻等均有养殖, 据农业农村部渔业渔政管理局等(2018)统计, 滤食性贝类占66.10%, 是沿海养殖的重要种类之一。长牡蛎(Crassostrea gigas)在中国南北沿海均有分布, 属于广温、广盐性贝类, 具有多年的养殖基础。由于无需投饵, 因此养殖海域饵料生物的供应情况是直接影响牡蛎养殖的关键因素(陈辰等, 2013)。养殖生态系统存在经典食物链和微食物环(microbial loop)(Azam et al, 1983), 在微食物环内, 生物粒径分为3个部分(pico-, 0.2—2μm; nano-, 2—20μm和micro-, 20—200μm), 主要代表生物为微微型浮游生物(0.2—2μm), 微型鞭毛虫(Nanoflagellates, NF, 2—20μm)和纤毛虫(Ciliates, 20—200μm), 我国在这方面的研究也取得了一定成果(潘科, 2006; 乐凤凤等, 2011; 丰美萍, 2014; 郭术津等, 2015)。研究表明, 微食物环是扇贝重要的旁路食物来源补充, 微微型浮游生物、微型鞭毛虫和纤毛虫在扇贝养殖生态系统中担负着重要的生态功能(Jiang et al, 2017)。桑沟湾是我国北方大型的贝藻养殖区, 近年来针对桑沟湾海域开展了大量深入细致的调查和研究, 对海域基础理化因子、贝、藻养殖容量等均有研究(方建光等, 1996a, b; 匡世焕等, 1996; 陆家昌, 2015), 但尚无微食物环生物对长牡蛎碳需求贡献的相关研究。本文对桑沟湾海域微食物环生物丰度和生物量开展了年度调查, 采用现场模拟流水法对长牡蛎对微食物环生物的滤食和截留进行了测定, 以期为深入研究长牡蛎的食谱组成及各组分生物对其的饵料贡献数据支撑, 也为准确评估桑沟湾长牡蛎的养殖容量提供科学依据, 保障桑沟湾长牡蛎养殖的健康可持续发展。
1 材料与方法 1.1 实验地点桑沟湾位于山东省荣成市, 三面环陆, 东临黄海。南北宽约11.5km, 东西宽约7.5km, 总面积约140km2, 湾内平均水深7.5m, 最深处21m。桑沟湾是我国北方重要的海水养殖区域, 以海带(Laminaria japonica)、龙须菜(Gracilaria lemaneiformis)、栉孔扇贝(Chlamys farreri)、长牡蛎(Crassostrea gigas)为主要养殖品种。整个桑沟湾西侧为贝类养殖区, 东侧湾外为海带养殖区, 中间区域为贝藻混养区(如图 1所示)。
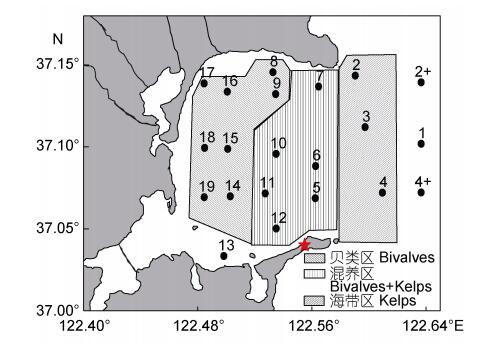 |
| 图 1 桑沟湾海域调查站位 Fig. 1 Sampling stations in Sanggou Bay |
本实验于2017年7月、2017年11月、2018年1月和2018年4月开展了四次海域调查, 全湾共设置21个采样站位, 站位分布如图 1所示, 每个站位的调查参数包括, 水温、盐度、透明度、叶绿素a (chl a)、微微型浮游生物(聚球藻、微微型真核浮游生物和异养细菌)、微型鞭毛虫和纤毛虫。具体取样方法如下:
水温、盐度使用YSI Pro plus现场测定。透明度采用透明度板测定。对海域现存chl a采取分级测定, 测定方法为分光光度计法:使用5L Niskin采水器采集水样, 然后准确量取1L水样过依次过滤于孔径2μm和孔径0.45μm的醋酸纤维素膜, 滤膜用锡纸包裹后冷冻保存待测(–20℃)。滤膜使用90%的丙酮避光低温萃取24h, 离心后使用分光光度计测定上清液分别在630、646、663、750nm下的吸光度值, 使用以下公式计算水样中的chl a。
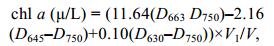 (1)
(1)式中: V—水样体积(L); D—相应波长下的吸光度值; V1—提取液定容后的体积
初级生产力的计算采用chl a进行估算, 公式为:
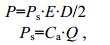 (2)
(2)其中, P为以chl a估算的初级生产力(mg/(m2·d)), Ps为表层水中浮游植物的潜在生产力, E为真光层的深度(m)(取透明度的3倍), D为日照时数(h), Ca为表层chl a浓度, Q为同化系数, 使用经验值3.7(王俊等, 2002)。
微微型浮游生物的测定采用流式细胞仪法, 准确移取4mL水样于已灭菌的5mL冻存管内, 立即加入多聚甲醛进行固定, 使其终浓度为1%, 然后迅速放入液氮中冷冻, 测试时, 将样品于室温融化后, 取1mL样品上样至FACS Calibur流式细胞仪进行检测, 激发光488nm。检测过程中使用2µm黄绿色荧光微球(polyseienees, 美国)作为标准内参。聚球藻(Synechococcus, SYN)含有藻红素和叶绿素, 于685nm处发射红色荧光, 560—590nm处发射橙色荧光, 微微型真核浮游生物(picoeukaryotes, PEUK)仅含叶绿素, 只能发出红色荧光, 由此区分聚球藻和微微型真核浮游植物。异养细菌(heterotrophic prokaryotes, HP)不含荧光基团, 需要使用染料染色后进行测定。取495µL水样加入5µL SYBR Green-I染色剂, 暗处染色15min后上机检测其丰度。微微型浮游生物的丰度使用碳转换系数转换为生物量, 其转换系数见表 1。
| 参数 | 种类 | 碳转换系数 |
| 叶绿素浓度chl a | chl a > 2μm | 50μgC/μg(Jiang et al, 2017) |
| chl a < 2μm | 82μgC/μg(Jiang et al, 2017) | |
| 微微型浮游生物(0.2—2μm)Picoplankton | 聚球藻 | 120gC/cell(赵苑, 2010) |
| 微微型真核浮游植物 | 239fgC/cell(赵苑, 2010) | |
| 异养细菌 | 20fgC/cell(赵苑, 2010) | |
| 微型鞭毛虫(2—20μm)Nanoflagellates | 220fg/μm3(陆家昌, 2015) | |
| 纤毛虫(20—200μm)Ciliates | 0.19pg/μm3(于莹等, 2013) |
微型鞭毛虫(2—20μm)的水样取样时首先使用20μm筛绢过滤, 然后准确移取水样50mL于灭菌的离心管中, 立即加入提前冰浴的25%戊二醛溶液固定, 终浓度为0.5% (V/V)。回到实验室将水样过滤20mL到黑膜(饱和苏丹黑染色的核孔膜, 孔径0.22μm), 待滤杯中水样剩余约1mL时, 关闭负压, 加入荧光染料4′, 6-二脒基-2-苯基吲哚(终浓度为10μg/mL), 混匀染色10min后滤干剩余液体。并制作成玻片于Lecia DM4500荧光显微镜镜检并计数。在紫外激发光下观察和计算每个视域下的总微型鞭毛虫(NF)的数量, 显微镜计数视域不少于20个, 以保证至少检测到100个鞭毛虫。使用公式计算鞭毛虫丰度。同时使用软件测量鞭毛虫细胞的长径(a)和短径(b)。通过含色素体微型鞭毛虫(pigmented nanoflagellates, PNF, 自养和混合营养鞭毛虫)和异养微型鞭毛虫(heterotrophic nanoflagellates, HNF)这两个类群的变化来探讨微型鞭毛虫群落的营养结构变化。根据以下公式计算微型鞭毛虫的体积, 并使用碳转换系数计算鞭毛虫的生物量(表 1)。

纤毛虫的取样:现场采集水样1L使用卢戈氏液固定后, 带回实验室浓缩后在倒置显微镜下进行纤毛虫的计数。并逐一测量纤毛虫的尺寸, 计算每个纤毛虫的体积, 使用体积碳转换系数计算生物量(表 1)。
1.2.2 现场流水实验实验在桑沟湾南侧楮岛海域开展(图 1中标星的位置), 实验时间为2018年6月份。采用模拟现场流水法, 在近岸搭建流水槽系统(Jiang et al, 2017), 实验使用水槽12个, 其中4个对照组(不放养殖生物), 8个处理组(每个流水槽放1个长牡蛎)。长牡蛎在室内流水槽暂养驯化48h, 水流流速控制为200—300mL/min。挑选摄食、排便正常的长牡蛎开始实验。
待流速稳定后实验开始, 每隔4h后进行微微型浮游生物、微型鞭毛虫、纤毛虫和chl a分级样品的取样, 连续取样3次, 分别在8:00、12:00、16:00取样, 避免夜间取样, 防止摄食节律对实验造成影响。实验结束测定贝类壳高、壳长、软体部干重。长牡蛎规格为:平均壳高: (14.19±1.86)mm, 平均湿重: (214.5±38.88)g, 软体部干重(2.01±0.71)g。根据处理组、空白对照出水口微微型浮游生物、鞭毛虫、纤毛虫的数量、生物量计算贝类的清滤率以及对不同浮游生物的截留率等摄食生理参数。其中所需公式如下:
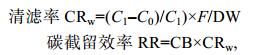 (3)
(3)其中: C1为对照组出水口浓度, C0为处理组出水口浓度, F为流速(L/h), DW为长牡蛎软体部干重(g), CB为对应生物碳含量(μgC/L)。
桑沟湾的颗粒态初级生产力使用6月份桑沟湾海域调查的Chl a和透明度依据以上公式计算。使用光和有机碳细胞外释放比例(PER, 23.1%)(刘诚刚, 2012)反推计算总初级生产力和溶解态处理生产力。根据现场实验中对照组的 > 2μm和 < 2μm生物的生物量数据计算计算其在颗粒态初级生产力中贡献的比例。以现场实验对照组 > 2μm以下生物量为 < 2μm微微型浮游生物(聚球藻, 微微型真核浮游生物和其他可贡献叶绿素的生物)贡献。> 2μm chl a、聚球藻、微微型真核浮游生物、异养细菌、微型鞭毛虫和纤毛虫对牡蛎的食物日贡献分别依据牡蛎对其碳摄食率计算。依据以上计算方式绘制桑沟湾海区碳硫途径图。
1.3 数据分析不同季节chl a浓度、微微型浮游生物、微型鞭毛虫和纤毛虫丰度的差异比较采用单因素方差分析, 统计使用SPSS 19.0软件。P < 0.05为差异显著, P < 0.01为差异极显著。
2 结果 2.1 桑沟湾微食物环生物丰度和生物量年度变化实验对桑沟湾全年不同季节的微微型浮游生物、微型鞭毛虫和纤毛虫调查结果显示, 三种浮游生物丰度和生物量, 全年皆以冬季最低(P < 0.05)。针对微微型浮游生物而言, 丰度和生物量均以夏季最高(P < 0.05)。其中, 丰度和生物量均为HP贡献最大(P < 0.01)(图 2)。
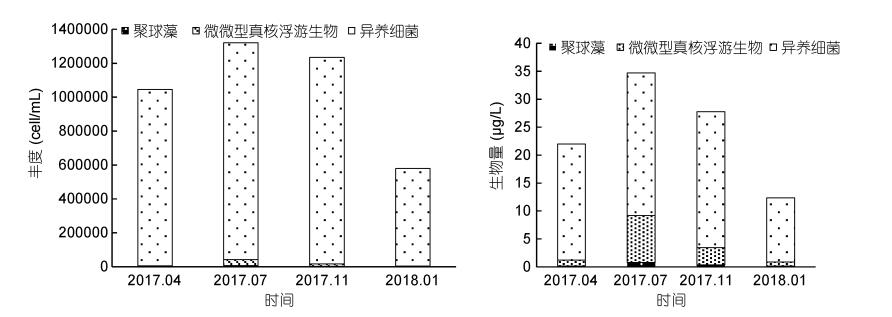 |
| 图 2 桑沟湾海域微微型浮游生物丰度和生物量的季节变化 Fig. 2 The seasonal distribution of picoplankton abundance and biomass in the Sanggou Bay |
微型鞭毛虫丰度春夏季相仿, 差异不显著, 高于秋季和冬季。其生物量春季显著高于其他3个季节, 夏秋季差异不显著。就微型鞭毛虫的种类组成丰度而言, 全年主要以HNF为主, 显著大于PNF(P < 0.05), 不同种类的生物量除夏季HNF和PNF生物量相当, 春、秋、冬季仍然以HNF为主, 显著大于PNF生物量(图 3)。
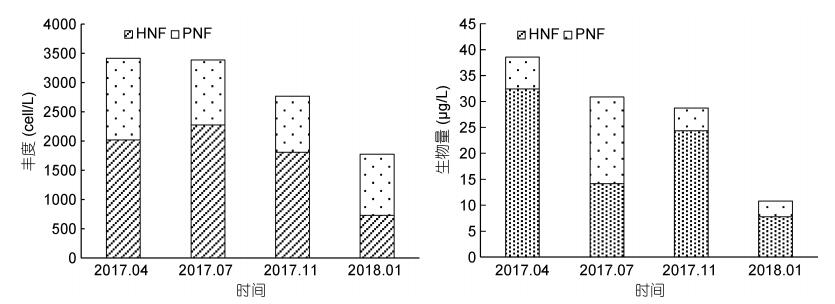 |
| 图 3 桑沟湾海域微型鞭毛虫丰度和生物量的季节变化 Fig. 3 The seasonal distribution of nanoflagellates abundance and biomass in the Sanggou Bay |
纤毛虫的丰度和生物量皆为春、夏、秋季三个季节较高, 组间差异不显著, 均高于冬季(P < 0.05)。主要以无壳纤毛虫为主(P < 0.05)(图 4)。
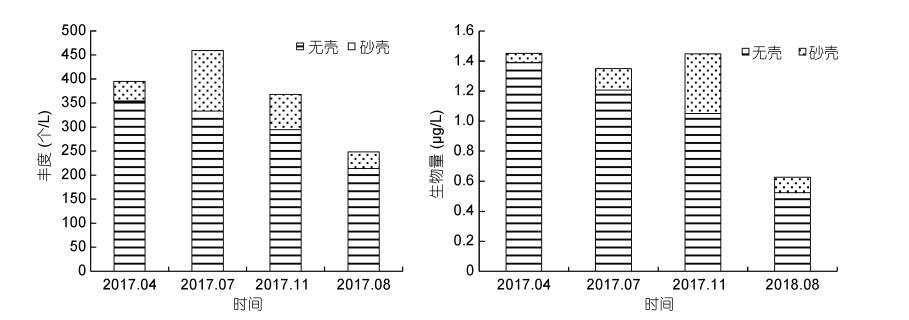 |
| 图 4 桑沟湾纤毛虫丰度和生物量的季节变化 Fig. 4 The seasonal distribution of ciliates abundance and biomass in the Sanggou Bay |
对桑沟湾全年的浮游生物生物量分析表明, 组成微食物环的三大类浮游生物中, 微型鞭毛虫贡献最大, 占51.69%(HNF贡献37.31%, PNF贡献14.38%); 微微型浮游生物的贡献次之(45.97%), 其中异养细菌贡献了39.03%的生物量; 纤毛虫贡献较小, 仅为2.31%(表 2)。
| 浮游生物的种类 | 生物量全年平均值(μgC/L) | 平均贡献率(%) | 平均贡献率(%) | |
| 微微型浮游生物 | 微微型真核 | 3.31±2.53 | 6.28±5.71 | 45.97 |
| 数据范围 | 0.74—8.38 | 1.41—15.90 | ||
| 聚球藻 | 0.35±0.32 | 0.78±0.60 | ||
| 数据范围 | 0.11—0.80 | 0.05—0.47 | ||
| 异养细菌 | 20.57±6.37 | 39.03±12.09 | ||
| 数据范围 | 11.51—25.58 | 21.84—48.56 | ||
| 微型鞭毛虫 | HNF | 19.66±10.91 | 37.31±20.69 | 51.69 |
| 数据范围 | 7.75—32.41 | 14.71—61.50 | ||
| PNF | 7.58±6.22 | 14.38±11.80 | ||
| 数据范围 | 3.06—16.72 | 5.80—31.73 | ||
| 纤毛虫 | 纤毛虫 | 1.22±0.40 | 2.31±0.75 | 2.31 |
| 数据范围 | 0.63—1.45 | 1.19—2.76 | ||
对实验期间海水基础数据分析表明, 自然海水中浮游植物主要以2μm以上的微型和小型浮游植物为主, 其chl a极显著大于微微型浮游植物(P < 0.01)。以chl a换算成碳, 小型和微型浮游植物碳总和占82.95%, 微微型浮游植物占17.05%。从丰度来看, 微微型浮游生物和微型鞭毛虫是主要组成, 数量分别为(35.59±9.6)×108cell/L和(3.17±0.59)×106cell/L。微食物环生物总碳贡献为105.85μgC/L, 其中, HP是主要贡献者(69.41%), 其次是NF(16.90%)(表 3)。
| 参数 | 对照组丰度 | 对照组生物量(以碳计)(μgC/L) | 处理组丰度 | 清滤率[L/(g·h)] | 碳截留率[μg/(g·h)] | |
| chl a > 2μm (μg/L) | 2.37±0.53 | 118.30±11.20 | 1.78±0.29 | 2.45±0.53 | 289.20±62.36 | |
| chl a < 2μm (μg/L) | 0.30±0.05 | 24.31±4.26 | 0.18±0.06 | 1.83±0.05 | 44.60±1.30 | |
| 微微型真核(cell/L) | (45.9±0.40)×106 | 10.97±0.93 | (39.30±0.05)×106 | 0.59±0.15 | 6.47±1.75 | |
| 聚球藻(cell/L) | (42.6±0.80)×106 | 5.11±0.97 | (40.40±0.60)×106 | 0.43±0.17 | 2.24±0.88 | |
| 异养细菌(cell/L) | (34.7±9.60)×108 | 69.41±19.36 | (27.00±11.80)×108 | 0.26±0.15 | 18.06±4.07 | |
| 微型鞭毛虫(cell/L) | 有色素体鞭毛虫 | (1.33±0.23)×106 | 5.01±1.39 | (0.74±0.18)×106 | 1.25±0.32 | 14.92±2.78 |
| 无色素体鞭毛虫 | (1.84±0.35)×106 | 12.89±1.93 | (1.03±0.38)×106 | 1.73±0.43 | 38.37±3.67 | |
| 纤毛虫(cell/L) | (1.65±0.46)×103 | 2.46±0.83 | (1.13±0.27)×103 | 3.50±1.46 | 8.63±3.61 | |
使用模拟现场流水法, 测定了长牡蛎对浮游生物的摄食, 其清滤率变化范围为0.26—3.50L/(g·h), 随着粒径的增大, 长牡蛎对浮游生物的清滤率增加。长牡蛎对不同浮游生物的清滤率由大到小依次为: 2μm以上有色素体浮游生物 > 纤毛虫 > 2μm以下有色素体浮游生物 > 无色素体微型鞭毛虫 > 异养细菌, 长牡蛎对2μm以上有色素体浮游生物碳截留最大[289.20±62.36μg/(g·h)], 其次是无色素体微型鞭毛虫、异养细菌和纤毛虫。
2.3 桑沟湾长牡蛎养殖区碳的物质流动为了更好地理解浮游生物对长牡蛎食物来源的贡献, 以现场摄食实验为基础绘制了桑沟湾长牡蛎养殖区碳流途径图(图 5), 基于6月份大面调查的chl a和透明度依据1.2.1中初级生产力的计算方法计算桑沟湾6月份的颗粒态初级生产力为169.71mg/(m2·d), 使用光和有机碳细胞外释放比例(PER, 23.1%)(刘诚刚, 2012)反推计算总初级生产力(222.13mg/(m2·d)), 微微型浮游生物中有叶绿素的生物(PEUK和SYN)为颗粒态光和有机产物贡献了13.36%, PEUK贡献了其中的45.13%, SYN贡献了其中的21.02%, 其他未知部分贡献了33.85%。有52.42mg/(m2·d)的溶解有机物释放, 并被HP利用, 通过直接被长牡蛎摄食或者经过原生动物的食物链传递到长牡蛎。长牡蛎从浮游生物获取的总碳为8713.4μg/(g·d)。其中微型和小型浮游植物贡献了76.53%, 无色素体微型鞭毛虫和纤毛虫共贡献了12.97%, 其次是微微型浮游生物(7.37%)。
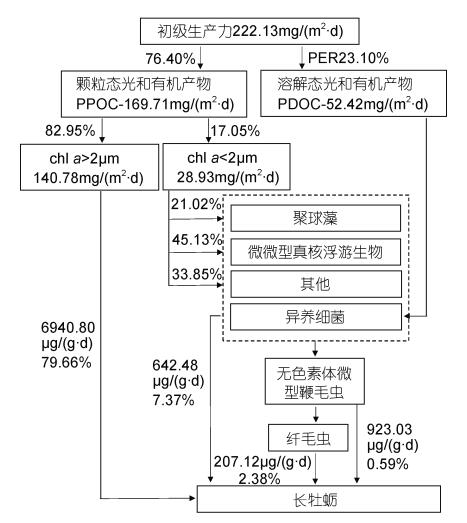 |
| 图 5 桑沟湾长牡蛎养殖区碳的物质流动 Fig. 5 A tentative carbon flow schematic diagram in spring 2018 in the Sanggou Bay |
传统食物链认为, 海水中的浮游植物通过光合作用固定初级生产力, 被滤食性贝类摄食后向较高的营养级传递(Jacobs et al, 2015)。近年来, 随着海洋微生物观测技术与手段的不断进步, 微微型浮游生物(HP, SYN和PEUK)在海洋生态系统中担负的重要作用引起了人们的关注。海洋是全球最大的有机碳库, 其中的碳大部分为溶解态(dissolved organic carbon, DOC, 占海洋有机碳含量的80%—95%), 主要来源为植物光合作用释放、动物排泄、粪便分解和摄食释放等。在黄海海域, 浮游植物释放的光合溶解有机物(photosynthetically produced dissolved organic carbon, PDOC)占总初级生产力平均为23.1%(PER)(刘诚刚, 2012)。桑沟湾是我国北方大型的贝藻养殖区, 年产海带53万吨(荣成市科技局统计数据), 占我国海带产量的23.79%(农业农村部渔业渔政管理局等, 2018), 主要养殖贝类(栉孔扇贝, 长牡蛎和鲍等)年产量总和13万吨。贝、藻的养殖活动贡献了大量的溶解有机碳, 桑沟湾POC的年平均浓度为0.55mg/L, DOC年平均浓度为2.03mg/L(为POC的3.69倍(夏斌等, 2013))。溶解有机物虽无法直接进入进入传统食物链, 但可被异养细菌(HP)利用, 并通过HP(微微型浮游生物)→浮游动物(微型鞭毛虫和纤毛虫等)→桡足类的微食物环(microbial loop)途径向上一级食物链传递。
长牡蛎为滤食性生物, 其鳃的鳃丝间隔很大程度上决定了其能够摄食的饵料粒径, 不同贝类对颗粒物的截留率不同, 地中海贻贝(Geukensia demissa)、大西洋浪蛤(Spisula solidissima)、硬壳蛤(Mercenaria mercenaria)能完全截留4μm以上的颗粒物, 而对4μm以下的颗粒物截留率仅为35%—70%。拥有较小侧纤毛的维吉尼亚美东牡蛎(Crassostrea virginica)能完全截留5μm以上的颗粒物, 而2μm以下的颗粒物只能截留50% (Riisg rd, 1988; Evan Ward et al, 2004), 虽然截留率较低, 但2μm以下的微微型浮游生物在通过微食物环帮助离开食物链的溶解有机物(DOC)再次进入食物网过程中肩负了重要的桥梁作用(蒋增杰等, 2015; Jiang et al, 2017)。对法国Takapoto Atoll泻湖的调查发现, 初级生产力主要由2μm以下的微微型浮游生物贡献, 但是该湖的主要养殖生物珍珠贝(Pinctada margaritifera)的生长和产量却十分可观, 摄食实验表明, 珍珠贝的主要食物来源为原生动物, 能量沿着DOC→微微型浮游生物→原生动物→珍珠贝物的途径传递, 微食物环在其中肩负重要作用, 2μm以下的微微型浮游生物产生的初级生产力支撑了原生动物的生物量从而保证了珍珠贝的食物来源(Loret et al, 2000)。除了被间接摄食外, 异养细菌粒径虽小, 但是依然有被摄食的机会。本文的研究中, 海域现存微微型浮游生物可提供的生物量十分可观, 年平均可达24.23μgC/L(贡献率45.97%), 虽然清滤率较低, 但异养细菌碳截留依然可以达到18.06μg/(g·h)(7.37%), 除了异养细菌丰度较高、生物量较大的“菌海战术”以外, 还与细菌有可能附着于粒径较大的浮游生物形成“聚合体”并借助牡蛎鳃表面纤毛以及黏液被贝类间接摄食有关(Ward et al, 1993; Kach et al, 2008)。
本文对微微型浮游生物的调查结果表明生物量夏、秋季最高, 冬春季较低, 全年分布皆为异养细菌贡献最大, 超过90%, 这与赵燕楚等(2018)的结果一致。桑沟湾的海带收获时间从每年的4月中旬开始, 到7月底结束, 这期间从湾内到湾外, 水温呈降低趋势(Jiang et al, 2017), 因此海带的收获也是从湾内开始逐渐向外, 直至7月底收获到湾口位置。PEUK和SYN为光合自养浮游生物, 其丰度和生物量受光照和营养盐影响, 桑沟湾大面积的大型藻养殖压制了营养盐水平, 相应地压制了微微型真核浮游生物和聚球藻的丰度和生物量, 从4月中旬开始的海带收获释放了桑沟湾内营养盐的压力(徐东会等, 2017), 给予了PEUK和SYN足够的机会进行生长和繁殖, 使得4月和7月丰度和生物量逐渐提升。
本文对长牡蛎对浮游生物的碳截留研究表明微型和小型浮游植物为长牡蛎的主要食物来源, 其次是原生动物, 微微型浮游生物贡献较小, 微食物环贡献率为20.34%。这低于蒋增杰等对栉孔扇贝的研究结果, 原生动物为栉孔扇贝的碳来源贡献了48.78%, 微食物环贡献58.45% (Jiang et al, 2017)。本文与Jiang等(2017)和Fournier等(2012)研究结果不同的是, 对长牡蛎的食物贡献最大的是2μm以上的浮游植物, 而非微型鞭毛虫, 由于季节不同, 浮游生物的优势类群有别, 浮游生物之间复杂的捕食-被捕食者之间的关系也影响了浮游生物的群落结构, 本研究中实验期间微型鞭毛虫的丰度和生物量[(3.17±0.59)×106cell/L, (17.9±3.93)μg/(g·h)]为蒋增杰等实验期间生物量的28.57%[(6.20±2.22)×106cell/L, (63.72±12.37)μg/(g·h)], 导致碳截留率较低。本实验中, 长牡蛎对不同粒径的清滤率遵循粒径越大, 清滤率越高的规律:纤毛虫 > 微型鞭毛虫 > 微微型浮游生物, 这与蒋增杰等对栉孔扇贝的现场摄食实验结果一致(Jiang et al, 2017)。
传统的对贝类滤水、摄食实验需要的参数有chl a、颗粒有机物(POM)、颗粒有机碳(POC)等(王俊等, 2000, 2004; 张继红等, 2006)。匡世焕等用POM和chl a分别计算栉孔扇贝的滤水率和同化率, 结果表明基于POM测出的滤水率大于基于chl a计算出来的滤水率。除了孔径的差异外(POM: 1.2μm, chl a: 0.45μm), 也与膜上的截留物有关, POM的浓度受海况和风浪的影响较大, 不如chl a稳定(匡世焕等, 1996), 而chl a只测定了有色素体的浮游生物却忽略了大部分无色素体的异养浮游生物, 造成对贝类食物来源的计算并不全面。在浮游生物类群中, 贡献chl a的有SYN、PEUK和PNF, 其中忽略了异养细菌、HNF以及纤毛虫等, 在桑沟湾海域全年调查结果中, 这三种生物的碳贡献约占浮游生物总碳的78.67%, 长牡蛎对三种生物的碳截留为1563.58μg/(g·d) (17.94%), 数量可观, 不可忽视。受工作量和篇幅限制, 因6月份是海区浮游生物数量和种类相对较高的季节, 本文仅分析并列明了6月份桑沟湾扇贝养殖区的碳硫途径图, 因不同季节海区微食物环组成, 浮游生物数量等有较大差别, 本文的碳流途径并不适用于其他季节, 其他月份的实验有待于进一步开展现场实验进行分析。
4 结论(1) 桑沟湾海域浮游生物生物量以2μm以上浮游生物最高, 其次是异养细菌。长牡蛎对2μm以上浮游生物的截留最高(289.20μg/(g·h)), 其次是微型鞭毛虫(53.29μg/(g·h)), 然后是微微型浮游生物(26.77μg/(g·h))。
(2) 传统的对于贝类食物来源的测定方法忽略了异养细菌、HNF以及纤毛虫, 对6月份桑沟湾海域微食物环框架分析得出3种微食物环生物对长牡蛎的碳贡献为1563.58μg/(g·d) (17.94%), 指示原生动物在长牡蛎的食谱组成中的地位不可忽视。异养细菌除了参与微食物环, 还能被长牡蛎直接或者间接的摄食, 成为长牡蛎的食物来源之一(由于现场摄食实验于6月份开展, 故以上数据仅代表 6月份的水平)。
于莹, 张武昌, 蒋增杰, 等. 2013. 桑沟湾浮游纤毛虫丰度和生物量分布的季节变化. 海洋学报, 35(3): 215-224 DOI:10.3969/j.issn.0253-4193.2013.03.025 |
丰美萍, 2014.砂壳纤毛虫分类和几个海区的分布研究.青岛: 中国科学院研究生院(海洋研究所)博士学位论文, 106-107
|
王俊, 李洪志. 2002. 渤海近岸叶绿素和初级生产力研究. 海洋水产研究, 23(1): 23-28 |
王俊, 姜祖辉, 张波, 等. 2000. 太平洋牡蛎同化率的研究. 应用生态学报, 11(3): 441-444 DOI:10.3321/j.issn:1001-9332.2000.03.028 |
王俊, 姜祖辉, 唐启升. 2004. 栉孔扇贝生理能量学研究. 海洋水产研究, 25(3): 46-53 |
方建光, 匡世焕, 孙慧玲, 等. 1996a. 桑沟湾栉孔扇贝养殖容量的研究. 海洋水产研究, 17(2): 18-31 |
方建光, 孙慧玲, 匡世焕, 等. 1996b. 桑沟湾海带养殖容量的研究. 海洋水产研究, 17(2): 7-17 |
乐凤凤, 刘诚刚, 郝锵, 等. 2011. 2009年春季南黄海聚球藻生长率、被摄食消亡率及其与环境因子的关系. 海洋学研究, 29(1): 34-41 DOI:10.3969/j.issn.1001-909X.2011.01.005 |
匡世焕, 方建光, 孙慧玲, 等. 1996. 桑沟湾栉孔扇贝不同季节滤水率和同化率的比较. 海洋与湖沼, 27(2): 194-199 DOI:10.3321/j.issn:0029-814X.1996.02.013 |
刘诚刚, 2012.中国近海浮游植物光合溶解有机碳生产研究.青岛: 中国海洋大学博士学位论文, 85-87
|
农业农村部渔业渔政管理局, 全国水产技术推广总站, 中国水产学会编制, 2018.中国渔业统计年鉴2018.北京: 中国农业出版社
|
张继红, 方建光. 2006. 栉孔扇贝对春季桑沟湾颗粒有机物的摄食压力. 水产学报, 30(2): 277-280 |
陆家昌, 2015.桑沟湾微型鞭毛虫的生态学研究.厦门: 厦门大学博士学位论文, 119-121
|
陈辰, 李琪, 慕翠敏. 2013. 乳山牡蛎养殖海域水质状况季节分析与评价. 海洋湖沼通报, (1): 38-44 |
赵苑, 2010.黄海和东海微微型浮游生物分布研究.青岛: 中国海洋大学博士学位论文, 123-124
|
赵燕楚, 赵丽, 张武昌, 等. 2018. 桑沟湾微微型浮游生物丰度和生物量分布的季节变化. 海洋科学, 42(5): 145-154 |
夏斌, 陈碧鹃, 崔毅, 等. 2013. 夏季桑沟湾养殖水域有机碳的平面分布特征及其来源分析. 渔业科学进展, 34(1): 44-49 DOI:10.3969/j.issn.1000-7075.2013.01.007 |
徐东会, 陈碧鹃, 江涛, 等. 2017. 桑沟湾养殖海域营养盐时空分布特征及富营养化评价. 渔业科学进展, 38(3): 1-11 |
郭术津, 丰美萍, 张瑞峰, 等. 2015. 2012年6月份桑沟湾褐潮期间浮游植物和浮游纤毛虫群落结构特征. 海洋科学, 39(12): 56-64 DOI:10.11759/hykx20140325001 |
蒋增杰, 杜美荣, 姜绪, 等. 2015. 獐子岛海域浮游植物的粒径结构及碳流途径. 渔业科学进展, 36(4): 35-43 |
潘科, 2006.海洋异养鞭毛虫摄食与生长的实验生态学研究.厦门: 厦门大学硕士学位论文, 62-63
|
Azam F, Fenchel T, Field J G et al, 1983. The ecological role of water-column microbes in the sea. Marine Ecology Progress, 10: 257-263 DOI:10.3354/meps010257 |
Evan Ward J, Shumway S E, 2004. Separating the grain from the chaff:particle selection in suspension-and deposit-feeding bivalves. Journal of Experimental Marine Biology and Ecology, 300(1-2): 83-130 DOI:10.1016/j.jembe.2004.03.002 |
Fournier J, Dupuy C, Bouvy M et al, 2012. Pearl oysters Pinctada margaritifera grazing on natural plankton in Ahe atoll lagoon (Tuamotu Archipelago, French Polynesia). Marine Pollution Bulletin, 65(10-12): 490-499 DOI:10.1016/j.marpolbul.2012.03.026 |
Jacobs P, Riegman R, van der Meer J, 2015. Impact of the blue mussel Mytilus edulis on the microbial food web in the western Wadden Sea, The Netherlands. Marine Ecology Progress Series, 527(3): 119-131 |
Jiang Z J, Du M R, Fang J H et al, 2017. Size fraction of phytoplankton and the contribution of natural plankton to the carbon source of Zhikong scallop Chlamys farreri in mariculture ecosystem of the Sanggou Bay. Acta Oceanologica Sinica, 36(10): 97-105 DOI:10.1007/s13131-017-0970-x |
Kach D J, Ward J E, 2008. The role of marine aggregates in the ingestion of picoplankton-size particles by suspension-feeding molluscs. Marine Biology, 153(5): 797-805 DOI:10.1007/s00227-007-0852-4 |
Loret P, Le Gall S, Dupuy C et al, 2000. Heterotrophic protists as a trophic link between picocyanobacteria and the pearl oyster Pinctada margaritifera in the Takapoto lagoon (Tuamotu Archipelago, French Polynesia). Aquatic Mirobial Ecology, 22(3): 215-226 |
Riisgård H U, 1988. Efficiency of particle retention and filtration rate in 6 species of Northeast American bivalves. Marine Ecology Progress Series, 45: 217-223 DOI:10.3354/meps045217 |
Ward J E, MacDonald B A, Thompson R J et al, 1993. Mechanisms of suspension feeding in bivalves:Resolution of current controversies by means of endoscopy. Limnology and Oceanography, 38(2): 265-272 DOI:10.4319/lo.1993.38.2.0265 |
 2019, Vol. 50
2019, Vol. 50


