中国海洋湖沼学会主办。
文章信息
- 何定芬, 谢超, 郑霖波, 叶常青, 李海波. 2019.
- HE Ding-Fen, XIE Chao, ZHENG Lin-Bo, YE Chang-Qing, LI Hai-Bo. 2019.
- 基于带鱼(Trichiurus lepturus)蛋白复合酶解液中ABP对G-等微生物的致死结构及表征活性分析
- ANTIBACTERIAL ACTIVITY OF HAIRTAIL (TRICHIURUS LEPTURUS) PROTEIN PEPTIDE AND THE FOOD PHYSICOCHEMICAL PROPERTIES
- 海洋与湖沼, 50(6): 1354-1360
- Oceanologia et Limnologia Sinica, 50(6): 1354-1360.
- http://dx.doi.org/10.11693/hyhz20190700134
文章历史
-
收稿日期:2019-07-05
收修改稿日期:2019-08-21
2. 浙江海洋大学食品与医药学院 舟山 316022;
3. 舟山市常青海洋食品有限公司 舟山 316021
2. College of Food and Pharmacy, Zhejiang Ocean University, Zhoushan 316022, China;
3. Zhoushan Changqing Marine Food Limited Company, Zhoushan 316021, China
抗菌肽(antibacterial peptide, ABP), 也被称作抗微生物肽、抗生素肽(王婧等, 2018), 广泛存在于生物体内, 是在抵御病原体入侵生物体内时产生的具有抵抗力的一种肽类, 具有免疫效果(Yeung et al, 2011)。抗菌肽为一种小分子肽, 具有特定的基因编码, 在特定条件诱导下产生, 主要是抵抗细菌、病毒、真菌, 也具有抑杀肿瘤细胞等活性等功效(梁秀丽等, 2019), 能够调控机体, 也被称为“宿主防御肽” (Yeaman et al, 2007; Ernesto et al, 2013), 在宿主细胞的免疫机制中起非常重要的作用(梁营芳等, 2016)。此外, 抗菌肽优点不仅是绿色、高效、安全, 且相比于抗生素, 它有着更好的热稳定性(田春雷等, 2015)、动物低耐药性(华蕊等, 2019)以及抗氧化性(金海涛等, 2016)。目前国内外对抗菌肽的研究越来越广, 应用前景开阔。
带鱼(Trichiurus lepturus), 别名刀鱼、裙带、牙带鱼, 属鲈形目(Perciformes)、带鱼科(Trichiuridae), 在我国的各沿海省份及地区都较常见。带鱼肉质紧实鲜美, 非常受人欢迎; 此外带鱼营养丰富, 人体必需的各类蛋白质、微量元素等含量较高, 因此有很高的营养价值和利用价值(陈军等, 2012), 是我国东海及舟山渔场是极具商业价值的鱼种类之一(Zhao, 2006)。数据显示, 自20世纪50年代以来, 东海带鱼的捕捞量始终占东海捕捞总量的最多份额, 是最重要的海洋资源(王跃中等, 2011)。在捕捞带鱼的过程中会夹杂20%—30%的低值小带鱼, 数量巨大, 但一直以来对低值小带鱼利用率却不高。因此, 如何提高低值小带鱼的利用率, 将是未来海洋渔业研究热点之一(陈凤杰, 2013)。本研究对舟山低值小带鱼蛋白抗菌肽的抑菌性及食品理化性进行分析, 为抗菌肽的进一步推广应用研究提供理论基础。
1 材料与方法 1.1 材料与试剂带鱼(Trichiurus lepturus)蛋白抗菌肽(ABP), 复合酶解法自制。
所用试剂如下:牛血清白蛋白(68000Da)、胰岛素(5808Da)、杆菌肽(1421Da)、氧化型谷胱甘肽(612Da)购自爱必信(上海)生物科技有限公司; 大肠杆菌CMCC 44102、副溶血弧菌ATCC 17802、肠炎沙门氏菌菌株CMCC(B) 50335、小肠结肠炎耶尔森氏菌ATCC 23715、黄色微球菌菌株ATCC 58166、嗜热脂肪地芽孢杆菌ATCC 7953、短双歧杆菌ATCC 15700、金黄色葡萄球菌ATCC 6538购自上海士锋生物科技有限公司; 十二烷基磺酸钠、考马斯亮蓝购自吴江市德隆精细化工有限公司。
1.2 仪器与设备仪器与设备如下:旋转蒸发仪(ZFY-1L)购自上海科兴仪器有限公司; ÄKTA蛋白纯化系统(ÄKTAavant)购自杭州纽蓝科技有限公司; 氨基酸自动分析仪(L-3000)购自苏州华美辰仪器设备有限公司; 高速分散均质机(HAD-FJ200-S)、可见分光光度计(HAD-UV3200)、离心机(HAD-X201)、水浴恒温振荡器(HAD-SHA-B)购自北京恒奥德仪器仪表有限公司。
1.3 标准品的分子量分布标准品及各分子量:牛血清白蛋白(68000Da)、胰岛素(5808Da)、杆菌肽(1421Da)、氧化型谷胱甘肽(612Da)。
采用ÄKTA蛋白纯化系统SuperdexTM-75 HR 10/300凝胶柱标准品进行洗脱分离, 其条件为:过滤膜直径0.45μm, 进样量300μL, 流动相50mmol/L磷酸盐缓冲液(pH 5.8, 含0.3mol/L NaCl), 流速0.4mL/min, 检测波长280nm (宋茹, 2011)。在上述条件下进行洗脱分离, 横坐标为标准品洗脱体积(mL), 纵坐标为相对分子质量对数(lgMt), 计算得出标准品的分子量曲线方程。
1.4 抗菌肽的分子量分布根据标准品的分子量曲线方程将带鱼蛋白抗菌肽的分子量分布情况分为3种: > 3000Da, 3000— 800Da, < 800Da, 然后根据图谱计算各分子量区间的占比, 最终确定带鱼蛋白抗菌肽的分子量分布情况。
1.5 氨基酸组成分析将带鱼蛋白抗菌肽浓缩到固定的体积, 然后用去离子水透析, 使用的透析袋截留分子量为100Da, 在4℃环境中放置24h, 取出后干燥, 冷冻保存。将一定量的冻干样品溶于水解管中, 溶剂选用6mol/L HCl, 并充惰性气体对水解管密封, 放置于110℃下24h得到水解液。水解液脱酸干燥后用氨基酸自动分析仪测定氨基酸组成。
1.6 抗菌肽的抗菌谱和抗菌效力 1.6.1 抑菌圈采用Pushpa S. Murthy等的琼脂扩散法进行抑菌圈的测定(Murthy et al, 2009), 作为抗菌效果的表征指标, 具体操作稍作调整。取100µL已被活化的菌种、菌浓度107CFU/mL的大肠杆菌菌悬液置于培养皿中, 再加入15mL的(47±2)℃的营养琼脂培养基, 混合均匀后静置, 等待其凝固, 然后用4mm的灭菌打孔器打孔, 将25µL已除菌的酶解液加入每个孔中, 在环境温度为恒定37℃下培养24h, 最后测定抑菌圈直径, 用以确定带鱼蛋白抗菌肽的抗菌效果。
1.6.2 抗菌谱实验用菌选用G–菌、G+菌、大肠杆菌CMCC 44102、副溶血弧菌ATCC 17802、肠炎沙门氏菌菌株CMCC(B) 50335、小肠结肠炎耶尔森氏菌ATCC 23715、黄色微球菌菌株ATCC 58166、嗜热脂肪地芽孢杆菌ATCC 7953、短双歧杆菌ATCC 15700、金黄色葡萄球菌ATCC 6538。将每种菌活化至生长对数期, 按前述的抑菌圈法测带鱼蛋白抗菌肽的抗菌效果, 均做平行实验3次, 得出其抑菌谱。
1.6.3 抗菌效力选取对照用的抗生素为土霉素和硫酸链霉素(华蕊等, 2019), 实验指示菌为大肠杆菌。首先配制土霉素及硫酸链霉素的浓度为1300U/mL, 再采用二倍稀释法进行稀释, 按前述方法测定各个浓度下的抑菌圈直径, 与带鱼蛋白抗菌肽形成的抑菌圈直径对比, 得出小带鱼抗菌肽的抑菌效力。
1.7 溶解度参照崔霞等(2006)的方法, 略作修改。首先配制1mol/L和6mol/L的HCL和NaOH缓冲液, 再分别取带鱼蛋白抗菌肽5mL。调节pH依次为2、3、4、5、6、7、8、9、10、11、12, 然后将各样品在25℃下振荡(100r/min, 30min), 取出离心20min, 取上清液测定蛋白质含量。对照组为pH 7未离心时的样品液蛋白质含量, 计算带鱼蛋白抗菌肽在各个pH条件下的溶解度, 实验均平行3次, 计算公式为式(1):
 (1)
(1)采用杨华连等(2019)的方法, 略做修改。配制浓度为1%的带鱼抗菌肽溶液为样品液, 调节pH依次为2、4、6、8、10、12, 取10mL样品液, 将10mL大豆色拉油加至样品液中, 8000r/min高速均质混合1min, 25℃恒温水浴25min, 获得混合均匀的乳化液, 最后在3000r/min离心条件下离心15min, 得到乳化液A。对乳化液A的液体高度和乳化层进行测定, 计算乳化性, 计算公式为式(2):
 (2)
(2)将乳化液A置于温度为80℃的恒温水浴锅中25min, 取出后再次在3000r/min离心条件下离心15min, 得到乳化液B。对乳化液B的乳化层高度进行测定, 计算乳化稳定性, 计算公式为式(3):
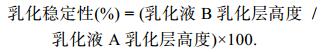 (3)
(3)采用Vilailak Klompong等人的方法(Klompong et al, 2007), 略做修改。分别取5.0mL带鱼抗菌肽溶液, 体积记为V1, 调节pH为2、4、6、8、10、12;然后在室温8000r/min高速均质混合3min, 样品液均质后马上转移到量筒中, 1min记录体积V2, 计算发泡性, 计算公式为式(4):
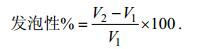 (4)
(4)均质后的混合液在室温静置5min, 记录体积V3, 计算泡沫稳定性, 计算公式为式(5):
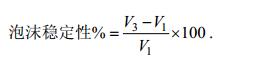 (5)
(5)标准品分子量分布结果见表 1。
| 标准品 | 牛血清白蛋白 | 胰岛素 | 杆菌肽 | 氧化型谷胱甘肽 |
| 分子量Mt(Da) | 68000 | 5808 | 1421 | 612 |
| lgMt | 4.6792 | 3.2168 | 3.1269 | 2.7136 |
| 洗脱体积(mL) | 10.38 | 17.24 | 18.32 | 22.58 |
| 分子量曲线方程 | y = –0.01848x+6.8023, R2=0.9913 | |||
观察图 1及表 2可以看出带鱼抗菌肽的分子量分布并不单一, 在三个区间(> 3000Da, 3000—800Da, < 800Da)内均有分布, 其中分子量在3000—800Da区间内分布最多, 百分含量达到49.61%, 而在洗脱体积在15mL前并没有出峰, 说明小带鱼抗菌肽并不含大分子量的肽, 酶解程度较深。
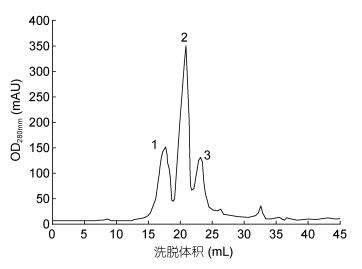 |
| 图 1 带鱼蛋白抗菌肽凝胶分离色谱图 Fig. 1 Separation chromatogram of the antibacterial peptide gel |
| 分离峰 | 洗脱体积(mL) | 分布范围(Da) | 百分含量(%) |
| 1 | 17.70 | >3000 | 31.53 |
| 2 | 20.28 | 3000—800 | 49.61 |
| 3 | 22.94 | < 800 | 18.86 |
分析表 3可得, 经过复合酶解得到的带鱼抗菌肽中共含有17种氨基酸, 氨基酸总量为881.83mg/g, 其中含量最高的是必需氨基酸缬氨酸, 含量为110.37mg/g; 其次是苯丙氨酸, 含量为94.34mg/g; 含量最低的氨基酸是甲硫氨酸, 含量仅有9.32mg/g。计算得出, 必需氨基酸比氨基酸总量的比值为44.75%, 高于FAO/WHO建议值40%;必需氨基酸比非必需氨基酸的比值为81.33%, 远高于FAO/WHO建议值60%, 因此可证明小带鱼抗菌肽营养价值较高(Eggum, 1991)。氨基酸种类中脯氨酸、亮氨酸、丙氨酸、赖氨酸、缬氨酸和精氨酸可以促进抗菌肽的结构形成, 就能够让抗菌肽的抗菌效力得到一定程度的提升(Boman et al, 1981; Jaynes et al, 1988)。由表中数据计算可得, 这六类氨基酸在氨基酸总量中占比达到42.71%, 可以推测小带鱼抗菌肽的抗菌效力较高。
| 氨基酸 | 含量(mg/g) | 氨基酸 | 含量(mg/g) |
| 天冬氨酸 | 38.17 | 苏氨酸* | 20.83 |
| 丝氨酸 | 41.18 | 谷氨酸 | 76.94 |
| 甘氨酸 | 32.68 | 丙氨酸 | 74.28 |
| 缬氨酸* | 110.37 | 半胱氨酸 | 48.46 |
| 异亮氨酸* | 36.57 | 亮氨酸* | 46.36 |
| 酪氨酸 | 84.62 | 苯丙氨酸* | 94.34 |
| 赖氨酸* | 76.85 | 组氨酸 | 22.13 |
| 精氨酸 | 26.35 | 脯氨酸 | 42.38 |
| 甲硫氨酸* | 9.32 | ΣAA | 881.83 |
| EAA | 394.64 | NEAA | 485.19 |
| 注: *代表必需氨基酸, ΣAA代表氨基酸总量; EAA代表必需氨基酸总量; NEAA代表非必须氨基酸总量 | |||
| 实验用菌 | 抑菌圈直径(mm) |
| 革兰氏阴性菌(G–) | |
| 大肠杆菌CMCC 44102 | 16.2±0.2 |
| 副溶血弧菌ATCC 17802 | 12.7±0.3 |
| 肠炎沙门氏菌菌株CMCC(B) 50335 | 9.8±0.1 |
| 小肠结肠炎耶尔森氏菌ATCC 23715 | 11.6±0.6 |
| 革兰氏阳性菌(G+) | |
| 黄色微球菌菌株ATCC 58166 | 8.9±0.4 |
| 嗜热脂肪地芽孢杆菌ATCC 7953 | 9.5±0.0 |
| 金黄色葡萄球菌ATCC 6538 | 10.8±0.3 |
| 短双歧杆菌ATCC 15700 | 9.3±0.2 |
| 稀释倍数 | 2倍 | 4倍 | 8倍 | 16倍 | 32倍 | 64倍 | 128倍 |
| 土霉素 | 32.6±0.3 | 29.8±0.1 | 27.1±0.6 | 24.5±0.2 | 22.3±0.8 | 20.2±0.4 | 18.7±0.7 |
| 硫酸链霉素 | 21.3±0.2 | 18.6±0.6 | 16.4±0.1 | 13.8±0.5 | 11.6±0.8 | 9.8±0.6 | 7.2±0.1 |
| 带鱼抗菌肽 | 18.8±0.3 | ||||||
分析表 4可得, 带鱼抗菌肽对革兰氏阴性菌(G–)及革兰氏阳性菌(G+)均有抑菌作用, 证明该抗菌肽具有广谱抗菌活性。从整体上分析, 该抗菌肽对G–的抗菌效果优于对G+的抗菌效果, 分析其原因可能是由于革兰氏阴性和阳性菌之间的菌外膜差别, 导致的作用结果不同。革兰氏阴性菌菌外膜上带负电的多糖等物质易与抗菌肽产生作用, 破坏膜结构, 内容物溢出, 发挥抗菌作用; 革兰氏阳性菌菌外膜多为无脂多糖类, 只有少数酸类物质带负电, 不易与抗菌肽产生作用, 故抗菌作用较弱(Bhaskar et al, 2008)。一般来说, 对革兰氏阴性菌抗菌效果较优的是阳离子型抗菌肽, 因此可以推测小带鱼抗菌肽为阳离子型抗菌肽。
由表 5可得, 带鱼抗菌肽对大肠杆菌的抗菌效力约与稀释128倍(10.15U/mL)的土霉素抗菌效力相当, 与稀释4倍的硫酸链霉素(325U/mL)抗菌效力相当。
2.5 溶解度通过对抗菌肽的表征特性进行研究, 获得带鱼抗菌肽在不同pH下的溶解度如图 2所示。分析柱状图可得, 在pH 7时抗菌肽的溶解度最低, 只有89.86%, 在偏酸或者偏碱性的环境下抗菌肽的溶解度较高, 分析其原因可能是pH 7时处于抗菌肽的等电点附近, 而蛋白质及肽类在等电点附近时, 溶解度会降低(Linder et al, 1996), 在pH远离7时因为偏离了等电点, 所以抗菌肽的溶解性提高。pH对溶解性的影响机制是改变溶液的静电荷和疏水相互作用, 达到影响溶解性的目的(Sorgentini et al, 2002)。总体而言, 带鱼抗菌肽在各个pH下溶解度表现良好, 均大于88%, 证明该抗菌肽有很强的适应性, 利用价值相对较高。
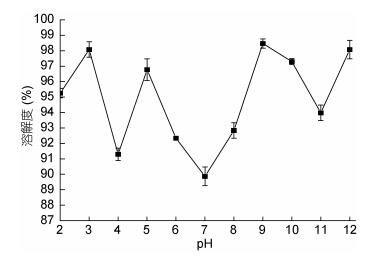 |
| 图 2 带鱼蛋白抗菌肽不同pH下溶解度 Fig. 2 Solubility of the antibacterial peptide at different pH values |
蛋白酶解液的乳化性与其肽链上的亲水基团、疏水基团有关。在酶解过程中, 疏水基团会不断暴露, 疏水性的变强会促进结合油滴, 进而增强了乳化性。但是酶解程度过大时产生的小分子肽会降低乳化性。小带鱼抗菌肽乳化性及乳化稳定性在不同pH下变化情况见图 3、图 4。
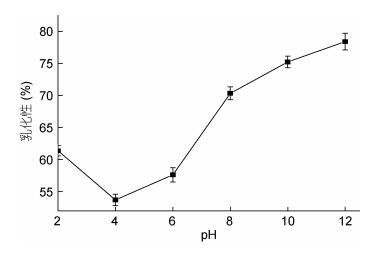 |
| 图 3 带鱼蛋白抗菌肽乳化性随pH变化 Fig. 3 Emulsification of the antimicrobial peptides with pH |
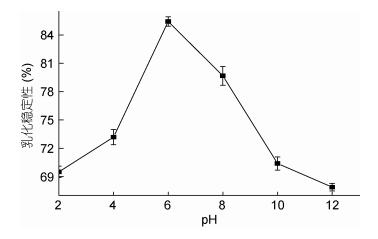 |
| 图 4 带鱼蛋白抗菌肽乳化稳定性随pH变化 Fig. 4 The emulsification stability of the antibacterial peptide vs. pH |
由图 3可得, 当pH为4时带鱼抗菌肽乳化性最低, 只有53.68%, 当pH上升时, 其乳化性也表现出增长的趋势, 在pH范围在6—10时增长迅速, 在pH为12时达到最高, 乳化性为78.34%。抗菌肽溶液的乳化性受各种因素的影响, 其中包括溶液中一些亲水基团和亲油基团的含量, 溶液溶解性、溶液所带电荷多少及正负性、肽链长度、肽链分子空间结构等会影响到乳化性(温青玉等, 2018)。
分析图 4可得, 带鱼抗菌肽的乳化稳定性呈现A型图, 在pH 6时达到最高, 为85.83%。当pH环境过酸或者过碱的情况下乳化稳定性均较低, 分析其原因可能是由于粒子之间存在电荷排斥作用, 一定条件下可能会造成粒子间的聚集和絮化, 因此导致了乳化稳定性的降低。总体来说, 带鱼抗菌肽不仅乳化性展现出较强的效果, 因此具有较高的商业价值。
2.7 发泡性和泡沫稳定性发泡性指的是产生并维持的界面面积, 与蛋白质分子的极性基团及大小相关, 酶解液的pH环境很大程度上决定了发泡性和泡沫稳定性(宋茹, 2011)。泡沫只有存在可溶性蛋白才能形成, 并且在等电点处可溶性蛋白浓度将会降低, 因此发泡性减弱, 但不溶性蛋白则会提高泡沫稳定性。带鱼抗菌肽发泡性和泡沫稳定性在不同pH下变化情况见图 5、图 6。
 |
| 图 5 带鱼蛋白抗菌肽发泡性随pH变化 Fig. 5 Flammability of antibacterial peptides of squid with pH |
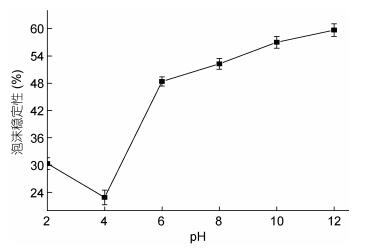 |
| 图 6 带鱼抗菌肽泡沫稳定性随pH变化 Fig. 6 Antibacterial peptide foam stability vs. pH |
由图 5可以看出, 带鱼抗菌肽发泡性随pH上升呈现出增长的趋势, 在pH 12时达到最大值57.33%, 分析原因可能是pH环境为碱性时, 溶液内的电荷数变多, 促进了蛋白质界面的气水吸收, 提高了起泡性。
如图 6所示, 当pH 4时带鱼抗菌肽泡沫稳定性降至最低, 只有22.86%, 可能是达到多数蛋白质分子的等电点; 之后当pH升高时, 泡沫稳定性也随之增强, 在pH 12时达到最大值59.58%。原因可能是在酸性环境下, 肽分子之间离子排斥作用较强, 不易在界面形成交联网状结构的稳定液膜(肖连冬等, 2014), 结果造成泡沫稳定性的降低。
3 结论本实验采用自制的舟山带鱼抗菌肽作为研究对象, 探究抗菌肽的抑菌结构及表征活性等特征。实验得出带鱼蛋白抗菌肽的抑菌结构及理化性质为:分子量在三个区间(> 3000Da, 3000—800Da, < 800Da)内均有分布, 其中分子量在3000—800Da区间内含量达到49.61%, 酶解程度较深; 氨基酸总量为881.83mg/g, 必需氨基酸比氨基酸总量的比值为44.75%, 必需氨基酸比非必需氨基酸的比值为81.33%, 营养价值高; 六类提升抗菌效力的氨基酸在氨基酸总量中占比42.71%, 推测抗菌效力较高; 具有广谱抗菌活性, 对G–菌具有较强的致死效果, 为阳离子型抗菌肽; 抗菌效力约与稀释128倍(10.15U/mL)的土霉素抗菌效力相当, 与稀释4倍的硫酸链霉素(325U/mL)抗菌效力相当。
带鱼蛋白抗菌肽表征活性为:在不同pH下溶解度表现均良好, 且大于88%, 证明该抗菌肽有很强的适应性, 利用价值相对较高; 乳化性随着pH值的增大而逐渐增强, 当pH为4时带鱼抗菌肽乳化性最低, 只有53.68%, 在pH为12时达到最高, 乳化性为78.34%;乳化稳定性在pH 6时达到最高, 为85.83%, pH环境过酸或者过碱的情况下乳化稳定性均较低; 发泡性随pH上升呈现出增长的趋势, 在pH 12时达到最大值57.33%; pH 4时小带鱼抗菌肽泡沫稳定性降至最低, 只有22.86%, 之后当pH升高时, 泡沫稳定性也随之增强, 在pH 12时达到最大值59.58%。本实验探究得到舟山带鱼蛋白抗菌肽的抑菌性及表征活性指标, 为蛋白抗菌肽的推广应用提供了理论依据。
王婧, 刁小龙, 陈晓兰, 等. 2018. 抗菌肽Indolicidin的研究进展. 江苏农业学报, 34(4): 949-954 |
王跃中, 贾晓平, 林昭进, 等. 2011. 东海带鱼渔获量对捕捞压力和气候变动的响应. 水产学报, 35(12): 1881-1889 |
田春雷, 袁威, 任志华, 等. 2015. 复合抗菌肽"态康利保"对断奶仔猪红细胞免疫功能的影响. 中国兽医学报, 35(5): 795-798 |
华蕊, 杨慧, 吴科榜, 等. 2019. 抗菌肽CJH对常见畜禽病原菌抑菌活性及与抗生素协同杀菌效应研究. 饲料研究, 42(1): 111-114 |
杨华连, 陈莉, 卢红梅, 等. 2019. 薏仁米糠多肽的功能特性研究. 中国酿造, 38(4): 126-130 |
肖连冬, 程爽, 李杰. 2014. 大豆分离蛋白起泡性和乳化性影响因素的研究. 中国酿造, 33(4): 83-86 |
宋茹, 2011.黄鲫(Setipinna taty)蛋白抗菌肽的制备及抗菌作用等生物活性研究.青岛: 中国海洋大学博士学位论文, 18-20
|
陈军, 赵立, 孟玉洁. 2012. 带鱼脱腥工艺研究. 江苏农业科学, 40(2): 223-225 |
陈凤杰, 2013.以低值小带鱼为原料的重组鱼脆粒加工及贮藏研究.无锡: 江南大学硕士学位论文
|
金海涛, 但启雄, 袁威, 等. 2016. 复合抗菌肽"态康利保"对断奶仔猪组织抗氧化功能的影响. 中国兽医学报, 36(7): 1212-1217, 1258 |
崔霞, 周艳明, 牛森, 等. 2006. 酶法水解苦荞蛋白制备可溶性生物活性肽最佳条件的研究. 粮食与食品工业, 13(1): 39-41 |
梁秀丽, 刘书梅, 蒋志惠, 等. 2019. 3种检测牛白细胞源抗菌肽抗病毒活性方法的建立. 畜牧与兽医, 51(5): 83-88 |
梁营芳, 林慧敏, 石芸洁, 等. 2016. 带鱼酶解蛋白亚铁螯合肽对凡纳滨对虾(Litopenaeus vannamei)生长、免疫及品质的影响. 海洋与湖沼, 47(6): 1257-1262 |
温青玉, 张康逸, 杨帆, 等. 2018. 小麦分离蛋白质理化性质及功能特性研究. 河南农业科学, 47(5): 149-154 |
Bhaskar N, Benila T, Radha C et al, 2008. Optimization of enzymatic hydrolysis of visceral waste proteins of Catla (Catla catla) for preparing protein hydrolysate using a commercial protease. Bioresource Technology, 99(2): 335-343 |
Boman Hans G, Hultmark D, 1981. Cell-free immunity in insects. Trends in Biochemical Sciences, 6: 306-309 |
Eggum B, 1991. Comments on report of a joint FAO/WHO expert consultation on protein quality evaluation, Rome 1990. Zeitschrift Für Ernährungswissenschaft, 30(2): 81-88 |
Ernesto P M, De Oca M, 2013. Antimicrobial peptide elicitors:new hope for the post-antibiotic era. Innate Immunity, 19(3): 227-241 |
Jaynes J M, Burton C A, Barr S B et al, 1988. In vitro cytocidal effect of novel lytic peptides on Plasmodium falciparum and Trypanosoma cruzi. The FASEB Journal, 2(13): 2878-2883 |
Klompong V, Benjakul S, Kantachote D et al, 2007. Antioxidative activity and functional properties of protein hydrolysate of yellow stripe trevally (Selaroides leptolepis) as influenced by the degree of hydrolysis and enzyme type. Food Chemistry, 102(4): 1317-1327 |
Linder M, Fanni J, Parmentier M, 1996. Functional properties of veal bone hydrolysates. Journal of Food Science, 61(4): 712-716 |
Murthy P S, Manonmani H K, 2009. Physico-chemical, antioxidant and antimicrobial properties of Indian monsooned coffee. European Food Research and Technology, 229(4): 645-650 |
Sorgentini D A, Wagner J R, 2002. Comparative study of foaming properties of whey and isolate soybean proteins. Food Research International, 35(8): 721-729 |
Yeaman M R, Yount N Y, 2007. Unifying themes in host defence effector polypeptides. Nature Reviews Microbiology, 5(9): 727-740 |
Yeung A T, Gellatly S L, Hancock R E W, 2011. Multifunctional cationic host defence peptides and their clinical applications. Cellular and Molecular Life Sciences, 68(13): 2161-2176 |
Zhao X Y, 2006. In situ target-strength measurement of young hairtail (Trichiurus haumela) in the Yellow Sea. ICES Journal of Marine Science, 63(1): 46-51 |
 2019, Vol. 50
2019, Vol. 50


