
中国海洋湖沼学会主办。
文章信息
- 陈智威, 许然, 南泽, 郑小东. 2019.
- CHEN Zhi-Wei, XU Ran, NAN Ze, ZHENG Xiao-Dong. 2019.
- 不同浓度氨氮胁迫下长蛸(Octopus minor)的半致死浓度和急性毒性评估
- DETERMINATION OF THE MEDIAN LETHAL CONCENTRATION AND ACUTE TOXICITY OF OCTOPUS MINOR UNDER DIFFERENT CONCENTRATIONS OF AMMONIA AND NITROGEN STRESS
- 海洋与湖沼, 50(6): 1361-1370
- Oceanologia et Limnologia Sinica, 50(6): 1361-1370.
- http://dx.doi.org/10.11693/hyhz20190700132
文章历史
-
收稿日期:2019-07-03
收修改稿日期:2019-08-19
2. 中国海洋大学海水养殖教育部重点实验室 青岛 266003
2. Key Laboratory of Mariculture, Ocean University of China, Qingdao 266003, China
随着人类社会的快速发展, 在现代工业、农业和人类日常活动中产生了许多含氮有机污染物。未经处理排放到环境中的有机氮污染物被微生物分解, 对生态系统造成氨氮污染。这种污染物对自然水体中生存的生物产生毒害作用, 进而影响养殖水质, 危害养殖生物健康。海水中的氨有两种形式, 即非离子氨(NH3)和铵离子(NG4+), 具体形式取决于海水的pH值和温度(Emerson et al, 1975), 前者比后者毒性大, 并且对水生生物的代谢、发育和免疫产生不利影响(Randall et al, 2002; Reddy-Lopata et al, 2006; Maas et al, 2012)。研究表明, 氨氮可以穿过脊椎动物的血脑屏障并对大脑产生毒性作用, 导致其惊厥, 昏迷甚至死亡(Arafa et al, 2013)。在海水养殖中, 氨氮的毒理学数据主要来自鱼类, 其毒性被认为是高水平的氨导致神经元去极化和N-甲基-D-天冬氨酸(NMDA)型谷氨酸受体激活, 导致过量Ca2+和K+的流入导致大脑中的细胞凋亡(Randall et al, 2002)。
目前, 国内外关于氨氮对养殖生物的毒性影响的研究较多, 对不同种类鱼具有影响且在鱼类鳃组织结构有反应(林忠婷等, 2011; Zhou et al, 2013); 影响海月水母螅状体和碟状体繁殖子体的速率(葛建龙等, 2018); 影响拟穴青蟹的免疫反应(徐胜威等, 2019)和凡纳滨对虾的生长状况(彭军辉等, 2018); 损伤菲律宾蛤仔的鳃组织结构(Cong et al, 2017)和影响圆蛤生长(Boardman et al, 2004)。近年来, 有关乌贼、蛸类的相关研究已见报道。Feyjoo等(2011)研究了真蛸幼体对氨氮的毒性耐受性; 陈思涵等(2018)报道了急性氨氮胁迫对虎斑乌贼三种组织的结构影响, 但是长蛸的相关研究未见记载。
随着人民生活水平不断提高, 对经济蛸类的需求不断提升。作为味道鲜美、营养丰富的经济种类, 长蛸市场处于供不应求。近年来, 有关其遗传(Wang et al, 2017; Xu et al, 2018)、胚胎发育(Kim et al, 2006)、增养殖(Zheng et al, 2014)、摄食行为(Song et al, 2019)等方面开展了较广泛研究。目前, 长蛸养殖死亡率高是制约其产业化的瓶颈。本文中, 通过设置六个氨氮浓度梯度, 记录24h、48h、72h以及96h长蛸的死亡率, 分析并获得48h、72h和96h的半致死浓度(median lethal concentration, LC50), 旨在确定长蛸养殖的安全氨氮浓度(safe concentration, SC), 为大规模养殖提供水质参数和理论依据。
1 材料与方法 1.1 实验材料山东省月湖海区采捕野生且体质健壮的成熟长蛸280只, 平均体重180.2±30.5g。在威海马山集团育苗厂内暂养。自然海水经沉淀、曝气以及消毒后使用。水温20.8±0.5℃, 每天更换水量约为养殖池的1/3。投喂饵料是肉球近方蟹, 1次/天。暂养期间长蛸活力旺盛, 死亡率低于5%。暂养一周后, 将其转移至长×宽×高为67cm×45cm×47cm的方桶中, 每桶放置长蛸8只, 养殖环境和管理方法与养殖池的一致, 持续充氧, 暂养一周。实验前停食一天, 选择身体健康、活力旺盛的个体随机分组进行实验。
1.2 预实验先根据非离子氨对其他海洋生物的毒性试验的相关研究(Boardman et al, 2004; 于晓, 2011; 葛建龙等, 2018)设置八个浓度组和一个对照组, 开展预实验。配置总氨氮浓度(total-NH3, TAN)分别为: 46.8、66.3、87.0、143.5、180.3、204.0、271.0、423.0mg/L的溶液(利用氨氮仪(哈纳HI96715)检测)。每只方桶分为一组, 编号1—8, 每组放入8只长蛸, 实验周期为96h, 随时测定水体中总氨氮的浓度, 停食, 每24h换1/2体积的水, 及时捞出死亡的个体。统计各个时间点长蛸的死亡率, 从而使正式实验的氨氮浓度跨度最小、最精确。
1.3 急性氨氮胁迫根据预实验结果, 设置6个浓度梯度和1个对照组进行实验, 总氨氮浓度分别为: 0(对照组, 自然海水养殖下氨氮浓度)、87.0、124.5、143.5、180.3、204.0、242.5mg/L。每组还设置2个平行重复组。每组个体数均为8只。采用氨氮仪(哈纳HI96715)每天检测总氨氮浓度, 维持实验环境的氨氮浓度不变。实验期间, 长蛸处于停食状态, 每24h换1/2体积的水, 持续充氧, 及时捞出死亡的个体。实验开始后, 观察记录长蛸中毒后的行为状态, 并记录24h、48h、72h、96h各组长蛸死亡数。
实验用当地海水(盐度30.0±1.0, pH 7.8±0.2, 温度20.8±0.5℃), 可通过总氨氮来计算出非离子氨(non-ionized ammonia, N-NH3)浓度(Bower et al, 1978)。总氨氮浓度0(对照组, 自然海水养殖下氨氮浓度)、87.0、124.5、143.5、180.3、204.0、242.5mg/L对应的非离子氨浓度为0、1.86、2.66、3.07、3.86、4.37、5.19mg/L。
1.4 数据分析本文通过概率单位法(Finney, 1952)、改良寇氏法(李翠萍等, 2012)和线性回归法(Nath et al, 1996)计算氨氮暴露48h、72h以及96h的半致死浓度(LC50), 对结果进行评估。将获得的半致死浓度取平均值, 计算最终结果。
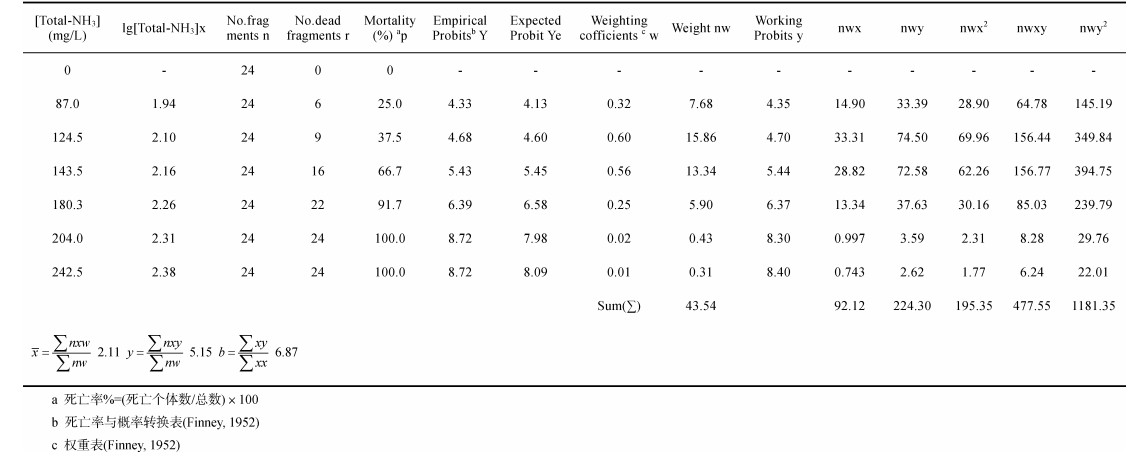
概率单位法:将死亡百分比转换为概率(Heinrichs et al, 1981), 使总氨氮浓度转换为常用对数lg的函数。表 1显示了用于进行概率单位分析和计算LC50值的数据。通过这些参数计算以下值: Σnwx, Σnwy, Σnwx2, Σnwxy和Σnwy2, 然后用它们找到x, y和b(斜率)值来计算概率回归线y =y+b(x–x), 计算lg[总氨氮]的LC50值。最终使用χ2检验(表 2)对结果进行验证。
 |
| 曲线拟合 | |||
| 公式 | 估计 | 公式 | 估计 |
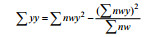 | 25.74 | 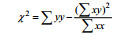 | 5.55 |
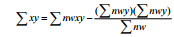 | 2.94 | χ2=(df=4; p < 0.05) | 9.49 |
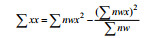 | 0.43 | 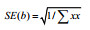 | 1.53 |
| 注: χ2 (df = 4; P < 0.05):自由度=(浓度数-2), 概率为0.05; SE(b):斜率(b)的标准误差 | |||
改良寇氏法:采用lgLC50=1/2(Xi+Xi+1)(Pi+1–Pi)(李翠萍等, 2012)获得半致死浓度。通过计算95%置信区间以及获得的Sm标准误差的值对所计算出的结果进行检验。
线性回归法:利用SPSS 28.0通过回归分析获得回归方程及R2等数据来计算急性氨氮胁迫48h、72h和96h的半致死浓度。通过显著性检验对结果进行验证。
最后, 根据当地海水温度、盐度以及pH值计算出48h、72h和96h的半致死浓度(LC50)所对应的非离子氨浓度(Bower et al, 1978), 并计算安全浓度。
2 结果 2.1 氨氮的中毒反应长蛸对六组不同氨氮浓度的溶液反应有明显的不同, 主要分为三个部分表现, 低浓度(87.0, 124.5mg/L)、中浓度(143.5, 180.3mg/L)以及高浓度(204.0, 242.5mg/L)。在低氨氮浓度胁迫下, 在试验初期长蛸仍旧保持旺盛活力, 与对照组个体活力相同, 体色未出现变化, 体表未见损伤, 游泳能力正常, 直至实验开始后24h出现死亡。实验过程中均自由游动, 水体颜色未有明显变化、无异味。在中氨氮浓度胁迫下, 实验初期长蛸偶尔会出现躁动现象, 即突然地窜动, 水体颜色未有明显变化; 实验开始后24h出现死亡, 在实验中期(48—72h)少数长蛸出现喷墨现象, 并蜷缩至方桶的角落。体色未见变化, 体表未见损伤。由于墨汁和较多分泌物影响, 水体颜色略黄, 仍呈透明状。实验后期(72—96h)大部分长蛸因死亡被捞出, 存活个体卧于方桶底部, 几乎不能游动。水体开始变浑浊, 呈黄色, 水面附有一些泡沫, 水体散发淡淡腥味, 主要是由于长蛸身体分泌物与过多的排便量导致的。在高氨氮浓度胁迫下, 在试验初期长蛸就会出现躁动不安的情况, 大部分长蛸出现急速游泳、喷墨等现象。部分长蛸有沿桶壁上爬的逃逸趋势。24h即出现大量死亡, 存活个体表现为腕全部伸展, 胴体水肿竖直悬浮于水中, 胴体与腕几乎呈90°角, 游泳能力尽失, 难以行动, 但仍有呼吸。体表未变色, 胴体尖部有损伤。在实验接近中期(24—48h)时, 大部分长蛸已死亡, 存活个体栖于桶底不动, 体表有损伤。水面附有很多泡沫, 水体已成棕黄色, 有腥臭味。
2.2 氨氮的急性毒性急性氨氮胁迫实验结果显示(图 1), 对照组中长蛸成体无死亡; 实验组相同胁迫浓度下, 随着时间的增长, 长蛸死亡率在不断升高; 相同胁迫时间下, 随着胁迫浓度的增加, 长蛸死亡率逐渐增大。图 1(a)显示在暴露24h条件下随着胁迫浓度的升高, 长蛸死亡率在不断地增加。从非离子氨浓度为3.07mg/L时开始出现死亡, 在非离子氨浓度从3.07mg/L增长到4.37mg/L, 死亡率由0升高到20.83%, 与4.37mg/L到5.19mg/L这一区间增长的死亡率(58.34%)相比, 增速要慢得多。图 1(b)、图 1(c)、图 1(d)显示在暴露48h、72h和96h条件下, 随着胁迫浓度的升高, 长蛸死亡率呈“s”型曲线增长。从图中曲线的斜率可以看出, 在这三个时间段, 非离子氨浓度从1.86mg/L增长到2.66mg/L, 死亡率增加的速度较缓。图 1(b)、图 1(c)中非离子氨浓度从3.86mg/L增长到4.37mg/L, 死亡率急速增加, 从4.37mg/L增长到5.19mg/L, 死亡率增加较慢。图 1(d)中死亡率增加最快的浓度范围是从2.66mg/L到3.07mg/L, 之后增长速率趋于平缓。
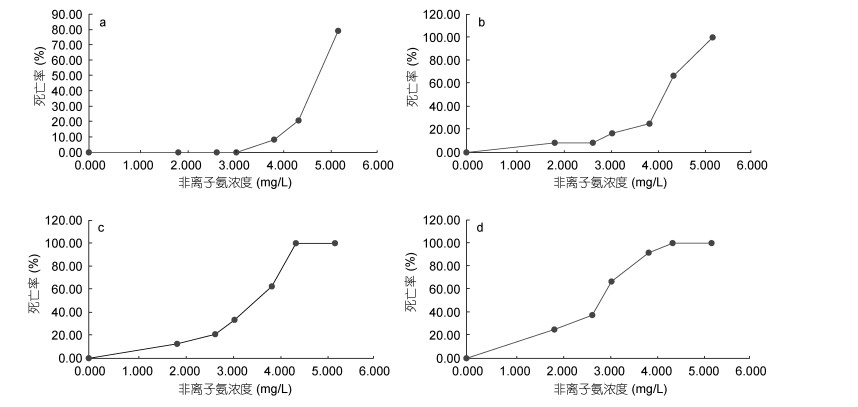 |
| 图 1 长蛸成体在非离子氨暴露下24h、48h、72h和96h的死亡率 Fig. 1 Mortality of O. minor at 24h, 48h, 72h and 96h in different concentration of non-ionized ammonia 注: a.暴露24h; b.暴露48h; c.暴露72h; d.暴露96h |
收集氨氮暴露96h下各浓度组长蛸死亡数量如表 1所示, 按1.4中概率单位计算法计算表中参数。并对表 1中的计算结果进行χ2方检验, 有关参数见表 2。同理收集氨氮暴露48h和72h下各浓度组长蛸死亡数量制表(计算方法如同表 1, 故未在文章中列出)。
利用所获数据, 使用概率单位法计算氨氮胁迫48h、72h和96h下的半致死浓度(如表 3)。表 3结果显示, 在受试时间为48h、72h和96h下, 所计算出的半致死浓度分别为204.59、159.57和122.51mg/L。且根据χ2检验结果(表 2)显示, P < 0.05时χ2估计值为9.49, 计算96h LC50时χ2结果为5.55, 低于P < 0.05时χ2估计值, 可证明结果显著性(Martins et al, 2018)。同理可求得48h LC50、72h LC50 χ2结果为8.44和6.53, 结果均显著, 证明该计算方法有效。
| 受试时间(t) | 概率方程 | lg[TAN] (LC50) | LC50 (mg/L) |
| 48h | y=4.44+5.55(x–2.21) | 2.31 | 204.59 |
| 72h | y=4.62+5.21(x–2.13) | 2.20 | 159.57 |
| 96h | y=5.15+6.87(x–2.11) | 2.09 | 122.51 |
采用改良寇氏法和线性回归法, 获得数据如表 4、表 5所示。表 4结果显示, 在受试时间为48h、72h和96h下, 所计算出的半致死浓度分别为178.36、147.41和121.40mg/L, 利用改良寇氏法计算的结果与概率单位法相比较低, 但从其计算出的半致死浓度区间来看, 与表 3结果是相吻合的, 证明该计算方法有效。表 5结果显示, 在受试时间为48h、72h和96h下, 所计算出的半致死浓度分别为180.83、156.86和130.86mg/L, 均处在表 4所示区间内, 与表 3所示结果相差不大, 可以证明该计算方法是有效的。
| 受试时间(t) | LC50(mg/L) | LC50上限(mg/L) | LC50下限(mg/L) | Sm |
| 48h | 178.36 | 195.37 | 162.84 | 0.02 |
| 72h | 147.41 | 161.77 | 134.33 | 0.02 |
| 96h | 121.40 | 133.14 | 110.70 | 0.02 |
| 受试时间(t) | 回归方程 | 相关系数R2 | LC50(mg/L) |
| 48h | y=112.06+137.53x | 0.84 | 180.83 |
| 72h | y=87.18+139.36x | 0.92 | 156.86 |
| 96h | y=49.49+162.74x | 0.89 | 130.86 |
为使实验所得结果更加精确, 将表 3、表 4、表 5所得48h、72h和96h的半致死浓度汇总并计算出三种方法所得半致死浓度的平均值(表 6), 即可被认为是急性氨氮胁迫下长蛸在48h、72h和96h的半致死浓度的最终结果。
| 受试时间(t) | 概率单位法(mg/L) | 寇氏法(mg/L) | 线性回归法(mg/L) | 平均LC50(mg/L) |
| 48h | 204.59 | 178.36 | 180.83 | 187.93 |
| 72h | 159.57 | 147.41 | 156.86 | 154.61 |
| 96h | 122.51 | 121.40 | 130.86 | 124.92 |
Vig等(1987)认为鱼类对水的环境污染很敏感, 污染物在进入鱼类器官时可能会严重损害某些生理和生化过程。McDonald等(1989)报道, 鱼体内电解质的生理调节对环境压力非常敏感, 在其细胞的系统功能障碍表现出来之前, 污染可能会引起鱼类的某些生理变化, 使鱼类在行为等方面产生变化。Senthamilselvan等(2011)研究表明, 氨氮通过改变鱼体内细胞膜的通透性, 来改变鱼血浆中离子的水平, 而这种水平的改变可以影响鱼的整体生化代谢, 生化水平的这种变化可能导致生命过程的能量损害。Randall等(2002)认为氨氮可使神经元去极化, 导致NMDA型谷氨酸受体过度活化, 从而影响中枢神经系统的正常工作, 最后导致细胞的死亡。陈思涵等(2018)发现氨氮对乌贼鳃、肝组织以及脑组织的组织学结构产生严重破坏。本文分析了氨氮对于长蛸成体的急性毒性, 长蛸在不同浓度氨氮溶液中发生的特殊行为是对此应激产生的生理变化。结果显示随着氨氮浓度升高和胁迫时间延长, 对于长蛸成体的毒性作用增强(图 1), 导致长蛸鳃细胞排列紊乱, 空泡化严重、肝小叶轮廓模糊等, 最终导致个体死亡(未发表数据)。对于不同浓度氨氮对长蛸各组织的损伤程度, 我们将在下一步实验进行验证。
长蛸成体在急性氨氮胁迫48h、72h和96h下的半致死浓度分别是187.93、154.61和124.92mg/L (如表 6)。查阅总氨氮与非离子氨转换表(Bower et al, 1978), 可以分别获得48h LC50、72h LC50和96h LC50的非离子氨浓度: 4.02、3.31、2.67mg/L。从总氨氮浓度来看, 暴露48h、72h和96h的半致死浓度差值不太大; 从非离子氨的浓度来看, 三个时间点的半致死浓度差值较大。在氨氮溶液中, 非离子氨对水生动物有着主要的毒性作用(Liew et al, 2013), 可以推测是不断增加的非离子氨浓度使长蛸成体在持续延长的暴露时间下形成不同的半致死效果。由于水生动物种类的不同, 对氨氮的耐受能力也不同(见表 7, 表 8)。
| 物种 | 96h LC50 (mg/L) |
| 刺参成体(Apostichopus japonicus) | 90.6 |
| 棘胸蛙蝌蚪(Paa spinosa) | 146.8 |
| 团头鲂幼鱼(Megalobrama amblycephala) | 56.5 |
| 裸项栉虾虎鱼仔鱼(Ctenogobius gymnauchen) | 163.7 |
| 虎斑幼乌贼(Sepia pharaonis) | 11.9 |
| 物种 | 96h LC50 (N-NH3)(mg/L) |
| 羊头鲦鱼(Cyprinodon variegatus) | 2.07 |
| 大西洋牙鲆(Paralichthys dentatus) | 1.08 |
| 大西洋白姑鱼(Argyrosomus regius) | 1.00 |
| 脊尾白虾(Exopalaemon carinicauda) | 4.95 |
| 幽灵虾(Palaemonetes pugio) | 1.66 |
| 糠虾(Mysidopsis bahia) | 0.76 |
| 圆蛤(Mercenaria mercenaria) | 37.90 |
表 7结果显示, 长蛸成体在氨氮胁迫96h LC50低于棘胸蛙蝌蚪96h LC50(牛春格等, 2019)和裸项栉虾虎鱼仔鱼96h LC50(林忠婷等, 2011); 高于刺参成体96h LC50 (于晓, 2011)、团头鲂幼鱼96h LC50(张武肖等, 2015)和虎斑幼乌贼96h LC50(陈思涵等, 2018)。表 8结果显示, 非离子氨对长蛸成体的影响大于圆蛤和脊尾白虾(梁俊平等, 2012); 低于羊头鲦鱼、大西洋牙鲆和幽灵虾(1.66mg/L)(Boardman et al, 2004); 远低于糠虾以及大西洋白姑鱼(1.0mg/L)(Kir et al, 2016)。Feyjoo等(2011)对真蛸幼体在氨氮暴露24h后的半致死浓度进行研究, 结果显示真蛸幼体的24h LC50为10.7mg/L (TAN), 低于虎斑幼乌贼96h LC50, 远低于草鱼幼体24h LC50 (85.47mg/L)(刘娥, 2013), 可以推测不同种类对于氨氮的耐受性还是有一定差距。氨耐受性具有物种特异性(Lin et al, 2001; Romano et al, 2007), 分析本文结果可以发现, 作为与长蛸相似的虎斑乌贼幼体, 其96h半致死浓度与其他物种相比较低; 而长蛸成体与其他水生动物相比, 96h的半致死浓度略高于大部分水动物。可以推测长蛸与其他动物相比, 在生长阶段对氨氮耐受性较差, 而成体对于氨氮的耐受性较高。Chew等(2014)认为鱼类对于氨氮胁迫产生的适应性是通过以下几种途径实现的, 如增加鱼体的排氨作用、减少氨氮代谢产物以及将氨氮通过反应机制转化成毒性较小物质等, 然而关于长蛸对氨氮胁迫的适应性机制还有待进一步研究。
本实验用静水法研究了氨氮对长蛸成体的急性毒性。根据观测数据及实验结果, 得出长蛸成体暴露在氨溶液中48h、72h以及96h后的半致死浓度(LC50), 根据以下公式计算安全浓度: SC= 0.1×96h LC50 (Sprague, 1971), 最终得到其安全浓度为12.49mg/L, 非离子氨浓度为0.27mg/L。低于棘胸蛙蝌蚪的安全浓度14.70mg/L (牛春格等, 2019); 高于成虾的安全浓度12.09mg/L (梁俊平等, 2012); 远高于海月水母螅状体安全浓度2.54mg/L (葛建龙等, 2018)和裸项栉虾虎鱼仔鱼0.91mg/L (林忠婷等, 2011)。不同物种间安全浓度差异产生的原因可能与个体大小与生活习性有关, 个体越小, 所需要的安全浓度越低; 虾与长蛸运动方式类似, 故二者安全浓度相似; 棘胸蛙蝌蚪虽为幼体, 但安全浓度却高于长蛸成体, 可能因为它作为两栖类动物的幼体, 继承了部分抗逆基因, 从而能更好的适应环境, 安全浓度较高。
为了初步验证本文所计算的安全浓度对长蛸成体生长状况的影响, 我们选取三个浓度的氨氮溶液, 每个梯度8只个体, 胁迫20d, 胁迫期间操作如1.3(每日均投喂饵料), 设置三组平行实验, 结果如表 9所示。
| 总氨氮浓度(mg/L) | 初始鲜重(g) | 终末鲜重(g) | 特定生长率(%) | 肝体比(%) |
| 对照组 | 109.94±12.33 | 102.10±15.55 | –0.47±0.29 | 7.51±1.39 |
| 6.25 | 117.14±16.25 | 119.41±13.86 | –0.06±0.13 | 8.25±1.37 |
| 12.50 | 112.23±13.66 | 114.54±14.27 | 0.10±0.14 | 7.98±1.65 |
SPSS结果显示, 对于初始鲜重和终末鲜重, 对照组和总氨氮浓度为12.50mg/L组P > 0.05, 差异不显著; 总氨氮浓度为6.25mg/L组P < 0.05, 结果显著。特定增长率不明显, 但随着氨氮浓度的增加, 有略微上升。胁迫的两组肝体比均高于对照组, 其中总氨氮浓度为6.25mg/L时肝体比比例最高。通过以上结果可以推测在进行长蛸工厂化养殖的过程中, 向养殖水体中加入微量含有氨氮的物质, 能够对促进长蛸生长起到一定的作用, 具体原因还需要进一步研究。
我国渔业水质标准(GB11607-89)中显示, 在水体中铬的浓度要小于0.1mg/L, 非离子氨的浓度要小于0.04mg/L, 铜的浓度小于0.01mg/L。由此可以看出, 渔业水体对于非离子氨的存在标准的要求更为严格, 可以推测非离子氨对于水生动物产生的危害仅次于金属铜。本文获得的安全浓度数值远高于渔业水质标准, 可以推测长蛸对非离子氨的耐受性较高。渔业水质标准的数值远低于急性毒性试验所得的安全质量浓度, 是考虑到水生食用类动物对水体环境有害物质的富集作用、生物积累作用和食物链中生物放大作用。因此渔业水质标准的设立需要考虑复杂因素, 低于急性毒性试验结果。
4 结论在本实验中, 最终计算出急性氨氮胁迫下长蛸在48h、72h及96h的半致死浓度分别为187.93、154.61和124.92mg/L进而计算出长蛸在氨氮溶液中的安全浓度为12.49mg/L并对其进行验证。结果表明, 在进行长蛸养殖的过程中添加微量氨氮对长蛸的生长起到一定的促进作用, 可以为大规模养殖提供水质参数和理论依据。
致谢 马山集团有限公司蔡兵经理、蔡辉厂长提供实验场地及实验样品; 中国海洋大学贝类遗传育种研究室研究生汪金海、宋旻鹏、李希豹协助实验, 谨致谢忱。
于晓, 2011.刺参(Apostichopus japonicus)对几种化学胁迫因子的生理生态学响应及其机制研究.青岛: 中国海洋大学硕士学位论文 http://d.wanfangdata.com.cn/Thesis/Y1927836
|
牛春格, 杨程, 申屠琰, 等. 2019. 氨氮急性攻毒对水产经济动物棘胸蛙(Paa spinosa)蝌蚪死亡率、排氨率、耗氧率及窒息点的影响. 海洋与湖沼, 50(1): 188-196 |
刘娥, 2013.草幼鱼对氨氮胁迫的形态及生理学响应.济南: 山东大学硕士学位论文 http://cdmd.cnki.com.cn/Article/CDMD-10422-1013219428.htm
|
李翠萍, 吴民耀, 王宏元. 2012. 3种半数致死浓度计算方法之比较. 动物医学进展, 33(9): 89-92 |
张武肖, 孙盛明, 戈贤平, 等. 2015. 急性氨氮胁迫及毒后恢复对团头鲂幼鱼鳃、肝和肾组织结构的影响. 水产学报, 39(2): 233-244 |
陈思涵, 彭瑞冰, 黄晨, 等. 2018. 急性氨氮胁迫对虎斑乌贼肝脏、鳃和脑组织结构的影响. 水产学报, 42(9): 1348-1357 |
林忠婷, 李建军, 陈琳, 等. 2011. 非离子氨和亚硝酸氮对虾虎鱼仔鱼的急性毒性及安全浓度评价. 中国比较医学杂志, 21(9): 45-48 DOI:10.3969/j.issn.1671.7856.2011.09.011 |
徐胜威, 杨程, 斯烈钢, 等. 2019. 氨氮胁迫对凡纳滨对虾的生长状况及虾肝肠胞虫(EHP)携带量的影响. 安徽农业科学, 47(7): 109-112 DOI:10.3969/j.issn.0517-6611.2019.07.035 |
梁俊平, 李健, 李吉涛, 等. 2012. 氨氮对脊尾白虾幼虾和成虾的毒性试验. 水产科学, 31(9): 526-529 DOI:10.3969/j.issn.1003-1111.2012.09.004 |
彭军辉, 陈丽英, 程长洪, 等. 2018. 氨氮对拟穴青蟹的急性毒性及对其血清免疫相关酶活力的影响. 渔业科学进展, 39(5): 114-121 |
葛建龙, 孟乾, 陈四清, 等. 2018. 氨氮对海月水母螅状体和碟状体的急性及慢性毒性作用. 海洋与湖沼, 49(4): 809-814 |
Arafa M H, Atteia H H, 2013. Sildenafil citrate attenuates the deleterious effects of elevated ammonia. Toxicology Mechanisms and Methods, 23(6): 402-411 DOI:10.3109/15376516.2013.770109 |
Boardman G D, Starbuck S M, Hudgins D B et al, 2004. Toxicity of ammonia to three marine fish and three marine invertebrates. Environmental Toxicology, 19(2): 134-142 DOI:10.1002/tox.20006 |
Bower C E, Bidwell J P, 1978. Ionization of ammonia in seawater: effects of temperature, pH, and salinity. Journal of the Fisheries Research Board of Canada, 35(7): 1012-1016 DOI:10.1139/f78-165 |
Chew S F, Ip Y K, 2014. Excretory nitrogen metabolism and defence against ammonia toxicity in air-breathing fishes. Journal of Fish Biology, 84(3): 603-638 DOI:10.1111/jfb.12279 |
Cong M, Wu H F, Yang H P et al, 2017. Gill damage and neurotoxicity of ammonia nitrogen on the clam Ruditapes philippinarum. Ecotoxicology, 26(3): 459-469 DOI:10.1007/s10646-017-1777-4 |
Emerson K, Russo R C, Lund R E et al, 1975. Aqueous ammonia equilibrium calculations: effect of pH and temperature. Journal of the Fisheries Research Board of Canada, 32(12): 2379-2383 DOI:10.1139/f75-274 |
Feyjoo P, Riera R, Felipe B C et al, 2011. Tolerance response to ammonia and nitrite in hatchlings paralarvae of Octopus vulgaris and its toxic effects on prey consumption rate and chromatophores activity. Aquaculture International, 19(1): 193-204 DOI:10.1007/s10499-010-9352-5 |
Finney D J, 1952. Probit Analysis: a Statistical Treatment of the Sigmoid Response Curve. 2nd ed. Cambridge: Cambridge University Press, 388-390
|
Heinrichs E A, Chelliah S, Valencia S L et al, 1981. Manual for Testing Insecticides on Rice. International Rice Research Institute, Los Banos, Laguna, Philippines, 92-102
|
Kim D S, Kim J M, 2006. Sexual maturity and growth characteristics of Octopus minor. Korean Journal of Fisheries and Aquatic Sciences, 39(5): 410-418 DOI:10.5657/kfas.2006.39.5.410 |
Kir M, Topuz M, Sunar M C et al, 2016. Acute toxicity of ammonia in Meagre (Argyrosomus regius Asso, 1801) at different temperatures. Aquaculture Research, 47(11): 3593-3598 DOI:10.1111/are.12811 |
Liew H J, Sinha A K, Nawata C M et al, 2013. Differential responses in ammonia excretion, sodium fluxes and gill permeability explain different sensitivities to acute high environmental ammonia in three freshwater teleosts. Aquatic Toxicology, 126: 63-76 DOI:10.1016/j.aquatox.2012.10.012 |
Lin Y C, Chen J C, 2001. Acute toxicity of ammonia on Litopenaeus vannamei Boone juveniles at different salinity levels. Journal of Experimental Marine Biology and Ecology, 259(1): 109-119 DOI:10.1016/S0022-0981(01)00227-1 |
Maas A, Seibel B A, Walsh P J, 2012. Effects of elevated ammonia concentrations on survival, metabolic rates, and glutamine synthetase activity in the Antarctic pteropod mollusk Clione limacina antarctica. Polar Biology, 35(7): 1123-1128 DOI:10.1007/s00300-012-1158-7 |
Martins I, Godinho A, Goulart J et al, 2018. Assessment of Cu sub-lethal toxicity (LC50) in the cold-water gorgonian Dentomuricea meteor under a deep-sea mining activity scenario. Environmental Pollution, 240: 903-907 DOI:10.1016/j.envpol.2018.05.040 |
McDonald D G, Reader J R, Dalziel T R K, 1989. The combined effects of pH and trace metals on fish ionoregulation. In: Morris R, Taylor E W, Brown D J A et al eds. Acid Toxicity and Aquatic Animals. Cambridge: Cambridge University Press, 221
|
Nath K A, Croatt A J, Likely S et al, 1996. Renal oxidant injury and oxidant response induced by mercury. Kidney International, 50(3): 1032-1043 DOI:10.1038/ki.1996.406 |
Randall D J, Tsui T K N, 2002. Ammonia toxicity in fish. Marine Pollution Bulletin, 45(1-12): 17-23 DOI:10.1016/S0025-326X(02)00227-8 |
Reddy-Lopata K, Auerswald L, Cook P, 2006. Ammonia toxicity and its effect on the growth of the South African abalone Haliotis midae Linnaeus. Aquaculture, 261(2): 678-687 DOI:10.1016/j.aquaculture.2006.06.020 |
Romano N, Zeng C S, 2007. Ontogenetic changes in tolerance to acute ammonia exposure and associated gill histological alterations during early juvenile development of the blue swimmer crab, Portunus pelagicus. Aquaculture, 266(1-4): 246-254 DOI:10.1016/j.aquaculture.2007.01.035 |
Senthamilselvan D, Chezhian A, 2011. Study on acute ammonia toxicity at different pH levels in fish Cyprinus carpio. Asian Journal of Biochemical and Pharmaceutical Research, 1(4): 231-235 |
Song M P, Wang J H, Zheng X D, 2019. Prey preference of the common long-armed octopus Octopus minor (Cephalopoda: Octopodidae) on three different species of bivalves. Journal of Oceanology and Limnology DOI:10.1007/s00343-019-8217-7 |
Sprague J B, 1971. Measurement of pollutant toxicity to fish-Ⅲ: sublethal effects and "safe" concentrations. Water Research, 5(6): 245-266 DOI:10.1016/0043-1354(71)90171-0 |
Vig E, Orbán L, Nemcsók J et al, 1987. Physiopathologic data on the action of selected fungicides and herbicides in carp. Archiv für Experimentelle Veterinärmedizin, 41(4): 491-505 |
Wang J H, Zheng X D, 2017. Comparison of the genetic relationship between nine cephalopod species based on cluster analysis of karyotype evolutionary distance. Comparative Cytogenetics, 11(3): 477-494 DOI:10.3897/compcytogen.v11i3.12752 |
Xu R, Bo Q K, Zheng X D, 2018. A divergent lineage among Octopus minor (Sasaki, 1920) populations in the Northwest Pacific supported by DNA barcoding. Marine Biology Research, 14(4): 335-344 DOI:10.1080/17451000.2018.1427866 |
Zheng X D, Qian Y S, Liu C et al, 2014. Octopus minor. In: Iglesias J, Fuentes L, Villanueva R eds. Cephalopod Culture. Dordrecht: Springer, 415-426
|
Zhou X, Dong Y W, Wang F et al, 2013. The effect of high ammonia concentration on gill structure alternation and expression of sod and hsp90 genes in grass carp, Ctenopharyngodon idella. Acta Hydrobiologica Sinica, 37(2): 321-328 |
 2019, Vol. 50
2019, Vol. 50


