
中国海洋湖沼学会主办。
文章信息
- 毛铁墙, 董宏坡, 陈法锦, 侯庆华, 朱庆梅, 阳雯娜, 张家伟, 纪梓晗, 凌炜琪. 2020.
- MAO Tie-Qiang, DONG Hong-Po, CHEN Fa-Jin, HOU Qing-Hua, ZHU Qing-Mei, YANG Wen-Na, ZHANG Jia-Wei, JI Zi-Han, LING Wei-Qi. 2020.
- 湛江湾沉积物中反硝化和厌氧氨氧化细菌的丰度、多样性及分布特征
- ABUNDANCE, DIVERSITY, AND DISTRIBUTION OF DENITRIFIER AND ANAMMOX BACTERIA IN ZHANJIANG BAY SEDIMENTS
- 海洋与湖沼, 51(1): 59-74
- Oceanologia et Limnologia Sinica, 51(1): 59-74.
- http://dx.doi.org/10.11693/hyhz20190600108
文章历史
-
收稿日期:2019-06-11
收修改稿日期:2019-09-12
2. 华东师范大学 河口海岸学国家重点实验室 上海 200062
2. State Key Laboratory of Estuarine and Coastal Research, East China Normal University, Shanghai 200062, China
反硝化微生物在海洋中发挥着重要的作用, 其主要功能是将或NO3-(或NO2-)转变为气态产物(包括NO、N2O、N2), 它们多属于异养或兼性厌氧菌(Senga et al, 2010)。在反硝化过程中, NO3-(或NO2-)主要作为电子传递链的末端电子受体; 参与的酶包括硝酸盐还原酶、亚硝酸盐还原酶、一氧化氮还原酶以及氧化亚氮还原酶等。亚硝酸盐还原酶是反硝化过程的限速酶, 负责将NO2-还原为NO; 亚硝酸还原酶主要以两种结构不同但功能相同的形式存在: nirK(含铜型)、nirS (细胞色素cd1型)。目前, 亚硝酸盐还原酶作为分子标记已经广泛被用于研究反硝化细菌的种群结构及多样性, 如Dang等(2009)对我国富营养化的胶州湾海域的nirS型反硝化细菌开展了较为深入的研究, 并首次发现沉积物的理化性质影响反硝化细菌的群落结构和分布。Mosier等(2010)对旧金山海湾河口区的nirS和nirK型反硝化细菌的丰度、多样性以及潜在的反硝化速率进行了研究, 结果发现nirS型反硝化细菌丰度及群落多样性均高于nirK型, 反硝化速率与nirS型反硝化细菌丰度呈显著正相关, 表明nirS型较之nirK型反硝化细菌在该海域具有更重要的生物地球化学意义。Smith等(2015)对美国Monterey海湾潮间带沉积物中的氨氧化和反硝化微生物的时空分布及潜在活性开展了研究, 结果表明反硝化细菌和氨氧化微生物之间存在相互关系或耦合作用。近些年来, 随着温室气体(如N2O)排放量逐渐增加, 使得科学家对于氧化亚氮还原酶基因(nosZ)也产生了浓厚的兴趣(Choi et al, 2016)。
尽管反硝化作用一直被认为是海洋中脱氮的最重要过程, 但随着厌氧氨氧化(anammox)的发现并对其逐步的深入研究, 科学家普遍认为厌氧氨氧化才可能是海洋氮损失的主要原因(Thamdrup et al, 2002)。有研究表明, 厌氧氨氧化细菌对海洋中N2产生的贡献率约为50% (Jetten et al, 2009), 对淡水生态系统中N2产生的贡献率约为30% (Wenk et al, 2013);也有研究表明, 厌氧氨氧化在沉积物中脱氮贡献率最高可达80% (Thamdrup, 2012)。厌氧氨氧化微生物为专性厌氧的化能自养型细菌, 其主要在厌氧环境下, 以CO2为唯一碳源, 将氨氧化为氮气(NH4+ +NO2-→ N2 + 2H2O)。16SrRNA基因分析结果表明, 厌氧氨氧化细菌隶属于浮霉菌门(Strous et al, 1999), 分为五个Candidatus属: “Candidatus Kuenenia”、“Candidatus Brocadia”、“Candidatus Scalindua”、“Candidatus Anammoxoglobus”和“Candidatus Jettenia”, 且在海洋生态系统中, Candidatus Scalindua占主导地位(Choi et al, 2016)。但由于培养条件的苛刻与困难, 至今厌氧氨氧化细菌暂无纯培养菌株(Dang et al, 2010), 环境中厌氧氨氧化细菌的丰度和多样性主要通过特异性引物如Anammox 16SrRNA或hzo基因(Schmid et al, 2008)进行研究。近些年来, 许多科学家使用分子生态学手段在海洋(Dang et al, 2010; Li et al, 2013; Choi et al, 2016)、淡水(Penton et al, 2006)以及陆地生态系统(Wang et al, 2012; Meng et al, 2016)等生境中检测到了厌氧氨氧化细菌, 并对其丰度、多样性以及生理生态功能开展了较为深入的研究。
反硝化和厌氧氨氧化细菌可能会利用相同的底物(NO2-或NO3-), 这可能会影响反硝化作用的潜在速率(Kim et al, 2016)。国内学者已经对莱州湾、胶州湾、渤海湾(Dang et al, 2009; Wang et al, 2013, 2014)等海湾的反硝化细菌或厌氧氨氧化细菌开展了深入的研究, 但对热带海湾中的反硝化细菌及厌氧氨氧化细菌, 以及它们之间的关系却研究甚少。近些年来, 地处亚热带季风气候的湛江湾经济发展迅猛, 无机氮浓度表现出一定增加的趋势(袁旗等, 2016)。在这样的一个地理环境、气候条件下, 反硝化细菌与厌氧氨氧化如何在氮循环中发挥作用、以及它们之间的关系目前仍了解不深。本研究选取湛江湾沉积物作为研究对象, 通过分子生态学手段, 对湛江湾反硝化细菌、厌氧氨氧化细菌丰度及多样性进行分析, 探讨反硝化细菌、厌氧氨氧化细菌的丰度、多样性、群落结构与环境因子的关系, 以期为进一步认识反硝化微生物和厌氧氨氧化微生物之间的关系以及它们在氮循环中的作用提供理论依据, 并为热带海湾氮污染治理提供新线索。
1 材料与方法 1.1 样品采集湛江湾(110.32°-110.52°E, 21.05°-21.38°N)位于中国粤西雷州半岛的东北侧, 临近南海, 其水域面积为1419km2, 平均水深约13m, 湛江地区属于热带亚热带季风气候, 由于河流输入、潮汐作用、排污口等人为因素导致湛江湾沉积速率较快, 其营养盐在四季的分布不均可能对沉积物中的微生物活动有着重要的影响。2017年4月、9月、11月, 2018年2月份航次采集湛江湾15个站位表层(0-3cm)沉积物样品, 站位信息详见图 1。沉积物泥样使用抓斗采泥器采集, 取少量表层沉积物样品装入已灭菌的采样杯, -20℃低温保存并带回实验室。取少量沉积物进行分装、离心, 并于-80℃冰箱保存, 以用于DNA提取; 另取部分样品进行理化参数分析。
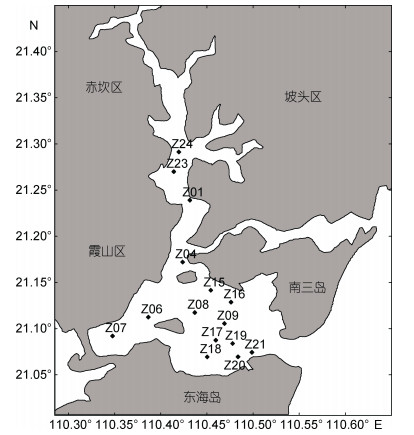 |
| 图 1 湛江湾沉积物采样站位 Fig. 1 The sampling sites in Zhanjiang Bay |
营养盐、总有机碳(TOC)以及沉积物含水率的测定均参照《土壤农化分析》(鲍士旦, 2008)的方法, 用2mol/L KCl溶液浸提取沉积物样品, 浸提液经聚醚砜针式滤头(13mm, 0.45um, 安普, 上海)过滤后, 采用连续流动分析仪(Skalar Analytical B.V SAN++, 检测限: ≥0.1μmol/L)测定NH4+-N、NO3--N、NO2--N, TOC含量用重铬酸钾-氧化还原滴定法进行测定。通过Wang等(2014)的方法, 使用采水器采集沉积物上覆水, 并采用碘量滴定法测定溶解氧(DO)。沉积物中的pH使用pH计(雷磁, 上海仪电科学)进行测定; 使用温度计(雷磁, 上海仪电科学)测定温度; 对于孔隙水的获取, 取适量沉积物至2mL离心管, 12000r/min室温离心, 然后使用盐度计(WYY-Ⅱ盐度计, 深圳)测量盐度。
1.3 DNA提取与实时荧光定量PCRDNA提取使用PowerSoil®DNA Isolation Kit提取试剂盒(MoBio公司, 加拿大)从沉积物样品中提取总DNA, 并通过NanoVueTM Plus微量分析仪(GE公司, 英国)测定其DNA浓度。使用实时荧光定量PCR检测系统(CFX96 TouchTM, Bio-Rad公司, 美国)进行定量PCR, 定量PCR选择的特异性引物如表 1所示。对于细胞色素cd1-亚硝酸盐还原酶(nirS)基因、Cu-亚硝酸盐还原酶(nirK)基因、一氧化二氮还原酶(nosZ)基因以及厌氧氨氧化的Ca.scalindua16SrRNA基因, 总反应体系为20μL, 包括SYBR Permix ExTaqM II (2×) (Takara, 大连) 10μL, 正、反向引物各0.5μL(10μmol/L), 1μL模板DNA, 用双蒸馏水(ddH2O)补至20μL。各基因扩增程序如下: 95℃, 30s; 95℃, 5s;退火温度见表 1, 退火时间: 30s; 72℃, 30s (nirS、Ca.scalindua16SrR NA基因延伸时间为60s); 共40个循环, 添加溶解曲线(将温度从65℃提高至95℃, 每5s提高0.5℃)。所有的DNA样品及标准质粒都设置三个平行。
| 目的基因 | 引物序列(5′-3′) | 退火(℃) | 扩增效率(%) | 参考文献 |
| nirS | cd3aF: GTS AAC GTS AAG GARACS GG R3cd: GAS TTC GGR TGS GTC TTG A |
57 | 95-110 | (Throbäck et al, 2004) |
| nirK | nirK876F: ATYGGCGGVAYGGCGA nirK1040R: GCCTCGATCAGRTTRTGGTT |
56 | 90-112 | (Henry et al, 2004) |
| nosZ | nosZ1F: WCSYTGTTCMTCGACAGCCAG nosZ1R: ATGTCGATCARCTGVKCRTTYTC |
56 | 86-90 | (Henry et al, 2006) |
| Ca.scalindua 16SrRNA | Brod541F: GAGCACGTAGGTGGGTTTGT Brod1260R: GGATTCGCTTCACCTCTCGG |
60 | 84-92 | (Penton et al, 2006) |
本研究设置阴性对照, 对标准质粒进行10倍梯度稀释, 再进行qPCR, 并绘制标准曲线。质粒标准品的构建主要按以下流程进行:使用AxyPrepDNA凝胶回收试剂盒(Axygen, 美国)分别获得纯化后的nirS、nirK、nosZ、Ca.scalindua16SrRNA基因片段PCR产物, 利用pMD® l8-T Vector连接试剂盒(Takara, 大连)将目的片段连接到载体上, 并将重组质粒导入大肠杆菌感受态细胞, 再涂布至含有AMP的固体培养基, 放入恒温震荡培养箱37℃培养12h;然后挑取已做好标记的1/2单菌落进行菌落PCR, 验证完毕后, 选取扩增结果良好的单菌落转入含有适宜浓度AMP的液体培养基, 并将其放至恒温震荡培养箱(37℃、180r/min)培养12-16h;然后使用质粒提取试剂盒(Takara, 大连)提取质粒, 从而获得质粒标准品。扩增效率由以下公式计算: E%=(10-1/slope)-1 (式中slope:标曲斜率) (Klein, 2002), 本研究的斜率在-3.79- -3.05, 其扩增效率在84%-112%之间(R2>0.98)。
1.4 文库构建与高通量测序以沉积物基因组DNA作为PCR模板, 使用表 1中nirS、nirK、nosZ特异性引物, 利用VeritiTM 96-Well热循环仪(Applied Biosystems, Foster, CA, 美国)进行PCR扩增, 由于高通量测序结果需要对不同样品序列进行区分, 故本研究对引物上游5′端添加标签(Barcode)。PCR扩增体系(20μL)为: 10μL 2×Taq Plus Master mix (南京诺唯赞生物科技有限公司), 1μL模板DNA, 正、反向引物各0.5μL (15μmol/L), 8μL ddH2O。PCR扩增程序为: 95℃预变性3min, 95℃变性30s, 退火: (nirS、nirK、nosZ、Ca.scalindua16SrRNA基因的退火温度和时间分别为: 56℃、20s; 58℃、30s; 57℃、30s; 57℃、1min), 72℃延伸45s, 循环数为35个; 最后72℃延伸10min; 4℃保存。PCR产物用1.2%琼脂糖凝胶电泳进行检测, 用AxyPrepDNA凝胶回收试剂盒(Axygen, 美国)进行回收纯化, 送至上海微基生物科技有限公司对PCR产物进行定量和均一化, 构建PE文库, 并在Illumina平台进行高通量测序。基于MOTHUR v.1.39.5软件平台, 按照MOTHUR操作流程(https://mothur.org/wiki/MiSeq_SOP), 对获得的序列进行处理优化, 并按照97%的相似度进行操作分类单元(operational taxonomic unit, OTU)划分, 用于Coverage、Chao1、Shannon、Simpson等多样性指数分析(Wang et al, 2014)。
1.5 系统发育分析抽取reads数为前20的OTU的代表序列在NCBI数据库中进行BLAST, 提取其相似度高的前几条序列与已知的OTU代表序列导入MEGA7.0软件, 使用邻接法(neighbor-joining)对系统软件进行发育分析, 构建系统发生树(phylogenetic tree), 自助法(Boostrap method)设置1000次计算, 步长值(bootstrap value)低于50%不予以显示。
1.6 生物学统计分析使用SPSS 22软件分析反硝化细菌、厌氧氨氧化细菌丰度与环境因子之间的相关性和显著性水平(P<0.05即有显著相关性), 单因素方差分析, 以及线性回归分析。用Vegan软件中的典范对应分析(canonical correspondence analysis, CCA)解析各站位的反硝化细菌、厌氧氨氧化细菌群落结构与环境因子之间的关系。用蒙特卡罗置换检验(Monte Carlo Permutation Test)检验环境因子和群落结构之间相关显著性。
2 结果与分析 2.1 沉积物样品的理化性质沉积物样品的理化性质各月份变化趋势如表 2所示。溶解氧在四个月份都整体较高, 最高可达8.49mg/L, 可能对厌氧微生物的活动有一定的抑制作用; pH值显示湛江湾沉积物在十一月份时偏弱酸性(6.26), 而四月份时偏弱碱性(7.99);盐度在九月份时最低(25.60), 在二月份时最高(29.42);铵盐浓度在十一月份最低(3.42mg/kg), 在九月份最高(7.39mg/kg); 硝酸盐浓度在九月份最低(0.06mg/kg), 四月份最高(0.40mg/kg); 亚硝酸盐在十一月份最高(0.52mg/kg), 而在四月、九月份未检测到。
| 环境参数 | 二月份 | 四月份 | 九月份 | 十一月份 |
| 温度(℃) | 19.05±0.54 | 24.27±0.17 | 30.64±0.53 | 21.35±1.27 |
| 溶解氧(mg/L) | 8.49±0.26 | 7.10±0.98 | 5.57±0.84 | 7.38±0.44 |
| pH | 6.72±0.74 | 7.99±0.03 | 7.84±0.09 | 6.26±0.16 |
| 盐度 | 29.42±1.31 | 27.10 ±2.26 | 25.60±2.24 | 28.51±1.10 |
| TOC (%) | 0.99±0.46 | 1.12±0.44 | 1.01±0.43 | 0.59±0.43 |
| NH4+-N (mg/kg) | 3.98±2.51 | 4.09±3.27 | 7.39±4.98 | 3.42±3.16 |
| NO3--N (mg/kg) | 0.10±0.08 | 0.39±0.17 | 0.06±0.02 | 0.24±0.12 |
| NO2--N (mg/kg) | 0.47±0.05 | n.d. | n.d. | 0.52±0.15 |
| 注: n.d.:未检测到; TOC:总有机碳; NH4+-N、NO3--N、NO2--N浓度均为提取态含量; 溶解氧为底层水的含量 | ||||
通过实时荧光定量PCR, 对湛江湾各站位沉积物样品进行了基于DNA水平上的绝对定量, 结果显示: nirS型、nirK型、nosZ型反硝化细菌、厌氧氨氧化细菌在四个月份的丰度平均值变化范围分别为: 6.17×105-9.12×105copies/g (以干土计), 8.00×104- 6.72×105copies/g (以干土计), 6.39×103-1.81×104copies/g (以干土计), 2.85×104-8.13×105copies/g (以干土计)。在湛江湾四个月份中发现: nirS型反硝化细菌丰度在二月份达到最高(ANOVA, F=8.60, P=0.012), 各站位平均丰度为9.12×105copies/g (以干土计), 在四月份、九月份、十一月份的平均丰度分别为6.17×105copies/g (以干土计)、7.59×105copies/g (以干土计)、8.20× 105copies/g (以干土计)。nirS型反硝化细菌四个月份平均丰度在位于特呈岛旁的Z15站位较之其它站位高一个数量级, 而位于宝钢排污口的Z21站位平均丰度低于其他站位, 仅为4.61×105copies/g (以干土计), 各站位在四个月份的平均丰度有从湛江湾湾内向湾口附近呈现先升高再降低的趋势。nirk型反硝化细菌在九月份丰度最高(ANOVA, F=5.43, P=0.043), 平均丰度为6.72×105copies/g (以干土计); 四月份次之, 其平均丰度为2.14×105copies/g (以干土计); 十一月份最低(ANOVA, F=5.21, P=0.045), 其平均丰度为3.88×104copies/g (以干土计)。nosZ型反硝化细菌在四月份有最高丰度(ANOVA, F=24.79, P=0.000), 其平均丰度为1.81×104copies/g (以干土计), 而在其他三个月份的丰度变化不大, 其空间分布的趋势与nirS型反硝化细菌大体一致。对于厌氧氨氧化细菌而言, 其在九月份有最高丰度(ANOVA, F=4.65, P=0.049), 平均丰度为8.13×105copies/g (以干土计); 四月份次之, 平均丰度为1.74×105copies/g (以干土计); 二月份丰度最低(ANOVA, F=7.19, P=0.018), 平均丰度为2.85×104copies/g (以干土计)。厌氧氨氧化细菌四个月份的平均丰度在位于火电厂旁的Z24站位平均丰度较之其他站位低了一个数量级, 而Z18站位平均丰度最高, 为8.22×105copies/g (以干土计)。总的说来, 在四个月份中nirS型反硝化细菌平均丰度最高, nosZ型反硝化细菌丰度在反硝化细菌中占比最低; 而厌氧氨氧化细菌与在湛江湾中占主导作用的nirS型反硝化细菌相比较, 两者在四、九月份丰度相差不大, 均处于同一数量级, 而在二月份、十一月份厌氧氨氧化细菌丰度则均低于nirS型反硝化细菌。另外, 四个月份的nirS型反硝化细菌丰度与氨氧氨氧化细菌丰度呈显著正相关性(R= 0.572, P<0.05)。
使用SPSS 22分别对nirS、nirK、nosZ型反硝化细菌、厌氧氨氧化细菌丰度与沉积物样品中的环境因子进行相关性分析(表 3)。结果表明, nirS型反硝化细菌丰度与NO2--N呈显著正相关(P < 0.05), 与pH呈显著负相关(P < 0.05); nirK型反硝化细菌丰度与盐度呈显著负相关(P < 0.05); nosZ型反硝化细菌丰度与NO3--N、pH呈显著性正相关(P < 0.05), 与温度呈显著负相关(P < 0.05);厌氧氨氧化细菌丰度与NH4+-N、NO2--N呈显著正相关(P < 0.05)。
| nirS | nirK | nosZ | Ca.scalindua-16SrRNA | nirS/Ca.scalindua-16SrRNA | |
| NH4+-N (mg/kg) | 0.476 | 0.287 | -0.064 | 0.959** | -0.070 |
| NO3--N (mg/kg) | -0.667 | 0.511 | 0.172 | 0.028 | -0.070 |
| NO2--N (mg/kg) | 0.961* | -0.343 | 0.578** | 0.484* | -0.570* |
| TOC (%) | 0.357 | -0.348 | 0.082 | 0.109 | 0.054 |
| 盐度 | 0.180 | -0.855* | 0.230 | -0.115 | 0.324 |
| 温度(℃) | -0.048 | -0.142 | -0.407* | 0.245 | -0.140 |
| 溶解氧(mg/L) | -0.048 | 0.236 | 0.449* | 0.245 | 0.201 |
| pH | -0.503* | -0.066 | 0.159 | 0.142 | -0.229 |
| 注: **: P < 0.01; *: P < 0.05; TOC:总有机碳 | |||||
表 4展现了5个沉积物站位中反硝化细菌和厌氧氨氧化细菌的OTU数目和多样性指数。从所有站位丰富度与多样性指数计算结果来看, 反硝化细菌和厌氧氨氧化细菌文库覆盖率均在99%以上, 表明得到的多样性指数数据有效可靠。
| 站位 | OTU数 | 覆盖率(%) | Chao1指数 | Shannon指数 | Simpson指数 | ||||
| nirS/ nirK/ nosZ/ Ca.scalindua- 16SrRNA | nirS/ nirK/ nosZ/ Ca.scalindua- 16SrRNA | nirS/ nirK/ nosZ/ Ca.scalindua- 16SrRNA | nirS/ nirK/ nosZ/ Ca.scalindua- 16SrRNA | nirS/ nirK/ nosZ/ Ca.scalindua- 16SrRNA | |||||
| Z06 | 378.00/ 217.00/ 421.00/ 35.00 | 99.89/ 99.90/ 99.97/ 99.97 | 396.37/ 244.14/ 427.11/ 56.00 | 4.23/ 3.96/ 5.15/ 1.92 | 0.053/ 0.053/ 0.0097/ 0.19 | ||||
| Z15 | 448.00/ 350.00/ 563.00/ 44.00 | 99.92/ 99.24/ 99.95/ 99.99 | 459.05/ 417.10/ 569.95/ 46.50 | 4.86/ 4.49/ 5.37/ 1.65 | 0.020/ 0.030/ 0.0095/ 0.27 | ||||
| Z17 | 415.00/ 411.00/ 512.00/ 44.00 | 99.92/ 99.90/ 99.92/ 99.97 | 433.00/ 435.17/ 527.79/ 51.20 | 4.49/ 4.94/ 5.09/ 1.54 | 0.026/ 0.016/ 0.014/ 0.33 | ||||
| Z21 | 367.00/ 432.00/ 491.00/ 48.00 | 99.83/ 99.88/ 99.92/ 99.98 | 404.94/ 449.25/ 508.10/ 50.50 | 3.91/ 5.09/ 4.97/ 2.06 | 0.068/ 0.016/ 0.015/ 0.20 | ||||
| Z24 | 343.00/ 278.00/ 400.00/ 36.00 | 99.95/ 99.95/ 99.97/ 99.97 | 351.08/ 291.13/ 405.50/ 45.00 | 4.65/ 4.12/ 4.99/ 0.62 | 0.024/ 0.050/ 0.013/ 0.78 |
对于反硝化细菌, 其在所有样品中的OTU数范围为278-563, nosZ的OTU数最大, nirK的OTU数最小; 通过Chao1指数评估样品中群落丰富度可知, nirS、nosZ型反硝化细菌均在Z15站位丰富度最高, Z24站位最小。nirK型反硝化细菌在Z21站位丰富度最高, Z06站位最小。通过Shannon指数和Simpson指数对群落多样性进行分析, 结果表明, 对于nirS型反硝化菌, 其群落多样性在的Z15站位最大, 在Z21站位最小; nirK型反硝化细菌的群落多样性在Z21站位最大, 在Z06站位最小; nosZ型反硝化菌的群落多样性在Z15站位最大, 在Z21站位最小。
对于厌氧氨氧化细菌而言, 在所有站位的样品中, Ca.scalindua16SrRNA共有207个OTUs, 通过Chao1指数评估样品中群落丰富度, 其在Z06站位最大, 在Z24站位最小; 通过Shannon指数和Simpson指数对群落多样性进行分析, 其群落多样性在湾口附近的Z21站位最大, 在Z24站位最小。
总而言之, 在湛江湾中, 反硝化细菌和厌氧氨氧化细菌在不同环境下的群落组成不同, 且反硝化细菌的生物多样性明显比厌氧氨氧化细菌高。
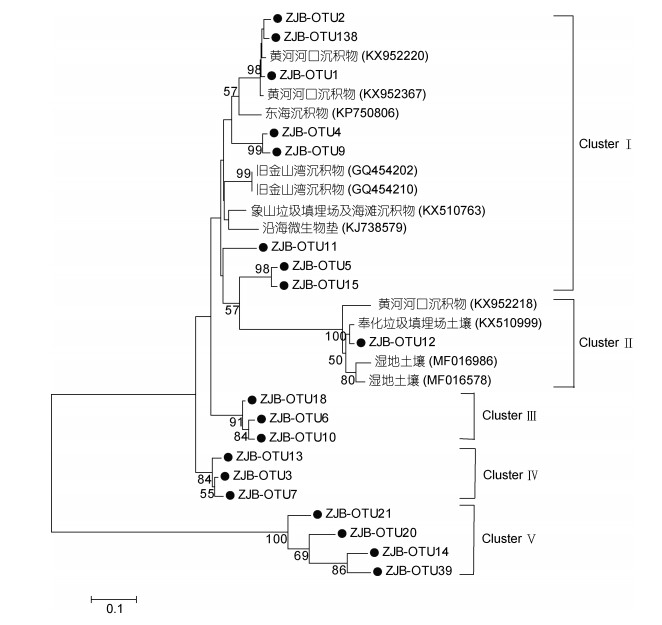
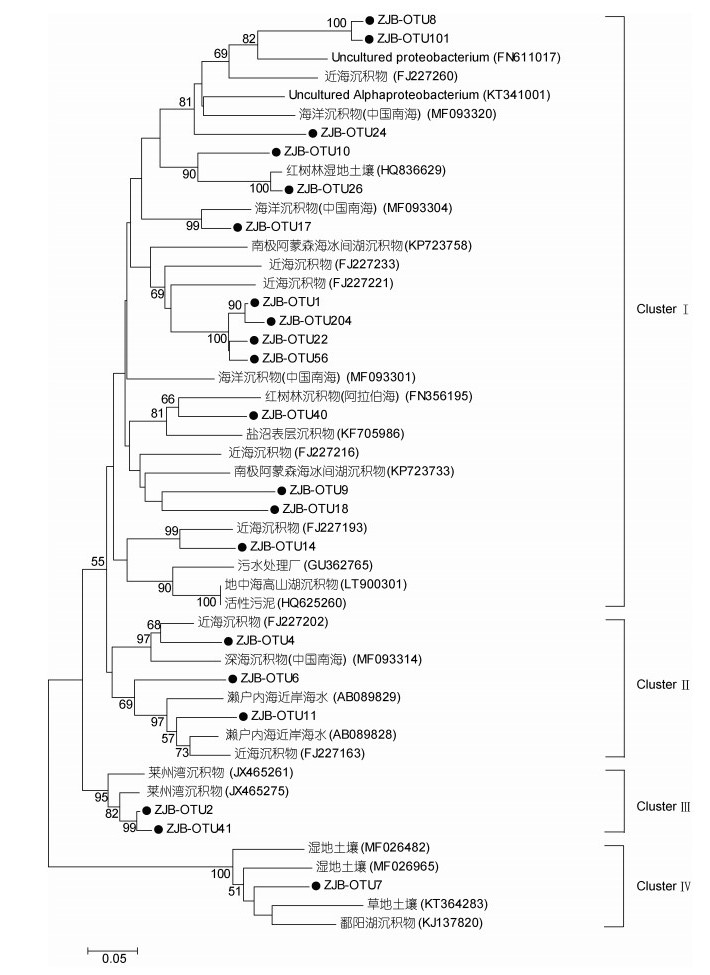
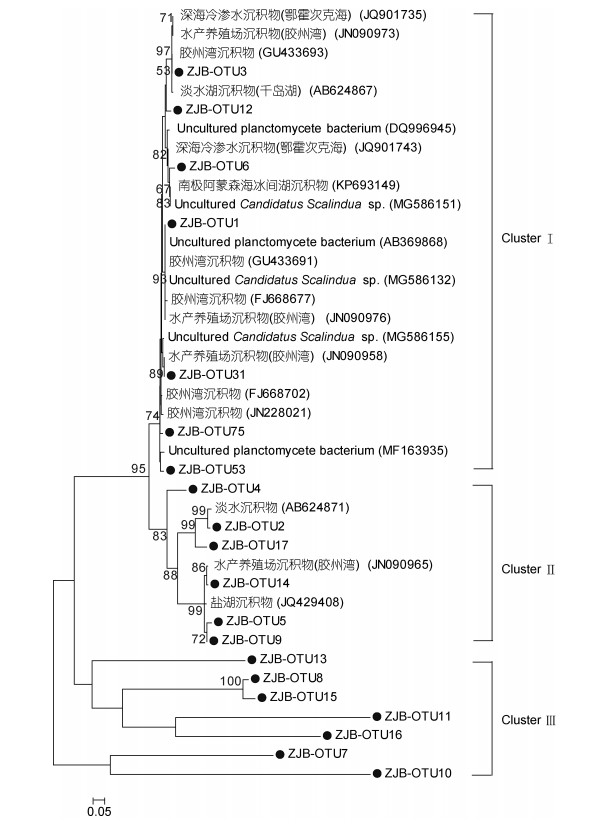
2.4 湛江湾沉积物中反硝化细菌和厌氧氨氧化细菌系统发育分析基于OTU聚类结果, 提取reads数值为前20的OTU为代表序列, 在NCBI数据库中进行BLAST, 提取同源性高的序列导入MEGA7.0中, 基于核酸序列进行系统发育分析, 构建系统进化树, 如图 3-6。nirS、nirK、nosZ、Ca.scalindua16SrRNA的OTUs分别占总序列的50.05%、44.24%、29.40%、98.45%。
对于nirS基因, 系统进化树可划分为6个Cluster, ClusterⅠ有10个OTUs跟不同环境得到的序列存在亲缘关系, 包括来自河口、水产养殖区、富营养化的海湾的沉积物。ClusterⅡ中OTU14和OTU17与九龙江和闽江、珠江口富营养化的河口沉积物中得到的序列有着很高的亲缘关系。Cluster Ⅲ中OTU34、OTU13与来自河口、海岸湿地沉积物得到的序列有很大的相似性。Cluster Ⅳ中有3个nirS OTUs与富营养化的长江口、大陆边缘沉积物得到的序列有高亲缘关系。Cluster Ⅴ中OTU5、OTU12与海洋表层、河口、富营养化河口区、海湾沉积物存在一定得亲缘关系。Cluster Ⅵ中只有OTU10与Chesapeake海湾的水层、河口等地区的沉积物有一定亲缘关系。总的说来, 与nirS基因OTUs同源性高的序列大部分来自河口沉积物。
对于nirK基因, 共可分为五个Cluster, ClusterⅠ包含8个OTUs, 它们与不同环境下获得的序列有着一定的亲缘关系, 如黄河河口、我国东部海域、美国加利福利亚海湾等的沉积物。Cluster Ⅱ只包含OTU12, 它与黄河河口沉积物、Fenghua垃圾填埋场、湿地土壤获得的序列有着较高同源性。Cluster Ⅲ包含三个OTUs, 分别为OTU18、OTU6、OTU10, 它们间的相似性为96%-97%, 与加利福利亚河口沉积物中所获得的序列有着一定的相似性(84%-87%)。Cluster Ⅳ也只包含三个OTUs, 分别为OTU13、OTU3、OTU7, 它们与加利福利亚河口区沉积物获得的序列有一定的同源性(85%)。Cluster Ⅴ包含4个OTUs, 它们与湿地土壤获得的序列有着很高的相似性(96%-100%)。
对于nosZ基因, 其系统进化树可分为4个Cluster。Cluster Ⅰ中共计14个OTUs, 其中OTU8、OTU101、OTU24、OTU10、OTU26都属于Alpha-proteobacteria, 其他9个OTUs与来自不同环境里得到的序列有一定的亲缘关系, 包括海洋沉积物、红树林湿地土壤、近海岸沉积物等。Cluster Ⅱ包含3个OTUs, 它们与近海岸、深海沉积物, 近海岸海水得到的序列存在一定的同源性。Cluster Ⅲ中包含2个OTUs, 分别为OTU2、OTU41, 它们只与从莱州湾沉积物中得到的序列有高亲缘关系。Cluster Ⅳ只有OTU7与从湿地、草原土壤, 及鄱阳湖沉积物中得到的序列有一定同源性。
对于Ca.scalindua16SrRNA基因而言, 其系统进化树可分为3个Cluster。Cluster Ⅰ共包含7个OTUs, 它们归属于未可培养的Candidatus Scalindua sp.其相似性范围为94%-97%, 同时它们与不同环境下得到的序列存在一定同源性关系, 如深海冷泉、胶州湾、淡水湖等区域的沉积物。Cluster Ⅱ包含6个OTUs, 它们与从淡水、水产养殖区、盐湖的沉积物中得到的序列有较高亲缘关系。Cluster Ⅲ包括7个OTUs, OTU10、OTU11、OTU13、OTU15均未在NCBI数据库里找到与之相匹配的序列, 本研究将其定义为一个new cluster。
2.5 反硝化细菌和厌氧氨氧化细菌的群落结构与环境因子之间的关系分析通过CCA分析环境变化对反硝化细菌和厌氧氨氧化细菌群落结构的影响(图 7)。从图 7a可以看出, 两个CCA轴解释了96.34%的nirS型反硝化细菌群落结构的变化, 且TOC对nirS型反硝化细菌群落结构的影响最大。溶解氧对Z06、Z21的nirS型反硝化细菌群落结构有较强的影响, 硝酸盐主要影响内湾的Z24站位的nirS型反硝化细菌群落结构。通过使用Permutation检验的五个环境因子, 结果表明, 硝酸盐(P < 0.05)与nirS型反硝化细菌的群落结构显著正相关。湾口Z17、Z15两站位的nirS型反硝化细菌群落结构相似度较高, 而内湾的Z24与其余几个站位的nirS型反硝化细菌群落结构存在较大差异。从图 7b可以看出, 两个CCA轴解释了89%的nirK型反硝化细菌群落结构的变化, 且盐度对其影响最大。pH对Z17的nirK型反硝化细菌群落结构影响较强, 溶解氧对Z06影响较强, 铵盐对Z24影响较强, 而盐度主要对Z21、Z15影响较强。通过使用Permutation检验五个环境因子, 结果表明硝酸盐(P < 0.05)与nirK型反硝化细菌的群落结构显著正相关。Z21和Z15站位的nirK型反硝化细菌存在着较高的群落结构相似性。从图 7C可以看出, 两个CCA轴解释了79.10%的nosZ型反硝化细菌群落结构的变化, 且盐度对其影响最小。pH对Z17的nosZ型反硝化细菌群落结构影响较强, 铵盐对Z24影响较强, 硝酸盐对Z06影响较强, 而盐度对Z15影响最强。使用Permutation检验五个环境因子, 结果表明, 各环境因子对nosZ型反硝化细菌群落结构均无显著性差异。在Z06和Z24的nosZ型反硝化细菌的群落结构具有较高相似性。从图 7D可以看出, 两个CCA轴解释了98.94%的厌氧氨氧化细菌群落结构的变化, 且在Z17和Z21具有较高的群落相似性。溶解氧对厌氧氨氧化细菌群落结构影响较其他因素强。pH对Z21站位的厌氧氨氧化细菌群落结构影响较强, 盐度对Z17影响较强, TOC对Z24影响较强。通过使用Permutation检验, 结果表明铵盐(P < 0.05)和硝酸盐(P < 0.05)与厌氧氨细菌的群落结构具有显著正相关性。综上所述, 硝酸盐可能是影响反硝化细菌和厌氧氨氧化细菌的一个重要环境因素。
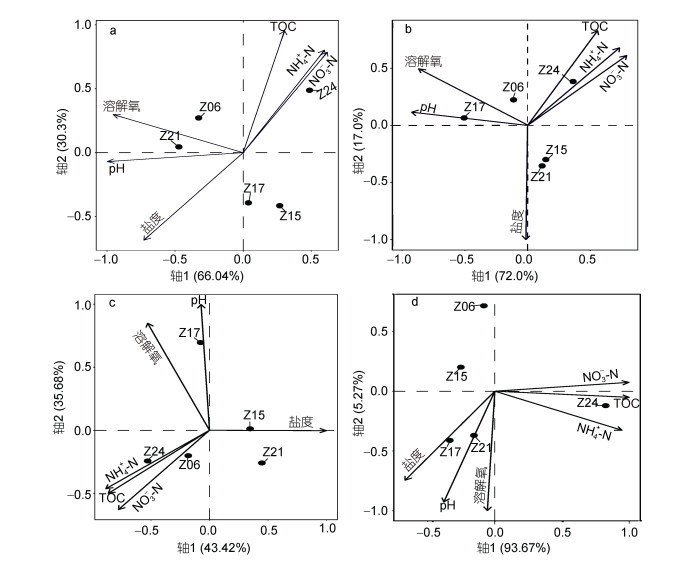 |
| 图 7 反硝化细菌、厌氧氨氧化细菌与环境因子的CCA分析 Fig. 7 CCA ordination plots for relationships between denitrifier or anammox bacteria and environment factors 注: a: nirS型反硝化细菌: b: nirK型反硝化细菌; c: nosZ型反硝化细菌; d:厌氧氨氧化细菌 |
尽管科学家们对于反硝化微生物和厌氧氨氧化微生物的丰度、多样性、群落结构等都有较为深入的研究(Kim et al, 2016; Oshiki et al, 2016), 但对于反硝化细菌与厌氧氨氧化细菌之间的关系及其季节性的变化仍有一定的局限性。本研究对湛江湾沉积物中反硝化细菌和厌氧氨氧化细菌各季度的丰度进行分析, 由图 2可看出, 反硝化细菌和厌氧氨氧化细菌在不同季节的丰度变化较大, 其整体丰度大小为:秋季>夏季>春季>冬季, 这可能是由于湛江湾在一年中氮输入量在秋季最大, 夏季次之(施玉珍等, 2015), 而亚硝酸盐、铵盐可分别为反硝化细菌和厌氧氨氧化微生物提供底物, 从而刺激反硝化作用及厌氧氨氧化作用, 本研究也发现nirS、nosZ型反硝化细菌丰度与亚硝酸盐均呈显著正相关性(P < 0.05), 厌氧氨氧化细菌与铵盐、亚硝酸盐均呈现出显著的正相关性(P < 0.05), 这可从一定程度上说明亚硝酸盐和铵盐对反硝化作用及厌氧氨氧化作用的影响。对于反硝化细菌, 其结果表明, 湛江湾中的nirS型反硝化细菌丰度变化范围相对较低于旧金山海湾、莱州湾、扬子江河口区域(Mosier et al, 2010; Wang et al, 2014; Zheng et al, 2015), 而比黄河河口区域高, 其变化范围为4.34×104-2.62×105copies/g (以干土计)(Li et al, 2017)。nirS型反硝化细菌丰度在二月份最高, 十一月份次之, 四月份最低, 这可能与pH和亚硝酸盐有关, pH在四月份、九月份明显高于二月份和十一月份(表 2), 而亚硝酸盐浓度则与之相反(四、九月份亚硝酸盐浓度低于检测限), 尽管二月份的pH要高于十一月份, 但二月份的亚硝酸盐浓度却低于十一月份; 而从其空间分布来看, nirS型反硝化细菌四个月份平均丰度在位于特呈岛旁的Z15站位较之其它站位高一个数量级, 而位于宝钢排污口的Z21站位平均丰度低于其它站位, 仅为4.61×105copies/g (以干土计), 各站位在四个月份的平均丰度有从湛江湾湾内向湾口附近呈现先升高再降低的趋势, 亚硝酸盐浓度也大致呈现出此变化趋势, 且本研究发现pH与nirS型反硝化细菌丰度呈显著负相关(P < 0.05), 亚硝酸盐与其呈显著正相关(P < 0.05), 故而pH和亚硝酸盐可能相互制约、共同调控着湛江湾中的nirS型反硝化细菌丰度。nirK型反硝化细菌丰度变化范围相对较一些河口区域低, 如南海、旧金山海湾(Li et al, 2013; Lee et al, 2017), 与美国Elkhorn Slough区域的nirK丰度大致相同(Smith et al, 2015)。nirK型反硝化细菌丰度在湛江湾四个月份的变化比较明显, 在九月份的时候丰度最高, 这可能是DO对其影响比较大(Lefebvre et al, 2006)。nosZ丰度变化范围相对来说比La Caldera湖低(Castellano-Hinojosa et al, 2017), 其在四月份丰度最大, 其他月份相差不大明显, 这可能与亚硝酸盐、温度、溶解氧有关(表 3)。从图 2可看出湛江湾反硝化作用以nirS型反硝化细菌为主导, 其丰度明显高于nirK、nosZ型反硝化细菌, 这与在旧金山海湾的研究结果一致(Mosier et al, 2010)。对于氨氧氨氧化细菌而言, 其在九月份丰度最高, 四月份次之, 二月份最低, 这可能与铵盐、亚硝酸盐有关。在湛江湾沉积物中, 厌氧氨氧化细菌与主导反硝化作用的nirS型反硝化菌相比较, 发现在二月份、十一月份时, 厌氧氨氧化细菌丰度明显小于nirS型反硝化细菌, 本研究通过SPSS 22分析丰度与环境因子的相关性时发现, 厌氧氨氧化细菌丰度与NH4+-N呈显著的正相关性(P < 0.05), 且二月份、十一月份的NH4+-N浓度低于四、九月份, 这可从一定程度上说明厌氧氨氧化微生物在此时的活动受到一定的抑制, 使得NO2--N消耗量减少, 其浓度累积较高, 这促进了nirS型反硝化细菌的活动, 故而在此时, 厌氧氨氧化细菌的丰度明显低于nirS型反硝化细菌。而在四月份和九月份时, 厌氧氨氧化细菌与主导反硝化的nirS型反硝化细菌丰度相差不大, 此时亚硝酸盐的浓度低于仪器检测限以下, 且通过相关性分析结果表明, NO2--N与nirS/Ca.scalindua16SrRNA丰度比值呈显著负相关性(P < 0.05), 这说明厌氧氨氧化细菌与反硝化细菌对亚硝酸盐可能存在一定的竞争作用, 使亚硝酸盐浓度严重偏低, 这与前人的研究结果一致(Du et al, 2017)。本研究通过分析四个月份的nirS型反硝化细菌与厌氧氨氧化细菌呈显著正相关性(P < 0.01), 并通过CCA分析表明, 硝酸盐对nirS、nirK型反硝化细菌, 以及厌氧氨氧化细菌均有着显著的正相关性, 这表明硝酸盐可能是反硝化细菌和厌氧氨氧化细菌共存的重要环境因子, 这与Li等(2016)对于反硝化细菌与厌氧氨氧化细菌的研究结果一致。在厌氧环境条件下, 硝酸盐能被反硝化作用还原为亚硝酸盐, 这可为反硝化细菌和厌氧氨氧化细菌提供底物, 同时有研究表明, 硝酸盐显著影响反硝化和厌氧氨氧化细菌群落结构(Wang et al, 2012; Meng et al, 2016)。综合上述分析推测, 湛江湾栖息的厌氧氨氧化细菌和反硝化细菌之间存在一种特殊的竞争与共存的关系, 且由铵盐、硝酸盐、亚硝酸盐、pH等共同驱动。
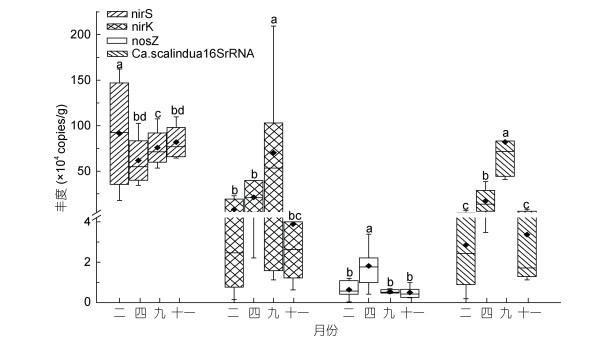 |
| 图 2 不同月份沉积物中反硝化细菌和厌氧氨氧化细菌丰度变化箱型图 Fig. 2 Box plot of abundance changes of denitrifying bacteria and anaerobic ammonium oxidizing bacteria in sediments of different months 注:箱型图从下往上的横线依次是下边缘、四分之一分位数、中位数、四分之三分位数、上边缘, 图中“◆”表示平均值, 二、四、九、十一分别表示二月份、四月份、九月份、十一月份。a、b、c、d表示各基因季节间的差异。 |
研究发现nirS丰富度变化范围为351.08-459.05, 其结果大小顺序为Z15>Z17>Z21>Z06>Z24, 可以看出nirS型反硝化细菌丰富度从湛江湾内向湾口附近呈现先升高再降低的趋势, 并在特呈岛旁的Z15站位有最大值, 这可能是因为在Z15站位的周边有许多的鱼虾养殖区, 使得大量DIN的输入影响了nirS反硝化细菌的群落(Hong et al, 2014); Shannon指数分析表明, nirS型反硝化细菌的群落多样性在Z15最大, 位于宝钢钢铁厂排污口附近的Z21最低, 且nirS型反硝化细菌四个月份平均丰度在Z15站位最高, 而Z21的平均丰度最低, 这可能表明nirS型反硝化细菌群落耐受污染能力较弱。nirK型反硝化细菌丰富度范围为244.14-449.25, 其丰富度的平均值为(367.36± 93.24), 比nirS型反硝化细菌(408.89±40.66)低, 这与Jiang等(2017)研究长江沉积物中反硝化细菌的结果一致。Shannon指数分析表明, nirK型反硝化细菌的群落多样性在位于宝钢排污口的Z21站位最大, 而在位于东头山岛旁的Z06站位最小, 这可能揭示了nirK型反硝化细菌群落耐污染能力较强, 这与nirS型反硝化细菌相反, 且两者在四个月份的基因平均丰度也表明, Z21站位的nirK高于nirS型反硝化细菌。nirK型反硝化细菌Shannon指数的平均值(4.32±0.49)稍低于nirS型反硝化细菌(4.43±0.37), 这与前人研究结果基本一致, 如长江沉积物(Jiang et al, 2017)、湖泊沉积物(Saarenheimo et al, 2015)。本研究中nirS的Shannon指数比长江沉积物(Zheng et al, 2015; Jiang et al, 2017)、Chesapeake海湾沉积物(Francis et al, 2013)高。nosZ丰富度范围为405.50~569.95, 其结果大小为Z15>Z17>Z21>Z06>Z24, 可以看出nosZ与nirS丰富度的变化趋势相同, 且其群落多样性在Z15最大, Z21最小, 这与nirS型反硝化细菌的群落多样性变化一致。而对于厌氧氨氧化细菌而言, 其群落丰富度远低于反硝化细菌, Chao1指数的平均值仅为49.84± 4.32, 在东头山岛旁的Z06站位最大, 而在火电厂旁的Z24站位最小; 其Shannon指数的平均值为1.56± 0.56, 且群落多样性在湾口附近的Z21站位最大, 在内湾的Z24站位最小, 且厌氧氨氧化细菌四个月份的平均丰度在位于火电厂旁的Z24站位较之其他站位低了一个数量级, 靠近湾口的Z18站位丰度最高, 且湾口其他站位的丰度均较高于湾内, 说明湛江湾厌氧氨氧化细菌呈现出从湾口向湾内逐渐递减的趋势。厌氧氨氧化细菌群落多样性明显低于反硝化细菌, 这与Li等(2013)对于中国南海表层沉积物中nirS型反硝化细菌和厌氧氨氧化细菌的研究结果一致。
通过分析反硝化细菌的nirS、nirK、nosZ基因的进化树(图 3-5), 发现在nirS基因进化树中, ClusterⅠ中的OTUs跟许多栖息地中得到的序列有很高的相似性, 包括来自河口、水产养殖区、富营养化的海湾的沉积物。ClusterⅠ中的这些OTUs遍及于诸多海域的沉积物中, 如胶州湾(Dang et al, 2009), 说明这些nirS型反硝化细菌在海洋中是广泛分布的。在ClusterⅡ中, OTU14和OTU17与九龙江和闽江、珠江口富营养化的河口沉积物中得到的序列有着很高的亲缘关系, 说明这两类反硝化细菌对盐度的适应能力很强, 在淡水和海水中都有存在, 这也从一定程度说明盐度影响了某些nirS型反硝化细菌的群落结构, 这也符合Mosier等(2010)在旧金山海湾河口的研究结果。同时本文发现nirS中包含的OTUs序列大多数与来自河口区域的序列有很高的相似性, 如珠江口、九龙江河口、墨西哥河口、长江河口等流域。对于nirK基因, 其系统进化树分为5个Cluster, 其中ClusterⅡ只包含OTU12, 它与黄河河口沉积物、Fenghua垃圾填埋场、湿地土壤获得的序列有着较高同源性, 说明该类nirK型反硝化细菌在陆地和海洋广泛分布, 且其对环境污染的适应能力很强。ClusterⅢ包含三个OTUs, 分别是OTU18、OTU6、OTU10, 它们间的相似性为96%-97%, 与旧金山河口沉积物(Mosier et al, 2010)中所获得的序列有着一定的相似性(84%- 87%)。ClusterⅣ也只包含三个OTUs, 分别为OTU13、OTU3、OTU7, 它们与旧金山河口沉积物(Mosier et al, 2010)获得的序列有一定的同源性(85%)。本研究发现在ClusterⅤ中包含4个OTUs, 它们只与湿地土壤获得的序列有着很高的相似性(96%-100%), 说明这几类nirK型反硝化细菌之前在海洋里还未曾被发现, 是一类新奇的海洋nirK型反硝化细菌。对于nosZ基因, 其系统进化树结果表明, nosZ型反硝化细菌主要属于Alpha-proteobacteria, 这与Castellano-Hinojosa等(2017)在地中海区域的高山湖的研究结果一致。在ClusterⅠ中的9个OTUs与来自不同环境里得到的序列有一定的亲缘关系, 包括海洋沉积物、红树林湿地土壤、近海岸沉积物等, 说明这些nosZ型反硝化细菌存在于不同的生境中。Cluster Ⅲ中只包含OTU2、OTU41, 且它们只与从莱州湾沉积物中得到的序列有高亲缘关系, 说明这两类nosZ型反硝化细菌之前可能只存在于莱州湾海域, 本研究在湛江湾海域可能目前尚属于第二次发现这两类反硝化细菌。Cluster Ⅳ只有OTU7, 它与从湿地、草原土壤, 及鄱阳湖沉积物中得到的序列有一定同源性, 说明该类nosZ型反硝化细菌之前只在陆地和淡水区域有发现, 本研究可能是首次在海洋里发现这类反硝化细菌。
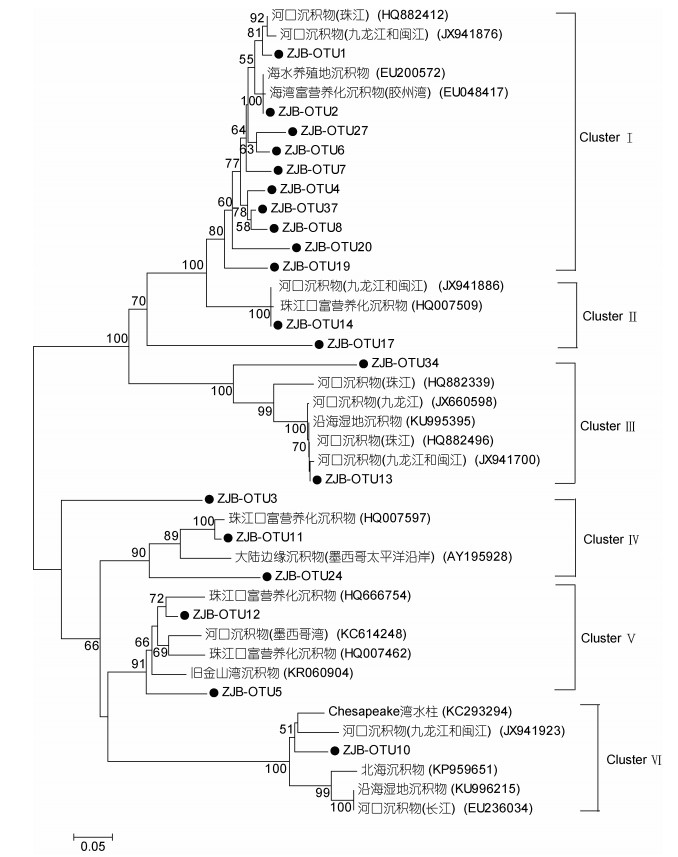 |
| 图 3 基于反硝化细菌nirS序列构建的NJ系统进化树(自展1000次验证节点置信度) Fig. 3 Neighbor-joining phylogenetic tree based on denitrifying bacteria nirS sequence (Bootstrap values were calculated using 1000 replications) 注:在分支点处只显示超过50%的自举值, 本研究的序列用黑色实心圆圈表示, 比例尺表示核苷酸取代百分比。 |
 |
| 图 4 基于反硝化细菌nirK序列构建的NJ系统进化树(自展1000次验证节点置信度) Fig. 4 Neighbor-joining phylogenetic tree based on denitrifying bacteria nirK sequence (Bootstrap values were calculated using 1000 replications) 注:在分支点处只显示超过50%的自举值, 本研究的序列用黑色实心圆圈表示, 比例尺表示核苷酸取代百分比。 |
 |
| 图 5 基于反硝化细菌nosZ序列构建的NJ系统进化树(自展1000次验证节点置信度) Fig. 5 Neighbor-joining phylogenetic tree based on denitrifying bacteria nosZ sequence (Bootstrap values were calculated using 1000 replications) 注:在分支点处只显示超过50%的自举值, 本研究的序列用黑色实心圆圈表示, 比例尺表示核苷酸取代百分比。 |
对于厌氧氨氧化细菌而言, 其进化树主要分析了由沉积物样品中扩增的厌氧氨氧化16SrRNA基因, 一个以“Candidatus Scalindua”(图 6)为主的厌氧氨氧化群落。其进化树结果表明, 湛江湾地区的厌氧氨氧化细菌主要属于Candidatus Scalindua sp., 以及浮霉菌门(planctomycetes), 这跟一些科学家以前在其他不同环境中的研究结果一致(Dang et al, 2010; Li et al, 2013), 且它们具有较高的耐盐性, 存在于许多生境中, 如一些上升流水柱的低氧区和一些次低氧水体中(Schubert et al, 2006; Schmid et al, 2007)。Cluster Ⅲ包括7个OTUs, 且OTU10、OTU11、OTU13、OTU15均未在NCBI数据库里找到与之相匹配的的序列, 说明在湛江湾沉积物中栖息着一些还未曾被发现的新奇的厌氧氨氧化细菌。
 |
| 图 6 基于厌氧氨氧化细菌Ca.scalindua16SrRNA序列构建的NJ系统进化树(自展1000次验证节点置信度) Fig. 6 Neighbor-joining phylogenetic tree based on anammox bacteria Ca.scalindua16SrRNA sequence (Bootstrap values were calculated using 1000 replications) 注:在分支点处只显示超过50%的自举值, 本研究的序列用黑色实心圆圈表示, 比例尺表示核苷酸取代百分比。 |
本研究发现, 在热带海湾反硝化细菌与厌氧氨氧化细菌之间存在特殊的竞争与共存的关系, 即当亚硝酸盐浓度较低时, 反硝化和厌氧氨氧化细菌丰度均比其他月份高, 且相关性分析结果表明亚硝酸盐与nirS/Ca.scalindua16SrRNA丰度比值呈显著负相关性, 说明两者对亚硝酸盐可能存在竞争作用; 而四个月份的nirS型反硝化细菌与氨氧氨氧化细菌丰度呈显著正相关性, 说明两者可能同时存在共存的关系, 且CCA分析结果表明, 硝酸盐可能影响反硝化和厌氧氨氧化细菌群落结构。系统进化分析结果表明在湛江湾海域栖息着一些新型的反硝化细菌和厌氧氨氧化细菌, 这对于深入认识人类活动影响下的热带海湾中的反硝化和厌氧氨氧化细菌有着重要的意义。
施玉珍, 张瑜斌, 孙省利. 2015. 湛江湾富营养化分布特征及与环境因子的关系. 环境科学与技术, 38(12): 90-96, 122 |
袁旗, 许振勇, 彭华强, 等. 2016. 湛江湾及其附近海域近5年海水中氮、磷变化趋势研究. 绿色科技, (24): 41-45 |
鲍士旦. 2008. 土壤农化分析. 3版. 北京: 中国农业出版社, 50-56
|
Castellano-Hinojosa A, Correa-Galeote D, Carrillo P et al, 2017. Denitrification and biodiversity of denitrifiers in a high- mountain Mediterranean Lake. Frontiers in Microbiology, 8: 1911 DOI:10.3389/fmicb.2017.01911 |
Choi A, Cho H, Kim S H et al, 2016. Rates of N2 production and diversity and abundance of functional genes associated with denitrification and anaerobic ammonium oxidation in the sediment of the Amundsen Sea Polynya, Antarctica. Deep Sea Research Part Ⅱ: Topical Studies in Oceanography, 123: 113-125 DOI:10.1016/j.dsr2.2015.07.016 |
Dang H Y, Chen R P, Wang L et al, 2010. Environmental factors shape sediment anammox bacterial communities in hypernutrified Jiaozhou Bay, China. Applied and Environmental Microbiology, 76(21): 7036-7047 DOI:10.1128/AEM.01264-10 |
Dang H Y, Wang C Y, Li J et al, 2009. Diversity and distribution of sediment nirS-encoding bacterial assemblages in response to environmental gradients in the eutrophied Jiaozhou Bay, China. Microbial Ecology, 58(1): 161-169 DOI:10.1007/s00248-008-9469-5 |
Du R, Cao S B, Li B K et al, 2017. Performance and microbial community analysis of a novel DEAMOX based on partial- denitrification and anammox treating ammonia and nitrate wastewaters. Water Research, 108: 46-56 DOI:10.1016/j.watres.2016.10.051 |
Francis C A, O'Mullan G D, Cornwell J C et al, 2013. Transitions in nirS-type denitrifier diversity, community composition, and biogeochemical activity along the Chesapeake Bay estuary. Frontiers in Microbiology, 4: 237 |
Henry S, Baudoin E, López-Gutiérrez J C et al, 2004. Quantification of denitrifying bacteria in soils by nirK gene targeted real-time PCR. Journal of Microbiological Methods, 59(3): 327-335 DOI:10.1016/j.mimet.2004.07.002 |
Henry S, Bru D, Stres B et al, 2006. Quantitative detection of the nosZ Gene, encoding nitrous oxide reductase, and comparison of the abundances of 16S rRNA, narG, nirK, and nosZ genes in soils. Applied and Environmental Microbiology, 72(8): 5181-5189 DOI:10.1128/AEM.00231-06 |
Hong Y G, Xu X R, Kan J J et al, 2014. Linking seasonal inorganic nitrogen shift to the dynamics of microbial communities in the Chesapeake Bay. Applied Microbiology and Biotechnology, 98(7): 3219-3229 DOI:10.1007/s00253-013-5337-4 |
Jetten M S M, van Niftrik L, Strous M et al, 2009. Biochemistry and molecular biology of anammox bacteria. Critical Reviews in Biochemistry and Molecular Biology, 44(2-3): 65-84 DOI:10.1080/10409230902722783 |
Jiang X L, Yao L, Guo L D et al, 2017. Multi-scale factors affecting composition, diversity, and abundance of sediment denitrifying microorganisms in Yangtze lakes. Applied Microbiology and Biotechnology, 101(21): 8015-8027 DOI:10.1007/s00253-017-8537-5 |
Kim H, Bae H S, Reddy K R et al, 2016. Distributions, abundances and activities of microbes associated with the nitrogen cycle in riparian and stream sediments of a river tributary. Water Research, 106: 51-61 DOI:10.1016/j.watres.2016.09.048 |
Klein D, 2002. Quantification using real-time PCR technology: applications and limitations. Trends in Molecular Medicine, 8(6): 257-260 DOI:10.1016/S1471-4914(02)02355-9 |
Lee J A, Francis C A, 2017. Spatiotemporal characterization of San Francisco bay denitrifying communities: a comparison of nirK and nirS diversity and abundance. Microbial Ecology, 73(2): 271-284 DOI:10.1007/s00248-016-0865-y |
Lefebvre S, Marmonier P, Peiry J L, 2006. Nitrogen dynamics in rural streams: differences between geomorphologic units. Annales de Limnologie - International Journal of Limnology, 42(1): 43-52 DOI:10.1051/limn/2006005 |
Li F E, Li M C, Shi W C et al, 2017. Distinct distribution patterns of proteobacterial nirK-and nirS-type denitrifiers in the Yellow River estuary, China. Canadian Journal of Microbiology, 63(8): 708-718 DOI:10.1139/cjm-2017-0053 |
Li J, Qiang Z M, Yu D S et al, 2016. Performance and microbial community of simultaneous anammox and denitrification (SAD) process in a sequencing batch reactor. Bioresource Technology, 218: 1064-1072 DOI:10.1016/j.biortech.2016.07.081 |
Li M, Hong Y G, Cao H L et al, 2013. Community structures and distribution of anaerobic ammonium oxidizing and nirS- encoding nitrite-reducing bacteria in surface sediments of the South China Sea. Microbial Ecology, 66(2): 281-296 DOI:10.1007/s00248-012-0175-y |
Meng H, Wang Y F, Chan H W et al, 2016. Co-occurrence of nitrite- dependent anaerobic ammonium and methane oxidation processes in subtropical acidic forest soils. Applied Microbiology and Biotechnology, 100(17): 7727-7739 DOI:10.1007/s00253-016-7585-6 |
Mosier A C, Francis C A, 2010. Denitrifier abundance and activity across the San Francisco Bay estuary. Environmental Microbiology Reports, 2(5): 667-676 DOI:10.1111/j.1758-2229.2010.00156.x |
Oshiki M, Satoh H, Okabe S, 2016. Ecology and physiology of anaerobic ammonium oxidizing bacteria. Environmental Microbiology, 18(9): 2784-2796 DOI:10.1111/1462-2920.13134 |
Penton C R, Devol A H, Tiedje J M, 2006. Molecular evidence for the broad distribution of anaerobic ammonium-oxidizing bacteria in freshwater and marine sediments. Applied and Environmental Microbiology, 72(10): 6829-6832 DOI:10.1128/AEM.01254-06 |
Saarenheimo J, Tiirola M A, Rissanen A J, 2015. Functional gene pyrosequencing reveals core proteobacterial denitrifiers in boreal lakes. Frontiers in Microbiology, 6: 674 |
Schmid M C, Hooper A B, Klotz M G et al, 2008. Environmental detection of octahaem cytochrome c hydroxylamine/hydrazine oxidoreductase genes of aerobic and anaerobic ammonium- oxidizing bacteria. Environmental Microbiology, 10(11): 3140-3149 DOI:10.1111/j.1462-2920.2008.01732.x |
Schmid M C, Risgaard-Petersen N, van de Vossenberg J et al, 2007. Anaerobic ammonium-oxidizing bacteria in marine environments: widespread occurrence but low diversity. Environmental Microbiology, 9(6): 1476-1484 DOI:10.1111/j.1462-2920.2007.01266.x |
Schubert C J, Durisch-Kaiser E, Wehrli B et al, 2006. Anaerobic ammonium oxidation in a tropical freshwater system (Lake Tanganyika). Environmental Microbiology, 8(10): 1857-1863 DOI:10.1111/j.1462-2920.2006.01074.x |
Senga Y, Okumura M, Seike Y, 2010. Seasonal and spatial variation in the denitrifying activity in estuarine and lagoonal sediments. Journal of Oceanography, 66(1): 155-160 DOI:10.1007/s10872-010-0013-0 |
Smith J M, Mosier A C, Francis C A, 2015. Spatiotemporal relationships between the abundance, distribution, and potential activities of ammonia-oxidizing and denitrifying microorganisms in intertidal sediments. Microbial Ecology, 69(1): 13-24 DOI:10.1007/s00248-014-0450-1 |
Strous M, Fuerst J A, Kramer E H M et al, 1999. Missing lithotroph identified as new planctomycete. Nature, 400(6743): 446-449 DOI:10.1038/22749 |
Thamdrup B, 2012. New pathways and processes in the global nitrogen cycle. Annual Review of Ecology, Evolution, and Systematics, 43: 407-428 DOI:10.1146/annurev-ecolsys-102710-145048 |
Thamdrup B, Dalsgaard T, 2002. Production of N2 through anaerobic ammonium oxidation coupled to nitrate reduction in marine sediments. Applied and Environmental Microbiology, 68(3): 1312-1318 DOI:10.1128/AEM.68.3.1312-1318.2002 |
Throbäck I N, Enwall K, Jarvis Å et al, 2004. Reassessing PCR primers targeting nirS, nirK and nosZ genes for community surveys of denitrifying bacteria with DGGE. FEMS Microbiology Ecology, 49(3): 401-417 DOI:10.1016/j.femsec.2004.04.011 |
Wang L P, Liu L S, Zheng B H et al, 2013. Analysis of the bacterial community in the two typical intertidal sediments of Bohai Bay, China by pyrosequencing. Marine Pollution Bulletin, 72(1): 181-187 DOI:10.1016/j.marpolbul.2013.04.005 |
Wang L P, Zheng B H, Nan B X et al, 2014. Diversity of bacterial community and detection of nirS- and nirK- encoding denitrifying bacteria in sandy intertidal sediments along Laizhou Bay of Bohai Sea, China. Marine Pollution Bulletin, 88(1-2): 215-223 DOI:10.1016/j.marpolbul.2014.09.002 |
Wang Y, Zhu G B, Harhangi H R et al, 2012. Co-occurrence and distribution of nitrite-dependent anaerobic ammonium and methane-oxidizing bacteria in a paddy soil. FEMS Microbiology Letters, 336(2): 79-88 DOI:10.1111/j.1574-6968.2012.02654.x |
Wenk C B, Blees J, Zopfi J et al, 2013. Anaerobic ammonium oxidation (anammox) bacteria and sulfide-dependent denitrifiers coexist in the water column of a meromictic south-alpine lake. Limnology and Oceanography, 58(1): 1-12 DOI:10.4319/lo.2013.58.1.0001 |
Zheng Y L, Hou L J, Liu M et al, 2015. Diversity, abundance, and distribution of nirS-harboring denitrifiers in intertidal sediments of the Yangtze Estuary. Microbial Ecology, 70(1): 30-40 DOI:10.1007/s00248-015-0567-x |
 2020, Vol. 51
2020, Vol. 51


