中国海洋湖沼学会主办。
文章信息
- 薛泽, 朱丽岩, 王博渊, 刘正宇. 2020.
- XUE Ze, ZHU Li-Yan, WANG Bo-Yuan, LIU Zheng-Yu. 2020.
- 温度和盐度对两种海洋桡足类动物摄食和代谢的影响
- EFFECTS OF TEMPERATURE AND SALINITY ON FEEDING AND METABOLISM OF TWO MARINE COPEPODS
- 海洋与湖沼, 51(1): 95-102
- Oceanologia et Limnologia Sinica, 51(1): 95-102.
- http://dx.doi.org/10.11693/hyhz20190700137
文章历史
-
收稿日期:2019-07-11
收修改稿日期:2019-09-20
海洋桡足类属于节肢动物门(Arthropoda)、甲壳动物亚门(Crustacea)、桡足纲(Copepoda)。桡足类在海洋生态系统中占据着独特的生态位(Kovatch et al, 1999), 对维持海洋生态系统平衡和稳定起着重要作用。海洋桡足类营养丰富, 富含促进海洋鱼虾生长发育的EPA和DHA等高不饱和脂肪酸, 是水产养殖中的优质饵料, 哲水蚤目、剑水蚤目和猛水蚤目的水蚤均适合作为海洋鱼虾的活体饵料(魏玉昌, 1987; Drillet et al, 2011)。
但目前对于海洋桡足类生物的培养存在瓶颈, 难以实现多世代、连续化培养的技术要求, 因此不能达到作为饵料生物的规模化生产的目标, 而海洋桡足类培养的关键在于建立适宜条件。不同种的海洋桡足类生物、甚至同一种在不同发育阶段对环境条件及饵料的需求都存在差异。
温度与盐度是海洋中重要的生态因子, 不仅能够决定浮游生物群落的多样性水平、组成以及分布, 而且对于浮游动物的生理与生殖过程影响都比较大。有研究报道, 相同适温条件下不同海洋桡足类、甚至不同适温条件下的同种桡足类生物的热耐受能力均存在差异(廖一波等, 2008)。温度的变化也会显著影响水域中桡足类优势种, 卜亚谦等(2019)研究发现, 夏冬两季在渤海、北黄海均出现的优势种为:中华哲水蚤、小拟哲水蚤、拟长腹剑水蚤、强壮箭虫、桡足类无节幼虫和桡足幼体。李光福(2015)发现温度与盐度变化对桡足类的生殖过程影响明显, 能显著影响指状伪镖水蚤(Pseudodiaptomus inopinus)的孵化率和孵化时间。于娟等(2012)的研究结果表明, 温度变化会显著影响中华哲水蚤(Calanus sinisus)和猛水蚤(Harcapticus sp.)的摄食及排粪, 说明其代谢过程也随温度变化而变化。蔡泽富等(2011)的现场围隔研究表明即使0.52℃的温升也会显著提高浮游生态系统代谢速率。另外, 温度还可通过影响水体运动而间接影响浮游动物的移动(Eisner et al, 2014)。另一方面, 作为水产养殖中的重要环境因子, 盐度与动物的生长发育和繁殖有密切的关系。盐度小于15或大于35时有明显抑制Pseudodiaptomus pelagicus幼体和成体的存活率, 且对于成体的抱卵间隔和卵囊大小也有显著影响(Ohs et al, 2010)。盐度对于海洋桡足类的摄食作用也具有显著影响, 不同种类对于盐度变化具有不同的生态幅与最适盐度范围(于娟等, 2012)。Michalec等(2012)报道了盐度变化与Pseudodiaptomus annandalei运动抑制之间的关系, 发现一定范围内的盐度升高能有效抑制其雌体与雄体的运动性。盐度变化还能影响桡足类体内大分子物质的合成, 从而影响其代谢与能量分配(Lindley et al, 2011)。
哲水蚤目(Calanoida)的火腿许水蚤(Schmackeria poplesia)与剑水蚤目(Cyclopoida)的拟长腹剑水蚤(Oithona similis)是我国近海两种重要的桡足类动物。二者的生态幅存在较大差异:前者常分布在沿海半咸水中, 为河口低盐种, 室内研究表明其对盐度的适应范围为0—20 (黄加祺等, 1998), 能够在长江口盐度低于10的区域为优势种(纪焕红等, 2006)。在2001—2003年对长江口邻近水域的调查发现, 火腿许水蚤常出现在沿岸半咸水体中(徐兆礼等, 2005), 并能在5—8月成为优势种, 但分布范围狭小。拟长腹剑水蚤是广温广盐种, 对温度和盐度的适应范围较广, 在我国的黄海渤海都有较多的分布, 是胶州湾小型浮游动物中的优势种(朱丽岩等, 2009)。事实上, 拟长腹剑水蚤在较广的纬度范围和季节跨度都有分布, 且食性较广, 对环境胁迫具有较强的耐受性(Castellani et al, 2005)。故本实验以火腿许水蚤与拟长腹剑水蚤(Oithona similis)为目标生物, 在实验生态条件下研究温度与盐度的变化对其摄食与代谢的影响, 比较二者最适培养条件的差异, 并对可能的原因进行探讨。研究将为阐明不同桡足类生物对环境变化的适应机制提供基础的研究资料, 为其室内连续培养技术提供理论支持。
1 材料与方法 1.1 目标生物的驯化培养两种海洋桡足类生物:火腿许水蚤(S. poplesia)与拟长腹剑水蚤(O. similis)均采自山东青岛潮海虾池, 用浅水Ⅱ型浮游生物网采集后在2h内返回实验室。用筛绢滤去较大杂质, 在解剖镜下挑取活泼、健康、趋光性强的个体, 于2L烧杯中驯化3—5d, 光照培养箱中培养, 驯化温度5—10℃, 盐度30, 光强14μmol/(m2·s), 光照比L︰D=12h︰12h。每天定时投喂饵料, 火腿许水蚤所用饵料混合比例为:金藻︰小球藻︰三角褐脂藻=3︰1︰1, 拟长腹剑水蚤所用饵料混合比例为:金藻︰海链藻︰青岛大扁藻=3︰1︰1, 初始混合饵料生物量控制在约104cells/mL。培养及实验过程中所需的海水及饵料单胞藻的培养条件根据方宽等(2013)制定。驯化后, 用滴管挑取活泼且完整的挂卵雌体移至1L烧杯中, 培养温度逐渐升至15℃。每隔一天收集无节幼虫, 用100目筛绢过滤后获得子代个体进行培养, 每天投喂密度为1×104cells/mL的金藻, 其他培养条件同驯化条件。待无节幼虫发育至成体后进行后续环境因子的影响实验。
1.2 实验体系的构建研究温度与盐度变化对两种海洋桡足类动物摄食与代谢的影响。实验中只改变体系中的温度或盐度条件, 其他培养条件同驯化条件。
(1) 温度实验:在预实验的基础上分别设定温度梯度, 火腿许水蚤为(10±0.5)、(15±0.5)、(20±0.5)和(25±0.5)℃; 拟长腹剑水蚤为: (5±0.5)、(10±0.5)、(15±0.5)、(20±0.5)、(25±0.5)和(30±0.5)℃。
(2) 盐度实验:分别设置5个盐度梯度: 15、20、25、30、35。用盐度为30的过滤海水配置各个盐度梯度的海水, 盐度低于30的海水通过添加蒸馏水配制, 盐度为35的海水通过加入固体海水盐配制, 所有经过配制海水均经过0.22μm膜过滤。
1.2.1 对摄食率与滤水率的影响用摄食率与滤水率的变化表征两种桡足类动物摄食作用的变化。挑选未挂卵的成体在盛有过滤海水的烧杯中驯化5天, 每48h用虹吸法去除烧杯表面和底部的杂质, 将液体表面和底部的过剩食物、死亡个体和粪团等清除干净, 其他驯化条件同1.1所述。驯化5d后进行摄食率与滤水率实验。用胶头滴管吸取50—70只健康活泼的两种桡足类个体置于含有80mL过滤海水的100mL烧杯中, 饥饿24h后进行摄食实验。
用胶头滴管分别取10只经过饥饿处理的目标生物放入盛有80mL过滤海水的烧杯中, 然后分别暴露于不同的温度与盐度条件下。向所有处理组添加金藻原液, 使得藻细胞密度控制在104cells/mL, 每处理组设2个平行。实验以不投加水蚤的一组为对照组。用黑色塑料袋包裹处理组和对照组的烧杯, 将其置于黑暗的培养箱中, 每隔2h晃动一次, 尽量避免藻细胞沉降。24h后, 取各烧杯溶液于1.5mL PE管中, 鲁哥氏碘液固定, 血球计数板在显微镜下计数, 饵料浓度差减法计算摄食率(G, grazing rate)和滤水率(F, filtering rate)(Frost, 1972)。

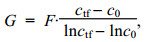
式中, V为试验溶液的体积; N为每个实验烧杯中轮虫个体数(ind.); c0为起始饵料密度(×104cells/mL); ct为对照组中最终饵料密度(×104cells/mL); ctf为实验组中最终饵料密度(×104cells/mL); t为实验组中最终饵料密度(×104cells/mL)。
1.2.2 对耗氧率、排氨率和氧氮比的影响用耗氧率与排氨率的变化表征两种桡足类动物代谢作用的变化。将装有重过滤海水的碘量置于不同的温度、盐度实验条件下。挑取各个温度下驯化的健康活泼, 不挂卵的火腿许水蚤成体10只, 加入碘量瓶后用重过滤海水补充满, 密封瓶口后, 置于黑暗的恒温培养箱中进行耗氧实验。24h后用100目筛绢滤除水蚤后用以耗氧率与排氨率的研究:一部分根据碘量瓶中溶解氧含量的变化分析耗氧率的变化, 另一部分用靛酚蓝分光光度法测定水样中的氨浓度变化以确定排氨率的变化(徐兆礼等, 2005)。氧氮比(O/N)即为耗氧率与排氨率之比。
1.3 统计分析Sigmaplot10.0作图, 各指标以平均值±标准差(mean±SD)表示; 数据统计分析用IBM SPSS Statistics 19中的one-way ANOVA及独立样本T检验进行, 其中显著性水平设置为0.05, P < 0.05即认为差异显著, P < 0.01认为差异极显著。
2 结果与分析 2.1 环境因子变化对两种桡足类生物摄食的影响 2.1.1 温度对摄食的影响在10—25℃的温度范围内, 随着温度的升高, 火腿许水蚤的摄食率与滤水率均呈现先升高后降低的趋势, 在15℃时达到最大值, 显著高于其他各温度处理组(P < 0.05);之后逐渐下降, 在25℃降至最低(图 1a)。拟长腹剑水蚤在不同温度条件下摄食作用的变化不同与火腿许水蚤:在5—25℃的温度范围内摄食率与滤水率保持持续上升, 并在25℃达到峰值; 温度升至30℃时略有下降(P > 0.05), 但仍保持较高的水平(图 1b)。
 |
| 图 1 温度对火腿许水蚤(a)及拟长腹剑水蚤(b)摄食率和滤水率的影响 Fig. 1 Effect of temperature on grazing rate and filtering rate of S. poplesia (a) and O.similis (b) |
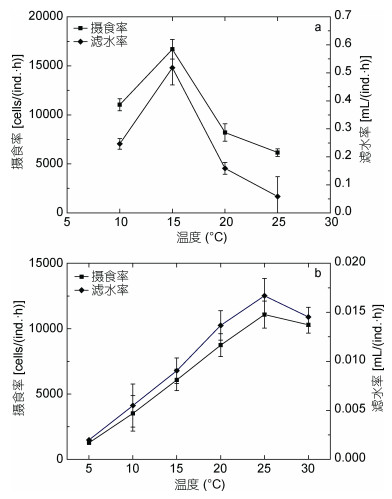
在实验盐度范围内, 火腿许水蚤摄食率和滤水率随盐度的升高呈现先升高后降低的趋势, 但各盐度之间无显著差异(P > 0.05);盐度25时摄食最为旺盛, 盐度上升至30时滤水率和摄食率反而有所下降(图 2a)。拟长腹剑水蚤摄食作用对盐度的耐受性强于火腿许水蚤。在实验的盐度范围内(15—35)其摄食率和滤水率表现为先抑后扬的变化趋势:在15—25的范围内随着盐度的升高而升高, 并于盐度25时达到峰值, 之后逐渐下降。研究结果表明, 拟长腹剑水蚤的摄食能力在25—30的盐度区间保持稳定, 超过这一范围, 摄食能力开始大幅降低。
 |
| 图 2 盐度对火腿许水蚤(a)及拟长腹剑水蚤(b)摄食率和滤水率的影响 Fig. 2 Effect of salinity on grazing rate and filtering rate of S. poplesia (a) and O.similis (b) |
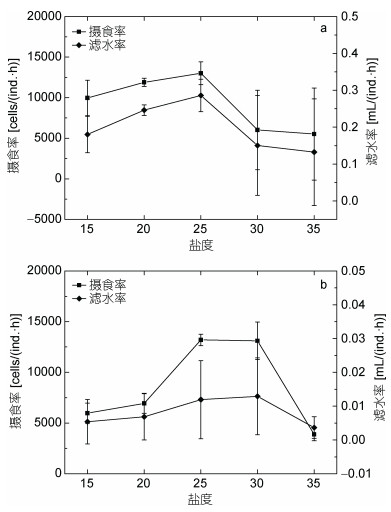
如图 3所示, 在实验温度范围内(5—20℃), 火腿许水蚤的耗氧率呈现先上升后降低的趋势, 15℃时达到最高点后逐渐下降; 排氨率的变化与耗氧率类似, 在5—20℃范围内逐渐上升至峰值, 然后逐渐下降, 至30℃时降至最低, 呈现“倒钟形”变化。拟长腹剑水蚤耗氧率与排氨率的变化趋势均与火腿许水蚤不同。前者耗氧率在5—25℃范围内随着温度升高而不断增大, 在25℃达到最大值, 之后稍有下降(P > 0.05);其中有两个温度范围: 10— 15℃与20—25℃的耗氧率增加显著(P < 0.05)。其排氨率随温度升高而缓慢增加, 在20℃时达到峰值, 之后随着温度继续升高逐渐下降, 至30℃时降至最低。
 |
| 图 3 温度对火腿许水蚤(a)及拟长腹剑水蚤(b)代谢的影响 Fig. 3 Effect of temperature on oxygen consumption, ammonia excretion rate, and O/N ratio of S. poplesia (a) and O. similis (b) |
火腿许水蚤氧氮比随温度升高而先升高再降低, 于15℃时达到峰值。而拟长腹剑水蚤的氧氮比随温度升高而不断升高, 较之于前者在低于25℃的温度区间变化平缓, 只在30℃时有极显著的增高(P < 0.01)。
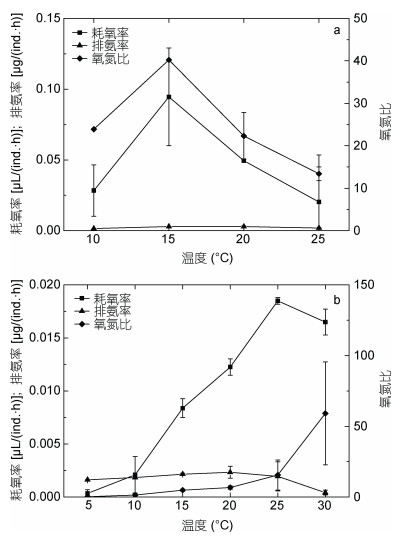
2.2.2 盐度对代谢的影响如图 4所示, 盐度范围为15—25时, 火腿许水蚤的耗氧率随着盐度的增加不断上升, 至盐度25时达到最高; 但继续升高至35时, 耗氧率显著降低(P < 0.05)。拟长腹剑水蚤的耗氧率随着盐度升高不断降低, 盐度为30时降至最低点。在实验的盐度范围内, 两种海洋桡足类的氧氮比都有着先升高后降低的趋势。拟长腹剑水蚤O/N在9— 18之间变化, 峰值17.7出现在盐度为35时; 火腿许水蚤O/N的变化范围为32—95, 在盐度为20时达到最大值。
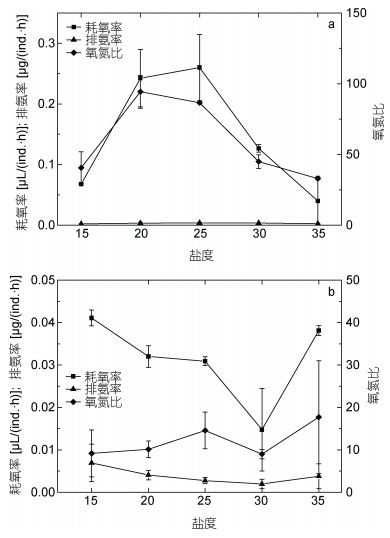 |
| 图 4 盐度对火腿许水蚤(a)及拟长腹剑水蚤(b)代谢的影响 Fig. 4 Effect of salinity on oxygen consumption, ammonia excretion rate and O/N ratio of S. poplesia (a) and O.similis (b) |
排氨率数据显示, 在盐度范围为15—30时拟长腹剑水蚤的排氨率随着盐度的增高不断下降, 盐度升至35时反而有所增加, 且显著高于盐度30时的排氨率(P < 0.05);火腿许水蚤随着盐度的升高而先升高后降低, 且相较差异不显著(P > 0.05)。结果说明, 拟长腹剑水蚤在盐度为30时氨氮代谢水平最低, 而火腿许水蚤在盐度为15和35时氨氮代谢较低。
3 讨论 3.1 对温度的响应差异与途径本研究结果表明, 温度变化对拟长腹剑水蚤摄食作用的影响较小, 但对火腿许水蚤的影响较大, 尤其低温条件的影响更显著。温度对二者的代谢作用也表现出明显的种间差异:随着温度的增加, 拟长腹剑水蚤稳定在较高的耗氧率水平, 火腿许水蚤持续较低的耗氧水平。我们尝试对这种变化趋势做进一步分析。
箱线图(Box-and-Whisker)是一种重要的探索性数据分析工具, 不仅能够反映原始数据位置与分散情况, 而且能直观反映某一因子在变化当中的作用, 其中下四分位线(Q1)与上四分位线(Q3)之间的四分位距及其与中位数之间的距离能清晰表明因子对结果分布的影响。本研究基于箱式图的分析显示(图 5), 温度变化对火腿许水蚤的耗氧率与排氨率的四分位距(Q1—Q3)较拟长腹剑水蚤大, 同时中位线更明显地偏向于Q1, 大约有75%的数据分布偏向于高耗氧率, 说明随着温度的增加火腿许水蚤稳定在较高的耗氧率水平, 且较高的呼吸率与排氨率也反映出较高的代谢潜力。拟长腹剑水蚤的耗氧率数据分布均匀, 四分位距明显小于火腿许水蚤, 且中位数基本位于Q1— Q3中部, 说明在整个温度变化过程中拟长腹剑水蚤的代谢水平变化不大。用二者的耗氧率与排氨率比例分析其在不同温度条件下的响应差异, 发现在10℃时, 火腿许水蚤与拟长腹剑水蚤的耗氧率与排氨率之比约分别为100︰7与91︰100;在20℃时, 两者排氨率均达到峰值, 同时耗氧率与排氨率之比降至100︰91与100︰81, 说明随着温度的持续升高, 二者的呼吸率差异逐渐减小, 且二者的氨氮代谢差异主要在15—20℃的温度区间。结果表明, 两种桡足类生物可通过不同代谢途径响应环境温度的变化。
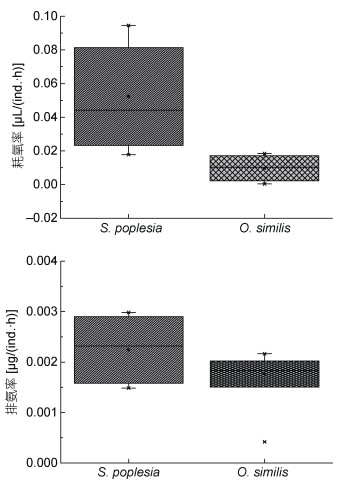 |
| 图 5 温度对火腿许水蚤及拟长腹剑水蚤代谢影响的箱线图分析 Fig. 5 Effect of temperature on oxygen consumption and ammonia excretion rate of S. poplesia and O.similis analyzed in Box-and-Whisker chart |
O/N比能够反映生物机体对能源物质代谢和利用的宏观指标, 通常来说, 当O/N在24左右时生物对脂肪和蛋白质的利用处于一个平衡的状态; O/N > 24时生物偏好利用脂肪类物质, O/N < 24时说明生物利用蛋白类物质的能力增强(Mayzaud et al, 1988)。本研究中, 火腿许水蚤O/N在整个温度范围内的变化不大, 比值在13—40之间波动, 低于24的居多, 说明其主要依靠消耗蛋白质和碳水化合物供能以响应温度的变化, 而拟长腹剑水蚤的O/N仅在30℃时高于24, 说明其对高温的响应主要通过消耗碳水化合物完成。
研究结果说明随温度升高火腿许水蚤耗氧率虽然降低但也保持较高水平, 反映其有较高的代谢潜力, 而拟长腹剑水蚤耗氧水平随温度升高而稳步提升, 与火腿许水蚤差异逐渐减弱。相较于排氨率, 拟长腹剑水蚤能在较大的温度范围内保持稳定的氨氮代谢水平, 说明拟长腹剑水蚤对温度的耐受性更强。
3.2 对盐度的响应差异及途径与对照组相比, 较高的盐度水平(30—35)能显著降低火腿许水蚤和拟长腹剑水蚤的摄食率及滤水率(P < 0.05), 说明其摄食能力收到明显抑制, 且两者的最适盐度分别为25及30。基于箱式图的分析结果显示(图 6), 在整个盐度范围中火腿许水蚤保持较高耗氧水平, 其耗氧率四分位距(Q1—Q3)较拟长腹剑水蚤大, 但盐度35会显著抑制其耗氧率。拟长腹剑水蚤50%的耗氧率数据分布集中在较小的区间内, 说明在15—25的盐度区间拟长腹剑水蚤能保持稳定且较高的耗氧水平, 而拟长腹剑水蚤的中位线偏向最高值也符合这一观点。排氨率的变化表明, 两者中位线水平相似, 而火腿许水蚤的Q3均显著高于拟长腹剑水蚤, 这说明在15—35的盐度区间, 拟长腹剑水蚤氨氮代谢较稳定; 且拟长腹剑水蚤排氨率数据的中位数偏向于最小值, 说明随着盐度梯度变化, 拟长腹剑水蚤的氨氮代谢始终处于较低的水平; 在盐度为20时, 两种水蚤的排氨率差别最小。火腿许水蚤及拟长腹剑水蚤更偏好低盐度(20—25), 二者通过强化自身代谢以抵消低盐度引起的渗透压变化对自身的影响。通过分析不同盐度条件下二者的耗氧率与排氨率之比发现, 在盐度分别为30和35时, 拟长腹剑水蚤与火腿许水蚤的耗氧率及排氨率之比分别为100︰12与100︰96和100︰65、67︰100, 说明拟长腹剑水蚤对高盐度的耐受性更好。
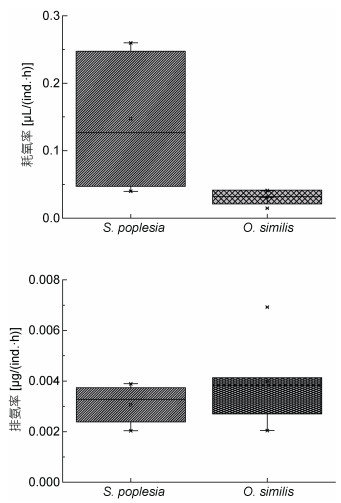 |
| 图 6 盐度对火腿许水蚤及拟长腹剑水蚤代谢影响的箱线图分析 Fig. 6 Effect of salinity on oxygen consumption and ammonia excretion rate of S. poplesia and O.similis analyzed in Box-and-Whisker chart |
生物体对高盐度、低盐度的适应机制是不同的, 在高渗环境中生物体通过增加内环境的渗透压来应对, 而在低渗环境中生物需要使用主动运输的方式转运离子, 或是启动离子转运蛋白来增加离子摄入, 以上两种机制都需要消耗能量(周显青等, 2001)。刘青等(2012)认为盐度变化对浮游动物呼吸速率的影响分为三种情况:随盐度上升而降低、呈反比; 随盐度上升而增加, 呈正比; 随盐度上升, 耗氧率先增大后降低。如真刺唇角水蚤和太平洋纺锤水蚤(陈丽华等, 2001), 属于第一种情况。汤氏纺锤水蚤属于第二种(Lance, 1965)。大多数河口桡足类属于广盐种, 属于第三种情况。本研究结果表明, 盐度对于两种桡足类生物代谢的影响不同, 对拟长腹剑水蚤的影响属于第一种情况, 对于火腿许水蚤的影响属于第二种情况, 故知拟长腹剑水蚤对盐度的耐受性较火腿许水蚤更高。
在整个实验过程中火腿许水蚤的氧氮比始终高于24, 这说明其主要依靠分解碳水化合物以响应盐度的变化; 拟长腹剑水蚤的变化正好相反, 说明它可能主要依靠消耗蛋白质和碳水化合物供能以抵御盐度变化。
4 结论(1) 两种桡足类生物可通过不同代谢途径响应环境温度的变化, 且拟长腹剑水蚤对温度具有较高的耐受性。
(2) 火腿许水蚤及拟长腹剑水蚤对低盐度(20— 25)表现出一定的偏好, 二者均可通过强化自身代谢以抵消低盐度引起的渗透压变化对自身的影响, 同时拟长腹剑水蚤对高盐度(35)的耐受性更强。
(3) 基于氧氮比(O/N)变化的代谢作用分析显示, 拟长腹剑水蚤能在较大的温、盐度范围内保持稳定的生物代谢水平, 具有更高的环境耐受性。
卜亚谦, 朱丽岩, 陈香, 等. 2019. 夏冬季渤海、北黄海浮游动物群落结构及其与环境因子的关系. 中国海洋大学学报, 49(2): 59-66 |
于娟, 张瑜, 杨桂朋, 等. 2012. 饵料、温度和盐度对两种海洋桡足类摄食与排粪的影响. 中国海洋大学学报, 42(7-8): 45-52 |
朱丽岩, 徐培培, 张天文, 等. 2009. 胶州湾拟长腹剑水蚤时空分布变化的研究. 中国海洋大学学报, 39(S1): 83-88 |
刘青, 宋莹莹, 邢勇, 等. 2012. 温度和盐度对近亲真宽水蚤耗氧率与窒息点的影响. 大连海洋大学学报, 27(3): 205-209 DOI:10.3969/j.issn.1000-9957.2012.03.003 |
纪焕红, 叶属峰. 2006. 长江口浮游动物生态分布特征及其与环境的关系. 海洋科学, 30(6): 23-30 DOI:10.3969/j.issn.1000-3096.2006.06.005 |
李光福, 2015.四种环境因子对指状伪镖水蚤摄食、繁殖和发育的影响.青岛: 中国海洋大学硕士学位论文
|
陈丽华, 陈钢, 李少菁, 等. 2001. 温盐度对厦门港春季主要桡足类呼吸率影响的实验. 台湾海峡, 20(S1): 184-189 |
周显青, 孙儒泳, 牛翠娟. 2001. 应激对水生动物生长、行为和生理活动的影响. 动物学研究, 22(2): 154-158 DOI:10.3321/j.issn:0254-5853.2001.02.013 |
房宽, 唐学玺, 张璟, 等. 2013. 饵料微藻的种类和密度差异对褶皱臂尾轮虫幼虫摄食和选食行为的影响. 海洋环境科学, 32(4): 497-501 |
徐兆礼, 沈新强, 马胜伟. 2005. 春、夏季长江口邻近水域浮游动物优势种的生态特征. 海洋科学, 29(12): 13-19 DOI:10.3969/j.issn.1000-3096.2005.12.004 |
黄加祺, 黄辉洋, 许振祖. 1998. 火腿许水蚤培养条件的初步研究. 台湾海峡, 17(S1): 44-48 |
蔡泽富, 杨红, 焦俊鹏, 等. 2011. 温排水对围隔生态系统各粒级海洋浮游生物的影响. 水产学报, 35(8): 1240-1246 |
廖一波, 陈全震, 曾江宁, 等. 2008. 海洋桡足类的热耐受性. 应用生态学报, 19(2): 449-452 |
魏玉昌. 1987. 论海产鱼虾幼体的优质饵料-海洋桡足类的繁殖发育种群产量和培养. 大连水产学院学报, (2): 41-54 |
Castellani C, Irigoien X, Harris R P et al, 2005. Feeding and egg production of Oithona similis in the North Atlantic. Marine Ecology Progress Series, 288: 173-182 DOI:10.3354/meps288173 |
Drillet G, Frouël S, Sichlau M H et al, 2011. Status and recommendations on marine copepod cultivation for use as live feed. Aquaculture, 315(3-4): 155-166 DOI:10.1016/j.aquaculture.2011.02.027 |
Eisner L B, Napp J M, Mier K L et al, 2014. Climate-mediated changes in zooplankton community structure for the eastern Bering Sea. Oceanography, 109: 157-171 |
Frost B W, 1972. Effects of size and concentration of food particles on the feeding behavior of the marine planktonic copepod Calanus pacificus. Limnology and Oceanography, 17(6): 805-815 DOI:10.4319/lo.1972.17.6.0805 |
Kovatch C E, Chandler G T, Coull B C, 1999. Utility of a full life-cycle copepod bioassay approach for assessment of sediment-associated contaminant mixtures. Marine Pollution Bulletin, 38(8): 692-701 DOI:10.1016/S0025-326X(99)00029-6 |
Lance J, 1965. Respiration and osmotic behaviour of the copepod Acartia tonsa in diluted sea water. Comparative Biochemistry and Physiology, 14(1): 155-165 DOI:10.1016/0010-406X(65)90016-2 |
Lindley L C, Phelps R P, Davis D A et al, 2011. Salinity acclimation and free amino acid enrichment of copepod nauplii for first-feeding of larval marine fish. Aquaculture, 318(3-4): 402-406 DOI:10.1016/j.aquaculture.2011.05.050 |
Mayzaud P, Conover R, 1988. O:N atomic ratio as a tool to describe zooplankton metabolism. Marine Ecology Progress Series, 45(3): 289-302 |
Michalec F G, Holzner M, Hwang J S et al, 2012. Three dimensional observation of salinity-induced changes in the swimming behavior of the estuarine calanoid copepod Pseudodiaptomus annandalei. Journal of Experimental Marine Biology and Ecology, 438: 24-31 DOI:10.1016/j.jembe.2012.09.013 |
Ohs C L, Chang K L, Grabe S W et al, 2010. Evaluation of dietary microalgae for culture of the calanoid copepod Pseudodiaptomus pelagicus. Aquaculture, 307(3-4): 225-232 DOI:10.1016/j.aquaculture.2010.07.016 |
 2020, Vol. 51
2020, Vol. 51


