中国海洋湖沼学会主办。
文章信息
- 杜美荣, 方建光, 毛玉泽, 李锋, 高亚平, 房景辉, 王同勇, 蒋增杰. 2020.
- DU Mei-Rong, FANG Jian-Guang, MAO Yu-Ze, LI Feng, GAO Ya-Ping, FANG Jing-Hui, WANG Tong-Yong, JIANG Zeng-Jie. 2020.
- 底栖硅藻生物膜附着基对扇贝幼虫附着和变态的影响
- EFFECT OF BENTHIC DIATOM FILMED SUBSTRATE ON SETTLEMENT AND METAMORPHOSIS OF SCALLOP
- 海洋与湖沼, 51(1): 125-131
- Oceanologia et Limnologia Sinica, 51(1): 125-131.
- http://dx.doi.org/10.11693/hyhz20190500101
文章历史
-
收稿日期:2019-05-30
收修改稿日期:2019-08-07
2. 青岛海洋科学与技术国家实验室海洋渔业科学与食物产出过程功能实验室 青岛 266000;
3. 威海市文登区水产技术推广站 威海 264400
2. Function Laboratory for Marine Fisheries Science and Food Production Processes, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266000, China;
3. Weihai Wendeng Fishery Technology Extension Station, Weihai 264400, China
我国是世界第一水产养殖大国和水产品贸易大国(唐启升等, 2014), 贝类养殖在水产养殖中占据举足轻重的地位, 目前已养殖的种类有40余种(王如才等, 2008), 我国主要养殖的扇贝包括栉孔扇贝、虾夷扇贝、海湾扇贝等。其中, 大量苗种的获得对规模化养殖功不可没。人工培育的苗种可以弥补天然苗种的不足, 有目的地选种和育种, 提高养殖企业的效益, 是规模化养殖中获取苗种的主要方式(王如才等, 2008)。
扇贝苗种培育经历胚胎期、浮游幼虫期和附着变态期。附着变态是扇贝幼虫发育史中的重要环节, 其形态和生活习性发生巨大的变化, 是发育和存活的敏感期。在此过程中, 幼虫分泌足丝在适合的附着基上进行附着, 面盘退化, 发育出鳃、闭壳肌, 在几丁质壳的外缘长出新的碳酸钙质的壳(次生壳), 由浮游生活转变为固着生活。附着变态阶段幼虫对环境因素异常敏感, 环境因素稍有不适, 幼虫即会延迟变态或者大量死亡, 死亡率有时可以高达80%—90%, 给生产造成巨大损失(Keough et al, 1982)。对双壳贝类的附着和变态的化学物质的研究较多, 例如咖啡因能诱导海湾扇贝Argopecten irradians的变态(Zhang et al, 2003), K+、GABA离子能促进红鲍幼虫和螺的附着和变态, L-DOPA和儿茶酚胺等神经递质能促进长牡蛎幼虫的附着和变态(Coon et al, 1990; Zhang et al, 2003; Feng et al, 2006; Lu et al, 2006), 化学物质的诱导并不稳定, 会导致幼虫死亡率高等问题。幼虫被诱导后会出现下沉到培育池底部或者无附着变态的现象, 难以实现向人为投放的附着基上附着(定向附着), 而定向附着在使用悬浮性附着基(聚乙烯网片, 红棕绳)的贝类(扇贝, 魁蚶等)采苗中十分重要(Zhang, 2000), 在此过程中如果可以优化育苗技术方案来促进眼点幼虫大量同步定向附着和变态, 将可以显著地提高扇贝育苗中产量和效益。
生物膜、菌膜等被众多学者认为能较好地诱导海洋无脊椎动物幼虫的附着和变态(Bao et al, 2007; Peteiro et al, 2007; Zapata et al, 2007; Yu et al, 2010), 且定向性好。底栖硅藻是生物膜的一种, 关于底栖硅藻对无脊椎动物幼虫附着变态诱导作用的研究大多集中在鲍、参和海胆等(柯才焕等, 2001; 康庆浩等, 2003; 于秀娟等, 2007)。研究表明, 硅藻膜之于鲍、刺参和海胆幼虫, 是三种舔食/杂食性动物附着变态阶段的优良饵料(Chen, 2007; Xing et al, 2008; Tung et al, 2011), 食物来源是一个关键因素(Watson et al, 2004; Xing et al, 2008)。底栖硅藻为附着型硅藻, 而扇贝的幼虫和稚贝均为滤食性, 附着型的底栖硅藻是否能成为滤食型贝类的有效食物来源尚存质疑, 尚无底栖硅藻附着基对扇贝附着和变态的影响相关研究。栉孔扇贝Chlamys farreri和海湾扇贝为我国北方重要养殖经济贝类, 附苗量和变态率的高低对育苗生产至关重要, 本研究针对底栖硅藻附着基对栉孔扇贝和海湾扇贝的附着和变态的影响进行了实验, 目的是为生态、高效的商业化苗种培育提供理论和技术支撑。
1 材料与方法 1.1 实验材料附着基分为2种, 一种为聚乙烯网片附着基, 目前被广泛应用于双壳贝类后期幼虫附着。聚乙烯网片附着基由聚乙烯绳(直径约1.5—2.0mm)编织而成的网结组成, 成品规格为40×80cm, 每张网片约3000网扣, 网扣处面积较大, 是幼虫附着的主要位置, 实际养殖生产中常以网扣为计量稚贝附着数量的单位。网片下方悬挂坠石, 在培育池内海水浮力的作用下, 网片便可垂直悬浮于育苗池中。另外一种为载玻片, 主要用于底栖硅藻的附着后在显微镜下观测底栖硅藻在黑暗的幼虫培育池内的数量变动情况。
实验中所用的底栖硅藻为混合藻种, 优势种类为舟形藻Navicula sp.和卵形藻Navicula sp.(金德祥等, 1982), 将聚乙烯网片和载玻片进行清洗后接种底栖硅藻, 聚乙烯网片接种30片, 载玻片接种6片, 具体操作如下。在扇贝预计附着前10d开始进行接种, 首先将聚乙烯网片平铺于藻类培养室的池底, 载玻片装于玻片架置于水池中, 加水至水深约20—30cm, 按照接种密度1.5×104cell/mL的接种密度将底栖硅藻藻种均匀的泼洒于水池中。第5天, 将载玻片和聚乙烯网片附着基分别翻转过来, 按照同样的密度进行另外一面的接种, 培育池水温8—10℃, 光照300— 400μmol/(m2·s)。从第2天开始, 使用流水培养附着基, 流速为0.5—0.8cm/s, 每天流水4h, 流水后施肥, 施肥的营养盐比例为:硝酸钠(10mg/L), 磷酸二氢钾(1mg/L), 柠檬酸铁(0.1mg/L), 硅酸钠(0.1mg/L)。
幼虫于全黑暗的幼虫培育池内培育, 当眼点幼虫的数量超过30%时开始投放附着基。眼点幼虫布苗密度为5个/mL, 将底栖硅藻网片附着基, 对照组网片附着基和载玻片附着基按照常规操作布放于幼虫培育池, 分别观测附着基上幼虫的附苗量和变态率(计算公式如下)以及底栖硅藻在育苗池环境下的数量变动。每个幼虫培育池投放附着基200片, 其中投放底栖硅藻处理组附着基100片, 对照组附着基100片, 均匀的穿插布放。在投入附着基12d后进行附着和变态数据统计, 每种附着基选取10片, 在上、中、下三个位置分别剪取5—10个网扣, 计数幼虫、稚贝和死壳的数量, 并计算附苗量和变态率。实验于3个幼虫培育池内开展, 实验结束后以三个培育池的附着基上的数量计算平均值和标准差。附苗量和变态率计算公式如下:


载玻片用于计数底栖硅藻在育苗池内的数量变动情况。每3d一次将载玻片从幼虫培育池内取出进行底栖硅藻丰度的测定后迅速放回至幼虫培育池内, 丰度测定于显微镜(×400)下进行, 视野内所有的底栖硅藻均进行计数, 一个载玻片计数6个视野, 使用目微尺测量视野直径, 计算视野的面积并统计底栖硅藻的丰度。
1.2 基于稳定碳氮同位素的栉孔扇贝稚贝食物来源分析人工培育下, 扇贝幼虫和稚贝的主要食物来源为人工培育的金藻Isochrysis galbana, 扁藻Platymonas subcordiformis。将金藻和扁藻分别经4500r/min离心后去掉上清液经60℃烘干, 玛瑙研钵研磨过筛(180目), 稚贝烘干后经HCl酸洗处理, 以上所制备的样品进入连接元素分析仪(Elementar, 美国)的同位素质谱仪ISOprime 100 (Isoprime, 英国)进行δ13C和δ15N的测定。碳、氮同位素比值以δ值的形式表达, 定义为δX(‰) = [(Rsample/Rstandard)–1]×1000, 式中, X表示13C或15N; Rsample是样本的同位素比值(12C/13C; 14N/15N), Rstandard是标样的同位素比值。碳、氮稳定同位素测定的标准物质分别为PDB(美洲拟箭石)和空气中的N2。
1.3 扫描电镜样品制备方法将在底栖硅藻附着基上完成附着变态的栉孔扇贝稚贝连同附着基一起剪下, 反复用生理盐水冲洗后, 固定于2.5%的戊二醛溶液中。乙醇脱水, 醋酸异戊脂置换, CO2临界点干燥器干燥, 离子溅射仪镀金, KYKY-2800B扫描电镜观察并拍照。
1.4 数据分析数据使用SPSS18.0进行分析, 不同处理组别间附苗量和变态率的使用独立样本T检验, 以P < 0.05为差异显著, P < 0.01为差异极显著。主要食物来源对扇贝食物贡献的分析用混合模型在R程序包SIAR (Stable Isotope Analysis in R)下进行(Parnell et al, 2010)。软件运行50000次, 计算各食物源0.95、0.75和0.25的置信水平下的置信区间(分别以浅灰色、中灰色和深灰色显示), 其中0.95下的置信区间在文中详述。
2 结果 2.1 底栖硅藻附着基对海湾扇贝和栉孔扇贝附着和变态的影响底栖硅藻附着基对海湾扇贝和栉孔扇贝附着变态的影响结果(表 1)表明, 底栖硅藻附着基的附苗量和变态率均高于对照组附着基, 海湾扇贝实验中, 底栖硅藻处理组比对照组附苗量提高220.19%(P < 0.01), 变态率和壳长指标中, 处理组和对照组差异不显著(P > 0.05)。在栉孔扇贝实验中底栖硅藻处理组比对照组附苗量提高43.02%(P < 0.01), 变态率提高87.31% (P < 0.01), 底栖硅藻处理组壳长和对照组差异不显著(P > 0.05)。对照组附着基约在投放7d左右在附着基上可以检查到变态的稚贝, 而底栖硅藻附着基在投放4d后即可检查到变态的稚贝, 比对照组早3d。
| 扇贝种类 | 组别 | 附苗量(个/扣) | 变态率(%) | 附苗量提高率(%) | 变态率提高率(%) | 平均壳长(μm) |
| 海湾扇贝 A. irradias |
对照组 | 1.9±0.3a | 66.74±6.68a | 561.86±84.56a | ||
| 底栖硅藻组 | 5.9±3.8b* | 78.40±10.69a | 220.19 | 17.47 | 573.30±65.84a | |
| 栉孔扇贝 C. farreri |
对照组 | 10.6±5.8a | 38.39±8.77a | 545.65±115.44a | ||
| 底栖硅藻组 | 15.2±3.6b* | 71.91±3.88b* | 43.02 | 87.31 | 611.84±146.68b* | |
| 注:不同的字母表示组间差异显著(P < 0.05), *表示组间差异极显著(P < 0.05) | ||||||
对附着在底栖硅藻处理后的聚乙烯网片上的栉孔扇贝稚贝的扫描电镜观察发现, 底栖硅藻在网片上生长状态良好, 虽然有少量硅壳破碎的现象, 但大部分生长良好, 部分处于分裂期, 栉孔扇贝稚贝在附着基上分泌足丝附着, 生长状态良好。
2.3 底栖硅藻在幼虫培育池内的数量变动底栖硅藻载玻片在幼虫培育池内的数量变动情况见图 2, 底栖硅藻接种并生长10d后, 转移至黑暗的幼虫培育池, 由于光照不足, 底栖硅藻光合作用受限, 在充气和换水等影响下容易导致脱落, 数量有一定的下降, 但丰度最终能保持56.0—183.9ind/mm2。
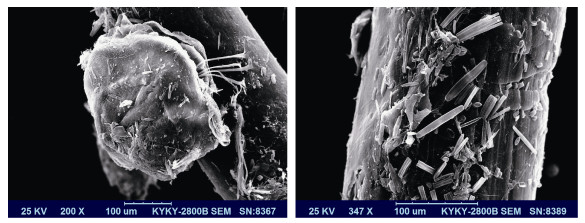 |
| 图 1 底栖硅藻附着基上附着栉孔扇贝稚贝的扫描电镜观察 Fig. 1 Scanning electron microscopic observation of C. farreri on the benthic diatom filmed substrate 注:图中所示分别为在聚乙烯网片上附着的底栖硅藻(左)和完成附着变态的稚贝以及附着的底栖硅藻(右) |
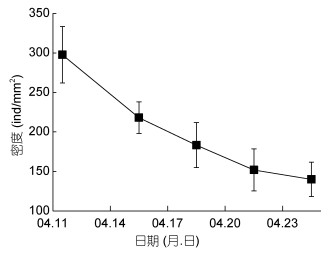 |
| 图 2 底栖硅藻在扇贝幼虫培育池内的数量变动 Fig. 2 Quantity changes of the benthic diatom in the scallop larval nursery pool |
大规模人工培育的稚贝, 其主要投喂饵料为金藻和扁藻, 对底栖硅藻附着基上的稚贝的稳定同位素测定, 使用基于混合模型对其食物来源进行分析结果显示栉孔扇贝幼虫培育池中金藻对稚贝的食物贡献较高(图 3), 其0.95水平的置信区间的贡献率为18%—65%(浅灰色), 高于扁藻的28%—44%, 位于第三的是底栖硅藻, 其0.95水平的置信区间的贡献率为0%—44%, 附着于底栖硅藻附着基上的稚贝, 底栖硅藻也是其食物来源之一。
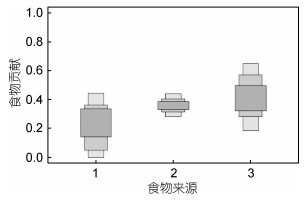 |
| 图 3 基于混合线性模型的底栖硅藻附着基上栉孔扇贝稚贝的食物来源分析 Fig. 3 Comparison in the contributions (%) of food source to C. farreri spat on benthic diatom filmed substrate 注:其中1为底栖硅藻; 2为金藻; 3为扁藻。浅灰色区域代表 0.95的置信区间; 中灰色代表 0.75的置信区间; 深灰色代表 0.25的置信区间 |
硅藻广泛分布于自然界的各大海水、淡水水域, 数量和种类占水域浮游生物的90%以上, 是水域初级生产力的主要贡献者, 浮游种类为滤食性贝类和小型浮游动物提供饵料, 贡献初级生产力。底栖硅藻能生长于生物和非生物的表面, 有一定的运动能力, 细胞壁较厚(金德祥等, 1982)。底栖硅藻附着的底层表面能有效地诱导鲍、刺参和海胆等舔食型幼虫的附着和变态(Avendaño-Herrera et al, 2003; Chen, 2007; Xing et al, 2008; Van Colen et al, 2009; Tung et al, 2011; 孙景春, 2012)。硅藻之于鲍、刺参和海胆幼虫, 食物来源是一个关键因素(Watson et al, 2004; Xing et al, 2008), 对于滤食性的扇贝幼虫是否有效, 尚未见相关报道。普遍认为底栖硅藻为附着型的硅藻, 而扇贝幼虫的整个发育周期为滤食性, 底栖硅藻在刺参和鲍附着变态中的诱导机理是基于其优良的食物来源, 而附着型的底栖硅藻在幼虫食谱组成中的贡献有限。其次, 扇贝幼虫培育过程对水质要求极为苛刻, 海水必须经过不少于24h的沉淀、砂滤等, 力求使得水体中的颗粒有机物、微生物和藻类的数量降到最低, 最大限度减少对幼虫培育环境的影响。贝类用附着基(网片)也要采用多道程序的浸泡、清洗、冲刷甚至使用盐酸、抗生素等处理。目的也是减少对幼虫培育水体稳定性的影响。并且, 现有的底栖硅藻的培养一般不是纯种/无菌培养, 大部分采用刮取长流水地面或者池壁, 或者洗刷大型藻表面附着的底栖硅藻获得, 几乎均是混种/菌培养, 其中不乏夹杂着浮游动物、原生动物等。
本研究结果从电镜, 底栖硅藻在幼虫培育池内的状态以及其诱导附着变态效果多方面对以上几个问题进行了解析。目前扇贝幼虫的商业化培育过程一般为黑暗培育, 幼虫培育池内光照低于底栖硅藻附着基培育池内的光照(300—400μmol/(m2·s)), 本文的研究表明, 进入幼虫培育池的黑暗环境后, 底栖硅藻附着基上的底栖硅藻丰度逐渐降低。相似的结果在其他藻类也有发现, 针对近岸卵形藻Cocconeis sublittoralis的结果表明, 在16.6μmol/(m2·s)的低光照下, 细胞数量先小幅度提高, 在接种2d或4d后数量开始下降(Parker et al, 2007), 近岸卵形藻的丰度在高光照处理组比低光照处理组要低。在本研究中, 在扇贝幼虫培育池的低光照环境下, 部分底栖硅藻能够存活, 在稚贝附着变态前(附着基投入后8—10d)仍能保持一定的丰度, 幼虫培育池的换水频率为每天两次, 脱落个体会在每天两次的换水中被换掉, 不影响幼虫培育池的环境, 扫描电镜的观察也表明部分底栖硅藻在扇贝幼虫完成附着变态后依然可以存活并保持良好状态。
扇贝幼虫的附着和变态经历三个阶段: (1)大范围探索。在这个阶段, 幼虫通常是沿直线爬行, 并经常从一个地点游动到另一个地点; (2)选定大致范围后开展小范围探索。在这个阶段, 探索的步调缩短, 方向改变的频率增加; (3)最后开始在小范围内的检查阶段。在这个阶段, 幼虫在很小范围内探索附着地点的适宜情况, 在它体长范围内移动和旋转, 幼虫如果暂时找不到合适的附着基, 就会发生变态延迟现象, 长牡蛎幼虫的变态延迟可达30d以上(Pechenik, 1990)。
扇贝幼虫在水中生活并呼吸和排泄, 向水体中释放二氧化碳和氨氮等(Lu et al, 1999), 同时幼虫的主要食物——单胞藻的养殖过程中, 需要添加N、P等营养盐(孙颖颖等, 2006), 其中总氨和亚硝酸盐均对贝类幼虫有毒害作用(王晔, 2016), 近年来开发出浓缩藻膏、藻粉等, 也是为了避免将单胞藻培养液代入幼虫培育池影响水环境稳定。而底栖硅藻的营养盐的吸收研究表明, 在其培养的前10d, 能够使培养液中的氨氮浓度显著降低(唐棣等, 2016)。本研究结果表明底栖硅藻附着基比对照组附着基早3d检测到变态后的稚贝, 底栖硅藻附着基吸收利用营养盐和对局部微环境的改善, 可能在缩短上述3个探索阶段的时间, 完成对附着基的选择过程中有至关重要的导向作用。
O'Foighil等(1990)对虾夷扇贝的研究表明, 在双壳贝类寻找附着基的过程中, 匍匐期幼虫使用足探寻适宜附着基的过程中有短暂的足摄食的过程, 生物膜附着基上的稚贝壳长显著大于普通附着基上的稚贝。这与本文对稚贝食物来源的稳定碳氮同位素结果是一致的, 人工培育的扇贝幼虫和稚贝, 后期主要的饵料种类为金藻和扁藻等, 因此金藻和扁藻在其食谱组成中占据了相当大的比重, 底栖硅藻数量少, 并且时间较短, 在食谱组成中比例最低, 但是从结果表明其依然承担了部分作用, 而这部分作用有可能是在扇贝附着和即将变态期间至关重要的。旧的摄食器官——面盘的退化、消失, 以及新的摄食器官——鳃的长出, 都需要一定的时间, 这一段时间内扇贝幼虫的营养供给至关重要。在底栖硅藻附着基上使用足进行探索和检查的扇贝眼点幼虫, 可能会导致底栖硅藻脱落, 自然脱落或者由于匍匐期幼虫的扰动脱落的底栖硅藻可以成为幼虫部分食物来源(Avendaño-Herrera et al, 2003), 虽然其比例远远弱于大量投喂的单胞藻, 但是在附着和变态这个异常敏感的阶段, 底栖硅藻附着基可能是幼虫从面盘摄食和转向鳃摄食中间的桥梁, 这种足摄食的模式也许能够成为面盘脱落且尚未形成稳定的鳃摄食的幼虫或者稚贝的一个重要饵料来源。
以往的一些贝类附着和变态诱导实验大多数采取小体积实验(5mL培养皿(Yu et al, 2010)及1000L容器(Pearce et al, 1996)), 本研究为大规模中试实验, 单位实验水体体积为18m3, 较大的实验水体以及多次的重复实验结果更有参考价值, 有利于扇贝幼虫商业化培育过程中的应用、推广。对双壳贝类的附着和变态的化学物质较多, 化学物质的诱导并不稳定、有负面效果, 并且定向性诱导差, 不利于使用悬浮性附着基的扇贝幼虫培育。相较之下, 本文中使用的底栖硅藻附着基在定向性诱导方面表现良好, 附苗量和变态率均较高。同时, 底栖硅藻附着基也能用于其他使用悬浮性附着基进行附着和变态的贝类, 如虾夷扇贝Patinopectin yessoensis、魁蚶Anadara uropygimelana等。底栖硅藻能诱导鲍、刺参和海胆幼虫的附着和变态, 除食源诱导外, 底栖硅藻的胞外产物(硅藻多糖和蛋白质等)被认为能促进多种海洋无脊椎动物幼虫的附着和变态。这些物质能被幼虫吸收从而诱导甲壳动物、藤壶和苔藓虫类的附着和变态(Kavouras et al, 2000; Van Colen et al, 2009), 胞外产物成分复杂, 底栖硅藻是否因其代谢的胞外产物对幼虫的附着和变态造成诱导、具体的成分及其诱导的分子生物学机理等将是下一步工作的重点。
4 结论底栖硅藻生物膜附着基对栉孔扇贝和海湾扇贝幼虫附着和变态具有明显的诱导作用。底栖硅藻在幼虫培育池的黑暗条件下不会迅速脱落影响水质, 部分在幼虫完成附着变态前依然能保持一定的丰度和良好的状态。虽不能成为幼虫的主要食物来源, 但底栖硅藻在稚贝的食谱组成中仍具有一定的贡献。本研究为底栖硅藻生物膜在贝类幼虫附着变态过程中作用的研究奠定了良好的基础, 并为生态、高效的商业化苗种培育提供理论和技术支撑。
于秀娟, 严岩, 顾继东. 2007. 微生物黏膜对杂色鲍幼虫附着和变态的影响. 海洋通报, 26(6): 32-36 DOI:10.3969/j.issn.1001-6392.2007.06.005 |
王晔, 2016. pH、氨态氮和亚硝酸态氮对日本海神蛤Panopea japonica早期发育和生长的影响.大连: 大连海洋大学硕士学位论文, 21-42
|
王如才, 王昭萍. 2008. 海水贝类养殖学. 青岛: 中国海洋大学出版社, 28-30
|
孙景春, 2012.底栖硅藻诱导仿刺参(Apostichopus japonicus)幼体附着变态的初步研究.青岛: 中国海洋大学硕士学位论文, 46-47
|
孙颖颖, 王长海. 2006. 球等鞭金藻的生长速率与培养液中营养盐的关系研究. 海洋科学, 30(1): 78-83 DOI:10.3969/j.issn.1000-3096.2006.01.016 |
金德祥, 程兆第, 林钧民, 等. 1982. 中国海洋底栖硅藻类-上卷. 北京: 海洋出版社, 257-323
|
柯才焕, 周时强, 田越, 等. 2001. 盘鲍幼体附着诱导的研究. 台湾海峡, 20(1): 9-14 DOI:10.3969/j.issn.1000-8160.2001.01.002 |
唐棣, 董伟未, 侯令, 等. 2016. 微生物膜培养及其对大珠母贝幼虫附着的影响. 基因组学与应用生物学, 35(1): 158-165 |
唐启升, 丁晓明, 刘世禄, 等. 2014. 我国水产养殖业绿色、可持续发展战略与任务. 中国渔业经济, 32(1): 6-14 DOI:10.3969/j.issn.1009-590X.2014.01.002 |
康庆浩, 郑家声, 金炳鹤. 2003. 诱导皱纹盘鲍浮游幼虫附着和变态的物质. 水产学报, 27(2): 131-136 |
Avendaño-Herrera R, Riquelmes C, Silva F et al, 2003. Optimization of settlement of larval Argopecten purpuratus using natural diatom biofilms. Journal of Shellfish Research, 22(2): 393-399 |
Bao W Y, Satuito C G, Yang J L et al, 2007. Larval settlement and metamorphosis of the mussel Mytilus galloprovincialis in response to biofilms. Marine Biology, 150(4): 565-574 |
Chen Y C, 2007. Immobilization of twelve benthic diatom species for long-term storage and as feed for post-larval abalone Haliotis diversicolor. Aquaculture, 263(1-4): 97-106 DOI:10.1016/j.aquaculture.2006.12.008 |
Coon S L, Fitt W K, Bonar D B, 1990. Competence and delay of metamorphosis in the Pacific oyster Crassostrea gigas. Marine Biology, 106(3): 379-387 DOI:10.1007/BF01344316 |
Feng D Q, Huang Y, Ke C H et al, 2006. Settlement and metamorphosis of Styela canopus Savigny larvae in response to some neurotransmitters and thyroxin. Acta Oceanologica Sinica, 25(3): 90-97 |
Kavouras J H, Maki J S, 2000. Biofilm effects on the attachment behavior of zebra mussels. In: Proceedings of ASM Workshop-Biofilm 2000. Big Sky, Montana: ASM, 16-20
|
Keough M J, Downes B J, 1982. Recruitment of marine invertebrates:the role of active larval choices and early mortality. Oecologia, 54(3): 348-352 DOI:10.1007/BF00380003 |
Lu S M, Bao Z M, Liu H et al, 2006. Effect of Epinephrine on the settlement and metamorphosis of Manila Clam Larvae. Journal of Ocean University of China, 5(2): 141-145 DOI:10.1007/BF02919213 |
Lu Y T, Blake N J, Torres J J, 1999. Oxygen consumption and ammonia excretion of larvae and juveniles of the bay scallop, Argopecten irradians concentricus (Say). Journal of Shellfish Research, 18(2): 419-423 |
O'Foighil D, Kingzett B, O'Foighil G et al, 1990. Growth and survival of juvenile Japanese scallops, Patinopecten yessoensis, in nursery culture. Journal of Shellfish Research, 9(1): 135-144 |
Parker F, Davidson M, Freeman K et al, 2007. Investigation of optimal temperature and light conditions for three benthic diatoms and their suitability to commercial scale nursery culture of abalone (Haliotis Laevigata). Journal of Shellfish Research, 26(3): 751-761 DOI:10.2983/0730-8000(2007)26[751:IOOTAL]2.0.CO;2 |
Parnell A C, Inger R, Bearhop S et al, 2010. Source partitioning using stable isotopes:coping with too much variation. PLoS One, 5(3): e9672 DOI:10.1371/journal.pone.0009672 |
Pearce C M, Bourget E, 1996. Settlement of larvae of the giant scallop, Placopecten magellanicus (Gmelin), on various artificial and natural substrata under hatchery-type conditions. Aquaculture, 141(3-4): 201-221 DOI:10.1016/0044-8486(95)01210-9 |
Pechenik J A, 1990. Delayed metamorphosis by larvae of benthic marine invertebrates:Does it occur? Is there a price to pay?. Ophelia, 32(1-2): 63-94 DOI:10.1080/00785236.1990.10422025 |
Peteiro L G, Filgueira R, Labarta U et al, 2007. Effect of submerged time of collector ropes on the settlement capacity of Mytilus galloprovincialis L. Aquaculture Research, 38(15): 1679-1681 DOI:10.1111/j.1365-2109.2007.01820.x |
Tung C H, Alfaro A C, 2011. Initial attachment, metamorphosis, settlement, and survival of black-footed abalone, Haliotis iris, on microalgal biofilms containing different amino acid compositions. Journal of the World Aquaculture Society, 42(2): 167-183 DOI:10.1111/j.1749-7345.2011.00454.x |
Van Colen C, Lenoir J, De Backer A et al, 2009. Settlement of Macoma balthica larvae in response to benthic diatom films. Marine Biology, 156(10): 2161-2171 DOI:10.1007/s00227-009-1246-6 |
Watson D, Daume S, Prince J et al, 2004. The influence of light intensity on the density of different diatoms as feed for juvenile greenlip abalone (Haliotis laevigata). Aquaculture, 235(1-4): 345-359 DOI:10.1016/j.aquaculture.2004.01.039 |
Xing R L, Wang C H, Cao X B et al, 2008. Settlement, growth and survival of abalone, Haliotis discus hannai, in response to eight monospecific benthic diatoms. Journal of Applied Phycology, 20(1): 47-53 DOI:10.1007/s10811-007-9179-2 |
Yu X J, He W H, Li H X et al, 2010. Larval settlement and metamorphosis of the pearl oyster Pinctada fucata in response to biofilms. Aquaculture, 306(1-4): 334-337 DOI:10.1016/j.aquaculture.2010.06.003 |
Zapata M, Silva F, Luza Y et al, 2007. The inhibitory effect of biofilms produced by wild bacterial isolates to the larval settlement of the fouling ascidia Ciona intestinalis and Pyura praeputialis. Electronic Journal of Biotechnology, 10(1): 149-159 |
Zhang T, 2000. The induction and mechanism of metamorphosis in larvae of bivalvia. Qingdao: Doctor Dissertation of Institute of Oceanology, Chinese Academy of Science
|
Zhang T, Yang H S, Que H Y et al, 2003. Evidence for the involvement of cyclic AMP in the metamorphosis of Bay scallop, Argopecten irradians (Lamarck) larvae. Journal of Shellfish Research, 22(2): 403-408 |
 2020, Vol. 51
2020, Vol. 51


