中国海洋湖沼学会主办。
文章信息
- 王雨浓, 李贤, 吴乐乐, 周莉, 马晓娜, 李军. 2020.
- WANG Yu-Nong, LI Xian, WU Le-Le, ZHOU Li, MA Xiao-Na, LI Jun. 2020.
- 大菱鲆(Scophthalmus maximus)不同发育阶段视蛋白基因表达特征研究
- EXPRESSION CHARACTERISTICS OF OPSIN GENES IN DIFFERENT DEVELOPMENTAL STAGES OF SCOPHTHALMUS MAXIMUS
- 海洋与湖沼, 51(1): 186-192
- Oceanologia et Limnologia Sinica, 51(1): 186-192.
- http://dx.doi.org/10.11693/hyhz20190800159
文章历史
-
收稿日期:2019-08-27
收修改稿日期:2019-10-24
2. 青岛海洋科学与技术国家实验室海洋生物学与生物技术功能实验室 青岛 266071;
3. 中国科学院海洋大科学研究中心 青岛 266071;
4. 中国科学院大学 北京 100049
2. Laboratory for Marine Biology and Biotechnology, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266071, China;
3. Center for Ocean Mega-Science, Chinese Academy of Sciences, Qingdao 266071, China;
4. University of Chinese Academy of S ciences, Beijing 100049, China
动物的视觉功能与其交配、觅食和躲避天敌等行为密切相关。视色素介导视觉形成的第一步是由G蛋白偶联受体(GPCR)视蛋白(opsin)和发色团(chromophore)共价结合形成。当光子被吸收后, 发色团由11-顺式异构化为全反式, 从而引起视蛋白构象的改变, 进而激活光感受器的下游转导通路, 并最终传递光信号(Nathans, 1987)。鱼类的视觉系统同大部分脊椎动物一样, 基因组中都有五个视蛋白基因亚家族:视杆细胞中表达的视紫红质(RH1, Rhodopsin), 以及视锥细胞中表达的四种:红视蛋白(M/LWS, red-sensitive)、紫外视蛋白(SWS1, ultraviolet-sensitive)、蓝视蛋白(SWS2, blue-sensitive)和绿视蛋白(RH2, green-sensitive)(李志强等, 2009; 刘楚吾等, 2015)。
鱼类通过基因复制形成了多样的视蛋白库, 以此来适应水体光环境变化的需要(Chinen et al, 2003; Matsumoto et al, 2006; Ward et al, 2008; Rennison et al, 2012; Nakamura et al, 2013)。其在不同发育时期视蛋白表达种类与组成的变化, 被认为与光谱环境的识别与适应相关, 如鲑科鱼类(salmonid)视网膜中紫外敏感的视锥细胞在变态过程中消失, 为进入更深的水域做准备, 在其性成熟并返回浅水层后重新出现(Bowmaker et al, 1987; Kunz et al, 1994; Flamarique, 2000; Allison et al, 2006)。虹鳟(Oncorhynchus mykiss)单锥细胞表达的视蛋白, 随着发育由SWS1转变为SWS2(Cheng et al, 2007)。此外, 斑马鱼(Danio rerio)、慈鲷(Cichlids)、孔雀鱼(Poecilia reticulata)等物种中也表现出视蛋白表达随发育呈动态变化的特征(Takechi et al, 2005; Carleton et al, 2008; Laver et al, 2011; Härer et al, 2017)。
大菱鲆(Scophthalmus maximus)隶属于鲽形目(Pleuronectiformes)、鲆科(Bothidae)、菱鲆属(Scophthalmus), 生长快、耐低温, 是我国重要的海水养殖品种之一。大菱鲆早期发育过程中, 经历重要的变态过程, 由浮游生活转变为底栖生活, 生存环境尤其光照环境变化巨大。然而其视蛋白种类及表达模式的研究却未见报道。本研究以大菱鲆为对象, 研究不同发育阶段大菱鲆视蛋白组成、基因表达特征、光谱敏感性变化及其对光谱环境变化的响应, 以期在理论上深入理解鱼类视觉发育规律、可塑性及对环境的适应机制。
1 材料与方法 1.1 实验用鱼实验用大菱鲆取自威海圣航水产科技有限公司, 分别为1月龄(0.15±0.09g)、4月龄(7.24±0.18g)和9月龄(40.68±0.97g)人工繁育的健康稚、幼鱼。样本采集前用300mg/LMS-222麻醉, 随后立即摘除眼睛并置于液氮中保存, 用于视蛋白qPCR分析。
1.2 数据库搜索与引物设计大菱鲆视蛋白序列通过BLASTn和BLASTp以默认参数搜索NCBI和Ensembl数据库获得(Altschul et al, 1990), 斑马鱼和牙鲆视蛋白序列用作检索参照(Chinen et al, 2003; Kasagi et al, 2018)。序列相似性由ClustalW2网站获得, 并利用MEGA7.0中邻接法(Neigh-borJoining)构建系统发生树。qPCR引物使用PrimerPre mier 5.0设计, 具体见表 1。内参基因β-actin使用引物见文献(Dang et al, 2011)。
| 引物 | 序列(5′—3′) | 退火温度(℃) | 扩增效率(%) |
| LWS F | TATTGCGTATGCTGGGGAC | 58 | 95.9 |
| LWS R | TGGGTTGTATATGGTGGCG | ||
| SWS1 F | AAACACTTCCACCTGTATGAG | 58 | 100.4 |
| SWS1 R | TGACGAGGATGTAGTTGAGA | ||
| SWS2 F | CATACCCTCCTGCCTCTCCA | 58 | 93.8 |
| SWS2 R | AATCCTCATCATCGCCTCCA | ||
| RH2a1 F | GCAGTCAAACGATTCCCAT | 58 | 98.0 |
| RH2a1 R | GTTCCTCTAACAACCACCAAAA | ||
| RH2a2 F | CTATCCACCAGCAAGACAGAAG | 58 | 105.3 |
| RH2a2 R | CCATTTCAAGTTAGCCATTCAG | ||
| RH2b1 F | TTGACCAGTGACGAATGGCTCC | 57 | 95.1 |
| RH2b1 R | GCTGAGAGATTCCTGTTCCCCG | ||
| RH2b2 F | TTACCGATTGCTTCCAGATTTC | 58 | 99.3 |
| RH2b2 R | ATGAGGCGGCATTCCTTTGTGT | ||
| RH2c F | CTGTGGACGCTCTCCTTGAC | 57 | 99.9 |
| RH2c R | GACTTGCGAGTTGAGGTGAA | ||
| RH1 F | AACGACTGAAGGCTAATGT | 57 | 102.6 |
| RH1 R | AACTCTGTAATGGGCTGAC |
实验用RNA提取试剂盒购自南京诺唯赞生物科技有限公司, 用Nanodrop 2000超微量分光光度计检测RNA浓度及纯度, 并用1%琼脂糖凝胶电泳检测RNA条带完整性。随后, 利用反转录试剂盒(TAKARA)合成大菱鲆cDNA第一链, –20℃保存备用。
1.4 实时荧光定量PCR以β-actin为内参基因, 每个样品设置三个复孔。总反应体系为20μL: cDNA 1.6μL, 上下游引物各0.4μL, TB Green Premix Ex Taq 10μL (TaKaRa), RNase free H2O 7.6μL。荧光定量反应条件如下: 95℃ 3min; 95℃ 10s; 57/58℃ 30s; 72℃ 30s; 40个循环。引物特异性采用CFX-96软件(Bio-Rad公司)进行高温熔解曲线分析和1%琼脂糖凝胶电泳检测, 并以5倍梯度稀释模板获得引物扩增效率。相对表达量计算采用2–ΔΔCt法, 统计分析使用SPSS19.0软件, 以“LSD”单因素方差分析法对不同发育阶段大菱鲆视蛋白表达量进行比较。当P < 0.05时, 即为差异显著。
1.5 视蛋白表达相对比例的计算参照相关文献方法(Fuller et al, 2004; Härer et al, 2017), 对大菱鲆不同阶段, 视锥细胞中各视蛋白表达比例的计算采用如下公式:
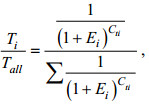
其中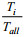
大菱鲆拥有5类视蛋白基因, 分别为视杆细胞中的视紫红质(RH1), 视锥细胞中的紫外视蛋白(SWS1, AWO98359)、红视蛋白(LWS, AF385826)、蓝视蛋白(SWS2, AWP03347)以及绿视蛋白(RH2), 其中绿视蛋白基因有五个亚型。序列相似性分析(表 2)表明RH2a1和RH2a2及RH2b1和RH2b2之间的序列相似性更高。系统发生树分析(图 1)表明RH2a1和RH2a2及RH2b1和RH2b2分别聚为一支, 故绿视蛋白基因五个亚型暂命名为RH2a1、RH2a2、RH2b1、RH2b2和RH2c。视紫红质和绿视蛋白相关序列已提交到NCBI, 视紫红质序列号为MN073188, 绿视蛋白五个基因分别为MN073190-MN073194。
| SWS2 | LWS | SWS1 | RH1 | RH2c | RH2b1 | RH2b2 | RH2a1 | RH2a2 | |
| SWS2 | 100.00 | 49.10 | 52.21 | 55.23 | 55.95 | 55.18 | 54.60 | 56.03 | 56.23 |
| LWS | 49.10 | 100.00 | 51.87 | 50.53 | 54.04 | 55.65 | 55.84 | 51.16 | 53.78 |
| SWS1 | 52.21 | 51.87 | 100.00 | 53.00 | 56.45 | 55.56 | 55.46 | 55.65 | 55.36 |
| RH1 | 55.23 | 50.53 | 53.00 | 100.00 | 62.71 | 64.35 | 64.35 | 62.22 | 63.38 |
| RH2c | 55.95 | 54.04 | 56.45 | 62.71 | 100.00 | 85.17 | 87.72 | 75.34 | 79.29 |
| RH2b1 | 55.18 | 55.65 | 55.56 | 64.35 | 85.17 | 100.00 | 94.43 | 76.69 | 80.44 |
| RH2b2 | 54.60 | 55.84 | 55.46 | 64.35 | 87.72 | 94.43 | 100.00 | 77.55 | 81.41 |
| RH2a1 | 56.03 | 51.16 | 55.65 | 62.22 | 75.34 | 76.69 | 77.55 | 100.00 | 85.93 |
| RH2a2 | 56.23 | 53.78 | 55.36 | 63.38 | 79.29 | 80.44 | 81.41 | 85.93 | 100.00 |
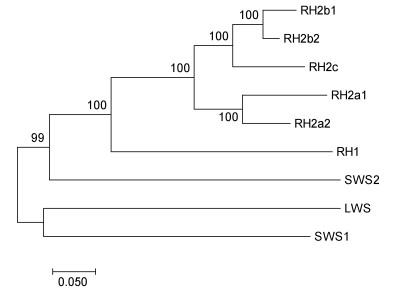 |
| 图 1 大菱鲆视蛋白核酸序列邻接法建树 Fig. 1 A phylogenetic tree constructed by the Neighbor-Joining method for nucleotide sequences of S. maximus opsins |
1月龄大菱鲆视紫红质基因RH1表达量较低, 其后表达量逐渐增加, 但4月龄和9月龄大菱鲆杆视蛋白表达量无显著差异(图 2)。
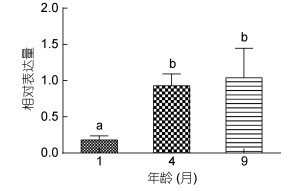 |
| 图 2 大菱鲆稚、幼鱼视紫红质基因(RH1)相对表达量随生长发育的变化 Fig. 2 Relative expression of RH1 during the development of juvenile S. maximus 注:不同的字母表示有显著差异(P < 0.05) |
大菱鲆锥视蛋白基因相对表达量随发育的变化见图 3。其中, LWS相对表达量在1月龄最高, 其后逐渐降低; SWS1和SWS2在9月龄的相对表达量均显著高于1、4月龄, 且1、4月龄之间无显著差异; 绿视蛋白中RH2a1和RH2b2在4、9月龄相对表达量显著低于1月龄; RH2a2和RH2b1在三个时期表达量均无显著变化; RH2c在1、4月龄相对表达量无明显变化, 而9月龄时显著降低。
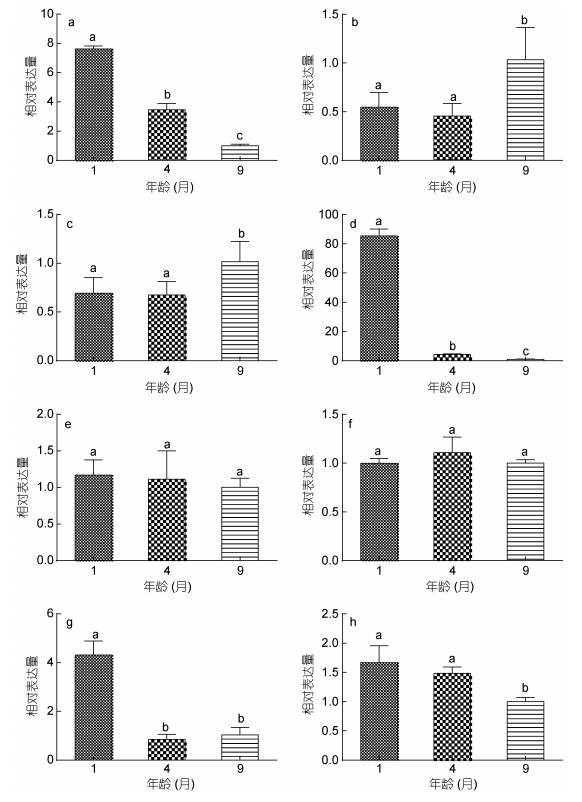 |
| 图 3 大菱鲆稚、幼鱼锥视蛋白基因相对表达量随生长发育的变化 Fig. 3 Relative expression of cone opsin genes during the development of juvenile S. maximus 注: a. LWS, b. SWS1, c. SWS2, d. RH2a1, e. RH2a2, f. RH2b1, g. RH2b2, h. RH2c。不同的字母表示有显著差异(P < 0.05) |
大菱鲆锥视蛋白中, LWS、RH2b1和RH2c为表达比例最高的三个锥视蛋白基因, 三者表达比例之和在三个阶段均超过95%(图 4)。1月龄时, LWS为表达比例最高的锥视蛋白, 超过总量的50%。随着大菱鲆的生长发育, LWS表达比例逐渐降低, 到9月龄时减少至约6%。RH2b1则刚好相反, 1月龄时表达量约占29.9%, 9月龄时升高至75.1%, 成为表达量最高的锥视蛋白。RH2c的表达比例从1月龄至9月龄略微增加, 由9.2%升高至14.8%。
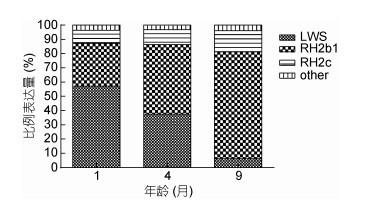 |
| 图 4 大菱鲆三种主要视蛋白表达比例随生长发育的变化 Fig. 4 Proportional expression of three main opsin during the development of juvenile S. maximus |
在其他未占优势锥视蛋白基因中, SWS1和SWS2表达比例均在9月龄时显著增加。绿视蛋白中RH2a1表达比例随着发育逐渐降低, 至9月龄时所占比例几乎为零; RH2a2在三个时期表达比例无显著变化, 且均不超过0.2%; RH2b2在4月龄的表达比例不足0.2%, 显著低于1、9月龄(表 3)。
| 月龄 | LWS | SWS1 | SWS2 | RH2a1 | RH2a2 | RH2b1 | RH2b2 | RH2c |
| 1 | 57.201a | 0.275a | 2.393a | 0.454a | 0.070a | 29.945a | 0.448a | 9.213a |
| 4 | 37.568b | 0.298a | 2.687ab | 0.036b | 0.113a | 48.803b | 0.143b | 10.353a |
| 9 | 6.214c | 0.740b | 2.860b | 0.007b | 0.112a | 75.057c | 0.224c | 14.787b |
| 注:不同的字母表示有显著差异(P < 0.05) | ||||||||
鱼类视蛋白基因的多拷贝事件报道较多, 其中以绿视蛋白基因RH2最为常见(刘楚吾等, 2015)。如斑马鱼(Danio rerio)的RH2基因通过复制形成了光谱敏感峰值(λmax)各不相同的四个基因, 串联排列在基因组上(Chinen et al, 2003)。而红鳍东方鲀(Takifugu rubripes)和黑青斑河豚(Tetraodon nigroviridis)的RH2也发生了加倍, 但它们的RH2-2趋同退化为假基因(Neafsey et al, 2005)。在已有报道中, 太平洋蓝鳍金枪鱼(Thunnus orientalis)RH2基因最多, 其至少有5个旁系同源基因。相关氨基酸位点替换导致光谱敏感蓝移, 形成不同λmax的绿视蛋白亚型, 进而增强了太平洋蓝鳍金枪鱼对蓝光的识别能力(Nakamura et al, 2013)。在大菱鲆视蛋白基因中, 我们发现其有五个RH2基因, 推测RH2基因的碱基替换引起λmax的改变, 可能是变态后大菱鲆对深海短光谱为主的光照环境的一种适应表现。
3.2 大菱鲆发育过程中视蛋白基因表达特征变化视蛋白基因在鱼体发育不同阶段表达的不一致性, 是其适应不同发育阶段下各异光谱环境的强大机制之一(Cheng et al, 2004; Carleton et al, 2008)。大菱鲆在仔稚鱼期营浮游生活, 变态后则转营底栖生活。本实验结果表明, 大菱鲆虽然经历长时间的养殖驯化, 但其可能仍保留了野生状态的视蛋白表达模式:从1月龄至9月龄, 大菱鲆杆视蛋白基因表达量增加; 大菱鲆在进入更深的水层后, 栖息环境光线逐渐变暗, 需要更多的视紫红质。
在锥视蛋白中, LWS表达量逐渐降低, SWS1和SWS2表达量逐渐升高, 绿视蛋白中占主导的RH2b1表达量无显著变化。大菱鲆变态前生存在表层水域, 光线以长波长为主, 变态后向更深的水层移动, 光谱以中短波长为主。我们的结果表明大菱鲆变态前后颜色识别能力的转变, 正好与大菱鲆生活史(从浮游向底栖生活转变)的视觉需求相吻合。条斑星鲽(Verasper moseri)有着与大菱鲆类似的生活史和光谱环境转变, 其在3—27月龄的发育过程中LWS表达逐渐降低, RH1表达升高, 但SWS1和SWS2b表达量下降(Kasagi et al, 2015)。南地刺鲷(Acanthopagrus butcheri)在仔鱼期视蛋白表达以SWS1、SWS2b和RH2aα为主, 而SWS2a、RH2aβ和LWS表达水平很低; 然而在成鱼中, 视蛋白表达情况刚好相反, 并且从仔鱼到成虫, RH1的相对表达水平上升了25倍(Shand et al, 2008), 这种变化可能与其稚鱼期到以长波长为主的单宁酸污染河口水域生活有关(Shand et al, 2002)。可见, 鱼类视蛋白表达的阶段特征与发育中环境光谱变化密切相关。
3.3 大菱鲆发育过程中的光谱敏感性变化发育过程中视蛋白基因表达比例的变化, 可以在一定程度上推测鱼类在不同发育阶段的光谱敏感性。各锥视蛋白表达比例的计算结果表明, 大菱鲆锥视蛋白在1月龄时LWS占主导, 随着发育, RH2b1逐渐取代了LWS高表达的地位。据此可推测:大菱鲆在变态前的1月龄可能对长波长的红光更为敏感, 而变态后可能对中短波长的绿光更敏感, 与其生活史中光谱环境变化吻合。美洲拟鲽(Pleuronectes Americanus)拥有与大菱鲆类似的生活史, 但其变态前只有RH2表达, 意味着仔鱼期的绿光高敏感性; 变态后SWS2和LWS两类锥视蛋白基因亦有表达, 其光谱敏感性可能有所转变(Mader et al, 2004)。
本实验中, 9月龄大菱鲆SWS1表达比例显著高于1、4月龄。然而大部分研究表明紫外敏感性的增强可能是不利的(Losey et al, 1999)。如罗非鱼(Oreochromis niloticus)的紫外敏感性随着发育逐渐降低, 其仔鱼期对紫外的高敏感性与摄食习性有关。浮游动物会吸收紫外线, 仔鱼的紫外视觉能够增强浮游动物与海水背景颜色的对比, 从而有助于其对浮游生物的捕捉(Sabbah et al, 2012); 罗非鱼成鱼为杂食性, 由于紫外线在水中的强烈散射造成视网膜图像形成的模糊化, 不利于其对大型水生植物及无脊椎动物的捕食。但大菱鲆9月龄SWS1所占比例依然很低, 可能对光谱敏感性影响微乎其微。SWS2的表达比例变化亦不大, 表明大菱鲆对蓝光敏感程度可能亦无显著变化。
4 结论大菱鲆视蛋白基因在不同发育阶段表达特征不同。1月龄LWS表达比例为57.2%, 9月龄时降至11.4%;绿视蛋白从1月龄29.9%升高至9月龄73.3%。表达占据主导地位的LWS逐渐被RH2b1取代, 进而可能引起视觉敏感性由长波长转变为中短波长敏感。不同阶段视蛋白表达特征变化引发的光谱敏感性转变, 可能是大菱鲆应对底栖光环境变化的一种适应策略。
刘楚吾, 余娟, 王中铎, 等. 2015. 鱼类视蛋白的研究进展. 海洋与湖沼, 46(6): 1564-1570 |
李志强, 何舜平. 2009. 脊椎动物视蛋白基因分子进化的研究进展. 水生生物学报, 33(6): 1193-1197 |
Allison W T, Dann S G, Veldhoen K M et al, 2006. Degeneration and regeneration of ultraviolet cone photoreceptors during development in rainbow trout. Journal of Comparative Neurology, 499(5): 702-715 DOI:10.1002/cne.21164 |
Altschul S F, Gish W, Miller W et al, 1990. Basic local alignment search tool. Journal of Molecular Biology, 215(3): 403-410 DOI:10.1016/S0022-2836(05)80360-2 |
Bowmaker J K, Kunz Y W, 1987. Ultraviolet receptors, tetrachromatic colour vision and retinal mosaics in the brown trout (Salmo trutta): age-dependent changes. Vision Research, 27(12): 2101-2108 DOI:10.1016/0042-6989(87)90124-6 |
Carleton K L, Spady T C, Streelman J T et al, 2008. Visual sensitivities tuned by heterochronic shifts in opsin gene expression. BMC Biology, 6: 22 DOI:10.1186/1741-7007-6-22 |
Cheng C L, Flamarique I N, 2004. Opsin expression: new mechanism for modulating colour vision. Nature, 428(6980): 279 |
Cheng C L, Flamarique I N, 2007. Chromatic organization of cone photoreceptors in the retina of rainbow trout: single cones irreversibly switch from UV (SWS1) to blue (SWS2) light sensitive opsin during natural development. Journal of Experimental Biology, 210(23): 4123-4135 DOI:10.1242/jeb.009217 |
Chinen A, Hamaoka T, Yamada Y et al, 2003. Gene duplication and spectral diversification of cone visual pigments of zebrafish. Genetics, 163(2): 663-675 |
Dang W, Sun L, 2011. Determination of internal controls for quantitative real time RT-PCR analysis of the effect of Edwardsiella tarda infection on gene expression in turbot (Scophthalmus maximus). Fish & Shellfish Immunology, 30(2): 720-728 |
Flamarique I N, 2000. The ontogeny of ultraviolet sensitivity, cone disappearance and regeneration in the sockeye salmon Oncorhynchus nerka. The Journal of Experimental Biology, 203(7): 1161-1172 |
Fuller R C, Carleton K L, Fadool J M et al, 2004. Population variation in opsin expression in the bluefin killifish, Lucania goodei: a real-time PCR study. Journal of Comparative Physiology A, 190(2): 147-154 |
Härer A, Torres-Dowdall J, Meyer A, 2017. Rapid adaptation to a novel light environment: the importance of ontogeny and phenotypic plasticity in shaping the visual system of Nicaraguan Midas cichlid fish (Amphilophus citrinellus spp.). Molecular Ecology, 26(20): 5582-5593 DOI:10.1111/mec.14289 |
Kasagi S, Mizusawa K, Murakami N et al, 2015. Molecular and functional characterization of opsins in barfin flounder (Verasper moseri). Gene, 556(2): 182-191 |
Kasagi S, Mizusawa K, Takahashi A, 2018. Green-shifting of SWS2A opsin sensitivity and loss of function of RH2-A opsin in flounders, genus Verasper. Ecology and Evolution, 8(2): 1399-1410 DOI:10.1002/ece3.3745 |
Kunz Y W, Wildenburg G, Goodrich L et al, 1994. The fate of ultraviolet receptors in the retina of the atlantic salmon (Salmo salar). Vision Research, 34(11): 1375-1383 DOI:10.1016/0042-6989(94)90136-8 |
Laver C R J, Taylor J S, 2011. RT-qPCR reveals opsin gene upregulation associated with age and sex in guppies (Poecilia reticulata)-a species with color-based sexual selection and 11 visual-opsin genes. BMC Evolutionary Biology, 11: 81 DOI:10.1186/1471-2148-11-81 |
Losey G S, Cronin T W, Goldsmith T H et al, 1999. The UV visual world of fishes: a review. Journal of Fish Biology, 54(5): 921-943 DOI:10.1111/j.1095-8649.1999.tb00848.x |
Mader M M, Cameron D A, 2004. Photoreceptor differentiation during retinal development, growth, and regeneration in a metamorphic vertebrate. Journal of Neuroscience, 24(50): 11463-11472 DOI:10.1523/JNEUROSCI.3343-04.2004 |
Matsumoto Y, Fukamachi S, Mitani H et al, 2006. Functional characterization of visual opsin repertoire in Medaka (Oryzias latipes). Gene, 371(2): 268-278 DOI:10.1016/j.gene.2005.12.005 |
Nakamura Y, Mori K, Saitoh K et al, 2013. Evolutionary changes of multiple visual pigment genes in the complete genome of Pacific bluefin tuna. Proceedings of the National Academy of Sciences of the United States of America, 110(27): 11061-11066 DOI:10.1073/pnas.1302051110 |
Nathans J, 1987. Molecular biology of visual pigments. Annual Review of Neuroscience, 10: 163-194 DOI:10.1146/annurev.ne.10.030187.001115 |
Neafsey D E, Hartl D L, 2005. Convergent loss of an anciently duplicated, functionally divergent RH2 opsin gene in the fugu and Tetraodon pufferfish lineages. Gene, 350(2): 161-171 DOI:10.1016/j.gene.2005.02.011 |
Rennison D J, Owens G L, Taylor J S, 2012. Opsin gene duplication and divergence in ray-finned fish. Molecular Phylogenetics and Evolution, 62(3): 986-1008 DOI:10.1016/j.ympev.2011.11.030 |
Sabbah S, Hui J, Hauser F E et al, 2012. Ontogeny in the visual system of Nile tilapia. Journal of Experimental Biology, 215(15): 2684-2695 DOI:10.1242/jeb.069922 |
Shand J, Davies W L, Thomas N et al, 2008. The influence of ontogeny and light environment on the expression of visual pigment opsins in the retina of the black bream, Acanthopagrus butcheri. Journal of Experimental Biology, 211(9): 1495-1503 DOI:10.1242/jeb.012047 |
Shand J, Hart N S, Thomas N et al, 2002. Developmental changes in the cone visual pigments of black bream Acanthopagrus butcheri. The Journal of Experimental Biology, 205(23): 3661-3667 |
Takechi M, Kawamura S, 2005. Temporal and spatial changes in the expression pattern of multiple red and green subtype opsin genes during zebrafish development. The Journal of Experimental Biology, 208(7): 1337-1345 DOI:10.1242/jeb.01532 |
Ward M N, Churcher A M, Dick K J et al, 2008. The molecular basis of color vision in colorful fish: four Long Wave- Sensitive (LWS) opsins in guppies (Poecilia reticulata) are defined by amino acid substitutions at key functional sites. BMC Evolutionary Biology, 8: 210 DOI:10.1186/1471-2148-8-210 |
 2020, Vol. 51
2020, Vol. 51


