中国海洋湖沼学会主办。
文章信息
- 郑学斌, 杜晨, 王景倩, 詹炜, 谢庆平, 楼宝, 竺俊全. 2020.
- ZHENG Xue-Bin, DU Chen, WANG Jing-Qian, ZHAN Wei, XIE Qing-Ping, LOU Bao, ZHU Jun-Quan. 2020.
- 小黄鱼(Larimichthys polyactis)精子的生理特性及超低温冷冻保存研究
- PHYSIOLOGICAL CHARACTERISTICS AND CRYOPRESERVATION EFFECT OF LARIMICHTHYS POLYACTIS SPERM
- 海洋与湖沼, 51(1): 193-205
- Oceanologia et Limnologia Sinica, 51(1): 193-205.
- http://dx.doi.org/10.11693/hyhz20191000198
文章历史
-
收稿日期:2019-10-29
收修改稿日期:2019-11-25
2. 浙江省农业科学院 杭州 310016
2. Zhejiang Academy of Agricultural Sciences, Hangzhou 310016, China
精子活力是评价精子质量的重要指标, 也是精子生理特性研究的主要内容(季相山等, 2007)。鱼类精子活力受盐度、pH、离子等环境因子的影响, 研究精子活力与环境因子的关系, 有助于筛选人工授精用激活液及精子冷冻保存用稀释液(Islam et al, 2011; Öğretmen et al, 2016; 王鑫伟等, 2017)。目前, 鱼类精子活力及其影响因子的研究已在大黄鱼(Larimichthys crocea)(朱冬发等, 2005)、黄姑鱼(Nibea albiflora)(闫家强等, 2010)、眼斑拟石首鱼(Csiaenopso cellatus)(魏平等, 2009)、大弹涂鱼(Boleophthalmus pectinirostris)(洪万树等, 1997)、夏牙鲆(Paralichthys dentatus)(王学颖等, 2016)、真鲷(Pagrosomus major)(江世贵等, 2000)、黄鳍鲷(Sparus latus)(黄晓荣等, 2008)等海水鱼类中研究报道, 研究较多的影响因子有盐度、pH、离子及葡萄糖等。鱼类精子活力检测常用传统的显微观察法, 该法主观性较强, 易产生人为误差, 近年来, 计算机辅助精子分析系统(Computer- assisted sperm analysis, CASA)已在鱼类精子活力(运动率、运动速率、鞭打频率等)的检测中得到广泛应用, 它可避免传统显微观测方法所造成的人为误差(Kime et al, 2001; 刘清华等, 2006; 季相山等, 2007; Kowalski et al, 2019)。
鱼类精子的超低温冷冻保存技术在人工繁殖、遗传育种及种质资源保存等方面具有重要应用价值(Cabrita et al, 2010)。目前, 已取得精子冷冻保存成功的海水鱼类有大黄鱼(程顺等, 2013)、黄姑鱼(金春华等, 2011)、黑鲷(Sparus macrocephalus)(叶霆等, 2009)、大菱鲆(Scophthalmus maximus)(Chereguini et al, 2003)、鲻鱼(Mugil cephalus)(Balamurugan et al, 2017)、太平洋鳕(Gadus macrocephalus)(Wang et al, 2016)、褐石斑鱼(Epinephelus bruneus)(Lim et al, 2013)等种类。
小黄鱼(Larimichthys polyactis)属鲈形目、石首鱼科、黄鱼属, 广泛分布于渤海、黄海、东海及朝鲜半岛西岸海区, 曾与大黄鱼、曼氏无针乌贼(Sepia maindroni)、带鱼(Trichiurus japonicus)并称为我国“四大海产”(李建生等, 2009)。近年来, 小黄鱼自然资源因过度捕捞及水环境污染而衰退, 并出现个体小型化、低龄化及性成熟提前等问题(林龙山等, 2004; 郭旭鹏等, 2006; Liu et al, 2017), 因此, 其种质资源保护、繁殖生物学、人工繁殖及增养殖技术研究引起研究者重视, 如性腺发育(吴佩秋, 1981; Lim et al, 20 10)、精卵发生(吴佩秋, 1980; Kang et al, 2013)、精子生理特性(Le et al, 2011b)、精子冷冻保存(Le et al, 2011a)、人工育苗及养殖(徐献明等, 2014; 陈睿毅等, 2016)等方面均已见研究报道。但对人工养殖的小黄鱼精子活力及超低温冷冻保存的研究未见报道。本研究检测分析了养殖小黄鱼精子的运动特征及盐度、pH、离子、葡萄糖等环境因子的变化对其精子活力的影响; 探究了稀释液、抗冻剂、稀释比及降温高度等对精子冷冻保存效果的影响, 旨在了解小黄鱼精子的生理特性及超低温冷冻保存效果, 为其人工繁殖及种质细胞保存提供参考。
1 材料与方法 1.1 材料人工培育的性成熟小黄鱼取自浙江省宁波市象山港湾水产苗种有限公司, 挑选成熟度好的雄鱼60尾, 体长13.7±1.13cm, 体质量35.38±7.82g。
1.2 方法 1.2.1 精液的采集用干毛巾擦净小黄鱼泄殖孔周围体表水分, 轻压鱼腹使精液自然流出, 吸取无污物精液于4℃冰盒内保存, 供后续实验。
1.2.2 精子密度测定取适量精液与HBSS稀释液以1︰1000比例混匀, 滴一滴于血球计数板(计数区16×25格, 总体积0.1mm3)上, 加盖玻片后于显微镜下观察并测定精子密度(n=3)。实验重复3次, 下同。
1.2.3 精子运动特征检测取0.5μL精液, 加入500μL自然海水激活, 并用计算机辅助精子分析系统(CASA)测定激活20s后精子的运动率(percentage of motile, MOT, 运动精子占所有精子的百分率)、直线运动速率(straight line velocity, VSL)、曲线运动速率(curvilinear velocity, VCL)、平均路径运动速率(average path velocity, VAP)、侧摆幅值(amplitude of lateral head displacement, ALH)、鞭打频率(beating cross frequency, BCF)、平均移动角度(mean angular displacement, MAD)等指标(视野数3, 捕捉精子数≥200), 并人工记录精子的运动时间(moving time, MT)及寿命(life span, LS)(精子激活开始至90%精子原地颤动的时间为运动时间, 90%精子停止运动的时间为寿命)。
1.2.4 盐度对精子活力的影响实验在过滤海水(盐度27, pH 8.1)中添加蒸馏水或海水晶, 配制成盐度为5、10、15、20、25、30、35、40的实验溶液, 检测精子在各实验溶液中的活力(运动率, 运动时间及寿命, 下同)。
1.2.5 pH对精子活力的影响实验在过滤海水(盐度27, pH 8.1)中滴加1mol/L的HCl或NaOH, 配制成pH为5.0、6.0、7.0、7.5、8.0、8.5、9.0、10.0、11.0的实验溶液, 检测精子在各实验溶液中活力。
1.2.6 葡萄糖对精子活力的影响实验在去离子水中添加葡萄糖, 配制成浓度梯度为0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0mol/L的实验溶液, 检测精子在各实验溶液中的活力。
1.2.7 KCl、NaCl、MgCl2及CaCl2溶液对精子活力的影响实验在去离子水中添加NaCl、KCl、MgCl2及CaCl2, 配制成浓度梯度为0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0mol/L的实验溶液, 检测精子在各实验溶液中的活力。
1.2.8 不同海水对精子活力的影响实验参考魏平等(2009)方法配制全人工海水(每1000mL人工海水中含19.29g NaCl、4.24g MgSO4、0.84g CaCl2、0.51gKCl、0.12g NaHCO3), 并用相同摩尔数的MgCl2、Na2SO4和NaCl依次替换ASW中的CaCl2、MgSO4和NaHCO3, 配制成缺Ca2+、缺Mg2+和缺HCO3–的人工海水, 检测精子在各实验溶液中的活力。
1.2.9 稀释液种类对冷冻保存效果的影响实验分别用MFRS、ASP、Hank’s、MPRS、HBSS、Cortland为稀释液(各稀释液成分见表 1), 稀释比1︰3, 并添加10%二甲基亚砜(dimethyl sulfoxide, DMSO)(终浓度, 下同)为抗冻剂, 0.25mL麦细管为冻存管, 用二步降温法于液氮面上3.5cm处平衡5min后投入液氮中保存, 12h后取出, 40℃水浴解冻6s后测定精子活力。
| 稀释液 | NaCl(g/L) | KCl | CaCl2 | CaCl2·2H2O | NaHCO3 | MgSO4·7H2O | MgCl2 | MgCl2·6H2O | KH2PO4 | Na2HPO4·7H2O | NaH2PO4 | NaH2PO4·2H2O | 葡萄糖 | pH |
| MFRS | 13.5 | 0.6 | 0.35 | — | 0.03 | — | 0.02 | — | — | — | — | — | — | 7.7 |
| ASP | 9.92 | 0.77 | 0.13 | — | — | — | 0.05 | — | — | — | — | — | 0.01 | 7.6 |
| Hank’s | 8.01 | 0.4 | 0.14 | — | 0.35 | 0.1 | — | 0.1 | 0.06 | 0.09 | — | — | 10 | 6.8 |
| MPRS | 3.35 | 0.39 | — | 0.166 | 0.252 | — | — | 0.299 | — | — | 0.216 | — | 10 | 6.68 |
| HBSS | 8 | 0.4 | — | 0.16 | 0.35 | — | — | — | 0.06 | 0.12 | — | — | 1 | 7.2 |
| Cortland | 7.25 | 0.38 | 0.18 | — | 1 | 0.23 | — | — | — | — | — | 0.41 | 1 | 7.0 |
| 注: “—”表示无此成分 | ||||||||||||||
以HBSS为稀释液, 稀释比1︰3, 分别以5%、10%、15%及20%的DMSO、乙二醇(ethylene glycol, EG)、丙二醇(propyleneglycol, PG)、甘油(glycerol, Gly)作为抗冻剂, 0.25mL麦细管为冻存管, 用二步降温法于液氮面上3.5cm处平衡5min后投入液氮中保存, 12h后取出, 40℃水浴解冻6s后测定精子活力。
1.2.11 稀释比对冷冻保存效果的影响实验以HBSS为稀释液, 分别以1︰1, 1︰3, 1︰5, 1︰7, 1︰9稀释精液, 添加10% DMSO为抗冻剂, 0.25mL麦细管为冻存管, 二步降温法于液氮面上3.5cm处平衡5min后投入液氮中保存, 12h后取出, 40℃水浴解冻6s后测定精子活力。
1.2.12 降温高度对冷冻保存效果的影响实验以HBSS为稀释液, 稀释比1︰3, 并添加10% DMSO为抗冻剂, 0.25mL麦细管为冻存管, 用二步降温法分别于液氮面上2、3.5、5、7.5、10cm处平衡5min后投入液氮, 12h后取出, 40℃水浴解冻6s后测定精子活力。
1.3 数据处理数据统计与分析采用Excel和SPSS19.0软件完成, 用Excel进行作图, 用单因素方差分析(One-Way ANOVA)进行显著性分析(SPSS19.0)。统计结果以平均值±标准差(Mean±SD)表示。
2 结果 2.1 小黄鱼精子密度经检测, 小黄鱼精液中精子密度为(6.92±1.20)× 109/mL。
2.2 小黄鱼精子运动特征小黄鱼精子经自然海水激活后各运动参数见表 2(n=10), 曲线运动速率和平均路径运动速率较高, 直线运动速率较低。
| 运动参数 | 数值 |
| 运动率MOT(%) | 59.31±4.85 |
| 运动时间MT(min) | 8.44±0.87 |
| 寿命LS(min) | 12.20±0.50 |
| 直线运动速率VSL(μm/s) | 11.96±5.21 |
| 曲线运动速率VCL(μm/s) | 25.38±7.19 |
| 平均路径运动速率VAP(μm/s) | 22.33±6.88 |
| 侧摆幅值ALH(μm) | 3.88±0.13 |
| 鞭打频率BCF(次/s) | 12.02±2.38 |
| 平均移动角度MAD(°/s) | 18.56±3.95 |
水温16℃、pH 8.1, 小黄鱼精子在不同盐度溶液中的活力(运动率、运动时间、寿命)见图 1。精子在盐度10—40溶液中均有一定比例被激活, 在盐度25—30溶液中, 精子运动率大于45%, 在盐度25溶液中, 精子运动率、运动时间及寿命分别达(53.43±5.08)%、8.17±0.41min及11.37±0.86min, 与对照组无显著差异。精子在盐度为5的溶液中未被激活。
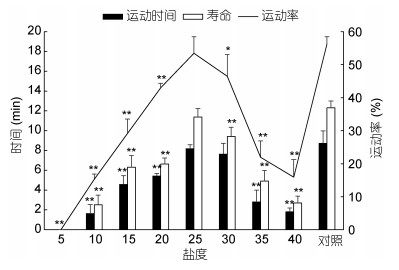 |
| 图 1 盐度对小黄鱼精子活力的影响 Fig. 1 Effects of salinity on the motility of L. polyactis sperm 注: *差异显著, P < 0.05; **差异极显著, P < 0.01;对照为自然海水(盐度27, pH 8.1)激活组, n=3, 下同 |
水温16℃、盐度27, 小黄鱼精子在不同pH溶液中的活力见图 2。精子在pH 5.0—11.0的实验溶液中均有一定比例被激活, 在pH 7.5—8.5溶液中, 精子运动率大于50%, 在pH 8.0溶液中, 精子运动率、运动时间及寿命分别达(59.12±8.62)%、8.32±0.33min及11.64±0.74min, 与对照组无显著差异。
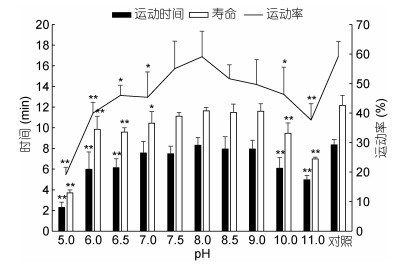 |
| 图 2 pH对小黄鱼精子活力的影响 Fig. 2 Effects of pH value on the motility of L. polyactis sperm |
水温16℃, 小黄鱼精子在葡萄糖溶液中的活力见图 3。在0.3—1.0mol/L葡萄糖溶液中, 均有部分精子被激活, 在0.7—0.9mol/L溶液中, 精子运动率与对照组无显著差异, 在0.8mol/L溶液中, 精子运动率、运动时间及寿命分别达(56.65±5.01)%、8.51± 0.46min及12.19± 0.67min。在0.1或0.2mol/L葡萄糖溶液中, 精子未被激活。
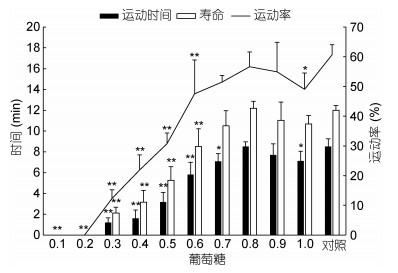 |
| 图 3 葡萄糖溶液对小黄鱼精子活力的影响 Fig. 3 Effects of glucose solutions on the motility of L. polyactis sperm |
水温16℃, 小黄鱼精子在KCl、NaCl、MgCl2及CaCl2溶液中的活力见表 3、表 4、表 5。精子在0.1—0.9mol/L的KCl溶液中均有部分被激活, 在0.4或0.5mol/L KCl溶液中, 精子的运动率相对较高(约45%), 但均显著低于对照组; 在0.1mol/L KCl溶液中, 精子未被激活。精子在0.2—1.0mol/L的NaCl溶液中均有一定比例被激活, 在0.4—0.6mol/L NaCl溶液中, 精子活力较好, 在0.5mol/L NaCl溶液中, 精子运动率、运动时间及寿命分别达(53.80±12.17)%、7.79± 1.45min及10.77±0.88min, 与对照组差异不显著; 在0.1mol/L NaCl溶液中, 精子未被激活。精子在0.3—1.0mol/L MgCl2溶液中均有一定比例被激活, 在0.7—1.0mol/L MgCl2溶液中, 精子运动率大于40%, 在0.9mol/L MgCl2溶液中, 精子运动率、运动时间及寿命分别达(58.39±1.83)%、8.04±0.32min及11.71±0.54min, 与对照组差异不显著; 在0.1—0.2mol/L MgCl2溶液中, 精子未被激活。精子在0.1—0.8mol/L CaCl2溶液中均有部分被激活, 在0.2—0.3mol/L CaCl2溶液中, 精子运动率, 运动时间及寿命相对较高, 但均显著低于对照组; 精子在0.9—1.0mol/L CaCl2溶液中未被激活。
| 浓度(mol/L) | 运动率(%) | |||
| KCl | NaCl | MgCl2 | CaCl2 | |
| 0.1 | 0** | 0** | 0** | 19.01±2.47** |
| 0.2 | 25.80±2.28** | 31.41±6.75** | 0** | 43.08±5.01** |
| 0.3 | 40.88±5.92** | 38.03±0.31** | 28.64±4.74** | 42.55±3.44** |
| 0.4 | 45.32±7.88** | 46.73±8.05* | 28.93±4.42** | 37.57±5.38** |
| 0.5 | 45.80±7.28** | 53.80±12.17 | 31.47±3.72** | 38.16±0.32** |
| 0.6 | 39.46±9.43** | 47.69±7.57* | 38.93±1.88** | 33.36±2.65** |
| 0.7 | 41.04±0.71** | 41.04±0.71** | 41.04±2.17** | 28.71±7.50** |
| 0.8 | 22.52±5.97** | 39.10±7.48** | 43.45±1.77** | 18.84±3.65** |
| 0.9 | 21.29±5.65** | 30.04±5.30** | 58.39±1.83 | 0** |
| 1.0 | 15.14±7.95** | 27.47±6.07** | 47.26±4.50** | 0** |
| 对照 | 60.70±3.34 | 63.31±4.04 | 62.89±3.52 | 62.89±3.52 |
| 注: *差异显著, P < 0.05; **差异极显著, P < 0.01;对照为自然海水(盐度27, pH 8.1)激活组, n=3。下同 | ||||
| 浓度(mol/L) | 运动时间(min) | |||
| KCl | NaCl | MgCl2 | CaCl2 | |
| 0.1 | 0** | 0** | 0** | 1.27±0.18** |
| 0.2 | 1.80±0.18** | 3.26±1.27** | 0** | 6.35±0.45** |
| 0.3 | 3.78±0.62** | 5.02±0.52** | 1.43±0.29** | 7.10±0.75** |
| 0.4 | 7.80±0.86 | 7.12±1.40 | 2.51±0.06** | 7.49±0.27* |
| 0.5 | 6.67±0.79** | 7.79±1.45 | 3.50±0.24** | 6.65±0.37** |
| 0.6 | 5.69±0.77** | 7.57±0.79 | 4.98±0.26** | 5.08±0.39** |
| 0.7 | 3.34±0.59** | 6.38±0.07* | 5.90±0.29** | 2.44±0.78** |
| 0.8 | 2.00±0.29** | 5.65±1.24** | 6.61±0.53** | 0.80±0.09** |
| 0.9 | 1.69±0.33** | 2.51±1.86** | 8.04±0.32 | 0** |
| 1.0 | 0.94±0.39** | 1.32±0.73** | 7.75±0.53* | 0** |
| 对照 | 8.38±0.58 | 8.51±0.74 | 8.38±0.58 | 8.35±0.58 |
| 浓度(mol/L) | 寿命(min) | |||
| KCl | NaCl | MgCl2 | CaCl2 | |
| 0.1 | 0** | 0** | 0** | 2.59±0.37** |
| 0.2 | 3.76±0.13** | 4.83±1.32** | 0** | 9.32±0.61** |
| 0.3 | 6.24±0.70** | 7.39±0.96** | 2.70±0.08** | 9.32±1.19** |
| 0.4 | 10.73±0.64** | 10.03±1.37* | 3.88±0.36** | 9.59±1.13** |
| 0.5 | 9.86±0.36** | 10.77±0.88 | 5.88±0.48** | 8.02±0.33** |
| 0.6 | 8.90±0.50** | 10.15±0.70 | 6.92±0.79** | 7.56±0.50** |
| 0.7 | 5.58±0.81** | 9.73±0.59* | 7.95±0.25** | 5.21±0.64** |
| 0.8 | 2.87±0.57** | 8.62±0.83** | 10.27±0.46** | 1.05±0.11** |
| 0.9 | 2.73±0.35** | 4.42±2.33** | 11.71±0.54 | 0** |
| 1.0 | 1.88±0.78** | 2.09±1.04** | 11.63±0.73 | 0** |
| 对照 | 12.27±0.32 | 11.99±0.47 | 12.27±0.32 | 12.27±0.32 |
水温16℃, 小黄鱼精子在各人工海水及自然海水中的活力见表 6。小黄鱼精子在自然海水中的运动率显著高于各人工海水, 运动时间及寿命也比各人工海水更长; 而在各离子缺陷型人工海水中, 精子的运动率与全人工海水相比无显著差异。
| 浓度(mg/L) | 运动率(%) | 运动时间(min) | 寿命(min) |
| ASW | 49.82±1.19b | 7.23±0.41bc | 10.33±0.95bc |
| Ca2+ free ASW | 52.08±1.52b | 7.98±0.69ab | 11.05±1.25ab |
| Mg2+ free ASW | 48.02±6.05b | 6.54±0.45c | 9.96±0.55c |
| HCO3– free ASW | 53.57±1.72b | 8.09±0.77ab | 11.56±0.30ab |
| 自然海水 | 60.70±3.34a | 8.51±0.74a | 11.99±0.47a |
| 注:不同上标字母表示差异显著 | |||
以MFRS等6种溶液为稀释液, 10% DMSO为抗冻剂冷冻保存小黄鱼精子, 结果显示, 精子在HBSS稀释液中冷冻保存效果最好, 冻精运动率为(41.38± 5.03)%, 其次是MFRS, 运动率(39.56±6.08)%, 在ASP、Hank’s、Cortland及MPRS稀释液中冷冻保存效果较差。对照组鲜精运动率为(59.93±3.41)%, 显著高于各冻精组(图 4)。
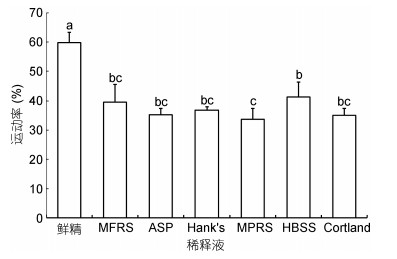 |
| 图 4 稀释液种类对小黄鱼精子冷冻保存效果的影响 Fig. 4 Effects of different extenders on cryopreservation of L. polyactis sperm |
以HBSS为稀释液, 不同浓度的四种抗冻剂对精子冷冻保存效果的影响见图 5。10% DMSO及15%PG对精子冷冻保存效果较好, 运动率分别为(43.57± 2.59)%和(43.06±6.77)%, 5%、10% EG, 5%、15%、20% DMSO及10%、15%、20% PG保存效果次之, 而不同浓度Gly保存效果较差, 运动率显著低于10% DMSO及15% PG。对照组鲜精运动率为(59.27± 1.38)%, 显著高于各冻精组(图 5)。
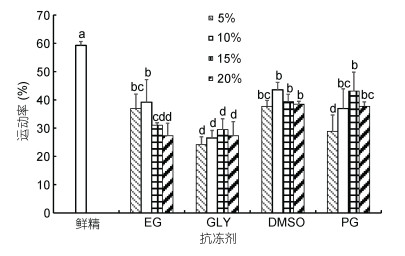 |
| 图 5 抗冻剂种类及浓度对精子冷冻保存效果的影响 Fig. 5 Effects of different cryoprotectants on cryopreservation of L. polyactis sperm |
以HBSS为稀释液, 10% DMSO为抗冻剂, 不同稀释比冷冻保存小黄鱼精子, 结果显示, 精子经1︰3或1︰5稀释后冷冻保存效果较好, 运动率分别为(43.59±1.59)%和(42.83±3.72)%, 其次为1︰7, 而1︰1及1︰9冷冻保存效果较差。对照组鲜精运动率为(57.55± 2.44)%, 显著高于各冻精组(图 6)。
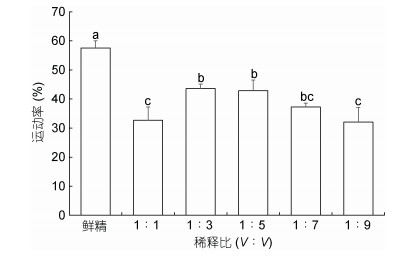 |
| 图 6 稀释比对小黄鱼精子冷冻保存效果的影响 Fig. 6 Effects of milt/diluent ratios on cryopreservation of L. polyactis sperm |
以HBSS为稀释液, 10% DMSO为抗冻剂, 不同液氮面高度降温5min后冷冻保存小黄鱼精子, 结果显示, 液氮面3.5cm处降温5min后冷冻保存效果较好, 冻精运动率为(45.67±0.95)%, 其次为2cm, 而5、7.5或10cm保存效果较差。对照组鲜精运动率为(57.70±2.72)%, 显著高于各冻精组(图 7)。
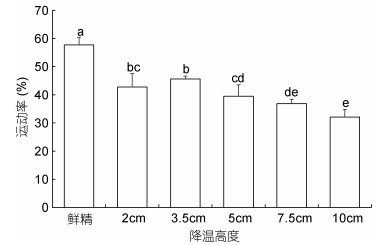 |
| 图 7 降温高度对小黄鱼精子冷冻保存效果的影响 Fig. 7 Effects of the height above surface of liquid nitrogen on cryopreservation of L. polyactis sperm |
鱼类精子的运动特征因种的不同存在差异, 现将部分鱼类精子的运动参数列于表 7, 对其进行比较。由表 7可知, 鱼类精子的运动速率一般介于几十至几百微米每秒, 如高体雅罗鱼(Siddique et al, 2016)精子的运动速率约为30μm/s, 条纹锯鮨(韩龙江等, 2014)精子的运动速率约为80μm/s, 而鲤鱼(Cejko et al, 2015)精子的运动速率较高, 可达250μm/s以上。本研究中, 小黄鱼精子的VSL、VCL及VAP分别为11.96±5.21、25.38±7.19及22.33±6.88μm/s, 低于大西洋鳕(Butts et al, 2010), 欧洲鳗鲡(Gallego et al, 2013)及条纹锯鮨(Gallego et al, 2013)等海水鱼类, 而与淡水的高体雅罗鱼(Siddique et al, 2016)相近。研究表明, 养殖大西洋鳕精子的运动速率要显著低于野生大西洋鳕, 且两种环境条件下, 大西洋鳕精子的运动速率均随繁殖时间的推移呈逐渐上升趋势(Butts et al, 2010), 小黄鱼精子是否存在此类现象, 值得进一步研究。鱼类精子的运动轨迹常为光滑的曲线, 因此精子VCL和VAP的值基本一致(Rurangwa et al, 2004)。表 7中, 鲤鱼(Cejko et al, 2015)、高体雅罗鱼(Siddique et al, 2016)、西伯利亚鲟(Siddique et al, 2016)、大西洋鳕(Butts et al, 2010)等鱼的运动速率均以VCL值最大, 且VCL和VAP值较接近(表 7), 表明这些鱼类精子多呈曲线式运动。本研究中, 小黄鱼精子VCL和VAP值也较接近, 且VSL较小, 表明小黄鱼精子的运动方式也是以曲线运动为主。
| 物种 | 直线运动速率(μm/s) | 曲线运动速率 (μm/s) |
平均路径运动速率(μm/s) | 参考文献 |
| 鲤鱼Cyprinus carpio | 201.0±9.3 | 267.0±26.5 | 246.8±17.4 | Cejko et al, 2015 |
| 高体雅罗鱼Leuciscus idus | 22.49±1.17 | 31.83±1.32 | 26.89±1.44 | Siddique et al, 2016 |
| 西伯利亚鲟Acipenser baeri | 86.8±9.3 | 119.9±19.1 | 102.4±12.0 | Sieczyński et al, 2015 |
| 中华鲟Acipenser sinensis | 22.85±3.16a | 74.22±10.29 a | 31.71±6.45a | 柳凌等, 2007 |
| 史氏鲟Acipenser schrencku | 45.02±6.72a | 100.16±13.75a | 56.66±5.45a | 柳凌等, 2007 |
| 大西洋鳕Gadus morhua | 116.9±5.6 | 128.2±6.5 | 124.9±6.1 | Butts et al, 2010 |
| 欧洲鳗鲡Anguilla anguilla | 87.03±5.77 | 162.88±7.28 | 110.58±6.33 | Gallego et al, 2013 |
| 条纹锯鮨Centropristis striata | 88.3±0.3a | 76.2±0.5a | 86.7±0.7a | 韩龙江等, 2014 |
| 小黄鱼L. polyactis | 11.96±5.21 | 25.38±7.19 | 22.33±6.88 | 本研究 |
| 注:上标字母a表示冷冻精子 | ||||
盐度是影响海水鱼类精子活力的主要因子, 且精子适宜的盐度范围往往与其生境或繁殖环境相关(江世贵等, 2000)。据研究, 眼斑拟石首鱼(魏平等, 2009)、黄姑鱼(闫家强等, 2010)及大黄鱼(朱冬发等, 2005)精子运动适宜的盐度分别为20—35、25—35及19.61—24.87, 而大弹涂鱼(洪万树等, 1997)精子运动适宜的盐度范围较低(15—20)。本研究中, 小黄鱼精子运动适宜的盐度为25—30, 与黄姑鱼(闫家强等, 2010)及眼斑拟石首鱼(C. ocellatus)(魏平等, 2009)精子运动适宜的盐度相似, 小黄鱼繁殖期的海区盐度一般为27—32, 是其精子运动适宜的盐度范围。
pH对鱼类精子活力影响也较大。据报道, 鱼类精浆pH大多介于7.3—8.5之间, 多数鱼类精子在中性或偏碱性的水体中激活效果更好(邓岳松等, 1999; Kowalski et al, 2019)。据研究, 大黄鱼(朱冬发等, 2005)精子运动适宜的pH范围是7.5—8.0, 精子在pH 7.5溶液中运动率最高、运动时间最长; 黄姑鱼(闫家强等, 2010)精子运动适宜的pH范围是7.5—8.5, 在pH 8.0时, 精子活力最好; 此外, 真鲷(江世贵等, 2000)、黄鳍鲷(S. latus)(黄晓荣等, 2008)、欧洲鲈鱼(Dicentrarchus labrax)(Öğretmen et al, 2016)等海水鱼类精子也都在中性偏碱的激活液中活力较高。本研究, 小黄鱼精子运动适宜的pH范围是7.5—8.5, pH为8.0时, 精子运动率、运动时间及寿命分别达(59.12± 8.62)%、8.32±0.33min及11.64±0.74min, 表明小黄鱼精子也是在偏碱性的环境中活力较好, 因此, 在配制小黄鱼人工授精激活液或精子冷冻保存抗冻液时, 应首选pH偏碱性(8.0左右)的配方。
据报道, 适宜浓度的葡萄糖溶液对江鳕(Lota lota)(王位莹等, 2015)、高体雅罗鱼(张涛等, 2017)、中华鲟(Acipenser sinensis)(刘鉴毅等, 2007)及乌原鲤(Procypris mterus)(吴清毅等, 2011)等淡水鱼类精子活力有促进作用, 可延长精子的运动时间或寿命; 葡萄糖溶液对眼斑拟石首鱼(魏平等, 2009)、黄姑鱼(闫家强等, 2010)、大黄鱼(朱冬发等, 2005)等海水鱼类精子活力无明显促进作用, 而对夏牙鲆(王学颖等, 2016)精子活力有一定提升。本研究中, 小黄鱼精子在0.7—0.9mol/L葡萄糖溶液中保持较高活力, 在0.8mol/L时, 精子运动率、运动时间及寿命分别达(56.65±5.01)%、8.51±0.46min及12.19±0.67min, 但与对照组各活力参数基本持平, 表明葡萄糖对小黄鱼精子活力无明显促进作用。
K+、Na+、Ca2+及Mg2+是激活鱼类精子的重要因子, 也是精浆中的主要离子成分(Alavi et al, 2006; Figueroa et al, 2016), 不同种鱼类精子对各种离子的敏感性不同(Alavi et al, 2006), 可能会导致其激活适宜的离子浓度有所差异。据研究, 大弹涂鱼(魏平等, 2010)精子激活效果较好的K+、Na+、Ca2+及Mg2+浓度分别为0.3、0.15、0.1、0.3mol/L, 眼斑拟石首鱼(魏平等, 2009)精子激活效果较好的K+、Na+、Ca2+浓度均为0.6mol/L, 而大黄鱼(朱冬发等, 2005)精子激活效果较好的K+、Na+浓度分别为0.5和0.3mol/L, 本研究小黄鱼精子激活效果较好的K+、Na+、Ca2+及Mg2+浓度分别为0.4、0.5、0.2、0.9mol/L, 与上述几种鱼类有所不同。
本研究显示, 小黄鱼精子在不同离子激活液中的运动率均低于自然海水, 这表明单一金属阳离子对小黄鱼精子的激活效果要低于含复合金属阳离子的自然海水; 小黄鱼精子在单一离子缺陷型人工海水和全人工海水中的运动率非常接近(介于48%—53%之间), 表明单一离子缺失的人工海水并没有对其精子活力造成明显的影响。王学颖等(2016)研究发现夏牙鲆精子在自然海水中的运动率要显著高于各人工海水, 自然海水的渗透压为939mosm/kg, 而缺Ca2+、缺Mg2+、缺HCO3–人工海水或全人工海水的渗透压介于1029—1131mosm/kg之间, 因此渗透压可能是导致精子运动率不同的因素之一。本研究中的小黄鱼精子在自然海水中的运动率显著高于各人工海水, 这可能是自然海水与人工海水的离子成分不同及渗透压不同所致。
3.3 精子超低温保存的适宜条件不同种鱼类精子超低温冷冻保存适宜的条件(稀释液、稀释比、抗冻剂种类及浓度等)不同(王鑫伟等, 2017)。表 8是部分海水鱼类精子冷冻保存条件及其效果比较。
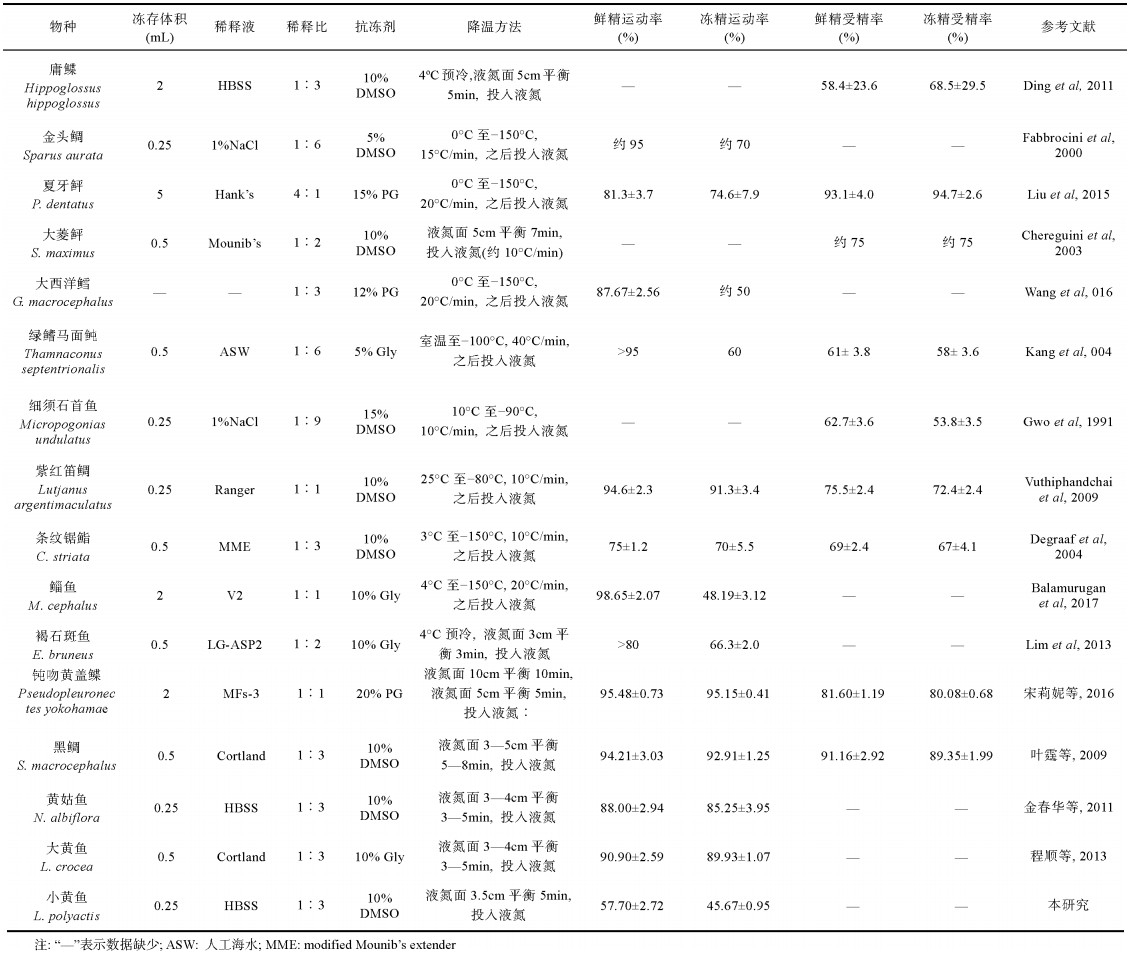
|
不同规格的麦管(0.25、0.5mL)和冻存管(2、5mL)在鱼类精子冷冻保存研究中均有应用, 麦管具有体积小、降温速率快、稳定性高等特点, 适用于精液量较少的冷冻保存研究(表 8)。而冻存管体积较麦管大、降温速率相对较慢, 适用于精液量较多的冷冻保存研究(Liu et al, 2015; Nomura et al, 2018)。本研究的养殖小黄鱼雄鱼个体较小、精液量较少, 因此使用0.25ml麦管进行了冷冻保存研究, 以确定其适宜的冷冻条件。今后, 若培育较大规格的小黄鱼雄鱼, 精液量多时, 可采用体积较大的冻存管进行精子冷冻保存研究, 以便于冷冻保存大量精液。
不同种鱼类精子冷冻保存用适宜的稀释液及其稀释比不同。Fabbrocini等(2000)和Gwo等(1991)用1% NaCl溶液为稀释液, 分别以1︰6和1︰9的稀释比冷冻保存金头鲷及细须石首鱼精子效果较好; Chereguini等(2003)用Mounib’s稀释液, 以1︰2的稀释比冷冻保存大菱鲆精子, 获得与鲜精相近的受精率; Degraaf等(2004)调整了Mounib’s稀释液成分, 并以1︰3的稀释比冷冻保存条纹锯鮨精子, 获得与鲜精相近的运动率和受精率。此外, HBSS、Hank’s、Ranger、Cortland等稀释液在庸鲽、夏牙鲆、紫红笛鲷、大黄鱼等海水鱼类精子冷冻保存研究中获得较好的效果(表 8)。本研究, 以10% DMSO为抗冻剂, 以HBSS为稀释液、1︰3或1︰5的稀释比, 超低温冷冻保存小黄鱼精子, 获得了较好的运动率, 但与鲜精运动率相比仍有一定差距。
超低温冷冻过程会导致精子结构损伤, 适宜浓度的抗冻剂可有效保护精子结构(陈松林等, 1992; Kowalski et al, 2019)。DMSO、Gly、EG、PG等是鱼类精子冷冻保存常用的抗冻剂, 其中DMSO具有渗透速度快、分布均匀、毒性低等特点(李纯等, 2000), 在庸鲽、金头鲷、细须石首鱼等海水鱼类精子冷冻保存中起到较好的抗冻保护效果(表 8)。抗冻剂适宜的使用浓度一般在5%—20%之间(表 8)。本研究的小黄鱼精子冷冻保存采用10% DMSO及15% PG为抗冻剂, 冻精解冻后运动率分别为(43.57±2.59)%和(43.06± 6.77)%, 与鲜精运动率(57.70±2.72)%较为接近, 表明10% DMSO和15% PG适用于小黄鱼精子超低温冷冻保存。
精子冷冻保存的降温方法主要有液氮面高度降温法或程序降温法, 两者使用的仪器设备和操作方法有所不同, 但都是控制降温速率。由表 8可知, 使用程序降温法超低温冻存鱼类精子, 其适宜的降温速率因鱼的种类不同存在差异, 但多数在10—20℃/min; 少数鱼如绿鳍马面鲀降温速率较高(40℃/min)。使用液氮面高度降温法超低温冻存鱼类精子, 多数在液氮面3—5cm处降温3—5min后投入液氮保存。液氮面3.5cm处的温度约–76℃ (Lim et al, 2013), 如果在此高度降温5min, 平均降温速率为15.2℃/min。本研究的小黄鱼精子冷冻保存也是在液氮面3.5cm处平衡5min后投入液氮, 其降温速率在15℃/min左右。今后, 应开展程序降温法超低温冻存小黄鱼精子试验, 以确定其最佳降温速率, 提高冻存效果。
4 结论小黄鱼精子主要以曲线运动为主, 精子适宜的盐度为25—30, 适宜的pH为7.5—8.5, 适宜浓度的葡萄糖溶液对精子活力无明显促进作用。小黄鱼精子在KCl和CaCl2溶液中受到一定程度抑制, 活力明显低于对照组。单一离子缺陷型人工海水对小黄鱼精子活力影响不大, 但激活效果不及自然海水。小黄鱼精子经HBSS稀释液1︰3稀释, 添加10% DMSO及15% PG为抗冻剂, 液氮面3.5cm处降温5min后投入液氮保存效果较好, 冻精运动率与鲜精较接近。
王位莹, 李胜忠, 张俊杰, 等. 2015. 江鳕精子在不同激活液中的活力测定. 贵州农业科学, 43(10): 144-146 DOI:10.3969/j.issn.1001-3601.2015.10.036 |
王学颖, 徐世宏, 刘清华, 等. 2016. 渗透压、pH、葡萄糖及离子溶液对夏牙鲆精子激活及运动特征的影响. 海洋科学, 40(3): 40-46 |
王鑫伟, 史应学, 竺俊全, 等. 2017. 光唇鱼精子的超低温冷冻保存及酶活性检测. 农业生物技术学报, 25(4): 639-649 |
邓岳松, 林浩然. 1999. 鱼类精子活力研究进展. 生命科学研究, 3(4): 271-278 DOI:10.3969/j.issn.1007-7847.1999.04.001 |
叶霆, 竺俊全, 杨万喜, 等. 2009. 黑鲷精子的超低温冻存及DNA损伤的SCGE检测. 动物学研究, 30(2): 151-157 |
朱冬发, 成永旭, 王春琳, 等. 2005. 环境因子对大黄鱼精子活力的影响. 水产科学, 24(12): 4-6 DOI:10.3969/j.issn.1003-1111.2005.12.002 |
刘清华, 李军, 丁福红, 等. 2006. 运用计算机辅助分析检测超低温保存的真鲷(Pagrosomus major)精子的质量. 自然科学进展, 16(9): 1181-1185 DOI:10.3321/j.issn:1002-008X.2006.09.018 |
刘鉴毅, 甘芳, 危起伟, 等. 2007. 几种不同浓度的离子及单糖对中华鲟精子活力的影响. 水生生物学报, 31(6): 849-854 DOI:10.3321/j.issn:1000-3207.2007.06.012 |
闫家强, 魏平, 姜建湖, 等. 2010. 环境因子及超低温冻存对黄姑鱼精子活力的影响. 生态科学, 29(4): 339-344 DOI:10.3969/j.issn.1008-8873.2010.04.006 |
江世贵, 李加儿, 区又君, 等. 2000. 四种鲷科鱼类的精子激活条件与其生态习性的关系. 生态学报, 20(3): 468-473 DOI:10.3321/j.issn:1000-0933.2000.03.022 |
李纯, 李军, 薛钦昭. 2000. 海洋生物种质细胞低温保存与机理. 海洋科学, 24(4): 12-15 |
李建生, 林龙山, 程家骅. 2009. 东海北部秋季小黄鱼分布特征及其与底层温度和盐度的关系. 中国水产科学, 16(3): 348-356 DOI:10.3321/j.issn:1005-8737.2009.03.006 |
吴佩秋. 1980. 小黄鱼卵母细胞发育的形态特征和季节变化. 动物学报, 26(4): 337-345 |
吴佩秋. 1981. 小黄鱼不同产卵类型卵巢成熟期的组织学观察. 水产学报, 5(2): 161-169 |
吴清毅, 孙翰昌, 李云瑶. 2011. 不同浓度的K+、Ca2+和葡萄糖对乌原鲤精子活力的影响. 水产科学, 30(4): 202-205 DOI:10.3969/j.issn.1003-1111.2011.04.004 |
宋莉妮, 田永胜, 李祥孔, 等. 2016. 钝吻黄盖鲽精子冷冻保存及生理特性分析. 农业生物技术学报, 24(4): 584-592 |
张涛, 李胜忠, 牛建功, 等. 2017. Na+、K+、葡萄糖及甘油对高体雅罗鱼精子活力的影响. 南方农业学报, 48(4): 734-738 DOI:10.3969/j.issn.2095-1191.2017.04.028 |
陈松林, 刘宪亭, 鲁大椿, 等. 1992. 鲢、鲤、团头鲂和草鱼精液冷冻保存的研究. 动物学报, 38(4): 413-424 |
陈睿毅, 楼宝, 詹炜, 等. 2016. 小黄鱼亲鱼驯养及苗种繁育. 科学养鱼, (1): 42-43 |
林龙山, 程家骅, 任一平, 等. 2004. 东海区小黄鱼种群生物学特性的分析. 中国水产科学, 11(4): 333-338 DOI:10.3321/j.issn:1005-8737.2004.04.010 |
季相山, 陈松林, 赵燕, 等. 2007. 鱼类精子质量评价研究进展. 中国水产科学, 14(6): 1048-1054 DOI:10.3321/j.issn:1005-8737.2007.06.025 |
金春华, 闫家强, 竺俊全. 2011. 黄姑鱼精子的超低温冻存及细胞结构损伤的检测. 水产学报, 35(6): 846-853 |
柳凌, Otomar L, 危起伟, 等. 2007. 计算机辅助对几种鲟鱼冻精激活液的比较. 水产学报, 31(6): 711-720 |
洪万树, 张其永, 周东晨. 1997. 四种海产经济鱼类精子的生理特性和环境因子的关系. 海洋科学, (3): 64-66 |
徐献明, 张志勇, 曹昆. 2014. 小黄鱼幼鱼人工培育技术. 水产养殖, 35(8): 22-24 DOI:10.3969/j.issn.1004-2091.2014.08.009 |
郭旭鹏, 金显仕, 戴芳群. 2006. 渤海小黄鱼生长特征的变化. 中国水产科学, 13(2): 243-249 DOI:10.3321/j.issn:1005-8737.2006.02.013 |
黄晓荣, 章龙珍, 庄平, 等. 2008. 黄鳍鲷精子主要生物学特性的研究. 热带海洋学报, 27(2): 54-59 DOI:10.3969/j.issn.1009-5470.2008.02.009 |
韩龙江, 刘清华, 官曙光, 等. 2014. 条纹锯鮨精液超低温冷冻保存研究. 水产学报, 38(10): 1714-1721 |
程顺, 闫家强, 竺俊全, 等. 2013. 甘油为抗冻剂超低温冷冻保存大黄鱼精子的DNA损伤. 中国畜牧杂志, 49(11): 34-36 DOI:10.3969/j.issn.0258-7033.2013.11.010 |
魏平, 叶霆, 吴向丹, 等. 2009. 环境因子对眼斑拟石首鱼精子活力的影响. 生态科学, 28(5): 438-442 DOI:10.3969/j.issn.1008-8873.2009.05.011 |
魏平, 闫家强, 竺俊全. 2010. 几种环境因子对大弹涂鱼精子活力的影响. 宁波大学学报(理工版), 23(3): 11-15 DOI:10.3969/j.issn.1001-5132.2010.03.003 |
Alavi S M H, Cosson J, 2006. Sperm motility in fishes. (Ⅱ) Effects of ions and osmolality: A review. Cell Biology International, 30(1): 1-14 |
Balamurugan R, Munuswamy N, 2017. Cryopreservation of sperm in Grey mullet Mugil cephalus (Linnaeus.1758). Animal Reproduction Science, 185: 205-213 DOI:10.1016/j.anireprosci.2017.08.022 |
Butts I A E, Litvak M K, Trippel E A, 2010. Seasonal variations in seminal plasma and sperm characteristics of wild-caught and cultivated Atlantic cod, Gadus morhua. Theriogenology, 73(7): 873-885 DOI:10.1016/j.theriogenology.2009.11.011 |
Cabrita E, Sarasquete C, Martínez-Páramo S et al, 2010. Cryopreservation of fish sperm: applications and perspectives. Journal of Applied Ichthyology, 26(5): 623-635 DOI:10.1111/j.1439-0426.2010.01556.x |
Cejko B I, Krejszeff S, Sarosiek B et al, 2015. Biochemical factors of common carp Cyprinus carpio L. 1758, seminal plasma and its relationship with sperm motility parameters. Journal of Applied Ichthyology, 31(S1): 10-17 |
Chereguini O, de la Banda I G, Herrera M et al, 2003. Cryopreservation of turbot Scophthalmus maximus (L.) sperm: Fertilization and hatching rates. Aquaculture Research, 34(9): 739-747 DOI:10.1046/j.1365-2109.2003.00877.x |
Degraaf J D, King V W, Benton C et al, 2004. Production and storage of sperm from the black sea bass Centropristis striata L. Aquaculture Research, 35(15): 1457-1465 DOI:10.1111/j.1365-2109.2004.01171.x |
Ding F H, Lall S P, Li J et al, 2011. Cryopreservation of sperm from Atlantic halibut (Hippoglossus hippoglossus, L.) for commercial application. Cryobiology, 63(1): 56-60 DOI:10.1016/j.cryobiol.2011.04.009 |
Fabbrocini A, Lavadera S L, Rispoli S et al, 2000. Cryopreservation of seabream (Sparus aurata) spermatozoa. Cryobiology, 40(1): 46-53 DOI:10.1006/cryo.1999.2220 |
Figueroa E, Valdebenito I, Farias J G, 2016. Technologies used in the study of sperm function in cryopreserved fish spermatozoa. Aquaculture Research, 47(6): 1691-1705 DOI:10.1111/are.12630 |
Gallego V, Carneiro P C F, Mazzeo I et al, 2013. Standardization of European eel (Anguilla anguilla) sperm motility evaluation by CASA software. Theriogenology, 79(7): 1034-1040 DOI:10.1016/j.theriogenology.2013.01.019 |
Gwo J C, Strawn K, Longnecker M T et al, 1991. Cryopreservation of Atlantic croaker spermatozoa. Aquaculture, 94(4): 355-375 DOI:10.1016/0044-8486(91)90179-B |
Islam SM, Akhter T, 2011. Tale of fish sperm and factors affecting sperm motility: a review. Advances in Life Sciences, 1(1): 11-19 |
Kang H W, Chung E Y, Chung J S et al, 2013. Ultrastructural studies of spermatogenesis and the functions of Leydig cells and Sertoli cells associated with spermatogenesis in Larimichthys polyactis (Teleostei, Perciformes, Sciaenidae). Animal Cells and Systems, 17(4): 250-258 DOI:10.1080/19768354.2013.829783 |
Kang K H, Kho K H, Chen Z T et al, 2004. Cryopreservation of filefish (Thamnaconus septentrionalis Gunther.1877) sperm. Aquaculture Research, 35(15): 1429-1433 DOI:10.1111/j.1365-2109.2004.01166.x |
Kime D E, Van Look K J W, McAllister B G et al, 2001. Computer-assisted sperm analysis (CASA) as a tool for monitoring sperm quality in fish. Comparative Biochemistry and Physiology Part C: Toxicology & Pharmacology, 130(4): 425-433 |
Kowalski R K, Cejko B I, 2019. Sperm quality in fish: Determinants and affecting factors. Theriogenology, 135: 94-108 DOI:10.1016/j.theriogenology.2019.06.009 |
Le M H, Lim H K, Min B H et al, 2011a. Semen cryopreservation of yellow croaker Larimichthys polyactis. Reviews in Fish Biology and Fisheries, 21(4): 789-797 DOI:10.1007/s11160-011-9209-7 |
Le M H, Lim H K, Min B H et al, 2011b. Effects of varying dilutions, pH, temperature and cations on spermatozoa motility in fish Larimichthys polyactis. Journal of Environmental Biology, 32(3): 271-276 |
Lim H K, Le M H, 2013. Evaluation of extenders and cryoprotectants on motility and morphology of longtooth grouper (Epinephelus bruneus) sperm. Theriogenology, 79(5): 867-871 DOI:10.1016/j.theriogenology.2013.01.004 |
Lim H K, Le M H, An C M et al, 2010. Reproductive cycle of yellow croaker Larimichthys polyactis in southern waters off Korea. Fisheries Science, 76(6): 971-980 DOI:10.1007/s12562-010-0288-5 |
Liu Q H, Ma D Y, Xu S H et al, 2015. Summer flounder (Paralichthys dentatus) sperm cryopreservation and application in interspecific hybridization with olive flounder (Polivaceus). Theriogenology, 83(4): 703-710 DOI:10.1016/j.theriogenology.2014.11.004 |
Liu L W, Sui Y Z, Zhu W B et al, 2017. In-depth transcriptome analysis of Larimichthys polyactis, de novo assembly, functional annotation. Marine Genomics, 33: 27-29 DOI:10.1016/j.margen.2017.02.002 |
Nomura K, Koh I C C, Iio R et al, 2018. Sperm cryopreservation protocols for the large-scale fertilization of Japanese eel using a combination of large-volume straws and low sperm dilution ratio. Aquaculture, 496: 203-210 DOI:10.1016/j.aquaculture.2018.07.007 |
Öğretmen F, Inanan B E, Kutluyer F, 2016. Combined effects of physicochemical variables (pH and salinity) on sperm motility: characterization of sperm motility in European sea bass Dicentrarchus labrax. Marine and Freshwater Behaviour and Physiology, 49(3): 217-222 DOI:10.1080/10236244.2016.1163838 |
Rurangwa E, Kime D E, Ollevier F et al, 2004. The measurement of sperm motility and factors affecting sperm quality in cultured fish. Aquaculture, 234(1-4): 1-28 DOI:10.1016/j.aquaculture.2003.12.006 |
Siddique M A M, Linhart O, Krejszeff S et al, 2016. Effects of preincubation of eggs and activation medium on the percentage of eyed embryos in ide (Leuciscus idus), an externally fertilizing fish. Theriogenology, 85(5): 849-855 DOI:10.1016/j.theriogenology.2015.10.032 |
Sieczyński P, Cejko B I, Grygoruk C et al, 2015. Cryopreserv ation of Siberian sturgeon (Acipenser baerii, Brandt.1869) and sterlet (Acipenser ruthenus, Linnaeus.1758) semen and its influence on sperm motility parameters assessed using a computer-assisted sperm analysis (CASA) system. Journal of Applied Ichthyology, 31(S1): 99-103 |
Vuthiphandchai V, Chomphuthawach S, Nimrat S, 2009. Cryopreservation of red snapper (Lutjanus argentimaculatus) sperm: Effect of cryoprotectants and cooling rates on sperm motility, sperm viability, and fertilization capacity. Theriogenology, 72(1): 129-138 DOI:10.1016/j.theriogenology.2009.02.013 |
Wang X Y, Shi X H, Liu Y F et al, 2016. Effects of chilled storage and cryopreservation on sperm characteristics, antioxidant enzyme activities, and lipid peroxidation in Pacific cod Gadus microcephalus. Chinese Journal of Oceanology and Limnology, 34(4): 763-771 DOI:10.1007/s00343-016-5088-z |
 2020, Vol. 51
2020, Vol. 51


