中国海洋湖沼学会主办。
文章信息
- 张亚亚, 闫国旺, 吴海燕, 谭志军, 张志华, 江涛, 李玉. 2020.
- ZHANG Ya-Ya, YAN Guo-Wang, WU Hai-Yan, TAN Zhi-Jun, ZHANG Zhi-Hua, JIANG Tao, LI Yu. 2020.
- 基于SPE与SPATT的水体中麻痹性贝类毒素检测方法构建与应用
- ESTABLISHMENT AND APPLICATION OF DETECTION METHODS TO PARALYTIC SHELLFISH POISONING IN WATER BASED ON SPE AND SPATT METHODS
- 海洋与湖沼, 51(2): 298-306
- Oceanologia et Limnologia Sinica, 51(2): 298-306.
- http://dx.doi.org/10.11693/hyhz20190900182
文章历史
-
收稿日期:2019-09-26
收修改稿日期:2019-11-26
2. 中国水产科学研究院黄海水产研究所 青岛 266071;
3. 河北省水产品质量检验检测站 石家庄 050011;
4. 青岛海洋科学与技术试点国家实验室 青岛 266237
2. Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao 266071, China;
3. Hebei Province Station for Quality Inspection and Test of Aquatic Products, Shijiazhuang 050011, China;
4. Pilot National Laboratory for Marine Science and Technology(Qingdao), Qingdao 266237, China
麻痹性贝类毒素(paralytic shellfish poisoning, PSP)是由亚历山大藻(Alexandrium)、裸甲藻(Gymnodinium)及盾甲藻(Pyrodinium)等单细胞甲藻产生、能够在海洋生物尤其是双壳贝类中富集的一类小分子有毒化学物质(Chang et al, 1997)。全球每年因PSP导致的中毒事件约2000起, 占贝类毒素中毒事件的64%, 该毒素是目前影响最大、危害最广的一类生物毒素(Visciano et al, 2016)。我国因PSP造成的食品安全事故也频频发生, 如香港虾夷扇贝中毒、福建贻贝中毒及秦皇岛贻贝中毒等(梁玉波等, 2019), 尤其是秦皇岛贻贝在2016-2019年连续出现PSP超标现象, 其中2016年的最高含量更是超出限量标准800μg STX eq/kg的65倍, 安全风险极其严峻。因此, 建立行之有效的PSP监控预警技术, 对于保障区域性贝类产品安全和消费者健康变得尤为重要。
美国、加拿大等多个发达国家已建立较为系统的PSP风险监测与预警体系, 一般同步结合浮游植物和贝类样品两种常规监测手段(田娟娟等, 2019)。通过常年定期监测浮游植物, 以摸清目标区域中浮游植物的变化规律, 当产毒藻密度大于预警值200cells/L时, 强化对贝类样品的监测; 如果贝类中PSP含量超过限量标准, 则需要关闭海域并同时监测浮游植物和贝类样品; 直至贝类中PSP低于限量标准且产毒藻浓度低于预警值时方可开放海域, 但仍需继续监测浮游植物直至风险完全解除。其中, 浮游植物监测法虽能反映产毒藻的变化情况, 但由于产毒藻种间差异并不显著且样品处理时间较长, 因而对鉴别人员的技术要求较高且时效性较差(于仁成等, 1998; Moreno-Pino et al, 2018)。贝类样品监测法虽是监控贝类毒素最直接可靠的方法, 但贝类基质复杂、组织提取物中干扰成分较多, 因此在检测前需经过复杂的净化处理(Turner et al, 2015), 这也极大影响了监控的时效性。
为了实现贝类毒素快速监测, MacKenzie等(2004)建立了固相吸附毒素跟踪技术(solid phase adsorption toxin tracking, SPATT), 该技术主要通过树脂吸附产毒藻释放到水体中的毒素, 以期实现贝类毒素的提前预警。随后, 众多SPATT的应用研究相继展开, 但大多集中在腹泻性贝毒(diarrhetic shellfish poisoning, DSP), 且已发现HP20大孔吸附树脂是吸附DSP最为有效的树脂(渠佩佩等, 2016)。相对而言, SPATT应用于水溶性贝毒PSP的监测还较少, 目前应用最多的是SP700大孔吸附树脂(Roué et al, 2018a), 但其吸附灵敏度及回收率并不理想。Hattenrath-Lehmann等(2018)优化了树脂的洗脱方法, 确定直接用含少量甲酸的乙腈水浸泡可快速有效洗脱树脂中吸附的PSP。Rodríguez等(2011)证明树脂吸附的PSP在无毒素水体中具有解吸现象, 这也是造成树脂回收率较低的主要原因, 因此在实际海域的放置时间不宜超过一周。此外, 现有研究虽也同时监测了产毒藻密度、贝类富集毒素含量, 但对于SPATT是否可用于贝类毒素提前预警的结论却有分歧(Fux et al, 2009; Pizarro et al, 2013; Li et al, 2017; Roué et al, 2018b)。固相萃取技术(solid phase extraction, SPE)通常用于实验室内贝类样品毒素测定前的净化与富集, 因此根据其吸附原理可有效检测水体中的毒素含量(Rodil et al, 2009; Wille et al, 2010; Zhuo et al, 2013)。吴海燕等(2017)的研究表明石墨化碳黑固相萃取柱对贝类样品中PSP的吸附效果明显优于C18、HLB, 同时确定将75%乙腈水(含0.25%甲酸)作为洗脱液可保证PSP目标化合物的完全洗脱。随后Riccardi等(2018)也证明石墨化碳黑固相萃取柱可有效吸附实际海水中的PSP, 但未见SPE用于PSP预警监测的研究。
因此, 本研究首先在实验室内构建了基于SPE与SPATT的水体中PSP监测方法, 并对其进行系统评价。随后, 将两种方法用于秦皇岛山海关贻贝养殖区的监测中, 该区域不仅为2016年秦皇岛贻贝中毒事件的发生地, 而且其贻贝富集PSP含量连续四年均超出限量标准。通过同时监测产毒藻密度及贻贝富集PSP含量, 以对比评估SPE与SPATT方法对目标海域中PSP风险的监控预警效果。
1 材料与方法 1.1 实验材料 1.1.1 仪器与设备AB-5500 QTRAP液相色谱-四极杆/离子阱复合质谱(美国AB SCIEX公司), 配有电喷雾离子源(ESI); Himac CR 22GⅡ高速离心机(日本Hitachi公司); XW-80A旋涡混合器(上海医大仪器厂); 恒温水浴锅(上海蓝凯仪器仪表有限公司); 光照培养箱(上海一恒科学仪器有限公司); 新型T18高速分散机(德国IKA公司); JY92-ⅡN超声细胞粉碎机(宁波新芝生物科技股份有限公司); E300H超声波清洗器(德国Elmasonic公司); Milli-Q超纯水仪(美国Millipore公司); 固相萃取装置(美国Supelco公司)。
1.1.2 化学试剂乙腈(质谱级, 美国Merck公司); 甲酸、甲酸铵(色谱级, 瑞士Fluka公司); 氨水(色谱级, 美国Sigma公司); 乙酸(色谱级, 美国Thermo公司); 超纯水(18.2 MΩ.cm); 石墨化碳黑固相萃取柱(ENVI-CarbTM, 250mg/3mL、500mg/6mL, 美国Supelco公司); 石墨化碳黑(ENVI-Carb, 120-400目, 美国Sigma公司); 大孔吸附树脂(DIAION HP20、SEPABEADS SP70、SEPABEADS SP207、SEPABEADS SP700, 日本三菱公司); 其他未作特殊说明的试剂均为分析纯。
1.1.3 PSP标准品石房蛤毒素(Saxitoxin, STX)、新石房蛤毒素(Neosaxitoxin, NEO)、膝沟藻毒素(Gonyautoxins-2 & -3, GTX2 & 3; Gonyautoxins-1 & -4, GTX1 & 4)、N-磺酰氨甲酰基类毒素(Gonyautoxin-5, GTX5; N-Sulfocarbamoylgonyautoxins-1 & -2, C1 & 2)、脱氨甲酰基类毒素(Decarbamoylsaxitoxin, dcSTX; Decarbamoylneosaxitoxin, dcNEO; Decarbamoylgon-yaut-oxins-2 & -3, dcGTX2 & 3)购自于加拿大国家海洋研究中心。用75%乙腈水(含0.25%甲酸)配置成混合标准溶液, 其中13种组分的实际浓度分别为: GTX5、NEO、STX、dcNEO、dcSTX为500ng/mL; GTX3、GTX4、dcGTX3、C2为200ng/mL; GTX1为613ng/mL; GTX2为472ng/mL; C1为669ng/mL; dcGTX2为681ng/mL。
1.1.4 藻细胞提取液塔玛亚历山大藻(Alexandrium tamarense, AT5-3株)由中国科学院海洋研究所提供, 分离自我国南海海域, 培养条件参考邴晓菲等(2017)。将指数生长期的AT5-3藻液置于冰浴中, 在全程时间5min、间隔时间2s、功率比30%的条件下进行充分超声细胞破碎, 随后8000r/min离心5min, 取上清液混合均匀即制得藻细胞提取液。经LC-MS/MS分析得:藻细胞提取液PSP含量为12.9ng STX eq/mL, 共包括GTX1 & 4、GTX2 & 3、GTX5、dcGTX2 & 3、C1 & 2在内的9种组分。
1.2 实验方法 1.2.1 LC-MS/MS分析液相色谱条件:色谱柱: TSK-Amide-80 (3μm, 2mm×15cm); 柱温: 40℃; 流速: 0.40mL/min; 进样量: 10μL; 流动相: A:水(含2mmol/L甲酸铵, 50mmol/L甲酸), B: 95%乙腈水溶液(含2mmol/L甲酸铵, 50mmol/L甲酸); 洗脱梯度: 0-3.0min, 80% B; 3.1-5.0min, 80%-40% B; 5.1-7.0min, 40% B; 7.1-8.0min, 40%-80% B; 8.1-10.0min, 80% B。质谱条件:电喷雾离子源(ESI), 多反应监测(MRM), 正负离子切换模式; 喷雾电压: 5.5kV, -4.5kV; 离子源温度550℃; 碰撞气压力: Medium; 气帘气压力: 30psi; 雾化气压力GS1: 50psi; 辅助加热气压力GS2: 50psi。其他参数参考吴海燕等(2017)。
1.2.2 基于SPE的水体中PSP检测方法石墨化碳黑固相萃取柱预先用3mL乙腈、1mL超纯水活化, 将待测水样8000r/min离心5min去除杂质后通过固相萃取柱, 自然流干后正压挤干, 最后用1mL 75%乙腈水溶液(含0.25%甲酸)洗脱混匀, 过0.22μm滤膜于进样小瓶中, 待LC-MS/MS分析。
选用ENVI-Carb 250mg/3mL、ENVI-Carb 500mg/6mL两商业化以及1g自制ENVI-Carb固相萃取柱, 均加入20mL藻细胞提取液, 筛选吸附效果较好的固相萃取柱; 分别向优选固相萃取柱中加入5、10、20、50mL藻细胞提取液, 以确定过样体积; 将500ng/mL PSP混合标准溶液用75%乙腈水(含0.25%甲酸)稀释至200、100、50、20、10、5ng/mL, 并将以上七个标准溶液分别用空白海水再次稀释500倍至50mL, 随后加入到优选固相萃取柱中, 以测定PSP各组分的回收率及检出限。
1.2.3 基于SPATT的水体中PSP检测方法树脂盘(图 1)的制备、活化及保存参考渠佩佩等(2016)。树脂中PSP的洗脱:将已在待测水体中放置7d的树脂盘取出, 去除保护网与圆形固定器, 并用10mL超纯水冲洗树脂袋去除盐分及其他杂质, 轻微甩干多余水分后将树脂从树脂袋中取出至50mL离心管中, 加入10mL 75%乙腈水溶液(含0.25%甲酸), 涡旋混匀5min, 超声40min, 静置浸泡一段时间后吸取1mL上清液过0.22μm滤膜于进样小瓶中, 待LC-MS/MS分析。
 |
| 图 1 SPATT树脂盘 Fig. 1 The resin disc of SPATT |
制备HP20、SP70、SP207、SP700树脂盘, 分别置于500mL藻细胞提取液中, 放置7d后取出, 筛选吸附效果较好的树脂; 将优选树脂的树脂盘置于500mL藻细胞提取液中, 放置7d后取出, 在树脂进行PSP洗脱过程中, 分别在涡旋后、超声后、静置1d后、静置2d后、静置3d后、静置4d后取洗脱液进行PSP测定, 以确定最佳洗脱时间; 将藻细胞提取液与空白海水按照体积比配制成高(1︰0)、中(1︰1)、低(1︰3)、极低(1︰7)四个浓度梯度的水体各500mL, 将优选树脂的树脂盘分别置于其中, 放置7d后取出, 以测定优选树脂的回收率。
1.3 实际应用研究建立的SPATT和SPE方法均在秦皇岛山海关贻贝养殖区展开实际应用, 实施时间为2019年3月25日-5月14日, 期间该海域发生了小规模亚历山大藻赤潮。共设置两个监测点S1和S2 (图 2), 每隔7d采集贻贝(Mytilus edulis)、海水及树脂盘, 同时布放新的已活化树脂盘。采集的贻贝用于PSP检测, 方法参考吴海燕等(2017);海水500mL用于浮游植物中产毒藻的鉴定与计数, 方法参考Utermöhl(1958);海水50mL用于SPE方法的PSP检测; 树脂盘用于SAPTT方法的PSP检测。
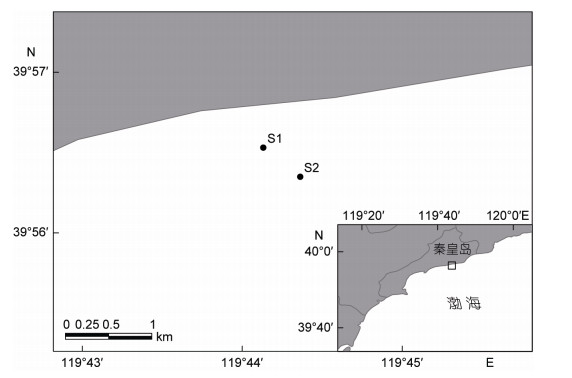 |
| 图 2 秦皇岛海域采样点设置 Fig. 2 Sampling sites in Qinhuangdao sea area |
(1) PSP各组分毒性大小以TEF换算成STX eq进行比较, 其中STX的TEF=1.00。具体计算公式如下:
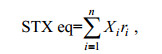 (1)
(1)式中, Xi为各PSP组分的含量; ri为毒性因子(Turner et al, 2015)。
(2) 基于SPE的水体中PSP检测方法对各PSP组分的回收率计算公式如下:
 (2)
(2)(3) 各PSP组分检出限及定量限的确定:以信噪比(signal to noise ratio, S/N≥3)的浓度确定检出限(limit of detection, LOD), 以信噪比(S/N≥10)的浓度确定定量限(limit of quantitation, LOQ)。
(4) 本文采用Origin 8.5、SPSS 23及Excel 2018等软件对实验数据进行整理与分析。
2 结果与讨论 2.1 基于SPE的水体中PSP检测方法确定及评价选用的ENVI-Carb填料包含高强度的大表面积球形粒子, 极易吸附强极性化合物(吴海燕等, 2017)。分别向三种ENVI-Carb固相萃取柱中添加相同体积的藻细胞提取液, 以筛选对水体中PSP吸附效果较好的固相萃取柱。如图 3所示, ENVI-Carb 250mg/3mL与ENVI-Carb 500mg/6mL商业化固相萃取柱均可有效吸附水体中所包含的9种PSP组分, 而1g自制ENVI-Carb固相萃取柱仅检测出5种组分。自制固相萃取柱由于粒径分布不均匀而导致理论塔板数较低, 因此即使填料重量增加, 毒素也无法得到有效保留。另外, ENVI-Carb 500mg/6mL固相萃取柱对每种组分的吸附量均高于ENVI-Carb 250mg/3mL, 这可能与填料重量较小的固相萃取柱出现吸附饱和现象有关。综上, 选取ENVI-Carb 500mg/6mL固相萃取柱作为优选材料。
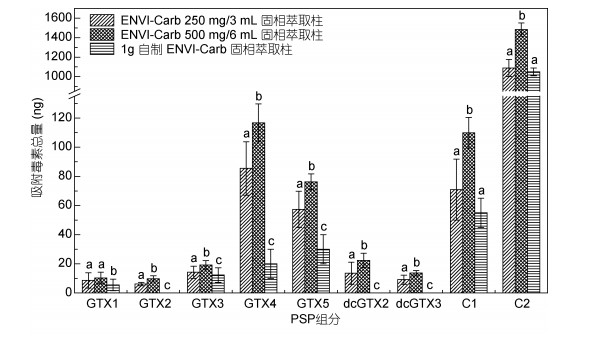 |
| 图 3 不同固相萃取柱对水体中PSP的吸附效果对比 Fig. 3 Comparison of adsorption effects of different solid phase extraction columns on PSP in water 注: a、b、c不同字母之间表示存在显著性差异(P < 0.05) |
分别向ENVI-Carb 500mg/6mL固相萃取柱中加入不同体积的藻细胞提取液, 并折算其回收率, 以确定最佳过样体积。结果表明:在上样体积5-50mL、毒素总量小于700ng STX eq时, 固相萃取柱对PSP的吸附总量(y)与过样体积(x)呈显著正相关, 拟合方程为y=9.989x-2.863, 相关系数R2为0.998, 样品回收率为77.6% ± 3.5%。综合考虑前处理时间及方法灵敏度, 同时避免上样量过大破坏固相萃取柱结构的可能性, 因此选择50mL作为上样体积, 其前处理时间约0.5h, 即满足快速精准检测的要求。
采用加入不同浓度梯度PSP混合标准溶液的方式, 以检测含量与理论含量的比值确定各组分的回收率, 以信噪比确定检出限(LOD)及定量限(LOQ)。结果表明: ENVI-Carb 500mg/6mL固相萃取柱对13种PSP组分的平均回收率为82.2%±10.0%, 其中C1最高为92.9%、dcGTX3最低为72.4%。稀释标准溶液经过固相萃取柱的被动吸附再次得到富集, 因此10ng/L混合标准溶液中的11种PSP组分均满足LOD要求, 而NEO、dcNEO由于离子通道杂质峰响应较强, 在浓度为20ng/L的混合标准溶液中方才满足LOD要求。各PSP组分经其混合标准溶液实际浓度换算得LOD及LOQ见表 1。此外, 本方法的LDO及LOQ均低于现有研究结果(Riccardi et al, 2018), 且涉及的毒素组分也较多, 因此更适合实际海水的检测。
| PSP组分 | 回收率(%) | 检出限(ng/L) | 定量限(ng/L) |
| STX | 89.8 | 10.0 | 40.0 |
| dcSTX | 79.0 | 10.0 | 40.0 |
| NEO | 80.1 | 20.0 | 100.0 |
| dcNEO | 81.6 | 20.0 | 100.0 |
| GTX1 | 90.9 | 12.3 | 49.2 |
| GTX2 | 87.7 | 9.44 | 37.8 |
| GTX3 | 84.8 | 4.0 | 16.0 |
| GTX4 | 73.7 | 4.0 | 16.0 |
| GTX5 | 75.3 | 10.0 | 40.0 |
| dcGTX2 | 83.3 | 13.6 | 57.4 |
| dcGTX3 | 72.4 | 4.0 | 16.0 |
| C1 | 92.9 | 13.4 | 53.6 |
| C2 | 77.2 | 4.0 | 16.0 |
PSP是一类非结晶、水溶性、高极性、不挥发的小分子物质, 常温条件下稳定性较好(李淑冰等, 2000), 因此在对比不同树脂的吸附效果时, 可直接将树脂盘放入PSP阳性水体中。由于水体毒素含量较低, 为避免吸附饱和现象, Rodríguez等(2011)在吸附树脂对比实验中选用的树脂填装重量仅为100mg, 而本研究采用的藻细胞提取液PSP含量远大于实际水体, 则可直接采用实际海域应用的填装重量10g。将四种类型的树脂分别置于相同体积的藻细胞提取液中, 以筛选对水体中PSP吸附效果较好的树脂。结果表明:四种树脂均可吸附水体所包含的9种PSP毒素组分且稳定性较好, 按吸附毒素总量从大到小排列为: SP207 > SP700 > SP70 > HP20(图 4)。除GTX2外, SP207对不同毒素组分的吸附量均明显高于其他三种树脂, 这是因为HP20、SP70、SP700均为芳香族系大孔吸附树脂, 而SP207是芳香族系衍生型大孔吸附树脂, 其是在芳香族系的骨架上结合了溴, 从而强化了疏水吸附力, 即更适合水溶性PSP的吸附。综上, 选取SP207作为优选吸附树脂。
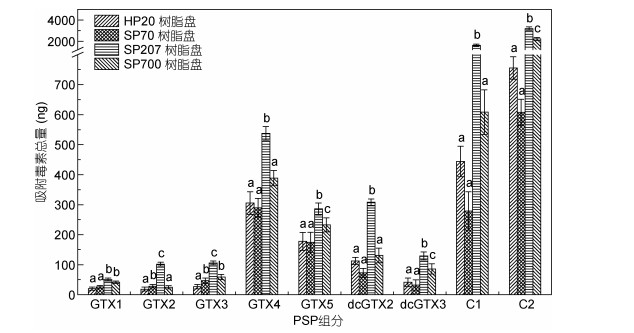 |
| 图 4 不同树脂盘对水体中PSP的吸附效果对比 Fig. 4 Comparison of adsorption effects of different resin discs on PSP in water 注: a、b、c不同字母之间表示存在显著性差异(P < 0.05) |
为避免LC-MS/MS分析由于定容溶液不同产生的误差, 因此直接选用75%乙腈水(含0.25%甲酸)作为树脂的洗脱溶剂, 并在Hattenrath-Lehmann等(2018)洗脱方法的基础上适当延长浸泡时间, 以对比不同处理步骤的洗脱效果。如图 5所示, 随SP207树脂洗脱过程的进行, 洗脱的毒素总量呈持续增加趋势。超声处理不仅可使树脂与洗脱溶剂充分接触, 还使洗脱总量增加到未超声的2.32倍。静置1d后洗脱含量增加最为显著, 毒素总量是超声后的2.05倍, 即延长树脂浸泡时间可大幅度提高洗脱效果。此外, 在静置2d、3d、4d后的洗脱总量虽也有所增加, 但效果并不明显。因此, 在实际应用中选择浸泡1d较为合适, 既可缩短实验时间, 也可显著提高洗脱效果, 更重要的是可避免由于浸泡时间过长而引起的树脂变性等问题。
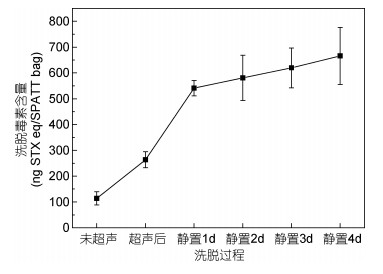 |
| 图 5 SP207树脂洗脱方法优化 Fig. 5 Optimization of SP207 resin elution method |
在有害赤潮暴发期间, 水体中的毒素含量一般呈先升后降的变化趋势(MacKenzie et al, 2004), 为达到SPATT监测结果准确反映水体中毒素消长规律的目的, 保证树脂的吸附稳定性是必要前提条件。用空白海水将藻细胞提取液稀释成四个不同浓度梯度的水体, 分别将SP207树脂盘放入其中。如图 6所示, SP207树脂的洗脱毒素总量与水体毒素总量呈显著正相关(R2=0.989), 即树脂吸附毒素能力十分稳定。由拟合方程可得SP207树脂的最终洗脱毒素总量约占水体毒素总量的9.20%, 而目前吸附PSP应用最多的SP700树脂的整体回收率仅为1% (Rodríguez et al, 2011)。然而, 实验所构造的环境无水体交换, 因此SP207树脂对于PSP的吸附灵敏度还需在实际海域中验证。
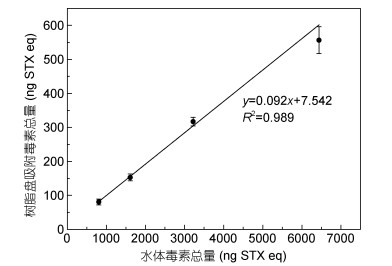 |
| 图 6 SP207树脂盘对水体中PSP的吸附回收率测定 Fig. 6 Determination of adsorption recovery of PSP in water by SP207 resin discs |
2019年秦皇岛山海关海域于三月下旬至五月中旬暴发了小规模有害赤潮, 经形态学鉴定确定肇事藻为亚历山大藻属(未定种), 最高藻细胞密度为3850cells/L, 已达到我国国家海洋局规定的闭海浓度103-104cells/L (田娟娟等, 2019), 贻贝富集PSP含量最高达985μg STX eq/kg, 已超过我国安全限量800μg STX eq/kg。在常规监测方法的基础上, 应用已优化的SPE及SPATT方法对水体中PSP进行监测。从整体变化趋势上来看, 4个监测结果呈现出基本一致的时空变化规律(图 7), S1站位较S2站位毒素分布更高, 即近岸的PSP污染情况较为严重。然而, SPE方法监测的水体中PSP含量(图 7a)与贻贝富集PSP含量(图 7c)、产毒藻密度(图 7d)同期达到最高值, 而SPATT方法监测的水体中PSP含量(图 7b)最高值却相对延迟一个采样周期。水体中的毒素含量随产毒藻密度的增加而增加(Lefebvre et al, 2008), 而树脂盘需经过7d的动态吸附过程, 因此造成SPATT方法的时效性较差, 这与相关研究表明SPATT可实现PSP提前预警不符(Rodríguez et al, 2011), 但不可否认其结果可表征上一监测周期贝类中毒素富集状况的作用(Li et al, 2017)。从毒素组分上看, SPE与SPATT方法都检测出贻贝中主要的4种膝沟藻毒素, 且毒素含量占比也均呈现出GTX1 > GTX4 > GTX3 > GTX2的规律。另外, 在监测初期, 贻贝蓄积PSP含量和产毒藻密度均较低时, SPE与SPATT方法也可检测到PSP的存在, 即所构建的两种方法均可满足实际海域监测要求。
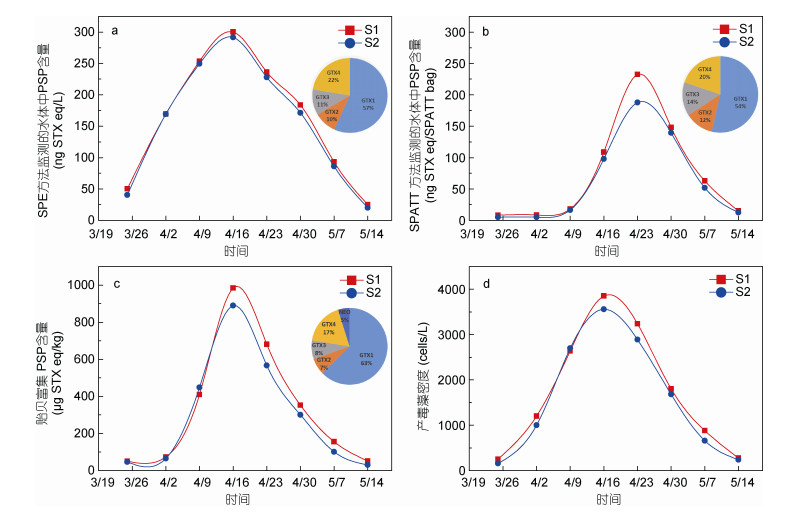 |
| 图 7 亚历山大藻赤潮过程中水体中毒素检测方法与常规监测方法的比较 Fig. 7 Comparison between detection methods of toxin in water and conventional monitoring methods during the Alexandrium bloom 注:曲线表示各要素随时间的变化, 饼状图表示PSP的毒素组分及其占比 |
为了达到贝类毒素有效预警的目的, 方法的时效性和灵敏度是最为重要的评价参数(王丹等, 2013)。通过自然暴露结果可见, 在有害赤潮初期(藻细胞密度 > 200cells/L), 贻贝富集PSP速率较缓慢; 当藻细胞密度 > 1000cells/L时, 贻贝富集PSP速率显著提升, 且两者同期达到最高值, 周期仅为14d, 这说明贻贝能在PSP赤潮爆发的短时间内迅速累积大量毒素(Qiu et al, 2018)。然而, 贝类毒素早期预警需至少提前一周进行监测结果的上报, 通过比较4月9日监测值可见, SPATT方法检测的PSP含量较低, 仅为18ng STX eq/SPATT bag, 而SPE方法检测的含量为254ng STX eq/L, 是其方法检出限的3.5倍。综上可得, SPE方法的时效性及灵敏度均显著优于SPATT, 因此该方法更适合作为PSP实时监测与提前预警的有效工具。从现有结果拟合得出:对于秦皇岛海域, 当SPE方法监测的水体中毒素含量达到100ng STX eq/L时, 两周后贻贝富集PSP含量将超出我国限量标准。然而, SPE方法应用于其他海域PSP监控预警的阈值还需根据现场监测结果设定。
3 结论本研究构建了基于SPE与SPATT的水体中PSP检测方法, 并在2016年秦皇岛贻贝中毒事件发生地的现场监测中比较了两种方法的监控预警效果。其中, SPE方法选用ENVI-Carb 500mg/6mL固相萃取柱, 过样体积为50mL, 13种PSP组分的平均回收率为82.2%±10.0%、检出限为4.0-20.0ng/L; SPATT方法选用SP207大孔吸附树脂, 洗脱时间为静置1d最佳, 整体回收率约为9.2%。现场监测结果表明, SPE方法的时效性及灵敏度均显著优于SPATT, 该方法可作为PSP监控预警的有效工具。对于秦皇岛海域, 当SPE方法检测的水体中PSP含量达到100ng STX eq/L时, 两周后该海域贻贝毒素富集含量将超出我国限量标准, 因此此时应提高监管频率并做好防控措施, 从而有效遏制贝类中毒事件的发生。
于仁成, 周名江. 1998. 麻痹性贝毒研究进展. 海洋与湖沼, 29(3): 330-338 |
王丹, 刘桂梅, 何恩业, 等. 2013. 有害藻华的预测技术和防灾减灾对策研究进展. 地球科学进展, 28(2): 233-242 |
田娟娟, 韩刚, 刘海棠, 等. 2019. 国内外麻痹性贝类毒素风险预警及管控措施的比对分析. 海洋环境科学, 38(3): 464-470 |
李淑冰, 李惠珍, 许旭萍. 2000. 贝毒素的研究现状及产生源探究. 食品科学, 21(5): 39-41 |
邴晓菲, 吴海燕, 王群, 等. 2017. 麻痹性贝类毒素在栉孔扇贝体内的代谢轮廓. 中国水产科学, 24(3): 623-632 |
吴海燕, 郭萌萌, 邴晓菲, 等. 2017. 液相色谱-四极杆/线性离子阱复合质谱测定双壳贝类中麻痹性贝类毒素. 海洋与湖沼, 48(3): 508-515 |
渠佩佩, 杨晶晶, 徐轶肖, 等. 2016. 固相吸附毒素跟踪技术(SPATT)在浙江南麂海域的应用. 海洋与湖沼, 47(4): 795-803 |
梁玉波, 李冬梅, 姚敬元, 等. 2019. 中国近海藻毒素及有毒微藻产毒原因种调查研究进展. 海洋与湖沼, 50(3): 511-524 |
Chang F H, Anderson D M, Kulis D M et al, 1997. Toxin production of Alexandrium minutum (Dinophyceae) from the Bay of Plenty, New Zealand. Toxicon, 35(3): 393-409 |
Fux E, Bire R, Hess P, 2009. Comparative accumulation and composition of lipophilic marine biotoxins in passive samplers and in mussels (M. edulis) on the West Coast of Ireland. Harmful Algae, 8(3): 523-537
|
Hattenrath-Lehmann T M, Lusty M W, Wallace R B et al, 2018. Evaluation of rapid, early warning approaches to track shellfish toxins associated with Dinophysis and Alexandrium blooms. Marine Drugs, 16(1): 28 |
Lefebvre K A, Bill B D, Erickson A et al, 2008. Characterization of intracellular and extracellular saxitoxin levels in both field and cultured Alexandrium spp. samples from Sequim Bay, Washington. Marine Drugs, 6(2): 103-116 |
Li M H, Sun G, Qiu J B et al, 2017. Occurrence and variation of lipophilic shellfish toxins in phytoplankton, shellfish and seawater samples from the aquaculture zone in the Yellow Sea, China. Toxicon, 127: 1-10 |
MacKenzie L, Beuzenberg V, Holland P et al, 2004. Solid phase adsorption toxin tracking (SPATT): a new monitoring tool that simulates the biotoxin contamination of filter feeding bivalves. Toxicon, 44(8): 901-918 |
Moreno-Pino M, Krock B, De la Iglesia R et al, 2018. Next Generation Sequencing and mass spectrometry reveal high taxonomic diversity and complex phytoplankton- phycotoxins patterns in Southeastern Pacific fjords. Toxicon, 151: 5-14 |
Pizarro G, Moroño Á, Paz B et al, 2013. Evaluation of passive samplers as a monitoring tool for early warning of Dinophysis toxins in shellfish. Marine Drugs, 11(10): 3823-3845 |
Qiu J B, Meng F P, Ding L et al, 2018. Dynamics of paralytic shellfish toxins and their metabolites during timecourse exposure of scallops Chlamys farreri and mussels Mytilus galloprovincialis to Alexandrium pacificum. Aquatic Toxicology, 200: 233-240 |
Riccardi C, Buiarelli F, Di Filippo P et al, 2018. Liquid chromatography–tandem mass spectrometry method for the screening of eight paralytic shellfish poisoning toxins, domoic acid, 13-desmethyl spirolide C, palytoxin and okadaic acid in seawater. Chromatographia, 81(2): 277-288 |
Rodil R, Quintana J B, López-Mahía P et al, 2009. Multi-residue analytical method for the determination of emerging pollutants in water by solid-phase extraction and liquid chromatography-tandem mass spectrometry. Journal of Chromatography A, . 1216(14): 2958-2969 |
Rodríguez P, Alfonso A, Turrell E et al, 2011. Study of solid phase adsorption of paralytic shellfish poisoning toxins (PSP) onto different resins. Harmful Algae, 10(5): 447-455 |
Roué M, Darius H T, Chinain M, 2018a. Solid phase adsorption toxin tracking (SPATT) technology for the monitoring of aquatic toxins: a review. Toxins, 10(4): 167 |
Roué M, Darius H T, Viallon J et al, 2018b. Application of solid phase adsorption toxin tracking (SPATT) devices for the field detection of Gambierdiscus toxins. Harmful Algae, 71: 40-49 |
Turner A D, McNabb P S, Harwood D T et al, 2015. Single- laboratory validation of a multitoxin ultra-performance LC-hydrophilic interaction LC-MS/MS method for quantitation of paralytic shellfish toxins in bivalve shellfish. Journal of AOAC International, 98(3): 609-621 |
Utermöhl H, 1958. Zur Vervollkommung der quantitativen phytoplankton-methodik. Mitt Int. Ver Limnol., 9: 38 |
Visciano P, Schirone M, Berti M et al, 2016. Marine biotoxins: occurrence, toxicity, regulatory limits and reference methods. Frontiers in Microbiology, 7: 1051 |
Wille K, Bussche J V, Noppe H et al, 2010. A validated analytical method for the determination of perfluorinated compounds in surface-, sea- and sewagewater using liquid chromatography coupled to time-of-flight mass spectrometry. Journal of Chromatography A, 1217(43): 6616-6622 |
Zhuo L Y, Yin Y C, Fu W S et al, 2013. Determination of paralytic shellfish poisoning toxins by HILIC–MS/MS coupled with dispersive solid phase extraction. Food Chemistry, 137(1-4): 115-121 |
 2020, Vol. 51
2020, Vol. 51


