
中国海洋湖沼学会主办。
文章信息
- 李卢国, 骆云慧, 徐善良. 2020.
- LI Lu-Guo, LUO Yun-Hui, XU Shan-Liang. 2020.
- 循环水养殖黑鲷(Acanthopagrus schlegelii)水体中循环率对水质因子和细菌群落多样性的影响
- EFFECTS OF FLOW RATE ON WATER QUALITY FACTORS AND MICROBIAL COMMUNITY IN RECIRCULATING AQUACULTURE SYSTEM FOR ACANTHOPAGRUS SCHLEGELII
- 海洋与湖沼, 51(2): 318-327
- Oceanologia et Limnologia Sinica, 51(2): 318-327.
- http://dx.doi.org/10.11693/hyhz20191100209
文章历史
-
收稿日期:2019-11-08
收修改稿日期:2019-12-11
2. 宁波大学海洋生物工程浙江省重点实验室 宁波 315211
2. Zhejiang Key Laboratory of Marine Bioengineering, Ningbo University, Ningbo 315211, China
黑鲷(Acanthopagrus schlegelii), 属硬骨鱼纲(Osteichthyes)、鲈形目(Perciformes)、鲷科(Sparidae), 系暖温性近海底层鱼类, 分布于北太平洋西部、中国沿海, 以黄、渤海产量较多(朱德芬, 1993), 现有黑鲷养殖以网箱和池塘为主(蒋万钊, 2011)。循环水养殖提供了一种高效利用水资源的养殖方式, 可大大降低养殖业对环境的污染程度, 且又具有养殖系统自身水质稳定、防病能力强等优势(王威等, 2012;王峰等, 2013; Wold et al, 2014)。循环率作为循环水养殖系统中一个重要的技术参数, 其可有效地影响循环水系统细菌多样性和去氨氮和亚硝态氮等营养盐的能力, 为很多研究者所重视, 如李雪晴(2018)、Fivelstad等(1994)、姚延丹等(2011)等。而对黑鲷循环水养殖模式的研究尚未见报道, 探究黑鲷循环水养殖中适合的循环率不仅可以提高黑鲷循环水饲养的效率, 同时还可避免能源浪费。
水产动物生活的水环境中有着丰富的微生物群落, 其对去除有害营养盐, 维持水环境稳态具有重要作用。当养殖环境水体理化性质改变时, 微生物群落结构会相应产生变化(Moriarty, 1997; Sugita et al, 2005; Balcázar et al, 2006)。基于16S rRNA的高通量测序技术, 主要基于细菌16S rRNA基因在功能上的高度保守性以及对应序列不同位点的高变性, 能够真实全面地反映样品中微生物群落结构的基本特征, 检测到纯培养和其他非培养技术未能发现的低丰度微生物种类(汤学敏等, 2012; Chen et al, 2018; Xu et al, 2019)。这方面的相关研究已有报道, 并发现不同循环率与养殖系统中的细菌群落及多样性具有相关性(Leonard et al, 2000;姚延丹等, 2011;张翔等, 2016)。
本文比较了不同循环率下黑鲷循环水养殖系统中水质和菌群结构及其多样性, 旨在为黑鲷的循环水养殖模式推广及健康养殖系统的建立提供理论依据。
1 材料与方法 1.1 循环水系统构建与试验设计本实验在象山港湾水产苗种有限公司进行, 黑鲷(Acanthopagrus schlegelii)幼鱼平均体重35±10g, 购自该公司。每个黑鲷循环水养殖系统由500L养殖圆桶和一个生物过滤桶通过出入水管组装而成。实验共设计3个循环率实验组, 每组3个重复共9个系统。每个养殖系统水体300L, 黑鲷幼鱼放养密度为6.5kg/m3。低循环率组(A), 4次/天; 中循环率组(B), 8次/天; 高循环率组, 12次/天(C)。
实验鱼在各自调节好流速的实验桶中暂养5d后开始实验, 实验周期为6周。实验期间, 水温18℃±0.5℃, 连续充气, DO≥5.9mg/L, 盐度25±1, pH 7.3±0.2, 自然光照。投喂海龙牌海水鱼饲料(粗蛋白≥44%, 粗脂肪≥5%)。每天上午9:00和下午16:00各投喂1次, 日投喂量为鱼体重的1 %。每天上午投喂前进行吸污, 并补水10%左右。
1.2 样品采集 1.2.1 水样采集分别在实验开始第2、7、14、21、28、35、42天采集水样。在上午投喂后4h, 分别用500mL水样瓶从每个系统的养殖桶和过滤桶出水口采集水样, 及时带回实验室用于分析氮磷营养盐指标。
1.2.2 微生物样品采集在实验中期的第3周(第21天), 分别采集三个实验组养殖桶水样中微生物(A1、B1、C1)和生物过滤桶中的微生物(A2、B2、C2)样品。分别在每个养殖桶采集1L水样, 同时在每个过滤桶中取滤料上的微生物样品, 每个滤桶样品约20g, 将滤料剪碎放入50mL离心管, 注入PBS缓冲液震荡, 使微生物脱离滤料表面, 收集水样。然后将养殖桶水样和过滤桶样品, 用0.22μm的无菌纤维素滤膜真空抽滤, 将抽滤后的滤膜取出放置于10mL的无菌离心管中, –80℃冰箱保存待送测。
1.3 氮磷营养盐检测水质指标氨氮(NH3)、亚硝酸盐(NO2)、硝酸盐(NO3)、磷酸盐(PO4)、总氮(TN)、总磷(TP)。按照GB/T 12763.4-2007海洋调查规范测定各水样营养盐含量(中华人民共和国国家质量监督检验检疫总局等, 2008)。经0.45μm纤维滤膜抽滤取25mL水样滤清液进行分析, 每个水样三个重复。
1.4 DNA提取及扩增测序利用水体环境基因组提取试剂盒Water DNA kit (Omega)对样本的基因组DNA进行提取1.5%琼脂糖凝胶电泳进行质量检测。以获取的DNA为模板, 用16S rRNA V3—V4区保守区通用引物进行PCR扩增。PCR产物使用2%浓度的琼脂糖凝胶进行电泳检测并剪切纯化回收产物后建库并测序。测序由诺和致源生物信息公司完成。
1.5 生物信息学分析对测序数据的预处理: (1)通过Cutadapt低质量部分剪切reads, 比对Barcode区分出样品分类数据, 经简化得到原始数据(raw reads); (2)为了得到有效数据(clean reads), 还需根据物种注释数据库比对Reads序列去除其中的嵌合体序列; (3)各样品OTUs (Operational Taxonomic Units)是通过Uparse软件以97%的一致性将clean reads聚类, 其后而成。
统计分析: (1)对OTUs序列进行物种注释分析得到各样本在各分类水平上的群落组成。(2)最后以样品中数据量最少的为标准对各样品的数据均一化处理, 所得的数据通过Qiime软件(Version 1.9.1)计算各样品数据的多样性指数和Unifrac距离、构建UPGMA样本聚类树。使用R软件(Version 2.15.3)绘制PCoA图。(3)对于环境因子关联分析, 使用vegan包对环境因子进行CCA分析。
2 结果与分析 2.1 不同循环率对水质指标的影响三个循环率组的水质因子变化如图 1所示, 活性磷酸盐浓度的变化范围在0.7—4.61mg/L, 其浓度随着循环率的增大有上升趋势, 随着养殖时间的延长, 三个流量组的变化规律一致, 呈逐渐上升的趋势。亚硝酸盐浓度的变化范围在0.08—0.95mg/L, 在实验期间三个流量组之间亚硝酸浓度并没有显著性差异(P > 0.05), 3组的变化规律也相似, 都先上升后下降的趋势, 在21d时达峰值; 硝酸盐浓度的变化范围在0.31—35.05mg/L, 在实验早期浓度波动较大, 在实验末高流量组显著低于低中流量组(P < 0.05);氨氮浓度的变化范围在1.22—7.65mg/L, 在实验第14天和第21天时, 高流量组氨氮浓度大于其他两组, 而在第28天后, 高流速组氨氮浓度均在中低流速组之下, 其中第35天时, 差异显著(P < 0.05)。总氮的变化范围在30.69—56.32mg/L, 高流速组总氮含量在第21天后开始下降, 低、中流速组则呈逐渐上升趋势; 总磷的变化范围在5.34—14.92mg/L, 3组变化趋势相同, 呈现先上升后下降的趋势, 在第7天达到最大值。
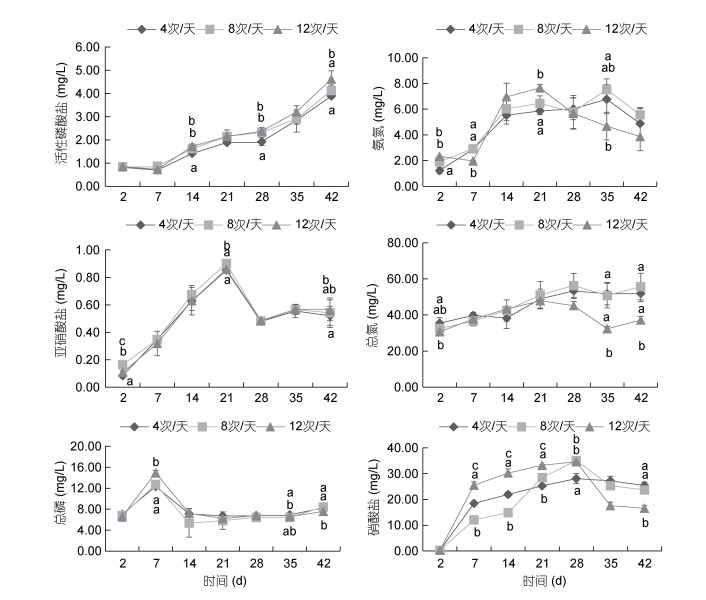 |
| 图 1 各实验组营养盐浓度 Fig. 1 The nutrient concentration of different experimental groups 注:数据上标不同表示组间存在显著差异(P < 0.05) |
通过对测序结果整理分析, 经过均一化的处理后, 如表 1所示, 6个样品最后得到有效序列在52418—80137条之间, 序列平均长度在402—408bp之间, 各组获得的有效OTU数量平均值为357.16, 其中各流量组养殖桶中的水环境OTU少于平均值, 生物桶中滤料上的OTU则多于平均值, 说明生物过滤桶中细菌丰富度更高。物种丰富度指数chao1、ACE、shannon指数显示, 生物过滤桶中的细菌群落丰富度和多样性均高于养殖桶, 其中, 高流量组和中流量组的生物过滤桶中细菌群落的丰富度和多样性要低于低流量组的。而在高流量组和中流量组的养殖桶中细菌群落的丰富度和多样性却高于低流量组的。三个实验组样品的测序覆盖率都超过了0.99, 说明测序数据覆盖了大部分OTU, 能很好地反映物种多样性。
| 样品 | 有效序列 | OTU | Chao1指数 | ACE指数 | 香农指数 | 测序覆盖率 |
| A1 | 80137 | 265 | 334.512 | 338.572 | 4.189 | 0.998 |
| B1 | 80108 | 300 | 373.077 | 373.71 | 4.617 | 0.998 |
| C1 | 52418 | 353 | 375.021 | 379.518 | 4.732 | 0.999 |
| A2 | 80038 | 438 | 474.833 | 469.108 | 6.024 | 0.999 |
| B2 | 80083 | 398 | 426.826 | 432.182 | 5.476 | 0.999 |
| C2 | 68400 | 389 | 440.771 | 442.323 | 5.895 | 0.998 |
选取每个样本门水平(Phylum)上最大丰度排名前10的物种, 生成物种相对丰度柱形累加图, 6个样品中的物种注释结果如图 2所示, 可以看出各样品细菌群落结构组成比较相似, 但同一类群的相对丰度存在较大区别。各样品中细菌种群主要分布在变形菌门(Proteobacteria)和拟杆菌门(Bacteroidetes), 在6个样品中所占的比例分别为58%—86%和8%—19%, 其他几个优势菌门分别是放线菌门(Actinobacteria, 0.8%—14%)、疣微菌门(Verrucomicrobia, 0.5%—3%)、厚壁菌门(Firmicutes, 0.2%—2%)等。
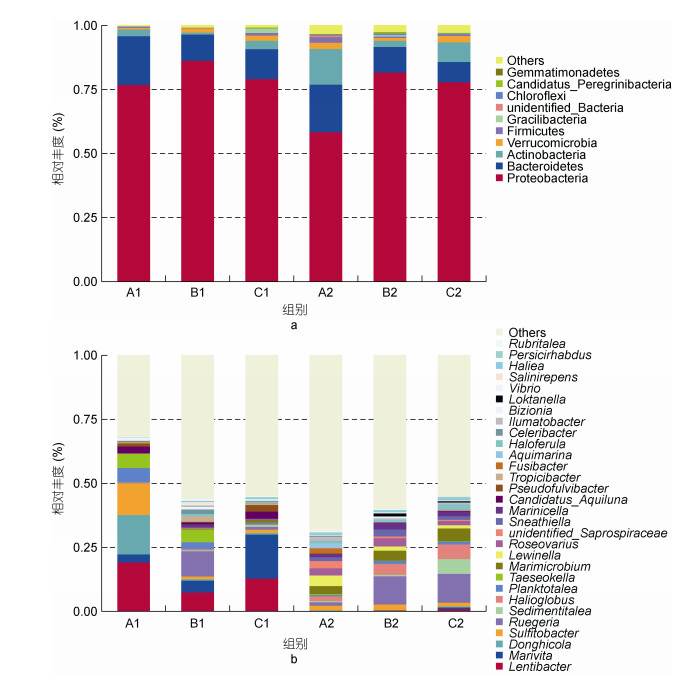 |
| 图 2 门水平(a)和属水平(b)上各样品细菌群落结构组成 Fig. 2 Bacterial community composition of each samples at levels of phylum (a) and genus (b) |
在属水平上, 选取最大相对丰度排名前30的物种, 生成如图 2所示柱型累加图。在6个样品中Lentibacter (0.3%—19%)、Marivita (0.09%—17%)、Donghicola (0.1%—15%)、Sulfitobacter (1%—12%)、Ruegeria (0.09%—11%)5个属的相对丰度最高, 其中来自红细菌科(Rhodobacteraceae)的Lentibacter和Marivita在养殖桶中占比(8%—19%, 3%—17%)明显高于过滤桶中的(0.3%—1%, 0.09%—0.7%)。
根据所有样本在属水平的物种注释及丰度信息, 选取丰度排名前35的属, 根据其在每个样本中的丰度信息进行聚类。聚类热图如图 3所示, 可以看出3组系统环境微生物中, 随着流量的上升, 斯氏弓形菌属(Arcobacter, 0.51%)、小纺锤状菌属(Fusibacter, 2.2%)、Aquimarina (2.1%)、弧菌属(Vibrio, 1.3%)、硫酸盐杆菌属(Sulfitobacter, 14%)、Donghicola (15.3%)相对丰度明显下降。而中、高流速组系统分别在系统内部环境微生物中少数几种属丰度明显升高, 中流量中包括陆丹氏菌属(Loktanella, 1.2%)、Bizionia (1.7%)、Salinirepens (1.1%)、乙醇速生杆菌属(Celeribacter, 2%)、Tropicibacter (2.1%); 高流量组中包括Sedimentitalea (6.7%)、Haloferula (2.5%)、Marivita (17.7%)。另外, 筛选出若干丰度不高, 但对水环境净化以及对水生物病害防控起到重要作用的功能性细菌以及对鱼体存在潜在致病性的细菌, 如图 4所示。可以看出, 样品中可检测到的条件致病菌为链球菌属(Streptococcus)。参与氮循环及与硝化功能相关的属包括亚硝化单胞菌属(Nitrosomonas)、黄杆菌属和蓝细菌(unidentified- Cyanobactia)。具有还原硫酸盐功能的属假单胞菌属(Pseudomonas)。具有调控水体微生物及病害防控功能的属乳杆菌属(Lactobacillus)。其中, 链球菌属的相对丰度随流量的升高而上升, 由0.075%上升至0.41%。亚硝化单胞菌属的相对丰度随流量的升高先下降后上升, 变化范围在0.003%—0.023%。黄杆菌属和蓝细菌的相对丰度都随流量的升高而上升, 分别由0.09%上升至0.3%和由0.07%上升至0.16%。假单胞菌属的相对丰度随流量的上升先上升后下降, 变化范围在0.08%—0.2%。乳杆菌属的相对丰度则随流量的上升先下降后上升, 变化范围在0.19%—0.5%。
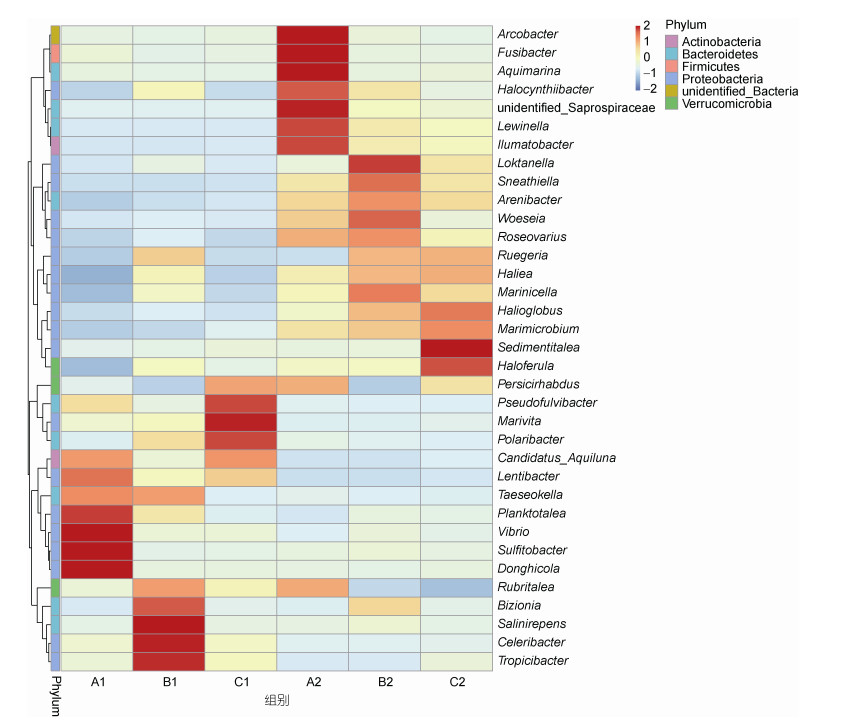 |
| 图 3 各样品优势细菌物种丰度热图 Fig. 3 Heatmap of the dominant bacteria in water samples of each samples |
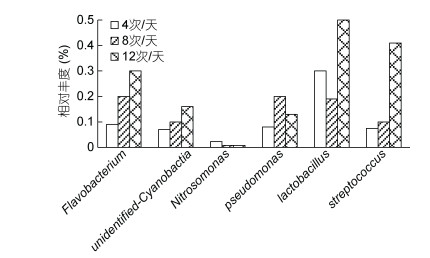 |
| 图 4 各组细菌特定属相对丰度变化 Fig. 4 Relative abundance changes of specific genus of each group |
主坐标分析(PCoA, Principal Co-ordinates Analysis), 是通过一系列的特征值和特征向量排序从多维数据中提取出最主要的元素和结构, 是一种研究数据相似性或差异性的可视化方法。本研究中, PC1贡献率为70.25%, PC2贡献率为18.06%, 累计贡献率达到了88.31%。由图 5a显示, 三个流量组的养殖水环境和生物过滤桶中的细菌群落存在明显差异。随着流速的升高, 其养殖桶中细菌群落结构不发生明显的改变, 而生物过滤桶中的细菌群落随着流速的上升, 中、高流速组相较于低流速组细菌群落结构发生了较明显的变化。
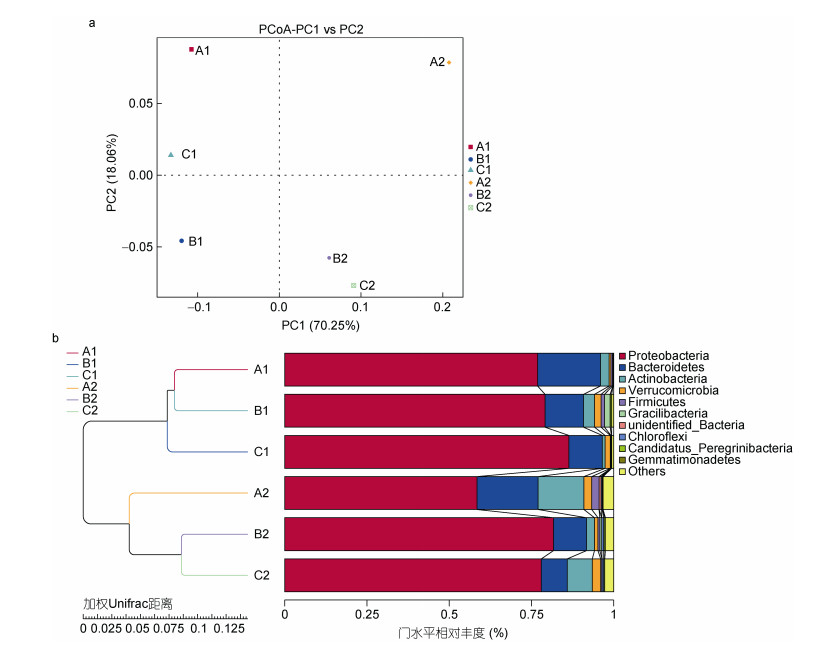 |
| 图 5 细菌群落主坐标分析图(a)和聚类分析图(b) Fig. 5 PCoA (a) and cluster (b) analysis plots of bacterioplankton |
对6个样本细菌群落结构进行聚类分析, 构建如图 5b所示的聚类树。结果显示, 三个流速组的养殖桶菌群结构聚为一类, 与3个流速组的生物过滤桶菌群有较大差异。在三组养殖桶菌群结构中, 中流量组又与低、高流量组有所不同; 而在各组生物过滤桶中, 低流速组则与中和高流速组有所差异。
2.5 细菌群落与环境因子的相关性分析菌群结构与环境因子的相关性结果可由多元直接梯度分析(CCA分析)所得, 该分析方法可反映整体菌群数据与实验环境因子的关系, 并进一步得到影响样本分布的重要环境驱动因子。从表 2可以看到细菌与环境之间的关系累积变化值达到了65.31%(第一排序轴CCA1和第二排序轴CCA2贡献率之和), 表中r2代表了环境因子对物种分布的决定系数, 其值与环境因子对物种分布影程度呈正相关。Pr表示相关性的显著性检验。6个环境因子中, 总磷、活性磷酸盐、亚硝酸盐和总氮含量与细菌群落丰富度和多样性密切相关。其中TN、TP与第一排序轴呈正相关, 其他营养盐与其呈负相关。但是总体而言, 这6个营养盐因子与菌群的分布无显著性影响(P > 0.05)。
| 理化因子 | CCA1 | CCA2 | r2 | Pr(> r) |
| PO43--P | –0.046 | –0.999 | 0.524 | 0.283 |
| NO2--N | –0.331 | –0.944 | 0.624 | 0.214 |
| NO3--N | –0.119 | –0.993 | 0.156 | 0.760 |
| NH4+-N | –0.020 | –1.000 | 0.074 | 0.885 |
| TN | 0.359 | –0.933 | 0.517 | 0.292 |
| TP | 0.469 | 0.883 | 0.831 | 0.072 |
循环率是循环水养殖系统中一个重要的技术参数, 适合的流量不仅有助于生物滤桶内基质的扩散和接触, 还可促进氨氧化菌的生长。Franco-Nava等(2004)和曹涵(2008)认为一定的流速会提高生物滤器的去除能力从而改善水质。本研究中, 三个实验组水质营养盐浓度检测结果显示, 在实验后期高流量组对氨氮和总氮的去除能力明显比其他两组强, 氨氮属于有害营养盐, 而总氮与水体有机物含量密切相关(Klausmeier et al, 2004;文世勇等, 2009)。这表明, 在系统运行稳定后, 高流量组对氨氮的去除能力及对水质的净化效果较其他两组更佳。在第21天的生物膜菌群也显示出中、高流量组中优势菌种氨氧化菌属Ruegeria相对丰度(21%, 12%)要明显高于低流速组(1.09%), Ruegeriam是α-Proteobacteria纲中Rhodobacteraceae红杆菌科中的一种紫色非硫菌, 可通过氨化作用降低水中化学需氧量(COD)(钦颖英等, 2007;黄志涛等, 2016)。但在实验中期(21d), 高流速组的氨氮含量却显著高于其他两组, 这可能跟高流速组黑鲷摄食能力更强, 日投饵量和代谢能力要高于其他两组, 加之功能菌群的滞后行使净化功能有关。另外, 在分析实验中期的3组系统环境菌群结构中发现高流速组中具有固氮作用功能菌属蓝细菌(unidentified-Cyanobactia)的丰度升高以及具有硝化作用功能的亚硝化单胞菌属(Nitrosomonas)丰度下降, 也造成了该时期高流量养殖系统中的氨氮更严重得积累。有研究表明循环水系统中溶解氧浓度会随流量的升高而升高(李雪晴, 2018), 在低流量下, 更易形成区域缺氧环境, 可能发生活跃的脱氮作用, 使环境硝酸盐含量降低, 并有利于具有脱氮作用的兼性厌氧菌的生长。本研究中低流速组的硝酸盐含量在第21天时显著低于其他两组, 可能原因就在于此, 并发现了低流量组优势菌种中具有反硝化功能的兼性厌氧菌的相对丰度要明显高于其他两组, 包括了斯氏弓形菌属(Arcobacter)、Woeseia和Donghicola。结合三组氨氮及亚硝酸盐浓度都在第21天开始下降, 推断三个流量组的生物过滤桶循在此时间点开始建立稳态的细菌生物膜并能有效地净化水质。随后, 对各实验组进行环境菌群取样, 分析三组之间细菌群落结构和多样性的差异以及其与环境因子相互关联分析。
鉴于微生物在海洋生态系统中的重要性, 微生物生态学的关键问题之一是微生物群落如何响应环境的变化。周洪玉等(2017)研究指出, 养殖环境中细菌群落的高多样性更有利于水体稳态, 减少病害的暴发。姚延丹等(2011)对比人工湿地-池塘养殖系统和传统养殖池塘的水体生物特征, 发现随着循环水的流量增大, 水环境中的细菌多样性也随之提高(姚延丹等, 2011)。本研究中, Alpha多样性分析结果显示, 随着流量的增加, 养殖桶中的OTU数量随之增加, 这与细菌多样性指数ACE、Chao1和Shannon指数的变化相同。而生物过滤桶中的OTU随着流量的升高呈下降趋势, 且高流量组的细菌多样性指数也比其他两组的要低。以上结果表明, 高流量虽然提高了养殖水环境细菌的多样性和丰度, 但却降低了生物过滤桶中细菌多样性和丰度。分析原因可能是:已有相关报道表明生物池过滤后的水样中细菌OTU总数较过滤前会有所提高(Leonard et al, 2000;张翔等, 2016), 这说明附着在滤料上的细菌会脱落进入水环境中, 而流量的提高会时细菌更容易脱落(姚延丹等, 2011)。但总体而言, 高流量组养殖水环境和生物滤桶中OTU数量之和(496)大于低流量组的OTU总数(486)和中流量组的OTU总数(460)。说明高流量更有利于水体稳态, 使水环境中的高浓度有害营养盐更快通过硝化作用回归正常值, 这与在第21天后的水质结果基本相似。另外, 本实验中, 对比了3组系统养殖桶和循环桶中优势菌群的相对丰度发现, 属上相对丰度最高且无运动能力的4个属Lentibacter、Marivita、Donghicola、Sulfitobacter在养殖桶中占比(最高分别是19%, 17%, 15%, 12%)要明显高于循环桶(最高分别是1%, 0.7%, 0.4%, 1%), 这是否与无运动能力的细菌遇到水流的作用更易脱落进入养殖桶中有关还需要进一步研究。
对海洋微生物群落的研究表明, Proteobacteria和Bacteroidetes是世界各地不同季节海水中的主要微生物群体(Gilbert et al, 2009; Tinta et al, 2015)。在淡水生境中, 许多关于河流, 湖泊和水库沉积物中细菌群落的报道已经显示出来类似的结果(Cheng et al, 2014)。在本研究中, 3个流量组中不管是养殖桶还是生物过滤桶中, Proteobacteria(58%—86%)丰度都是最高的。伴随着流量的提高, 3个组总体γ-Proteobacteria丰度也随之升高。据文献报道, γ-Proteobacteria类群广泛存在于是循环水健康养殖池及一些鱼类的皮肤、腮、肠道中(Roeselers et al, 2011), 且养殖水体好坏的与其丰度存在正相关, 丰度越高越有利于养殖动物的健康生长(Hu et al, 2007; Schreier et al, 2010;吴越等, 2017)。
有研究表明, 环境微生物的分布存在显着的区域差异, 具有类似功能的微生物往往聚集在一起(Xu et al, 2019)。本研究中, 三组流量组系统中丰度相似的优势属有9个。包括Marinicella、Roseovarius、Rubritalea、Lentibacter等功能性有益菌。另外14个优势属在三组系统中差异较大。其中, 低流量组优势属有6个, 包括条件致病菌斯氏弓形菌(Arcobacter)和弧菌属(Vibrio), 弧菌可引起大规模水产疾病发生并造成严重死亡(Higgins et al, 2007; Zhang et al, 2013);中流量组优势属有5个, 包括可降解多环芳烃的乙醇速生杆菌(Celeribacter)、Tropicibacter; 高流量组优势属有3个, 包括可生产细菌叶绿素a的Marivita。说明流量的变化会使环境微生物结构产生一些差异。通过聚类分析也可看出这一现象, 三组生物过滤桶细菌群落相似性要高于过滤桶和养殖桶之间的相似性, 说明在过滤桶这样更为复杂的环境中, 由于溶氧、光照、有无附着滤料等条件制约下, 会形
成与养殖桶截然不同的细菌结构, 这与吴越等(2017)的研究发现相一致。在过滤桶中, 中、高流量组细菌群落聚为一类。暗示了流量的升高会使生物滤膜趋向于选择和形成相似的细菌结构。而在低丰度菌群中, 黄杆菌属(Flavobacterium)、Haloferula和Lactobacillus有益菌在高流量组系统中占比相较于其他两组更高, 假单胞菌属(Pseudomonas)则在中流量组更高。有研究表明Flavobacteriu能在某些条件下将硝酸盐转化为各种还原性产物, 可降低养殖水体含氮量(Ma et al, 2013; Mcbride, 2014;张海耿等, 2017); Haloferula属于绿弯菌门, 其可通过自身生产的细菌叶绿素a进行光合作用(黄志涛等, 2016); Lactobacillus代谢可以产生有机酸、细菌素、过氧化氢、双乙酞等多种天然抑菌物质, 具有调节水体菌群平衡, 并可提高鱼体免疫力等多种功能(韩俊华, 2003)。假单胞菌属(Pseudomonas)可通过还原的硫酸盐来降低水体硫的含量。通过CCA分析, 发现环境因子和微生物种群之间相关性并没有显著相关性, 分析其原因可能是实验期间只探究了其实验中期一个时间点水质与环境微生物的相关性(P > 0.05), 会因为样本量过少造成相应的误差。
4 结论综上所述, 在本实验循环水条件运行过程中, 3个循环率组养殖桶中氨氮和亚硝态氮浓度均在实验开始后第21天开始下降, 说明3个组生物膜在第21天都已经挂膜稳定。3个循环率组养殖桶中菌群结构差异不明显, 而与3组过滤桶生物膜中菌群结构有较大差异, 且随着循环率增大, 生物膜中细菌结构也发生较明显的改变。其中有益菌属Marivita、黄杆菌属(Flavobacterium)、Ruegeria和Haloferula等在高循环率组中占比变高, 而潜在致病菌斯氏弓形菌(Arcobacter)和弧菌属(Vibrio)在中、高循环率组中占比变低。通过分析水样中营养盐与群落分布的相关性发现, 总磷、总氮、活性磷酸盐和亚硝酸盐含量虽然与细菌群落丰富度和多样性密切相关, 但没有显著性差异。本研究全面了解了不同循环率下养殖桶和循环桶中细菌群落结构和多样性。但由于微生物挂膜应该是一个动态的过程, 而此次试验仅在实验中期一个时间点采样, 今后应该研究增大采样时间点(比如实验系统运行后的前、中、后期)来改进, 全面了解水体各功能群体动态变化。
王威, 曲克明, 朱建新, 等. 2012. 3种滤料生物滤器的挂膜与黑鲷幼鱼循环水养殖效果. 中国水产科学, 19(5): 833-840 |
王峰, 雷霁霖, 高淳仁, 等. 2013. 国内外工厂化循环水养殖研究进展. 中国水产科学, 20(5): 1100-1111 |
中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会, 2008. GB 17378.4-2007海洋监测规范第4部分: 海水分析.北京: 中国标准出版社
|
文世勇, 赵冬至, 赵玲, 等. 2009. 基于氮磷比的赤潮灾害危险度评估方法研究. 中山大学学报(自然科学版), 48(2): 84-89 DOI:10.3321/j.issn:0529-6579.2009.02.018 |
朱德芬. 1993. 沿海鱼池黑鲷养殖试验. 水产学报, 17(1): 64-67 |
汤学敏, 郑江, 郝聚敏, 等. 2012. 现代微生物识别技术在水产养殖环境研究中的应用. 微生物学通报, 39(6): 835-842 |
李雪晴, 2018.循环水养殖系统中水流速度及多营养级复合养殖的实验研究.青岛: 青岛理工大学硕士学位论文
|
吴越, 马建忠, 郑伊诺, 等. 2017. 石斑鱼循环水养殖系统微生物群落结构. 中国水产科学, 24(5): 1045-1054 |
张翔, 闫茂仓, 肖国强, 等. 2016. 虾-贝-红树林耦合循环水养殖系统中微生物群落分析. 水生生物学报, 40(3): 557-564 |
张海耿, 宋红桥, 顾川川, 等. 2017. 基于高通量测序的流化床生物滤器细菌群落结构分析. 环境科学, 38(8): 3330-3338 |
周洪玉, 韩梅琳, 仇天雷, 等. 2017. 不同生物过滤系统铵态氮转化速率及生物膜特性分析. 环境科学, 38(6): 2444-2451 |
钦颖英, 李道棠, 杨虹. 2007. 给水生物预处理反应器的细菌种群多样性和群落结构. 应用与环境生物学报, 13(1): 104-107 DOI:10.3321/j.issn:1006-687X.2007.01.023 |
姚延丹, 李谷, 陶玲, 等. 2011. 复合人工湿地-池塘养殖生态系统细菌多样性研究. 环境科学与技术, 34(7): 50-55 DOI:10.3969/j.issn.1003-6504.2011.07.014 |
黄志涛, 宋协法, 李勋, 等. 2016. 基于高通量测序的石斑鱼循环水养殖生物滤池微生物群落分析. 农业工程学报, 32(S1): 242-247 |
曹涵, 2008.循环水养殖生物滤池滤料挂膜及其水处理效果研究.青岛: 中国海洋大学硕士学位论文
|
蒋万钊. 2011. 黑鲷养殖实用技术研究. 河北渔业, (9): 22-23 DOI:10.3969/j.issn.1004-6755.2011.09.007 |
韩俊华, 2003.嗜酸乳杆菌的益生特性及其在乳品中的应用.保定: 河北农业大学硕士学位论文
|
Balcázar J L, De Blas I, Ruiz-Zarzuela I et al, 2006. The role of probiotics in aquaculture. Veterinary Microbiology, 114(3-4): 173-186 DOI:10.1016/j.vetmic.2006.01.009 |
Chen X Y, Shao T Y, Long X H, 2018. Evaluation of the effects of different stocking densities on the sediment microbial community of juvenile hybrid grouper (♀ Epinephelus fuscoguttatus × ♂ Epinephelus lanceolatus) in recirculating aquaculture systems. PLoS One, 13(12): e0208544 DOI:10.1371/journal.pone.0208544 |
Cheng W, Zhang J X, Wang Z et al, 2014. Bacterial communities in sediments of a drinking water reservoir. Annals of Microbiology, 64(2): 875-878 |
Fivelstad S, Binde M, 1994. Effects of reduced waterflow (increased loading) in soft water on Atlantic salmon smolts (Salmo salar L.) while maintaining oxygen at constant level by oxygenation of the inlet water. Aquacultural Engineering, 13(3): 211-238 DOI:10.1016/0144-8609(94)90004-3 |
Franco-Nava M A, Blancheton J P, Deviller G et al, 2004. Effect of fish size and hydraulic regime on particulate organic matter dynamics in a recirculating aquaculture system: elemental carbon and nitrogen approach. Aquaculture, 239(1-4): 179-198 DOI:10.1016/j.aquaculture.2004.05.040 |
Gilbert J A, Field D, Swift P et al, 2009. The seasonal structure of microbial communities in the Western English Channel. Environmental Microbiology, 11(12): 3132-3139 DOI:10.1111/j.1462-2920.2009.02017.x |
Higgins D A, Pomianek M E, Kraml C M et al, 2007. The major Vibrio cholerae autoinducer and its role in virulence factor production. Nature, 450(7171): 883-886 DOI:10.1038/nature06284 |
Hu Z Y, Li Y, 2007. Pseudidiomarina sediminum sp. nov., a marine bacterium isolated from coastal sediments of Luoyuan Bay in China. International Journal of Systematic and Evolutionary Microbiology, 57(11): 2572-2577 DOI:10.1099/ijs.0.65199-0 |
Klausmeier C A, Litchman E, Daufresne T et al, 2004. Optimal nitrogen-to-phosphorus stoichiometry of phytoplankton. Nature, 429(6988): 171-174 DOI:10.1038/nature02454 |
Leonard N, Blancheton J P, Guiraud J P, 2000. Populations of heterotrophic bacteria in an experimental recirculating aquaculture system. Aquacultural Engineering, 22(1-2): 109-120 DOI:10.1016/S0144-8609(00)00035-2 |
Ma J X, Wang Z W, Yang Y et al, 2013. Correlating microbial community structure and composition with aeration intensity in submerged membrane bioreactors by 454 high-throughput pyrosequencing. Water Research, 47(2): 859-869 DOI:10.1016/j.watres.2012.11.013 |
McBride M J, 2014. The family Flavobacteriaceae. In: Rosenberg E, DeLong E F, Lory S et al eds. The Prokaryotes: Other Major Lineages of Bacteria and the Archaea. Berlin, Heidelberg: Springer
|
Moriarty D J W, 1997. The role of microorganisms in aquaculture ponds. Aquaculture, 151(1-4): 333-349 DOI:10.1016/S0044-8486(96)01487-1 |
Roeselers G, Mittge E K, Stephens W Z et al, 2011. Evidence for a core gut microbiota in the zebrafish. The ISME Journal, 5(10): 1595-1608 DOI:10.1038/ismej.2011.38 |
Schreier H J, Mirzoyan N, Saito K, 2010. Microbial diversity of biological filters in recirculating aquaculture systems. Current Opinion in Biotechnology, 21(3): 318-325 DOI:10.1016/j.copbio.2010.03.011 |
Sugita H, Nakamura H, Shimada T, 2005. Microbial communities associated with filter materials in recirculating aquaculture systems of freshwater fish. Aquaculture, 243(1-4): 403-409 DOI:10.1016/j.aquaculture.2004.09.028 |
Tinta T, Vojvoda J, Mozetič P et al, 2015. Bacterial community shift is induced by dynamic environmental parameters in a changing coastal ecosystem (northern Adriatic, northeastern Mediterranean Sea) - a 2-year time-series study. Environmental Microbiology, 17(10): 3581-3596 DOI:10.1111/1462-2920.12519 |
Wold P A, Holan A B, Øie G et al, 2014. Effects of membrane filtration on bacterial number and microbial diversity in marine recirculating aquaculture system (RAS) for Atlantic cod (Gadus morhua L.) production. Aquaculture, 422-423: 69-77 DOI:10.1016/j.aquaculture.2013.11.019 |
Xu H C, Wang L, Bao X Y et al, 2019. Microbial communities in sea cucumber (Apostichopus japonicus) culture pond and the effects of environmental factors. Aquaculture Research, 50(4): 1257-1268 DOI:10.1111/are.14002 |
Zhang L L, Orth K, 2013. Virulence determinants for Vibrio parahaemolyticus infection. Current Opinion in Microbiology, 16(1): 70-77 DOI:10.1016/j.mib.2013.02.002 |
 2020, Vol. 51
2020, Vol. 51


