中国海洋湖沼学会主办。
文章信息
- 李倩, 郭建林, 王雨辰, 姜建湖, 孙丽慧, 宓国强, 陈建明, 顾志敏. 2020.
- LI Qian, GUO Jian-Lin, WANG Yu-Chen, JIANG Jian-Hu, SUN Li-Hui, MI Guo-Qiang, CHEN Jian-Ming, GU Zhi-Min. 2020.
- 池塘内循环流水养殖下太湖鲂鲌(翘嘴鲌(♀)×三角鲂(♂))肠道微生物群落变化的研究
- ON CHANGES OF INTESTINAL MICROBIOTA OF A NEW HYBRID STRAIN OF (FEMALE CULTER ALBURNUS)×(MALE MEGALOBRAMA TERMINALIS) REARED IN IN-POND RACEWAY AQUACULTURE SYSTEM
- 海洋与湖沼, 51(2): 364-370
- Oceanologia et Limnologia Sinica, 51(2): 364-370.
- http://dx.doi.org/10.11693/hyhz20191200266
文章历史
-
收稿日期:2019-12-19
收修改稿日期:2020-01-18
池塘内循环流水养殖系统(in-pond raceway system, IPRS), 又称为跑道养殖系统, 2007年首次在美国阿拉巴马州的鲶鱼商业化养殖中获得成功(Brown et al, 2011)。该模式于2013年引进我国, 据统计, 截止2016年, 我国IPR面积约15.7ha, 并逐渐在江苏、浙江、安徽、上海等地推广应用(胡廷尖等, 2018)。池塘内循环流水养殖通过现代土建工程对传统养殖池塘进行改造, 其基本单元包括推水区、养殖区和净化区(金武等, 2015)。该模式具有养殖密度高、占地面积小、管理方便等优点, 已经在鲶鱼(Brown et al, 2011)、南美白对虾(廖思明等, 2006)、虹鳟(D’Orbcastel et al, 2009)等品种上成功应用。
池塘内循环流水养殖具有推水单元和不间断增氧的优点, 和传统池塘养殖相比, 养殖密度是后者的数十倍以上。在高密度养殖条件下, 养殖对象的肠道健康显得尤为重要。肠道微生物与养殖生物的健康有着密切的关系, 肠道菌群在宿主的代谢(Tremaroli et al, 2012)、生长(Turnbaugh et al, 2009; Zheng et al, 2016)和免疫(Qi et al, 2017)等方面发挥着重要作用, 是维持动物健康的必要因素。已有研究表明, 环境因子(Wang et al, 2014; Abdul et al, 2019)、养殖方式(刘瑞娟等, 2014; 尚碧娇等, 2018)、饲料营养(Ingerslev et al, 2014; Zheng et al, 2018)等因素会显著影响动物肠道微生物群落的组成。目前对池塘内循环流水养殖模式的研究主要集中在高产量、系统设计、养殖单元污染物的去除等方面, 而有关池塘内循环流水养殖对象肠道微生物方面的研究鲜有报道。
太湖鲂鲌(翘嘴鲌(♀)×三角鲂(♂))(femaleCulter alburnus Basilewsky × male Megalobrama terminalis)是本所通过属间远缘杂交获得的新品种, 具有体型优(顾志敏等, 2008)、生长快(贾永义等, 2011)、肌间刺少(蒋文枰等, 2016)等杂种优势, 适合IPR高密度养殖, 具有较好的经济效益和较大的养殖前景。本研究以太湖鲂鲌为研究对象, 采用16S rRNA高通量测序技术, 对IPR养殖模式下太湖鲂鲌的肠道微生物和养殖水体环境微生物群落组成进行了分析, 并以普通池塘养殖为对照, 研究IPR养殖模式下太湖鲂鲌肠道菌群的变化, 为太湖鲂鲌肠道健康提供基础数据, 为IPR养殖管理提供技术参考。
1 材料与方法 1.1 采样地点与时间试验用IPR位于浙江省淡水水产研究所八里店综合试验基地, 长22m, 宽5m, 高2m, 实际水深1.5m。养殖对象为本所自主培育的太湖鲂鲌(female Culter alburnus Basilewsky × male Megalobrama terminalis), 初始体重为517.15±12.79g, 放养密度为19.5kg/m3。对照组池塘面积1333.4m2, 养殖密度为1.29kg/m3, 初始体重和试验组相同。每天早晚各投喂一次, 投喂量为鱼体质量的2%, 养殖试验从2018年5月8日开始, 养殖时间90d, 试验结束时, IPR组平均体质量为(863.28±22.44)g, 对照组平均体质量为(1007.65±35.66)g。试验结束时, 用无菌剪刀将肠道组织剪开, 并用解剖刀轻轻刮取内溶物, 试验组和对照组随机采集鱼10尾, 将肠道内容物混合为一个样品。无菌方式采集试验组和对照池塘水样2L, 经0.22μm滤膜过滤后, 所有样品保存于–80℃冰箱备用。
1.2 DNA提取及PCR扩增无菌条件下取出滤膜, 剪碎后放置于1.5mL离心管中, 参照DNA提取试剂盒E.Z.N.A. Water DNA Kit (OMEGA Biotech, 美国)方法提取基因组DNA。称取1g肠道样品, 参照土壤核酸提取试剂盒(OMEGA Biotech, 美国)说明步骤提取肠道总DNA。16S rRNA基因测序以V3和V4区为目标设计引物, 引物序列为338F (5′-ACTCCTACGGGAGGCAGCAG-3’)和806R (5′-GGACTACHVGGGTWTCTAAT-3’)。PCR采用TransGen AP221-02, 反应体系20μL: 5×FastPfu缓冲液4μL、2.5mmol/L dNTPs 2μL、5μmol/L上下游引物各0.8μL、FastPfu聚合酶0.4μL、BSA 0.2μL、DNA模板10ng, 补ddH2O至20μL。PCR反应条件: 95℃ 3min; 95℃ 30s, 53℃ 45s, 72℃ 1min, 28个循环; 72℃延伸10min。PCR反应在PCR反应仪9700 (Applied Biosystems® GeneAmp®, CA, 美国)上进行。扩增完成后的PCR产物使用Beads纯化之后进行上机测序, 测序委托上海美吉生物医药科技有限公司(上海, 中国)进行。
1.3 数据分析对测序得到的原始数据, 首先根据PE reads之间的overlap关系进行拼接, 之后同时对reads的质量和拼接效果进行质控过滤, 根据序列首尾两端的barcode和引物序列区分样品得到有效序列, 并校正序列方向, 即为优化数据(Callahan et al, 2016)。对最终获得Clean数据归一化之后, 按照97%相似性进行OTUs (Operational taxonomic units, OTU)聚类分析和物种分类学分析。采用QIIME软件(http://qiime.org/scripts/assign_taxonomy.html)对样品序列进行Alpha多样性分析, 采用Excel进行样品的柱状图、OTU稀释曲线图绘制, 采用R语言和Adobe Illustrator CS6软件绘制样品热图和Venn图。
2 结果与分析 2.1 测序质量分析本试验总共获得226516条有效序列, 试验组和对照组获得的有效序列数分别为69300和52559, 对应养殖水体获得的有效序列数分别为58162和46495。利用测得序列中已知OTU的相对比例与其相对应的OTU数量的期望值构建稀释曲线, 结果显示, 各样品曲线都趋于平缓, 说明测序深度基本能够覆盖样品中的所有物种(图 1)。
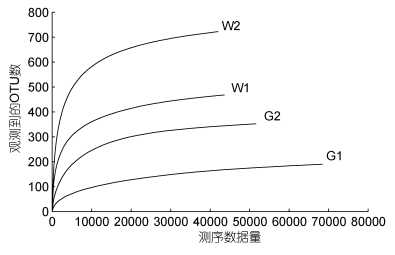 |
| 图 1 肠道和水体样本菌群的OTU稀释性曲线图 Fig. 1 The OTU rarefaction curve of microflora in the gut and water samples 注: G1、G2为IPR组和对照组鱼肠道样本, W1、W2为IPR组和对照组水体样本, 下同 |
将所有样本中相对丰度小于1%的物种归为其他, 图 2为各样本在门分类水平的细菌群落组成图。在G1中, 梭杆菌门(Fusobacteria)为绝对优势菌, 所占丰度为92.47%;在G2中, 优势菌有三个门, 分别为梭杆菌门、变形菌门(Proteobacteria)、厚壁菌门(Firmicutes), 三者的相对丰度分别为34.45%、33.30%和21.30%。对应养殖水体中的优势菌和肠道不同, W1中的优势菌为蓝细菌(Cyanobacteria), 相对丰度为36.53%, 其次为放线菌门(Actinobacteria; 24.67%)。W2中的优势菌为放线菌门和变形菌门, 分别占细菌总数的38.99%和28.15%。
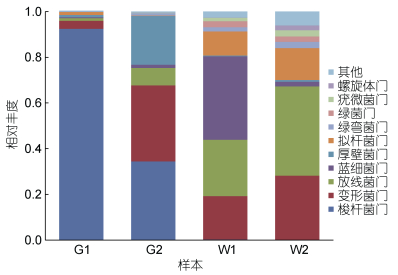 |
| 图 2 样品在门分类水平的细菌种群丰度图 Fig. 2 The relative abundance of bacterial communities in all the samples at phylum level |
与门水平相同, G1的绝对优势菌为梭杆菌纲(Fusobacteriia), 相对丰度为92.47%, G2的优势菌有3个, 分别为梭杆菌纲(Fusobacteriia)、γ-变形菌纲(Gammaproteobacteria)、丹毒丝菌纲(Erysipelotrichia), 相对丰度分别为34.45%、29.02%、19.82%。水环境中的优势菌和肠道样本不同, W1中丰度排名靠前的为蓝细菌纲和放线菌纲(Actinobacteria), 所占比例为36.53%、24.67%; W2中丰度较高的前3个纲分别为放线菌纲、鞘脂杆菌纲(Sphingobacteriia)、β-变形菌纲(Betaproteobacteria), 所占比例分别为38.99%、11.56%、10.59% (表 1)。
| 项目名称 | 样本 | |||
| G1 | G2 | W1 | W2 | |
| 梭杆菌Fusobacteriia | 92.465 | 34.445 | 0.333 | 0.110 |
| 放线菌Actinobacteria | 1.156 | 7.589 | 24.674 | 38.986 |
| 鞘脂杆菌 Sphingobacteriia |
0.007 | 0.043 | 7.331 | 11.559 |
| 绿硫菌Chlorobia | 0 | 0.002 | 2.630 | 2.358 |
| 蓝细菌Cyanobacteria | 0.443 | 1.424 | 36.527 | 2.017 |
| 丹毒丝菌 Erysipelotrichia |
0.003 | 19.821 | 0.002 | 0.012 |
| α-变形菌 Alphaproteobacteria |
0.211 | 2.756 | 6.534 | 6.838 |
| β-变形菌 Betaproteobacteria |
0.218 | 1.155 | 9.911 | 10.586 |
| δ-变形菌 Deltaproteobacteria |
0.063 | 0.298 | 1.276 | 6.090 |
| γ-变形菌纲 Gammaproteobacteria |
3.024 | 29.015 | 1.173 | 4.256 |
| 螺旋体菌 Saccharibacteria |
0.006 | 0.051 | 0.154 | 2.158 |
| 其他 | 2.405 | 3.402 | 9.454 | 15.031 |
| 注:将所有样本中相对丰度小于2%的种类归为其他 | ||||
筛选出每个样本中相对丰度最高的前20种OTU所对应的细菌, 在属水平上对每个样品的细菌分布进行热图统计分析(图 3)。结果表明, 两个肠道微生物样本优势菌相同, 均为鲸杆菌属(Cetobacterium), 但所占比例不同。G1中鲸杆菌属为绝对优势菌, 所占丰度为91.67%, 而G2的优势菌除鲸杆菌属(34.43%)外, 还发现一定比例的弧菌(Vibrio)(26.08%)。在环境样本中, W1的优势菌为聚球藻(Synechococcus)(29.28%)、hgcI_clade(11.68%), W2中优势菌为hgcI_ clade(20.31%)。图顶端为样品间聚类关系树, 结果显示肠道样本聚为一支, 水体样本聚为另一支。此外, 在属水平出现了大量未能鉴别或无法分类的细菌。
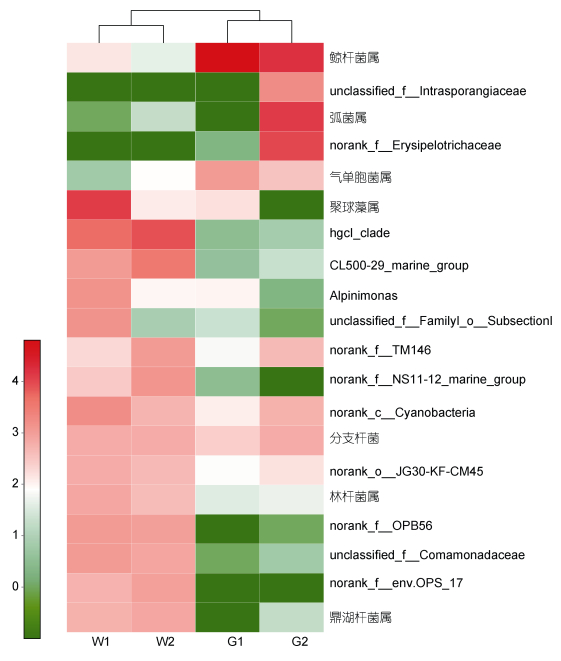 |
| 图 3 各样品中丰度最高的前20种OTU分布的热图分析 Fig. 3 Heatmap analysis of the top 20 OTUs in abundance of the samples 注:数值经lg处理, 颜色条代表相对丰度大小 |
为详细分析环境和养殖对象肠道微生物的异同, 本研究采用Venn图分析了4个样本在OTU水平上的组成相似性及重叠情况。图 4表明, 两个肠道样本G1和G2中分别有190个和352个OTUs, 共有的OTUs数为134个(图 4a), 水体样本W1和W2分别有468和722个OTUs, 共有的OTUs数为416个(图 4b)。从环境和养殖对象肠道微生物群落分析, W1和G1共有的OTUs为117个, G1中61.58%的OTUs可以在W1中找到(图 4c), W2和G2共有的OTUs数为223个, G2中63.35%的OTUs可以在W2中找到(图 4d)。共有OTUs数大小为, W1 & W2(416) > W2 & G2(223)G1 & G2 > (134) > W1 & G1(117)。
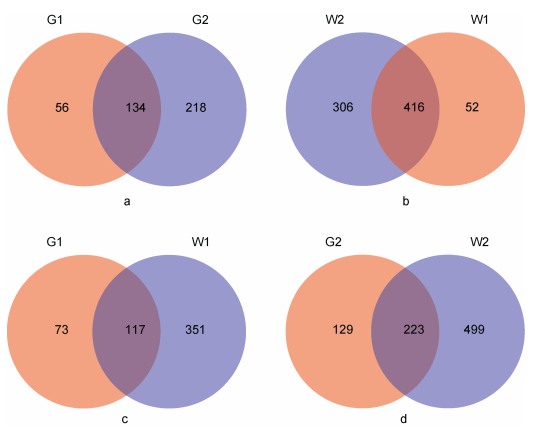 |
| 图 4 肠道和水体微生物OTU韦恩图 Fig. 4 The Venn diagram of the OTU of microflora in the gut and water samples 注:图中数字为各组样本中OTU的数量 |
在97%相似性水平下共观测到1732个物种, 各样本多样性指数见表 2。结果显示, 养殖水体中的OTU数、Chao1指数和香农多样性指数高于肠道样本。W2的微生物种类、多样性以及丰富度最高, G1物种数目和多样性则最低, 微生物群落均一性也最低。肠道样本中, G1微生物群落多样性指数低于对照组。
| 样本 | OTUs | Chao1 指数 |
辛普森 指数 |
香农 指数 |
均一性 指数 |
| G1 | 190 | 273.22 | 0.81 | 0.69 | 0.13 |
| G2 | 352 | 722.53 | 0.18 | 2.30 | 0.39 |
| W1 | 468 | 505.66 | 0.07 | 4.11 | 0.67 |
| W2 | 722 | 779.06 | 0.02 | 5.09 | 0.77 |
本研究采用细菌16S rRNA高通量测序技术分析了普通池塘和IPR中太湖鲂鲌肠道及养殖水体的微生物群落结构组成。结果表明, 与对照组相比, IPR组太湖鲂鲌肠道和养殖水体中的微生物多样性、菌群的均一性均降低, 优势菌所占比例发生较大改变。在属水平, IPR组鱼体肠道中, 鲸杆菌(Cetobacterium)成为绝对优势菌, 所占丰度为92.47%。鲸杆菌是一种兼性厌氧有益菌, 是许多鱼类肠道细菌群落的核心菌群, 涉及维生素B12的合成(Sugita et al, 1991; Tsuchiya et al, 2008)。有研究表明, 鱼体长期暴露在氨氮等胁迫性因子环境中时会产生氧化应激反应, 造成组织损伤和免疫毒性(Benli et al, 2008; Foss et al, 2009), 当水体中氨氮含量达到10mg/L时, 鲫鱼肠道中鲸杆菌的丰度显著增加, 其抗氧化酶相关基因表达上调(Qi et al, 2017)。IPR养殖密度高、投饵量大、水体中氨氮含量较高, 鱼体肠道菌群中鲸杆菌丰度的增加, 可能为抵抗氨氮胁迫造成的应激反应。同时, 本研究结果发现,
弧菌属(Vibrio)在对照组中相对丰度较高, 所占丰度为26.08%, 是第二优势菌, 这与前人的研究结果(许燕等, 2018)类似, 可能与养殖对象处于亚健康状态有关。本研究结果表明, 在门和目水平, IPR组太湖鲂鲌肠道中优势菌的种类结构变化较小, 但优势菌的相对丰度发生明显变化。在属水平, IPR组肠道微生物种类和丰度都发生了明显的改变, 说明IPR养殖环境对太湖鲂鲌的肠道细菌群落的结构产生了一定的影响, 但具体是哪些水环境因子对养殖对象的肠道菌群有显著影响, 有待进一步研究。
3.2 养殖环境和肠道微生物群落结构的关系养殖环境中存在大量的微生物类群, 它们参与养殖系统的物质循环和水质调节, 并直接影响鱼类的健康状况(Cheng et al, 2015; 薛明等, 2017)。本研究中, 在不同的分类学水平上, 虽然两种养殖水体绝对优势菌的种类并不完全相同, 但是两者均有共同的优势菌。如在门分类水平, 两种养殖水体中的优势菌均含有放线菌; 在目和属水平, 两种养殖模式养殖水体中的优势菌包括弗兰克氏菌(Frankiales)和hgcI_clade。Venn图结果表明, W1和W2具有416个共同的OTUs, W1中有57.62%的OTUs可以在W2中找到, 说明两种养殖模式水环境中的微生物群落结构有较高的相似性。从肠道微生物和养殖水体微生物群落分析, 在对照组中, W2和G2共有的OTUs占肠道微生物群落总数的63.35%。在试验组中, 二者共有的OTUs占肠道样本的61.58%, 说明养殖水体和肠道样本的微生物群落具有较高的相似性。
3.3 IPR对太湖鲂鲌肠道微生物群落结构多样性的影响细菌多样性在维持生态功能方面有重要作用, 已有研究表明, 多样性的降低可能导致细菌群落功能稳定性的降低, 从而增加养殖生物患病的风险(刘晶晶等, 2010; Jones et al, 2010; 刘志刚等, 2018)。在对照组鱼体肠道中, 共发现了352个OTU, 然而在IPR组中, OTU数目仅有190个, 养殖对象肠道微生物群落Shannon多样性指数、Chao1指数发生明显的下降。从Simpson指数分析, IPR组对象肠道中Simpson指数大于对照组, 其值越大, 说明群落多样性越低, 与Shannon多样性指数相一致(表 2)。这些结果均表明, 高密度的IPR养殖模式降低了养殖对象肠道微生物的多样性。在IPR组, 鱼体肠道中出现了大量的鲸杆菌属, 而变形菌门、厚壁菌门等种类的丰度降低, 同时, 条件致病菌气单胞菌属(Aeromonas)所占丰度比例有所上升, 说明在高密度IPR养殖模式下, 养殖对象肠道微生物群落结构发生了一定的改变。已有报道表明(Xiong et al, 2015; 吴金凤等, 2016), 发病组动物肠道中细菌多样性相对于健康组有较大幅度的下降, 本研究样本虽然没有出现发病情况, 但IPR高密度养殖模式中鱼体肠道微生物群落的改变及多样性的降低可能是一种应激预警。
4 结论本研究采用16S rRNA高通量测序方法研究了IPR高密度养殖模式下, 太湖鲂鲌肠道菌群的变化情况, 结果表明: IPR高密度养殖模式下, 太湖鲂鲌的肠道菌群结构发生了明显的变化, 同时, 鱼体肠道微生物的多样性降低。本研究结果提示, 池塘内循环流水高密度养殖要注意优化养殖密度、加强养殖管理, 预防因理化因子变化而导致大规模疾病的暴发。
刘志刚, 卢迈新, 可小丽, 等. 2018. 尼罗罗非鱼肠道及养殖环境中菌群结构与链球菌病的相关性. 水产学报, 42(10): 1635-1647 |
刘晶晶, 曾江宁, 陈全震, 等. 2010. 象山港网箱养殖区水体和沉积物的细菌生态分布. 生态学报, 20(2): 377-388 |
刘瑞娟, 田相利, 董双林, 等. 2014. 蟹虾贝混养池塘生态系统微生物群落功能多样性研究. 水产科学, 33(9): 535-544 DOI:10.3969/j.issn.1003-1111.2014.09.001 |
许燕, 王印庚, 张正, 等. 2018. 不同健康程度和抗生素氟苯尼考干预下斑石鲷肠道菌群的结构差异. 水产学报, 42(3): 388-398 |
吴金凤, 熊金波, 王欣, 等. 2016. 肠道菌群对凡纳滨对虾健康的指示作用. 应用生态学报, 27(2): 611-621 |
尚碧娇, 左志晗, 窦春萌, 等. 2018. 高通量测序法分析两株益生菌对凡纳滨对虾肠道菌群结构的影响. 水产学报, 42(12): 1967-1976 |
金武, 罗荣彪, 顾若波, 等. 2015. 池塘工程化养殖系统研究综述. 渔业现代化, 42(1): 32-37 DOI:10.3969/j.issn.1007-9580.2015.01.008 |
胡廷尖, 李倩, 程海华, 等. 2018. PIECs技术参数优化探究及模式设计比较. 水产养殖, 39(3): 1-3 DOI:10.3969/j.issn.1004-2091.2018.03.001 |
贾永义, 顾志敏, 叶金云, 等. 2011. 翘嘴红鲌(♀)×团头鲂(♂)杂种F1的SRAP标记分析. 上海海洋大学学报, 20(2): 198-203 |
顾志敏, 贾永义, 叶金云, 等. 2008. 翘嘴红鲌(♀)×团头鲂(♂)杂种F1的形态特征及遗传分析. 水产学报, 32(4): 533-544 |
蒋文枰, 贾永义, 刘士力, 等. 2016. 鲌鲂F1、F2及其亲本肌间骨的比较分析. 水生生物学报, 40(2): 277-286 |
廖思明, 王志成, 李祥兴, 等. 2006. 跑道式对虾养殖生态系主要生态因子研究. 水产科学, 25(4): 166-170 DOI:10.3969/j.issn.1003-1111.2006.04.002 |
薛明, 何瑶瑶, 邱孟德, 等. 2017. 高通量测序分析凡纳滨对虾育苗期水体菌群结构特征. 水产学报, 41(5): 785-794 |
Abdul R S, Griffin M J, Mischke C C et al, 2019. Biotic and abiotic factors influencing channel catfish egg and gut microbiome dynamics during early life stages. Aquaculture, 498: 556-567 DOI:10.1016/j.aquaculture.2018.08.073 |
Benli A K, K ksal G, zkul A., 2008. Sublethal ammonia exposure of Nile tilapia (Oreochromis niloticus L. ):effects on gill, liver and kidney histology. Chemosphere, 72(9): 1355-1358 |
Brown T W, Chappell J A, Boyd C E., 2011. A commercial-scale, in-pond raceway system for Ictalurid catfish production. Aquacultural Engineering, 44(3): 72-79 DOI:10.1016/j.aquaeng.2011.03.003 |
Callahan B J, McMurdie P J, Rosen M J et al, 2016. DADA2:high-resolution sample inference from Illumina amplicon data. Nature Methods, 13(7): 581-583 DOI:10.1038/nmeth.3869 |
Cheng C H, Yang F F, Ling R Z et al, 2015. Effects of ammonia exposure on apoptosis, oxidative stress and immune response in pufferfish (Takifugu obscurus). Aquatic Toxicology, 164: 61-71 DOI:10.1016/j.aquatox.2015.04.004 |
D'Orbcastel E R, Blancheton J P, Belaud A., 2009. Water quality and rainbow trout performance in a Danish Model Farm recirculating system:comparison with a flow through system. Aquacultural Engineering, 40(3): 135-143 DOI:10.1016/j.aquaeng.2009.02.002 |
Foss A, Imsland A K, Roth B et al, 2009. Effects of chronic and periodic exposure to ammonia on growth and blood physiology in juvenile turbot (Scophthalmus maximus). Aquaculture, 296(1-2): 45-50 DOI:10.1016/j.aquaculture.2009.07.013 |
Ingerslev H C, Strube M L, Von Gersdorff J rgensen L et al, 2014. Diet type dictates the gut microbiota and the immune response against Yersinia ruckeri in rainbow trout (Oncorhynchus mykiss). Fish & Shellfish Immunology, 40(2): 624-633 |
Jones S E, Lennon J T., 2010. Dormancy contributes to the maintenance of microbial diversity. Proceedings of the National Academy of Sciences of the United States of America, 107(13): 5881-5886 DOI:10.1073/pnas.0912765107 |
Qi X Z, Xue M Y, Yang S B et al, 2017. Ammonia exposure alters the expression of immune-related and antioxidant enzymes-related genes and the gut microbial community of crucian carp (Carassius auratus). Fish & Shellfish Immunology, 70: 485-492 |
Sugita H, Miyajima C, Deguchi Y., 1991. The vitamin B12-producing ability of the intestinal microflora of freshwater fish. Aquaculture, 92: 267-276 DOI:10.1016/0044-8486(91)90028-6 |
Tremaroli V, B ckhed F., 2012. Functional interactions between the gut microbiota and host metabolism. Nature, 489(7415): 242-249 DOI:10.1038/nature11552 |
Tsuchiya C, Sakata T, Sugita H., 2008. Novel ecological niche of Cetobacterium somerae, an anaerobic bacterium in the intestinal tracts of freshwater fish. Letters in Applied Microbiology, 46(1): 43-48 |
Turnbaugh P J, Hamady M, Yatsunenko T et al, 2009. A core gut microbiome in obese and lean twins. Nature, 457(7228): 480-484 DOI:10.1038/nature07540 |
Wang C Z, Lin G R, Yan T et al, 2014. The cellular community in the intestine of the shrimp Penaeus penicillatus and its culture environments. Fisheries Science, 80(5): 1001-1007 DOI:10.1007/s12562-014-0765-3 |
Xiong J B, Wang K, Wu J F et al, 2015. Changes in intestinal bacterial communities are closely associated with shrimp disease severity. Applied Microbiology and Biotechnology, 99(16): 6911-6919 DOI:10.1007/s00253-015-6632-z |
Zheng Y F, Yu M, Liu Y et al, 2016. Comparison of cultivable bacterial communities associated with Pacific white shrimp (Litopenaeus vannamei) larvae at different health statuses and growth stages. Aquaculture, 451: 163-169 DOI:10.1016/j.aquaculture.2015.09.020 |
Zheng Y, Wu W, Hu G D et al, 2018. Gut microbiota analysis of juvenile genetically improved farmed tilapia (Oreochromis niloticus) by dietary supplementation of different resveratrol concentrations. Fish & Shellfish Immunology, 77: 200-207 |
 2020, Vol. 51
2020, Vol. 51


