中国海洋湖沼学会主办。
文章信息
- 陈凯锋, 董迎辉, 姚韩韩, 林志华, 孙长森. 2020.
- CHEN Kai-Feng, DONG Ying-Hui, YAO Han-Han, LIN Zhi-Hua, SUN Chang-Sen. 2020.
- 缢蛏(Sinonovacula constricta)氨氮胁迫应答miR-8245a-5p靶基因GOT验证及其表达特征分析
- Identification And Characteristic Expression analysis of miR-8245a-5p target gene related to ammonia nitrogen stress in Sinonovacula constricta
- 海洋与湖沼, 51(2): 388-394
- Oceanologia et Limnologia Sinica, 51(2): 388-394.
- http://dx.doi.org/10.11693/hyhz20191200271
文章历史
-
收稿日期:2019-12-23
收修改稿日期:2020-01-26
2. 浙江万里学院 宁海海洋生物种业研究院 宁波 315604
2. Ninghai Institute of Marine Biology Seed Industry, Zhejiang Wanli University, Ningbo 315604, China
缢蛏(Sinonovacula constricta)是浙江、福建等地重要的养殖贝类之一, 在我国海水养殖中占有重要的位置, 其生活在滩涂或池塘的泥滩洞穴中, 对污染物具有较高的耐受性(徐凤山等, 2008; Wu et al, 2018)。近年来, 由于环境污染, 导致水体氨氮浓度偏高, 此外, 随着混养模式的推广及饲料的过量投喂, 养殖水体富营养化越来越普遍, 使营穴居生活的缢蛏面临更高浓度氨氮的威胁(王岩, 1999)。有研究表明氨氮过高会造成水生生物组织氧化损伤、细胞凋亡或坏死、抑制免疫系统、增加病原敏感性, 甚至导致高死亡率(Cheng et al, 2015; Zhang et al, 2018)。
microRNA (miRNA)是一类长度约为21个核苷酸的非编码内源性单链RNA, 具有高度保守性、组织特异性和时序性, 其通过与靶mRNA裂解或优先与蛋白质编码基因的非编码区结合, 使得靶mRNA降解或者抑制靶mRNA翻译(Ambros, 2004; Bartel, 2004)。miRNA参与调控多个细胞功能, 包括细胞分化、生长、凋亡、代谢以及应激反应等生物学过程(Modlin et al, 2005; Houshmand et al, 2018; Raghuwanshi et al, 2018)。近年来, 越来越多的研究表明, miRNA与环境胁迫的响应有关。Sun等(2016)用氨暴露刺激团头鲂(Megalobrama amblycephala)时, 发现大量miRNAs被诱导或抑制; Ou等(2012)检测了感染绒螯螺旋体时中华绒螯蟹(Eriocheir sinensis)血液中miRNA的变化, 发现228个特异性miRNAs在正常血细胞和感染血细胞中有显著差异; Zeng等(2015)通过WSSV刺激凡纳滨对虾(Litopenaeus vannamei)时, 鉴定出8个miRNAs在病毒感染后差异表达; Schmidt(2010)通过深度测序美洲鲎(Limulus polyphemus)miRNA在短期锌和铜胁迫下的总体表达和miRNA群体的变化。
最近几年, 有关贝类miRNA生物学作用的研究逐渐成为热点, Zhao等(2016)鉴别出8个与渗透压调节相关的太平洋牡蛎(Crassostrea gigas)和香港巨牡蛎(C. hongkongensis) miRNA; Zhou等(2014)用温度和灿烂弧菌刺激太平洋牡蛎(C. gigas)时, 发现大量miRNAs被诱导或抑制; Bao等(2014)筛选到5个与镉胁迫应答相关且表达显著差异的泥蚶(Tegillarca granosa) miRNAs; 此外, Jiao等(2015)从马氏珠母贝(Pinctada martensii)生物矿化相关的miRNA库中鉴别出一个与珍珠层形成相关的miRNA; 谢淑媚(2018)从缢蛏(S. constricta)8个发育时期中中鉴别出了7个与类胰岛素生长因子系统信号途径相关的miRNA; 宋浩(2018)研究了脉红螺(Rapana venosa)变态过程中的miRNA, 鉴定了195条差异显著的miRNA。
本研究对氨氮胁迫下缢蛏肝胰腺组织中表达水平差异显著的miR-8245a-5p靶基因进行预测和验证, 并对其靶基因GOT的序列和表达特征进行了分析, 为揭示和探讨缢蛏在氨氮环境胁迫下的解毒代谢机制提供依据。
1 材料与方法 1.1 实验材料实验所用缢蛏材料取自宁波市鄞州区丹艳水产养殖基地, 壳长(56.96±3.13)mm、体重(13.38±2.40)g, 于实验室循环水养殖箱内暂养7d后待用(养殖条件为:连续充气, 水温25℃左右, 盐度20左右, 每天投喂单胞藻饵料一次)。
1.2 miR-8245a-5p靶基因的预测与验证基于Illumina Hiseq 2500高通量测序, 筛选氨氮胁迫下缢蛏肝胰腺组织表达水平差异显著的miR-8245a-5p进行分析。使用miRBase、miRanda和RNAhybrid数据库软件预测miR-8245a-5p的靶基因, 并利用qRT-PCR筛选miR-8245a-5p与氨氮胁迫相关的靶基因。
验证实验所需特异性激动剂agomir-8245a-5p和拮抗剂antagomir-8245a-5p由上海吉玛制药技术有限公司合成, agomir-NC和antagomir-NC为对照组(与miRBase数据库中所有的miRNA具有最小的同源性)。通过闭壳肌对缢蛏分别注射特异性和对照组激动剂和拮抗剂, 注射浓度2μg/μL, 时间间隔12h。注射后的缢蛏分组放入正常海水中养殖, 3d后每组取6粒缢蛏解剖取肝胰腺, 提取RNA, 反转录为cDNA, 为qRT-PCR模板, 用Primer Premier 5设计引物q-GOT-F和q-GOT-R, 用Vazyme miRNA设计miRNA引物q-miR8245a5p-F和q-miR8245a5p-R, 内参基因分别选择18S rRNA和U6, 使用Light Cycler 480ⅡPCR仪进行qRT-PCR反应。各组另取肝胰腺, 按照重量(g) :体积(mL) = 1 : 9的比例加入PBS (4℃, 0.01mol/L, pH 7.4), 匀浆(10000r/min, 30s), 离心(10000×g, 10min), 取上清, GOT酶活采用谷草转氨酶比色法测试盒测定。采用相对值2-∆∆Ct进行数据分析, 使用SPSS 19.0及Excel软件进行数据统计分析, 以P < 0.05作为差异显著性的标志。
1.3 Sc-GOT基因生物信息学分析利用缢蛏转录组文库获得Sc-GOT基因EST片段, 设计RACE引物GOT-F和GOT-R, 进行PCR扩增, PCR产物切胶回收、连接转化到DH5α大肠杆菌中, 培养12h, 挑选白色单菌落, 菌液PCR后将阳性克隆进行测序。为验证Sc-GOT基因的cDNA全长, 设计引物GOT-F1和GOT-R1进行PCR扩增, 产物切胶回收、连接转化步骤同上。
通过ORF Finder软件预测Sc-GOT基因的开放阅读框; 使用ProtParam软件预测氨基酸序列以及理化性质; 利用ExPASy软件推测蛋白质理化性质; 使用NetNGlyc预测糖基化位点; 使用NetPhos预测磷酸化位点; 使用SMART软件预测蛋白质功能域; 利用TMHMM分析蛋白质跨膜区; 用Signal P分析蛋白质信号肽区域; 用MEGA6.0软件构建系统进化树。
1.4 Sc-GOT基因的差异表达分析 1.4.1 不同组织中差异表达分析实验设计3个平行, 每个平行取6粒缢蛏分别活体解剖其水管、足、鳃、肾脏、外套膜、肝胰腺和闭壳肌7个组织用于时空表达特征分析, RNA提取方法及qRT-PCR和酶活测定方法参照1.2进行。
1.4.2 Sc-GOT基因氨氮胁迫后的表达分析实验设计3个处理, 分别是对照组(养殖用海水, 0.01mg/L), 60mg/L氨氮胁迫组, 140mg/L氨氮胁迫组, 每个处理设3个平行组。在实验室循环水养殖箱内进行试验, 每12h全换水一次, 换水后实验组用氨氮质量浓度为1000g/L的NH4Cl(优级纯)溶液调节氨氮水平。试验期间不充气, 每次换水前2h投喂角毛藻, 温度保持在25℃, 盐度保持在20, pH值保持在8.00左右。各组取6粒缢蛏(实验后1h、3h、6h、12h、24h、48h、72h取样), 解剖其肝胰腺组织冻存于液氮中, 一部分用于RNA提取, 另一部分用于酶活测定, RNA提取及qRT-PCR和酶活测定方法仍参照1.2进行。
| 引物 | 序列 | 引物信息 |
| GOT-F | AGGACAAGGTGAATCTGAGTGTTGGCG | 3′-RACE |
| GOT-R | CATGAGTGCCATTACACCTTTCGCTG | 5′-RACE |
| GOR-F | GCTATGTGGAGACAACAGATGGAAAGGTT | 已知片段验证 |
| GOT-R | GAGTTTAGAGAGAGATGCACGTTCGTGG | 已知片段验证 |
| q-GOT-F | TGTTCTTCTCTCGGCACACC | qRT-PCR |
| q-GOT-R | GTTGGCGCCTATCGTACAGA | qRT-PCR |
| q-miR8245a5p-F | GCGCGATAGCTGTCGGTAA | qRT-PCR |
| q-miR8245a5p-R | AGTGCAGGGTCCGAGGTATT | qRT-PCR |
| 18S-F 18S-R |
TCGGTTCTATTGCGTTGGTTTT CAGTTGGCATCGTTTATGGTCA |
内参基因 内参基因 |
| U6-F U6-R |
CTCGCTTCGGCAGCACA AACGCTTCACGAATTTGCGT |
内参基因 内参基因 |
使用miRBase、miRanda和RNAhybrid软件预测miR-8245a-5p靶基因(LPCAT2, UP1, UP2, UP3, UP4, GOT), 利用qRT-PCR筛选出极显著差异的靶基因GOT(图 1)。再利用miRBase取得miR-8245a-5p成熟序列(图 2), 从测序结果中选取GOT的mRNA序列。
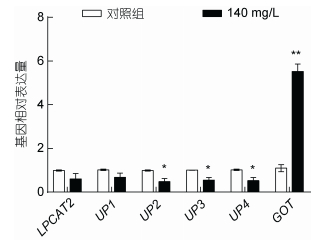 |
| 图 1 miR-8245a-5p靶基因的预测(n=3) Fig. 1 Prediction of target genes of miRNA-8245a-5p (n=3) 注: *代表显著差异(P < 0.05); **代表极显著差异(P < 0.01) |
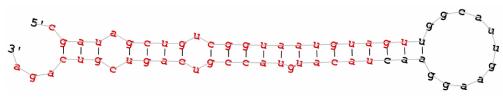 |
| 图 2 预测的缢蛏miR-8245a-5p的二级茎环结构 Fig. 2 Predicted secondary stem ring structure of microRNA-8245a-5p 注:红色部分为成熟miRNA的主要形式 |
经过qRT-PCR检测, agomir-8245a-5p和antagomir- 8245a-5p的相对表达量显著升高(P < 0.01)(图 3a)。注射agomir-8245a-5p, Sc-GOT基因相对表达量及Sc-GOT酶活显著降低(P < 0.01);相反, 注射antagomir-8245a-5p, Sc-GOT基因相对表达量及Sc-GOT酶活显著升高(P < 0.01)(图 3b, c)。
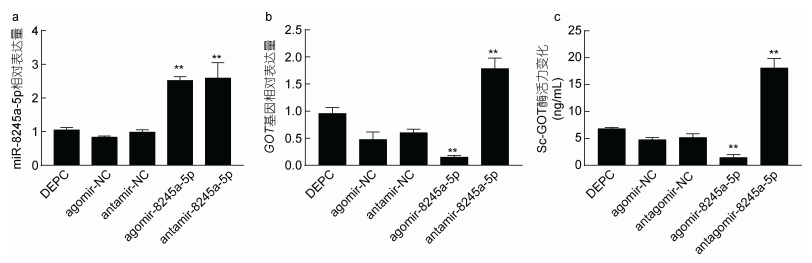 |
| 图 3 miR-8245a-5p靶基因的验证 Fig. 3 Verification of the target gene of miRNA-8245a-5p 注: a. agomir-8245a-5p和antagomir-8245a-5p注射后miR-8245a-5p相对含量分析(n=3); b. agomir-8245a-5p和antagomir-8245a-5p注射后Sc-GOT基因表达分析(n=3); c. agomir-8245a-5p和antagomir-8245a-5p注射后Sc-GOT蛋白含量分析(n=3); **代表极显著差异(P < 0.01) |
Sc-GOT基因cDNA全长2594 bp, Sc-GOT基因开放阅读框(ORF)长度1227bp。ExPASy软件推导出ORF编码408个氨基酸, 包含55个碱性氨基酸(K, R, H), 43个酸性氨基酸(D, E), 178个疏水性氨基酸(A, L, I, F, P, V, W, M)以及132个亲水性氨基酸(S, G, T, Y, N, C, Q), 该蛋白质含有很大比例的疏水性氨基酸, 表现为疏水性; 该蛋白的分子量为45.38ku, 等电点pI=8.37。该序列包含3个N-糖基化位点, 30个磷酸化位点(其中丝氨酸位点13个, 苏氨酸位点13个, 酪氨酸位点4个); TMHMM和SignalP软件预测该蛋白质无跨膜区和信号肽。SMART软件进行功能域预测显示, Sc-GOT存在1个保守结构域: Aminotran_1_2 (29—397aa)。
利用MEGA6.0软件对缢蛏和其他16个物种的GOT氨基酸序列进行了序列比对和系统进化树分析(见图 4)。结果显示, Sc-GOT基因与虾夷扇贝(Mizuhopecten yessoensis, OWF49471.1)、太平洋牡蛎(C. gigas, EKC40669.1)和美洲牡蛎(C. virginica, XP_ 022339935.1)同源性较高, 分别为70.2%、70.4%和69.9%, 与智人(Homo sapiens, AAA35563.1)、小鼠(Mus musculus, AAA37263.1)、原鸡(Gallus gallus, NP_990652.1)、鹌鹑(Coturnix japonica, XP_ 015722585.1)、非洲爪蟾(Xenopus tropicalis, NP_ 998829.1)、伯氏溪树蛙(Buergeria buergeri, BAM10994.1)、斑马鱼(Danio rerio, NP_998222.1)、半滑舌鳎(Cynoglossus semilaevis, XP_008320093.1)、内华达古白蚁(Zootermopsis nevadensis, KDR10996.1)、菜叶蜂(Athalia rosae, XP_012267682.1)、中国对虾(Penaeus chinensis, AID18683.1)和斑节对虾(Penaeus monodon, KP984794.1)等动物的同源性为50.5%—66.7%。进化树分析表明, 缢蛏与其他几种贝类动物的亲缘性较近, 与鸟类、两栖类、哺乳类、鱼类等脊椎动物的亲缘性较远。
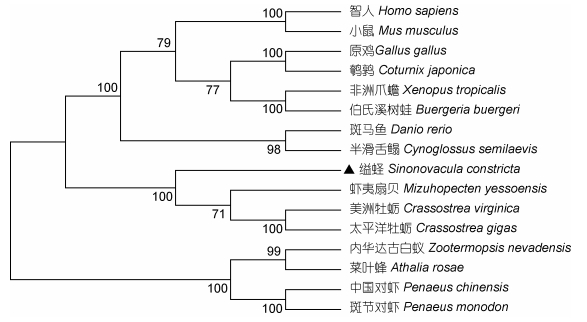 |
| 图 4 采用MEGA6.0软件NJ法构建GOT基因的进化树 Fig. 4 The GOT gene phylogenetic tree constructed by MEGA6.0 software using NJ method |
不同组织的qRT-PCR结果显示, Sc-GOT基因在缢蛏成体的水管、足、鳃、肾脏、外套膜、肝胰腺和闭壳肌中均有表达, 该基因在缢蛏肝胰腺中表达量相对其他6个组织最高(P < 0.01), 其次是鳃, 在唇瓣组织中的表达量最低(图 5)。
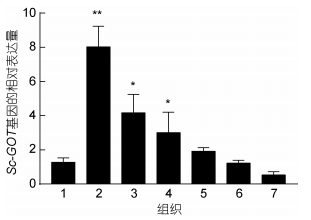 |
| 图 5 Sc-GOT基因在缢蛏不同组织的表达分析(n=3) Fig. 5 Expression analysis of Sc-GOT gene in different tissues of S. constricta (n=3) 注: 1.足, 2.肝胰腺, 3.鳃, 4.肾脏, 5.外套膜, 6.水管, 7.唇瓣。*代表显著差异(P < 0.05); **代表极显著差异(P < 0.01) (与足组织的显著性比较) |
氨氮胁迫对缢蛏GOT基因在肝胰腺中的表达特征见图 6, 从图中结果可以看出不同浓度氨氮胁迫Sc-GOT基因表达趋势不同。140mg/L组中Sc-GOT基因表达在胁迫初始阶段迅速上调, 显著高于对照组(P < 0.01), 之后在胁迫过程中不断下降。60mg/L组中Sc-GOT基因表达呈现先升高后下降的趋势, 上调水平在胁迫后12h达到峰值。
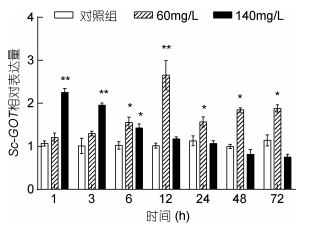 |
| 图 6 氨氮暴露下肝胰腺中Sc-GOT基因表达水平变化(n=3) Fig. 6 Variation of Sc-GOT gene expression in hepatopancreas of S. constricta under high ammonia nitrogen stress (n=3) 注: *代表显著差异(P < 0.05); **代表极显著差异(P < 0.01) |
图 7显示了氨氮胁迫后缢蛏肝胰腺组织中GOT酶活力的变化趋势, 60mg/L和140mg/L两个胁迫组均呈现先上升后下降的特征, 但140mg/L氨氮胁迫组较60mg/L组GOT酶活力上升更为快速, 前者峰值出现在胁迫后第6h, 后者峰值出现在第24h。
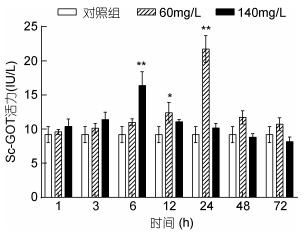 |
| 图 7 氨氮暴露下缢蛏肝胰腺中GOT酶活力变化(n=3) Fig. 7 Variation of GOT enzyme activity in hepatopancreas of S. constricta under high ammonia nitrogen stress (n=3) 注: *代表显著差异(P < 0.05); **代表极显著差异(P < 0.01) |
本研究确定了GOT基因为miR-8245a-5p的靶基
因, 且获得Sc-GOT基因cDNA全长2594bp, 开放阅读框(ORF)长度1227bp, 编码408个氨基酸, 经过多重序列比对发现, 该氨基酸序列很保守, 属于天冬氨酸超家族(Mehta et al, 1993)。该氨基酸与无脊椎动物中太平洋牡蛎、美洲牡蛎和虾夷扇贝同源性较高, 推测其功能较为相似, 而与脊椎动物同源性较低。系统进化分析结果表明缢蛏与太平洋牡蛎归为一支, 同源性为70.4%。
谷草转氨酶(GOT)主要通过辅酶在磷酸吡哆醛(pyridoxal phosphate, PLP)和磷酸吡哆胺(pyrodoxamine photophate, PMP)之间的转换来完成氨基的转运(王镜岩等, 2002)。本研究表明, Sc-GOT基因在缢蛏各组织中均有表达, 其中肝胰腺的表达量最高, 且鳃和肾脏的表达量处于较高水平, 其中肝胰腺相对于其他组织为极显著差异(P < 0.01), 该结果与中国对虾和斑节对虾GOT基因的组织表达规律(李少飞, 2014; 陈劲松等, 2016)相似, 可以推测Sc-GOT基因参与缢蛏氨基酸分解和氨氮代谢的过程。
GOT通过催化草酰乙酸和谷氨酸生成天冬氨酸, 天冬氨酸参与鸟氨酸循环形成尿素(李少飞, 2014), 而尿素是双壳类贝类排泄氨的方式之一(Hammen, 1968; Weihrauch et al, 2004)。为研究GOT在缢蛏氨氮解毒代谢中的作用, 通过低浓度组与高浓度组对缢蛏进行氨氮胁迫实验, 分析了在不同浓度氨氮胁迫过程中缢蛏GOT基因在肝胰腺中表达变化趋势。在低浓度组中, Sc-GOT基因表现出先升后降直至平衡的趋势。Sc-GOT基因应对氨氮初始刺激时表达量升高, 表明Sc-GOT基因对氨氮胁迫反应迅速, 跟斑节对虾结果一致(陈劲松等, 2016)。有研究发现在6h表达量下降的原因是体内氨增加, 抑制了天门冬氨酸转氨酶参与的嘌呤核苷酸联合脱氨基作用, 从而减少体内氨的产生(李少飞, 2014)。随着氨氮实验的进行, GOT基因表达量再次上升, 原因是谷草转氨酶催化转氨反应生成天冬氨酸参与尿素的形成。三疣梭子蟹暴露在氨氮环境时, 通过鳃和肝胰腺中的尿素循环, 将体内氨转变成尿素, 再经鳃将其排出体外(岳峰, 2010)。尿素的形成需要大量的能量, 甲壳动物以合成谷氨酰胺作为主要的排氨途径, 因此48h后GOT基因的表达量下降并趋于平衡。而在高浓度组中的情况有所不同, 整体呈现出逐渐下降的趋势。中国对虾应对氨氮胁迫时, 肝胰腺中的吸收细胞转变为分泌细胞, 原来的肝管部位充满大量的溶酶体以及细胞碎片(姜会民, 2012), 因此致使本实验出现这种情况的原因可能也是水体中氨氮浓度过大, 肝细胞遭到破坏, 阻碍了肝细胞正常的解毒代谢功能。
谷草转氨酶在氨的产生和排泄过程中具有重要的作用, 其活性反应机体氨基酸代谢情况, 是反应肝功能的重要指标(Weihrauch et al, 2004)。两组表现出先升后降趋势, 区别在于达到最大酶活力的时间以及活力大小。胁迫初始阶段, 实验组GOT活力上升, 表明氨氮对GOT活性有诱导作用, 加快氨氮的代谢, 减少代谢产物对机体的影响(McKenna et al, 2006)。低浓度组24h后GOT活性逐渐下降, 高浓度组6h后GOT活性逐渐下降, 出现该现象的原因可能是在随着氨氮实验的进行, 肝胰腺被破坏, 与上述结论相呼应。
4 结论本研究筛选并验证了表达差异显著的miR-8245a-5p及其靶基因, 并对靶基因GOT进行生物学信息分析得到其cDNA全长2594bp, 该基因与贝类同源性较高, 表明该基因比较保守。通过测定在氨氮胁迫下转录水平和酶活力水平的变化情况, 表明该基因参与缢蛏氨基酸分解和氨氮代谢的过程, 也表明天冬氨酸转氨酶受氨氮暴露时间和氨氮剂量的影响, 初步探讨了缢蛏在氨氮胁迫下的miRNA及分析机制, 以期更好地理解氨氮在机体内的毒性作用以及机体对氨氮的解毒代谢机制。
王岩. 1999. 不同单养及混养海水实验围隔水化学的研究. 水产学报, 23(4): 350-356 |
王镜岩, 朱圣庚, 徐长 法.. 2002. 生物化学. 3版. 北京: 高等教育出版社, 306-308
|
李少飞..2014.中国对虾氨氮代谢酶基因的cDNA克隆及其在氨氮解毒代谢过程中的作用.大连: 大连海洋大学硕士学位论文
|
宋浩..2018.脉红螺幼虫变态过程多组学解析及关键基因的调控作用.青岛: 中国科学院大学(中国科学院海洋研究所)博士学位论文
|
陈劲松, 周发林, 江世贵, 等. 2016. 斑节对虾谷氨酰胺合成酶基因的克隆及氨氮胁迫对其时空表达的影响. 上海海洋大学学报, 25(4): 497-507 |
岳峰..2010.三疣梭子蟹在氨氮胁迫下免疫应答与解毒代谢机制的研究.青岛: 中国海洋大学硕士学位论文, 87-95
|
姜会民. 2012. 氨氮胁迫对黄河鲤幼鱼肝胰脏、肾脏抗氧化性的影响. 山东大学学报(理学版), 47(1): 17-22 |
徐凤山, 张素萍, 王少 青.. 2008. 中国海产双壳类图志. 北京: 科学出版社, 211-213
|
谢淑媚..2018.缢蛏类胰岛素生长因子系统3个基因表达特征及功能初步分析.上海: 上海海洋大学博士学位论文
|
Ambros V., 2004. The functions of animal microRNAs. Nature, 431(7006): 350-355 DOI:10.1038/nature02871 |
Bao Y B, Zhang L L, Dong Y H et al, 2014. Identification and comparative analysis of the Tegillarca granosa haemocytes microRNA transcriptome in response to cd using a deep sequencing approach. PLoS One, 9(4): e93619 DOI:10.1371/journal.pone.0093619 |
Bartel D P., 2004. MicroRNAs:genomics, biogenesis, mechanism, and function. Cell, 116(2): 281-297 |
Cheng C H, Yang F F, Ling R Z et al, 2015. Effects of ammonia exposure on apoptosis, oxidative stress and immune response in pufferfish (Takifugu obscurus). Aquatic Toxicology, 164: 61-71 DOI:10.1016/j.aquatox.2015.04.004 |
Hammen C S., 1968. Aminotransferase activities and amino acid excretion of bivalve mollusks and brachiopods. Comparative Biochemistry and Physiology, 26(2): 697-705 DOI:10.1016/0010-406X(68)90661-0 |
Houshmand M, Hagh M N, Soleimani M et al, 2018. MicroRNA microarray profiling during megakaryocyte differentiation of cord blood CD133+ hematopoietic stem cells. Cell Journal, 20(2): 195-203 |
Jiao Y, Zheng Z, Tian R R et al, 2015. MicroRNA, Pm-miR-2305, participates in nacre formation by targeting pearlin in pearl oyster Pinctada martensii. International Journal of Molecular Sciences, 16(9): 21442-21453 DOI:10.3390/ijms160921442 |
McKenna M C, Hopkins I B, Lindauer S L et al, 2006. Aspartate aminotransferase in synaptic and nonsynaptic mitochondria:differential effect of compounds that influence transient hetero-enzyme complex (metabolon) formation. Neurochemistry International, 48(6-7): 629-636 DOI:10.1016/j.neuint.2005.11.018 |
Mehta P K, Hale T I, Christen P., 1993. Aminotransferases:demonstration of homology and division into evolutionary subgroups. European Journal of Biochemistry, 214(2): 549-561 |
Modlin I M, Kidd M, Latich I et al, 2005. Current status of gastrointestinal carcinoids. Gastroenterology, 128(6): 1717-1751 DOI:10.1053/j.gastro.2005.03.038 |
Ou J T, Meng Q G, Li Y et al, 2012. Identification and comparative analysis of the Eriocheir sinensis microRNA transcriptome response to Spiroplasma eriocheiris infection using a deep sequencing approach. Fish & Shellfish Immunology, 32(2): 345-352 |
Raghuwanshi S, Gutti U, Kandi R et al, 2018. MicroRNA-9 promotes cell proliferation by regulating RUNX1 expression in human megakaryocyte development. Cell Proliferation, 51(1): e12414 DOI:10.1111/cpr.12414 |
Schmidt S A., 2010. Population structure and heavy metal stress response in the horseshoe crab Limulus polyphemus. Newark: Doctor Dissertation of University of Delaware
|
Sun S M, Ge X P, Zhu J et al, 2016. De novo assembly of the blunt snout bream (Megalobrama amblycephala) gill transcriptome to identify ammonia exposure associated microRNAs and their targets. Results in Immunology, 6: 21-27 DOI:10.1016/j.rinim.2016.03.001 |
Weihrauch D, Morris S, Towle D W., 2004. Ammonia excretion in aquatic and terrestrial crabs. Journal of Experimental Biology, 207(26): 4491-4504 DOI:10.1242/jeb.01308 |
Wu X P, Feng Y W, Jiang H L et al, 2018. A preliminary genetic linkage map of Sinonovacula constricta (Lamarck.. 1818) based on microsatellites derived from RAD Sequencing. Journal of Ocean University of China, 17(4): 947-956 |
Zeng D G, Chen X L, Xie D X et al, 2015. Identification of highly expressed host microRNAs that respond to white spot syndrome virus infection in the Pacific white shrimp Litopenaeus vannamei (Penaeidae). Genetics and Molecular Research, 14(2): 4818-4828 DOI:10.4238/2015.May.11.14 |
Zhang L, Pan L Q, Xu L J et al, 2018. Effects of ammonia-N exposure on the concentrations of neurotransmitters, hemocyte intracellular signaling pathways and immune responses in white shrimp Litopenaeus vannamei. Fish & Shellfish Immunology, 75: 48-57 |
Zhao X L, Yu H, Kong L F et al, 2016. High throughput sequencing of small RNAs transcriptomes in two Crassostrea oysters identifies microRNAs involved in osmotic stress response. Scientific Reports, 6: 22687 DOI:10.1038/srep22687 |
Zhou Z, Wang L L, Song L S et al, 2014. The identification and characteristics of immune-related microRNAs in haemocytes of oyster Crassostrea gigas. PLoS One, 9(2): e88397 DOI:10.1371/journal.pone.0088397 |
 2020, Vol. 51
2020, Vol. 51


