中国海洋湖沼学会主办。
文章信息
- 陈强, 黎中宝, 高瞻. 2020.
- CHEN Qiang, LI Zhong-Bao, GAO Zhan. 2020.
- 镉铜单一及复合胁迫对双齿围沙蚕(Perineresis aibuhitensis)消化酶活性和抗氧化指标的影响
- EFFECTS OF SINGLE Cu, Cd, AND Cu-Cd COMBINED STRESS ON DIGESTIVE ENZYME ACTIVITIES AND ANTIOXIDANT INDEXES OF PERINEREIS AIBUHITENSIS
- 海洋与湖沼, 51(2): 395-404
- Oceanologia et Limnologia Sinica, 51(2): 395-404.
- http://dx.doi.org/10.11693/hyhz20191200264
文章历史
-
收稿日期:2019-12-18
收修改稿日期:2020-01-27
2. 福建省海洋渔业资源与生态环境重点实验室 厦门 361021
2. Fujian Provincial Key Laboratory of Marine Fishery Resources and Eco-environment, Xiamen 361021, China
重金属镉、铜是水陆交错带的典型污染物, 水体中的镉主要来源于地表径流以及工业废水, 其本身不具有氧化还原活性, 但能诱导氧化应激(Cuypers et al, 2010), 能在生物体的特定位置取代必需元素而表现出毒性。鉴于镉的毒性, 世界卫生组织(WHO)将其列为优先研究的食品污染物; 联合国环境规划署(UNEP)把其列为十二种全球性环境污染物之首; 美国国家环境保护局(USEPA)将其列为制定水质基准时的优先控制污染物; 美国毒物管理委员会(ATSDR)将其列为第六位危及人类健康的有毒物质(李学鹏等, 2010)。铜虽然是生物体必需的微量营养元素, 但高剂量铜可在动物组织细胞(尤其是肝脏)中蓄积。农业上含Cu杀菌剂、杀虫剂、饲料添加剂以及微量营养肥料的施用, 工业上Cu矿的过度开采及含Cu污染物的大量排放, 导致水陆交错带Cu污染加剧, 其毒性已引起人们的普遍重视(洪美玲等, 2015)。
双齿围沙蚕(Perinereis aibuhitensis)隶属于环节动物门(Annelida)、多毛纲(Polychaeta), 是一种栖息于沿海潮间带生态系统中的无脊椎动物, 在沿岸水域的能量流动和物质循环中起着非常重要的作用, 具有分布广泛、多样性丰富的特点(王晶等, 2007)。以前许多研究报道沙蚕对重金属等污染物比较敏感, 经常把其作为监测海洋环境的指示物种(孙福红等, 2006a; 宿丽丽等, 2016)。但也有一些研究表明, 沙蚕对重金属等污染胁迫能够表现出很高的适应性和耐受性。比如, 沙蚕暴露于Cd2+ 192h的半致死剂量为100mg/L (Bryan et al, 1976), 远远高于一般海洋无脊椎动物的LC50值(0.1—10mg/L)。英国西南潮间带泥滩中的沙蚕因长期暴露在重金属污染中, 对镉、铜等重金属产生了适应性和耐受能力(Mason et al, 1995)。近岸海洋环境中, 重金属污染多以复合形式存在, 单一污染比较少见。当环境中存在多种污染物质时, 联合作用会对不同水生生物及其不同生长阶段产生不一样的毒性效应, 可能表现出协同或拮抗作用, 尤其是加和效应和协同效应会产生更大的毒性。以往的实验研究大多数选择单一重金属胁迫评价其对沙蚕的影响, 为更好地评估重金属对沙蚕的影响, 对重金属复合污染胁迫的研究更应引起重视。
近年来有许多关于重金属胁迫对水生生物生长发育、生理生化指标影响的报道, 但主要集中于毒性效应、氧化损伤和抗氧化酶活性等方面(孙福红等, 2006b), 环境对生物机体的影响是多方面的, 沙蚕的消化和摄食会对重金属胁迫产生应激反应, 消化酶活性是评价其消化机能的重要指标。为防止过氧化对细胞成分的损伤, 许多防御系统成分参与抗氧化作用, 抗氧化防御系统成分的改变也常常被用来作为水生生物氧化损伤的指示。本文以广泛分布的多毛类双齿围沙蚕为研究对象, 研究了在镉铜单一及复合胁迫作用下其消化酶活力和抗氧化指标的变化规律, 能够进一步了解沙蚕机体的代谢状况和对外部环境的适应情况, 旨在为利用消化酶活力和抗氧化指标作为环境监测指标提供数据参考, 评估利用沙蚕修复滩涂、海洋环境污染的可行性, 为后续开展海洋滩涂的污染修复提供理论支撑。
1 材料与方法 1.1 实验材料供试双齿围沙蚕购于福建省霞浦县, 健康成体沙蚕在海水(盐度25±1)中暂养7d, 期间不断曝气, 视水质情况日换水1—2次。暂养温度(22±1)℃, pH 7—8, 溶氧6.0mg/L以上。投喂凡纳滨对虾饵料, 每日喂食2次并及时清理死亡个体。
供试重金属镉铜分别为CdCl2·2.5H2O和CuSO4·5H2O, 均为分析纯, 配置成10.0mg/L的储备液, 实验时按比例稀释使用。
1.2 实验方法 1.2.1 浓度设计参考预试验中获得的Cd2+、Cu2+对双齿围沙蚕96h LC50半致死浓度, Cd2+按照《国家渔业水质标准》(GB11607-89) (Cd2+≤0.005mg/L)的0、40和200倍设置实验梯度, Cu2+按照《国家渔业水质标准》(Cu2+≤0.01mg/L)的0、10和50倍设置实验梯度。不同处理组中镉和铜的浓度见表 1。
| Cu2+-Cd2+处理组 | 铜浓度(μg/L) | 镉浓度(μg/L) |
| Cu0-Cd0 | 0 | 0 |
| Cu0-Cd200 | 0 | 200 |
| Cu0-Cd1000 | 0 | 1000 |
| Cu100-Cd0 | 100 | 0 |
| Cu100-Cd200 | 100 | 200 |
| Cu100-Cd1000 | 100 | 1000 |
| Cu500-Cd0 | 500 | 0 |
| Cu500-Cd200 | 500 | 200 |
| Cu500-Cd1000 | 500 | 1000 |
试验前停食24h, 挑取形态完整、体格健壮、规格一致的沙蚕(1.8±0.2g), 随机分配到1000mL烧杯中开展试验。共9个处理组, 每个处理组3个平行共27个烧杯。每个烧杯中加入500mL不同浓度供试重金属水溶液, 加入12尾沙蚕。水溶液每24h更换1次, 试验期间停止喂食, 持续充气增氧。试验温度控制在(22±1)℃。为了消除干扰因素, 减少误差, 实验过程中使用的烧杯均在实验前用10% HNO3浸泡处理。
分别于第3、6和9天, 从各实验组中随机选取3尾沙蚕, 滤纸吸干, 活体解剖, 摘取肠、头部等组织, 分别置于离心管中, 于–80℃冰箱中保存待测。
1.2.3 样品处理与指标测定样品的制备参照南京建成生物工程研究所试剂盒的组织匀浆方法:组织称重, 按1: 9 (W/V)加入4℃的0.86%生理盐水, 冰水浴中匀浆5min, 采用低温高速离心机(4℃, 3000r/min, 15min)对匀浆液进行离心处理, 取上清液待测。
消化酶指标包括肠蛋白酶(erepsin)、脂肪酶(intestinal lipase)、淀粉酶(intestinal amylase)。抗氧化指标包括超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(POD)、谷胱甘肽过氧化物酶(GSH-Px)、丙二醛(MDA)含量。测定所用试剂盒均购自南京建成生物工程研究所, 严格按照试剂盒说明书进行测定操作。
1.3 数据处理采用SPSS22.0数据软件进行实验数据的统计学分析, 单因素方差分析, Duncan比较, 数据全部用3个平行组数据的平均值±标准差(Mean±SD)表示, 取显著水平P < 0.05。
2 结果 2.1 镉铜单一及复合胁迫对沙蚕主要消化酶的影响 2.1.1 对沙蚕肠淀粉酶的影响Cd2+-Cu2+单一及复合胁迫对沙蚕肠淀粉酶活性的影响如图 1所示。随着胁迫时间的延长, 实验组和对照组(即Cu0-Cd0组, 下同)淀粉酶活性总体上呈降低的变化规律, 表现出时间效应。胁迫3d, 除了Cu100-Cd200组外, 其余实验组与对照组均有显著性差异(P < 0.05)。单一Cd2+、Cu2+胁迫3d, 实验组淀粉酶活性均显著高于对照组(P < 0.05); Cd2+-Cu2+复合胁迫3d, Cu100-Cd1000组和Cu500-Cd200组淀粉酶活性显著低于对照组(P < 0.05), 说明Cd2+、Cu2+之间可能存在拮抗关系。单一Cu2+胁迫6d, 实验组淀粉酶活性显著高于对照组(P < 0.05), 随着Cu2+浓度的增加, 活性增加; 单一Cd2+胁迫6d, 低浓度组淀粉酶活性高于对照组, 但无显著差异(P > 0.05), 高浓度组呈显著诱导作用(P < 0.05)。复合胁迫6d, Cu100-Cd1000组被显著抑制(P < 0.05), 而Cu100-Cd200组和Cu500-Cd1000组被显著诱导(P < 0.05)。在胁迫9d的样本中, 单一胁迫时, Cd2+、Cu2+高浓度组与对照组均存显著性差异(P < 0.05);复合胁迫9d, 仅Cu500-Cd200组与对照组有显著性差异(P < 0.05), 说明Cd2+、Cu2+胁迫导致沙蚕淀粉酶活性快速出现应激, 随着胁迫时间延长, Cd2+、Cu2+对淀粉酶活性的影响逐渐下降。
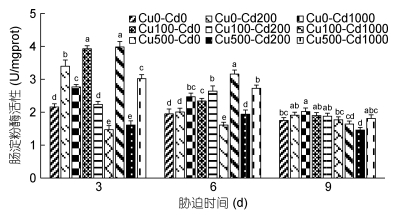 |
| 图 1 镉-铜单一及复合胁迫对沙蚕肠淀粉酶活性的影响 Fig. 1 Effects of single and combined stress of Cd2+ and Cu2+ on intestinal amylase activities of P. aibuhitensis 注:同一时间组内字母不同者表示差异显著(P < 0.05)。下同 |
Cd2+-Cu2+单一及复合胁迫3d、6d、9d沙蚕肠蛋白酶活性的变化如图 2所示。对照组蛋白酶活性随着实验时间延长呈现降低→升高的动态变化趋势, 而实验组蛋白酶活性随着胁迫时间延长大部分呈下降趋势, 表现出时间效应。单一Cd2+胁迫3d, 低浓度组蛋白酶活性显著下降(P < 0.05), 高浓度组显著升高(P < 0.05);单一Cu2+胁迫3d, 实验组与对照组均无显著差异(P > 0.05)。Cd2+-Cu2+复合胁迫3d, 高浓度Cd2+组蛋白酶活性均显著高于对照组(P < 0.05)。单一Cd2+胁迫6d, 实验组与对照组均无显著差异(P > 0.05);单一Cu2+胁迫6d, 低浓度组蛋白酶活性无显著差异(P > 0.05), 高浓度组被显著诱导(P < 0.05)。Cd2+-Cu2+复合胁迫6d实验组蛋白酶活性均显著升高(P < 0.05)。单一Cd2+胁迫9d, 实验组被显著抑制(P < 0.05);单一Cu2+胁迫9d, 低浓度组蛋白酶活性被显著抑制(P < 0.05), 高浓度组低于对照组, 但无显著差异(P > 0.05)。Cd2+-Cu2+复合胁迫9d, 低浓度Cu2+组蛋白酶活性差异不显著(P > 0.05), 高浓度Cu2+组蛋白酶活性被显著抑制(P < 0.05)。从整个胁迫过程来看, 低浓度组大部分被抑制, 高浓度组迅速产生激发作用, 随着胁迫时间延长, 对肠蛋白酶活性的影响总体呈现先诱导后抑制的变化趋势, 长时间高浓度胁迫诱导作用变弱, 其酶活性逐步降低到对照组水平。
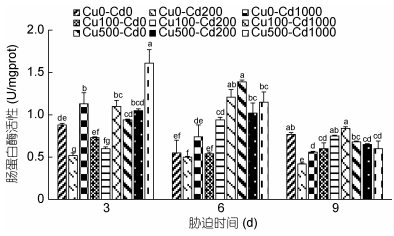 |
| 图 2 镉-铜单一及复合胁迫对沙蚕肠蛋白酶活性的影响 Fig. 2 Effects of single and combined stress of Cd2+ and Cu2+ on erepsin activities of P. aibuhitensis |
Cd2+-Cu2+单一及复合胁迫对沙蚕肠脂肪酶活性的影响见图 3。如图 3所示, Cd2+、Cu2+胁迫对沙蚕脂肪酶整体表现出抑制作用。单一Cd2+和Cu2+胁迫3d, 低浓度组脂肪酶活性无显著差异(P > 0.05), 高浓度组显著下降(P < 0.05)。单一Cd2胁迫6d、9d, 低浓度组脂肪酶活性无显著差异(P > 0.05), 高浓度组显著下降(P < 0.05);单一Cu2+胁迫6d、9d, 实验组脂肪酶活性被显著抑制(P < 0.05), 随着Cu2+浓度的增加, 抑制作用增强。复合胁迫3d、6d、9d, 高浓度Cd2+组脂肪酶活性均显著高于单一Cd2+组(P < 0.05), 说明Cd2+能够干扰脂肪酶活性的降低, 高浓度Cd2+和Cu2+之间表现为拮抗效应; Cd2+-Cu2+复合胁迫3d、6d, 低浓度Cd2+组脂肪酶活性显著低于单一Cd2+组(P < 0.05), 复合胁迫9d, 低浓度Cd2+-低浓度Cu2+组脂肪酶活性低于单一Cd2+组, 但无显著差异(P > 0.05), 低浓度Cd2+-高浓度Cu2+组脂肪酶活性显著低于单一Cd2+组(P < 0.05), 说明低浓度Cd2+和Cu2+之间可能存在协同关系, Cu2+的存在使低浓度Cd2+的脂肪酶活性抑制作用增强。
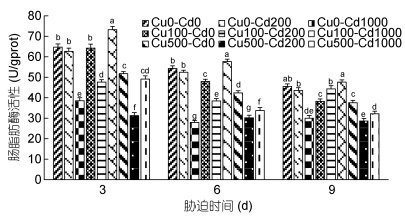 |
| 图 3 镉-铜单一及复合胁迫对沙蚕肠脂肪酶活性的影响 Fig. 3 Effects of single and combined stress of Cd2+ and Cu2+ on intestinal lipase activities of P. aibuhitensis |
Cd2+-Cu2+单一及复合胁迫对沙蚕SOD活性的影响如图 4所示。从图 4可见, Cd2+、Cu2+胁迫使沙蚕SOD被诱导, 实验组SOD活性均高于对照组, 随着胁迫时间延长大部分呈下降趋势, 表现出明显的时间效应。单一Cd2+和Cu2+胁迫3d, 低浓度组SOD活性显著高于高浓度组(P < 0.05); Cd2+-Cu2+复合胁迫3d, 相同Cu2+浓度的各组差异不显著(P > 0.05), 表现出与单一胁迫不同的变化趋势。胁迫6d, 实验各组SOD活性均显著高于对照组(P < 0.05), 但各实验组之间差异不显著(P > 0.05)。Cd2+、Cu2+单一胁迫9d, 仅高浓度Cu2+组SOD活性显著高于对照组(P < 0.05), 其他各实验组SOD活性虽高于对照组, 但差异不显著(P > 0.05); Cd2+-Cu2+复合胁迫9d, 仅Cu500-Cd200组SOD活性显著高于对照组(P < 0.05), 其他各实验组SOD活性虽高于对照组, 但差异不显著(P > 0.05)。SOD可以在逆境情况下通过提高活性来降低生物细胞受伤害的程度, 达到自我保护的目的, 胁迫强度和时间对沙蚕SOD活性的影响似乎是可以累加的。
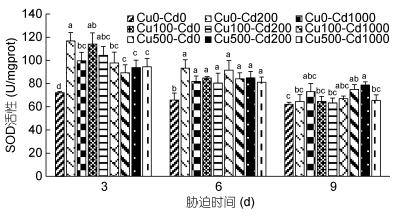 |
| 图 4 镉-铜单一及复合胁迫对沙蚕超氧化物歧化酶活性的影响 Fig. 4 Effects of single and combined stress of Cd2+ and Cu2+ on SOD activities of P. aibuhitensis |
Cd2+-Cu2+单一及复合胁迫对沙蚕CAT活性的影响如图 5所示。Cd2+、Cu2+胁迫整体上激活沙蚕过氧化氢酶(CAT)活性。沙蚕Cd2+单一胁迫3d时, 实验组CAT被显著诱导(P < 0.05), 随着Cd2+浓度的升高CAT活性呈上升趋势; Cu2+单一胁迫3d时, 随着Cu2+浓度的升高呈先升后降的变化趋势, 低浓度时CAT被显著诱导(P < 0.05), 高浓度时CAT被抑制, 但与对照组差异不显著(P > 0.05)。Cd2+-Cu2+复合胁迫3d时, Cu100-Cd200组CAT被显著诱导(P < 0.05), 其他三组CAT被抑制, 但与对照组差异不显著(P > 0.05)。Cd2+单一胁迫6d、9d时, 随着Cd2+浓度的升高CAT活性呈先降后升的变化趋势, 低浓度时CAT被显著抑制(P < 0.05), 高浓度时CAT被诱导, 但与对照组差异不显著(P > 0.05); Cu2+单一胁迫6d、9d时, 随着Cu2+浓度的升高CAT活性呈上升趋势, 低浓度时CAT被诱导, 但与对照组差异不显著(P > 0.05), 高浓度组CAT活性显著高于对照组(P < 0.05)。Cd2+-Cu2+复合胁迫6d时, 低浓度Cd2+组CAT被显著诱导(P < 0.05)。Cd2+-Cu2+复合胁迫9d时, 低浓度Cu2+组CAT被显著诱导(P < 0.05), 高浓度Cu2+组CAT活性高于对照组, 但差异不显著(P > 0.05), 复合胁迫中, 低浓度Cd2+组表现出持续的激活作用。胁迫浓度和时间对沙蚕CAT活性的影响存在累加效应。
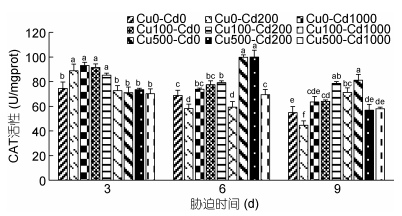 |
| 图 5 镉-铜单一及复合胁迫对沙蚕过氧化氢酶活性的影响 Fig. 5 Effects of single and combined stress of Cd2+ and Cu2+ on CAT activities of P. aibuhitensis |
Cd2+-Cu2+单一及复合胁迫对沙蚕POD活性的影响如图 6所示。沙蚕Cd2+单一胁迫3d、6d、9d时, 实验组POD均被显著诱导(P < 0.05), 随着Cd2+浓度的升高POD活性呈上升趋势; Cu2+单一胁迫3d和6d时, 随着Cu2+浓度的升高呈先升后降的变化趋势, 低浓度时POD被显著诱导(P < 0.05), 高浓度时POD被显著抑制(P < 0.05); Cu2+单一胁迫9d时, 随着Cu2+浓度的升高呈先升后降的变化趋势, 实验组POD均被显著诱导(P < 0.05)。Cd2+-Cu2+复合胁迫3d时, 低浓度Cu2+组POD被显著诱导(P < 0.05), 高浓度Cu2+组POD被显著抑制(P < 0.05), 总体来看, 在相互关系中Cu2+表现出主导作用。Cd2+-Cu2+复合胁迫6d时, Cu100-Cd200组POD被显著诱导(P < 0.05), 其他组POD被抑制, 但Cu100-Cd1000组与对照组差异不显著(P > 0.05)。Cd2+-Cu2+复合胁迫9d时, Cu500-Cd1000组POD被显著抑制(P < 0.05), 其他三组POD被显著诱导(P < 0.05)。从整个过程来看, 高浓度Cd2+-Cu2+组表现出持续的抑制作用, 胁迫强度和时间对沙蚕POD活性的影响可能存在累加效应。
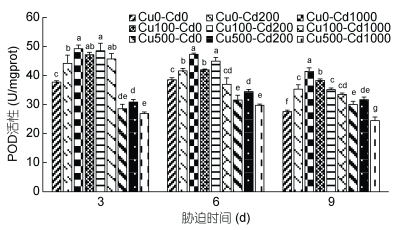 |
| 图 6 镉-铜单一及复合胁迫对沙蚕过氧化物酶活性的影响 Fig. 6 Effects of single and combined stress of Cd2+ and Cu2+ on POD activities of P. aibuhitensis |
Cd2+-Cu2+单一及复合胁迫对沙蚕GXH-Px活性的影响如图 7所示。从图 7可见, Cd2+、Cu2+胁迫使沙蚕GXH-Px被诱导, 实验组GXH-Px活性均高于对照组。沙蚕Cd2+单一胁迫3d时, 实验组GXH-Px活性被显著诱导(P < 0.05), 随着Cd2+浓度的升高GXH-Px活性呈先升后降的趋势, 但实验组之间差异不显著(P > 0.05); Cu2+单一胁迫3d时, 随着Cu2+浓度的升高GXH-Px活性呈先升后降的变化趋势, 低浓度时GXH-Px被显著诱导(P < 0.05), 高浓度组GXH-Px活性高于对照组, 但与对照组差异不显著(P > 0.05)。Cd2+-Cu2+复合胁迫3d时, 实验组GXH-Px均被显著诱导(P < 0.05), GXH-Px活性与Cu2+浓度呈正相关关系, 与Cd2+浓度呈负相关关系。沙蚕胁迫6d、9d时, 实验组GXH-Px活性均显著高于对照组(P < 0.05)。单一胁迫6d时, 随着Cd2+浓度的升高GXH-Px活性呈先升后降的趋势; 随着Cu2+浓度的升高GXH-Px活性呈上升的变化趋势。Cd2+-Cu2+复合胁迫6d时, GXH-Px活性与Cu2+浓度呈正相关关系, Cu2+浓度低时Cd2+浓度的变化对GXH-Px活性的影响不显著(P > 0.05), Cu2+浓度高时, 随着Cd2+浓度的增加GXH-Px活性显著下降(P < 0.05)。单一胁迫9d时, 随着Cd2+浓度的升高GXH-Px活性呈增强的趋势; 随着Cu2+浓度的升高GXH-Px活性呈先升后降的趋势的变化趋势。Cd2+-Cu2+复合胁迫9d, Cu2+浓度低时, 随着Cd2+浓度的增加GXH-Px活性显著升高(P < 0.05); Cu2+浓度高时, 随着Cd2+浓度的增加GXH-Px活性显著下降(P < 0.05)。Cd2+、Cu2+胁迫对沙蚕GXH-Px活性的影响存在交互效应, 胁迫浓度和时间对沙蚕GXH-Px活性的影响存在累加效应。
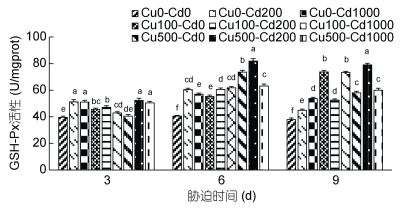 |
| 图 7 镉-铜单一及复合胁迫对沙蚕谷胱甘肽过氧化物酶活性的影响 Fig. 7 Effects of single and combined stress of Cd2+ and Cu2+ on GSH-Px activities of P. aibuhitensis |
Cd2+-Cu2+单一及复合胁迫对沙蚕MDA含量的影响见图 8。如图 8所示, Cd2+、Cu2+胁迫使沙蚕MDA被诱导, 实验组MDA含量均高于对照组, 具有明显的“剂量-效应”关系。随着胁迫时间延长显现升高→降低的动态变化规律, 表现出时间效应。实验过程中, 高浓度组和复合胁迫组MDA含量均显著高于对照组(P < 0.05)。单一胁迫3d、9d后, Cd2+和Cu2+低浓度实验组MDA含量高于对照组, 但差异不显著(P > 0.05), 胁迫6d时仅低浓度Cd2+组MDA含量与对照组差异不显著(P > 0.05)。整个实验过程中相同浓度的复合胁迫组MDA含量均高于单一胁迫组, Cd2+和Cu2+之间存在着协同关系。相同Cu2+浓度的复合胁迫实验组MDA含量无显著性差异(P > 0.05), 说明复合胁迫效果和Cu2+浓度并没有显著的相关性。
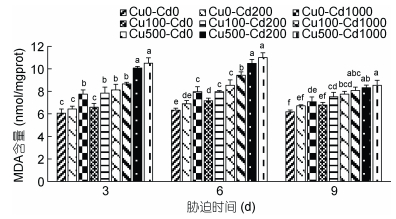 |
| 图 8 镉-铜单一及复合胁迫对沙蚕丙二醛含量的影响 Fig. 8 Effects of single and combined stress of Cd2+ and Cu2+ on MDA concentrations of P. aibuhitensis |
消化酶是由消化腺和消化系统分泌的一类水解酶, 主要分为淀粉酶、脂肪酶和蛋白酶等几大类, 不同生物体内同一功能酶的活性大小与其遗传性和食性有关。本实验结果表明, 沙蚕3种消化酶活性大小为淀粉酶 > 蛋白酶 > 脂肪酶, 黄晓春等(2005)报道沙蚕的淀粉酶活性高于蛋白酶的活性, 陈细香等(2007)研究结果显示星虫淀粉酶活性大于脂肪酶活性, 且脂肪酶活性相当低, 这与本研究相似, 这也是以海洋藻类或有机碎屑为食的海洋无脊椎动物共有的特点。
消化酶的活性变化能及时反映出动物的代谢状况和对环境适应的响应。已证实外界多种因素能对消化酶活性产生影响(李俊辉等, 2011)。由于整个胁迫过程中不喂食, 本实验是在饥饿条件下开展的, 结果显示, 饥饿胁迫下对照组的三种主要消化酶活性存在着动态变化, 淀粉酶、脂肪酶活性随着实验时间延长而降低, 酶活性-实验时间呈负相关关系; 蛋白酶活性随着时间延长呈升→降→升的变化趋势。因此, 本文在研究镉铜胁迫对沙蚕消化酶活性影响时, 通过比较相同胁迫时间时各实验组与对照组的测定值, 以便更好地阐明镉铜胁迫对沙蚕消化酶的真实影响效应。
目前重金属胁迫对沙蚕消化酶活性的影响报道很少。可口革囊星虫(Phascoloma esculenta)Cd2+处理组淀粉酶活性低于对照组, 且随着Cd2+浓度的增高而降低; 脂肪酶的变化趋势与淀粉酶相反, Cd2+处理组酶活性均显著性高于对照组, 随着Cd2+浓度的增高, 脂肪酶活性呈先增加、后下降、再增加而后又下降的变化趋势。Cu2+对星虫淀粉酶活性有抑制作用, 对脂肪酶活性有浓度依存的增强作用(陈细香等, 2007)。Cd2+对方格星虫(Sipunculus nudus)体腔液蛋白酶和淀粉酶活性在试验周期内均表现为抑制, 且淀粉酶活性受到的抑制作用较强; 低浓度Cd2+对脂肪酶活性有诱导作用, 高浓度Cd2+则产生抑制(董兰芳等, 2016)。Cu2+可以显著提高缢蛏淀粉酶活性, 对缢蛏蛋白酶活性无显著影响(吴众望等, 2003)。泥蚶在重金属Cd2+、Cu2+及其复合的胁迫下, 低浓度实验组的淀粉酶活性先升后降, 高浓度实验组淀粉酶活性从实验初始就保持在低水平, 处于抑制状态; 脂肪酶活性实验前期被激活, 后期处于抑制状态; 蛋白酶活性实验前期被激活, 呈升高-降低-再升高-再降低的复杂变化趋势, 实验后期呈升高-降低的动态变化(陈肖肖等, 2013)。以上实验结果表明, 金属离子对不同种类生物消化酶活性的作用效果并不完全一致, 显示出不同生物对外界环境中金属离子胁迫响应的多样性。现已证实, 金属离子能与底物、消化酶和酶活性产物以不同方式产生很强的亲和力, 进而改变酶活性, 产生抑制或诱导作用(李文静等, 2013)。在本实验中沙蚕3种消化酶活性对2种金属离子的胁迫呈现出不同的响应规律, 推测Cd2+、Cu2+对3种消化酶的作用形式和作用机制并不同。本实验结果初步表明, 随着水环境中添加的金属离子浓度的改变, 沙蚕蛋白酶和脂肪酶活性的变化能够一定程度上反映出金属离子的胁迫程度, 某些金属离子可提高沙蚕的摄食和消化吸收功能, 促进其生长。
本实验中, 消化酶活性和胁迫浓度间并没有呈显著的效应-剂量间相关关系, 消化酶活性的变化不足以准确地反映出沙蚕受损害的程度, 灵敏度偏低, 把沙蚕主要消化酶活性用作重金属Cd2+、Cu2+污染监测的潜在生物标记物的可能性较小。
3.2 镉-铜单一及复合胁迫对沙蚕抗氧化指标的影响SOD能够催化沙蚕体内的氧自由基(O2-·)歧化反应生成O2和H2O2, 清除细胞内新陈代谢等过程中产生的氧自由基, 并能稳定细胞膜, 同时SOD还是一种需要金属作为辅助因子的酶, 可与Cu、Zn和Mn螯合。SOD的活性间接反映了机体清除氧自由基的能力。本实验结果表明Cd2+、Cu2+胁迫能使沙蚕SOD被诱导, 随着胁迫时间的延长大部分呈下降趋势, 实验组和对照组的差别缩小, 表现出明显的时间效应。任可欣(2013)的研究结果表明在不同浓度镉胁迫情况下, 多齿围沙蚕SOD活性均高于对照组。赵圆圆(2013)研究显示Cu2+胁迫能诱导多齿围沙蚕SOD活性, 随着浓度的增加呈先上升后下降的趋势。双齿围沙蚕暴露在Pb2+溶液中, 胁迫的第1天SOD活性就被诱导, 随着胁迫时间的延伸, 其活性逐渐降低到对照组水平(田雨露, 2014); 孙福红等(2006b)报道Cu2+单因子污染暴露沙蚕SOD的活性被极显著的诱导。以上研究与本实验结果基本一致。受到胁迫时沙蚕体内产生了大量的活性氧自由基, SOD活性进而被激活, 可以在逆境胁迫下通过提高活性来减轻细胞的受损害程度, 是沙蚕对外界不利条件的一种自我保护机制。随着胁迫时间的延长, 双齿围沙蚕逐渐适应了Cd2+、Cu2+毒性, 实验后期SOD活性趋于一致。
CAT以铁卟啉为辅基, 是生物防御体系的关键酶之一, 能分解过氧化氢和羟自由基。本实验中, CAT整体呈被诱导的特性, CAT与SOD活性变化趋势并不完全一致。本实验前期, Cd2+胁迫能诱导沙蚕CAT活性, 且有明显的“剂量-效应”关系。实验后期, 高浓度Cu2+组被显著诱导, 随着Cu2+浓度的升高CAT活性呈上升趋势, 具有“剂量-效应”关系。复合胁迫实验组表现出持续的激活作用。在不同浓度Cd2+胁迫情况下, 多齿围沙蚕CAT活性高于对照组(任可欣, 2013); 低浓度Cu2+胁迫能诱导多齿围沙蚕CAT活性, 差异不显著, 高浓度Cu2+抑制CAT活性(赵圆圆, 2013); 王丽丽等(2015)研究发现Cd2+单一污染胁迫下, 双齿围沙蚕体内CAT活性先升高后降低, Cd2+污染胁迫下, 双齿围沙蚕体内CAT活性与Cd2+没有明显的“剂量-效应”关系; 然而Yuan等(2010)的实验结果显示, 双齿围沙蚕CAT活性与Cd2+胁迫浓度之间没有显著相关性。在一定的Cd2+、Cu2+浓度下, 沙蚕通过增加代谢来应对环境胁迫, CAT活性的增加可视为生物体对新陈代谢的适应, 减轻脂质过氧化损伤。当CAT能够抵御细胞内的氧化损伤时, 机体的CAT活性将会升高。随着胁迫时间的延长, 细胞结构受到了一定程度的损伤, 酶活性又逐渐回落。
POD可催化过氧化氢与氢供给体之间的氧化反应, 从而分解有毒物质过氧化氢。本实验中, POD与CAT和SOD活性变化规律并不完全一致, 低浓度实验组整体上被诱导, 高浓度组大部分被抑制。田雨露(2014)把双齿围沙蚕暴露在Pb2+溶液中, 发现双齿围沙蚕POD活性在Pb2+胁迫的第1天被显著诱导, 在第7天其活性降到对照组水平; 孙福红等(2006b)报道Cu2+单因子污染暴露下沙蚕POD活性受到显著影响, 在Cu2+单一处理条件下, 各处理组POD活性均低于对照组, 表现出先受到抑制后缓慢增加的趋势; 暴露在含镉水中15d后, 矛尾复虾虎鱼体内POD活性都随着暴露镉浓度的增加而显著减少(刘香江, 2010), 说明由于实验胁迫时间和处理剂量等的不同, 得出的结论会有差异。许多报道显示, 低浓度污染物对生物体代谢有一定的诱导激活作用, 叫做“毒物兴奋效应”(Vlahogianni et al, 2007)。当生物体受到轻度逆境胁迫时, 污染物的刺激导致了酶蛋白合成的增加, POD活性往往升高, 以清除体内的活性氧自由基。当胁迫浓度超过了生物的耐受度后, 会伤害生物细胞, 抑制酶活性。
GXH-Px可以将活性氧自由基和过氧化氢还原为水, 从而保护细胞免受活性氧自由基的伤害。本实验结果表明实验组GXH-Px活性均高于对照组, 这是因为Cd2+、Cu2+胁迫使沙蚕产生大量活性氧自由基, 激发GXH-Px活性, 防止细胞膜等生物组织受到伤害。本实验中随着胁迫时间的延长GXH-Px活性总体上呈先升后降的变化趋势, 表现出明显的时间效应。实验前期GXH-Px逐渐增大, 随着细胞损害程度的加重, 一旦超过了生物体的耐受限度, 就会导致GXH-Px活性下降。本研究中Cd2+-Cu2+复合胁迫实验前期, GXH-Px活性与Cu2+浓度呈正相关关系, 与Cd2+浓度呈负相关关系; 胁迫实验后期, Cu2+浓度低时, GXH-Px活性与Cd2+浓度呈正相关关系, Cu2+浓度高时, GXH-Px活性与Cd2+浓度呈负相关关系, 说明Cd2+、Cu2+胁迫对沙蚕GXH-Px活性的影响存在交互效应。Pb2+胁迫能诱导双齿围沙蚕的GSH-PX活性(田雨露, 2014), Cd2+对长江华溪蟹GSH-Px酶活性的影响(金芬芬等, 2011)和Cu2+对牡蛎GSH-Px酶活的影响(李艳红, 2013)结果均显示诱导能力呈现先增强后减弱的变化趋势, 与本实验结果基本吻合。GXH-Px活性变化情况与沙蚕种类、重金属的种类以及胁迫强度和时间密切相关。
MDA含量是最具代表性的膜脂质过氧化指标之一, 可以反映沙蚕机体内脂质过氧化的程度, 间接地反映出细胞受自由基攻击的严重程度。MDA含量的测定常常与SOD的测定相互配合, 本实验结果表明Cd2+、Cu2+胁迫使沙蚕MDA被诱导, 随着胁迫时间延长显升高→降低的动态变化趋势, 表现出时间效应, 说明Cd2+、Cu2+胁迫对沙蚕细胞膜造成过氧化损害, 加剧了膜的损伤, 且复合胁迫造成的伤害更大。王丽丽等(2015)指出双齿围沙蚕在单一Cd2+胁迫情况下, 随着胁迫浓度的升高MDA含量逐渐增大, Banni等(2009)Cd2+胁迫实验也得出相似的结论, 与本实验剂量-含量关系基本一致。不同Pb2+胁迫浓度和胁迫时间下, 双齿围沙蚕MDA含量呈现出动态的变化, 总的来说, 均为诱导的趋势(田雨露, 2014)。本实验中显著的效应-剂量间相关关系存在于特定时间(3d、6d)的MDA含量, MDA含量作为重金属Cd2+、Cu2+污染监测的潜在生物标志物的可能性较大。
许多资料表明, Cd2+、Cu2+胁迫水生生物时, 都会激活其SOD、CAT、POD和GXH-Px等抗氧化酶活性(Sun et al, 2008; Won et al, 2012), 原因可能是因为重金属的胁迫作用, 造成机体内活性氧自由基的生成, 从而诱导了酶活性的增加。通常情况下, 不同抗氧化酶会联合产生作用减轻细胞的受伤害程度, 在功能上既存在一定的相关性, 又具有相对的独立性, 对相同的胁迫条件会表现出不一样的响应规律, 相互作用机制较为复杂。比如SOD能催化机体内O2-·生成过氧化氢, 其自身就是一种活性氧化物, 过氧化氢可以通过CAT、POD和GXH-Px进一步分解。赖晓健等(2007)研究发现Cd2+胁迫下, 可口革囊星虫肠和体液抗氧化酶活性及MDA含量对Cd2+胁迫的响应趋势各有不同, 体液比肠更敏感, 因此抗氧化指标的增加或抑制不仅与污染物的浓度组合、污染时间、受试生物的敏感性等因素有关, 而且与测定时选择的生物体组织类型具有相关性。在应用抗氧化指标监测海洋环境污染时, 不应仅根据一种指标的变化, 而是应将几种指标结合起来综合分析(王重刚等, 2002), 同时应固定监测时间、选择统一的组织类型, 严格做到标准化、规范化操作。
4 结论(1) 沙蚕3种消化酶活性大小为淀粉酶 > 蛋白酶 > 脂肪酶。Cd2+、Cu2+胁迫对沙蚕不同消化酶的作用效果不同, 消化酶活性和胁迫浓度并没有呈显著的效应-剂量间相关关系。
(2) Cd2+、Cu2+胁迫对沙蚕的不同抗氧化指标作用效果不同, 整体上, Cd2+、Cu2+胁迫使沙蚕抗氧化指标增大, 随着胁迫时间的延长诱导作用减弱。显著的效应-剂量间相关关系存在于特定时间(3d、6d)的MDA含量, MDA含量作为潜在生物标志物的可能性较大, 但其能否作为Cd2+、Cu2+污染水生生态风险的预警性生物指标需要更进一步的调查和研究。
(3) Cd2+、Cu2+对同一指标分别表现出不同的胁迫效应, 复合胁迫中Cd2+、Cu2+对沙蚕各指标的影响存在交互效应。
王晶, 周启星, 张倩茹, 等. 2007. 沙蚕暴露于石油烃、Cu2+和Cd2+毒性效应及乙酰胆碱酯酶活性的响应. 环境科学, 28(8): 1796-1801 DOI:10.3321/j.issn:0250-3301.2007.08.026 |
王丽丽, 王轶男, 宋莹莹, 等. 2015. 镉、苯并(a)芘胁迫对双齿围沙蚕SOD、CAT活性及MDA含量的影响. 海洋环境科学, 34(1): 17-22 |
王重刚, 郑微云, 余群, 等. 2002. 苯并(a)芘和芘的混合物暴露对梭鱼肝脏抗氧化酶活性的影响. 环境科学学报, 22(4): 529-533 DOI:10.3321/j.issn:0253-2468.2002.04.023 |
田雨露..2014.双齿围沙蚕(Perinereis aibuhitensis)的形态学研究及其对Pb2+的毒性响应.青岛: 中国海洋大学硕士学位论文, 27-30
|
任可欣..2013. Cd2+污染胁迫对多齿围沙蚕(Perinereis nuntia)的毒性效应.哈尔滨: 黑龙江大学硕士学位论文, 25-35
|
刘香江..2010.重金属铜和镉(Cu和Cd)及乙酰甲胺磷对矛尾复虾虎鱼毒性效应的研究.武汉: 华中农业大学硕士学位论文, 33-37
|
孙福红, 周启星. 2006a. 沙蚕耐污染的特征及机理研究进展. 应用生态学报, 17(3): 530-533 |
孙福红, 周启星, 张倩如. 2006b. 石油烃、Cu2+对沙蚕的毒性效应及对其抗氧化酶系统的影响. 环境科学, 27(7): 1415-1419 |
李文静, 陈强, 杨欢, 等. 2013. 汞胁迫对拟穴青蟹(Scylla paramamosain)主要消化和免疫因子的影响. 海洋与湖沼, 44(3): 747-754 |
李学鹏, 段青源, 励建 荣.. 2010. 我国贝类产品中重金属镉的危害及污染分析. 食品科学, 31(17): 457-461 |
李俊辉, 王庆恒, 杜晓东, 等. 2011. 温度和pH对马氏珠母贝肝胰脏消化酶活力的影响. 水产学报, 30(2): 115-117 |
李艳红..2013.温度和铜离子对近江牡蛎抗氧化物酶活力及相关基因表达的影响.湛江: 广东海洋大学硕士学位论文, 12-24
|
吴众望, 潘鲁青, 董双 林.. 2003. 9种金属离子对缢蛏消化酶活力的影响. 中国水产科学, 10(4): 297-300 DOI:10.3321/j.issn:1005-8737.2003.04.007 |
陈肖肖, 高业田, 吴洪喜, 等. 2013. 重金属Cd2+和Cu2+胁迫下泥蚶消化酶活性的变化. 生态学报, 33(24): 7690-7698 |
陈细香, 卢昌 义.. 2007. 4种金属离子对可口革囊星虫消化酶活力的影响. 台湾海峡, 26(4): 528-535 DOI:10.3969/j.issn.1000-8160.2007.04.011 |
金芬芬, 徐团, 秦圣娟, 等. 2011. 镉对长江华溪蟹肝胰腺线粒体抗氧化酶活力和脂质过氧化水平的影响. 水生生物学报, 35(6): 1019-1024 |
赵圆圆..2013. Cu2+胁迫对多齿围沙蚕毒性效应的研究.厦门: 集美大学硕士学位论文, 19-25
|
洪美玲, 李春瑜, 王力军, 等. 2015. 急性铜胁迫对海陆蛙蝌蚪抗氧化效应及金属解毒能力的影响. 应用与环境生物学报, 21(3): 494-498 |
黄晓春, 苏秀榕, 苏月 萍.. 2005. 沙蚕和星虫的营养成分研究. 水产科学, 24(6): 10-11 DOI:10.3969/j.issn.1003-1111.2005.06.004 |
宿丽丽, 阎希 柱.. 2016. BDE-47胁迫对双齿围沙蚕抗氧化防御系统的影响. 福建农业学报, 31(6): 560-565 |
董兰芳, 张琴, 曾梦清, 等. 2016. Cd2+急性胁迫下方格星虫体腔液消化酶活力和游离氨基酸的变化. 水生生物学报, 40(3): 524-531 |
赖晓健, 李裕红, 林智 勇.. 2007. Cd2+对可口革囊星虫抗氧化酶活性的影响. 厦门大学学报(自然科学版), 46(S1): 131-135 |
Banni M, Bouraoui Z, Clerandeau C et al, 2009. Mixture toxicity assessment of cadmium and benzo. Chemosphere, 77(7): 902-906 DOI:10.1016/j.chemosphere.2009.08.041 |
Bryan G W. Johaston R., 1976. Heavy Metal Contamination in the Sea in Marine Pollution. London: Academic Press, 185-302
|
Cuypers A, Plusquin M, Remans T et al, 2010. Cadmium stress:an oxidative challenge. Biometals, 23(5): 927-940 DOI:10.1007/s10534-010-9329-x |
Mason A Z, Jenkins K D..1995. Metal detoxification in aquatic organisms. In: Tessier A, Turner D eds. Metal Speciation and Bioavailability in Aquatic Systems. London: John Wiley, 479-608
|
Sun F H, Zhou Q X., 2008. Oxidative stress biomarkers of the polychaete Nereis diversicolor exposed to cadmium and petroleum hydrocarbons. Ecotoxicology and Environmental Safety, 70(1): 106-114 DOI:10.1016/j.ecoenv.2007.04.014 |
Vlahogianni T H, Valavanidis A., 2007. Heavy-metal effects on lipid peroxidation and antioxidant defence enzymes in mussels Mytilus galloprovincialis. Chemistry and Ecology, 23(5): 361-371 DOI:10.1080/02757540701653285 |
Won E J, Rhee J S, Kim R O et al, 2012. Susceptibility to oxidative stress and modulated expression of antioxidant genes in the copper-exposed polychaete Perinereis nuntia. Comparative Biochemistry and Physiology Part C:Toxicology & Pharmacology, 155(2): 344-351 |
Yuan X T, Chen A H, Zhou Y B et al, 2010. The influence of cadmium on the antioxidant enzyme activities in polychaete Perinereis aibuhitensis Grube (Annelida:Polychaeta). Chinese Journal of Oceanology and Limnology, 28(4): 849-855 DOI:10.1007/s00343-010-9127-x |
 2020, Vol. 51
2020, Vol. 51


