中国海洋湖沼学会主办。
文章信息
- 史秀兰, 王炳谦, 黄天晴, 谷伟, 程琳, 刘晨斌, 陈春山, 魏凯, 徐革锋. 2020.
- SHI Xiu-Lan, WANG Bing-Qian, HUANG Tian-Qing, GU Wei, CHENG Lin, LIU Chen-Bin, CHEN Chun-Shan, WEI Kai, XU Ge-Feng. 2020.
- 黑龙江乌苏里白鲑(Coregonus ussuriensis Berg)胚胎发育观察研究
- OBSERVATION ON EMBRYO DEVELOPMENT OF USSURI WHITEFISH COREGONUS USSURIENSIS BERG IN HEILONGJIANG RIVER
- 海洋与湖沼, 51(2): 415-421
- Oceanologia et Limnologia Sinica, 51(2): 415-421.
- http://dx.doi.org/10.11693/hyhz20191200286
文章历史
-
收稿日期:2019-12-31
收修改稿日期:2020-01-30
2. 上海海洋大学水产与生命学院 上海 200120;
3. 北京市水生野生动植物救护中心 北京 102110
2. School of Fisheries and Life Sciences, Shanghai Ocean University, Shanghai 200120, China;
3. Beijing Aquatic Wildlife Rescue and Conservation Center, Beijing 102110, China
乌苏里白鲑(Coregonus ussuriensis Berg)俗称雅巴沙、兔子鱼、白鱼, 隶属鲑形目(Salmoniformes)、鲑科(Salmonidae)、白鲑亚科(Coregoninae)、白鲑属(Coregonus), 常年栖息在水质清澈、水温偏低的水域, 属典型的冷水性鱼类(张觉民, 1995)。广泛分布在北纬45°以北, 包括俄罗斯西伯利亚、萨哈林地区, 中国黑龙江、乌苏里江、松花江、牡丹江等流域(解玉浩, 2007)。乌苏里白鲑因口感鲜嫩、富含高不饱和脂肪酸而倍受消费者青睐, 成为中国黑龙江水系特产珍稀名贵冷水鱼(王继隆等, 2018)。通过资源调查发现, 在黑龙江境内的乌苏里白鲑群体数量最多, 其资源开发率为0.403(王继隆等, 2019)。由于乌苏里白鲑属于洄游性鱼类, 其产卵期恰逢黑龙江水域的封冰期, 致使捕捞难度加大, 但这正对资源起到了重要保护作用(李虹娇等, 2017)。然而近几年来, 由于水利工程的兴建, 水体污染, 高强度捕捞作业致使乌苏里白鲑的渔获量急剧减少(吕军等, 2017), 群体数量与个体繁殖力呈现衰退趋势, 目前该鱼已被收入到《中国濒危动物红皮书鱼类》名录(乐佩琪等, 1998)。
为恢复种群规模, 进行保护性水产养殖工作已迫在眉睫。自1997年至今, 有学者已对乌苏里白鲑的生物学特征(董崇智等, 1997)、遗传多样性(梁利群等, 2004)与资源现状评估(杨富亿等, 2015)等方面进行了研究, 而对乌苏里白鲑的胚胎发育观察还未见报道。本研究对乌苏里白鲑的胚胎发育过程进行观察, 旨在探究人工繁育条件下的乌苏里白鲑胚胎发育规律, 为进行保护性水产养殖的苗种培育提供基础数据。
1 材料与方法 1.1 受精卵获取与孵化条件在中国水产科学研究院黑龙江水产研究所渤海冷水性鱼类试验站完成了乌苏里白鲑(Coregonus ussurinsis Berg)亲鱼的全人工培育。12月初, 选取5龄的性成熟雄鱼与雌鱼, 人工采集配子, 进行湿法授精获得受精卵, 受精卵孵化和仔稚鱼培育的水温为3.0—5.6℃, 平均水温为4.3℃, 溶氧为5.0— 9.0mg/L。
1.2 取样与观察在受精后2h内, 间隔15min取样1次; 受精后2—48h, 间隔2h取样1次; 48—72h, 间隔12h取样1次; 72h之后, 每天取样1次, 直到出膜期, 每次所采卵粒个数为15—25粒, 并将受精卵置于Bouin’s液, 固定48h后, 将样品转入75%的酒精中, 置于4℃备用。除去受精卵的黏膜使胚体暴露, 易于观察胚胎发育, 胚胎发育的时序以镜检50%个体出现新特征为划分发育阶段的标准; 仔稚鱼阶段则直接使用显微照像的方法进行观察。使用LEICA S9D型体视显微镜进行观察, 并记录乌苏里白鲑胚胎发育和仔稚鱼期的形态特征; 同时使用ToupView 3.7成像系统进行拍照, 以出现超过50%的个体新特征进行发育时期的划分。为详细描述乌苏里白鲑的胚胎发育, 本文参照鲑科鱼类的研究成果, 如哲罗鲑(Hucho taimen)、虹鳟(Oncorhynchus mykiss)、金鳟(O. mykiss)、山女鳟(O. masou masou)、细鳞鲑(Brachymystax lenok) (韩荀, 1984; 王昭明等, 2005; 张永泉等, 2008; 杜佳等, 2010; 徐革锋等, 2010; 王庆龙, 2013)等, 确定乌苏里白鲑胚胎发育的主要分期和形态学特征, 整理发育时序图。
1.3 有效积温计算与图像处理由于生物体发育到某个阶段的总热量趋于一个常数, 故使用有效积温来描述胚胎发育的各阶段, 计算公式如下: K = NT (K表示有效积温(℃·h), N表示此发育阶段所经历的时间h, T表示此发育阶段的平均水温℃)。整个胚胎发育有效积温等于各发育阶段的有效积温之和。采用Phtoshop CC图像处理软件制作胚胎发育与仔稚鱼时序图版。
2 结果与分析 2.1 胚胎发育通过观察发现, 乌苏里白鲑成熟卵粒呈圆球形, 浅黄色, 卵膜较光滑且卵质透明, 卵径大小为1.8—2.3mm, 平均直径为2.1mm, 是具微黏性的沉性卵。在3.0—4.5℃的水温条件下, 受精卵完成胚胎期发育所需有效积温为7753.80(℃·h)。其胚胎发育时序与其他鲑科鱼类分期一致, 分为8个阶段, 即受精卵、卵裂期、囊胚期、原肠期、神经胚期、器官分化期及孵出阶段。进一步分为16个发育分期, 即受精期、卵裂期、囊胚中期、低囊胚期、囊胚晚期、原肠胚期、神经胚期、眼基出现期、脑部分化期、尾芽出现期、眼囊形成期、胸鳍出现期、眼晶体出现期、尾鳍出现期、眼色素出现期、出膜期(表 1)。
| 图序 | 发育时期 | 平均水温(℃) | 受精后时间(h) | 有效积温(℃·h) | 主要特征 |
| 1 | 受精期 | 4.2 | 0 | 0.00 | 卵呈圆形, 淡黄色, 具有微黏性的沉性卵。 |
| 2 | 卵裂期 | 5.0 | 24 | 125.30 | 胚盘隆起, 由2细胞逐渐向4细胞, 8细胞至多细胞分裂。 |
| 3 | 囊胚早期 | 5.2 | 135 | 642.60 | 囊胚层的高度较早期低, 细胞界限不清晰, 且沿卵膜开始向下扩展。 |
| 4 | 低囊胚期 | 5.3 | 156 | 826.80 | 囊胚层逐渐变扁, 呈现圆盘状 |
| 5 | 囊胚晚期 | 5.3 | 182 | 959.30 | 囊胚层外包卵黄面积逐渐扩大, 且厚度变薄, 胚环开始形成。 |
| 6 | 原肠胚期 | 5.2 | 216 | 1019.40 | 卵黄被覆盖2/3以上。胚盾向动物极发展, 胚环向下凹陷, 胚盾逐渐变厚变大。 |
| 7 | 神经胚期 | 4.7 | 248 | 1132.20 | 胚盾出现较深的神经沟 |
| 8 | 眼基出现期 | 4.7 | 264 | 1245.00 | 胚体头部两侧向外出现对称隆起。 |
| 9 | 脑部分化期 | 4.5 | 292 | 1353.00 | 头部区逐渐分化有清晰的前、中、后脑。 |
| 10 | 尾芽出现期 | 4.3 | 320 | 1456.20 | 胚体后端突起呈现圆弧状, 较前段粗大。 |
| 11 | 眼囊形成期 | 4.3 | 341 | 1559.40 | 胚体头部区两侧形成对称的椭圆性形囊状窝。 |
| 12 | 胸鳍出现期 | 4.3 | 366 | 1662.60 | 在胚体两侧出现一对对称的月牙状突起, 胸鳍出现。 |
| 13 | 眼晶体出现期 | 4.3 | 408 | 1765.80 | 眼囊中逐渐浮现圆形半透明晶体, 在胚体扭动时转动。 |
| 14 | 尾鳍出现期 | 3.7 | 480 | 2061.00 | 扇形尾部出现鳍褶, 贴伏在卵黄一周。 |
| 15 | 眼色素出现期 | 3.3 | 720 | 2901.00 | 眼球部黑色素不断沉积, 眼囊逐渐变黑。 |
| 16 | 出膜期 | 4.5 | 1791 | 7753.80 | 胚体尾部先破膜, 尾部剧烈摆动。 |
原生质逐渐聚集在动物极形成胚盘(图 1-1), 胚盘隆起, 其顶部中央开始横向凹陷且粘连, 分裂出大小均等且形状相似的细胞, 即2细胞期(图 1-2), 随细胞分裂继续且呈指数型快速增长至4细胞、8细胞、16细胞及桑葚期(图 1-3), 细胞体积变小且界限由清晰逐渐模糊, 胚盘厚度增加逐渐向囊胚早期过渡。此时乌苏里白鲑受精卵完成卵裂期的有效发育积温达到125.30(℃·h)。
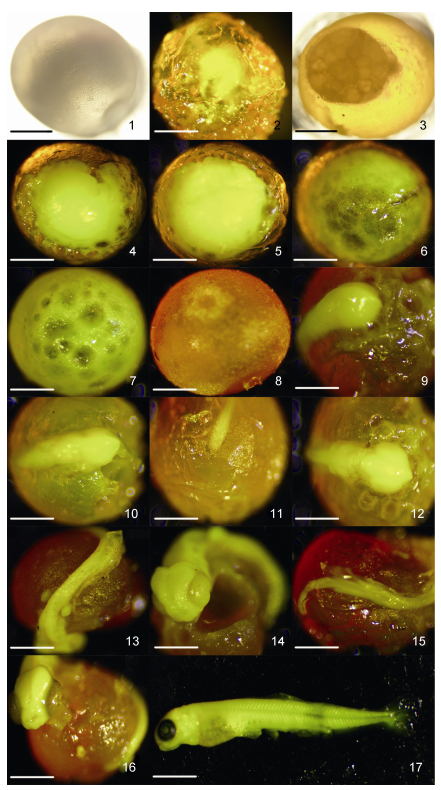 |
| 图 1 乌苏里白鲑胚胎发育 Fig. 1 Embryonic development of C. ussuriensis 注: 1.受精卵, 2. 2细胞期, 3.桑葚期, 4.囊胚早期, 5.囊胚中期, 6.囊胚晚期, 7.原肠胚期, 8.神经胚期, 9.眼基出现期, 10.脑部分化期, 11.尾芽出现期, 12.眼囊形成期, 13.胸鳍出现期, 14.眼晶体出现期, 15.尾鳍出现期, 16.眼色素出现期, 17.仔稚鱼。图中标尺: 1mm |
随细胞数目增加, 胚盘隆起厚度达到最高, 形成高囊胚, 标志着此时进入囊胚早期(图 1-4), 囊胚层如土堆状, 与卵黄颜色及质地有明显差异, 边缘形状不规则, 向植物极有延伸趋势; 随着发育继续, 囊胚层面积开始变大, 并且边缘沿卵黄向植物极下包和内卷, 细胞层逐渐变薄, 胚胎进入囊胚中期(图 1-5); 囊胚层逐渐变得更为扁平, 随后胚盘继续下包, 形成胚环, 囊胚进入晚期阶段(图 1-6)。
2.1.3 原肠胚期当胚盘下包至卵黄约1/3处, 即进入原肠早期。此时胚盘细胞层内缩, 且大小不一, 分布不均如沟壑, 此时头突轮廓形成, 胚体开始延长并逐步完整, 胚层细胞下周逐渐增厚隆起形成胚盾, 当胚体下包至卵黄约2/3处标志着进入原肠晚期, 胚盾逐渐延伸并微微膨大(图 1-7), 此时积温已达到1019.40(℃·h)。
2.1.4 神经胚期胚体继续下包至卵黄的4/5, 植物极被胚层包裹构成胚孔。在此发育阶段, 神经沟板逐渐形成, 卵黄栓外露(图 1-8)。胚体的中后部明显隆起, 头部雏形逐渐形成, 此阶段的有效发育积温达到1132.20(℃·h)。
2.1.5 早期器官发生阶段当胚胎的有效发育积温达到1245.00(℃·h)时, 在胚体的头部轮廓区的两侧有向外的椭圆形隆起, 即构成眼睛的原基, 值得注意的是, 此时胚孔未完全封闭(图 1-9)。有效积温达到1353.00(℃·h)时, 脑部开始分化, 从脑部轮廓来看, 可明显的分为前、中、后脑(图 1-10); 达到1456.20(℃·h)后, 尾芽开始游离于卵黄, 继续延伸(图 1-11); 1559.40(℃·h)时, 在眼囊下方出现暗色斑块, 即嗅囊, 眼原基继续发育, 眼囊形成(图 1-12); 1662.60(℃·h)时, 在头部后方两侧出现两个对称的椭圆形突起, 即胸鳍出现(图 1-13); 积温达到1765.80(℃·h)时, 眼囊继续发育, 视泡变成视杯, 内部晶体形成(图 1-14); 2061.00(℃·h)时, 此时尾鳍逐渐形成, 出现透明鳍褶且游离于卵黄(图 1-15); 2901.00(℃·h), 眼球内部不断沉积黑色素, 眼囊渐渐变黑, 进入眼色素出现期, 此阶段称做发眼期(图 1-16); 7753.80(℃·h), 胚体已完全具备仔鱼特征, 尾部继续延伸并且鳍褶变宽, 胚体扭动强烈, 卵膜渐渐变薄, 同时胚体的运动扭扯, 卵膜开始破裂, 从尾部破膜而出, 即出膜期。
2.2 仔稚鱼发育 2.2.1 初孵仔鱼时期当胚胎发育的有效积温达到7753.80(℃·h)时进入出膜期, 这与哲罗鱼、金鳟相比较晚。胚体尾部通过扭动破膜而出, 随后头部摆脱卵膜的束缚, 褪去卵壳的初孵仔鱼头部伏在卵黄囊上, 腹部与卵黄囊相连, 尾部与卵黄囊脱离, 且卵黄囊有呈向扁长型发展趋势, 此时几乎没有游泳能力, 全身透明, 肌节较明显, 肛门原基可见, 由不存在油球, 因此多数沉于水底, 通过尾部的摆动向前行进。在出膜后9d, 鱼体质量为5.6—7.2mg, 全长为8.3—12mm, 卵黄囊逐渐吸收, 由原始圆形转变为扁椭圆形, 此时鱼体的营养来源仍是依靠卵黄囊, 体色仍呈现透明状, 腹部开始有斑点状黑色素沉积, 胸鳍变宽呈扇形, 有较强的游泳能力(图 2-1)。
 |
|
图 2 乌苏里白鲑仔鱼的发育 Fig. 2 Development of C. ussuriensis larvae 注: 1.出膜后9d仔鱼, 2.出膜后12d仔鱼, 3.出膜后18d仔鱼, 4.上浮17d仔鱼, 5.上浮27d仔鱼, 6.上浮37d仔鱼, 7.上浮47d稚鱼。图中标尺: 5mm |
在出膜后12d, 卵黄囊与心脏相连, 血液流动开始明显布满全身, 由于眼囊充满黑色素使得全部眼球呈现黑色, 眼球变大, 鳃盖透明有较弱张合, 口裂活动不明显, 此时尾鳍分化完全(图 2-2)。出膜后18d仔鱼, 鱼体质量为8.3—13.4mg,
体长9.6—15.8mm, 卵黄囊吸收基本完全并开始上浮, 在显微镜下可看到清晰的血管分布, 此时可依稀看清血液流通路径, 在泄殖腔处尤其可见明显血管球且能明显看到体节(图 2-3a), 于背部、尾部均出现黑色素, 肠道较之前变粗(图 2-3)。上浮17d后, 鱼体质量为15.6—21.5mg, 体长为16—22mm, 在背鳍和尾鳍分化完全, 斑点状黑色素从背部与腹部向体两侧延伸, 并且已有明显口裂(图 2-4b), 可进行外界摄食, 鱼体的营养能量来源已进入外源性营养阶段, 由鱼体呈现半透明, 肠道可见粪便轮廓(图 2-4)。在上浮27d后, 鱼体质量为24.3—30mg, 体长为21.5—26mm, 胸鳍已分化完全, 头部出现星点状黑色素分布(图 2-5c), 体色较前期更深, 差异逐渐清晰(图 2-5)。
2.2.3 稚鱼在上浮37d后, 鱼体质量为32— 36.2mg, 体长为23.5—32.4mm, 背部鳞片逐渐覆盖全身, 体色开始转换(图 2-6)。上浮47d后, 体型体色已接近成鱼(图 2-7d), 体色已呈银白色。尾鳍、腹鳍与胸鳍分化完全, 且呈现半透明状。鳞片已覆盖全身(图 2-7)。
3 讨论目前关于鲑科鱼类胚胎发育的报道, 可见虹鳟、山女鳟、金鳟、哲罗鱼、细鳞鱼以及杂交品种的胚胎发育分期, 通过对比发现, 在这些物种之间, 虽同属鲑科鱼类, 但胚胎发育时期有较大差异。卵裂期是众多育种学者关注的时期, 这关系到多倍体育种关键时间点的把控(王延晖, 2017), 母源因子转录物分析(Sun et al, 2010)等。在卵裂期, 哲罗鱼、细鳞鱼、金鳟与乌苏里白鲑的有效积温分别为160.90、199.90、216.24和125.30℃·h, 结果显示, 乌苏里白鲑在进行这一阶段所需热量最少, 推测原因是由于孵化温度的差异或物种自身差异导致胚胎发育速度不同。在生产当中, 将眼色素形成期称为发眼期(黄志秋, 2016), 比较虹鳟、金鳟、哲罗鱼、细鳞鱼、山女鳟和乌苏里白鲑的有效积温分别为4332.00、5130.00、3735.50、3365.00、5808.00和2901.00℃·h, 乌苏里白鲑较众多鲑科鱼类偏低。在进行胚胎发育的过程中, 其他鲑科鱼类的胚胎会出现“敏感期”, 即从原肠胚期开始至眼色素形成期, 易受孵化环境的变化波动影响, 使得生产效率下降(杨瑞斌等, 2008), 因此在进行长途运输过程中, 通常采用发眼卵。值得注意的是, 乌苏里白鲑不存在“敏感期”, 在硬骨鱼类中, 先天免疫系统对宿主防御极为重要, 而免疫系统显著的受到水温的影响, 但目前胚胎孵育温度对幼鱼先天免疫的影响机制还知之甚少(Zhang et al, 2018)。乌苏里白鲑到出膜期的有效积温达到7753.80℃·h, 较其他鲑科鱼类进入出膜期迟缓, 推测出现这一结果可能是由于水温较低使得发育缓慢。
温度是影响胚胎发育、孵化率以及孵化后性能一个非常重要的环境因素, 在早期研究中已经展开了温度对养殖以及野生鱼类早期发育和存活影响的探讨(Puvanendran et al, 2015)。在胚胎发育的研究表明, 早期胚胎阶段, 如卵裂、原肠胚和胚孔闭合期, 对热和机械应力的敏感性高于后期胚胎发育阶段(Buckley et al, 2000)。孵化温度的快速升高可能对胚胎产生有害影响, 并且可以阻止发育, 甚至是畸形, 最终可能导致死亡。但在最佳范围内升高温度可以加快孵化速度并缩短孵化时间(Small et al, 2001)。乌苏里白鲑比起其他鲑科鱼类, 孵化温度偏低, 甚至有些在破膜后一天内上浮, 推测破膜时, 胚体失去卵壳的保护, 使得胚体受到温度变化起伏较大, 由于刚出膜的乌苏里白鲑仔鱼不能开口摄食, 因此, 卵黄囊是提供的内源性营养维持生命活动的唯一来源, 卵黄物质在仔鱼早期的生长发育起到了关键作用(马宾等, 2019)。现有研究表明胚胎期的温度会影响胚胎的发育和活力, 在较高温度下胚胎代谢率的增加使得幼鱼能够更快地发育并且以更小的尺寸孵化, 即卵黄囊吸收迅速, 但具体原因需进一步探讨。
在全球气候变化的背景下, 对野生物种的生存环境也产生了不可忽视的影响。保护性水产养殖是通过幼鱼的增殖放流来帮助保护和恢复濒危野生鱼类种群, 目前已在鳟、鲟和鲱等物种中开展。当前乌苏里白鲑被列为濒危物种, 实施保护性水产养殖措施已迫在眉睫。因此在今后的扩繁工作中, 利用分子标记辅助育种技术, 加强对种质群体的遗传多样性的保护与维持也尤为重要(黄天晴等, 2018)。乌苏里白鲑表现出与其他鲑科鱼类在生长发育的不同, 通过胚胎发育的观察, 不仅对苗种规模化生产有指导意义, 并且乌苏里白鲑可以作为研究孵化温度对硬骨鱼类先天免疫系统及胚后发育影响的良好模型。
4 结论本文对乌苏里白鲑胚胎发育过程进行了系统观察和描述, 乌苏里白鲑胚胎发育时序分为8个阶段, 即受精卵、卵裂期、囊胚期、原肠胚期、神经胚期、早期器官形成及孵出阶段。根据其形态特征进一步可分为16个分期。本研究为开展乌苏里白鲑保护性水产养殖工作进行了基础性研究, 对在苗种生产过程中出现异常提供科学理论指导。
马宾, 张磊, 张志强, 等. 2019. 欧洲舌齿鲈胚胎发育及仔鱼生长观察. 大连海洋大学学报, 34(3): 303-309 |
王延晖. 2017. 鱼类人工多倍体育种及其在水产养殖中的应用. 河南水产, (6): 3-5 |
王庆龙, 2013.金鳟和虹鳟繁殖与育种关键技术研究.青岛: 中国海洋大学硕士学位论文, 28-34
|
王昭明, 王炳谦, 陈 惠.. 2005. 山女鳟早期发育及低温耐性观察. 水产学杂志, 18(2): 6-10 DOI:10.3969/j.issn.1005-3832.2005.02.002 |
王继隆, 刘伟, 李培伦, 等. 2018. 乌苏里白鲑肌肉营养成分与品质评价. 广东海洋大学学报, 38(5): 35-40 DOI:10.3969/j.issn.1673-9159.2018.05.006 |
王继隆, 刘伟, 鲁万桥, 等. 2019. 黑龙江中游乌苏里白鲑资源现状评估. 生态学杂志, 38(6): 1824-1829 |
乐佩琪, 陈宜瑜. 1998. 中国濒危动物红皮书(鱼类). 北京: 科学出版社, 41
|
吕军, 汪雪格, 刘伟, 等. 2017. 松花江流域主要干支流纵向连通性与鱼类生境. 水资源保护, 33(6): 155-160, 174 |
杜佳, 徐革锋, 韩英, 等. 2010. 尖吻细鳞鲑胚胎及仔、稚、幼鱼发育的研究. 大连海洋大学学报, 25(5): 379-385 DOI:10.3969/j.issn.1000-9957.2010.05.001 |
李虹娇, 韩英. 2017. 乌苏里白鲑生物学特征调查报告. 黑龙江水产, 36(1): 17-20 DOI:10.3969/j.issn.1674-2419.2017.01.007 |
杨富亿, 阎百兴, 王强, 等. 2015. 松花江下游鱼类资源评估. 湿地科学, 13(1): 87-97 |
杨瑞斌, 谢从新, 樊启学. 2008. 仔稚鱼发育敏感期研究进展. 华中农业大学学报, 27(1): 161-165 DOI:10.3321/j.issn:1000-2421.2008.01.034 |
张永泉, 尹家胜, 贾钟贺, 等. 2008. 哲罗鱼胚胎和仔鱼发育的研究. 大连水产学院学报, 23(6): 425-430 DOI:10.3969/j.issn.1000-9957.2008.06.003 |
张觉民. 1995. 黑龙江省鱼类志. 哈尔滨: 黑龙江科技出版社, 56-58
|
徐革锋, 杜佳, 张永泉, 等. 2010. 哲罗鱼(♀)与细鳞鱼(♂)杂交种胚胎及仔稚鱼发育. 中国水产科学, 17(4): 630-636 |
黄天晴, 徐革锋, 谷伟, 等. 2018. 用微卫星分析细鳞鲑(Brachymystax lenok)连续3代选育群体的遗传结构. 海洋与湖沼, 49(4): 858-865 |
黄志秋. 2016. 攀西地区山女鳟发眼卵人工孵化技术探讨. 西昌学院学报•自然科学版, 30(4): 4-6 |
梁利群, 常玉梅, 董崇智. 2004. 黑龙江乌苏里白鲑遗传多样性分析. 中国水产科学, 11(6): 501-505 DOI:10.3321/j.issn:1005-8737.2004.06.003 |
董崇智, 夏重志, 姜作发, 等. 1997. 黑龙江乌苏里白鲑生殖群体生态学特征及资源保护. 水产学杂志, 10(1): 14-21 |
韩荀. 1984. 虹鳟鱼胚胎发育的研究. 山西大学学报, (2): 54-61 |
解玉浩. 2007. 东北地区淡水鱼类. 沈阳: 辽宁科学技术出版社, 322-325
|
Buckley L J, Bradley T M, Allen-Guilmette J, 2000. Production, quality, and low temperature incubation of eggs of Atlantic cod Gadus morhua and haddock Melanogrammus aeglefinus in captivity. Journal of the World Aquaculture Society, 31(1): 22-29 DOI:10.1111/j.1749-7345.2000.tb00694.x |
Puvanendran V, Falk-Petersen I B, Lysne H et al, 2015. Effects of different step-wise temperature increment regimes during egg incubation of Atlantic cod (Gadus morhua L. ) on egg viability and newly hatched larval quality. Aquaculture Research, 46(1): 226-235 |
Small B C, Bates T D., 2001. Effect of low-temperature incubation of channel catfish Ictalurus punctatus eggs on development, survival, and growth. Journal of the World Aquaculture Society, 32(2): 189-194 DOI:10.1111/j.1749-7345.2001.tb01094.x |
Sun M, Li Z, Gui J F., 2010. Dynamic distribution of spindlin in nucleoli, nucleoplasm and spindle from primary oocytes to mature eggs and its critical function for oocyte-to-embryo transition in gibel carp. Journal of Experimental Zoology. Part A-Ecological Genetics and Physiology, 313A(8): 461-473 DOI:10.1002/jez.618 |
Zhang Q R, Kopp M, Babiak I et al, 2018. Low incubation temperature during early development negatively affects survival and related innate immune processes in zebrafish larvae exposed to lipopolysaccharide. Scientific Reports, 8: 4142 DOI:10.1038/s41598-018-22288-8 |
 2020, Vol. 51
2020, Vol. 51


