
中国海洋湖沼学会主办。
文章信息
- 史宝, 孙冉冉, 柳学周, 徐永江, 姜燕, 王滨, 张正荣. 2020.
- SHI Bao, SUN Ran-Ran, LIU Xue-Zhou, XU Yong-Jiang, JIANG Yan, WANG Bin, ZHANG Zheng-Rong. 2020.
- 黄条鰤(Seriola aureovittata)MyHC基因克隆及其在早期发育阶段表达研究
- MOLECULAR CLONING AND mRNA EXPRESSION OF MyHC GENE IN THE EARLY DEVELOPMENT OF YELLOWTAIL KINGFISH SERIOLA AUREOVITTATA
- 海洋与湖沼, 51(2): 422-432
- Oceanologia et Limnologia Sinica, 51(2): 422-432.
- http://dx.doi.org/10.11693/hyhz20191100205
文章历史
-
收稿日期:2019-11-06
收修改稿日期:2020-01-06
2. 大连海洋大学水产与生命学院 大连 116023
2. College of Fisheries and Life Science, Dalian Ocean University, Dalian 116023, China
肌纤维体积决定了肌肉的生长发育, 骨骼肌纤维粗肌丝的基本组成单位是肌球蛋白。肌球蛋白是动物体内一种重要的功能性马达蛋白, 在肌肉运动、细胞器运动以及肌肉收缩和信号传导等方面发挥着重要调控作用(Heissler et al, 2016)。肌球蛋白是由2条肌球蛋白重链(MyHC)和4条肌球蛋白轻链(MyLC)组成。MyHC具有ATP酶活性, 可将其水解为ADP释放能量, 并且含有肌动蛋白结合位点, 为肌肉收缩提供动力从而直接影响鱼类的生长(Knight et al, 2000; Campion et al, 2012)。与哺乳动物肌肉生长的模式不同, 鱼类肌纤维生长模式始终存在增生和增粗, 鱼类这种生长现象被称为非限制性生长。研究表明MyHC表达量高低影响肌纤维的增生, 与鱼类的非限制性生长有关(Biga et al, 2009; 陈之航等, 2017)。在翘嘴鳜(Siniperca chuatsi), MyHC在快长组与慢长组实验鱼中的差异表达提示其在翘嘴鳜胚胎及早期生长发育过程中发挥重要作用(陈之航等, 2017)。对大西洋鲑(Salmo salar)的研究表明鱼体特定生长率与MyHC表达量的高低有关(Hevr y et al, 2006)。对脊尾白虾(Exopalaemon carinicauda)的研究发现MyHC在仔虾第一天的表达量显著高于胚胎发育的其他时期(王佳佳等, 2019)。
黄条鰤(Seriola aureovittata)属鲈形目(Perciformes)、鯵科(Carangidae)、鰤属(Seriola), 是我国本土分布的大洋性经济鱼类(柳学周等, 2017; 史宝等, 2019a, b), 具有营养丰富、生长速度快等优点。生长速度是鱼类养殖中一项重要的经济指标, 而提高鱼类产量是水产养殖业不断追求的目标, 因此解析鱼类肌肉生长发育基因的分子调控机制有利于鱼类养殖业发展。黄条鰤早期生长发育研究相对较少, 相关功能基因研究信息缺乏。本研究克隆了黄条鰤MyHC基因全长cDNA序列、分析了其序列结构与分子系统进化, 并利用实时荧光定量PCR方法进一步研究了MyHC在不同组织、胚胎发育进程、仔稚幼鱼发育阶段的表达图式, 为揭示MyHC在黄条鰤早期发育和后期生长中的生理功能奠定基础, 以期为黄条鰤的养殖产业可持续发展提供参考。
1 材料与方法 1.1 材料及取样本研究所用黄条鰤采集自大连富谷水产有限公司。实验鱼养殖过程中的培育条件:养殖期间海水盐度为28—30、水温为18—25℃、pH为8.0—8.3;投喂鲜杂鱼饵料, 日投喂2次(8:00, 15:00), 投喂量为鱼体质量的2%—5%。挑选3尾体质健康的一龄黄条鰤, 全长33—35cm, 体重450—500g。实验鱼经MS222麻醉后快速解剖, 取脑、垂体、鳃、肝脏、肌肉、头肾、脾脏、肾脏、心脏、胃、肠, 液氮中速冻, 置于–80℃保存。
在黄条鰤繁殖季节首先在NIKON解剖镜(MSZ800, 日本)下观察胚胎发育情况, 依据黄条鰤胚胎时期发育阶段的划分(徐永江等, 2019), 从受精卵到初孵仔鱼共18个时间点取材, 每个时间点平行取3个样本。孵化后的仔稚幼鱼(1—60日龄)共14个时间点取材, 每个时间点平行取3个样本。迅速冻于液氮, 用于胚胎和仔稚幼鱼发育过程的基因表达分析。
1.2 总RNA的提取与cDNA第一链的合成黄条鰤肌肉组织中总RNA的提取按照RNAiso Plus (TaKaRa, 日本)试剂说明书进行, 然后通过1.2%琼脂糖凝胶电泳检测, 28S和18S二条带清晰可见; 使用Nanodrop2000 (Thermo, 美国)测定RNA浓度。cDNA第一链合成使用PrimeScript RT reagent Kit反转录试剂盒(TaKaRa, 日本), 以肌肉总RNA为模板; 合成的cDNA第一链用于核心片段扩增。5′RACE和3′RACE cDNA第一链合成参照SMARTerTM RACE cDNA Amplification Kit (Clontech, 美国)试剂盒操作说明进行。
1.3 MyHC基因cDNA的RACE克隆采用Primer Premier 5.0软件设计特异扩增引物(表 1)。以黄条鰤肌肉cDNA为模板, 扩增核心片段。PCR反应体系为25μL: 10×PCR Buffer 2μL, Taq酶0.5μL, dNTP Mixture 2.5μL, 正、反向引物各2μL, cDNA 2μL, ddH2O 14μL。PCR反应条件为94℃ 5min、95℃ 30s、59℃ 30s、72℃ 40s, 36个循环, 72℃延伸10min, PCR产物经2%琼脂糖电泳后, 用E.Z.N.A.TM Gel Extraction Kit Manual胶回收试剂盒(Omega, 美国)回收纯化, 然后克隆至pEASY-T1载体, 转入Transl-T1感受态细胞(全式金, 中国), PCR检测阳性克隆后送上海生工生物工程股份有限公司进行测序。
| 引物名称 | 引物序列(5′→3′) | 用途 |
| MyHC-F1 | TCACTGTAAAAGACGACGCA | 中间片段PCR克隆1段 |
| MyHC-R1 | TTCACTCTGGGGTAGCATAA | |
| MyHC-F2 | GGTCGGGAACGAGTATGT | 中间片段PCR克隆2段 |
| MyHC-R2 | ACCTTTGCCAGGGTGAG | |
| MyHC-F3 | TGTTCAGTCAGCCCGTCAT | 中间片段PCR克隆3段 |
| MyHC-R3 | TCACGACTCTTCGCCCTC | |
| MyHC-5′-R1 | CTGAAGCCACTGCGATTGT | 5′RACE, 1st PCR |
| MyHC-5′-R2 | TGGGGAAGATTGCGTCGTC | 5′RACE, 2nd PCR |
| MyHC-3′-F1 | GACACCAGCGGTCATTTG | 3′RACE, 1st PCR |
| MyHC-3′-F2 | CTGAGTCCCAGGTCAACAAG | 3′RACE, 2nd PCR |
| MyHC-qPCR-F1 | TCACTGTAAAAGACGACGCA | |
| MyHC-qPCR-R1 | CACTGGGAGCCACTTGTAGG | |
| 18S-F | TACCACATCCAAAGAAGGCA | |
| 18S-R | TCGATCCCGAGATCCAACTA |
根据克隆得到的MyHC核心片段序列及RACE试剂盒要求设计RACE特异引物(表 1)。5′RACE反应的操作参照SMARTerTM RACE cDNA Amplification Kit试剂盒方法进行。5′RACE的首次PCR反应体系为25μL: 10×Advantage 2 PCR Buffer 2.5μL, 50×dNTP Mix 2μL, 50×Advantage 2 Polymerase Mix 0.5μL, 5′RACE模板cDNA 1μL, 正向引物UPM 1μL、反向引物MyHC-5′-R1 0.5μL, PCR-Grade Water 17.5μL。PCR反应条件为94℃ 30s, 65℃ 30s, 72℃ 3min, 共25个循环。取首次PCR产物, 加入Tricine-EDTA buffer进行10倍稀释后作为巢式PCR的模板, NUP为正向引物、MyHC-5′-R2为内侧反向引物, 进行目标基因的5′RACE第二次扩增, PCR反应条件同上。3′RACE的操作参照SMARTerTM RACE cDNA Amplification Kit试剂盒方法进行, 3′RACE的PCR反应体系及反应条件与5′RACE相似。RACE产物纯化、克隆和测序方法同上。
1.4 反转录实时荧光定量PCR(qRT-PCR)利用荧光定量PCR检测MyHC基因的表达水平。根据克隆获得的黄条鰤MyHC cDNA全长序列和内参基因18S, 采用Primer Primer5.0设计荧光定量PCR引物(表 1)。参照SYBR Premix Ex TaqTMⅡ(TaKaRa, 日本)荧光定量预混试剂盒说明书进行操作, 每个样品设定3个重复, 20μL反应体系: SYBR Premix Ex TaqTMⅡ10μL, 正、反向引物(10μmol/L)各0.8μL, cDNA 2μL, RNase-Free ddH2O补足到20μL。反应条件为95℃预变性30s; 95℃循环变性5s, 60℃退火复性20s, 72℃延伸30s, 共40个循环。内参基因18S的实时PCR检测也被平行执行。PCR反应结束后使用Mastercycler ep realplex荧光实时定量PCR仪自带软件包进行扩增和熔解曲线分析。结果采用2–ΔΔCT法对不同基因的表达量进行比较分析(Livak et al, 2001)。
1.5 序列结构及系统进化分析黄条鰤MyHC蛋白的结构、分子量和等电点的预测, 使用Expasy在线软件预测(www.expasy.org/tools/protparam.html); 应用软件DNAMAN 6.0软件进行序列拼接、氨基酸序列推导和不同物种的MyHC氨基酸同源性分析; 通过NCBI (http://www.ncbi.nlm.nih.gov) BLAST进行DNA和蛋白质序列相似性搜索; 使用NCBI数据库(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)进行结构域的预测; 通过SOPM (https://npsa-prabi.ibcp.fr/cgi-bin/npsa-automat.pl/page=npsa-sopma.html)分析蛋白质二级结构; 应用ClustalW在线软件(http://www.genome.jp/tools-bin/clustalw)进行氨基酸序列比对; 采用MEGA 6.0软件构建蛋白的系统进化树, 1000次重复计算自展(bootstrap)值。
1.6 数据处理实验数据用平均值±标准差表示, 并用Origin 8.0作图。统计分析采用单因素方差分析(One-way ANOVA), 使用SPSS 19.0软件中Duncan's Multiple Range Test比较基因相对表达水平的差异, 以P < 0.05作为显著性差异。
2 结果 2.1 MyHC基因序列与结构特征扩增产物经纯化、克隆、测序、拼接后获得黄条鰤MyHC全长6143bp的cDNA序列。将序列提交GenBank数据库, 获得登录号为MH378805。该cDNA序列包括135bp 5′UTR、5811bp的ORF和197bp的3′UTR, 编码1936个氨基酸, 蛋白预测的分子量222.07kDa, 等电点5.6; MyHC氨基酸序列有4个ATP结合位点, 两个保守结构域, 分别是头区MYSc-class II (99—767)和尾区Myosin tail1 (847—1920)结构域; 另外, N端含有结构域Src同源区3 (Srchomology3, SH3)(34—72aa)(图 1)。
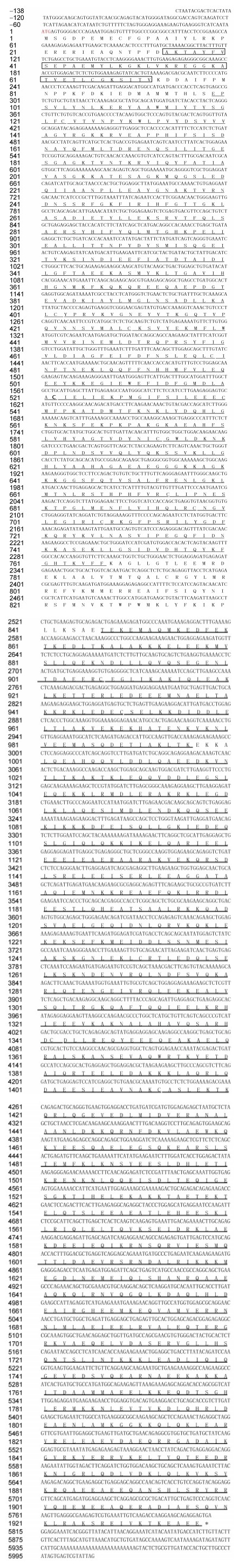 |
| 图 1 黄条鰤MyHC的cDNA核苷酸序列和推导的氨基酸序列 Fig. 1 Nucleotide and deduced amino acid sequences of S. aureovittata MyHC cDNA 注:方框表示Src同源区; 下划线表示MYSc-class II; 双下划线表示Myosin tail1 |
对不同物种MyHC氨基酸序列进行多重比对分析, 结果显示黄条鰤MyHC的氨基酸序列与同属鲈形目高体鰤(S. dumerili)的同源性最高为97.2%, 与牙鲆(Paralichthys olivaceus)同源性为95.1%, 与草鱼(Ctenopharyngodon idella)同源性为76.7%, 与小鼠(Mus musculus)的同源性为82.8%, 与人(Homo sapiens)的同源性为82.4%;不同物种MyHC既有高度保守序列但也有一定差异序列(图 2)。使用Mega 6.0软件对不同物种的MyHC氨基酸序列按邻接法(N-J法)建立了系统进化树(图 3)。从图 3中可以看出黄条鰤MyHC与同为鰤属鱼类的高体鰤(S. dumerili)MyHC聚于一簇, 再与鲈形总目聚为一支, 这说明黄条鰤与高体鰤亲缘关系最近; 而人、小鼠、大鼠等在另一分支, 说明哺乳类、啮齿类与其亲缘关系较远(图 3)。
 |
| 图 2 黄条鰤与其他动物MyHC tail1结构域氨基酸序列的多重比较 Fig. 2 Alignment of amino acid sequences of S. aureovittata and other reported MyHC tail1 domain sequences 注:来自不同物种MyHC的氨基酸序列的GenBank登录号如下: CI:草鱼Ctenopharyngodon idella (ACA33869); SD:高体鰤Seriola dumerili (XP_022602616); SA:黄条鰤Seriola aureovittata (AZQ19991); HS:人Homo sapiens (NM_005963); MM:小鼠Mus musculus (NM_030679); PO:牙鲆Paralichthys olivaceus (XP_019957075); “*”表示保守的氨基酸残基, “.”表示相似性氨基酸 |
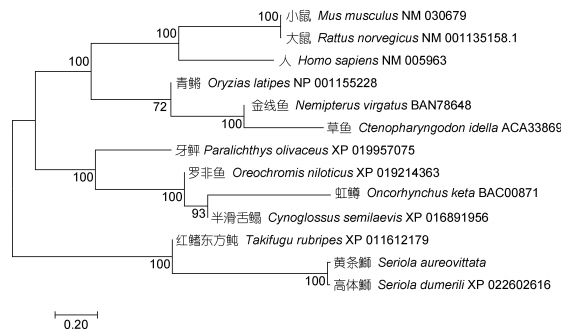 |
| 图 3 基于MyHC氨基酸序列的系统进化树(NJ法, bootstraps=1000) Fig. 3 Phylogenetic analysis of S. aureovittata and other deduced MyHC amino acid sequences (neighbor-joining method, bootstraps=1000) |
采用qRT-PCR检测MyHC在黄条鰤的脑、垂体、肝脏、肌肉、脾脏、肾脏、鳃、心脏、胃、肠、头肾共11个组织的表达特征, 发现MyHC在黄条鰤脑、垂体、肝脏、脾脏、肾脏、鳃、心脏、胃、肠、头肾等10个组织中表达量相对较低, 而在肌肉组织中表达量最高, 且与其他组织中MyHC的表达量差异显著(P < 0.05)(图 4)。
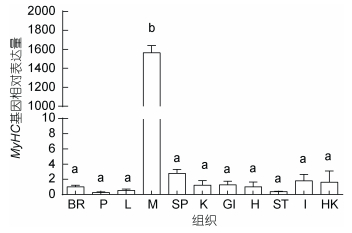 |
| 图 4 黄条鰤MyHC在各组织的相对表达量 Fig. 4 The relative abundance of MyHC in different tissues of S. aureovittata 注: BR.脑; P.垂体; L.肝脏; M.肌肉; SP.脾脏; K.肾脏; GI.鳃; H.心脏; ST.胃; I.肠; HK.头肾; 柱上不同小写字母表示显著差异(P < 0.05) |
在胚胎发育的各个时期都能检测到MyHC的表达, 其中MyHC在16细胞期之前表达量较高, 随后显著下降(P < 0.05);从原肠胚早期MyHC表达量开始再次升高, 胚体下包2/3期表达量显著升高, 至孵化期表达量达到峰值(P < 0.05)(图 5)。在仔稚幼鱼时期, MyHC在孵化后的20d之前表达水平较低, 20d后表达量显著升高(P < 0.05), 在30d表达水平达到峰值, 随后的35d到40d表达水平略有下降但仍保持较高表达趋势至40d, 之后表达量显著下降但仍维持在较高水平(P < 0.05) (图 6)。
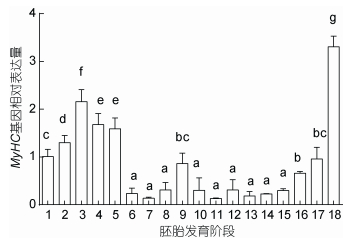 |
| 图 5 黄条鰤MyHC在胚胎发育时期的表达 Fig. 5 Relative expression levels of MyHC in different embryonic stages of S. aureovittata 注: 1.受精卵; 2. 2细胞; 3. 4细胞; 4. 8细胞; 5. 16细胞; 6. 32细胞; 7.多细胞; 8.桑椹胚; 9.高囊胚; 10.低囊胚; 11.原肠胚早期; 12.原肠胚中期; 13.原肠胚末期; 14.神经胚; 15.胚体下包1/2; 16.胚体下包2/3; 17.胚体全包; 18.孵化期; 柱上不同小写字母表示显著差异(P < 0.05);以受精卵mRNA表达量为标准1 |
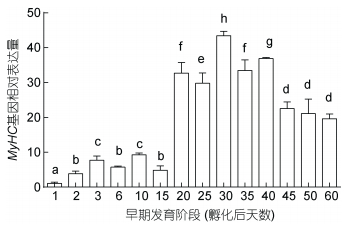 |
| 图 6 黄条鰤MyHC在仔稚幼鱼发育阶段的表达 Fig. 6 The expression levels of MyHC in larval and juvenile development stages of S. aureovittata 注:柱子上不同小写字母表示显著差异(P < 0.05);以孵化后1d MyHC表达量为标准1 |
本研究通过RT-PCR及RACE方法获得了黄条鰤MyHC全长cDNA序列。黄条鰤MyHC具有典型的保守结构域(Kim et al, 2009)包含MYSc-class II和Myosin-tail1。头部保守性较强, 是肌球蛋白家族的主要功能域, ATP酶活性位点和肌动蛋白结合位点都位于该区域。尾部则作为粗肌丝的结构支撑。在黄条鰤MyHC中还发现了Src同源区即SH3结构域, 其可以调节酶的活性, 并在蛋白质的亚细胞定位有重要调控作用(Mayer, 2001)。有研究表明具有SH3结构的MyHC还可以维持细胞骨架和协助细胞跨膜运动(Okrut et al, 2015)。通过多重序列比对分析发现, MyHC氨基酸序列高度保守, 黄条鰤等几种鱼类与哺乳类(人)、啮齿类(小鼠)MyHC序列相似性均在70%以上; 与同属鲈形目高体鰤的同源性高达97.2%。系统进化树分析表明黄条鰤的MyHC与高体鰤聚为一支, 再与鲈形总目聚为一支; 这也进一步证实本研究克隆获得的cDNA序列为黄条鰤MyHC序列。
MyHC在鱼类具有组织和发育不同阶段的表达特异性(Nord et al, 2014; Schiaffino et al, 2015)。本研究中, 黄条鰤MyHC具有组织表达特异性, qRT- PCR分析发现在肌肉组织中表达量最高, 在脑、垂体、肝脏、脾脏和肾脏等组织的表达量较低。在其他鱼类中MyHC组织表达具有各自的特征, 在红鳍东方鲀(Takifugu rubripes)成鱼白肌和红肌中都检测到MyHC的表达, 在心肌中具有高表达(Akolkar et al, 2010)。草鱼MyHC在红肌、白肌和心肌中高表达, 在肾脏、脾脏和肠表达量较低(Chu et al, 2010)。翘嘴鳜MyHC在心肌、红肌中高表达, 白肌中无表达(易潭等, 2014)。在甲壳纲的脊尾白虾, MyHC主要在肌肉中表达, 其次在眼柄、甲壳中表达。在腹足纲的瘤背石磺(Onchidium struma), MyHC在腹足和背部皮肤表达量最高, 肝胰腺、蛋白腺、两性腺中微量表达(顾冰宁等, 2018)。综上分析发现MyHC表达丰度高的组织为肌肉组织; 肌纤维体积决定了肌肉的生长发育, 而肌球蛋白是构成肌纤维主要结构蛋白和功能蛋白之一, 这也表明MyHC是促进黄条鰤肌肉生长的一个重要基因。
本研究中, MyHC在黄条鰤细胞形成期表达量较高, 随后表达量有所下降; 从原肠胚早期MyHC表达量开始再次升高, 在胚体下包2/3期表达量显著升高, 且在孵化期表达量达到峰值。在草鱼胚胎发育阶段的研究发现, 从神经胚期到尾牙期MyHC表达逐步升高; 在孵化的仔鱼表达量最高(Chu et al, 2010)。翘嘴鳜的MyHC在未受精卵有微量的表达, 在尾牙期表达量明显升高, 随着胚胎发育, 表达量持续增加(陈之航等, 2017)。本研究结果与草鱼、翘嘴鳜的研究结果相似, 也进一步证实MyHC的表达变化与胚胎发育时期相关; 黄条鰤胚胎在胚体下包2/3后, 随着发育出现了肌肉效应, 此时需要肌球蛋白的参与, 并随着发育进程表达量增加。本课题组另有研究表明PTEN基因对黄条鰤的早期生长发育有抑止作用, PTEN从黄条鰤受精卵到高囊胚表达量均较低(孙冉冉等, 2019)。在本研究中, MyHC从黄条鰤受精卵到高囊胚表达量相对较高, 这预示MyHC对黄条鰤胚胎发育起到正向的调控作用。
已有的研究表明, 黄条鰤仔稚幼鱼在早期生长速度慢、后期生长速度快(Martínez-Monta o et al, 2016; Yang et al, 2016)。黄条鰤受精卵孵化后60d内的仔稚幼鱼全长随着日龄的增加而加快增长, 孵化后25d后全长大幅增加(张正荣等, 2019)。MyHC在黄条鰤仔稚幼鱼生长发育的各个阶段都有表达, 在孵化后20d显著升高, 此时为摄食卤虫无节幼体阶段, 随着鱼体新陈代谢变化和营养状态的改变, 肌肉增生和分化能力加强, 此时期MyHC的升高可能为肌肉生长提供分子基础。鱼类的骨骼肌可以特异的调整鱼体缓慢游动和快速游动。在鲤鱼(Cyprinus carpio L.)早期发育阶段, 研究发现MyHC表达水平在孵化后30d表达水平最高(Nihei et al, 2006)。在本研究中孵化后30d时, MyHC在黄条鰤的表达水平达到峰值, 这与鲤鱼的研究结果类似, MyHC的高表达可能与黄条鰤运动能力和适应外界环境环境能力增强有关。孵化后45d后MyHC表达虽然显著下降但维持一个相对较高的表达水平, 此阶段黄条鰤生长速度也较快, 推测可能与MyHC的较高表达有关。以上研究结果说明MyHC基因对于黄条鰤胚胎发育及仔稚幼鱼的生长发育均有重要调控作用。
4 结论本研究对黄条鰤MyHC基因进行了克隆、鉴定和生物学分析。黄条鰤MyHC具有典型的保守结构域MYSc-class II和Myosin-tail1。序列同源性比对分析发现黄条鰤MyHC与高体鰤、牙鲆、草鱼的同源性分别为97.2%、95.1%、76.7%。系统进化树分析结果表明黄条鰤MyHC与高体鰤聚于一簇。qRT-PCR分析发现MyHC在被检测的各组织中均有表达, 但在肌肉中表达量最高(P < 0.05);在不同的胚胎发育时期和仔稚幼鱼发育阶段, 黄条鰤MyHC表达具有发育阶段表达的特异性。本研究结果表明MyHC参与调控了黄条鰤的早期生长发育。
王佳佳, 李健, 葛倩倩, 等. 2019. 脊尾白虾肌球蛋白重链和肌球蛋白轻链基因的克隆与表达分析. 中国海洋大学学报, 49(1): 16-27 |
史宝, 柳学周, 刘永山, 等. 2019a. 黄条鰤线粒体全基因组测序及结构特征分析. 中国水产科学, 26(3): 405-415 |
史宝, 柳学周, 刘永山, 等. 2019b. 盐度渐变过程对黄条鰤(Seriola aureovittata)幼鱼渗透调节的影响. 海岸工程, 38(1): 63-70 |
孙冉冉, 史宝, 柳学周, 等. 2019. 黄条鰤PTEN基因克隆、组织分布及早期发育阶段的表达分析. 大连海洋大学学报, 34(1): 47-55 |
张正荣, 柳学周, 于毅, 等. 2019. 黄条鰤仔稚幼鱼消化酶活性变化研究. 渔业科学进展 DOI:10.19663/j.issn2095-9869.20181211002 |
陈之航, 董浚键, 孙成飞, 等. 2017. 基于转录组测序对翘嘴鳜(Siniperca chuatsi)2种肌球蛋白重链基因的克隆与分析. 渔业科学进展, 38(3): 51-61 |
易潭, 刘希良, 宾石玉, 等. 2014. 鳜鱼Siniperca chuatsi红肌sMyHC1基因cDNA的克隆及其表达分析. 广西师范大学学报:自然科学版, 32(2): 175-180 |
柳学周, 徐永江, 李荣, 等. 2017. 黄条鰤(Seriola aureovittata)肌肉营养组成分析与评价. 渔业科学进展, 38(1): 128-135 |
顾冰宁, 刘欣, 沈和定, 等. 2018. 瘤背石磺肌球蛋白重链(MyHC)基因的克隆与表达分析. 渔业科学进展, 39(4): 126-138 |
徐永江, 张正荣, 柳学周, 等. 2019. 黄条鰤早期生长发育特征. 中国水产科学, 26(1): 172-182 |
Akolkar D B, Kinoshita S, Yasmin L et al, 2010. Fibre type-specific expression patterns of myosin heavy chain genes in adult torafugu Takifugu rubripes muscles. Journal of Experimental Biology, 213(1): 137-145 |
Biga P R, Meyer J, 2009. Growth hormone differentially regulates growth and growth-related gene expression in closely related fish species. Comparative Biochemistry and Physiology Part A, 154: 465-473 |
Campion L A, Choi S, Mistry H L et al, 2012. Myosin heavy chain and parvalbumin expression in swimming and feeding muscles of centrarchid fishes:the molecular basis of the scaling of contractile properties. Comparative Biochemistry and Physiology Part A:Molecular & Integrative Physiology, 163(2): 223-230 |
Chu W Y, Fu G H, Bing S Y et al, 2010. Molecular cloning and mRNA expression analysis of myosin heavy chain (MyHC) from fast skeletal muscle of grass carp, Ctenopharyngodon idella. Chinese Journal of Oceanology and Limnology, 28(2): 239-247 |
Heissler S M, Sellers J R, 2016. Kinetic adaptations of myosins for their diverse cellular functions. Traffic, 17(8): 839-859 |
Hevr y E M, Jordal A E O, Hordvik I et al, 2006. Myosin heavy chain mRNA expression correlates higher with muscle protein accretion than growth in Atlantic salmon, Salmo salar. Aquaculture, 252(2-4): 453-461 |
Knight A E, Molloy J E, 2000. Muscle, myosin and single molecules. Essays in Biochemistry, 35: 43-59 |
Livak K J, Schmittgen T D, 2001. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCT method. Methods, 25(4): 402-408 |
Martínez-Monta o E, González- lvarez K, Lazo J P et al, 2016. Morphological development and allometric growth of yellowtail kingfish Seriola lalandi V. larvae under culture conditions. Aquaculture Research, 47(4): 1277-1287 |
Mayer B J., 2001. SH3 domains:complexity in moderation. Journal of Cell Science, 114(7): 1253-1263 |
Nihe Y, Kobiyama A, Ikeda D et al, 2006. Molecular cloning and mRNA expression analysis of carp embryonic, slow and cardiac myosin heavy chain isoforms. Journal of Experimental Biology, 209: 188-198 |
Nord H, Burguiere A C, Muck J et al, 2014. Differential regulation of myosin heavy chains defines new muscle domains in zebrafish. Molecular Biology of the Cell, 25(8): 1384-1395 |
Okrut J, Prakash S, Wu Q et al, 2015. Allosteric N-WASP activation by an inter-SH3 domain linker in Nck. Proceedings of the National Academy of Sciences of the United States of America, 112(47): E6436-E6445 |
Schiaffino S, Rossi A C, Smerdu V et al, 2015. Developmental myosins:expression patterns and functional significance. Skeletal Muscle, 5: 22 |
Yang S G, Hur S W, Ji S C et al, 2016. Morphological development of embryo, larvae and juvenile in yellowtail kingfish, Seriola lalandi. Development & Reproduction, 20(2): 131-140 |
 2020, Vol. 51
2020, Vol. 51


