中国海洋湖沼学会主办。
文章信息
- 刘春云, 姜少玉, 宋博, 闫朗, 张建设, 李宝泉, 陈琳琳. 2020.
- LIU Chun-Yun, JIANG Shao-Yu, SONG Bo, YAN Lang, ZHANG Jian-She, LI Bao-Quan, CHEN Lin-Lin. 2020.
- 烟台养马岛潮间带大型底栖动物食物网结构特征
- FOOD WEB STRUCTURE OF MACROBENTHOS IN THE INTERTIDAL ZONE OF YANGMA ISLAND, YANTAI, CHINA
- 海洋与湖沼, 51(3): 467-476
- Oceanologia et Limnologia Sinica, 51(3): 467-476.
- http://dx.doi.org/10.11693/hyhz20191100217
文章历史
-
收稿日期:2019-11-19
收修改稿日期:2020-01-15
2. 中国科学院烟台海岸带研究所 海岸带生物学与生物资源保护实验室 烟台 264003;
3. 中国科学院大学 北京 100049;
4. 中国科学院海洋大科学研究中心 青岛 266071
2. Key Laboratory of Coastal Biology and Bioresource Utilization, Yantai Institute of Coastal Zone Research, Chinese Academy of Science, Yantai 264003, China;
3. University of Chinese Academy of Sciences, Beijing 100049, China;
4. Center for Ocean Mega-Science, Chinese Academy of Sciences, Qingdao 266071, China
潮间带是重要的海洋湿地生态系统之一, 物种多样性丰富, 生产力较高。由于地处海陆交界处, 受周期性的潮汐运动影响, 该区域光照、温度、盐度、营养、气体等环境因子变化剧烈(王智, 2015)。此外, 海岸带区域人类涉海活动加剧, 如海水养殖、工厂污染排放、围填海等, 对潮间带区域产生了剧烈影响。养马岛海域沿海岸线有几条小型季节性河流, 能够为养马岛潮间带区域带来丰富的陆源有机质, 并且养马岛海域是我国北方重要的海水养殖区之一, 海水养殖过程中投喂的饵料中含有大量的营养物质(氮和磷等)(陈一波等, 2016), 其中只有少部分被养殖生物所摄食, 剩余大部分则被释放到养殖水域中, 造成养殖水域及其附近水体富营养化(Naylor et al, 2000; Tovar et al, 2000; Cabello, 2006)。
大型底栖动物(Macrofauna)是指不能通过500μm孔径网筛的动物, 是海洋环境中的一个重要类群, 它在海洋系统的能流和物流中起着十分重要的作用(马骏等, 2010; 李新正, 2011)。由于大型底栖动物活动范围有限, 甚至部分大型底栖动物营固着生活, 因此, 大型底栖动物对逆境的逃避相对迟缓, 受环境影响更为深刻, 能够客观地反映海洋环境的特点和环境质量状况。所以长期以来大型底栖动物一直被当作监测生态系统变化的主要研究对象, 是生态系统健康的重要指示生物(蔡德陵等, 2001; 李新正, 2011; 张莹等, 2012)。
食物网中的营养关系、物质循环和能量流动途径是海洋生态系统动力学研究中的重要问题(王田田等, 2013)。因此, 探究潮间带海域大型底栖动物的食物网关系和营养级特征, 可以更好地了解该区域物质循环和能量流动的变化。在特定的生态系统中, 各生物种群的摄食关系、营养物质和能量的流动途径是生态学研究的一个难题(蔡德陵等, 1999)。食物网研究中传统的胃内含物法, 只能反映生物短时间内的食性(Hyslop, 1980), 且因胃含物中常含有难以消化的物质, 导致食物网鉴定结果产生偏差(Gee, 1989; 余婕等, 2008)。稳定同位素技术应用于食物网研究是从20世纪90年代以后发展的分析方法, 其主要原理是基于生物新陈代谢引起同位素分馏, 会优先选择排出较轻的同位素, 不同程度地保留较重的同位素(DeNiro et al, 1978; 郭承秧等, 2018), 其优点是能够反映生物近几个月间的食性(Preciado et al, 2017)。通常消费者的碳元素通过呼吸作用发生分馏, 且消费者获取的碳稳定同位素与食源基本相同, 用于确定食物来源与组成(Fanelli et al, 2011); 而氮元素通过排泄作用发生分馏, 消费者的氮稳定同位素比率(δ15N)较被捕食者增加3‰—5‰, 用于确定消费者所处的食物网中的营养级(Hobson et al, 1992)。稳定同位素技术的发展为食物网以及营养级的精确分析奠定了基础。通过测定生物碳、氮稳定同位素数值来确定主要大型底栖动物类群在潮间带区域的营养级, 能够直观地表现营养级的能流途径(卢伙胜等, 2009), 并借此了解潮间带不同生物的种间关系。
本研究是基于养马岛潮间带底栖生物的稳定同位素测定结果, 分析养马岛潮间带底栖生物群落的食物网关系, 明确该区域大型底栖动物营养级特征, 为潮间带生态环境改善和修复, 以及进一步合理利用潮间带生物资源提供科学依据。
1 材料与方法 1.1 样品采集与处理分别于2019年春季(3月)和夏季(7月)在养马岛潮间带(37°26′16″—37°26′41″E, 121°36′34″—121°36′49″N)采集大型底栖动物样品。同时夏季还采集了底栖动物的潜在食源样品, 包括沉积颗粒(SOM)、悬浮有机质(POM)、浮游生物以及大型海藻。
潮间带大型底栖动物定性采集调查, 在采样点附近收集尽可能多的个体; 浮游动物采用25号浮游生物网采集, 浮游植物采用13号浮游植物网采集; 用一次性医用注射器改装后的柱状采样器采集沉积物样品以收集SOM样品(取上层5cm); 用1L塑料瓶采集表层海水以收集POM样品。
在实验室内, 浮游植物用100μm筛绢进行过滤, 除去浮游动物和碎屑等, 经筛绢过滤后的浮游植物样品抽滤至预先经450℃灼烧5h的What-man GF/F滤膜上。采集的表层海水样品经150μm筛绢过滤后抽滤到预先经450℃预灼烧5h的What-man GF/F滤膜上收集POM样品。沉积物样品经过酸化处理后, 过63μm筛绢分筛, 所获得颗粒物即为SOM样品。浮游动物和大型底栖动物经冷冻后进行取样, 每个待测样品由同一物种的1—8个个体的组织混合而成(表 1, 2)。
| 物种 | 取样组织 | δ13C(‰)均值±SD | δ15N(‰)均值±SD |
| 软体动物 | |||
| 双壳类 | 闭壳肌 | ||
| 菲律宾蛤仔Ruditapes philippinarum | -20.23±0.13 | 5.38±0.15 | |
| 异白樱蛤Macoma incongrua | -14.42±0.15 | 5.32±0.02 | |
| 腹足类 | 足部肌肉 | ||
| 古氏滩栖螺Batillaria cumingi | -13.44±0.00 | 8.07±0.00 | |
| 宽带薄梯螺Papyriscala latifasciata | -13.91±0.13 | 8.12±0.16 | |
| 皮氏蛾螺Volutharpa perryi | -12.99±0.00 | 8.30±0.00 | |
| 环节动物 | |||
| 多毛类 | 体壁 | ||
| 日本刺沙蚕Hediste japonica | -14.69±0.13 | 10.12±0.69 | |
| 红色叶蜇虫Amphitrite rubra | -13.93±0.00 | 8.81±0.00 | |
| 圆头索沙蚕Lumbrineris inflata | -15.03±0.14 | 9.60±0.08 | |
| 长吻沙蚕Glycera chirori | -15.98±0.00 | 10.45±0.00 |
| 物种 | 取样部位 | δ13C(‰)均值±SD | δ15N(‰)均值±SD | 潜在食源平均贡献率(%) | |||
| 大型藻类 | POM | SOM | 浮游动物 | ||||
| 环节动物 | |||||||
| 多毛类 | 体壁 | ||||||
| 那不勒斯膜帽虫Lagis neapolitana | -17.08±0.00 | 10.85±0.00 | 15.8±4.9 | 23.6±17.4 | 29.8±21.8 | 30.8±22.5 | |
| 短叶索沙蚕Lumbrineris latreilli | -14.25±0.50 | 10.14±0.80 | 65.7±11.5 | 9.8±8.8 | 10.7±9.6 | 10.8±9.8 | |
| 软体动物 | |||||||
| 腹足类 | 足部肌肉 | ||||||
| 灰黄镰玉螺Lunatia gilva | -21.91±0.00 | 10.29±0.00 | / | / | / | / | |
| 经氏壳蛞蝓Philine kinglipini | -19.38±0.66 | 12.54±0.12 | 72.8±4.2 | 9.8±9.1 | 7.6±7.2 | 7.4±7.0 | |
| 秀丽织纹螺Nassarius festivus | -14.56±1.02 | 10.00±1.89 | 63.1±11.2 | 10.6±9.5 | 11.5±10.4 | 11.7±10.5 | |
| 古氏滩栖螺Batillaria cumingi | -13.40±0.38 | 10.10±1.02 | 72.6±12.1 | 7.6±6.9 | 8.4±7.6 | 8.5±7.7 | |
| 朝鲜花冠小月螺Lunella coronata correensis | -11.28±1.18 | 9.84±0.41 | 89.7±12.7 | 2.7±2.6 | 3.0±2.8 | 3.0±2.9 | |
嫁 Cellana toreuma Cellana toreuma |
-10.75±1.48 | 11.70±0.08 | 94.5±12.0 | 1.6±2.1 | 1.9±2.3 | 1.9±2.3 | |
| 双壳类 | 闭壳肌 | ||||||
| 菲律宾蛤仔Ruditapes philippinarum | -20.95±0.00 | 7.39±0.00 | 94.7±0.8 | 1.3±1.6 | 1.1±1.4 | 0.9±1.2 | |
| 长巨牡蛎Crassostrea gigas | -20.67±0.00 | 8.79±0.00 | 90.4±1.4 | 2.2±2.8 | 2.2±2.3 | 2.9±2.3 | |
| 薄壳绿螂Glauconome primeana | -20.66±0.11 | 7.48±0.00 | 90.3±1.2 | 2.9±2.8 | 2.3±2.3 | 2.2±2.3 | |
| 异白樱蛤Macoma incongrua | -13.87±0.12 | 7.42±0.17 | 68.7±11.7 | 8.8±7.9 | 9.7±8.7 | 9.8±8.9 | |
| 红明樱蛤Moerella rutila | -13.42±0.00 | 7.01±0.00 | 72.3±12 | 7.7±6.9 | 8.4±7.7 | 8.5±7.8 | |
| 扁形动物 | 整体 | ||||||
| 网纹平涡虫Planocera reticulata | -15.37±0.20 | 8.60±0.08 | 69.5±2.1 | 7.8±6.1 | 10.1±7.9 | 11.1±8.2 | |
| 节肢动物 | 肌肉组织 | ||||||
| 大蝼蛄虾Upogebia major | -17.73±0.00 | 11.78±0.00 | 3.3±2.6 | 59.5±10.6 | 19.1±14.4 | 17.1±12.6 | |
| 鲜明鼓虾Alpheus distinguendus | -17.36±0.00 | 14.17±0.00 | 45, 4±8.6 | 18.9±16.2 | 16.6±15.0 | 16.2±14.7 | |
| 豆形拳蟹Philyra pisum | -16.31±1.34 | 11.55±0.11 | 49.3±9.9 | 15.5±13.5 | 16.0±14.2 | 16.1±14.3 | |
| 肉球近方蟹Hemigrapsus sanguineus | -17.36±1.03 | 12.66±0.06 | 45.4±8.6 | 18.9±16.2 | 16.6±15 | 16.2±14.7 | |
| 日本寄居蟹Pagurus japonicus | -15.10±0.82 | 10.98±0.11 | 58.7±10.9 | 12.0±10.7 | 13.0±11.6 | 13.1±11.7 | |
| 日本大眼蟹Macrophthalmus japonicus | -13.45±0.45 | 8.91±1.90 | 74.5±12.2 | 7.0±6.3 | 7.7±7.0 | 7.8±7.1 | |
| 绒毛近方蟹Hemigrapsus penicillatus | -15.78±1.15 | 10.84±0.52 | 53.4±10.3 | 13.9±12.2 | 14.7±13.1 | 14.8±13.2 | |
| 脊索动物 | 肌肉组织 | ||||||
| 黄鳍刺虾虎鱼Acanthogobius flavimanus | -15.31±0.88 | 11.33±1.40 | 57.0±10.7 | 12.6±11.2 | 13.5±12.1 | 13.7±12.2 | |
| 注: POM:悬浮有机物; SOM:沉积颗粒 | |||||||
样品碳(C)、氮(N)稳定同位素的测定采用Mat253同位素质谱仪(Thermo Fisher美国)。同位素含量计算公式(Sabo et al, 2010), 即
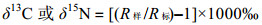 (1)
(1)式中, R样为样品的同位素比值, R标为标准同位素比值。对于碳同位素R=13C/12C, 以国际标准物质PDB (Peedee Belemnite carbonate)为标准物; 对于氮同位素, R=15N/14N, 以空气中的N2为标准物。
1.3 食源贡献率计算潜在食源对大型底栖动物生长的贡献率通过Iso Source软件(Phillips et al, 2003)进行分析计算, 该软件根据质量守恒原理计算各食物源对生物消费者的贡献率(Schwarcz, 1991), 计算公式如下:
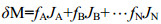 (2)
(2)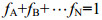 (3)
(3)其中δM代表待测大型底栖动物即消费者的同位素数值; JA、JB…JN代表潜在食源稳定同位素值; fA、fB…fN代表各潜在食源的相对贡献率。对于采集到的潜在食源基于碳稳定同位素来确定不同食物对消费者的贡献率。
1.4 营养级测定氮稳定同位素比值的高低可以表征生物体在食物网中的营养层次, 其具体的计算公式如下(Vander Zanden et al, 2007):
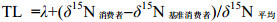 (4)
(4)式中, TL为营养级, λ为基准消费者营养级, 一般根据所研究的生物群体取值1, 2, 3; δ15 N消费者、δ15 N基准消费者和δ15N平均分别是所测消费者、基准消费者和平均每一营养级富集的δ15N值。本文选取在养马岛潮间带海域分布较为广泛且在春季和夏季均有出现的菲律宾蛤仔(Ruditapes philippinarum)作为基准生物, λ值确定为2。参照文献(Post, 2002; Enge et al, 2018) δ15N平均值定为3.4‰。
1.5 统计分析根据采集生物样本的碳、氮稳定同位素值, 采用SPSS 24.0统计软件和Excel进行平均值和方差计算; 应用Primer 6.0软件, 对δ13C和δ15N双因子比值数据进行平方根转化后再进行Bray-Curtis相似性处理后对所获得的生物食性进行聚类分析。应用Origin9.1软件, 进行作图。
2 结果与分析 2.1 样品的物种组成本研究共采集大型底栖动物28种, 隶属于7纲18目26科26属。其中春季采集到的大型底栖动物共计9种, 多毛纲4种, 腹足纲3种, 双壳纲2种(表 1)。夏季采集到的大型底栖动物共计22种, 涡虫纲1种, 多毛纲2种, 软甲纲5种, 甲壳纲2种, 腹足纲6种, 双壳纲5种, 辐鳍鱼纲1种(表 2)。春季和夏季共同采集到的物种为双壳类的菲律宾蛤仔(Ruditapes philippinarum)、异白樱蛤(Macoma incongrua)和腹足类的古氏滩栖螺(Batillaria cumingi)。
养马岛潮间带区域大型底栖动物的潜在食源主要采集到浮游动物、POM、SOM和大型海藻等, 其中大型海藻共采集到4种(表 3)。
| 生物种类 | δ13C(‰)均值±SD | δ15N(‰)均值±SD |
| 红藻门 | ||
| 紫菜Porphyra sp. | -21.17±0.80 | 10.82±0.20 |
| 绿藻门 | ||
| 浒苔Enteromorpha sp. | -9.88±0.64 | 11.60±0.03 |
| 石莼Ulva lactuca | -10.56±0.36 | 8.32±1.42 |
| 褐藻门 | ||
| 网管藻Dictyosiphon foeniculaceus | -16.20±1.11 | 7.20±3.48 |
| POM | -18.15±1.51 | 3.24±0.50 |
| SOM | -17.40±1.36 | 2.32±0.05 |
| 浮游动物 | -17.30±0.00 | 2.30±0.00 |
养马岛潮间带生态系统中, 大型底栖动物不同季节的δ13C和δ15N值结果如表 1和表 2所示。春季大型底栖动物δ13C值的范围为-20.23‰(菲律宾蛤仔)— -12.99‰(皮氏蛾螺), δ15N值的范围为5.32‰(异白樱蛤)—10.45‰(长吻沙蚕)(表 1, 图 1)。夏季大型底栖动物δ13C值的范围为-21.91‰(灰黄镰玉螺)— -10.75‰(嫁
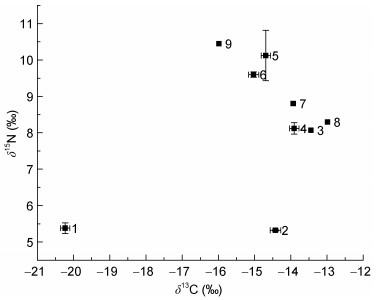 |
| 图 1 养马岛潮间带春季大型底栖动物不同物种的δ13C-δ15N分布图 Fig. 1 The δ13C-δ15N plots of macrobenthos species in the intertidal zone of Yangma island in Spring 注:序号代表生物: 1.菲律宾蛤仔; 2.异白樱蛤; 3.古氏滩栖螺; 4.宽带薄梯螺; 5.日本刺沙蚕; 6.圆头索沙蚕; 7.红色叶蜇虫; 8.皮氏蛾螺; 9.长吻沙蚕; δ13C、δ15N值为平均值±标准偏差(Mean±SD) |
 |
图 2 养马岛潮间带夏季大型底栖动物及潜在食源的δ13C-δ15N分布图 Fig. 2 Theδ13C-δ15N plots of macrobenthos and potential food source species in the intertidal zone of Yangma island in Summer 注:序号代表物质:1. SOM; 2. POM; 3.浮游动物; 4.石莼; 5.浒苔; 6.紫菜; 7.网管藻; 8.薄壳绿螂; 9.朝鲜花冠小月螺; 10.大蝼蛄虾; 11.豆形拳蟹; 12.短叶索沙蚕; 13.菲律宾蛤仔; 14.古氏滩栖螺; 15.红明樱蛤; 16.黄鳍刺虾虎鱼; 17.灰黄镰玉螺; 18.嫁 ; 19.经氏壳蛞蝓; 20.那不勒斯膜帽虫; 21.日本大眼蟹; 22.日本寄居蟹; 23.绒毛近方蟹; 24.肉球近方蟹; 25.网纹平涡虫; 26.鲜明鼓虾; 27.秀丽织纹螺; 28.异白樱蛤; 29.长巨牡蛎 ; 19.经氏壳蛞蝓; 20.那不勒斯膜帽虫; 21.日本大眼蟹; 22.日本寄居蟹; 23.绒毛近方蟹; 24.肉球近方蟹; 25.网纹平涡虫; 26.鲜明鼓虾; 27.秀丽织纹螺; 28.异白樱蛤; 29.长巨牡蛎 |
稳定同位素分析结果表明, 潜在食源的δ13C平均值为-16.24‰; 其中最低值为紫菜(Porphyra sp.), -21.17‰; 最高为浒苔(Enteromorpha sp.), -9.88‰; 差值为11.29‰。δ15N平均值为6.81‰, 最低值为浮游动物, 2.30‰; 最高值为浒苔, 11.60‰; 差值为9.3‰(表 3, 图 2)。
2.2.3 潜在食源对大型底栖动物食物组成的贡献率基于Iso Source模型的计算结果, 大型藻类作为初级生产者, 是研究区域大部分底栖动物的主要碳源, 但是其对不同物种的贡献率不同(表 2)。大型藻类是滤食性贝类和杂食性螺类等软体动物的主要碳源, 其中紫菜(Porphyra sp.)对于菲律宾蛤仔的碳源贡献率平均可高达93.9%, 但灰黄镰玉螺(Lunatia gilva)因δ13C值低, 其碳源并不在所分析的碳源内(表 2)。浮游动物对多毛类生物那不勒斯膜帽虫(Lagis neapolitana)的贡献率最高, 为30.8%(表 2)。而大型藻类对网纹平涡虫(Planocera reticulata)、短叶索沙蚕(Lumbrineris latreilli)的贡献率最高, 分别为69.5%和65.7%。POM对甲壳生物大蝼蛄虾(Upogebia major)的贡献率最高, 为59.5%, 其余甲壳生物主要碳源均为大型藻类(表 2)。
2.3 消费者的营养级春季大型底栖动物营养级范围为1.98(异白樱蛤)—3.49(长吻沙蚕)。其中, 多毛类生物营养级范围为3.01(红色叶蜇虫)—3.49(长吻沙蚕); 软体动物营养级范围为1.98(异白樱蛤)—2.86(皮氏蛾螺) (图 3)。
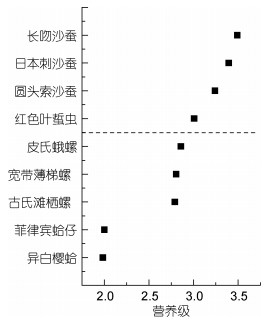 |
| 图 3 养马岛潮间带区域春季大型底栖动物营养级 Fig. 3 Trophic level of macrobenthos in the intertidal zone of Yangma island in Spring |
夏季大型底栖动物营养级范围为1.89(红明樱蛤)—4.00(鲜明鼓虾)。其中, 多毛类生物营养级范围为2.36(网纹平涡虫)—3.02(那不勒斯膜帽虫); 软体动物营养级范围为1.89(红明樱蛤)—3.52(经氏壳蛞蝓); 甲壳动物营养级范围为2.45(日本大眼蟹)—4.00(鲜明鼓虾); 黄鳍刺虾虎鱼营养级为3.16(图 4)。
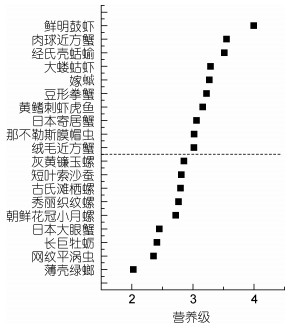 |
| 图 4 养马岛潮间带区域夏季大型底栖动物营养级 Fig. 4 Trophic level of macrobenthos in the intertidal zone of Yangma island in Summer |
此次调查中, 春季和夏季共同采集到的大型底栖动物的营养级季节间无显著变化(P>0.05), 菲律宾蛤仔为基准生物, 春季和夏季营养级均为2, 异白樱蛤营养级在夏季仅比春季高0.02, 古氏滩栖螺营养级无变化, 均为2.79。
2.4 消费者的食性相似性分析对养马岛潮间带底栖生物食物网组成成分进行聚类分析(图 5), 按照90%的相似性水平, 可将春季消费者分为两大类群, 第1组又以99%的相似性分为1a、1b和1c三组, 其中1a组为小型螺类, 包括古氏滩栖螺和宽带薄梯螺, 其主要食源为藻类, 1b组为杂食性的日本刺沙蚕, 其主要食物为藻类、小型动物、腐屑及动植物碎片, 1c组则主要为肉食性多毛类和软体类, 包括长吻沙蚕、红色叶蜇虫、圆头索沙蚕及皮氏蛾螺等。第2组主要为滤食性贝类, 包括菲律宾蛤仔和异白樱蛤。
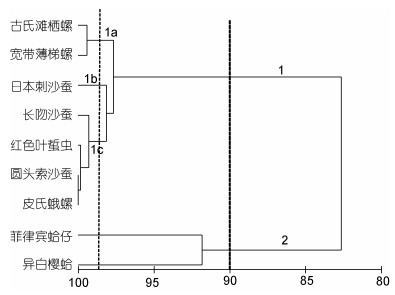 |
| 图 5 养马岛潮间带春季大型底栖动物不同物种δ13C和δ15N值的聚类分析 Fig. 5 Cluster analysis of δ13C and δ15N values for macrobenthic species in the intertidal zone of Yangma island in Spring |
夏季大型底栖动物食性按照97%的相似性水平, 大体可分为六个营养类群(图 6)。第1组为滤食性, 滤食水体中微小的浮游生物; 第2组网纹平涡虫是以蠕虫、甲壳类和昆虫为食, 与滤食性异白樱蛤和红明樱蛤食性不同。第3组是杂食偏肉食性; 第4组嫁
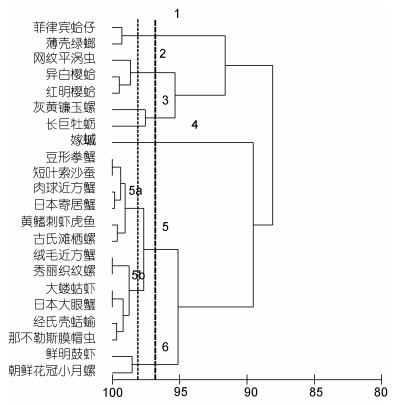 |
| 图 6 养马岛潮间带夏季大型底栖动物不同物种δ13C和δ15N值的聚类分析 Fig. 6 Cluster analysis of δ13C and δ15N values for microbenthic species in the intertidal zone of Yangma island in Summer |
基准生物通常是食物网中低营养级生物或其有机物, 其选择标准通常会影响对整个食物网结构和功能的判别(Vander Zanden et al, 2007; 徐军等, 2010)。因此, 根据自己所研究的区域和生物种群来选择合适的基准生物, 对于准确地判断该区域的食物网结构和能量流动非常重要。在对大型底栖动物或潮间带区域食物网的研究中, 基准生物λ值多为2(余婕等, 2008; 张雷燕等, 2017)。同时, 需要根据生物个体的活动范围小、生命周期相对长、易采集、分布广泛、营养级位置低等条件进行综合考量(徐军等, 2010)。参考已有的研究资料和选取标准并结合当地的物种组成, 本文选取菲律宾蛤仔作为养马岛潮间带区域大型底栖动物营养级研究的基准生物, 取λ值为2。
3.2 大型底栖动物稳定同位素数值分析养马岛潮间带区域大型底栖生物的碳、氮稳定同位素数值季节差异明显, 这与大型底栖动物碳、氮稳定同位素数值会随季节变化而变化的结论一致(刘保占, 2013)。具体表现为春季δ13C和δ15N值的范围明显小于夏季, 且δ15N值明显偏低。有研究表明, 除物种类别外, 温度和饵料也是影响稳定同位素富集过程的重要因素(田甲申等, 2019), 因此推测养马岛潮间带海域碳、氮稳定同位素季节性差异也与水温升高及饵料结构随季节变化有关。由于温度升高, 生物呼吸作用(Deniro et al, 1978; 蔡德陵等, 1999)和代谢作用(Preciado et al, 2017)增强, 导致生物的δ13C值和δ15N值普遍增高。根据δ13C值可以用来反映食物来源, δ15N值可以反映生物的营养级特征(Madurell et al, 2008), 我们推断夏季大型底栖动物的食物来源相较于春季要更加广泛, 虽然δ15N值夏季相对于春季整体提高, 但季节之间共同采集到的生物营养级并没有明显变化(P>0.05)。
本研究中养马岛潮间带区域夏季大型底栖动物的碳、氮稳定同位素值与烟台西海岸海草床区域(宋博等, 2019)、大连近岸海域(王荦等, 2017)以及北黄海、渤海辽东湾海域(刘保占, 2013)相比, 其整体范围均比上述海域差值范围大。推测造成上述差异的原因主要为: (1)研究区域生境的差异, 潮间带区域因处于陆海交界处, 环境条件变化剧烈(王金宝等, 2018), 而潮下带海草床区域和近岸海域相对于潮间带环境变化较小。(2)大型底栖动物群落组成不同。由于大型底栖动物受不同环境条件的影响, 其群落特征变化也较大(王金宝等, 2018)。该结论与大型底栖动物可通过自身代谢作用, 富集较重的同位素(DeNiro et al, 1981; Minagawa et al, 1984), 该富集作用在不同的水生生物之间存在差异, 也造成不同物种之间稳定同位素数值的差异(郭梁等, 2016)。(3)大型底栖动物的碳、氮稳定同位素来源不同, 与潮下带近岸海域相比, 潮间带区域碳、氮稳定同位素不仅来源于水生有机质, 还有陆源有机质输入(Finlay et al, 2010)。稳定同位素来源丰富, 造成潮间带区域稳定同位素值范围较宽。
3.3 养马岛潮间带食物网结构和营养级养马岛潮间带海域只有多毛类营养级随季节变化而变化; 鱼类营养级主要受个体大小的影响, 季节变化不明确; 软体动物营养级随季节变化不明显。本次调查获取的大型底栖动物按照功能群主要分为滤食性、植食性、杂食性和肉食性(蔡文倩等, 2016)。软体动物主要为滤食性和植食性, 春季和夏季营养级平均值分别为2.49和2.47, 无明显变化, 为次级消费者。多毛类多为杂食性, 春季和夏季营养级平均值分别为3.28和2.73, 营养级位置发生较大改变。多毛类产生季节性差异的原因分析存在以及可能:一是种间竞争, 夏季甲壳类快速生长, 需要大量摄食, 而我们捕捉到的甲壳类大部分为肉食性与多毛类存在食源竞争, 由于多毛类行动缓慢, 竞争能力弱于甲壳类, 造成多毛类因摄食来源不同导致整体营养级下降; 二是食源的物种组成发生变化, 春季多毛类摄食的物种多为早期发育阶段的小型生物个体, 活动能力不强, 随着这些物种的生长发育, 夏季活动能力加强, 不易被多毛类捕食; 三是多毛类群中, 部分物种, 如沙蚕, 成体在夏季进入繁殖期, 有海面群游婚舞的习性(于超勇等, 2016), 这可能对潮间带底栖生境多毛类营养级高低产生影响。此外, 黄鳍刺虾虎鱼的营养级为3.16, 而辽东湾海域获得的矛尾刺虾虎鱼营养级接近5.00(孙明等, 2013), 这两个物种同属于刺虾虎鱼属, 食性相近, 但营养级差别明显。有研究显示即使相同季节捕获的不同体长/体重的同种鱼, 其碳氮同位素值也有明显的变化(蔡德陵等, 2005), 我们推断在潮滩上捕捉到的幼体黄鳍刺虾虎鱼, 其营养级会相对成鱼偏低。
3.4 潜在食源δ13C和δ15N值的变化烟台养马岛潮间带区域采集到的潜在食源的δ13C和δ15N值的范围间距较大, 为11.29‰和9.3‰。本研究区域的POM和SOM的碳稳定同位素数值均比北黄海、渤海辽东湾(刘保占, 2013)、青岛崂山湾(蔡德陵等, 2001)、天津海域(张博伦等, 2019)以及浙江枸杞岛海域(蒋日进等, 2014)的POM和SOM数值偏高。与之相反, 该海域POM和SOM的δ15N值与北黄海、渤海辽东湾(刘保占, 2013), 天津海域(张博伦等, 2019)和海州湾区域(谢斌等, 2017)相比则偏低。POM和SOM的来源比较复杂, POM主要由浮游生物本身、海洋生物代谢过程产生的碎屑组成(赵明辉等, 2014), 而SOM主要由悬浮颗粒在水体中的自然沉降、海洋生物死亡后形成的碎屑沉积等形成(谢斌等, 2017)。而对于近岸水域, POM和SOM会有部分来自陆源和人为输入(赵明辉等, 2014)。因研究区域处于海洋养殖区以及河流排污口周围, 其POM和SOM数值与上述其他海域产生差异的原因应主要来自外源输入。
本研究在养马岛采集到的大型藻类包括褐藻门(网管藻)、绿藻门(浒苔、石莼)和红藻门(紫菜), 其δ13C值与北黄海、渤海辽东湾(刘保占, 2013)相比, 绿藻门和褐藻门的δ13C值偏高, 红藻门偏低; 而氮稳定同位素值则普遍高于上述海域。本研究氮稳定同位素数据与王玉珏等(2016)在养马岛区域分析的大型海藻氮稳定同位素值基本一致。潮间带大型藻类的碳源主要是通过光合作用吸收的海水中的游离CO2和大量存在的HCO3-(夏建荣等, 2010), 因此大型藻类碳稳定同位素值在不同海域的空间差异性不大。而大型藻类的氮稳定同位素值则需要依据不同来源氮的营养盐δ15N值进行判断(王玉珏等, 2016), 由于不同区域受人类活动影响和水体富营养化程度不同, 其氮营养盐的δ15N值也有明显的差异。如生活污水和生物排泄物的δ15N值较高, 范围约7‰—51‰(王玉珏等, 2016)。而养马岛处于河流排污口以及海水养殖区域, 其氮营养盐来源广泛, 在该区域采集到的大型藻类氮稳定同位素值均处于上述δ15N值范围内, 这也说明了排污和养殖自身污染已严重影响到大型藻类的生长代谢。并且已有研究表明, 浒苔属的δ15N值较高是因其在高浓度营养盐环境中基本不存在分馏的结果(王玉珏等, 2016), 本研究中发现浒苔δ15N值偏高与上述结论一致。同时我们也发现紫菜的δ15N数值也偏高, 除氮营养盐外源输入的影响, 紫菜自身代谢可能存在差异, 但具体机制目前还不清楚, 需要进一步研究。
4 结论碳、氮稳定同位素数值会随季节变化而变化, 但是营养级并不会随季节变化而发生改变。烟台养马岛潮间带区域食物网能量流动中的碳流可能主要通过三条途径: (1) POM和浮游动物被滤食性软体动物菲律宾蛤仔、异白樱蛤等捕获, 小型软体动物被肉食性多毛类长吻沙蚕、圆头索沙蚕等和甲壳类生物大蝼蛄虾、绒毛近方蟹等所摄食。(2)大型海藻被植食性以及只摄食大型海藻的嫁
于超勇, 刘名, 刘莹, 等. 2016. 沙蚕类性信息素研究进展. 广西科学院学报, 32(2): 129-135 |
马骏, 付荣恕. 2010. 大型底栖动物生态学研究进展. 山东农业科学, (2): 78-81 |
王荦, 杜双成, 杨婷越, 等. 2017. 应用稳定同位素技术评价大连近岸海域食物网营养结构. 生态学杂志, 36(5): 1452-1457 |
王智, 2015.青岛湾潮间带大型底栖动物生态学和形态学研究.山东: 中国海洋大学硕士学位论文, 1-2
|
王玉珏, 邸宝平, 李欣, 等. 2016. 潮间带大型海藻氮稳定同位素的环境指示作用. 海洋环境科学, 35(2): 174-179 |
王田田, 吕振波, 李凡, 等. 2013. 基于稳定碳氮同位素的莱州湾4种鳀鲱科鱼类营养级研究. 中国水产科学, 20(5): 1076-1085 |
王金宝, 李新正, 王洪法, 等. 2018. 山东长岛潮间带大型底栖动物生态特征研究. 海洋科学, 42(10): 41-52 |
卢伙胜, 欧帆, 颜云榕, 等. 2009. 应用氮稳定同位素技术对雷州湾海域主要鱼类营养级的研究. 海洋学报, 31(3): 167-174 |
田甲申, 王震, 李多慧, 等. 2019. 温度、饵料和物种对滤食性贝类碳氮稳定同位素分馏的影响. 大连海洋大学学报, 34(1): 80-86 |
刘保占, 2013.基于稳定同位素组成分析的中国北方海域食物网结构研究.辽宁: 大连海事大学博士学位论文, 63-71
|
孙明, 刘修泽, 李轶平, 等. 2013. 应用氮稳定同位素技术研究辽东湾海域主要渔业生物的营养级. 中国水产科学, 20(1): 190-198 |
李新正. 2011. 我国海洋大型底栖生物多样性研究及展望:以黄海为例. 生物多样性, 19(6): 676-684 |
余婕, 刘敏, 侯立军, 等. 2008. 崇明东滩大型底栖动物食源的稳定同位素示踪. 自然资源学报, 23(2): 319-326 |
陈一波, 宋国宝, 赵文星, 等. 2016. 中国海水养殖污染负荷估算. 海洋环境科学, 35(1): 1-6, 12 |
宋博, 陈琳琳, 闫朗, 等. 2019. 山东东营和烟台潮间带海草床食物网结构特征. 生物多样性, 27(9): 984-992 |
张莹, 吕振波, 徐宗法, 等. 2012. 环境污染对小清河口大型底栖动物多样性的影响. 生态学杂志, 31(2): 381-387 |
张博伦, 郭彪, 于莹, 等. 2019. 基于稳定同位素技术的天津大神堂海域人工鱼礁区食物网结构研究. 渔业科学进展, 40(06): 25-35 |
张雷燕, 安浩, 关保华, 等. 2017. 贡湖湾大型底栖动物碳、氮稳定同位素的空间分布特征. 环境科学与技术, 40(7): 67-71 |
赵明辉, 李绪录. 2014. 2000~2011年深圳湾及邻近水域颗粒有机物的来源和时空分布. 中国环境科学, 34(11): 2905-2911 |
郭梁, 孙翠萍, 任伟征, 等. 2016. 水生动物碳氮稳定同位素富集系数的整合分析. 应用生态学报, 27(2): 601-610 |
夏建荣, 田其然, 高坤山. 2010. 经济海藻红毛菜原位光合作用日变化. 生态学报, 30(6): 1524-1531 |
徐军, 张敏, 谢平. 2010. 氮稳定同位素基准的可变性及对营养级评价的影响. 湖泊科学, 22(1): 8-20 |
郭承秧, 杨志, 陈建芳, 等. 2018. 基于碳、氮稳定同位素的雅浦海沟底栖生物食物来源和营养级初探. 海洋学报, 40(10): 51-60 |
蒋日进, 章守宇, 王凯, 等. 2014. 枸杞岛近岸海域食物网的稳定同位素分析. 生态学杂志, 33(4): 930-938 |
谢斌, 李云凯, 张虎, 等. 2017. 基于稳定同位素技术的海州湾海洋牧场食物网基础及营养结构的季节性变化. 应用生态学报, 28(7): 2292-2298 |
蔡文倩, 刘静, 周娟, 等. 2016. 基于生物量的大型底栖动物功能摄食群结构及生态质量评价. 生物多样性, 24(9): 1045-1055 |
蔡德陵, 毛兴华, 韩贻兵. 1999. 13C/12C比值在海洋生态系统营养关系研究中的应用——海洋植物的同位素组成及其影响因素的初步探讨. 海洋与湖沼, 30(3): 306-314 |
蔡德陵, 洪旭光, 毛兴华, 等. 2001. 崂山湾潮间带食物网结构的碳稳定同位素初步研究. 海洋学报, 23(4): 41-47 |
蔡德陵, 李红燕, 唐启生, 等. 2005. 黄东海生态系统食物网连续营养谱的建立:来自碳氮稳定同位素方法的结果. 中国科学C辑生命科学, 35(2): 123-130 |
Cabello F C, 2006. Heavy use of prophylactic antibiotics in aquaculture:a growing problem for human and animal health and for the environment. Environmental Microbiology, 8(7): 1137-1144 |
Deniro M J, Epstein S, 1978. Influence of on the distribution of carbon isotopes in animals. Geochimica et Cosmochimica Acta, 42(5): 495-506 |
DeNiro M J, Epstein S, 1981. Influence of diet on the distribution of nitrogen isotopes in animals. Geochimica et Cosmochimica Acta, 45(3): 341-351 |
Enge A J, Wanek W, Heinz P, 2018. Preservation effects on isotopic signatures in benthic foraminiferal biomass. Marine Micropaleontology, 144: 50-59 |
Fanelli E, Cartes J E, Papiol V, 2011. Food web structure of deep-sea macrozooplankton and micronekton off the Catalan slope:insight from stable isotopes. Journal of Marine Systems, 87(1): 79-89 |
Finlay J C, Doucett R R, Mcneely C, 2010. Tracing energy flow in stream food webs using stable isotopes of hydrogen. Freshwater Biology, 55(5): 941-951 |
Gee J M, 1989. An ecological and economic review of meiofauna as food for fish. Zoo logical Journal of the Linnean Society, 96(3): 243-261 |
Hobson K A, Welch H E, 1992. Determination of trophic relationships within a high Arctic marine food web using δ13C and δ15N analysis. Marine Ecology Progress Series, 84: 9-18 |
Hyslop E J, 1980. Stomach contents analysis-a review of methods and their application. Journal of Fish Biology, 17(4): 411-429 |
Madurell T, Fanelli E, Cartes J E, 2008. Isotopic composition of carbon and nitrogen of suprabenthic fauna in the NW Balearic Islands(western Mediterranean). Journal of Marine Systems, 71(3-4): 336-345 |
Minagawa M, Wada E, 1984. Stepwise enrichment of 15N along food-chains:Further evidence and the relation between δ15N and animal age. Geochimica et Cosmochimica Acta, 48(5): 1135-1140 |
Naylor R L, Goldburg R J, Primavera J H et al, 2000. Effect of aquaculture on world fish supplies. Nature, 405(6790): 1017-1024 |
Phillips D L, Gregg J W, 2003. Source partitioning using stable isotopes:coping with too many sources. Oecologia, 136(2): 261-269 |
Post D M, 2002. Using stable isotopes to estimate trophic position:models, methods, and assumptions. Ecology, 83(3): 703-718 |
Preciado I, Cartes J E, Punzón A et al, 2017. Food web functioning of the benthopelagic community in a deep-sea seamount based on diet and stable isotope analyses. Deep Sea Research Part Ⅱ:Topical Studies in Oceanography, 137: 56-68 |
Sabo J L, Finlay J C, Kennedy T et al, 2010. The Role of Discharge Variation in Scaling of Drainage Area and Food Chain Length in Rivers. Science, 330(6006): 965-967 |
Schwarcz H P, 1991. Some theoretical aspects of isotope paleo diet studies. Journal of Archaeological Science, 18(3): 261-275 |
Tovar A, Moreno C, Mánuel-Vez M P et al, 2000. Environmental implications of intensive marine aquaculture in earthen ponds. Marine Pollution Bulletin, 40(11): 981-988 |
Vander Zanden M J, Fetzer W W, 2007. Global patterns of aquatic food chain length. Oikos, 116(8): 1378-1388 |
 2020, Vol. 51
2020, Vol. 51


