
中国海洋湖沼学会主办。
文章信息
- 何鎏臻, 寿鹿, 廖一波, 汤雁滨, 刘强, 刘清河, 陈全震, 高爱根. 2020.
- HE Liu-Zhen, SHOU Lu, LIAO Yi-Bo, TANG Yan-Bin, LIU Qiang, LIU Qing-He, CHEN Quan-zheng, GAO Ai-Gen. 2020.
- 长江口及其临近海域大型底栖动物功能群演替初探
- THE SUCCESSION OF MACROBENTHIC FUNCTIONAL GROUPS IN CHANGJIANG RIVER ESTUARY AND ITS ADJACENT WATERS
- 海洋与湖沼, 51(3): 477-483
- Oceanologia et Limnologia Sinica, 51(3): 477-483.
- http://dx.doi.org/10.11693/hyhz20191100238
文章历史
-
收稿日期:2019-11-30
收修改稿日期:2020-02-05
大河河口三角洲及其临近海域是陆地、海洋间物质和能量交换最强烈的地带, 具有复杂的物理、化学、生物和地质过程, 是全球变化研究的前沿领域之一(Bianchi et al, 2009)。长江口作为世界第三大河的入海口, 与陆架水体共同塑造了长江三角洲和临近海域的环境特征(Chen et al, 1999)。长江口及临近海域受到长江冲淡水、黑潮、台湾暖流、东海沿岸流的剧烈影响(Zhang et al, 2006.), 同时作为长三角经济带重要港口和渔场, 还受到排水、捕捞、航运等多种人为活动影响, 是我国近海生物地化循环最为活跃, 生态系统最为复杂的海域之一。
大型底栖动物是海洋生态系统物质循环和能量流动的消费者和转移者, 是食物网中重要的一环, 在海洋生态系统中占据重要地位(Conlan et al, 2008)。大型底栖动物由于生命周期相对较长, 迁移能力较弱, 主要生活在海底沉积物表面或者内部, 生活环境相对固定, 因此大型底栖动物的区域演化能够很好地反映环境因素对该区域长期的影响状况。与种类组成相比, 功能群分类能更有效地反应生境梯度变化和生态系统的功能(Gaudêncio et al, 2007)。国内外已经有许多学者在研究底栖动物时, 运用了功能群的研究方法(Andersen, 1995; 尤仲杰等, 2011)。对于长江口大型底栖动物的研究, 则主要集中在其群落结构和数量分布时空变化的研究(王延明等, 2009; 刘录三等, 2012)。本文从食性即功能群角度来分析长江口及临近海域大型底栖动物的演变, 并结合环境因子分析, 探究环境因素变化对底栖动物功能群演化的影响, 以期为我国近海生态系统的管理和修复提供参考。
1 材料与方法 1.1 研究海域和站位长江是中国最大的河流, 绵延6200km, 每年向长江口输送大量的淡水(924109m3)和沉积物(486106t)等(Rabouille et al, 2008)。长江口富营养化发生情况较多, 而且周边分布着舟山渔场、长江口渔场、吕泗渔场和大沙渔场等众多著名渔场。本文采用2006年、2009年、2011年以及2013年的908项目以及补充航次所获的样品进行分析, 采样日期均为夏季8月份, 具体站位见图 1。
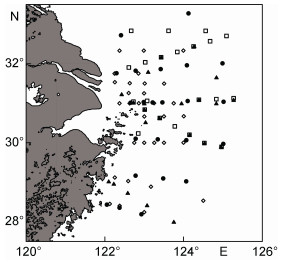 |
| 图 1 2006—2013年长江口及其临近海域调查站位图 Fig. 1 Station deployment for survey in Changjiang (Yangtze) River estuary and its adjacent waters from 2006 to 2013 注: ◇: 2006年; ●: 2009年; □: 2011年; ▲: 2013年 |
根据《海洋调查规范》(GB/T 12763-2007)和《海洋监测规范》(GB 17378-2007), 使用0.1m2的Van Veen型抓斗式底质采样器, 重复采样两次。泥样经过0.5mm孔径的网筛, 收集筛取的生物样品, 并用5%中性福尔马林固定。同时测量采样站位底层水环境状况, 主要参数包括盐度、温度、溶解氧(DO)、pH、硝酸盐、磷酸盐。实验室内对固定样品进行物种鉴定、计数、称重。
1.3 功能群划分底栖动物功能群是具有相同生态功能的底栖动物的组合(廖一波等, 2013)。根据大型底栖动物的食性, 参考相关文献, 将其划分为以下5类功能群:浮游生物食者(planktophagous group, Pl)、植食者(phytophagous group, Ph)、肉食者(carnivorous group, C)、杂食者(omnivorous group, O)、碎屑食者(detritivorous group, D)(刘瑞玉等, 2007; Navarro-Barranco et al, 2013)。
1.4 数据处理以及分析利用SPSS 19.0版本对功能群参数和环境参数进行以年限为因素的单因素方差分析, 先对数据进行正态性(Kolmogorov-Smirnov test)和方差同质性(Bartlett test)检验, 然后做参数统计分析, 显著性水平设置为α=0.05。采用Cacono 5中的典范对应分析(CCA)对大型底栖动物功能群与环境因素的关系进行分析。
2 结果 2.1 环境参数的变化长江口及其临近海域环境变化非常剧烈, 单因素方差分析结果表明(表 1), 环境参数包括温度、盐度、溶解氧(DO)、pH、硝酸盐、磷酸盐均呈现出较显著的年际差异(P<0.05)。
| 2006年 | 2009年 | 2011年 | 2013年 | P | |
| 温度(℃) | 21.10±2.52 | 21.27±3.53 | 17.50±3.47 | 25.70±2.34 | 0.00 |
| 盐度 | 33.21±2.86 | 33.87±1.11 | 32.79±1.27 | 31.92±1.87 | 0.02 |
| DO(mg/L) | 3.75±0.98 | 4.09±1.08 | 5.10±1.48 | 4.00±1.12 | 0.01 |
| pH | 8.09±0.09 | 8.18±0.28 | 8.06±0.07 | 7.99±0.07 | 0.00 |
| 硝酸盐(µmol/L) | 13.39±7.10 | 20.41±15.56 | 12.91±5.44 | 9.01±4.09 | 0.00 |
| 磷酸盐(µmol/L) | 0.60±0.26 | 0.75±0.39 | 0.93±1.02 | 0.79±0.28 | 0.03 |
| 注: P<0.05为差异显著 | |||||
2006年设置站位31个, 共采集到大型底栖动物256种, 其中竹节虫(Maldane sp.)物种密度最高, 其次是小头虫(Capitella capitata)、中华异稚虫(Heterospio sinica)和沙蚕类等, 生物量最高的为毛蚶属(Scapharca sp.), 之后是海地瓜(Acaudina molpadioides)和红点圆趾蟹(Ovalipes punctatus)。2009年设置站位23个, 共获取大型底栖动物251种, 其中密度最高的物种为栉江珧(Atrina pectinata), 梳鳃虫(Terebellide stroemii)和龟螺(Cavolinia tridentata)紧随其后。生物量方面, 凹裂星海胆(Scchizaster lacunosus)的生物量最高, 其次是魁蚶(Scapharca broughtonii)和栉江珧(Atrina pectinata)。2011年设置站位22个, 采集到大型底栖动物261种, 毛头梨体星虫(Apionsoma trichocephalus)、变肋角贝(Dentalium octangulatum)和异蚓虫(Heteromastus filiforms)是密度的前三名, 海地瓜(Acaudina molpadioides)、芋参(Molpadia sp.)和孔虾虎鱼(Trypauchen vagina)则占据了生物量的前三甲。2013年设置站位22个, 共采集到大型底栖动物343种, 毛头犁体星虫(Apionsoma trichocephalus)的密度依旧最高, 其次是伪才女虫(Pseudopolydora sp.)和小胡桃蛤(Nucula paulula), 鹰爪虾(Trachypenaeus curvirostris)的生物量最高, 其次是伪才女虫(Pseudopolydora sp.)。
2.3 大型底栖动物功能群密度和生物量的变化在2006—2013年的四个调查年份的调查区域内, 底栖动物的密度都呈现出逐年上升的趋势(表 2), 2006年平均密度174.19ind./m2, 2009年为160.65ind./m2, 2011年上升到378.64ind./m2, 2013年继续上升至628.64ind./m2, 其中增长最快的是浮游生物食者功能群, 从18.55ind./m2上升到了137.73ind./m2, 其次是肉食者功能群, 从55.00ind./m2上升至246.82ind./m2, 碎屑食者功能群和杂食者功能群在2009年有略微的下降, 但在2011年和2013年迅速上升, 植食者功能群则一直保持在较低的水平。
| 2006年 | 2009年 | 2011年 | 2013年 | P | |
| 密度(ind./m2) | |||||
| 肉食者 | 55.00 | 69.57 | 141.82 | 246.82 | <0.01 |
| 碎屑食者 | 74.84 | 46.30 | 151.36 | 177.73 | <0.01 |
| 杂食者 | 25.00 | 11.09 | 47.73 | 65.00 | 0.01 |
| 植食者 | 0.81 | 1.74 | 0.00 | 1.36 | 0.14 |
| 浮游生物食者 | 18.55 | 31.96 | 37.73 | 137.73 | <0.01 |
| 生物量(g/m2) | |||||
| 肉食者 | 1.33 | 17.63 | 17.63 | 14.71 | 0.11 |
| 碎屑食者 | 1.57 | 5.57 | 5.48 | 3.58 | 0.10 |
| 杂食者 | 0.12 | 2.37 | 4.27 | 1.23 | 0.30 |
| 植食者 | 0.62 | 0.39 | 0.00 | 0.07 | 0.62 |
| 浮游生物食者 | 0.64 | 9.62 | 4.61 | 5.21 | 0.06 |
| 注: P<0.05为差异显著 | |||||
大型底栖动物的生物量, 各年份之间的差异则较大。2006年各站位平均生物量为4.27g/m2, 在2009年和2011年分别上升到35.58g/m2和32.00g/m2, 但是在2013年又回落到24.79g/m2。除浮游生物食者功能群在2011年有所下降外, 几个功能群各自的生物量变化趋势都与大型底栖动物生物量总量相似, 在2006年保持较低水平, 在2009年上升至较高的水平之后, 2011年继续保持在较高水平, 2013年略有回落。其中浮游生物食者功能群在2011年出现了较大的回落, 从2009年的9.62g/m2回落到4.61g/m2, 然后2013年又上升到5.21g/m2。
2.4 大型底栖动物功能群组成占比变化从四个调查年份的总体看, 肉食者功能群和碎屑食者功能群占主导地位, 肉食者平均密度占38.24%, 碎屑食者占33.55%, 浮游生物者与杂食者分别占16.84%和11.09%, 植食者密度极低, 仅占0.29%(图 2)。在2006—2013年间, 肉食者功能群和碎屑食者功能群呈现出交替上升的现象, 当肉食者功能群占比上升时, 碎屑食者功能群占比则会减少, 反之亦然。而杂食者功能群和浮游生物食者功能群也是呈现相似的状况。这也说明, 在密度的占比方面, 肉食者功能群和浮游生物食者功能群表现出协同增长的趋势, 碎屑食者功能群则和杂食者功能群表现出协同增长的趋势, 而植食者功能群一直保持较低占比。
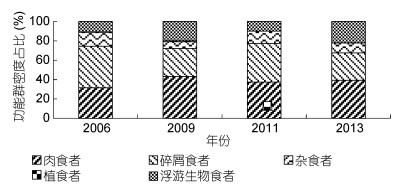 |
| 图 2 2006—2013年长江口大型底栖动物功能群密度百分比组成 Fig. 2 Percentage composition of biological density of macrobenthic functional groups in the estuary from 2006 to 2013 |
在生物量方面, 由于肉食者功能群普遍个体较大, 生物量最高, 占比高达53.09%, 浮游生物食者占比为20.78%, 碎屑食者占到了16.76%。而由于杂食者个体较小, 植食者的密度较低, 所以这两类的生物量占比都较低, 分别为8.26%和1.11%(图 3)。2006年至2013年间, 肉食者功能群的生物量占比持续上升, 从31.08%上升到59.35%, 碎屑食者功能群生物量占比则持续下降, 从36.73%下降至14.43%。浮游生物食者功能群生物量占比呈现出上下波动的趋势, 四个调查年度内占比分别为5.96%、27.04%、14.42%和21.00%。杂食者功能群的生物量占比在2011年达到高值为13.34%, 但是在2013年迅速跌落至4.95%。植食者功能群的生物量占比在2006年较高为14.47%, 但是在后面几年中占比极低。
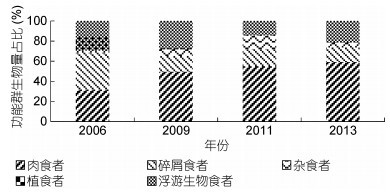 |
| 图 3 2006—2013年长江口大型底栖动物功能群生物量百分比组成 Fig. 3 Percentage composition of biomass of macrobenthic functional groups in the estuary from 2006 to 2013 |
CCA分析结果表明(图 4), 大型底栖动物功能群和所测环境因子表现出较好的相关性, 其中pH、硝酸盐(NO3-N)、溶解氧(DO)和温度(T)对功能群密度的影响较大, 而且不同环境因子对不同功能群生物量的正负相关性也有较大差异。
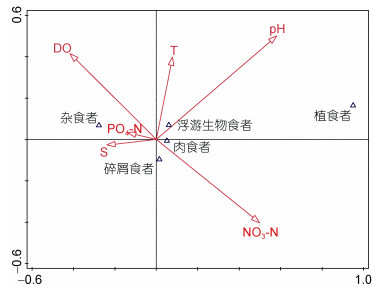 |
| 图 4 大型底栖动物功能群密度与环境因子的CCA排序图 Fig. 4 CCA ordination diagrams of macrobenthic functional groups and environmental factors 注: DO:溶解氧; T:温度; S:盐度; NO3-N:硝酸盐; PO4-N:磷酸盐。 |
长江口及临近海区的大型底栖动物中肉食者功能群的密度和生物量最高, 代表性物种为多毛类, 包括双鳃内卷齿蚕、日本索沙蚕、长吻沙蚕、西奈索沙蚕等, 肉食者功能群在四个年份的生物量分别占到了31.08%、49.55%、55.12%、59.35%, 呈现上升趋势, 这可能是因为长江口及其临近海域是长江流域入海的纳污区域, 受人类活动影响较大, 致使该海域富营养化严重, 多毛类等肉食者能获得充足的食物来源, 有利于这些机会种的生存与发展, 这个结果与莱州湾大型底栖动物功能群的研究结果吻合(李少文等, 2013)。而在其他海域的研究中, 浙江西门岛和象山港的大型底栖动物功能群中浮游生物食者的平均密度和生物量最高(尤仲杰等, 2011; 廖一波等, 2013); 广州南沙潮间带(颜露露等, 2016)以及灵昆岛东滩(葛宝明等, 2008)的大型底栖动物功能群主要为软体动物和甲壳类等植食者功能群。
长江口及其临近海域受富营养化影响较大, 经常出现赤潮等现象(林国红等, 2019), 赤潮过后, 大量有机质从水体沉降至海底, 碎屑食者获得充足的食物来源, 致使其生物密度大量增加, 而以这些小型碎屑食者为食物来源的肉食者数量也相应增加, 从而形成了该海域大型底栖动物功能群以肉食者和碎屑食者为主的现象。但根据于仁成等(2017)的研究, 2011年至2015年藻华发生数量下降较为明显, 因此碎屑食者占比有所下降。
在不同年份的功能群组成中, 各功能群在密度和生物量上的差异明显, 肉食者功能群的密度和生物量均最高, 碎屑食者功能群的密度虽然与肉食者相差不多, 但是生物量远低于肉食者功能群, 这主要是因为肉食者功能群的个体较大, 单位生物量较高。浮游生物食者和杂食者的密度和生物量均处于中等水平, 这可能是由于长江口及其临近海域的人为营养盐输入较多, 促进了浮游植物的生长, 从而造成了浮游生物食者和杂食者功能群数量的增加。此外植食者功能群的密度和生物量均较小, 可能是由于长江口区域大多属于软泥底质, 底栖植物较少所导致的。
3.2 大型底栖动物功能群的年际变化2006—2013年长江口海域的大型底栖动物生物量并没有显著差异, 但是密度的差异比较显著, 每年的增长量都较大, 而且物种数量也有所增加, 说明底栖动物的个体趋于小型化, 其中肉食者和浮游生物食者功能群的增长速度较快, 肉食者功能群中环境适应能力较强的多毛类数量和种类增长较明显。而根据以往资料, 近50年来, 由于该水域生境的变化, 个体较小、生命周期较短、繁殖快速的多毛类取代了个体较大、生长周期较长的棘皮动物, 成为长江口区域最重要的优势类群(周晓蔚等, 2009)。而袁一鸣等(2015)基于2011—2014年长江口海域夏季大型底栖动物调查资料也发现底栖动物种类总数呈升高趋势, 多毛类比例上升。
在四次调查中, 2006—2009年, 密度没有显著变化, 而生物量则发生表现出显著增长, 主要是因为环境稳定, 致使软体动物的数量明显上升, 软体动物生物量相对较大, 使得浮游生物食者功能群的生物量显著增加。而后在2011—2013年, 由于环境影响与扰动, 功能群平均密度急剧增加, 平均生物量却没有变化甚至有所减少, 主要是因为功能群组成种类发生了变化, 个体小、生存能力强的机会种代替了个体较大、不能适应环境变化的物种。
3.3 大型底栖生物功能群变化与环境因素的关系通过环境因子和大型底栖动物功能群的密度的CCA分析可以发现, 不同环境因子对不同功能群的影响是有差异的。本次研究中, 溶解氧、硝酸盐、pH和温度对功能群密度的影响较大。其中杂食者与溶解氧有较强的正相关关系, 其次为温度、磷酸盐与盐度, 而硝酸盐则与杂食者功能群密度有着极强的负相关关系; 肉食者功能群受硝酸盐的正面影响较大, 其次为pH和温度, 但是同时受到溶解氧、磷酸盐和盐度的限制; 碎屑食者的密度与肉食者功能群相似, 与硝酸盐呈较高的正相关, 但是又与温度呈现较高的负相关性; 植食者由于密度较小, 与环境因子的相关性不高; 浮游生物食者功能群与pH和温度呈较高的正相关性, 盐度和磷酸盐与其呈现较高的负相关性。
长江口及其临近海域长期受到富营养化的影响, 时常出现藻华以及缺氧区。近年来, 大量生活工业污水进入长江口水体, 富营养化愈发严重, 藻华的发生次数较多(图 5, 于仁成等, 2017), 浮游植物的增加使得浮游生物食者和杂食者有一定增加, 但是由于溶解氧含量的下降和海水的酸化使这个增加较为有限。藻华后有机质的沉降为碎屑食者提供了充足的食物来源, 为碎屑食者的繁殖生长提供了良好的条件。而有机质分解和水流的影响又导致了长江口季节性缺氧区的形成(周锋, 2010), 根据本研究的环境数据, 长江口部分区域处于低氧状态, 而未到缺氧状态, 虽然并未使该区域的生物灭绝, 但是溶解氧的限制使得该区域的生物趋于小型化, 肉食者功能群尤为明显, 沙蚕类等机会种底栖动物大量增长, 这些底栖动物的活动能力较强、体节较多, 对低氧环境有很强的适应能力。而2011—2015年藻华发生数量有所下降, 溶解氧含量上升, 营养盐含量下降, 富营养化得到缓解, 藻华发生次数下降, 所以本研究中长江口及其临近海域的大型底栖动物密度和生物量都显著上升。
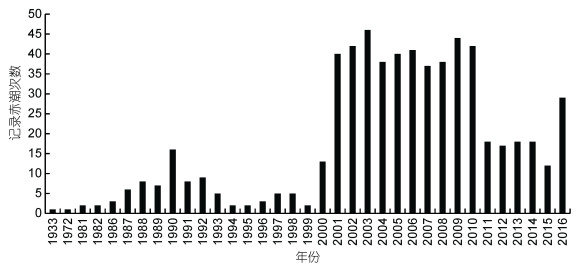 |
| 图 5 长江口临近海域纪录赤潮发生次数 Fig. 5 Recorded red-tide events in the sea area adjacent to the estuary 注:引用自(于仁成等, 2017) |
目前有研究指出不同的底栖动物对环境因子的响应根据不同区域不同时间有较大差异(Norris et al, 2000)。温度(朱鑫华等, 1994)、洋流、淡水输入以及沉积物粒径(Service et al, 1992)等物理条件, 以及pH、溶解氧、营养盐等化学条件都会对底栖动物产生长足的影响(刘录三等, 2012)。长江三峡大坝工程的建设与运行、航运工程的建设、长三角地区生活工业污水的排放、大型船只的通航、渔业的过度捕捞以及人为的增殖放流等人为因素加剧了这些环境变化(袁一鸣等, 2015)。特别是长江口低氧区的存在(周锋等, 2010), 使得溶解氧成为影响大型底栖动物密度的重要条件。
4 结论2006—2013年, 长江口及其临近海域大型底栖动物功能群平均密度增长较快; 2006—2009年, 该区域平均生物量出现暴发式增长, 之后发展较为平稳, 变化较小。肉食者功能群在该区域处于优势地位, 其次为碎屑食者和浮游生物食者, 植食者不论是平均密度和平均生物量都较小。环境因子中溶解氧、硝酸盐、pH和温度对功能群密度的影响较大, 由于该区域受到多种理化因素和人为因素影响, 环境条件较为多变, 使得大型底栖动物逐步从个体大、适应能力较弱的种类向个体较小、繁殖较快、适应能力较强的机会种转变。
于仁成, 张清春, 孔凡洲, 等. 2017. 长江口及其邻近海域有害藻华的发生情况、危害效应与演变趋势. 海洋与湖沼, 48(6): 1178-1186 |
王延明, 方涛, 李道季, 等. 2009. 长江口及毗邻海域底栖生物丰度和生物量研究. 海洋环境科学, 28(4): 366-370, 382 DOI:10.3969/j.issn.1007-6336.2009.04.005 |
尤仲杰, 陶磊, 焦海峰, 等. 2011. 象山港大型底栖动物功能群研究. 海洋与湖沼, 42(03): 431-435 |
朱鑫华, 吴鹤洲, 徐凤山, 等. 1994. 黄渤海沿岸水域游泳动物群落多样性及其相关因素的研究. 海洋学报, 16(3): 102-112 |
刘录三, 郑丙辉, 李宝泉, 等. 2012. 长江口大型底栖动物群落的演变过程及原因探讨. 海洋学报, 34(3): 134-145 |
刘瑞玉, 任先秋, 李新正, 等. 2007. 中国动物志:无脊椎动物. 北京: 科学出版社
|
李少文, 刘元进, 李凡, 等. 2013. 莱州湾大型底栖动物功能群现状. 生态学杂志, (02): 380-388 |
林国红, 李克强, 王修林. 2019. 基于赤潮控制要素识别的近海富营养化压力指数研究. 海洋与湖沼, 50(3): 563-578 |
周锋, 黄大吉, 倪晓波, 等. 2010. 影响长江口毗邻海域低氧区多种时间尺度变化的水文因素. 生态学报, 30(17): 4728-4740 |
周晓蔚, 王丽萍, 郑丙辉, 等. 2009. 基于底栖动物完整性指数的河口健康评价. 环境科学, 30(1): 242-247 DOI:10.3321/j.issn:0250-3301.2009.01.041 |
袁一鸣, 秦玉涛, 刘材材, 等. 2015. 长江口海域夏季大型底栖动物群落结构分析. 水产学报, 39(8): 1107-1121 |
葛宝明, 鲍毅新, 程宏毅, 等. 2008. 灵昆岛东滩潮间带大型底栖动物功能群及营养等级构成. 生态学报, 28(10): 4796-4804 DOI:10.3321/j.issn:1000-0933.2008.10.022 |
廖一波, 寿鹿, 曾江宁, 等. 2013. 浙江西门岛海洋特别保护区大型底栖动物功能群特征及其与环境的关系. 生物多样性, 21(1): 3-10 |
颜露露, 蔡立哲, 陈昕韡, 等. 2016. 广州南沙十四涌潮间带大型底栖动物的功能群. 生物多样性, 24(7): 802-810 |
Andersen A N, 1995. A classification of Australian ant communities, based on functional groups which parallel plant life-forms in relation to stress and disturbance. Journal of Biogeography, 22(1): 15-29 DOI:10.2307/2846070 |
Bianchi T S, Allison M A, 2009. Large-river delta-front estuaries as natural "recorders" of global environmental change. Proceedings of the National Academy of Sciences of the United States of America, 106(20): 8085-8092 |
Chen J Y, Li D J, Chen B L et al, 1999. The processes of dynamic sedimentation in the Changjiang Estuary. Journal of Sea Research, 41(1-2): 129-140 DOI:10.1016/S1385-1101(98)00047-1 |
Conlan K, Aitken A, Hendrycks E et al, 2008. Distribution patterns of Canadian Beaufort Shelf macrobenthos. Journal of Marine Systems, 74(3-4): 864-886 DOI:10.1016/j.jmarsys.2007.10.002 |
Gaudêncio M J, Cabral H N, 2007. Trophic structure of macrobenthos in the Tagus estuary and adjacent coastal shelf. Hydrobiologia, 587(1): 241-251 |
Navarro-Barranco C, Tierno-de-Figueroa J M, Guerra-García J M et al, 2013. Feeding habits of amphipods (Crustacea:Malacostraca) from shallow soft bottom communities:comparison between marine caves and open habitats. Journal of Sea Research, 78: 1-7 |
Norris R H, Hawkins C P, 2000. Monitoring river heaith. Hydrobiologia, 435(1-3): 5-17 |
Service S K, Feller R J, 1992. Long-term trends of subtidal macrobenthos in North Inlet, South Carolina. Hydrobiologia, 231(1): 13-40 DOI:10.1007/BF00008528 |
Rabouille C, Conley D J, Dai M H et al, 2008. Comparison of hypoxia among four riverdominated ocean margins:the Changjiang (Yangtze), Mississippi, Pearl, and Rhône rivers. Continental Shelf Research, 28(12): 1527-1537 DOI:10.1016/j.csr.2008.01.020 |
Zhang J, Su J L, 2006. Nutrient dynamics of the Chinese Seas: The Bohai, Yellow Sea, East China Sea and South China Sea. In: Robinson A R, Brink K H eds. The Sea. Cambridge: Harvard University Press, 14, 637-671
|
 2020, Vol. 51
2020, Vol. 51


