中国海洋湖沼学会主办。
文章信息
- 黄雅琴, 王建军, 何雪宝, 林和山, 林俊辉, 牟剑锋, 刘坤, 张舒怡, 黎中宝. 2020.
- HUANG Ya-Qin, WANG Jian-Jun, HE Xue-Bao, LIN He-Shan, LIN Jun-Hui, MOU Jian-Feng, LIU Kun, ZHANG Shu-Yi, LI Zhong-Bao. 2020.
- 三沙湾互花米草(Spartina alterniflora)入侵对大型底栖动物群落结构的影响
- EFFECT OF SPARTINA ALTERNIFLORA INVASION ON COMMUNITY STRUCTURE OF MACROBENTHOS IN SANSHA BAY, FUJIAN
- 海洋与湖沼, 51(3): 506-519
- Oceanologia et Limnologia Sinica, 51(3): 506-519.
- http://dx.doi.org/10.11693/hyhz20191200242
文章历史
-
收稿日期:2019-12-01
收修改稿日期:2020-03-04
2. 自然资源部第三海洋研究所 厦门 361005;
3. 福建省海洋渔业资源与生态环境重点实验室 厦门 361021
2. Third Institute of Oceanography Ministry of Natural Resources, Xiamen 361005, China;
3. Fujian Provincial Key Laboratory of Marine Fishery Resources and Eco-environment, Xiamen 361021, China
互花米草(Spartina alterniflora)源于北美东海岸和墨西哥湾, 最适于生长于河口区, 是原产地盐沼常见优势种, 具有削减波浪, 保滩护岸, 促淤造陆等重要的生态功能。我国于1979年从美国引种互花米草, 20世纪80年代开始在江苏、福建部分海域试验移栽。互花米草具有强适应性和扩散能力, 从引种地迅速蔓延, 现已扩张到世界范围内诸多滨海和河口地区, 作为全球性入侵种引起广泛关注和研究(An et al, 2007; Zhang et al, 2012; 冯建祥等, 2018), 并于2003年被列入16种中国首批外来入侵种名单。
互花米草的入侵增加了生境的复杂性, 对底栖动物的影响也是多方面的, 目前国内外学者已对互花米草生境中大型底栖动物的群落结构、时空动态、多样性(Able et al, 2000; Posey et al, 2003; 徐晓军等, 2006; 杨泽华等, 2007; 仇乐等, 2010; 黄雅琴等, 2011; 沈永明等, 2013; 赵彩云等, 2014; 江旷等, 2016; 冯建祥等, 2018)、次级生产力(杜永芬等, 2012; 吴辰等, 2013; 张苗苗, 2019)等方面进行了研究, 并对不同密度(Webster et al, 1998; 赵永强等, 2009)、不同发育时间(Neira et al, 2007; 谢志发等, 2008)的互花米草对大型底栖动物的影响进行分析比较, 近年来也陆续开展了互花米草区大型底栖动物对不同治理措施的响应研究(段博文, 2013; 盛强等, 2014; 马强等, 2017)。然而, 目前互花米草入侵对底栖动物群落结构的影响尚无一致的结论, 需从不同时间和空间尺度上进一步深入研究。
三沙湾位于福建省宁德市东南部, 地理坐标119°31′26.19″E—120°05′15.92″E, 26°31′01.90″N—26°57′52.14″N (林航, 2014), 三沙湾总面积726.75km2, 滩涂宽阔, 面积为299.44km2, 约占整个海湾面积的41.2%, 是福建六大深水良港之一(郑守专, 2012; 李荣冠等, 2014)。宁德地区海域为我国引种互花米草最早推广试验区之一, 互花米草在潮间带湿地生境中繁殖速度惊人, 占据了三都湾大面积滩涂, 在一定程度上影响了红树林和滩涂中的生物的生存与分布, 1990年, 《中国农牧渔业报》最早报道了互花米草在福建宁德地区的危害状况, 发出了“来自东吾洋的呼吁”(福建省科协, 1988)。据福建省“908专项”调查研究统计, 福建省沿海潮间带滩涂分布米草99.24km2, 其中宁德市66.29km2, 占全省沿海滩涂面积的60%以上, 主要分布在里山湾、福宁湾、三沙湾、东吾洋和三都澳潮间带滩涂(许珠华, 2012)。2013年, 周在明等(2017)应用SPOT6 6m空间分辨率影像获取了影像覆盖区内三沙湾互花米草的分布总面积为20.19km2, 覆盖度以40%—60%和60%—80%的中、高等覆盖度为主。探明三沙湾互花米草入侵对大型底栖动物生物多样性、群落结构及其稳定性的影响, 对入侵危害进行正确的评估, 有助于全面评价外来植物入侵对当地生态系统的生态影响, 为湿地生态系统的结构重建和功能恢复提供理论基础, 同时对于生物多样性保护和生态安全评估具有重要的现实意义和应用价值。
1 材料与方法 1.1 采样方法 1.1.1 大型底栖动物调查基于福建地区气候温和, 互花米草从4月开始进入生长期, 生物量逐渐增大, 直至7—10月, 互花米草停止生长, 而后伴随着植株衰老枯死, 生物量又呈现出下降趋势, 本研究没有按常规调查选择春、秋两季开展调查, 而是选择了2013年10月和2014年9月, 互花米草长势最好, 即生物量最大的月份进行调查, 目的是为了充分反映互花米草入侵对大型底栖动物群落的影响。
三沙湾的主要植被为秋茄和互花米草, 其中秋茄主要分布于环三都澳湿地水禽红树林自然保护区内, 在云淡村成片状连续分布, 平均高度为186± 9.56cm; 互花米草主要分布在云淡村和飞鸾镇, 云淡村的互花米草平均高度为191.83±23.98cm, 平均株数为236.44±74.52株/m2, 飞鸾镇的互花米草平均高度为150.72±14.23cm, 平均株数为221.33±74.73株/m2, 相比之下, MCH1(云淡)互花米草植株的高度较高且分布较密集, 该处土壤水分较少, 互花米草多倒伏, 且开花较早, MCH2(飞鸾)互花米草花期正盛之时, 云淡的互花米草的花蕾已枯萎。
根据三沙湾主要植被的分布特征, 在云淡村布设1条互花米草断面MCH1、2条红树林断面HSH1和HSH2以及1条光滩断面(GTH1), 在飞鸾镇布设1条互花米草断面MCH2, 每条断面布设3个采样点(图 1), 3个采样点离岸距离分别为50m、100m和150m, 每一采样点以25cm×25cm的定量框随机取3个样方, 采样深度为30cm。每个样方样品经“WSBI”型底栖生物涡旋分选器分选后, 再经网目为0.5mm的筛网淘洗分离。样品的取样、保存、分离、鉴定和分析按照国标《海洋调查规范》(GB/ T12763.6-2007)。
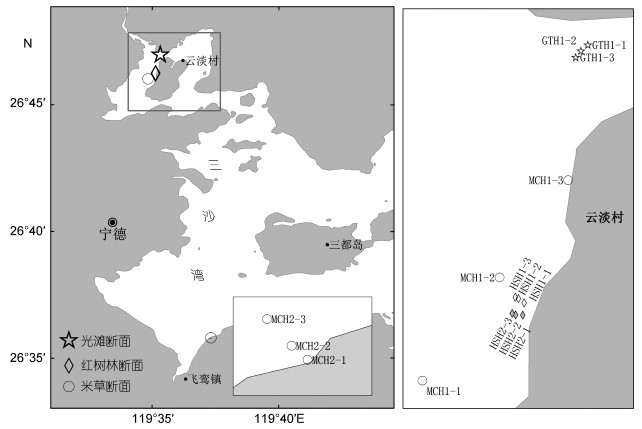 |
| 图 1 三沙湾潮间带大型底栖动物取样断面 Fig. 1 Sampling transects of intertidal benthos in the Sansha Bay, Fujian Province |
为了解调查区域沉积物类型、分布以及粒度参数特征, 在大型底栖动物取样的同时, 进行沉积物表层采样, 并用Mastersi× et2000型激光粒度分布测定仪进行粒度分析测定, 沉积物类型参照《海洋调查规范第8部分:海洋地质地球物理调查(GB/T 12763.8-2007)》。有机质和硫化物含量测定按《海洋监测规范第5部分:沉积物分析(GB 17378.5-2007)》中的有关规定进行(表 1)。
| 序号 | 项目 | 分析方法 | 执行标准 |
| 1 | 底质类型 | 激光粒度仪法 | 《海洋调查规范》GB/T 12763.8-2007 |
| 2 | 粒度 | 激光粒度仪法 | 《海洋调查规范》GB/T 12763.8-2007 |
| 3 | 硫化物 | 亚甲基蓝分光光度法 | 《海洋监测规范》GB 17378.5-2007 |
| 4 | 有机质 | 重铬酸钾氧化-还原容量法 | 《海洋监测规范》GB 17378.5-2007 |
采用下列指数分析大型底栖动物群落的多样性(黄雅琴等, 2010):
数据分析采用Margalef的物种丰富度指数(d)、Shannon-Wiener多样性指数(H′)、Pielou均匀度(J)以及Simpson物种优势度(D)进行多样性研究:
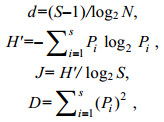
式中, N为采泥样品中所有种类的总个体数目, S为采泥样品中的种类总数, Pi为第i种的个体数与样品中的总个体数的比值(ni/N)。物种丰度计算方法为物种在各站位的平均分布密度, 如某站没有出现该种, 则不计入。采用Primer6.0软件进行上述指数的计算。
1.2.2 物种优势度指数分析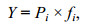
式中, Pi为研究区种i的个体数占总个体数的比例, fi为种i在研究区内各站位出现的频率, 当Y > 0.02时, 该种为优势种。物种数和物种优势度指数计算的数据取各断面3个站点的平均值(唐以杰等, 2012)。
1.2.3 群落结构分析丰度数据经四次方根转化及标准化后, 在Bray-Curtis相似性测量的基础上, 组合使用等级聚类(Cluster)(组平均连接法)来分析群落结构的相似性, 并采用丰度/生物量比较法(ABC)(周红等, 2003)分析生物群落受污染或其他因素扰动的情况, 物种丰度为物种在各站位的平均分布密度, 如某站没有出现该种, 则不计入。
1.2.4 差异显著性分析差异显著性分析用SPSS 21.0软件包进行, 实验数据的比较用双因素无重复方差分析(2-way ANOVA)。
1.2.5 相关性分析潮间带大型底栖动物物种数、栖息密度、生物量以及生物多样性指数与理化因子的相关性分析, 用SPSS 21.0软件包进行, 采用Pearson Correlation。
2 研究结果 2.1 理化因子水平红树林区HSH1断面、互花米草区和光滩沉积物有机碳含量 < 2%, 符合国家沉积物质量一类标准。红树林区HSH2断面沉积物有机碳含量为2.00± 0.06 < 3%, 符合国家沉积物质量二类标准。不同生境间比较, 红树林区(1.94±0.08) > 互花米草区(1.49±0.27) > 光滩(1.19± 0.22)(表 2)。
| 理化因子 | 红树林 | 光滩GTH1(云淡) | 互花米草 | ||
| HSH1(云淡) | HSH2(云淡) | MCH1(云淡) | MCH2(飞鸾) | ||
| 有机碳(%) | 1.88±0.04 | 2.00±0.06 | 1.19±0.22 | 1.58±0.13 | 1.41±0.39 |
| 硫化物(mg S/kg) | 112.67±16.14 | 173.7±26.40 | 82.07±13.64 | 134.35±27.43 | 200.03±16.45 |
| 砂(%) | 13.49±7.38 | 11.5±3.18 | 2.43±1.14 | 8.00±3.03 | 23.38±20.94 |
| 粉砂(%) | 61.08±2.52 | 64.29±2.00 | 66.76±1.47 | 64.44±0.66 | 51.06±15.23 |
| 粘土(%) | 25.43±5.02 | 24.21±1.19 | 30.82±2.41 | 27.57±3.15 | 25.56±5.79 |
各研究区域沉积物硫化物测值均 < 300mg S/kg, 符合国家沉积物质量一类标准, 不同生境硫化物测值差异较大, 互花米草区(167.19±41.28) > 红树林区(143.18±38.74) > 光滩(82.07±13.64)(表 2)。互花米草区和红树林区沉积物硫化物含量较高, 主要与互花米草和红树凋落物在沉积物中腐烂有关。
对沉积物特征因子进行双因素无重复方差分析, 以检验水平α=0.05下对各区域沉积物粒径参数因子:砂含量、粉砂含量、黏土含量、中值粒径(Mdφ)、平均粒径(Mzφ)、标准偏差(σi)、峰态(Kgφ)进行F检验, 结果显示沉积峰态(Kgφ)行上的F=13.96412, P=0.001108 < 0.01, 差异极显著, 这说明沉积物峰态(Kgφ)在不同离岸距离差异极显著, 其他沉积物粒径参数因子在不同离岸距离不同底质差异不显著。沉积物中有机质含量的F检验结果, 可见离岸距离的F=9.143673, P=0.004443 < 0.01, 差异极显著, 沉积物中硫化物含量的F检验结果, 可见离岸距离的F=22.27, P=0.000215 < 0.01, 差异极显著, 这说明调查区域的底质不同对硫化物和有机质含量没有显著影响, 而调查站位离岸的距离对硫化物和有机质含量影响极显著。
2.2 大型底栖动物种类组成与优势种 2.2.1 种类组成三沙湾互花米草、光滩、红树林三种生境大型底栖动物经鉴定共计68种, 隶属于7门40科(见附录)。其中节肢动物种类最多, 有23种, 占33.82%;环节动物22种, 占32.35%;其他动物13种(包括3种刺胞动物, 4种纽形动物, 1种星虫动物和5种脊索动物), 占19.12%;软体动物10种, 占14.71%。不同生境间比较, 红树林区(40) > 互花米草区(37) > 光滩(26)(表 3)。
| 类群 | 光滩GTH1(云淡) | 红树林 | 互花米草 | |||||
| HSH1(云淡) | HSH2(云淡) | 合计 | MCH1(云淡) | MCH2(飞鸾) | 合计 | |||
| 环节动物 | 13 | 11 | 7 | 11 | 5 | 5 | 9 | |
| 软体动物 | 3 | 2 | 1 | 3 | 2 | 7 | 7 | |
| 节肢动物 | 6 | 13 | 10 | 15 | 10 | 11 | 15 | |
| 棘皮动物 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| 其他动物 | 4 | 8 | 9 | 11 | 5 | 3 | 6 | |
| 总计 | 26 | 34 | 27 | 40 | 22 | 26 | 37 | |
不同生境大型底栖动物的优势种存在差异(表 4)。光滩、红树林和互花米草湿地中大型底栖动物优势种种数分别为4、3、4种, 3种生境中优势度指数最高的物种都不相同, 分别为宁波泥蟹(0.186)、巴林虫(0.063)和短拟沼螺(0.152)。3种生境中物种优势度指数最高和最低值相差分别为:光滩(0.163)、红树林(0.036)、互花米草(0.131)。
| 类型 | 种名 | 优势度指数 |
| 光滩 | 宁波泥蟹Ilyoplax ningpoensis Shen | 0.186 |
| 异蚓虫Heteromastus filiformis (Claparede) | 0.093 | |
| 短拟沼螺Assiminea brevicula Pfeiffer | 0.078 | |
| 巴林虫Barantolla sp. | 0.023 | |
| 红树林 | 巴林虫Barantolla sp. | 0.063 |
| 弧边招潮Uca (Deltuca) arcuata (de Haan) | 0.043 | |
| 拟异蚓虫Parheteromastus sp. | 0.027 | |
| 互花米草 | 短拟沼螺Assiminea brevicula Pfeiffer | 0.152 |
| 双齿围沙蚕Perinereis aibuhitensis Grube | 0.086 | |
| 锥虫Haploscoloplos sp. | 0.046 | |
| 褶痕相手蟹Parasesarma plicata (Latreille) | 0.021 |
对各断面大型底栖动物物种组成进行双因素无重复方差分析, 以检验水平α=0.05下对各主要生物类群物种组成进行F检验, 结果显示列上的F=5.088398, P=0.016806 < 0.05, 差异显著, 这说明大型底栖动物物种组成在不同生境差异显著。对2条入侵程度不同的互花米草区域大型底栖动物物种进行双因素无重复方差分析, 以检验水平α=0.05下对各主要生物类群物种组成进行F检验, 结果显示差异不显著。
2.3 生物量和栖息密度组成与分布 2.3.1 生物量组成与分布三种生境大型底栖动物平均生物量为62.49g/m2, 不同生境差别较大, 以互花米草区(81.78g/m2) > 红树林区(51.12g/m2) > 光滩(46.68g/m2)。除互花米草断面MCH2(飞鸾)外, 其余各生境大型底栖动物平均生物量都以环节动物为栖息密度主要贡献群体。2013和2014两个年度, 两条互花米草群落平均生物量比较, 均以MCH2(飞鸾) > MCH1(云淡)(表 5)。
| 年度 | 类型 | 断面 | 环节动物 | 软体动物 | 节肢动物 | 其他动物 | 合计 |
| 2013 | 互花米草 | MCH1 | 3.70 | 0.76 | 37.58 | 23.41 | 65.46 |
| MCH2 | 43.80 | 21.99 | 28.94 | 2.22 | 96.96 | ||
| 平均 | 23.75 | 11.38 | 33.26 | 12.82 | 81.21 | ||
| 光滩 | GTH1 | 11.95 | 1.12 | 33.62 | 0.39 | 47.08 | |
| 红树林 | HSH1 | 8.82 | 0.00 | 43.40 | 0.66 | 52.87 | |
| HSH2 | 1.71 | 0.04 | 18.97 | 1.28 | 21.99 | ||
| 平均 | 5.26 | 0.02 | 31.18 | 0.97 | 37.43 | ||
| 年平均生物量 | 13.99 | 4.78 | 32.50 | 5.59 | 56.87 | ||
| 2014 | 互花米草 | MCH1 | 6.83 | 1.17 | 39.68 | 8.71 | 56.39 |
| MCH2 | 34.70 | 27.43 | 30.54 | 15.64 | 108.32 | ||
| 平均 | 20.76 | 14.30 | 35.11 | 12.18 | 82.36 | ||
| 光滩 | GTH1 | 13.65 | 2.35 | 29.89 | 0.39 | 46.28 | |
| 红树林 | HSH1 | 10.52 | 0.76 | 47.64 | 0.76 | 59.70 | |
| HSH2 | 6.54 | 0.00 | 47.57 | 15.79 | 69.90 | ||
| 平均 | 8.53 | 0.38 | 47.61 | 8.28 | 64.80 | ||
| 年平均生物量 | 14.45 | 6.34 | 39.07 | 8.26 | 68.12 | ||
| 注:生物量单位为g/m2 | |||||||
对各断面大型底栖动物生物量组成进行双因素无重复方差分析, 以检验水平α=0.05下对各主要生物类群物种组成进行F检验, 2013年结果显示列上的F=6.4817, P=0.007426 < 0.01, 差异极显著, 2014年结果显示列上的F=12.8671, P=0.000466 < 0.01, 差异极显著, 这说明大型底栖动物生物量的组成在不同生境差异极显著。
2.3.2 栖息密度组成与分布三种生境大型底栖动物平均栖息密度为607ind./m2, 不同生境差别较大, 以光滩(1017ind./m2) > 红树林区(662ind./m2) > 互花米草区(346ind./m2)。各断面平均栖息密度都以环节动物为栖息密度主要贡献群体。2013和2014两个年度, 两条互花米草群落平均栖息密度比较, 均以MCH2(飞鸾) > MCH1(云淡)(表 6)。
| 年度 | 类型 | 断面 | 环节动物 | 软体动物 | 节肢动物 | 其他动物 | 合计 |
| 2013 | 互花米草 | MCH1 | 57 | 21 | 44 | 21 | 144 |
| MCH2 | 256 | 140 | 43 | 7 | 446 | ||
| 平均 | 156 | 81 | 44 | 14 | 295 | ||
| 光滩 | GTH1 | 1052 | 110 | 240 | 11 | 1413 | |
| 红树林 | HSH1 | 171 | 0 | 82 | 11 | 263 | |
| HSH2 | 142 | 4 | 66 | 12 | 224 | ||
| 平均 | 156 | 2 | 74 | 12 | 244 | ||
| 年平均栖息密度 | 336 | 55 | 95 | 12 | 498 | ||
| 2014 | 互花米草 | MCH1 | 256 | 36 | 28 | 32 | 352 |
| MCH2 | 284 | 117 | 30 | 9 | 441 | ||
| 平均 | 270 | 76 | 29 | 20 | 396 | ||
| 光滩 | GTH1 | 398 | 52 | 160 | 11 | 620 | |
| 红树林 | HSH1 | 1536 | 4 | 66 | 53 | 1659 | |
| HSH2 | 370 | 0 | 69 | 64 | 503 | ||
| 平均 | 953 | 2 | 68 | 59 | 1081 | ||
| 年平均栖息密度 | 569 | 42 | 71 | 34 | 715 | ||
| 注:栖息密度单位为ind./m2 | |||||||
对各断面大型底栖动物栖息密度组成进行双因素无重复方差分析, 以检验水平α=0.05下对各主要生物类群物种组成进行F检验, 2013年结果显示列上的F=2.9014, P=0.0787 > 0.05, 差异不显著, 2014年结果显示列上的F=3.8263, P=0.0511 > 0.05, 差异不显著, 这说明大型底栖动物栖息密度的组成在不同生境差异不显著。
2.4 大型底栖动物群落特征指数根据Shannon-Wiener种类多样性指数(H′)、Pielous种类均匀度指数(J)、Margalef种类丰富度指数(d)和Simpson优势度(D)显示, 多样性指数和均匀度指数均以光滩最大。丰富度指数和优势度指数都以红树林区 > 互花米草区 > 光滩, 这一特征与不同生境类型物种数水平分布变化趋势相吻合。两条互花米草断面间比较, 2013和2014两个年度, 生物样性指数和均匀度指数均以MCH1(云淡) > MCH2(飞鸾)(表 7)。
| 物种多样性指数 | 年度 | 光滩GTH1(云淡) | 红树林 | 互花米草 | |||||
| HSH1(云淡) | HSH2(云淡) | 平均 | MCH1(云淡) | MCH2(飞鸾) | 平均 | ||||
| 2013 | 2.344 | 2.692 | 2.402 | 2.547 | 2.415 | 2.950 | 2.683 | ||
| Richness (d) | 2014 | 2.177 | 3.237 | 3.054 | 3.146 | 2.729 | 2.628 | 2.679 | |
| 平均 | 2.261 | 2.965 | 2.728 | 2.846 | 2.572 | 2.789 | 2.681 | ||
| 2013 | 2.946 | 3.057 | 2.741 | 2.899 | 3.191 | 3.122 | 3.157 | ||
| Shannon (H') | 2014 | 3.213 | 2.469 | 3.320 | 2.895 | 2.843 | 2.416 | 2.630 | |
| 平均 | 3.080 | 2.763 | 3.031 | 2.897 | 3.017 | 2.769 | 2.893 | ||
| 2013 | 0.707 | 0.764 | 0.720 | 0.742 | 0.862 | 0.735 | 0.799 | ||
| Evenness (J) | 2014 | 0.822 | 0.532 | 0.768 | 0.650 | 0.696 | 0.591 | 0.644 | |
| 平均 | 0.765 | 0.648 | 0.744 | 0.696 | 0.779 | 0.663 | 0.721 | ||
| 2013 | 0.183 | 0.166 | 0.211 | 0.189 | 0.135 | 0.164 | 0.150 | ||
| Simpson (D) | 2014 | 0.130 | 0.332 | 0.156 | 0.244 | 0.217 | 0.280 | 0.249 | |
| 平均 | 0.157 | 0.249 | 0.184 | 0.216 | 0.176 | 0.222 | 0.199 | ||
对各断面大型底栖动物群落特征值组成进行双因素无重复方差分析, 以检验水平α=0.05下对各主要生物类群物种组成进行F检验, 2013年结果显示列上的F=423.18, P=1.97×10-12 < 0.01, 差异极显著, 2014年结果显示列上的F=94.905, P=1.26×10-8 < 0.01, 差异极显著, 这说明大型底栖动物群落特征值在不同生境差异极显著。
2.5 大型底栖动物群落结构及其稳定性 2.5.1 群落结构相似性根据等级CLUSTER聚类分析结果, 5条断面大型底栖动物群落分成3组, 群落结构组成相似的聚成一组:群落A为光滩断面; 群落B包括HSH1和HSH2两条断面, 两条断面位置相近且生境相同, 群落结构较为相似; 群落C包括MCH1(云淡)和MCH2(飞鸾)两条断面, 两条断面位置相近且生境相同, 群落结构较为相似。群落结构聚类分析结果表明, 三种生境大型底栖动物群落结构相似度与生境类型密切相关, 其中, 两条互花米草断面的大型底栖动物群落结构的相似度最高约为50, 两条红树林断面的大型底栖动物群落结构的相似度为35, 三种生境之间的相似度非常低, 群落结构差异较大(图 2)。
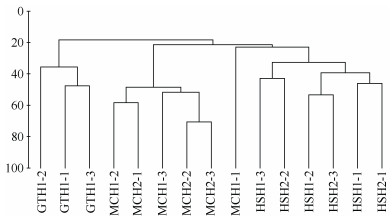 |
| 图 2 大型底栖动物年平均CLUSTER聚类分析 Fig. 2 The hierarchical cluster dendrogram of benthic communities in the Sansha Bay |
应用密度生物量比较法(ABC曲线法)对3种生境大型底栖动物群落结构进行分析, 结果表明:光滩大型底栖动物群落生物量优势度曲线始终位于丰度上方, 群落结构稳定; 2013年度红树林区大型底栖动物群落生物量优势度曲线始终位于上方, 群落结构稳定, 2014年度, 生物量优势度曲线在末端有部分重叠, 群落结构受到轻微扰动; 云淡互花米草区(MCH1)群落生物量优势度曲线始终位于丰度上方, 群落结构稳定; 飞鸾互花米草区(MCH2)群落生物量优势度曲线与密度曲线相互交叉, 群落结构不稳定, 总体而言, 互花米草区大型底栖动物群落结构不稳定(图 3)。
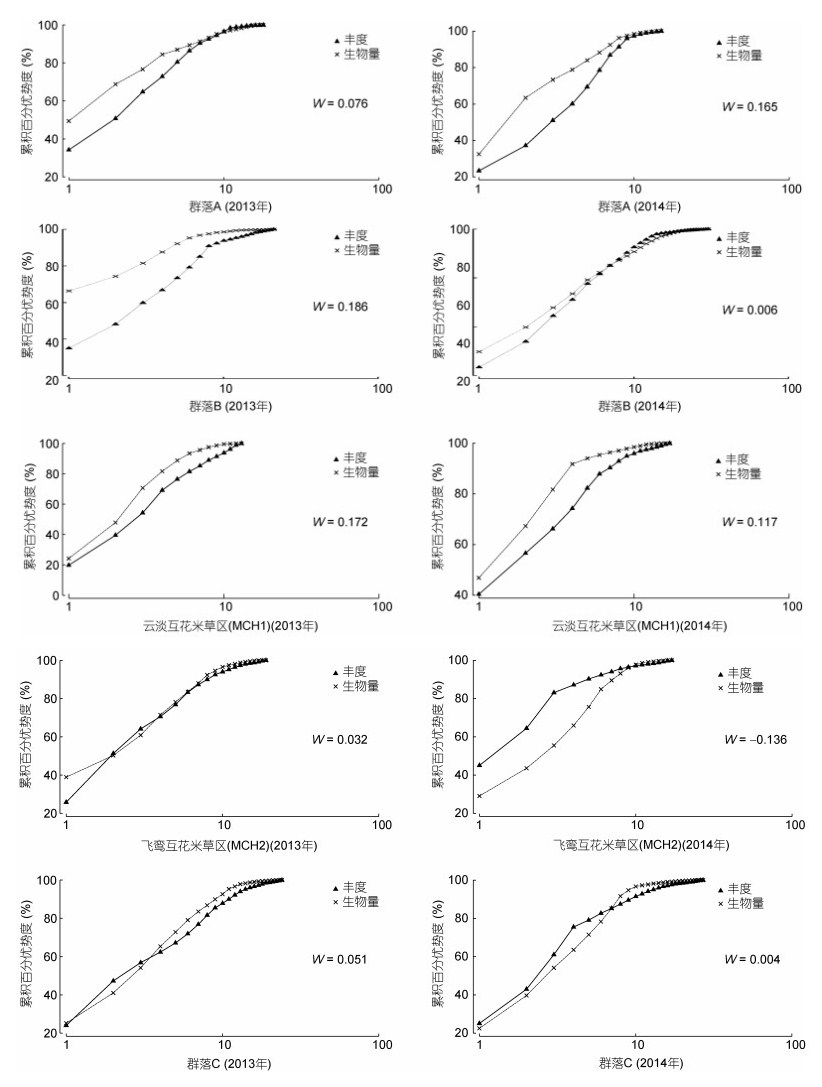 |
| 图 3 大型底栖动物群落丰度生物量复合k-优势度曲线 Fig. 3 Comparison in the abundance biomass (k-dominance curve) of the intertidal benthos |
对大型底栖动物物种数、平均栖息密度、平均生物量与对应的沉积物理化因子进行Pearson相关性分析, 结果显示, 大型底栖动物物种数、平均栖息密度与沉积物环境因子均无显著线性相关关系, 大型底栖动物平均生物量与硫化物含量的相关系数r=0.539, P=0.038 < 0.05, 表明二者间存在着显著的正相关关系, 即每个调查站位平均生物量的差异主要和沉积物中硫化物含量显著相关(表 8)。
| 生物参数 | 关系类型 | 砂含量 | 粉砂含量 | 黏土含量 | 中值粒径 | 平均粒径 | 标准偏差 | 峰态 | 有机质 | 硫化物 |
| 物种数 | Pearson相关性 | –0.415 | 0.379 | 0.372 | 0.435 | 0.411 | –0.255 | –0.332 | 0.504 | –0.030 |
| 显著性(双侧) | 0.124 | 0.164 | 0.172 | 0.105 | 0.128 | 0.358 | 0.227 | 0.055 | 0.915 | |
| 栖息密度 | Pearson相关性 | –0.142 | 0.145 | 0.096 | 0.103 | 0.140 | –0.179 | –0.323 | 0.288 | –0.311 |
| 显著性(双侧) | 0.613 | 0.605 | 0.734 | 0.716 | 0.618 | 0.522 | 0.240 | 0.297 | 0.259 | |
| 生物量 | Pearson相关性 | 0.362 | –0.474 | –0.033 | –0.254 | –0.283 | 0.420 | 0.488 | –0.099 | 0.539* |
| 显著性(双侧) | 0.185 | 0.074 | 0.906 | 0.361 | 0.306 | 0.120 | 0.065 | 0.726 | 0.038 | |
| N | 15 | 15 | 15 | 15 | 15 | 15 | 15 | 15 | 15 | |
| 注: *表示在0.05水平(双侧)上显著相关 | ||||||||||
通过比较不同生境间大型底栖动物物种数, 红树林区(40) > 互花米草区(37) > 光滩(26), 可以推测, 互花米草入侵红树林后大型底栖动物物种数稍有下降, 但是入侵光滩后物种数有所增加, 可能是因为互花米草入侵增加了光滩的复杂性, 也可能因为互花米草的庇护, 减少了涉禽对大型底栖动物的捕食, 从而增加了大型底栖动物数量(Lana et al, 1991; Daehler et al, 1996; Engle et al, 1999; 沈永明等, 2013)。大型底栖动物物种数、平均栖息密度、平均生物量与沉积物理化因子Pearson相关性分析结果显示, 大型底栖动物物种数、平均栖息密度与沉积物理化因子的无显著线性相关关系, 大型底栖动物平均生物量与硫化物含量显著正相关, 且调查站位离岸的距离对硫化物和有机质含量影响极显著, 从而造成各断面各站位大型底栖动物生物量组成差异极显著。
应用密度生物量比较法(ABC曲线法)对3种生境大型底栖动物群落结构进行分析, 结果表明:光滩群落结构稳定; 互花米草入侵后, 大型底栖动物群落结构受到扰动变得不稳定, 一方面主要是因为互花米草发达的根系促进了根和根区的可利用性(Lana et al, 1992), 微生境的改变为底埋型无脊椎动物的生存提供了有利的生存环境(Netto et al, 1997); 另一方面, 互花米草是一种强泌盐植物, 可降低土壤盐分含量, 从而导致适宜于生活在淡咸水中的双齿围沙蚕大量繁殖, 降低了原有大型底栖动物群落结构的稳定性。
本研究结果显示, 互花米草入侵后大型底栖动物物种多样性指数都有所下降, 这可能与互花米草入侵形成较为密闭的空间环境, 其发达的根系不利于大型底栖动物的摄食行为有关, 同时研究也发现大型底栖动物群落结构发生改变, 优势物种差异显著, 这与朱晓君等(2003)和陈中义等(2005)研究结果一致, 他们通过比较互花米草盐沼与其它盐沼, 发现大型底栖动物功能群的物种丰富度和多样性较低, 种类组成存在显著差异, 同时显著改变了营养类群的结构(朱晓君等, 2003; 陈中义等, 2005)。而王安安等(2014)结果显示虽然互花米草入侵红树林湿地后, 大型底栖动物多样性没有显著差异, 但物种组成和群落结构已有明显不同。
除此之外, 还有相当多的研究认为互花米草发育阶段不同, 其群落密度不同, 它们对底栖动物群落结构和组成的影响是动态的, 在互花米草入侵初始阶段, 其群落密度较低, 这时入侵地大型底栖动物生物多样性、栖息密度和丰富度较邻近光滩有所增加(Hedge et al, 2000), 而当互花米草入侵达到繁盛阶段时, 结果相反(赵永强等, 2009)。互花米草入侵江苏滨海湿地后, 在初期会因土壤有机质提升而促进多毛类动物生长, 导致多样性相比光滩有所升高, 但入侵后期则因促淤作用导致原本更适宜光滩生存的双壳类、部分腹足纲动物消失, 动物群落多样性逐渐降低(仇乐等, 2010)。Neira等(2007)得到类似的结果, 入侵8—10年的互花互花米草内物种组成及多样性均与光滩无差异, 入侵15年的互花米草内底栖动物栖息密度和生物量虽与光滩无差异, 但物种组成已发生变化, 入侵长达30年的互花米草内, 底栖动物丰富度和多样性均比光滩显著下降(Neira et al, 2007)。温州灵昆岛和广西北海滨海湿地的研究结果均显示, 在入侵初期阶段对底栖动物群落的影响更为复杂, 物种数和生物量可能会有所升高, 但随着入侵时间的延长, 5年和20年入侵样地内, 底栖动物生物量和多样水平会呈现下降的趋势(Ge et al, 2012; 赵彩云等, 2014)。谢志发等(2008)则认为大型底栖动物群落的物种丰富度和多样性只是在互花米草盐沼发育初期处于较低的水平。随着时间的推移, 会逐步形成新的大型底栖动物群落, 其物种丰富度和多样性逐渐上升, 并可能高于原有的水平(谢志发等, 2008)。在本研究中MCH1(云淡)断面互花米草植株的高度较高, 且分布较密集, 该处土壤水分较少, 互花米草多倒伏, 且开花较早, MCH2(飞鸾)断面互花米草花期正盛之时, MCH1(云淡)该处互花米草的花蕾已枯萎, 本研究的结果与谢志发等(2008)更为接近, 互花米草入侵初期, 大型底栖动物物种多样性指数有所降低, 随着时间的推移, 物种多样性逐渐上升, 当互花米草入侵达到年内繁盛阶段时, 物种多样性数值也达到较大值。但是本研究仅反映2013和2014两个年度三沙湾互花米草入侵对大型底栖动物群落结构的影响, 要从时间尺度上较全面反映互花米草入侵对三沙湾大型底栖动物群落结构的影响, 还需要继续定点定时的长期跟踪监测。
4 结论互花米草入侵是当前中国滨海湿地面临的严重威胁之一(陈中义等, 2004; An et al, 2007; Zhang et al, 2012; 冯建祥等, 2018), 互花米草的入侵会影响原有的生态系统的生物多样性、植被演替、潮滩地貌格局、土壤沉积过程、生物化学地球循环过程中营养物质累积, 甚至改变原有生态系统的服务功能。大型底栖动物类群是湿地生态系统的重要组成部分, 且对环境变化敏感, 互花米草入侵可以改变底泥的理化性质, 这些特征的改变在一定程度上也影响着大型底栖动物群落结构, 因此大型底栖动物常常用来评价互花米草入侵的生态影响。互花米草入侵区域的原生植被状况、入侵的潮位、入侵阶段、互花米草植株生长密度差异等均会对大型底栖动物多样性、群落结构、摄食特征等造成影响。在不同时间和空间尺度上进一步深入研究三沙湾互花米草入侵对大型底栖动物群落结构的影响, 可为客观评价三沙湾互花米草的生态作用和有效防治互花米草扩散提供理论参考。
| 中文名 | 拉丁文名 | 生境 | ||
| 红树林 | 光滩 | 互花米草 | ||
| 环节动物门 | ANNELIDA | |||
| 叶须虫科 | PHYLLODOCIDAE | |||
| 长双须虫 | Eteone longa (Fabricius) | + | ||
| 多鳞虫科 | POLYNOIDAE | |||
| 渤海格鳞虫 | Gattyana pohaiensis Fauvel | + | ||
| 白毛虫科 | PILARGIIDAE | |||
| 钩毛虫 | Sigambra sp. | + | + | |
| 沙蚕科 | NEREIDAE | |||
| 溪沙蚕 | Namalycastis abiuma (Muller) | + | ||
| 日本刺沙蚕 | Neanthes japonica (Izuka) | + | ||
| 光突齿沙蚕 | Leonnates persica Wesenberg Lund | + | + | |
| 角沙蚕 | Ceratonereis sp. | + | ||
| 沙蚕 | Nereis sp. | + | + | |
| 双齿围沙蚕 | Perinereis aibuhitensis Grube | + | ||
| 齿吻沙蚕科 | NEPHTYIDAE | |||
| 圆锯齿吻沙蚕 | Dentinephtys glabra (Hartman) | + | + | + |
| 海稚虫科 | SPIONIDAE | |||
| 膜质伪才女虫 | Pseudopolydora kempi (Southern) | + | ||
| 稚齿虫 | Prionospio sp. | + | ||
| 奇异稚齿虫 | Paraprionospio pinnata (Ehlers) | + | ||
| 锥头虫科 | ORBINIIDAE | |||
| 锥虫 | Haploscoloplos sp. | + | ||
| 小头虫科 | CAPITELLIDAE | |||
| 小头虫 | Capitella capitata (Fabriceus) | + | + | |
| 异蚓虫 | Heteromastus filiformis (Claparede) | + | ||
| 巴林虫 | Barantolla sp. | + | + | + |
| 拟异蚓虫 | Parheteromastus sp. | + | ||
| 节裂虫 | Mastobranchus sp. | + | ||
| 杯尾蚓虫 | Scyphoproctus sp. | + | ||
| 双栉虫科 | AMPHARETIDAE | |||
| 米列虫 | Melinna cf. aberrans Fauvel | + | + | |
| 寡毛类 | Oligochaeta | + | + | + |
| 软体动物门 | MOLLUSCA | |||
| 绿螂科 | GLAUCONOMIDAE | |||
| 中国绿螂 | Glauconme chinensis Gray | + | ||
| 篮蛤科 | CORBULIDAE | |||
| 焦河篮蛤 | Potamocorbula ustulata (Reeve) | + | ||
| 蛏科 | PHARELLIDAE | |||
| 尖齿灯塔蛏 | Pharella acutidens (Broderip et Sowerby) | + | + | |
| 蚬科 | CORBICULIDAE | |||
| 红树蚬 | Geloina coaxans (Gmelin) | + | ||
| 滨螺科 | LITTORINIDAE | |||
| 黑口滨螺 | Littoraria (Palustorina) melanostoma Gray | + | ||
| 拟沼螺科 | ASSIMINEIDAE | |||
| 短拟沼螺 | Assiminea brevicula Pfeiffer | + | + | + |
| 汇螺科 | POTAMIDIDAE | |||
| 珠带拟蟹守螺 | Cerithidea cingulata (Gmelin) | + | ||
| 尖锥拟蟹守螺 | Cerithidea largillierti (Philippi) | + | ||
| 麂眼螺科 | RISSOIDAE | |||
| 麂眼螺 | Ceratia sp. | + | ||
| 耳螺科 | ELLOBIIDAE | |||
| 绞孔胄螺 | Cassidula plectorematoides (Mollendorff) | + | ||
| 节肢动物门 | RTHOPODA | |||
| 玻璃钩虾科 | YALIDAE | |||
| 施氏玻璃钩虾 | Hyale schmidti (Heller) | + | ||
| 大角玻璃钩虾 | Hyale grandicornis (Kroyer) | + | ||
| 蜾蠃蜚科 | COROPHIIDAE | |||
| 日本大螯蜚 | Grandidierella japonica Stephensen | + | ||
| 三角柄蜾蠃蜚 | Grandidierella tridentium Hirayama | + | + | |
| 合眼钩虾科 | OEDICEROTIDAE | |||
| 极地蚤钩虾 | Pontocrates altamarimus (Bate et Westwood) | + | ||
| 钩虾科 | GAMMARIDAE | |||
| 朝鲜马尔他钩虾 | Melita koreana Stephensen | + | ||
| 玻璃虾科 | PASIPHAEIDAE | |||
| 尖尾细螯虾 | Leptochela aculeocaudata Paulson | + | + | |
| 长臂虾科 | PALAEMONIDAE | |||
| 葛氏长臂虾 | Palaemon gravieri (Yu) | + | ||
| 锯齿长臂虾 | Palaemon serrifer (Stimpson) | + | + | |
| 鼓虾科 | ALPHEIDAE | |||
| 刺螯鼓虾 | Alpheus hoplocheles Coutiere | + | + | |
| 美人虾科 | CALLIANASSIDAE | |||
| 日本美人虾 | Callianassa japonica Ortmann | + | + | |
| 猴面蟹科 | CAMPTANDRIIDAE | |||
| 六齿猴面蟹 | Camptandrium sexdentatum Stimpson | + | + | |
| 扁平拟闭口蟹 | Paracleistostma depressum De man | + | + | |
| 沙蟹科 | OCYPODIDAE | |||
| 弧边招潮 | Uca (Deltuca) arcuata (de Haan) | + | + | + |
| 毛带蟹科 | DOTILLIDAE | |||
| 宁波泥蟹 | Ilyoplax ningpoensis Shen | + | + | |
| 锯眼泥蟹 | Ilyoplax serrata Shen | + | ||
| 相手蟹科 | SESARMINDAE | |||
| 褶痕相手蟹 | Parasesarma plicata (Latreille) | + | + | |
| 三栉拟相手蟹 | Parasesarma tripectinis Shen | + | ||
| 无齿相手蟹 | Sesarma (Holometopus) dehaani H. Milne Edwards | + | ||
| 侧足厚蟹 | Helice (Helice) latimera Parisi | + | + | |
| 弓蟹科 | VARUNIDAE | |||
| 秀丽长方蟹 | Metaplax elegans de Man | + | + | |
| 绒螯近方蟹 | Hemigrapsus penicillatus (de Haan) | + | ||
| 长方拟方额蟹 | Parapyxidognatus deianira (de Haan) | + | ||
| 刺胞动物门 | CNIDARIA | |||
| 爱氏海葵科 | EDWARDSIDAE | |||
| 爱氏海葵 | Edwardsia sp. | + | ||
| 海葵科 | ACTINIIDAE | |||
| 侧花海葵 | Anthopleura sp. | + | + | |
| 绿海葵科 | SAGARTIIDAE | |||
| 中华仙影海葵 | Cereus sinensis Veerrill | + | + | |
| 纽形动物门 | NEMERTINEA | |||
| 细首科 | CEPHALATHRICIDAE | |||
| 沙栖原细首纽虫 | Procephalathrix arenarius Gibson | + | + | + |
| 细首纽虫 | Procephalathrix sp. | + | + | |
| 纵沟科 | LINEIDAE | |||
| 脑纽虫 | Cerebratulus sp. | + | + | + |
| 纽虫 | Nemertinea und. | + | ||
| 星虫动物门 | SIPUNCULA | |||
| 革囊星虫科 | PHASCOLOSOMATIDAE | |||
| 弓形革囊星虫 | Phascolosoma arcuatum Gray | + | + | |
| 脊索动物门 | CHORDATA | |||
| 塘鳢科 | ELEOTRIDAE | |||
| 乌塘鳢鱼 | Bostrichthys sinensis (Lacépède) | + | ||
| 鰕虎鱼科 | GOBIIDAE | |||
| 触角沟鰕虎鱼 | Oxyurichthys tentacularis (Cuvier et Valenciennes) | + | ||
| 少齿叉牙鰕虎鱼 | Apocryptod glyphisodon Bleeker | + | ||
| 弹涂鱼科 | PERIOPHTHALMIDAE | |||
| 弹涂鱼 | Periophthalmus cantonensis (Osbeck) | + | ||
| 大青弹涂鱼 | Scartelaos gigas Chu et Wu | + | ||
马强, 吴巍, 汤臣栋. 2017. 崇明东滩湿地互花米草治理对鸟类及底栖动物多样性的影响. 南京林业大学学报(自然科学版), 41(1): 9-14 |
王安安, 孙雪, 蔡景波, 等. 2014. 互花米草入侵对红树林湿地潮滩大型底栖动物群落的影响. 浙江农业科学, (4): 572-577 |
仇乐, 刘金娥, 陈建琴, 等. 2010. 互花米草扩张对江苏海滨湿地大型底栖动物的影响. 海洋科学, 34(8): 50-55 |
冯建祥, 黄茜, 陈卉, 等. 2018. 互花米草入侵对盐沼和红树林滨海湿地底栖动物群落的影响. 生态学杂志, 37(3): 943-951 |
朱晓君, 陆健健. 2003. 长江口九段沙潮间带底栖动物的功能群. 动物学研究, 24(5): 355-361 |
江旷, 陈小南, 鲍毅新, 等. 2016. 互花米草入侵对大型底栖动物群落垂直结构的影响. 生态学报, 36(2): 535-544 |
许珠华. 2012. 福建沿海米草治理的建议. 海洋开发与管理, 29(9): 70-73 |
李荣冠, 王建军, 林俊辉. 2014. 福建典型滨海湿地. 北京: 科学出版社, 49
|
杨泽华, 童春富, 陆健健. 2007. 盐沼植物对大型底栖动物群落的影响. 生态学报, 27(11): 4387-4393 |
沈永明, 王艳芳, 陈寿军, 等. 2013. 互花米草盐沼湿地大型底栖动物时空分布特征. 地理研究, 32(4): 638-644 |
陈中义, 付萃长, 王海毅, 等. 2005. 互花米草入侵东滩盐沼对大型底栖无脊椎动物群落的影响. 湿地科学, 3(1): 1-7 |
陈中义, 李博, 陈家宽. 2004. 米草属植物入侵的生态后果及管理对策. 生物多样性, 12(2): 280-289 |
杜永芬, 高抒, 于子山, 等. 2012. 福建罗源湾潮间带大型底栖动物的次级生产力. 应用生态学报, 23(7): 1904-1912 |
吴辰, 蔡立哲, 陈昕韡, 等. 2013. 福建漳江口红树林和盐沼湿地大型底栖动物次级生产力研究. 厦门大学学报(自然科学版), 52(2): 259-266 |
张苗苗, 2019.苍南沿浦湾秋茄种植前、后大型底栖动物群落结构及次级生产力变化研究.舟山: 浙江海洋大学硕士学位论文, 37-38
|
周红, 张志南. 2003. 大型多元统计软件PRIMER的方法原理及其在底栖群落生态学中的应用. 青岛海洋大学学报, 33(1): 58-64 |
周在明, 杨燕明, 陈本清. 2017. 基于无人机影像的滩涂入侵种互花米草植被信息提取与覆盖度研究. 遥感技术与应用, 32(4): 714-720 |
郑守专, 2012.三沙湾滨海湿地生态系统评价.厦门: 集美大学硕士学位论文, 3
|
林航. 2014. 福建三沙湾的潮汐特征. 福建水产, 36(4): 306-314 |
赵永强, 曾江宁, 陈全震, 等. 2009. 不同互花米草(Spartina alterniflora Loisel)密度生境中大型底栖动物群落格局. 自然资源学报, 24(4): 630-639 |
赵彩云, 李俊生, 宫璐, 等. 2014. 广西北海市滨海湿地互花米草入侵对大型底栖动物的影响. 湿地科学, 12(6): 733-739 |
段博文, 2013.红树植物秋茄治理互花米草的生态效应研究.厦门: 集美大学硕士学位论文, 56-57
|
徐晓军, 王华, 由文辉, 等. 2006. 崇明东滩互花米草群落中底栖动物群落动态的初步研究. 海洋湖沼通报, (2): 89-95 |
唐以杰, 方展强, 钟燕婷, 等. 2012. 不同生态恢复阶段无瓣海桑人工林湿地中大型底栖动物群落的演替. 生态学报, 32(10): 3160-3169 |
盛强, 黄铭垚, 汤臣栋. 2014. 不同互花米草治理措施对植物与大型底栖动物的影响. 水生生物学报, 38(2): 279-290 |
黄雅琴, 李荣冠, 王建军, 等. 2010. 湄洲湾潮间带底栖生物多样性. 生物多样性, 18(2): 156-161 |
黄雅琴, 李荣冠, 江锦祥. 2011. 泉州湾洛阳江红树林自然保护区潮间带软体动物多样性及分布. 海洋科学, 35(10): 110-116 |
谢志发, 何文珊, 刘文亮, 等. 2008. 不同发育时间的互花米草盐沼对大型底栖动物群落的影响. 生态学杂志, 27(1): 63-67 |
福建省科协. 1988. 浅谈互花米草在滩涂开发中的应用:论福建海洋开发. 福州: 福建省科学技术出版社
|
Able K W, Hagan S M, 2000. Effects of common reed (Phragmites australis) invasion on marsh surface macrofauna:response of fishes and decapod crustaceans. Estuaries, 23(5): 633-646 |
An S Q, Gu B H, Zhou C F et al, 2007. Spartina invasion in China:Implications for invasive species management and future research. Weed Research, 47(3): 183-191 |
Daehler C C, Strong D R, 1996. Status, prediction and prevention of introduced cordgrass Spartina spp. invasions in pacific estuaries, USA. Biological Conservation, 78(1-2): 51-58 |
Engle V D, Summers J K, 1999. Latitudinal gradients in benthic community composition in western Atlantic estuaries. Journal of Biogeography, 26(5): 1007-1023 |
Ge B M, Bao Y X, Cheng H Y et al, 2012. Influence of Spartina alterniflora invasion stages on macrobenthic communities on a tidal flat in Wenzhou Bay, China. Brazilian Journal of Oceanography, 60(3): 441-448 |
Hedge P, Kriwoken L K, 2000. Evidence for effects of Spartina anglica invasion on benthic macrofauna in Little Swanport estuary, Tasmania. Austral Ecology, 25(2): 150-159 |
Lana P D C, Guiss C, 1991. Influence of Spartina alterniflora on structure and temporal variability of macrobenthic associations in a tidal flat of Paranaguá Bay (southeastern Brazil). Marine Ecology Progress Series, 73: 231-234 DOI:10.3354/meps073231 |
Lana P D C, Guiss C, 1992. Macrofauna-plant-biomass interactions in a euhaline salt marsh in Paranaguá Bay (SE Brazil). Marine Ecology Progress Series, 80: 57-64 DOI:10.3354/meps080057 |
Neira C, Levin L A, Grosholz E D et al, 2007. Influence of invasive Spartina growth stages on associated macrofaunal communities. Biological Invasions, 9(8): 975-993 |
Netto S A, Lana P C, 1997. Influence of Spartina alterniflora on superficial sediment characteristics of tidal flats in Paranaguá Bay (south-eastern Brazil). Estuarine, Coastal and Shelf Science, 44(5): 641-648 DOI:10.1006/ecss.1996.0154 |
Posey M H, Alphin T D, Meyer D L et al, 2003. Benthic communities of common reed Phragmites australis and marsh cordgrass Spartina alterniflora marshes in Chesapeake Bay. Marine Ecology Progress Series, 261: 51-61 DOI:10.3354/meps261051 |
Webster P J, Rowden A A, Attrill M J, 1998. Effect of shoot density on the infaunal macro-invertebrate community within a Zostera marina Seagrass bed. Estuarine, Coastal and Shelf Science, 47(3): 351-357 |
Zhang Y H, Huang G M, Wang W Q et al, 2012. Interactions between mangroves and exotic Spartina in an anthropogenically disturbed estuary in southern China. Ecology, 93(3): 588-597 |
 2020, Vol. 51
2020, Vol. 51


