中国海洋湖沼学会主办。
文章信息
- 浦舒为, 逯峰, 王佳伟, 黄勃, 王小兵, 王林桂. 2020.
- PU Shu-Wei, LU Feng, WANG Jia-Wei, HUANG Bo, WANG Xiao-Bing, WANG Lin-Gui. 2020.
- γ-氨基丁酸、氯化钾和5-羟色胺对羊鲍(Haliotis ovina)幼虫存活、附着和变态的影响
- EFFECTS OF GABA, POTASSIUM CHLORIDE, AND SEROTONIN ON LARVAL SURVIVAL, SETTLEMENT, AND METAMORPHOSIS OF ABALONE HALIOTIS OVINA
- 海洋与湖沼, 51(3): 541-546
- Oceanologia et Limnologia Sinica, 51(3): 541-546.
- http://dx.doi.org/10.11693/hyhz20191200261
文章历史
-
收稿日期:2019-12-16
收修改稿日期:2020-02-29
2. 海南省热带水生生物技术重点实验室 海口 570228;
3. 海南大学南海海洋资源利用国家重点实验室 海口 570228;
4. 海南大学热带生物资源教育部重点实验室 海口 570228
2. Key Laboratory of Tropical Hydrobiology and Biotechnology of Hainan Province, Haikou 570228, China;
3. State Key Laboratory of Marine Resource Utilization in South China Sea, Hainan University, Haikou 570228, China;
4. Key Laboratory of Tropical Biological Resources of Ministry of Education in Hainan University, Haikou 570228, China
近年来在鲍幼虫培养研究中已发现幼虫存活率和附着率偏低以及变态异常等问题(Wenresti et al, 2003; Wang et al, 2010), 而高附着率和变态率在鲍幼虫生命周期的初始阶段显得十分关键(Wenresti et al, 2003; Stott et al, 2004; Wang et al, 2010)。因此, 寻找促进附着变态的有效解决方案具有重要意义。
许多证据表明, 外部化学信号可以用来诱导浮游幼虫附着和变态(Akashige et al, 1981; Trapido-Rosenthal et al, 1986; Wenresti et al, 2003)。一些化学因子能够成功诱导鲍幼虫的附着变态, 如L-甲状腺素(T4) (Fukazawa et al, 2001)、溴甲烷(Taniguchi et al, 1994; Seki et al, 1997; Kang et al, 2004), 钾离子(Baloun et al, 1984; Kang et al, 2004), γ-氨基丁酸(Morse et al, 1979, 1980; Searcy-Bernal et al, 1998; Laimek et al, 2008)和5-羟色胺(Pawlik, 1990; Zhao et al 2003; Wang et al, 2010)。
已有大量研究证明, 化学因素在海洋生物幼虫的附着和变态过程中起着重要作用(Akashige et al, 1981; Trapido-Rosenthal et al, 1986; Wenresti et al, 2003)。国内研究人员利用γ-氨基丁酸、氯化钾等化学物质对盘鲍(柯才焕等, 2001)、皱纹盘鲍(康庆浩等, 2003)、九孔鲍(张静等, 2009)、耳鲍(Wang et al, 2010)附着和变态的诱导进行了研究。γ-氨基丁酸、氯化钾和5-羟色胺的作用已被证明是某些鲍幼虫附着和变态的有效诱导剂, 但鲍幼虫对这些因素的反应具有物种特异性(Todd et al, 1994; Keough et al, 1995; Roberts et al, 1997; Daume et al, 1999)。此外, 关于羊鲍幼虫的相关系统研究较少。本研究的目的是探讨γ-氨基丁酸、氯化钾和5-羟色胺对羊鲍存活、附着和变态的影响。
1 材料与方法 1.1 产卵及生产幼虫2014年4—8月在西沙群岛海域捕获壳长(SL)≥600mm的成熟羊鲍(Haliotis ovina)。挑出性腺成熟的个体并继续养殖在海南三亚(18°13′N, 109°28′E)的鲍文化农场。约3个月后, 将其清洗以去除真菌, 阴干2h, 然后在经过紫外线和双氧水灭菌处理的海水中, 缓慢升温诱导产卵。期间温度为(28±1)℃、盐度为33, 在玻璃缸(500L)中充满过滤海水(FSW), 以30ind./mL的密度贮存受精卵。–24h后采集受精卵发育的浮游幼虫并进行计数, 用于后续实验。
1.2 试剂配制为了防止氧化作用, 在实验开始前用过滤海水分别配置浓度为10–2、10–3、10–4、10–5、10–6、10–7mol/L的γ-氨基丁酸、氯化钾和5-羟色胺溶液。γ-氨基丁酸购自郑州瑞佳食品添加剂公司, 氯化钾购自广州化学试剂厂, 5-羟色胺购自上海谱振生物公司。
1.3 实验设计在γ-氨基丁酸、氯化钾和5-羟色胺对羊鲍幼虫存活、附着和变态影响的实验进行前, 准备有充氧功能的玻璃缸(40×30×25cm)以及规格为3×3cm的塑料板作为羊鲍的附着基质, 并在其中预先准备好藻类, 为幼虫附着做好准备。每个容器中放入300只幼虫, 分别设置γ-氨基丁酸、氯化钾及5-羟色胺浓度为10–2、10–3、10–4、10–5、10–6、10–7mol/L的实验组及空白对照组, 相同浓度设置5组平行。实验过程中, 所有水箱的水温保持在(28±1)℃, 盐度为33, 光照强度为500 lx。在实验进行24h和72h之后, 统计幼虫的存活率、附着率和变态率(Wang et al, 2010)。后期幼虫牢固附着在基质上, 并能在基质上爬行, 可视为完成附着; 幼虫面盘萎缩、纤毛脱落或出现围口壳, 即视为完成变态(Hahn, 1989; Bryan et al, 1998; Gapasin et al, 2004)。
1.4 数据分析方法采用SPSS统计软件包(SPSS Science, Chicago, Illinois)对数据进行统计分析。简而言之, 首先使用Kolmogorov-Smirnov和Shapiro-Wilk检验, 对幼虫存活率、附着率和变态率的原始数据进行正态分布检验, 并使用Levene检验对方差齐性进行检验。如果原始数据没有通过这些测试, 则执行平方根或自然对数转换。在满足正态性和同质性的条件下, 采用一维方差分析(ANOVA)和Tukey’s HSD多重比较分析各组间生存、附着和变态的相关因素。
2 结果与分析 2.1 γ-氨基丁酸的作用γ-氨基丁酸对羊鲍幼虫存活、附着和变态的影响如图 1所示。结果显示在低浓度(10–6—10–7 mol/L) γ-氨基丁酸的实验组相较于对照组存活率显著提高(P < 0.05, 图 1a)。浓度为10–7mol/L处理24h的实验组存活率(67.5%)明显高于其他组别, 浓度为10–6mol/L处理72h的实验组存活率(30.84%)高于其他组别, γ-氨基丁酸处理24h和72h也对附着率产生显著影响(P < 0.05, 图 1b)。γ-氨基丁酸浓度为10–2—10–5 mol/L时, 24h和72h的附着率均有显著提高(P < 0.05)。在γ-氨基丁酸浓度为10–4 mol/L时, 附着速率明显高于其他组别, 分别为18.26% (24h)和26.27% (72h), 与对照组相比, 10–3—10–5 mol/L的γ-氨基丁酸处理72h的变态率更高(P < 0.05, 图 1c)。γ-氨基丁酸浓度为10–4 mol/L时, 其变态率明显高于其他组别, 为22.26%。
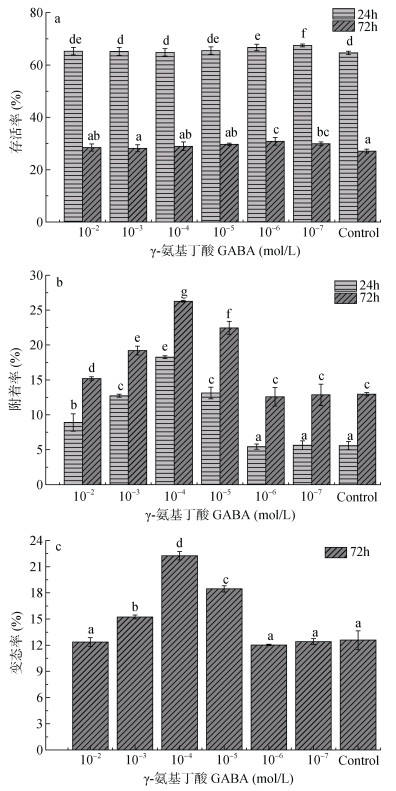 |
| 图 1 六种不同的γ-氨基丁酸浓度(10–2, 10–3, 10 –4, 10–5, 10–6和10 –7 mol/L)以及不同处理时间(24h和72h)对羊鲍幼虫存活率、附着率、变态率的影响(%) Fig. 1 Survival (%), settlement (%) and metamorphosis (%) of H. ovina larvae in response to GABA at six different concentrations (10–2, 10–3, 10–4, 10–5, 10–6, and 10–7 mol/L) in 24h and 72h 注: a.存活率; b.附着率; c.变态率。误差线表示标准偏差, 重复次数n=5。列的顶部不同字母表示显著差异(一维方差分析和图基HSD测试α=0.05): < b < c < d < e < f < g |
氯化钾对幼虫存活、附着和变态的影响如图 2所示。10–2—10–7 mol/L氯化钾浓度以及处理24h和72h的存活率无显著差异(P > 0.05)。高浓度氯化钾(10–2— 10–3mol/L)处理24h和72h, 附着率显著提高(P < 0.05)。10–3mol/L浓度下附着率明显高于其他组别, 分别为11.3% (24h)和16.4% (72h), 而10–2— 10–7mol/L氯化钾处理72h与对照组相比, 变态率无显著差异(P > 0.05)。
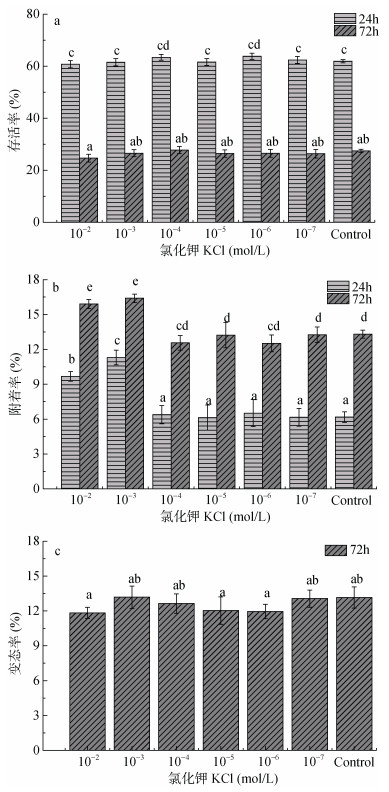 |
| 图 2 六种不同的氯化钾浓度(10–2, 10–3, 10–4, 10–5, 10–6和10–7 mol/L)以及不同处理时间(24h和72h)对羊鲍幼虫存活率、附着率、变态率的影响(%) Fig. 2 Survival (%), settlement (%), and metamorphosis (%) of H. ovina larvae in response to KCl at six different concentrations (10–2, 10–3, 10–4, 10–5, 10–6, and 10–7 mol/L) in 24h and 72h 注: a.存活率; b.附着率; c.变态率。误差线表示标准偏差; 重复次数n=5。列的顶部不同字母表示显著差异(一维方差分析和图基HSD测试α=0.05): < b < c < d < e < f < g |
5-羟色胺对幼虫存活、附着和变态的影响如图 3所示。结果表明, 5-羟色胺在高浓度时(10–2—10–3 mol/L)对幼虫的存活明显的抑制作用, 在低浓度时(10–4—10–7mol/L)对幼虫存活无明显抑制作用, 但浓度为10–5 mol/L时存活率有明显的提高, 24h时存活率为65.2% (P < 0.05)。5-羟色胺浓度为10–2—10–5mol/L时(24h)、10–4—10–6mol/L时(72h)附着率明显升高(P < 0.05)。5-羟色胺浓度为10–5 mol/L时, 附着率明显高于其他组别, 分别为16.34% (24h)和20.73% (72h)。10–4—10–5mol/L的5-羟色胺处理组变态率高于对照组, 而10–2mol/L的5-羟色胺处理组变态率明显低于对照组(P < 0.05)。5-羟色胺浓度为10–5mol/L时变态率明显高于其他组别, 为20.18%。
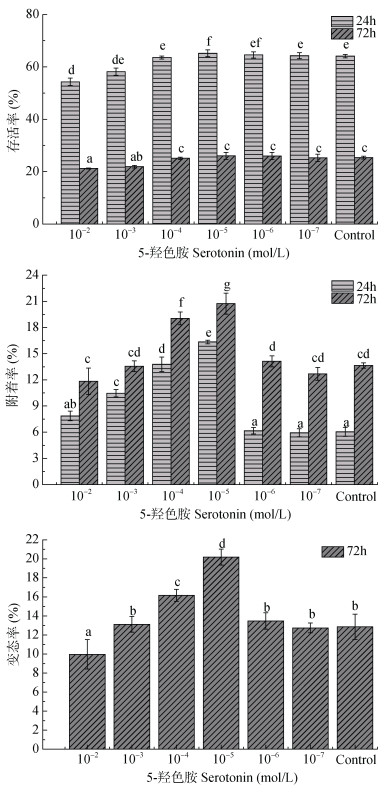 |
| 图 3 六种不同的5-羟色胺浓度(10–2, 10–3, 10–4, 10–5, 10–6和10–7 mol/L)以及不同处理时间(24h和72h)对羊鲍幼虫存活率、附着率、变态率的影响(%) Fig. 3 Survival (%), settlement (%) and metamorphosis (%) of H. ovina larvae in response to Serotonin at six different concentrations (10–2, 10–3, 10–4, 10–5, 10–6, and 10–7 mol/L) in 24h and 72h 注: a.存活率, b.附着率, c.变态率。误差线表示标准偏差; 重复次数n=5。列的顶部不同字母表示显著差异(一维方差分析和图基HSD测试α=0.05): < b < c < d < e < f < g |
相关研究证明一些化学因子在鲍幼虫附着和变态的初始阶段产生非常重要的影响(Laimek et al, 2008), 用适当的诱导剂来诱导幼虫的附着和变态, 可以增加鲍产量。化学物质通过对软体动物行为方式或生活方式的影响, 可使更多的幼虫附着到基质上。因此, 一旦幼虫探测到化学信号, 它们可能会改变其垂直分布, 并显著改变附着模式, 使幼虫集中分布在水体的底部并附着在基质板上(Gross et al, 1992; Wang et al, 2010)。因此, 通过掌握这些有促进作用化学物质的来源、化学性质以及产生方面的知识来研究附着和变态过程具有重要意义(Zimmer-Faust et al, 1994)。关于KCl和GABA对其他鲍品种如皱纹盘鲍的研究已有报道, 但由于实验方法条件的不同, 实验结果也有所差异, 可重复性较差, 无法得出统一结论。GABA的诱导效果优于KCl(赵海峰等, 2018)的结论与本研究一致。与5-羟色胺对耳鲍的诱导研究(Wang et al, 2010)相比, 可以发现5-羟色胺对羊鲍幼虫的诱导效果逊于对耳鲍幼虫的诱导效果。对羊鲍幼虫附着变态的研究较少, 相较于皱纹盘鲍, 羊鲍幼虫的附着率和变态率较低, 可能是物种差异性的缘故, 具体原因有待进一步研究。
γ-氨基丁酸是已知的可诱导商业鲍品种的幼虫附着和变态的关键物质(Searcy-Bernal et al, 1992; Laimek et al, 2008)。Morse等(1979)发现, γ-氨基丁酸可在10–6mol/L浓度可以使得98%的幼虫附着。Stott等(2004)报道, 相对高浓度的2×10–6和20×10–6的γ-氨基丁酸可能会诱导幼虫成功完成变态的能力。在本研究中, 我们发现对羊鲍来说, 与氯化钾和5-羟色胺相比, γ-氨基丁酸是最有效的诱导剂。γ-氨基丁酸10–7mol/L (24h)处理组的存活率明显高于其他组别, 10–6mol/L (72h)处理组的存活率明显高于其他组别。γ-氨基丁酸浓度为10–4mol/L时, 附着率和变态率均明显高于其他组别。本研究认为GABA的综合诱导效果优于其他两种物质。
氯化钾促进多种海洋无脊椎动物幼虫附着和变态的作用已得到确定。例如, Baloun等(1984)研究发现海水中钾离子浓度会影响红鲍(H. rufescens)的附着和变态, 钾离子浓度越高, 幼虫附着的比率就越高。在本研究中, 氯化钾作为诱导剂, 对羊鲍幼虫存活率和变态率没有显著影响。然而, 高浓度氯化钾(10–2—10–3mol/L)可使羊鲍幼虫附着率显著提高, 其中10–3mol/L浓度下诱导附着效果优于其他组别。使用氯化钾成本相较于其他两种诱导剂较低, 具有较高的性价比。在变态和附着过程中, 钾离子对不同物种的影响有所不同(Kang et al, 2004)。
5-羟色胺是一种神经递质和调节剂, 在脊椎动物和无脊椎动物的神经系统中起着重要的作用(Kuffler et al, 1984; Pawlik, 1990; Zhao et al, 2003)。现有研究表明, 5-羟色胺可以诱导泥螺(Ilyanassa obsolete) (Levantine et al, 1986)和白蝶珠母贝(Pinctada maxima) (Zhao et al, 2003)幼虫的变态发育。作者在本研究中发现5-羟色胺对羊鲍是一种有效的诱导剂, 5-羟色胺浓度为10–5mol/L时, 对羊鲍幼虫附着和变态的诱导效果优于其他组别。相较于其他两种诱导剂, 综合考虑5-羟色胺诱导效果略逊。
4 结论本研究阐明了γ-氨基丁酸、氯化钾和5-羟色胺对羊鲍幼虫有着不同的影响。γ-氨基丁酸能够提升存活率、附着率和变态率。氯化钾仅能诱导附着, 对幼虫的存活和变态无影响; 5-羟色胺能诱导附着和变态, 但对幼虫的存活无影响或有抑制作用。γ-氨基丁酸是目前研究较为深入的一种重要的抑制性神经递质, 它参与多种代谢活动, 具有很高的生理活性。γ-氨基丁酸能抑制谷氨酸的脱羧反应, 使血氨降低, 提高葡萄糖磷酸酯酶的活性, 使脑细胞活动旺盛, 可促进脑组织的新陈代谢和恢复脑细胞功能改善神经机能(Li et al, 2006)。因此, 经综合考虑, 10–4mol/L的γ-氨基丁酸效果较优, 可以作为有效诱导剂应用推广于幼虫培育过程中。
张静, 严正凛. 2009. 化学物质诱导九孔鲍幼虫变态附着的初步研究. 水产科学, 28(1): 32-35 |
赵海峰, 冯艳微, 刘相全, 等. 2018. 氯化钾和γ-氨基丁酸诱导皱纹盘鲍(Haliotis discus hannai)幼虫附着变态的研究. 海洋湖沼通报, (1): 123-128 |
柯才焕, 周时强, 田越, 等. 2001. 盘鲍幼体附着诱导的研究. 台湾海峡, 20(1): 9-14 DOI:10.3969/j.issn.1000-8160.2001.01.002 |
康庆浩, 郑家声, 金炳鹤. 2003. 诱导皱纹盘鲍浮游幼虫附着和变态的物质. 水产学报, 27(2): 131-136 |
Akashige S, Seki T, Kan-no H et al, 1981. Effects of gamma-aminobutyric acid and certain neurotransmitters on the settlement and metamorphosis of the larvae of Haliotis discus hannai Ino (Gastropoda). Bull Tohoku Fish Res Lab, 43: 37-45 |
Baloun A J, Morse D E, 1984. Ionic control of settlement and metamorphosis in larval Haliotis rufescens (Gastropoda). Biol Bull, 167(1): 124-138 DOI:10.2307/1541342 |
Bryan P J, Qian P Y, 1998. Induction of larval attachment and metamorphosis in the abalone Haliotis diversicolor (Reeve). J Exp Mar Biol Ecol, 223(1): 39-51 DOI:10.1016/S0022-0981(97)00156-1 |
Daume S, Brand-Gardner S, Woelkerling W J, 1999. Preferential settlement of abalone larvae:diatom films vs non-geniculate coralline algae. Aquaculture, 174: 243-254 DOI:10.1016/S0044-8486(99)00003-4 |
Fukazawa H, Hirai H, Hori H et al, 2001. Induction of abalone larval metamorphosis by thyroid hormones. Fish Sci, 67(5): 985-988 DOI:10.1046/j.1444-2906.2001.00351.x |
Gapasin R S J, Polohan B B, 2004. Induction of larval settlement and metamorphosis in the donkey-ear abalone, Haliotis asinina Linnaeus, by chemical cues. Hydrobiologia, 519: 9-17 DOI:10.1023/B:HYDR.0000026480.00928.5a |
Gross T F, Werner F E, Eckman J E, 1992. Numerical modeling of larval settlement in turbulent bottom boundary layers. J Mar Res, 50(4): 61l-642 |
Hahn K O, 1989. Handbook of Culture of Abalone and Other Marine Gastropods. USA: CRC Press, Inc, Boca Raton, Florida
|
Kang K H, Kim B H, Kim J M, 2004. Induction of larval settlement and metamorphosis of the abalone, Haliotis discus hannai larvae using bromomethane and potassium chloride. Aquaculture, 230(1-4): 249-259 DOI:10.1016/S0044-8486(03)00440-X |
Keough M J, Raimondi P T, 1995. Responses of settling invertebrate larvae to bioorganic films:effects of different types of films. J Exp Mar Biol Ecol, 185(2): 235-253 DOI:10.1016/0022-0981(94)00154-6 |
Kuffler S W, Nicholls K R, Martin A R, 1984. From Neuron to Brain. Sinauer, Sunderland. USA: Sinauer Associates Publishers
|
Laimek P, Clark S, Stewart M et al, 2008. The presence of GABA in gastropod mucus and its role in inducing larval settlement. J Exp Mar Biol Ecol, 354(2): 182-191 DOI:10.1016/j.jembe.2007.11.003 |
Levantine P L, Bonar D B, 1986. Metamorphosis of Ilyanassa obsoleta:natural and artificial inducers. Amer Zool, 26: 14A |
Li H F, Lin W, Zhang G et al, 2006. Enhancement of larval settlement and metamorphosis through biological and chemical cues in the abalone Haliotis diversicolor supertexta. Aquaculture, 258(1-4): 416-423 DOI:10.1016/j.aquaculture.2006.04.013 |
Morse D E, Hooker N, Duncan H et al, 1979. γ-Aminobutyric acid, a neurotransmitter, induces planktonic abalone larvae to settle and begin metamorphosis. Science, 204(4391): 407-410 DOI:10.1126/science.204.4391.407 |
Morse D E, Hooker N, Duncan H, 1980. GABA induces metamorphosis in Haliotis, V:stereochemical specificity. Brain Res Bull, 5(2): 381-387 DOI:10.1016/0361-9230(80)90061-1 |
Pawlik J R, 1990. Natural and artificial induction of metamorphosis of Phragmatopoma lapidosa californica (Polychaeta:Sabellariidae), with a critical look at the effects of bioactive compounds on marine invertebrate larvae. Bull Mar Sci, 46(2): 512-536 |
Roberts R D, Nicholson C M, 1997. Variable response from abalone larvae (Haliotis iris, H. virginea) to a range of settlement cues. Moll Res, 18(2): 131-141 DOI:10.1080/13235818.1997.10673687 |
Searcy-Bernal R, Anguiano-Beltrán C, 1998. Optimizing the concentration of gamma-aminobutyric acid (GABA) for inducing larval metamorphosis in the red abalone Haliotis rufescens (Mollusca:Gastropoda). J World Aquac Soc, 29(4): 463-470 DOI:10.1111/j.1749-7345.1998.tb00670.x |
Searcy-Bernal R, Salas-Garza A E, Flores-Aguilar R A et al, 1992. Simultaneous comparison of methods for settlement and metamorphosis induction in the red abalone (Haliotis rufescens). Aquaculture, 105(3-4): 241-250 DOI:10.1016/0044-8486(92)90090-8 |
Seki T, Taniguchi K, Kurata K, 1997. The metamorphosis inducing role of dibromomethane on the Japanese abalone, Haliotis discus hannai Ino. Monterey: Abstracts of the Third International Abalone Symposium
|
Stott A E, Takeuchi T, Koike Y, 2004. Testing various substances that have been bound to plastic plates with agar to induce larval settlement and metamorphosis of abalone Haliotis discus discus (Reeve). Aquaculture, 231(1-4): 547-557 DOI:10.1016/j.aquaculture.2003.09.004 |
Taniguchi K, Kurata K, Maruzoi T et al, 1994. Dibromomethane, a chemical inducer of larval settlement and metamorphosis of the sea urchin Strongylocentrotus nudus. Fish Sci, 60(6): 795-796 DOI:10.2331/fishsci.60.795 |
Todd C D, Keough M J, 1994. Larval settlement in hard substratum epifaunal assemblages:a manipulative field study of the effects of substratum filming and the presence of incumbents. J Exp Mar Biol Ecol, 181(2): 159-187 DOI:10.1016/0022-0981(94)90126-0 |
Trapido-Rosenthal H G, Morse D E, 1986. Regulation of receptor-mediated settlement and metamorphosis in larvae of a gastropod mollusc (Haliotis rufescens). Bull Mar Sci, 39(2): 383-392 |
Wang X B, Bai Y, Huang B, 2010. Effects of chemical cues on larval survival, settlement and metamorphosis of abalone Haliotis asinina. Chin J Oceanol Limnol, 28(6): 1261-1265 DOI:10.1007/s00343-010-9013-6 |
Wenresti G G, Shelah M A, 2003. Evaluation of mucus, Navicula, and mixed diatoms as larval settlement inducers for the tropical abalone Haliotis asinina. Aquaculture, 221: 357-364 DOI:10.1016/S0044-8486(03)00121-2 |
Zhao B, Zhang S, Qian P Y, 2003. Larval settlement of the silver-or goldlip pearl oyster Pinctada maxima (Jameson) in response to natural biofilms and chemical cues. Aquaculture, 220(1-4): 883-901 DOI:10.1016/S0044-8486(02)00567-7 |
Zimmer-Faust R K, Tamburri M N, 1994. Chemical identity and ecological implications of a waterborne, larval settlement cue. Limnol Oceanogr, 39(5): 1075-1087 DOI:10.4319/lo.1994.39.5.1075 |
 2020, Vol. 51
2020, Vol. 51


