
中国海洋湖沼学会主办。
文章信息
- 蒲思潮, 史本泽, 徐奎栋. 2020.
- PU Si-Chao, SHI Ben-Ze, XU Kui-Dong. 2020.
- 西北太平洋深海小型底栖生物群落结构与分布特点初探
- COMMUNITY STRUCTURE AND DISTRIBUTION OF MEIOFAUNA IN DEEP-SEA AREAS OF THE NORTHWESTERN PACIFIC OCEAN
- 海洋与湖沼, 51(3): 547-554
- Oceanologia et Limnologia Sinica, 51(3): 547-554.
- http://dx.doi.org/10.11693/hyhz20191200265
文章历史
-
收稿日期:2019-12-19
收修改稿日期:2020-03-02
2. 中国科学院大学 北京 100049;
3. 中国科学院海洋大科学研究中心 青岛 266071;
4. 国家海洋局北海预报中心 青岛 266061
2. University of Chinese Academy of Sciences, Beijing 100049, China;
3. Center for Ocean Mega-Science, Chinese Academy of Sciences, Qingdao 266071, China;
4. North China Sea Marine Forecasting Center of State Oceanic Administration, Qingdao 266061, China
小型底栖生物是分选时可通过0.5mm网筛, 但被0.042mm网筛蓄留的动物, 深海生态研究中采用0.031mm作为小型底栖生物的下限(Mare, 1942; Somerfield et al, 2013)。小型底栖生物是底栖环境中最为优势的生物类群, 具有很高的物种多样性和功能多样性, 包含在部分或全部生活史阶段营底栖生活的共20多个后生动物门类(Mare, 1942; Giere, 1993)。小型底栖生物是底栖生态系统中的一个独立功能单位, 具有特殊的生殖、扩散和生活史对策, 其和大型底栖生物之间具有明显的个体大小和营养级等方面的差异(Schwinghamer, 1981; Somerfield et al, 2013)。
关于太平洋深海小型底栖的生态调查从20世纪中后期开始, 大多涉及热带南太平洋地区以及太平洋中部区域(Tietjen, 1992; Brown et al, 2001), 关于西北太平洋深海的小型底栖生物研究却十分欠缺(Shirayama, 1984a, b; Shirayama et al, 1994)。近年来全球范围内的深远海调查航次数量显著增多, 但对于深海生态环境的认识还远远不够。我国关于深海小型底栖生物多样性研究明显不足, 研究仅涉及了热带太平洋多金属结核区(高爱根等, 2002; 杨俊毅等, 2005; 王小谷等, 2013; 张顺等, 2017), 北极地区白令海和楚科奇海(黄丁勇等, 2010; Lin et al, 2014)和南海北部深海区域(王家栋等, 2009; 刘晓收等, 2014)的小型底栖生物的类群组成、丰度、生物量及空间分布。总体上, 我国对于深海小型底栖生物的研究十分缺乏, 尤其是对于深海线虫的群落结构和多样性组成与分布等知之甚少, 仅Liu等(2015)报道了南海北部深海区域的线虫群落结构特点, Yu等(2018)和Shi等(2017)报道了西北太平洋深海线虫3新种。本研究基于西北太平洋深海海域的沉积物样品, 对小型底栖生物群落结构及相关的底质情况进行了分析, 并同邻近海域的历史研究进行了比较分析, 为我国深海小型底栖生物研究提供了进一步的本底资料和研究基础。
1 方法与材料 1.1 调查海域2017年2—4月, 搭乘远洋科考船“科学”号, 对西北太平洋深海海域进行了小型底栖生物采样调查(32°—36°N, 147°—157°E)。调查海域位于日本以东的深海平原, 邻近黑潮延伸体与亲潮交汇的区域(图 1)。黑潮发源于太平洋北赤道流, 其主要特点为高温、高盐、流幅窄、流速强、流量大, 黑潮在(35°N, 142°E)附近离开日本海岸向东流去, 这部分水体被称为黑潮延伸体, 其地理范围一般为(32°—38°N, 140°—180°E)(张笑等, 2013; 胡冬等, 2018)。
 |
| 图 1 西北太平洋深海小型底栖生物采样站位图 Fig. 1 Map of sampling stations for deep-sea meiofauna in the northwestern Pacific Ocean |
底栖生物样品通过0.25m2箱式采泥器采集, 从未受扰动的沉积物中, 用直径11cm的有机玻璃采样管垂直插入沉积物取样, 每个芯样按0—1cm、1—2cm、2—4cm和4—6cm共分四层(史本泽等, 2015), 分别装入采样瓶中, 加入等量的10%海水福尔马林溶液固定, 摇匀后置于室温保存, 用于小型底栖生物的分析。此外, 以同样方式取另外1个芯样, 按照每厘米分一层, 共分10层, 将各分层样品置于封口袋中, 混合均匀, 排尽封口袋中的空气, 置于-80℃冰箱中避光保存, 用于沉积物中叶绿素a、脱镁叶绿素、粒度、有机质、总有机碳及含水量的分析(史本泽等, 2015)。
固定后的小型底栖生物样品在实验室内经虎红溶液(Rose Bengal)染色, 用孔径500μm和31μm的套筛淘洗干净, 将31μm套筛上的小型底栖生物样品转入Ludox溶液, 悬浮离心, 提取其中的小型底栖生物。在解剖镜下进行小型底栖生物分选, 对小型底栖生物类群进行统计和分析(Somerfield et al, 2013)。为保证数据资料的可比性, 线虫的平均个体干重依据国内通用的经验系数0.4μg/ind., 桡足类参照1.86μg计算, 其他类群的平均个体干重依据多毛类: 14mg; 双壳类: 4.2μg; 动吻类: 2.0μg; 介形类: 26μg; 端足类: 15μg; 原足类: 15μg; 其他: 3.5μg。小型底栖生物的干湿比按1/4计算。
环境因子的测定由中国科学院海洋研究所分析测试中心完成。其中, 沉积物有机质含量的测定, 利用总有机碳分析仪Vario TOC Cube (Elementar, Germany)测定有机碳含量, 再利用有机碳含量乘以系数1.724得到有机质含量; 沉积物含水量通过烘箱中烘干前后质量的减少来计算(80℃, 48h); 沉积物叶绿素a含量和脱镁叶绿素含量采用Turner Ⅱ荧光光度计测定; 深度资料来自随船现场测定; 沉积物粒度分析采用Cilas(940L)型激光粒度仪。
1.3 数据统计与分析根据分选鉴定结果, 统计小型底栖生物主要类群组成、群落结构和生物多样性。利用SPSS软件包对小型底栖生物群落组成与与环境因子的相关性进行分析。对原始数据进行转换后, 采用PRIMER软件小型底栖生物群落组成进行Cluster聚类分析等, 划分沉积环境状况和生境特征, 对小型底栖生物群落组成和环境因子BIOENV分析, 寻找影响小型底栖生物群落结构和分布的主要环境因素, 进行RELATE检验(周红等, 2003)。采用Surfer软件制作小型底栖生物丰度与生物量分布图。
2 研究结果 2.1 沉积环境调查海区的水深范围为4080—6066m, 其中, 最东侧的4号、8号和10号站位水深最浅, 西北部的3号和5号站位水深最深, 总体上该海域水深呈现自西北到东南水深变浅的趋势(表 1, 图 1)。沉积物的平均中值粒径为8.367μm, 沉积物粒度的分布趋势为从东到西逐渐增大(表 1)。
| 站位编号 | 水深(m) | 中值粒径(μm) | 含水量(%) | 叶绿素a含量(μg/g) | 脱镁叶绿素含量(μg/g) | 有机碳含量(%) |
| 1 | 5687 | 8.39 | 61.28 | 0.056 | 0.943 | 0.528 |
| 2 | 5843 | 9.53 | 57.84 | 0.020 | 0.646 | 0.377 |
| 3 | 6005 | 8.11 | 65.41 | 0.550 | 0.846 | 0.626 |
| 4 | 5121 | 7.63 | 65.73 | 0.017 | 0.891 | 0.697 |
| 5 | 6066 | 8.00 | 57.52 | 0.029 | 0.264 | 0.403 |
| 6 | 5768 | 6.66 | 68.05 | 0.012 | 1.042 | 0.657 |
| 7 | 5984 | 8.78 | 66.91 | 0.726 | 8.100 | 1.072 |
| 8 | 5040 | 6.14 | 65.19 | 0.041 | 0.527 | 0.553 |
| 9 | 5844 | 8.58 | 55.09 | 0.017 | 0.203 | 0.397 |
| 10 | 4080 | 6.39 | 61.97 | 0.026 | 0.334 | 0.411 |
调查海区的沉积物中叶绿素a含量总体呈现西高东低的分布趋势, 平均为0.058μg/g, 其中7号站和3号站位的叶绿素a含量远高于比其他站位, 分别达到0.726μg/g和0.550μg/g, 而叶绿素a含量最低的6号站位仅为0.012μg/g。沉积物中脱镁叶绿素含量总体分布趋势上与叶绿素a相似, 平均含量为0.836μg/g, 亦以7号站最高, 达到8.100μg/g, 较其他站位高一个数量级左右。沉积物有机碳含量平均为0.498%, 其含量最高值亦位于7号站位, 远高于其他站位, 调查海域的沉积物有机质含量无明显分布趋势。
该海域邻近黑潮与亲潮交汇区域, 来自上层的初级生产力沉降构成了沉积物中主要的有机物质来源。对各站位的所有环境因子(表 1)位进行Cluster聚类分析发现(图 2), 采样站位可以分为两组, 其中7号站位与其他站位明显分开, 主要由于其具有极高的叶绿素a含量、脱镁叶绿素含量和有机质含量, 其他站位之间则相差不大。
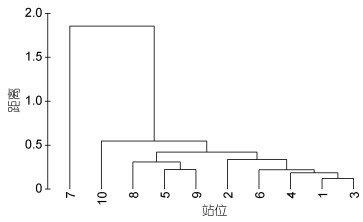 |
| 图 2 西北太平洋深海环境因子的Cluster聚类分析 Fig. 2 Cluster analysis of environmental parameters at the 10 deep-sea stations in the northwestern Pacific Ocean 注:此处的距离为多维度欧几里得空间的距离, 用以指示两个站位环境因子组合的差异大小 |
在本研究中, 共检获14个小型底栖生物主要类群(表 2), 小型底栖生物的平均丰度为150.8ind./ 10cm2。其中, 线虫是小型底栖生物中的绝对优势类群, 占小型底栖生物总丰度的93.56%(91.90%— 95.21%), 桡足类次之, 其他类群所占比例极低, 仅在个别站位有所检获。据估算, 该海域小型底栖生物的平均生物量为100.3μg dwt/10cm2, 对小型底栖生物的生物量贡献最大的分别为线虫、多毛类和桡足类(表 3)。
| 站位 | 丰度(ind./10cm2) | ||||||||||||||
| 线虫 | 桡足类 | 多毛类 | 无节 幼体 |
动吻类 | 腹毛类 | 缓步 动物 |
介形类 | 端足类 | 涡虫类 | 海螨类 | 双壳类 | 有甲类 | 其他 | 小型底栖生物 | |
| 1 | 237.8 | 8.5 | 2.4 | 1.6 | < 0.1 | < 0.1 | 1.1 | - | 0.1 | 0.2 | - | - | - | 0.8 | 252.6 |
| 2 | 233.7 | 11.6 | 1.1 | < 0.1 | 0.6 | < 0.1 | < 0.1 | 0.6 | - | - | - | - | - | 3 | 250.6 |
| 3 | 179.6 | 6.2 | 1.8 | 2.4 | 0.1 | 0.1 | 0.5 | < 0.1 | - | - | 0.1 | - | - | 0.7 | 191.4 |
| 4 | 103.2 | 3.5 | 0.9 | 1.6 | - | - | - | 0.1 | - | - | - | - | - | < 0.1 | 109.3 |
| 5 | 17.6 | 0.3 | 0.3 | 0.3 | - | - | - | - | - | - | - | - | - | 0.2 | 18.7 |
| 6 | 212 | 9.5 | 2.1 | 4.3 | 0.4 | 0.2 | 0.3 | 0.3 | - | - | - | - | - | 1.5 | 230.7 |
| 7 | 76.7 | 2.3 | 1.4 | 0.5 | 0.2 | 0.2 | < 0.1 | - | - | - | - | 0.9 | 0.1 | < 0.1 | 82.4 |
| 8 | 205.8 | 7.5 | 2.6 | 2.5 | 0.1 | 0.6 | 1.2 | 0.3 | - | - | - | - | - | 2.5 | 223.1 |
| 9 | 60.5 | 2.1 | 0.5 | 0.3 | < 0.1 | 0 | 0.5 | < 0.1 | - | - | - | 0.2 | 64.2 | ||
| 10 | 79.2 | 3.3 | 0.1 | < 0.1 | < 0.1 | 0.1 | 0.9 | 0.1 | - | - | - | - | - | 0.9 | 84.6 |
| 平均 | 140.6 | 5.5 | 1.3 | 1.4 | 0.1 | 0.1 | 0.5 | 0.1 | < 0.1 | < 0.1 | < 0.1 | 0.1 | < 0.1 | 1 | 150.8 |
| 注: -表示未检获 | |||||||||||||||
| 站位 | 生物量(μg dwt/10cm2) | ||||||||||||||
| 线虫 | 桡足类 | 多毛类 | 无节 幼体 |
动吻类 | 腹毛类 | 缓步 动物 |
介形类 | 端足类 | 涡虫类 | 海螨类 | 双壳类 | 有甲类 | 其他 | 小型底栖生物 | |
| 1 | 95.1 | 15.9 | 33.9 | 5.5 | < 0.1 | < 0.1 | 3.7 | - | 2.7 | 0.7 | - | - | - | 2.9 | 160.5 |
| 2 | 93.5 | 21.6 | 15.5 | < 0.1 | 2 | < 0.1 | < 0.1 | 15.1 | - | - | - | - | - | 10.5 | 158.2 |
| 3 | 71.8 | 11.5 | 25.8 | 8.3 | 0.4 | 0.4 | 1.8 | < 0.1 | - | - | 0.2 | - | - | 2.4 | 122.5 |
| 4 | 41.3 | 6.5 | 13.3 | 5.5 | - | - | - | 2.7 | - | - | - | - | - | < 0.1 | 69.3 |
| 5 | 7 | 0.6 | 4.4 | 1.1 | - | - | - | - | - | - | - | - | - | 0.7 | 13.9 |
| 6 | 84.8 | 17.7 | 29.5 | 15.1 | 1.5 | 0.6 | 1.1 | 8.2 | - | - | - | - | - | 5.3 | 163.8 |
| 7 | 30.7 | 4.3 | 19.2 | 1.8 | 0.7 | 0.7 | < 0.1 | - | - | - | - | 4 | 0.4 | < 0.1 | 61.8 |
| 8 | 82.3 | 13.9 | 36.8 | 8.8 | 0.2 | 2 | 4.1 | 8.2 | - | - | - | - | - | 8.8 | 165.2 |
| 9 | 24.2 | 3.9 | 7.4 | 1.1 | < 0.1 | < 0.1 | 1.8 | 0 | - | - | - | 0.7 | 39.2 | ||
| 10 | 31.7 | 6.2 | 1.5 | < 0.1 | < 0.1 | 0.2 | 3.1 | 2.7 | - | - | - | - | - | 3.3 | 48.7 |
| 平均 | 56.2 | 10.2 | 18.7 | 4.7 | 0.5 | 0.4 | 1.6 | 3.7 | 0.3 | 0.1 | < 0.1 | 0.4 | < 0.1 | 3.5 | 100.3 |
| 注: -表示未检获 | |||||||||||||||
在水平分布上(表 2), 小型底栖生物在1号和2号站丰度最高, 分别为252.6ind./10cm2和250.6ind./10cm2, 在5号站丰度最低, 仅为18.7ind./10cm2, 其次为9号站位, 其丰度为64.2ind./10 cm2。总体上, 小型底栖生物的生物量与丰度分布相一致(图 2, 3)。小型底栖生物平均生物量在6和8号站最高, 分别为165.2μg dwt/10cm2和163.8μg dwt/10cm2, 其次为1号和2号站位, 其生物量分别为160.5μg dwt/10cm2和158.2μg dwt/10cm2。而在5号站小型底栖生物的生物量最低, 仅分别为13.9μg dwt/10cm2, 其次为9号站, 其生物量为39.2μg dwt/10cm2(表 3)。在垂直分布上, 小型底栖生物随沉积物分层深度增加, 其数量逐渐减少, 在沉积物0—1cm、1—2cm、2—4cm和4—6cm各层的比例分别为38.87%、28.65%、22.50%和9.98%。线虫的垂直分布趋势与小型底栖生物一致, 在垂直各分层所占比例分别为40.1%、28.5%、24.7%和6.6%。分布在沉积物0—4cm的小型底栖生物和线虫所占比例分别达到90.02%和93.4%。
 |
| 图 3 西北太平洋深海小型底栖生物平均丰度(a)和生物量(b)分布图 Fig. 3 Distribution of the abundance (a) and biomass (b) of deep-sea meiofauna at the 10 stations in the northwestern Pacific Ocean |
对各站位小型底栖生物群落组成与丰度进行Cluster聚类分析发现(图 4), 在80%的相似性水平, 各站位的小型底栖生物群落可以分为3组, 其中5号站位明显与其他站位分开, 4号站、7号站以及9号站和10号站聚为一组, 其他站位则聚为一组。5号站仅检获5个小型底栖生物类群, 且小型底栖生物的丰度和生物量均最低。4号站、7号站以及9号站和10号站的小型底栖生物丰度略高于5号站, 但远低于其他站位(图 3)。
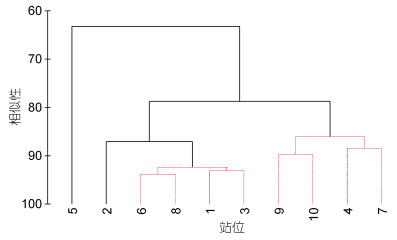 |
| 图 4 西北太平洋10个深海站位小型底栖生物的Cluster聚类分析 Fig. 4 Cluster analysis of meiofauna at 10 deep-sea stations in northwestern Pacific Ocean |
因7号站位的叶绿素a含量、脱镁叶绿素含量和有机质含量极高, 远超其余站位环境因子的平均水平, 因此本研究中去除了这一极端值。对剩余9个站位的深海小型底栖生物各类群丰度和环境因子作Pearson相关性分析。结果显示, 线虫丰度、桡足类丰度以及小型底栖生物丰度与叶绿素a含量显著正相关, 分布在沉积物表层0—2cm的线虫所占比例与沉积物粒径显著正相关(表 4)。将环境矩阵与小型底栖生物群落组成矩阵相连接, 进行BIOENV分析, 并用RELATE分析检验相关系数的显著性, 结果显示与小型底栖生物类群结构相关性最高的环境因子组合为:水深和沉积物脱镁叶绿素含量(R=0.43, P=0.022)。
| 线虫丰度 | 桡足类丰度 | 多毛类丰度 | 小型底栖生物丰度 | 0—2cm生物比例 | 线虫所占比例 | |
| 水深 | -0.267 | -0.217 | -0.167 | -0.267 | 0.233 | 0.183 |
| 中值粒径 | 0.233 | 0.017 | 0.333 | 0.233 | 0.750* | 0.067 |
| 叶绿素a含量 | 0.750* | 0.717* | 0.617 | 0.750* | -0.167 | -0.200 |
| 脱镁叶绿素含量 | 0.167 | 0.150 | 0.400 | 0.167 | -0.417 | -0.017 |
| 有机质含量 | 0.167 | 0.133 | –0.100 | 0.167 | 0.233 | 0.400 |
| 注: *表示显著相关(P < 0.05) | ||||||
深海底栖生物的食物主要依赖于上层水体的有机物质沉降, 食物通常是深海底栖生物分布的影响因子。在日本以东的西北太平洋, 黑潮延伸体与来自北部的千岛寒流混合, 后者带来了丰富的营养盐, 冷暖水混合, 促进了海洋浮游植物及浮游动物的繁盛。来自上层水体的有机物质沉降是该海域底栖生物的重要食物来源, 成为影响深海底栖生物数量分布的重要因子。本研究发现, 所研究的深海海域小型底栖生物总体上呈现沿西北至东南方向数量高, 该分布趋势与黑潮延伸体影响区域基本吻合, 而在黑潮延伸区两侧数量低(图 3)。
本研究海域水深范围为4080—6066m, 这是迄今在西北太平洋海域有关小型底栖生物的报道中水深最大的。本研究检获的14个小型底栖生物主要类群中, 线虫的平均丰度占据绝对优势(93.6%), 小型底栖生物类群组成与已有的深海研究结果大体一致。Shirayama(1984a)在本研究海域以东水深2430— 3950m的3个站位获得小型底栖的平均丰度达1135ind./10cm2; Shirayama等(1994)在日本东北部海域水深超过4130m的站位获得多大小型底栖生物平均丰度为373—488ind./10cm2(平均为475ind./10cm2)。相较于此, 本研究所获的小型底栖生物的平均丰度和生物量仅为150.8ind./10cm2和100.3μg dwt/10cm2, 明显低于上述研究结果(Shirayama, 1984a; Shirayama et al, 1994)。本研究获得的小型底栖生物平均丰度也明显低于史本泽(2016)在冲绳海槽(水深1527— 1590m)获得的研究结果, 与南海北部深海的研究结果相比亦较低(王家栋等, 2009; 刘晓收等, 2014)。这些差异可能与不同海域的水深以及底质类型有关(Shirayama et al, 1994)。
在垂直分布方面, 本研究中发现90%以上的小型底栖生物个体分布于0—4cm, 4—6cm层的小型底栖生物仅占总数的9.98%。线虫和桡足类在沉积物各层的垂直分布与小型底栖生物类似, 在4—6cm层分布较少。因而, 可以认为本研究中采用的6cm采样深度的调查结果基本可以代表这一海区的小型底栖生物。尽管如此, 该海域小型底栖生物自上而下分布的下降趋势相较平缓, 显示沉积物具有较好的通透性, 可使小型底栖生物更多地拓殖于深层沉积物中。Grove等(2006)对自西南太平洋244—1394m水深获得的小型底栖生物样品分析表明, 约95%的小型底栖生物分布在0—5cm沉积物, 在5—10cm沉积物中的小型底栖生物仅占总数的约5%。
小型底栖生物受多种环境因子的共同影响, 不同海区间水深和底质差异均会影响到小型底栖生物的群落结构, 包括沉积物有机碳含量、碳酸钙含量、光合色素量、微生物丰度和沉积物粒度等(Shirayama, 1984b; Alongi et al, 1988; Tietjen, 1992; Pfannkuche et al, 1999; Brown et al, 2001)。关于小型底栖生物群落与环境因子的关系, 不同研究中得出结论往往不一致(Shirayama, 1984b), 甚至是在同一研究中, 有时也会获得相关性不一致的结论(Grove et al, 2006)。这些不一致的结论正体现了小型底栖生物群落同环境因子之间复杂的关系。
4 结论本研究在西北太平洋深海研究海域, 共检获14个小型底栖生物主要类群, 其中, 线虫占据绝对优势(93.8%)。小型底栖生物的平均丰度和生物量分别仅为150.8 ind./10cm2和100.3μg dwt/10cm2, 低于邻近海域的研究结果。绝大多数小型底栖生物分布于沉积物的0—4cm层, 位于4—6cm层的小型底栖生物仅占总数的不到10%。小型底栖生物总体上呈现沿西北至东南方向数量高, 该分布趋势与黑潮延伸体影响区域基本吻合, 而在黑潮延伸区两侧数量低。
王小谷, 周亚东, 张东声, 等. 2013. 2005年夏季东太平洋中国多金属结核区小型底栖生物研究. 生态学报, 33(2): 492-500 |
王家栋, 类彦立, 徐奎栋, 等. 2009. 中国近海秋季小型底栖动物分布及与环境因子的关系研究. 海洋科学, 33(9): 62-70 |
史本泽, 2016.不同生境中海洋线虫分类及小型底栖生物群落结构研究.青岛: 中国科学院海洋研究所博士学位论文
|
史本泽, 于婷婷, 徐奎栋. 2015. 长江口及东海夏季小型底栖动物丰度和生物量变化. 生态学报, 35(9): 3093-3103 |
刘晓收, 许嫚, 张敬怀, 等. 2014. 南海北部深海小型底栖动物丰度和生物量. 热带海洋学报, 33(2): 52-59 DOI:10.3969/j.issn.1009-5470.2014.02.007 |
杨俊毅, 王春生, 刘镇盛, 等. 2005. 热带北太平洋深海小型底栖生物大尺度空间分布. 海洋学研究, 23(3): 23-29 DOI:10.3969/j.issn.1001-909X.2005.03.004 |
张顺, 林施泉, 孟凡旭, 等. 2017. 太平洋克拉里昂-克利伯顿断裂带嘴刺目线虫多样性. 生态学报, 37(5): 1630-1638 |
张笑, 贾英来, 沈辉, 等. 2013. 黑潮延伸体区域海洋涡旋研究进展. 气候变化研究快报, 2(1): 1-8 |
周红, 张志南. 2003. 大型多元统计软件PRIMER的方法原理及其在底栖群落生态学中的应用. 青岛海洋大学学报, 33(1): 58-64 DOI:10.3969/j.issn.1672-5174.2003.01.023 |
胡冬, 陈希, 毛科峰, 等. 2018. 黑潮延伸体邻近区域中尺度涡特征统计分析. 海洋与湖沼, 49(3): 497-511 |
高爱根, 王春生, 杨俊毅, 等. 2002. 中国多金属结核开辟区东、西两小区小型底栖动物的空间分布. 东海海洋, 20(1): 28-35 DOI:10.3969/j.issn.1001-909X.2002.01.004 |
黄丁勇, 王建佳, 林荣澄, 等. 2016. 2010年夏季白令海小型底栖动物丰度与生物量初步研究. 极地研究, 28(2): 203-210 |
Alongi D M, Pichon M, 1988. Bathyal meiobenthos of the western Coral Sea:distribution and abundance in relation to microbial standing stocks and environmental factors. Deep Sea Research Part A. Oceanographic Research Papers, 35(4): 491-503 |
Brown C J, Lambshead P J D, Smith C R et al, 2001. Phytodetritus and the abundance and biomass of abyssal nematodes in the central, equatorial Pacific. Deep Sea Research Part Ⅰ:Oceanographic Research Papers, 48(2): 555-565 |
Giere O, 1993. Meiobenthology:The Microscopic Fauna in Aquatic Sediments. Heidelberg, Berlin: Springer-Verlag
|
Grove S L, Probert P K, Berkenbusch K et al, 2006. Distribution of bathyal meiofauna in the region of the Subtropical Front, Chatham Rise, south-west Pacific. Journal of Experimental Marine Biology and Ecology, 330(1): 342-355 DOI:10.1016/j.jembe.2005.12.038 |
Lin R C, Huang D Y, Guo Y Q et al, 2014. Abundance and distribution of meiofauna in the Chukchi Sea. Acta Oceanologica Sinica, 33(6): 90-94 DOI:10.1007/s13131-014-0493-7 |
Liu X S, Xu M, Zhang J H et al, 2015. Community structure and biodiversity of free-living marine nematodes in the northern South China Sea. Acta Oceanologica Sinica, 34(6): 77-85 DOI:10.1007/s13131-014-0549-8 |
Mare M F, 1942. A study of a marine benthic community with special reference to the micro-organisms. Journal of the Marine Biological Association of the United Kingdom, 25(3): 517-554 DOI:10.1017/S0025315400055132 |
Pfannkuche O, Boetius A, Lochte K et al, 1999. Responses of deep-sea benthos to sedimentation patterns in the North-East Atlantic in 1992. Deep Sea Research Part Ⅰ:Oceanographic Research Papers, 46(4): 573-596 DOI:10.1016/S0967-0637(98)00081-8 |
Schwinghamer P, Hargrave B, Peer D et al, 1986. Partitioning of production and respiration among size groups of organisms in an intertidal benthic community. Marine Ecology Progress Series, 31(2): 131-142 |
Shi B Z, Yu T T, Xu K D, 2017. Two new species of Paramphimonhystrella (Nematoda, Monhysterida, Xyalidae) from the deep-sea sediments in the Western Pacific Ocean and adjacent shelf seafloor. Zootaxa, 4344(2): 308-320 DOI:10.11646/zootaxa.4344.2.6 |
Shirayama Y, 1984a. Vertical distribution of meiobenthos in the sediment profile in bathyal, abyssal and hadal deep-sea systems of the western Pacific. Oceanologica Acta, 7(1): 123-129 |
Shirayama Y, 1984b. The abundance of deep-sea meiobenthos in the western Pacific in relation to environmental factors. Oceanologica Acta, 7(1): 113-121 |
Shirayama Y, Kojima S, 1994. Abundance of deep-sea meiobenthos off Sanriku, Northeastern Japan. Journal of Oceanography, 50(1): 109-117 |
Somerfield P J, Warwick R M. 2013. Meiofauna techniques. In: Eleftheriou A ed. Methods for the Study of Marine Benthos. 4th ed. Oxford: John Wiley & Sons, Ltd, 252-284
|
Tietjen J H, 1992. Abundance and biomass of metazoan meiobenthos in the deep sea. In: Rowe G T, Pariente V eds. Deep-Sea Food Chains and the Global Carbon Cycle. Dordrecht: Springer, 45-62
|
Yu T T, Xu K D, 2018. Two new oxystominid species (Nematoda:Enoplida) from an abyssal plain in the southern Philippine Sea. Journal of the Marine Biological Association of the United Kingdom, 98(4): 801-810 |
 2020, Vol. 51
2020, Vol. 51


