中国海洋湖沼学会主办。
文章信息
- 周红, Saif MD UDDIN, 黄梦娇, 刘晓收, 王正茂, 尹泳桐, 姜钱钱, Rebeca MONTERO-TABOADA, Karim MD ABDUL. 2020.
- ZHOU Hong, Saif MD UDDIN, HUANG Meng-Jiao, LIU Xiao-Shou, WANG Zheng-Mao, YIN Yong-Tong, JIANG Qian-Qian, Rebeca MONTERO-TABOADA, Karim MD ABDUL. 2020.
- 南海北部陆架和陆坡区小型底栖动物群落的比较研究
- COMPARISON IN MEIOFAUNAL COMMUNITIES BETWEEN SHELF AND SLOPE OF THE NORTHERN SOUTH CHINA SEA
- 海洋与湖沼, 51(3): 555-563
- Oceanologia et Limnologia Sinica, 51(3): 555-563.
- http://dx.doi.org/10.11693/hyhz20191100228
文章历史
-
收稿日期:2019-11-25
收修改稿日期:2020-02-08
小型底栖动物是指栖息在海底沉积物底内或底表, 分选时能通过0.5mm孔径网筛, 但被0.031—0.063mm孔径网筛(深海生态研究者建议使用0.031mm作为分选下限)截留的一类底栖动物。
小型底栖动物数量巨大, 种类丰富, 分布广泛, 生命周期短, 对环境改变有快速反应的能力(陈海燕等, 2009;王彦国等, 2011), 是海洋环境质量监测中的重要指示生物。同时, 小型底栖生物是海洋底栖小食物网中的重要环节, 是鱼、虾、蟹等经济动物的重要饵料, 在海洋底栖生态系统的能流和物质循环中发挥着重要作用(杜永芬等, 2010;刘晓收等, 2014)。
南海是西太平洋最大的边缘海, 平均水深1212m, 北接中国华南大陆, 西临中南半岛, 东界和南界为一系列岛弧围绕。其北部陆架边缘水深在200m左右, 陆坡水深介于200—3000m之间(姚伯初, 1998)。我国学者已对渤海、黄海、东海的小型底栖动物做了大量的研究和报道, 但对南海的报道相对较少, 且大部分聚焦在内湾、沿岸和浅海陆架(杜永芬等, 2010;王彦国等, 2011;唐玲等, 2012; Cai et al, 2012), 对水深超过200m的陆坡区的报道更是十分有限(王家栋等, 2009;刘晓收等, 2014)。本文对南海北部海域的7个站位(4个浅海陆架站位和3个深海陆坡站位)小型底栖动物的生态学特点及其与环境因子的关系进行了分析, 并与南海已有其他研究进行比较, 旨在为南海北部海域, 特别是陆坡深海区的小型底栖动物及其沉积环境研究提供更多的数据资料。
1 材料与方法 1.1 调查海域与站位2015年6月, 搭载中国科学院南海海洋研究所“实验三号”科考船, 对位于南海北部(19.3°—21.4°N, 112.4°—115.1°E)的7个站位(站位15、17、18、24、26、28、30)进行了小型底栖动物和沉积物环境因子的调查研究。采样站位见图 1。
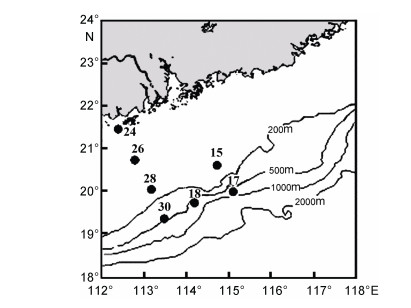 |
| 图 1 南海北部调查站位图 Fig. 1 The sampling stations in the northern South China Sea 注:站位旁边数字代表站位编号 |
沉积物粒度分析采用激光粒度仪进行测定, 依据《海洋调查规范》(中华人民共和国国家质量监督检验检疫总局, 2007a)中采用的谢帕德法对沉积物粒度进行分类命名; 有机质测定参照《海洋调查规范》和刘昌岭等(2007)改进的方法, 叶绿素a和脱镁叶绿酸测定采用湿样法(王荣, 1986; Metaxatos et al, 2002), 其他环境资料利用随船温盐深测定仪(conductivity temperature depth, CTD)现场测定。
小型底栖动物样品采集和处理均按照《海洋调查规范》(中华人民共和国国家质量监督检验检疫总局, 2007b)进行, 在每个站位利用0.16m2改进型Gray- O’Hara箱式采泥器采集沉积物, 并用内径为2.9cm的采样管, 选取未受扰动的样品, 从中采集4个长度为10cm的重复, 分别加入等体积的10%的中性福尔马林溶液后, 摇匀并保存, 用于小型底栖动物的分析, 同时取一定量的表层沉积物, -20℃冷冻避光保存, 用于环境因子的分析。
向小型底栖动物样品中加入虎红染色, 摇匀静置24h后, 用0.05mm和0.031mm孔径套筛冲洗, 转入比重为1.15的硅溶胶(Ludox-TM)中悬浮离心, 然后在解剖镜下按类群分选计数。
1.3 数据处理与统计分析在解剖镜下按个体计数法计数, 并根据取样管的内径(2.9cm), 将每个站位的小型底栖动物个体数换算为每10cm2的个体数(ind./10cm2)作为丰度, 同时计算线虫/桡足类丰度比(N/C比)。生物量的测定采用估算法, 即以各类群丰度乘以个体平均干重, 不同类群个体平均干重参照Widbom (1984)、McIntyre (1968)和Zhang等(2001)的研究结果(表 1)。
| 类群 | 个体干重 (μg) |
类群 | 个体干重 (μg) |
| 线虫Nematoda | 0.4 | 介形类Ostracoda | 14.0 |
| 桡足类Copepoda | 1.86 | 涡虫Turbellaria | 3.5 |
| 多毛类Polychaeta | 14.0 | 温步类Thermosbaenacea | 3.5 |
| 无节幼Nauplii | 0.11 | 等足类Isopoda | 15.0 |
| 腹足类Gastropoda | 4.2 | 端足类Amphipoda | 15.0 |
| 双壳类Bivalvia | 4.2 | 异足类Tanaidacea | 15.0 |
| 动吻类Kinorhyncha | 2.0 | 其他类Others | 3.5 |
| 涟虫Cumacea | 3.5 |
采用Surfer 8.0软件绘制采样站位图。利用SPSS 21软件中2组独立样本的Mann-Whitney U非参数方法对陆架和陆坡区小型底栖动物丰度和生物量等单变量进行比较和差异检验。非参数方法不要求变量满足正态分布、方差齐性等统计学假定, 适用于丰度和生物量数据的分析。利用多元统计软件PRIMER 6.0, 依据各站位小型底栖动物类群的丰度和生物量组成进行等级聚类(Cluster)和非度量多维标度(non-metric Multidimensional Scaling, MDS)排序, 分析各站位群落组成和结构的相似性, 并用相似百分比(Similarity Percentage, SIMPER)分析找出引起不同分组的主要贡献类群; 利用主成分分析(Principal Components Analysis, PCA)解析陆架和陆坡区不同的环境特征及与小型底栖动物现存量分布相关的环境因子; 利用单因素相似性分析(one-way ANOSIM)对陆架和陆坡区小型底栖动物群落结构进行差异检验; 用生物-环境分析(Biota-Environment, BIOENV)找出影响群落结构的最佳环境因子组合(Clarke et al, 2001)。
2 结果与分析 2.1 水层环境南海海底地形从周边向中央倾斜, 水深逐渐增大, 发育的大型地貌单元依此为大陆架、大陆坡和边缘海盆地。本次调查站位最浅为站位24(24m), 位于近岸的陆架区, 最深为站位17(1062m), 位于陆坡区。随水深增加, 底层水温(以下简称“底温”)呈下降趋势, 陆架区水深最浅的24站位底温最高, 为23.3℃, 陆坡区的3个站位(站位17、18和30)底温均低于9℃。底层水盐度(以下简称“底盐”)差异较小, 没有明显的变化趋势, 波动范围为34.5±0.1(表 2)。
| 陆架站位 | 陆坡站位 | |||||||||
| 24 | 26 | 15 | 28 | 平均 | 30 | 18 | 17 | 平均 | ||
| 经度(o E) | 112.4 | 112.8 | 114.7 | 113.2 | 113.6 | 114.2 | 115.1 | |||
| 纬度(o N) | 21.4 | 20.7 | 20.6 | 20.0 | 19.3 | 19.7 | 20.0 | |||
| 水深(m) | 24 | 69 | 108 | 122 | 81±44 | 485 | 627 | 1062 | 725±301 | |
| 底层水温(℃) | 23.3 | 19.6 | 19.6 | 17.6 | 20.0±2.4 | 8.6 | 6.8 | 4.6 | 6.7±2.0 | |
| 底层水盐度 | 34.4 | 34.6 | 34.6 | 34.6 | 34.6±0.1 | 34.4 | 34.4 | 34.5 | 34.5±0.0 | |
| 总有机碳含量(%) | 0.50 | 0.39 | 0.25 | 0.45 | 0.40±0.10 | 0.11 | 0.42 | 0.35 | 0.29±0.16 | |
| 叶绿素a (mg/kg) | 0.32 | 0.13 | 0.13 | 0.17 | 0.19±0.09 | 0.06 | 0.06 | 0.08 | 0.06±0.01 | |
| 脱镁叶绿酸(mg/kg) | 3.31 | 2.87 | 2.16 | 2.32 | 2.67±0.52 | 1.56 | 1.66 | 2.42 | 1.88±0.47 | |
| 粉砂-黏土(%) | 71 | 45 | 29 | 49 | 48±17 | 49 | 43 | 75 | 56±17 | |
| 分选系数(Φ) | 3.5 | 2.5 | 2.9 | 2.5 | 2.8±0.5 | 3.0 | 2.8 | 2.8 | 2.9±0.1 | |
| 中值粒径(Φ) | 6.1 | 3.8 | 1.8 | 3.9 | 3.9±1.8 | 3.9 | 3.3 | 5.4 | 4.2±1.1 | |
| 沉积物类型 | 砂-粉砂-黏土 | 粉砂质砂 | 粉砂质砂 | 粉砂质砂 | 粉砂质砂 | 粉砂质砂 | 砂质粉砂 | |||
调查的7个站位属于3种沉积物类型, 主要为粉砂质砂(站位15、18、26、28、30), 其余两种分别为砂质粉砂(站位17)和砂-粉砂-黏土(站位24)。中值粒径最大的是站位15, 为0.29mm(1.8Φ), 最小的是站位24, 为0.02mm(6.1Φ)。在陆架和陆坡区, 沉积物叶绿素a的平均含量分别为0.19mg/kg和0.06mg/kg, 脱镁叶绿酸的平均含量分别为2.67mg/kg和1.88mg/kg; 总有机碳的平均含量分别为0.40%和0.29%。在7个站位中, 水深最浅的陆架站位24(24m)的叶绿素a、脱镁叶绿酸和总有机碳的含量均为最高, 分别为0.32mg/kg、3.31mg/kg、0.50%;水深较深的陆坡站位30(485m)的叶绿素a、脱镁叶绿酸和总有机碳的含量均为最低, 分别为0.06mg/kg、1.56mg/kg、0.11%(表 2)。
2.3 PCA分析PCA分析结果表明, 两个主成分轴PC1、PC2保留的信息量占总信息量的79%, 其中PC1轴可解释环境变异度的51%, PC2轴可解释环境变异度的28%。表 3显示, 对PC1轴贡献较大的环境变量为叶绿素a、脱镁叶绿酸和底温, 且它们与小型底栖动物的丰度和生物量呈正相关关系。对PC2轴贡献较大的环境变量为粉砂-黏土含量、底盐、中值粒径和水深。
| 主成分轴PC1 | 主成分轴PC2 | |
| 总有机碳(%) | -0.24 | -0.01 |
| 叶绿素a (mg/kg) | -0.41 | 0.04 |
| 脱镁叶绿酸(mg/kg) | -0.37 | 0.01 |
| 水深(m) | 0.27 | -0.40 |
| 底层水温(℃) | -0.34 | 0.34 |
| 底层水盐度 | -0.01 | 0.46 |
| 粉砂-黏土含量(%) | -0.16 | -0.47 |
| 分选系数(Φ) | -0.24 | -0.29 |
| 中值粒径(Φ) | -0.22 | -0.44 |
| 总丰度(ind./10cm2) | -0.40 | -0.10 |
| 总生物量(μg dwt/10cm2) | -0.39 | 0.11 |
| 变异(%) | 51 | 28 |
| 注:绝对值较大的负荷系数用粗体表示 | ||
按照所测定的9个环境变量以及小型底栖动物总丰度和总生物量进行PCA排序, 可以将7个调查站位分为3组:组1包括陆架近岸站位24;组2包括陆架离岸站位15、26、28;组3包括陆坡站位17、18、30(图 2)。组1水深最浅(24m), 沉积物中值粒径最小, 叶绿素a、脱镁叶绿酸和有机碳含量最高, 小型底栖动物丰度和生物量最高; 组2水深较浅(69—122m), 叶绿素a、脱镁叶绿酸和有机碳含量较高, 小型底栖动物丰度和生物量较高; 组3水深最深(485— 1062m), 叶绿素a、脱镁叶绿酸和有机碳含量低, 小型底栖动物丰度和生物量较低。
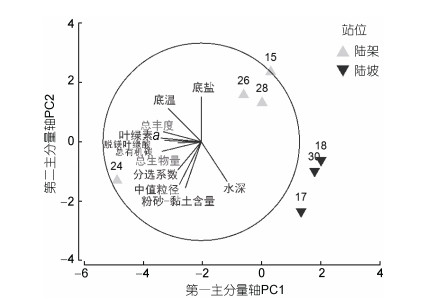 |
| 图 2 南海北部调查站位环境因子及小型底栖动物总丰度和总生物量的主成分分析 Fig. 2 PCA plot of the sampling stations in the northern South China Sea |
本次调查共鉴定出13个主要小型底栖动物类群, 包括自由生活海洋线虫(以下简称线虫)、底栖桡足类(以下简称桡足类)、多毛类、涡虫、动吻类、介形类、双壳类、腹足类、涟虫、等足类、异足类、端足类、温步类和其他未鉴定类群(表 1)。其中, 线虫在丰度上占绝对优势, 占总丰度的83%, 其次为多毛类和桡足类, 分别占总丰度的7%和3%, 其他各类群合计所占比例不足总丰度的7%(图 3)。研究海域小型底栖动物的平均丰度约为(90±108)ind./10cm2, 其中, 最高值位于水深最浅的近岸站位24, 为(329±259)ind./10cm2, 最低值出现在水深较深的陆坡站位18, 仅为(19±14)ind./10cm2。在生物量上, 多毛类生物量最大, 占总生物量的47%, 其次为线虫和桡足类, 分别占总生物量的30%和5%(图 3)。小型底栖动物的平均生物量为(120±85)μg dwt/10cm2, 最高值同样位于站位24, 为(276±164)μg dwt/10cm2, 最低值出现在陆坡站位17和18, 平均值均为36μg dwt/10cm2(表 4)。
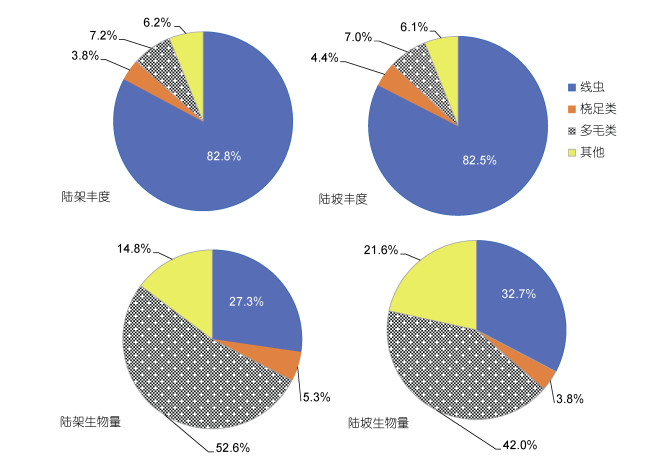 |
| 图 3 南海北部陆架和陆坡区小型底栖动物类群丰度和生物量百分比组成 Fig. 3 Percentage compositions of the abundance and biomass of meiofaunal groups in the shelf and slope stations in the northern South China Sea |
| 陆架站位 | 陆坡站位 | P值 | 显著水平 | |||||||||
| 24 | 26 | 15 | 28 | 平均 | 30 | 18 | 17 | 平均 | ||||
| 总丰度(ind./10cm2) | 329±259 | 71±43 | 89±48 | 38±31 | 132±130 | 47±19 | 19±14 | 33±28 | 33±14 | 0.007 | ** | |
| 总生物量(μg dwt/10cm2) | 276±164 | 163±163 | 149±93 | 87±80 | 169±79 | 96±52 | 36±30 | 36±28 | 56±35 | 0.010 | * | |
| 线虫丰度(ind./10cm2) | 311±248 | 52±31 | 72±39 | 32±26 | 117±130 | 37±15 | 16±14 | 30±26 | 28±11 | 0.010 | * | |
| 多毛类丰度(ind./10cm2) | 7±6 | 6±7 | 6±4 | 5±5 | 6±1 | 4±3 | 1±1 | 1±1 | 2±2 | 0.009 | ** | |
| 桡足类丰度(ind./10cm2) | 8±7 | 3±3 | 8±5 | 0±0 | 5±4 | 2±2 | 1±1 | 1±2 | 1±1 | 0.103 | ns | |
| 线虫丰度百分比(%) | 94±2 | 74±26 | 79±6 | 85±1 | 83±8 | 79±10 | 76±19 | 92±6 | 83±9 | 0.943 | ns | |
| 线虫/桡足类比 | 33±7 | 17±5 | 8±5 | 32±26 | 23±12 | 18±19 | 10±8 | 18±12 | 15±4 | 0.152 | ns | |
| 注: ns: P > 0.05; *: P < 0.05; **: P < 0.01. | ||||||||||||
采用非参数Mann-Whitney U检验对陆架和陆坡区小型底栖动物丰度、生物量、线虫丰度百分比和线虫/桡足类比等单变量进行差异检验(表 4)。结果显示, 在南海北部的陆架区, 线虫和多毛类丰度、小型底栖动物总丰度及总生物量均显著高于陆坡区(P < 0.05或P < 0.01), 而桡足类丰度、线虫丰度百分比和线虫/桡足类比没有显著差异(P > 0.05)。该结果表明小型底栖动物优势类群的组成从陆架到陆坡区没有明显改变, 这可以从图 3显示的线虫、桡足类、多毛类和其他类群丰度和生物量百分比看出来。尽管如此, 小型底栖动物的多样性伴随着丰度的下降而减少, 双壳类、动吻类、涟虫、等足类和端足类在陆坡站位没有发现, 类群总数由陆架的13个减少为8个。
2.5 小型底栖动物的群落结构分析根据各站位小型底栖动物丰度做Cluster聚类和MDS排序(图 4), 以相似性系数65%可将7个站位划分为2个组。组1主要包括陆架浅水站位15、24、26和1个陆坡站位30, 组2主要包括陆坡深水站位17、18和1个陆架站位28。在70%的相似性水平上, 组1中水深最浅的近岸站位24又与其他站位分开, 独立成组。根据小型底栖动物类群丰度矩阵的聚类分组结果(图 4)与结合了底栖环境变量和小型底栖动物丰度和生物量数据的PCA分析结果基本上一致(图 2), 即:近岸站位24与陆架其他站位分开, 而其余的站位基本按照陆架和陆坡分成2组。但在聚类分析中, 处于陆架和陆坡边缘的两个站位28(122m)和30(485m)分组发生换位, 说明小型底栖动物群落结构的聚类分析在类群的水平上难以将这两个站位清楚地分开, 这与涉及的变量数较少(13个类群对应的13个变量)导致分辨率较低有关。
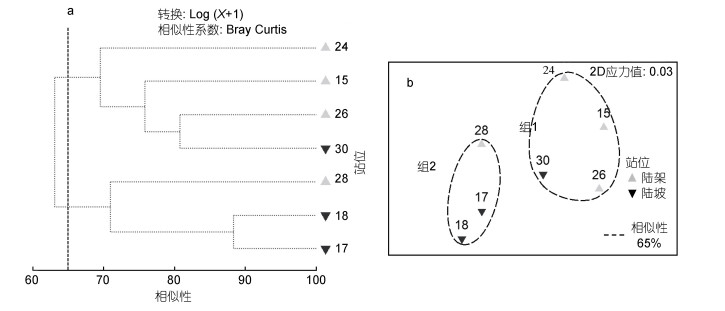 |
| 图 4 基于南海北部7个站位小型底栖动物类群丰度矩阵的聚类(a)和排序分析(b) Fig. 4 Cluster(a) and MDS(b) analysis based on abundance of meiofaunal taxa in the northern South China Sea 注: X表示各小型底栖动物类群的丰度 |
根据水深的变化, 可以将海洋环境划分为陆架浅海带(水深小于200m)和陆坡深海带(水深大于200m) (Leduc et al, 2012)。以200m为界限, 将本次调查的7个站位划分为陆架浅海组(包括站位15、24、26、28)和陆坡深海组(包括站位17、18、30), 利用one-way ANOSIM检验陆架和陆坡区小型底栖动物群落结构是否存在显著差异。结果表明, 基于小型底栖动物丰度矩阵的陆架和陆坡区群落结构差异显著(P < 0.05), 但基于生物量矩阵的群落差异不显著(表 5)。
| 丰度 | 生物量 | |
| 显著水平P | 0.035* | 0.074 |
| 统计量R | 0.116 | 0.098 |
| 注: *: P < 0.05 | ||
对小型底栖动物类群的丰度矩阵进行相似百分比(Similarity Percentage, SIMPER)分析(表 6), 找出引起陆架和陆坡组群落组成和结构差异的主要贡献类群。截取70%的累积贡献率, 结果表明, 对陆架和陆坡群落结构非相似性贡献最大的是线虫, 贡献率达24.8%, 其次是桡足类和多毛类, 贡献率分别为17.9%和17.7%, 涡虫的贡献率较小, 为7.1%。
| 类群 | 平均丰度(ind./10cm2) | 贡献率 (%) |
累积贡献率 (%) |
|
| 陆架 | 陆坡 | |||
| 线虫 | 116.6 | 28.5 | 24.8 | 24.8 |
| 桡足类 | 4.7 | 1.4 | 17.9 | 42.6 |
| 多毛类 | 6.1 | 1.9 | 17.7 | 60.3 |
| 涡虫 | 0.7 | 0.5 | 7.1 | 67.5 |
对7个站位的环境因子与其对应的生物群落(类群水平)进行BIOENV相关分析(表 7), 结果显示, 能够解释研究海域小型底栖动物群落结构的最佳环境因子组合是叶绿素a和底温, 相关系数为0.551, 其次是叶绿素a、水深和底温的组合, 相关系数为0.532。单个环境因子与生物群落结构的相关系数按由大到小的顺序是:底温 > 水深 > 叶绿素a > 中值粒径 > 分选系数, 而脱镁叶绿酸、粉砂-黏土含量、底盐及总有机碳含量的相关系数均为负数, 表明这些变量对研究海域小型底栖动物群落结构的解释度较差(Clarke et al, 2001)。
| 序号 | 变量 | 相关系数 |
| 1 | 底层水温(℃) | 0.487 |
| 2 | 水深(m) | 0.356 |
| 3 | 叶绿素a (mg/kg) | 0.231 |
| 4 | 中值粒径(Φ) | 0.100 |
| 5 | 分选系数(Φ) | 0.071 |
| 6 | 脱镁叶绿酸(mg/kg) | -0.083 |
| 7 | 粉砂-黏土含量(%) | -0.083 |
| 8 | 底层水盐度 | -0.299 |
| 9 | 总有机碳含量(%) | -0.332 |
| 环境变量最佳组合 | 底温和叶绿素a | 0.551 |
在本研究中, 随着采样站位水深的增加, 从200m以浅的陆架区到1000m左右的陆坡深海区, 小型底栖动物的丰度和生物量呈显著下降的趋势:最优势的线虫丰度减少了约75%, 多毛类减少了约70%。相应地, 小型底栖动物的总丰度减少了约75%, 而总生物量也减少了近70%。小型底栖动物的丰度和生物量随水深增加呈现下降的趋势, 可能与其食物的含量和组成随水深的变化有关, 也可能受水温条件和沉积物类型等非生物因素的影响(Soltwedel, 2000), 但食物的缺乏被看作是小型底栖生物丰度减少最重要的原因(Cai et al, 2012)。在本研究中, 综合来看, 该趋势主要受叶绿素a等因素的影响, 从陆架到陆坡区, 沉积物叶绿素a含量减少了近70%, 脱镁叶绿酸含量和总有机碳含量也有所减少, 但仅约30%。
在南海北部研究海域, 由近岸到陆架坡折, 再到深海陆坡, 随着水深和离岸距离的增加, 小型底栖动物可获得食物的量和质均发生变化:水深的增加导致底栖植物光合初级生产力下降, 叶绿素a含量减少, 意味着小型底栖动物可以利用的新鲜食物来源总体减少, 同时通过径流(如珠江口)由陆源输入的有机和无机营养物也相应减少, 食物的来源更多地依靠从上层水体沉降下来的死亡浮游植物和碎屑(这部分食物的量更多地可由脱镁叶绿酸和总有机碳的含量反映出来), 从而引起小型底栖动物现存量的下降和群落结构的变化, 这与Pfannkuche的研究结果一致。沉积物中叶绿素a含量代表了活体植物有机质的现存量, 也反映底栖初级生产力水平, 其分解产物脱镁叶绿酸可以很好地被估入海底植物腐殖质的数量(Pfannkuche, 1985), 也是底栖动物的一种重要食物来源。本研究的PCA分析表明沉积物叶绿素a和脱镁叶绿酸含量与小型底栖动物的丰度和生物量具有较高的正相关性, 而BIOEVN分析则揭示了叶绿素a对小型底栖动物群落组成和结构的影响。因此叶绿素a被认为是本研究中影响小型底栖动物丰度和生物量及群落结构的最重要的环境因子, 而水深通过影响小型底栖动物食物的量和质, 间接影响着小型底栖动物的丰度(王家栋等, 2009)。与水深增加有关的底层水温下降也会降低小型底栖动物的繁殖和发育速率, 从而引起其现存量和群落组成与结构发生改变。
海洋富营养化及有机污染在一定程度上可用线虫与桡足类的数量之比(N/C)来检测。Raffaelli(1987), Warwick(1981), Coull等(1981)通常认为N/C比值小于50的环境质量属正常, 50—100属富营养化, 而大于100则属有机污染。但N/C比主要适用于砂质潮间带的污染指示。在本研究中, 尽管7个站位的N/C比值均小于50, 但应用这一比值的目的是反映小型底栖动物群落的优势类群组成, 而非环境质量的指示。在陆架和陆坡区N/C比和线虫丰度百分比没有明显差异, 说明尽管小型底栖动物的现存量有随水深呈显著下降的趋势, 但并未伴随着优势类群组成的改变, 意味着各优势类群丰度下降的趋势是一致的。
与南海其他研究相比(表 8), 本研究小型底栖动物在丰度上的绝对优势类群为线虫, 第二大优势类群为多毛类, 这与Pavlyuk等(2006)、杜永芬等(2010)、唐玲等(2012)和刘晓收等(2014)的调查结果一致。而在渤海、黄海、东海海域, 桡足类通常为第二大优势类群。这可能与南海叶绿素a含量较其他海域偏低有关, 叶绿素a代表着底栖藻类的现存量, 而大多数底栖桡足类通常以微藻为食, 食物的限制引起底栖桡足类减少, 而以沉积食性和肉食性为主的多毛类数量增加, 从而影响小型底栖动物的群落组成和结构(杜永芬等, 2010)。
| 研究海域 | 采样时间(年.月) | 水深范围 (m) |
优势沉积物类型 | 网筛孔径 (μm) |
小型底栖动物总丰度(ind./10cm2) | 线虫丰度百分比(%) | 参考文献 |
| 南海北部 | 2015.6 | 24—1062 | 粉砂质砂 | 31 | 90±108 | 83 | 本研究 |
| 南海北部 | 2010.9 | 87—1600 | 粉砂 | 31 | 566±636 | 95 | 刘晓收等(2014) |
| 南海北部 | 2007.9—10 | 1302—1394 | 粉砂质砂和砂-黏土-粉砂 | 31 | 156±56 | 85 | 王家栋等(2009) |
| 海南岛以东沿岸 | 2007.10—11 | 20—160 | 砂质粉砂和粉砂质砂 | 42 | 901±913 | 93 | 杜永芬等(2010) |
| 北部湾 | 2008.10 | 4—35 | 粉砂 | 31 | 399±452 | 93 | 王彦国等(2011) |
| 北部湾 | 2006—2007 | 20—120 | 粉砂 | 42 | 320±79—936±430 | 85 | Cai等(2012) |
| 大亚湾 | 2009.10 | 11—17 | 黏土质粉砂 | 38 | 593±265 | 92 | 唐玲等(2012) |
| 芽庄湾(越南) | 2003.10 | 6—39 | 粗砂和细砂 | 63 | 1035±450 | 69 | Pavlyuk等(2006) |
本研究所涉及的南海北部海域, 与南海其他研究的近岸(杜永芬等, 2010)和内湾(Pavlyuk et al, 2006;王彦国等, 2011;唐玲等, 2012; Cai et al, 2012)生境类型不同, 很难进行直接比较(表 8)。与南海北部海域的其他研究相比, 本研究调查站位与王家栋等(2009)和刘晓收等(2014)具有较大程度的重叠, 但与后者的研究结果相比, 本研究小型底栖动物丰度和生物量明显偏低, 并且所呈现的随水深下降的趋势也与刘晓收等(2014)的结论相反。本研究的陆架站位15和水深最深的陆坡站位17分别与刘晓收等(2014)研究中的X1和X6在位置上最为接近, 具有较高的可比性。但是, 两次研究所揭示的小型底栖动物丰度和生物量随水深的变化趋势并不一致。从有限的具有可比性的环境数据方面, 发现可供解释这种差异的主要环境因子是两次研究的沉积物类型有很大的不同。本研究海域粉砂-黏土含量较低, 多数站位低于50%, 沉积物中值粒径较大, 多数站位的沉积物类型为粉砂质砂(其中陆坡站位30和17沉积物中含有大量有孔虫壳); 而刘晓收等(2014)所涉及的6个站位中, 5个站位沉积物类型为粉砂或黏土质粉砂, 粉砂-黏土含量均超过80%, 且其中小型底栖动物丰度最高的站位X6, 粉砂-黏土含量超过95%, 相应地沉积物有机质含量也高于本研究。Liu等(2015)对南海北部相同站位海洋线虫的种类组成和群落结构进一步研究也证实, 由于南海北部多数站位的沉积物由细颗粒的粉砂组成, 非选择沉积食性1B型在线虫群落的食性组成中比例最高。可见沉积物类型的不同, 直接影响到小型底栖动物的生存环境, 特别是其食物质和量的差异。此外, 考虑到本研究的取样时间是在夏季, 与其他大部分研究的秋季相比, 深水站位夏季温跃层的加深可能是引起本研究小型底栖动物总丰度偏低的另一个因素。
底栖生物现存量以及生物多样性随水深梯度的变化规律是生态学研究中受到高度关注的科学问题之一。南海作为我国沿岸水深最深、生物多样性最高的区域之一, 其海底的地形地貌单元依此发育为大陆架、大陆坡和边缘海盆地, 是开展底栖生物现存量和生物多样性水深梯度研究的理想海域, 针对该区域底栖生物的多样性和群落结构研究具有重要的学术意义。然而, 因底栖生物样品采集存在费时费力等诸多客观困难, 对南海陆架区和陆坡区, 特别是对边缘海盆底栖群落可供比较的相关研究较少。以上对南海北部海域两次研究结果的不一致性为未来对南海小型底栖动物及其沉积环境开展进一步研究提供了科学问题:从浅海陆架到深水陆坡区, 再到中央海盆, 小型底栖动物的现存量和多样性是否存在随水深梯度的下降趋势, 若存在是否受到食物质和量的限制?南海北部的沉积环境特别是沉积物类型存在怎样的时空异质性, 在何种程度上对小型底栖动物群落的数量、组成和结构产生影响?这些问题的回答, 需结合多时空尺度的精巧的取样设计, 并对优势类群特别是海洋线虫进行更加精细的种类组成和群落结构分析才能实现。
4 结论本研究通过对2015年6月南海北部共享航次所获得的陆架区4个站位(水深24—122m)和陆坡区3个站位(水深485—1062m)小型底栖动物在类群水平上丰度和生物量及群落组成和结构的比较, 并与沉积物和水层环境因子进行相关分析, 结果表明:
(1) 研究海域小型底栖动物及各优势类群的丰度和生物量有随水深增加呈下降的趋势, 陆坡深海区显著低于陆架浅海区; 随水深增加, 研究海域沉积物叶绿素a含量和底层水温度与小型底栖动物现存量的下降呈最大程度正相关性;
(2) 从陆架到陆坡, 伴随着小型底栖动物现存量的下降, 类群数量也明显减少, 但优势类群的百分比组成没有显著改变, 线虫始终是丰度的最优势类群, 多毛类排第二位;
(3) 研究海域陆架站位与陆坡站位相比, 小型底栖动物的群落结构(类群水平)存在显著差异, 可用来解释这种差异的最佳环境因子组合是沉积物叶绿素a含量和底层水温度;
(4) 本研究的小型底栖动物丰度和生物量低于南海北部海域的其他研究结果, 这可能与研究站位含砂量较高的沉积物类型有关。
以上结论说明, 在南海北部, 从陆架到陆坡, 水深的增加可以通过改变小型底栖动物食物的可获得性和组成以及降低底温, 从而间接影响小型底栖动物群落的数量和结构特征; 同时, 沉积物类型的不同对小型底栖动物群落的生存环境可能有着更为直接的影响。
王荣. 1986. 荧光法测定浮游植物色素计算公式的修正. 海洋科学, 10(8): 1-5 |
王彦国, 王春光, 陈小银, 等. 2011. 北部湾海域小型底栖动物丰度和生物量. 生态科学, 30(4): 375-382 DOI:10.3969/j.issn.1008-8873.2011.04.002 |
王家栋, 类彦立, 徐奎栋, 等. 2009. 中国近海秋季小型底栖动物分布及与环境因子的关系研究. 海洋科学, 33(9): 62-70 |
中华人民共和国国家质量监督检验检疫总局, 2007a. GB/T 12763.8-2007海洋调查规范第8部分: 海洋地质地球物理调查.北京: 中国标准出版社
|
中华人民共和国国家质量监督检验检疫总局, 2007b. GB/T 12763.6-2007海洋调查规范第6部分: 海洋生物调查.北京: 中国标准出版社
|
刘昌岭, 朱志刚, 贺行良, 等. 2007. 重铬酸钾氧化-硫酸亚铁滴定法快速测定海洋沉积物中有机碳. 岩矿测试, 26(3): 205-208 DOI:10.3969/j.issn.0254-5357.2007.03.008 |
刘晓收, 许嫚, 张敬怀, 等. 2014. 南海北部深海小型底栖动物丰度和生物量. 热带海洋学报, 33(2): 52-59 DOI:10.3969/j.issn.1009-5470.2014.02.007 |
杜永芬, 徐奎栋, 孟昭翠, 等. 2010. 南海小型底栖动物生态学的初步研究. 海洋与湖沼, 41(2): 199-207 |
张志南, 周红, 慕芳红. 2001. 渤海线虫群落的多样性及中性模型分析. 生态学报, 21(11): 1808-1814 DOI:10.3321/j.issn:1000-0933.2001.11.010 |
陈海燕, 周红, 慕芳红, 等. 2009. 北黄海小型底栖生物丰度和生物量时空分布特征. 中国海洋大学学报, 39(4): 657-663 |
姚伯初. 1998. 南海北部陆缘的地壳结构及构造意义. 海洋地质与第四纪地质, 18(2): 1-16 |
唐玲, 张洪波, 李恒翔, 等. 2012. 大亚湾秋季小型底栖生物初步研究. 热带海洋学报, 31(4): 104-111 |
Cai L Z, Fu S J, Yang J et al, 2012. Distribution of meiofaunal abundance in relation to environmental factors in Beibu Gulf, South China Sea. Acta Oceanologica Sinica, 31(6): 92-103 DOI:10.1007/s13131-012-0256-2 |
Clarke K R, Warwick R M, 2001. Change in marine communities: an approach to statistical analysis and interpretation. 2nd ed. Plymouth, UK: PRIMER-E
|
Coull B C, Hicks G R F, Well J B J, 1981. Nematode/copepod ratios for monitoring pollution:A rebuttal. Marine Pollution Bulletin, 12(11): 378-381 DOI:10.1016/0025-326X(81)90408-2 |
Leduc D, Rowden A A, Probert P K et al, 2012. Further evidence for the effect of particle-size diversity on deep-sea benthic biodiversity. Deep Sea Research Part Ⅰ:Oceanographic Research Papers, 63: 164-169 DOI:10.1016/j.dsr.2011.10.009 |
Liu X S, Xu M, Zhang J H et al, 2015. Community structure and biodiversity of free-living marine nematodes in the northern South China Sea. Acta Oceanologica Sinica, 34(6): 77-85 DOI:10.1007/s13131-014-0549-8 |
McIntyre A D, 1968. The meiofauna and macrofauna of some tropical beaches. Journal of Zoology, 156(3): 377-392 |
Metaxatos A, Ignatiades L, 2002. Seasonality of algal pigments in the sea water and interstitial water/sediment system of an eastern Mediterranean coastal area. Estuarine, Coastal and Shelf Science, 55(3): 415-426 DOI:10.1006/ecss.2001.0915 |
Pavlyuk O N, Trebukhova J A, 2006. Meiobenthos in Nha trang bay of the South China Sea (Vietnam). Ocean Science Journal, 41(3): 139-148 DOI:10.1007/BF03022419 |
Pfannkuche O, 1985. The deep-sea meiofauna of the Porcupine seabight and abyssal plain (NE Atlantic):population structure, distribution, standing stocks. Oceanologica Acta, 8(3): 343-353 |
Raffaelli D, 1987. The behaviour of the Nematode/Copepod ratio in organic pollution studies. Marine Environmental Research, 23(2): 135-152 DOI:10.1016/0141-1136(87)90042-0 |
Soltwedel T, 2000. Metazoan meiobenthos along continental margins:a review. Progress in Oceanography, 46(1): 59-84 DOI:10.1016/S0079-6611(00)00030-6 |
Warwick R M, 1981. The nematode/copepod ratio and its use in pollution ecology. Marine Pollution Bulletin, 12(10): 329-333 DOI:10.1016/0025-326X(81)90105-3 |
Widbom B, 1984. Determination of average ind.ividual dry weights and ash-free dry weights in different sieve fractions of marine meiofauna. Marine Biology, 84(1): 101-108 DOI:10.1007/BF00394532 |
 2020, Vol. 51
2020, Vol. 51

