中国海洋湖沼学会主办。
文章信息
- 孟昭翠, 徐奎栋. 2020.
- MENG Zhao-Cui, XU Kui-Dong. 2020.
- 长江口邻近海域夏季底栖纤毛虫的多样性与群落结构特点
- DIVERSITY AND COMMUNITY STRUCTURE OF BENTHIC CILIATES IN SEDIMENTS OF CHANGJIANG RIVER ESTUARY AND ITS ADJACENT AREAS IN SUMMER
- 海洋与湖沼, 51(3): 591-601
- Oceanologia et Limnologia Sinica, 51(3): 591-601.
- http://dx.doi.org/10.11693/hyhz20200100004
文章历史
-
收稿日期:2020-01-04
收修改稿日期:2020-03-02
2. 青岛海洋科学与技术试点国家实验室 海洋生物与生物技术功能实验室 青岛 266071;
3. 中国科学院大学 北京 100049;
4. 中国科学院海洋大科学研究中心 青岛 266071
2. Laboratory for Marine Biology and Biotechnology, Pilot National Laboratory for Marine Science and Technology(Qingdao), Qingdao 266071, China;
3. University of Chinese Academy of Sciences, Beijing 100049, China;
4. Center for Ocean Mega-Science, Chinese Academy of Sciences, Qingdao 266071, China
纤毛虫个体微小、生命周期短、代谢率高, 对环境变化响应敏感, 其作为浮游和底栖微食物网的重要成员, 可通过摄食在营养物质循环和能量流动中起重要的枢纽作用。与水体相比, 海洋底栖生态环境异质多样且具有丰富的食物来源, 使底栖纤毛虫具有较高的形态和功能多样性, 其丰度可达1000cells/mL甚至更高, 远高于浮游种类(1—100cells/mL), 在近岸海域尤其是砂质沉积物是最为重要的捕食者(徐奎栋, 2011)。沉积物中纤毛虫的种类组成、分布及数量变动等与其生存的环境密切相关, 其群落结构及多样性格局的变动会对整个微食物网及生态系统结构有影响(Hamels et al, 2004)。
底栖纤毛虫作为原生动物的重要组成部分, 由于其个体极其脆弱、需经过特殊的染色进行鉴定, 如何将其从沉积物中分离、提取并进行定量和定性分析, 一直制约着原生动物生态学的研究(类彦立等, 2007)。直到Wickham等(2000)开创性地通过硅胶液(Percoll)非线性密度梯度离心法与定量蛋白银染色(QPS)相结合, 使得底栖纤毛虫的定量提取与定性研究结合起来。但由于Percoll液价格昂贵(1500元/100mL, Sigma-Aldrich)且比重小(1.13g/mL)限制了其在生态学研究中的大量应用。Xu等(2010)提出的Ludox-QPS方法采用价格便宜(500元/L, Sigma- Aldrich)且比重大(1.30g/mL)的Ludox硅胶液作为替代品, 通过稀释淘洗处理解决Ludox不能直接提取海水沉积物样品的问题, 该方法的提出有效地拓展了海洋底栖纤毛虫的生态学研究。目前国际上有关海洋底栖纤毛虫的研究主要在潮间带、潮下带等近岸海域, 少数研究在离岸海域, 极少数研究在深海海域(Hausmann et al, 2002; Azovsky et al, 2005; Hamels et al, 2005)。国内在黄海及东海的潮间带和离岸海域有少量关于底栖纤毛虫的多样性和生态分布的报道(Du et al, 2012; Meng et al, 2012, 2018; Zhou et al, 2016; Xu et al, 2018), 分类研究的欠缺和采样不足, 造成对底栖纤毛虫的多样性和分布及其生态作用的认识不足。
长江口及邻近海域受长江径流、台湾暖流、闽浙沿岸流和黄海冷水团等的影响, 生态环境复杂, 营养物质丰富, 有害藻华高发, 同时也是季节性低氧区, 成为诸多研究的焦点(张莹莹等, 2007;王延明等, 2009)。本调查于2011年8月在长江口邻近海域进行沉积物采集, 对底栖纤毛虫的群落类群组成、多样性及分布进行研究, 并结合环境因子分析对底栖纤毛虫的现存量、多样性及分布的影响, 为探讨底栖纤毛虫的多样性分布格局提供数据支持, 并为进一步研究底栖生态系统中物质循环和能量流动提供基础。
1 材料与方法 1.1 调查海域与样品采集搭乘中国科学院海洋研究所“科学三号”考察船于2011年8月12—30日, 在长江口邻近海域(29°31'—31°59'N, 122°23'—125°30'E)进行生物调查, 成功获取9个站位的底栖生物及沉积物环境因子样品(图 1)。
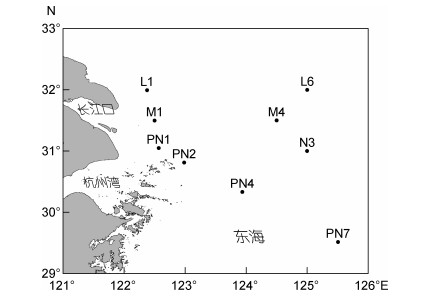 |
| 图 1 长江口邻近海域采样站位图 Fig. 1 Sampling stations in the Changjiang River estuary and adjacent sea area |
在每一站位用0.1m2改进型Gray-Ohara箱式采泥器采集3箱未受扰动的沉积物, 使用经注射器改造的采样管(内径为2.3cm)采集8cm长芯样7个(随机选取一箱采集3管, 其他两箱各采2管), 并按0—2、2—5、5—8cm进行分层。将4个芯样(含3个重复样, 1个备份样)的各分层进行瓶装, 用终浓度为2%冷戊二醛溶液固定, 4℃避光保存用于纤毛虫分析和鉴定; 另将3个芯样的相应分层合并后装入封口袋, –20℃冷冻保存用于环境因子的测定。
1.2 样品及环境因子分析方法沉积物中纤毛虫利用Ludox-QPS方法进行分析(Xu et al, 2010), 永久制片通过镜检, 依据文献对纤毛虫进行鉴定和计数(Lynn, 2008;宋微波等, 2009), 获得沉积物样品中纤毛虫的多样性和丰度信息。生物量通过生物体积换算法和相应转换系数进行计算(Putt et al, 1989)。依据有关纤毛虫食性的文献及对纤毛虫食物泡的镜检观察(Fenchel, 1968; Lynn, 2008), 将其分为四种食性:肉食性、藻食性、菌食性和杂食性。其中肉食性纤毛虫指摄食其他非光合的原生动物或小的后生动物, 藻食性纤毛虫指主要摄食底栖微型藻类尤其是硅藻。
各站位水深及底水层温度、盐度数据据随船温盐深测定仪(CTD)现场测定。沉积物粒度分析采用Cilas (940L)型激光粒度仪进行。沉积物叶绿素a和脱镁叶绿素a含量利用Turner II荧光光度计测定。利用总有机碳分析仪Vario TOC Cube (Elementar, Germany)测定沉积物有机碳含量, 有机质含量为有机碳含量乘以系数1.724 (Nelson et al, 1982)。沉积物含水量根据将其烘干(80℃, 48 h)前后质量的减少来计算。
1.3 数据统计分析数据分析采用PRIMER 6 (Plymouth Routines in Multivariate Ecological Research)。物种多样性分析包括群落的物种数、Margalef多样性指数、Shannon- Wiener多样性指数和Pielou’s均匀度指数。利用PRIMER软件中的CLUSTER分析纤毛虫群落的等级聚类; 利用BIOENV分析, 找出与底栖纤毛虫群落结构相关性最高的环境因子。采用Surfer 12.0绘制站位图及底栖纤毛虫丰度、生物量和多样性的分布图。采用SPSS 19.0统计软件对纤毛虫丰度、生物量、多样性指数与环境因子进行相关分析。为使数据正态分布, 原始数据经过log(x+1)转化处理。
2 结果 2.1 环境因子2011年8月研究海域各调查站位的水深为13—100m, 随着离岸距离增大, 水深逐渐加深。底层水温度为19.0—24.4℃ (22.1℃±1.5℃), 随离岸距离增加而降低。底层水盐度差异较大(19.3—34.5), 在调查海域呈现与水深相似的变化趋势, 长江口海域南部站位的盐度较高, 北部站位盐度较低。沉积物类型从极细粉砂到细砂, 中值粒径为7—168μm。沉积物中有机质含量平均为0.51%±0.24%, 最高值出现于PN1站(1.04%), 最低值出现于L6站(0.20%)。表层8cm沉积物中叶绿素a平均含量为(0.46± 0.25)μg/g, 脱镁叶绿素a平均含量为(1.93±0.89)μg/g, 两者的最高值均出现于PN1站, 最低值均见于PN4站(表 1)。
| 站位 | 水深(m) | 底温(℃) | 底盐 | 中值粒径(μm) | 叶绿素a (μg/g) | 脱镁叶绿素a (μg/g) | 有机质(%) |
| L1 | 18 | 24.4 | 30.1 | 34 | 0.68 | 1.54 | 0.54 |
| L6 | 45 | 21.5 | 33.1 | 168 | 0.25 | 1.52 | 0.20 |
| M1 | 25 | 22.4 | 31.9 | 28 | 0.35 | 2.04 | 0.39 |
| M4 | 43 | 23.9 | 33.7 | 26 | 0.33 | 1.92 | 0.37 |
| N3 | 53 | 23.2 | 34.0 | 34 | 0.34 | 1.37 | 0.54 |
| PN1 | 13 | 22.9 | 19.3 | 7 | 0.90 | 4.04 | 1.04 |
| PN2 | 42 | 21.0 | 32.6 | 46 | 0.71 | 2.29 | 0.51 |
| PN4 | 50 | 20.8 | 34.3 | 143 | 0.13 | 0.88 | 0.32 |
| PN7 | 100 | 19.0 | 34.5 | 55 | 0.45 | 1.82 | 0.66 |
调查海域各站位间底栖纤毛虫的平均丰度为(2787±1491)cells/10cm2 [相当于(35±19)cells/cm3], 生物量为(9.07±5.98)μg C/10cm2 [(0.12±0.07)μg C/cm3], 长江口海域北部站位的丰度和生物量呈从近岸向外海增加, 南部的站位呈现相反的分布趋势, 且南部站位的丰度和生物量高于北部站位。最大值均出现于PN2站(6316cells/10cm2, 24.15μg C/10cm2), 丰度最小值见于L1站(828cells/10cm2), 生物量最小值见于N3站(4.62μg C/10cm2, 图 1, 2)。
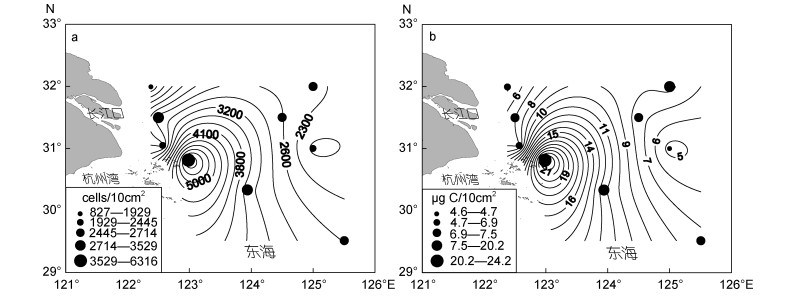 |
| 图 2 长江口邻近海域底栖纤毛虫丰度(a)和生物量(b)分布图 Fig. 2 The ciliate abundance (a) and biomass (b) in the upper 8cm sediments of the nine stations in the study area |
调查海域各站位间底栖纤毛虫的丰度和生物量随沉积物深度增加而减少, 数量上约有62%分布在表层0—2cm (1739cells/10cm2, 6.02μg C/10cm2), 26%分布在2—5cm (770cells/10cm2, 1.46μg C/10cm2), 12%分布在5—8 cm分层(278cells/10cm2, 0.86μg C/10cm2)。
2.3 底栖纤毛虫物种多样性与食性在调查海域各站位表层8cm沉积物样品中, 共检获纤毛虫106种, 隶属于15纲/亚纲, 24目, 69属, 其中96种鉴定到属/种, 优势物种(其丰度占纤毛虫总丰度的1%以上)的列表见表 2。侧口目(14种, 13.2%)、前管目(13种, 12.3%)、异毛目和游仆目(均9种, 8.5%)、合膜目、尾柱目、刺钩目、原口目(均为6种, 5.7%)的物种数较多(图 3), 为该海域沉积物中纤毛虫的主要类群, 占据总物种数的65.1%。就纲/亚纲级别来看, 钩刺亚纲种类数最多(20种, 18.9%), 其次是前口纲(17种, 16.0%)、篮口纲(12种, 11.3%), 腹毛亚纲、游仆亚纲、异毛纲及核残迹纲均有9种。前口纲在丰度及生物量上均为最优势类群(丰度占45.5%, 生物量占56.4%), 其次是核残迹纲, 丰度仅占4.1%, 但由于个体较大, 生物量占总量的19.3%, 再次是篮口纲(丰度占15.7%, 生物量占7.0%) (图 4)。
| 物种 | 食性 | 物种 | 食性 | |
| 核残疾纲Karyorelictea | Loxophyllum sinicum | 肉食性 | ||
| Cryptopharynx setigerus | 杂食性 | Phialina salinarum | 肉食性 | |
| Geleia sp. | 杂食性 | Loxophyllum qiuianum | 肉食性 | |
| Prototrachelocerca sp. | 肉食性 | 管口亚纲Cyrtophoria | ||
| Trachelocerca sagitta | 肉食性 | Atopochilodon distichum | 藻食性 | |
| Trachelocerca sp. | 肉食性 | Chlamydonellopsis sp. | 藻食性 | |
| 异毛纲Heterotrichea | 篮口纲Nassophorea | |||
| Anigsteinia longissima | 杂食性 | Discotricha papillifera | 藻食性 | |
| Blepharisma tardum | 菌食性 | Eucamptocerca longa | 藻食性 | |
| Condylostoma minutum | 藻食性 | Leptopharynx torpens | 藻食性 | |
| Peritromus faurei | 藻食性 | Zosterodasys undescribed | 藻食性 | |
| 原克鲁亚纲Protocruziidia | 前口纲Prostomatea | |||
| Protocruzia adherens | 杂食性 | Holophrya sp.1 | 肉食性 | |
| 游仆亚纲Euplotia | Holophrya sp.2 | 肉食性 | ||
| Aspidisca aculeata | 菌食性 | Holophrya sp.3 | 肉食性 | |
| Aspidisca fusca | 菌食性 | Holophrya sp.4 | 肉食性 | |
| Aspidisca steini | 菌食性 | Holophrya sp.5 | 肉食性 | |
| Euplotes minuta | 菌食性 | Holophrya sp.6 | 肉食性 | |
| Euplotes sp. | 菌食性 | Metacystis elongata | 菌食性 | |
| 腹毛亚纲Hypotrichia | Metacystis truncata | 菌食性 | ||
| Periholosticha sp. | 菌食性 | Metacystis daphnicola | 菌食性 | |
| Strongylidium crassum | 肉食性 | Prostomatea g. sp. | 肉食性 | |
| Oxytricha sp. | 杂食性 | 斜毛纲Plagiopylea | ||
| 舞毛亚纲Choreotrichia | Sonderia undescribed | 杂食性 | ||
| Strombidinopsis sp. | 藻食性 | 盾纤亚纲Scuticociliatia | ||
| 瓶纤纲Armophorea | Cyclidium glaucoma | 菌食性 | ||
| Metopus contortus | 菌食性 | Pleuronema coronema | 杂食性 | |
| 钩刺亚纲Haptoria | Pleuronema sp. | 菌食性 | ||
| Acineria undescribed | 肉食性 | Paratetrahymena wassi | 菌食性 | |
| Acineria sp. | 肉食性 | Uronema marina | 菌食性 | |
| Amphileptus sikorai | 肉食性 | 膜口亚纲Hymenostomatia | ||
| Lacrymaria kahli | 肉食性 | Hymenostomatia g. sp. | 肉食性 |
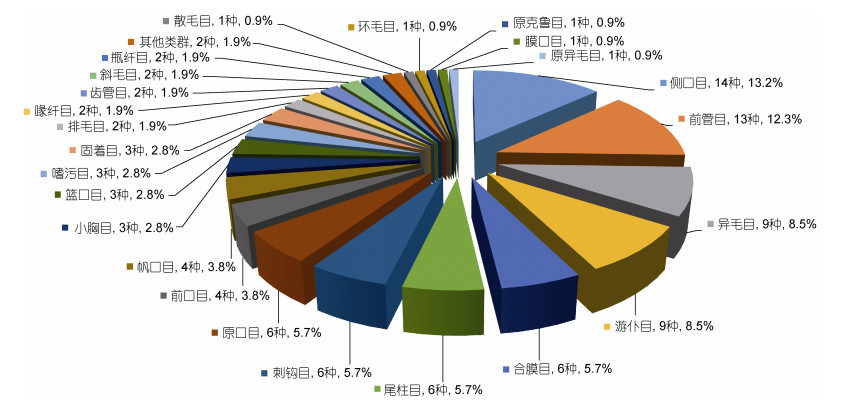 |
| 图 3 长江口邻近海域底栖纤毛虫的物种多样性分布图 Fig. 3 Species diversity distribution of benthic ciliates in nine stations of the study areas |
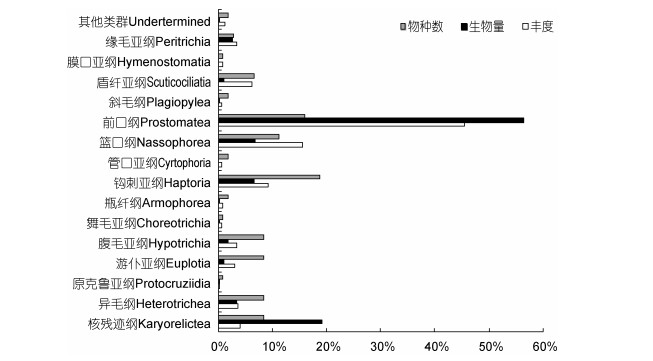 |
| 图 4 长江口邻近海域底栖纤毛虫主要类群的丰度、生物量及物种数百分比 Fig. 4 Proportions of main benthic ciliate assemblages in abundance, biomass, and species number in the nine stations in the Changjiang River estuary and the adjacent sea areas |
依据对纤毛虫食物泡的镜检观察及相关文献, 本研究中发现肉食性纤毛虫44种, 菌食性33种, 藻食性18种, 杂食性11种。肉食性纤毛虫主要包括前口纲的裸口虫属(Holophrya)、钩刺亚纲的长吻虫属(Lacrymaria)及斜叶虫属(Loxophyllum)的种类, 在表层8cm沉积物中其丰度占总丰度的40.3%, 由于此类纤毛虫个体较大其生物量占总生物量的66.8% (图 5a), 丰度所占比例最高出现于PN1站(61%), 而生物量所占比例最高出现于L6站(86%) (图 5b)。菌食性纤毛虫的主要包括楯纤虫属(Aspidisca)、游仆虫属(Euplotes)、全列虫属(Holosticha)、中圆虫属(Metacystis)及盾纤亚纲的类群, 其丰度占40.0%, 生物量占21.8% (图 5a); 菌食性纤毛虫的丰度和生物量在M1站所占比例均为最大(72%和67%) (图 5b)。藻食性纤毛虫主要类群为乳突盘毛虫(Discotricha papillifera)和佛瑞环须虫(Peritromus faurei), 其丰度占17.1%, 生物量占8.0%;表层8cm沉积物中藻食性纤毛虫丰度所占比例最高出现于PN4站(30%), 而生物量所占比例最高出现于M4站(15%) (图 5b)。其他无选择性的杂食性纤毛虫丰度仅占2.6%, 生物量占3.4%。就各站位来看, 除M1站, 肉食性纤毛虫在表层8 cm沉积物中生物量上均为最优势类群(图 5b)。就沉积物各分层来看, 肉食性纤毛虫生物量所占比例在各分层中均最大, 其丰度所占比在表层0—2cm中也最大; 随着沉积物深度的增加, 菌食性纤毛虫丰度和生物量所占比例增加, 且在2—5cm及5—8cm沉积物中, 其丰度所占比例最大(图 5c, 5d)。
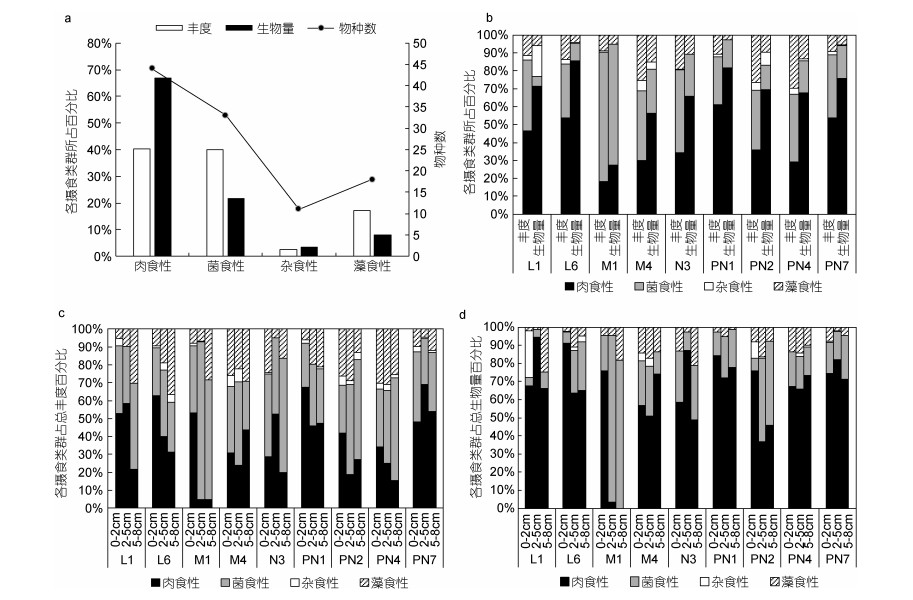 |
| 图 5 长江口邻近海域底栖纤毛虫各摄食类群的丰度和生物量百分比 Fig. 5 Proportion of the four trophic types of ciliates in abundance and biomass at the nine stations in the Changjiang River estuary and its adjacent sea areas 注: a:表层8 cm沉积物中纤毛虫4种摄食类型的丰度、生物量百分比及每种摄食类型的物种数; b:表层8 cm沉积物中纤毛虫4种摄食类型在各站位的丰度和生物量百分比; c:纤毛虫4种摄食类型在各站位3分层中的丰度百分比; d:纤毛虫4种摄食类型在各站位3分层中的生物量百分比 |
调查海域各站位沉积物中纤毛虫的物种数(图 6a)、Margalef多样性指数(6b)和Pielou’s均匀度指数(6d)呈现由近岸往外海逐步递减的趋势, 而Shannon- Wiener指数则呈现相反的趋势(6c)。
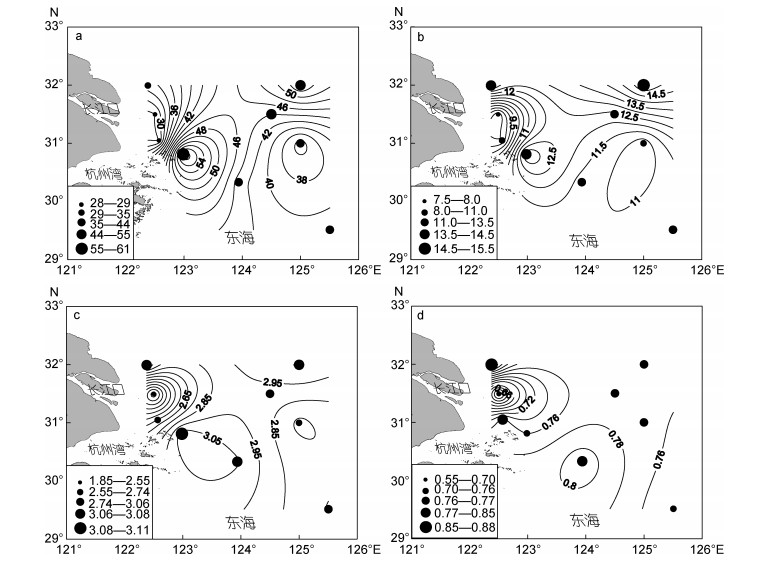 |
| 图 6 长江口邻近海域底栖纤毛虫物种数(a)、Margalef多样性指数(b)、Shannon-Wiener多样性指数(c)和Pielou’s均匀度指数(d)分布图 Fig. 6 The number of species (a) and the diversity indexes of Margalef (b), Shannon-Wiener (c) and Pielou's evenness (d) from the nine stations in the Changjiang River estuary and its adjacent sea areas |
利用Cluster分析对各研究站位纤毛虫群落结构进行分析, 结果表明在27.96%的相似性水平上, 长江口邻近海域的9站位分成了两组(group, 图 7), 且两组的纤毛虫群落结构具有显著差异(P < 0.001)。其中最邻近长江口的L1独立为一组, 其特点为水较浅(18m), 底层水温度及沉积物叶绿素a含量较高(表 1)。另外一组包含其余8个站位, 可分成3个亚组(subgroup), 但3个亚组间的纤毛虫群落结构无显著差异。其中亚组I包含PN1站位, 其特点为水浅(13m), 底层水盐度低(19.3), 沉积物叶绿素及有机质含量较高(表 1);亚组II包括L6和PN2站位, 两站位具有相近的水深、底层水温度和盐度(表 1), 其余站位为一亚组(图 7)。经过SIMPER分析, 造成L1与其余站位间纤毛虫群落结构差异的主要类群是Metacystis daphnicola (蚤居中圆虫), Discotricha papillifera (乳突盘毛虫), Cyclindium glaucoma (瞬闪膜袋虫), Holophrya sp.1 (裸口虫未定种1), Pseudovorticella sp. (原领毛虫未定种), Metacystis truncata (平截中圆虫), Prototrachelocerca sp. (原领毛虫未定种), Holophrya sp.2 (裸口虫未定种2).
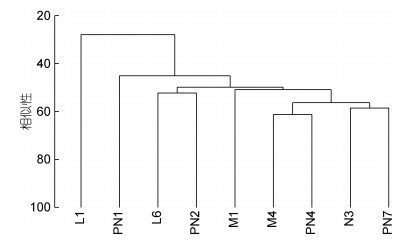 |
| 图 7 长江口邻近海域底栖纤毛虫群落结构的聚类分析 Fig. 7 Cluster analysis of the ciliate communities at the nine stations in the Changjiang River estuary and its adjacent sea areas |
相关性分析表明, 2011年8月在长江口邻近海域沉积物中底栖纤毛虫的丰度、生物量及多样性指数与任何单一环境因子均无相关性。BIOENV分析表明, 纤毛虫群落结构与底层水盐度最相关(R = 0.634, P = 0.022)。
3 讨论 3.1 底栖纤毛虫的现存量及多样性迄今, 对底栖纤毛虫的研究主要在潮间带、潮下带等近岸海域, 少数研究在离岸海域, 极少量研究涉及深海海域(Hausmann et al, 2002; Azovsky et al, 2005; Hamels et al, 2005)。与近年来东海离岸海域的相关研究进行比较, 本研究所获夏季底栖纤毛虫的丰度和生物量均高; 其丰度和生物量约是同一海域、同一年度春季相同站位的2.7倍(孟昭翠等, 2013);其丰度是同一海域、同一年度夏季长江口至济州岛沿线四站位的7倍, 生物量为后者的1.7倍(周百灵等, 2015);其丰度是同一海域2009年春季39站位的3.9倍、秋季18站位的2.7倍, 而其生物量则均是后者的11倍(代仁海, 2012)。与已报道黄海离岸海域的相关研究进行比较, 本研究所获底栖纤毛虫的丰度和生物量与其相近(Meng et al, 2012)或高(丰度是其5倍, 生物量是其1.7倍, Zhou et al, 2016);而较黄海潮间带报道的底栖纤毛虫丰度偏低(Du et al, 2012; Meng et al, 2018)。此外, 对同一航次且相同站位的浮游纤毛虫的研究结果显示, 在上层30 m水柱中的纤毛虫丰度为24cells/10cm2 (范围4—42cells/10cm2), 生物量为0.06μg C/10cm2 (范围0.002—0.124μg C/10cm2) (丁军军, 2012)。如此, 在长江口邻近海域表层8cm沉积物中的纤毛虫丰度约为浮游纤毛虫丰度的116倍, 生物量则是后者的约150倍。由此可见, 底栖纤毛虫在该海域生态系统中的作用不容忽视。
由于分类研究欠缺和采样不足, 对纤毛虫物种多样性难以准确估计。Azovsky等(2013)通过对全球范围内17个区域350多个采集地1342种海洋底栖纤毛虫的多样性和分布等研究发现, 单一区域内仅发现所有物种数的25%, 18%为广布种, 仅有5%—7%的物种为特有种。区域多样性高低不依赖于采样面积及海岸线的长度, 也未显示明显的随纬度变化趋势, 但是与区域内的采样强度有正相关性, 与盐度负相关。本研究在表层8 cm沉积物中获得24目69属的106种纤毛虫, 高于同年4月在本海域发现的91种(孟昭翠等, 2013), 两航次发现纤毛虫共计125种。据此对长江口邻近海域底栖纤毛虫的物种丰富度估计, Chao1为125和Chao2为142, 且以站位数和物种数获得的物种累积曲线未达到饱和(图 8), 说明尚有物种未被采集到。代仁海(2012)在与本研究同海域的研究显示, 2009年春季在39站位发现底栖纤毛虫278种, 秋季在18站位发现154种, 两航次共计发现313种; 周百灵等(2015)在长江口至韩国济州岛沿线四站位四航次发现底栖纤毛虫166种, 上述研究也验证了采样强度对物种多样性的正相关性及该海域尚有大量底栖纤毛虫物种待发现。据Xu等(2018)在长江口附近的上海崇明东滩湿地三个采样点连续一年的调查, 共发现20目57属93种纤毛虫, 其Chao1和Chao2均为93, 且物种累积曲线已达到饱和(图 8)。由此可见, 底栖纤毛虫的物种多样性在长江口离岸海域高于近岸潮间带, 相似的研究结果在黄海及俄罗斯北部的伯朝拉海均有报道(Azovsky et al, 2007; Meng et al, 2018)。在中国其他海域是否具有此分布现象有待于进一步研究。
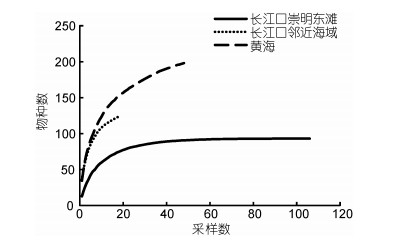 |
| 图 8 长江口及黄海底栖纤毛虫物种累积曲线 Fig. 8 Species accumulation curves of ciliate taxa in the Changjiang River estuary and Yellow Sea 注:物种累积曲线的数据来源:长江口崇明东滩(Xu et al, 2018), 长江口邻近海域(本研究数据及孟昭翠等, 2013), 黄海(Meng et al, 2012) |
黄海离岸海域底栖纤毛虫物种多样性也有少量报道, 代仁海(2012)在2009年春秋两季于山东半岛外黄海海域发现底栖纤毛虫121种; Meng等(2012)在2007年夏季南北黄海发现底栖纤毛虫198种, 物种累积曲线尚未达到饱和且物种数增加率较长江口邻近海域高(图 8), Chao2为233;与其相同海域Zhou等(2016)于2011年夏秋季发现底栖纤毛虫249种, 说明黄海离岸海域同样尚有物种未被采集到。基于已有报道, 离岸海域东海底栖纤毛虫的物种多样性较黄海低, 但对于黄海及东海底栖纤毛虫物种多样性的准确估计, 仍需进一步的样品采集。
已有研究表明, 温度是对海洋生物分布及多样性最关键的因子(Tittensor et al, 2010), 但影响底栖纤毛虫数量分布的常常为多因子(如水深、温度、盐度、沉积物粒径及食物可得性等)的共同作用(Hamel et al, 2005)。长江冲淡水在长江径流、台湾暖流、沿岸流的共同作用下由入海口开始向东北偏转, 海水盐度也呈现由近岸往东北方向逐渐增大的趋势。在本研究海域沉积物中纤毛虫的丰度、生物量及各多样性指数未见与任何单一环境因子的相关性, 仅底栖纤毛虫的群落结构与底层水盐度具有相关性。就底栖纤毛虫的丰度和生物量在调查海域的分布情况来看, 位于长江口海域南部站位较高, 其次是长江口外站位, 北部站位最低, 这也与调查海域底层水盐度变化趋势一致。
此外, 长江口低氧区在8月份最严重, 主要发生于20m以下的近底层水体中, 缺氧区域通常也会呈现氨、硫化物及颗粒有机物的增加, 从而影响浮游及底栖生物的生存(王延明等, 2009), 导致底栖生物数量显著下降。本研究中的L1、M1及PN1位于低氧区常发的海域, 三站位底栖纤毛虫的丰度、生物量及物种数都低于调查海域的平均值, 且L1站的丰度、生物量和物种数最低, 通过三个站位纤毛虫的群落结构与环境因子的相关性分析发现, 底栖纤毛虫的丰度和生物量与底层水温度呈显著负相关。通常, 温度对生物的生长具有促进作用。8月表层水温在25.1—28.2℃, 底层水温度在19.0—24.4℃, 可促进纤毛虫、藻类等类群的生长, 同时底层水体中有机物的分解可导致营养盐的再生并消耗大量的氧, 致使该区域的底层低氧现象更加严重, 导致沉积物中纤毛虫数量减少, 出现其丰度和生物量与底层水温度的负相关关系。通过与本海域已报道数据比较发现(代仁海, 2012;孟昭翠等, 2013;周百灵等, 2015), 本研究中底栖纤毛虫的丰度和生物量较已报道的数据高, 而物种数则较已报道的数据低, 其原因可能为本研究中底层水温度较已有研究均高, 虽然存在低氧区, 但整体上温度的升高促进了纤毛虫的增长, 而物种数较低, 则是站位数即采样强度差异的显现: 9站(本研究) vs. 57站(代仁海, 2012) vs. 16站(周百灵等, 2015)。
3.2 底栖纤毛虫群落结构及食性结合已有的长江口及东海离岸海域底栖纤毛虫的研究(代仁海, 2012;孟昭翠等, 2013;周百灵等, 2015), 长江口邻近海域底栖纤毛虫裂口纲种类数最多, 其次是前口纲; 在丰度及生物量上, 前口纲均为最优势类群, 核残迹纲在生物量上居第二位; 食性构成上, 肉食性纤毛虫均为最优势的摄食类群。上述最优势类群构成与黄海海域相同(Meng et al, 2012, 2018)。本研究中位于长江口海域北部的L1站具有不同于其他站位的纤毛虫群落结构, 通过分析发现是由于Pseudovorticella sp. (伪钟虫未定种)、Prototrachelocerca sp. (原领毛虫未定种)的较多量的出现, 而大量出现于其余站位的Metacystis truncata (平截中圆虫), Discotricha papillifera (乳突盘毛虫), Cyclidium glaucoma (瞬闪膜袋虫), Holophrya sp.1 (裸口虫未定种1)在本站则极少量的出现。本站位出现的Pseudovorticella sp.外栖于线虫和桡足类体表。M1站位由于Metacystis spp. (中圆虫属类群)大量出现, 导致菌食性纤毛虫的丰度和生物量所占比例均最大。
底栖纤毛虫生活于沉积物表面和底内, 其群落结构及多样性构成受沉积物颗粒间隙的影响较大, 已有研究表明在海洋生境中, 粒径在120—250μm范围内的沉积物中纤毛虫的物种多样性及数量较高(Hamels et al, 2005)。本研究所涉各站位沉积物类型从极细粉砂到细砂, 中值粒径为7—168μm, 仅L6和PN4站中值粒径大于120μm, 两站位底栖纤毛虫的丰度及物种多样性也较高, 但未呈现与沉积物粒径的相关关系。肉食性纤毛虫个体通常较大, 生活所需沉积物颗粒间隙较大, 随着沉积物深度的增加, 颗粒间隙变小, 故肉食性纤毛虫在表层2cm沉积物中占优势。代仁海(2012)对该海域的微型底栖生物研究表明, 硅藻、异养鞭毛虫具有明显的垂直分层, 而细菌无明显的垂直分层, 上述类群作为纤毛虫的食物来源, 其在沉积物中的分布也影响纤毛虫的摄食构成, 在本研究中随着沉积物深度的增加, 菌食性纤毛虫丰度和生物量所占比例增加, 且在2—5cm及5—8cm沉积物中, 其丰度所占比例最大。故底栖纤毛虫群落结构及摄食类型的演替, 除受沉积环境因子的强烈影响, 可能与饵料竞争或者捕食者有关。
纤毛虫可摄食细菌、藻类、其他原生动物(包括其他类群纤毛虫)甚至小的后生动物, 通过摄食将初级生产力/次级生产传递到下一级食物链, 在生态系统的物质循环和能量流动中发挥着重要的作用。已有研究表明, 摄食类型可作为研究纤毛虫在群落功能及生态过程中的作用时使用最广泛的生物学特征(Paganelli et al, 2012)。通过分析底栖纤毛虫摄食类群的变化及其影响因子, 有助于了解其生态功能的变动, 进而探究纤毛虫在底栖微食物网中的作用。本研究中通过食性的分析发现, 肉食性纤毛虫在长江口邻近海域为优势类群, 不同于潮间带藻食性纤毛虫通常为优势类群(Du et al, 2012; Hamels et al, 2004)。在潮间带藻类作为丰富的食物来源, 促进了藻食性纤毛虫的大量繁殖, 而在离岸海域由于水深较深, 藻类数量相对较少, 其他类型的摄食方式占据优势, 但对于纤毛虫在食物网物质循环和能量传递起多大作用, 需要结合其食物现存量、摄食率、增长率及新陈代谢率等进行综合分析。
4 结论本文利用Ludox-QPS方法分析了2011年8月长江口邻近海域底栖纤毛虫的群落结构及分布特点, 发现底栖纤毛虫在长江口海域北部站位的丰度和生物量呈从近岸向外海增加, 南部的站位呈现相反的分布趋势, 且本研究所获底栖纤毛虫的丰度和生物量较东海离岸海域已有研究结果均高, 揭示了其在该海域生态系统中的作用不容忽视。本研究共检获纤毛虫106种, 通过与已有报道的分析发其多样性在长江口离岸海域高于近岸潮间带, 且在离岸海域东海高于黄海。
长江口邻近海域底栖纤毛虫裂口纲种类数最多, 其次是前口纲; 在丰度及生物量上, 前口纲均为最优势类群, 核残迹纲在生物量上居第二位; 食性构成上, 肉食性纤毛虫均为最优势的摄食类群。上述最优势类群构成与黄海海域相同。由于较多量的伪钟虫属(Pseudovorticella)和原领毛虫属(Prototrachelocerca)种类出现导致长江口北部L1站的纤毛虫群落结构不同于其他站位。
致谢 中国科学院海洋研究所“科学三号”科考船全体人员及本课题组李承春和王璐协助进行沉积物样品的采集, 各站位的CTD数据由天津科技大学魏浩教授课题组提供, 在此一并致谢。
丁军军, 2012.黄东海微小型浮游动物群落结构与分布及水母发生的影响.青岛: 中国科学院海洋研究所硕士学位论文, 30-36
|
王延明, 方涛, 李道季, 等. 2009. 长江口及毗邻海域底栖生物丰度和生物量研究. 海洋环境科学, 28(4): 366-370, 382 DOI:10.3969/j.issn.1007-6336.2009.04.005 |
代仁海, 2012.黄东海底栖纤毛虫多样性及微型底栖生物群落结构特点.青岛: 中国科学院海洋研究所博士学位论文, 120-124
|
宋微波, 沃 伦A, 胡晓钟. 2009. 中国黄渤海的自由生纤毛虫. 北京: 科学出版社, 518
|
张莹莹, 张经, 吴莹, 等. 2007. 长江口溶解氧的分布特征及影响因素研究. 环境科学, 28(8): 1649-1654 DOI:10.3321/j.issn:0250-3301.2007.08.001 |
周百灵, 孟昭翠, 赵峰, 等. 2015. 长江口外海域微型和小型底栖生物群落结构和时空变化. 生态学报, 35(15): 5050-5063 |
孟昭翠, 徐奎栋. 2013. 长江口及东海春季底栖硅藻、原生动物和小型底栖生物的生态特点. 生态学报, 33(21): 6813-6824 |
类彦立, 徐奎栋. 2007. 海洋底栖原生动物生态学研究方法学综述. 海洋科学, 31(5): 49-57 DOI:10.3969/j.issn.1000-3096.2007.05.010 |
徐奎栋. 2011. 海洋微型底栖生物的多样性与地理分布. 生物多样性, 19(6): 661-675 |
Azovsky A I, Mazei Y A, 2005. Distribution and community structure of benthic ciliates in the North-Eastern part of the Black Sea. Protistology, 4(2): 83-90 |
Azovsky A I, Mazei Y A, 2007. Structure of subtidal and intertidal communities of psammophilous ciliates of the Pechora Sea. Oceanology, 47(1): 60-67 DOI:10.1134/S0001437007010092 |
Azovsky A I, Mazei Y A, 2013. Do microbes have macroecology? Large-scale patterns in the diversity and distribution of marine benthic ciliates. Global Ecology and Biogeography, 22(2): 163-172 DOI:10.1111/j.1466-8238.2012.00776.x |
Du Y F, Xu K D, Warren A et al, 2012. Benthic ciliate and meiofaunal communities in two contrasting habitats of an intertidal estuarine wetland. Journal of Sea Research, 70: 50-63 DOI:10.1016/j.seares.2012.03.004 |
Fenchel T, 1968. The ecology of marine microbenthos II. The food of marine benthic ciliates. Ophelia, 5(1): 73-121 |
Hamels I, Sabbe K, Muylaert K et al, 2004. Quantitative importance, composition, and seasonal dynamics of protozoan communities in polyhaline versus freshwater intertidal sediments. Microbial Ecology, 47(1): 18-29 |
Hamels I, Muylaert K, Sabbe K et al, 2005. Contrasting dynamics of ciliate communities in sandy and silty sediments of an estuarine intertidal flat. European Journal of Protistology, 41(4): 241-250 DOI:10.1016/j.ejop.2005.02.002 |
Hausmann K, Hülsmann N, Polianski I et al, 2002. Composition of benthic protozoan communities along a depth transect in the eastern Mediterranean Sea. Deep Sea Research Part I:Oceanographic Research Papers, 49(11): 1959-1970 DOI:10.1016/S0967-0637(02)00095-X |
Lynn D H, 2008. The Ciliated Protozoa: Characterization, Classification, and Guide to the Literature. Dordrecht, The Netherlands: Springer, 605
|
Meng Z C, Xu K D, Dai R H et al, 2012. Ciliate community structure, diversity and trophic role in offshore sediments from the Yellow Sea. European Journal of Protistology, 48(1): 73-84 |
Meng Z C, Xu K D, Dai R H et al, 2018. Benthic ciliate diversity and community composition along water depth gradients:a comparison between the intertidal and offshore areas. European Journal of Protistology, 65(1): 31-41 |
Nelson D W, Sommers L E, 1982. Total carbon, organic carbon and organic matter. In: Page A L, Miller R H, Keeney D R eds. Methods of Soil Analysis: Part 2. Chemical and Microbiological Properties. Madison, Wisconsin: American Society of Agronomy, 539-597
|
Paganelli D, Marchini A, Occhipinti-Ambrogi A, 2012. Functional structure of marine benthic assemblages using Biological Traits Analysis (BTA):a study along the Emilia-Romagna coastline (Italy, North-West Adriatic Sea). Estuarine, Coastal and Shelf Science, 96: 245-256 DOI:10.1016/j.ecss.2011.11.014 |
Putt M, Stoecker D K, 1989. An experimentally determined carbon:volume ratio for marine "oligotrichous" ciliates from estuarine and coastal waters. Limnology Oceanography, 34(6): 1097-1103 DOI:10.4319/lo.1989.34.6.1097 |
Tittensor D P, Mora C, Jetz W et al, 2010. Global patterns and predictors of marine biodiversity across taxa. Nature, 466(7310): 1098-1101 |
Wickham S, Gieseke A, Berminger U G, 2000. Benthic ciliate identification and enumeration:an improved methodology and its application. Aquatic Microbial Ecology, 22: 79-91 DOI:10.3354/ame022079 |
Xu K D, Du Y F, Lei Y L et al, 2010. A practical method of Ludox density gradient centrifugation combined with protargol staining for extracting and estimating ciliates in marine sediments. European Journal of Protistology, 46(4): 263-270 DOI:10.1016/j.ejop.2010.04.005 |
Xu Y, Stoeck T, Forster D et al, 2018. Environmental status assessment using biological traits analyses and functional diversity indices of benthic ciliate communities. Marine Pollution Bulletin, 131: 646-654 |
Zhou B L, Xu K D, 2016. Spatiotemporal variation in community structure of marine benthic ciliates in the Yellow Sea during and after macroalgal and giant jellyfish blooms. Chinese Journal of Oceanology and Limnology, 34(4): 629-641 DOI:10.1007/s00343-016-5115-0 |
 2020, Vol. 51
2020, Vol. 51


