中国海洋湖沼学会主办。
文章信息
- 黄平平, 赵峰, 徐奎栋. 2020.
- HUANG Ping-Ping, ZHAO Feng, XU Kui-Dong. 2020.
- 近海水体环境DNA沉降对沉积物中纤毛虫分子多样性评估的影响
- EFFECTS OF SEDIMENTATION OF DNA FROM OVERLYING WATERS ON THE EVALUATION OF CILIATE MOLECULAR DIVERSITY IN OFFSHORE SEDIMENTS
- 海洋与湖沼, 51(3): 602-612
- Oceanologia et Limnologia Sinica, 51(3): 602-612.
- http://dx.doi.org/10.11693/hyhz20191100235
文章历史
-
收稿日期:2019-11-29
收修改稿日期:2020-01-14
2. 中国科学院大学 北京 100049
2. University of Chinese Academy of Sciences, Beijing 100049, China
纤毛虫具有较高的生物多样性, 是微食物网中的重要组成部分, 在海洋生态系统中发挥着重要的生态学功能(Fenchel, 2008;宋微波等, 2009)。研究者们已采用经典形态学方法开展了多项浅海水体或者沉积物中纤毛虫多样性的研究, 并揭示了浮游与底栖环境具有截然不同的纤毛虫群落构成(Meng et al, 2012;李洁等, 2016)。海水中, 舞毛亚纲(Choreotrichia, 73.3%)和寡毛亚纲(Oligotrichia, 13.3%)等典型浮游纤毛虫为物种数最高的类群, 且丰度占据绝对优势(Liu et al, 2016);而沉积物中, 前口纲(Prostomatea, 40%—47%)和裂口纲(Litostomatea, 9%—25%)纤毛虫为最优势类群, 而舞毛和寡毛类群则罕见(Meng et al, 2012;周百灵等, 2016; Zhou et al, 2016)。但是, 形态学方法本身存在的问题和不足限制了人们对纤毛虫多样性的深入了解, 如:容易忽视数量少、个体微小且难以培养的类群, 且操作过程复杂, 需要丰富的分类学鉴定经验等(黄平平等, 2017)。
近年来, 基于基因测序的方法, 尤其是DNA高通量测序, 可检获较之形态学方法更高的多样性, 极大地扩展了对海洋纤毛虫多样性的认识。Gimmler等(2016)通过18S rRNA基因的高通量测序技术, 在大洋真光层水体中检获了1274个纤毛虫的可操作分类单元(operational taxonomic units, OTUs), 其分子多样性远高于基于形态研究的结果; 类群构成上, 分子手段与形态学手段研究结果类似, 主要隶属于舞毛亚纲和寡毛亚纲。在沉积物中, DNA高通量测序技术检获了极高的纤毛虫分子多样性, 但是浮游生舞毛亚纲的多样性占比高达20%, 为多样性最高的类群, 且序列数所占比例最高达20%, 这与形态学研究结果截然不同(Li et al, 2019)。我们的前期研究也发现类似现象, 浮游生舞毛亚纲和寡毛亚纲纤毛虫的序列在沉积物中占比高达42%, 而通过形态学手段并未在相同站位的沉积物中检获该类群(黄平平等, 2017)。沉积物中不仅包括底栖活动虫体的DNA, 还富集了来自上层水体中浮游类群的包囊和死亡个体, 以及胞外DNA等的eDNA (Torti et al, 2015)。Corinaldesi等(2005)研究发现近海沉积物中胞外DNA浓度约为胞内DNA浓度的40倍以上, 将这些胞外eDNA包含在内会直接影响沉积物中纤毛虫分子多样性的评价。
较之DNA, RNA降解快, 不易在环境中保存, 因此环境RNA(反转录成cDNA, complementary DNA), 即cDNA测序被应用于活动虫体多样性的研究(Xu et al, 2017)。而且, 我们前期研究发现cDNA测序检获的底栖纤毛虫群落结构与形态学结果更为相似(黄平平等, 2017)。因此, 基于cDNA测序的方法会降低水体纤毛虫对沉积物中纤毛虫分子多样性评价的干扰。
迄今, 研究者们主要针对水体或者沉积物单一生境中的纤毛虫多样性开展了研究, 尚未有工作同时研究相同站位的水体和沉积物中的纤毛虫多样性, 因此, 海水中的eDNA如何影响沉积物中纤毛虫分子多样性的评价, 以及影响程度依然不明。
本研究以黄海冷水团内的两个站位(水深约70m)为研究对象, 同时提取不同水层和沉积物中的DNA和RNA, 其中沉积物中DNA提取采用直接提取和洗脱两种方法, 通过核糖体18S DNA及其cDNA V4区高通量测序获得纤毛虫的分子多样性信息, 探明来源于上层水体纤毛虫的eDNA对沉积物中纤毛虫多样性评价的影响, 为陆架海域纤毛虫的分子多样性研究提供可靠的技术体系和理论依据。
1 材料与方法 1.1 调查站位与样品采集本研究于2018年8月搭乘“科学3号”科学考察船在南黄海冷水团内Y1 (35°59′56.4″N, 123°0′2.4″E)和Y2 (35°59′48.6″N, 123°59′58.8″E)两个站位进行样品采集。
海水样品, 利用温盐深剖面探测系统(SBE911)的Rosette采水器采集: 6个分层:表层、10m、20m、30m、50m和底层(Y1: 69m和Y2: 72m), 每个分层各采集1L海水(Liu et al, 2017)。根据温度和盐度数据, 两个站位40m以深水层处于黄海冷水团(温度 < 10℃; 盐度 > 32) (Xin et al, 2015)。海水首先经孔径为200μm的筛绢预过滤, 去除大型浮游生物和杂质等。然后采用Masterflex蠕动泵(美国)过滤海水至直径为47mm, 孔径为0.22μm的混合纤维素酯膜上(Millipore, USA), 富集生物。过滤时, 控制蠕动泵的转速和压力, 保证细胞完整性。1L海水, 包括极少数泥沙含量较高的底层水体, 可在10分钟内完成过滤。滤膜置于无RNA酶的冻存管中, 于-20℃冰箱中冷冻保存, 回到实验室转移至-80℃超低温冰箱中保存。
沉积物, 利用0.1m2改进型Gray-Ohara箱式采泥器采集。每个站位采集3箱未受扰动的沉积物样品:每箱刮取0—2cm表层沉积物约20g放入封口袋中, 混匀, 快速置于-20℃冰箱中冷冻保存, 回到实验室转移至-80℃超低温冰箱中保存。
1.2 DNA和RNA提取及PCR扩增滤膜DNA和RNA提取采用All Prep DNA/RNA Mini Kit (Qiagen, Germany), 该试剂盒可同时提取滤膜上的DNA和RNA。
沉积物RNA提取采用RNA PowerSoil Total RNA Isolation kit (Qiagen, Germany), 每个站位3个样品(三箱泥, 每箱1个), 各取2g用于RNA提取; RNA洗脱完成后的吸附柱, 继续采用RNA PowerSoil DNA Elution Accessory Kit (Qiagen, Germany)洗脱DNA, 获得沉积物的洗脱DNA。
沉积物DNA提取, 还采用了PowerSoil DNA Isolation kit (Qiagen, Germany), 每个站位3个样品, 各取3份0.3g, 分别进行DNA提取, 获得沉积物的提取DNA。
总RNA采用PrimerScript Ⅱ1st strand cDNA Synthesis Kit反转录成cDNA。每个海水样品各一份DNA以及cDNA, 每个沉积物样品各一份洗脱DNA、cDNA以及三份提取DNA通过巢式PCR对纤毛虫18S rRNA基因V4区进行特异性扩增(Stock et al, 2013)。首先, 采用纤毛虫特异性引物(CilF和CilRI-III)针对纤毛虫的18S rRNA基因进行扩增, 扩增长度约600bp (Lara et al, 2007), 每个样品的DNA/cDNA进行三次重复PCR。采用Q5高保真DNA聚合酶(New England Biolabs)进行PCR扩增, 第一轮PCR反应体系为:正反向引物各0.5μL, 模板1.5μL, Q5聚合酶0.25μL, 10mmol/L dNTPs 0.5μL, Q5 Reaction Buffer和High GC Enhancer各5μL, 最后加双蒸水补齐25μL。反应流程: 98℃预变性30s;然后98℃变性45s, 58℃退火1min, 72℃延伸1min, 共循环35次; 最后72℃延伸10min终止于4℃ (Lara et al, 2007)。然后, 以第一轮PCR产物为模板, 采用真核特异性引物(EukF和EukR)对V4高变区进行特异性扩增, 扩增长度约400bp (Stoeck et al, 2010)。第二轮PCR反应体系为:正反向引物各1μL, 模板1.5μL, Q5聚合酶0.5μL, 10mmol/L dNTPs 1μL, Q5 Reaction Buffer和High GC Enhancer各10μL, 最后加双蒸水补齐50μL。反应流程: 98℃预变性30s;然后98℃变性30s, 57℃退火45s, 72℃延伸1min, 共循环10次; 98℃变性30s, 49℃退火45s, 72℃延伸1min, 共循环25次; 最后72℃延伸5min终止于4℃ (Stoeck et al, 2010)。
1.3 测序及序列数据分析琼脂糖凝胶电泳检测PCR产物质量, 若符合要求, 则将来自同一样品的3个重复的DNA/cDNA的PCR产物分别进行合并, 每个水层的DNA/cDNA的PCR产物各一组(如: Y1站位5m层DY1.5和RY1.5), 每个站位沉积物提取DNA、洗脱DNA和cDNA的PCR产物各三组(如Y1站位提取DNA: SDY1_1T, SDY1_2T, SDY1_3T; Y1站位洗脱DNA: SDY1_1, SDY1_2, SDY1_3; Y1站位cDNA: SRY1_1, SRY1_2和SRY1_3)。最终共24个水体样品(12个DNA和12个cDNA)和18个沉积物样品(6个提取DNA、6个洗脱DNA和6个cDNA), 进行Illumina Hiseq测序。
测序过程如下:使用NEB Next® Ultra® DNA Library Prep Kit (New England Biolabs, USA)试剂盒构建文库, 检测文库, 合格后上机测序。测得的原始序列采用FLASH V1.2.7对双端测序序列进行合并, 得到原始Tags (Raw Tags) (Magoč et al, 2011)。采用QIIME对Raw Tags进行质量控制和过滤: (1)质量控制:将Raw Tags从连续低质量值(≤19)碱基数达到设定长度(默认长度值为3)的第一个低质量碱基位点截断; (2)长度过滤:经截取后得到的Tags数据集, 进一步过滤掉其中连续高质量碱基长度低于Tags长度75%的Tags (Caporaso et al, 2010)。进一步采用UCHIME去除嵌合体序列, 最终获得有效序列(Edgar et al, 2011; Haas et al, 2011)。采用USEARCH对有效序列进一步处理。流程如下:去冗余; 去噪; 以97%水平进行OTU聚类。对获得的OTU代表序列与Silva数据库(v. 123)进行BLAST比对, 获得相应序列的分类信息。其中纤毛虫的相对丰度以每个类群的序列数占总序列数的比例(序列数百分比)表示; 丰富度以每个类群的OTUs数表示; 相对丰富度以每个类群的OTUs数占总OTUs数的比例(OTUs数百分比)表示。
1.4 数据统计分析稀释性曲线用于评估测序样本的饱和程度。为确保样品间的可比性, 根据单个样本纤毛虫最低序列数进行标准化(n=6683, DY2.30)。稀释性曲线的绘制, 采用R语言(R3.4.3)中的“fossil”和“vegan”包。序列数的标准化处理, 采用USEARCH v10。使用Venny2.1绘制韦恩图。使用PRIMER v6软件包中的CLUSTER分析不同水层环境因子(温度和盐度), 沉积物和水体样品中纤毛虫的群落结构, 分析之前原始数据进行log(x+1)转化; 环境因子的CLUSTER分析基于欧式距离(Euclidean Distance)矩阵, 生物样本的CLUSTER分析基于Bray-Curtis矩阵。SIMPROF (P < 0.05)和ANOSIM用于分析群落结构差异的显著性。
2 结果与分析 2.1 环境因子海水温度和盐度的垂直变化趋势相反, 随着水层加深, 温度降低, 而盐度增加。在40m以浅水域, 温度为16.9—27.7℃, 盐度为30.5—32.0;在40m以深水域, 温度为7.4—8.8℃, 盐度均约为32.5。以每个分层温度和盐度进行聚类, 结果显示: 12个样本聚为两大支, 40m以深和以浅样本分别聚为一支, ANOSIM分析两组之间环境因子差异显著(R=0.85, P=0.002), 但各组内部差异不显著(SIMPROF: P > 0.05) (图 1)。
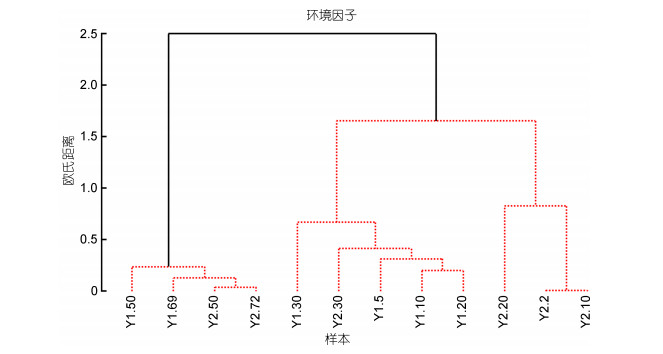 |
| 图 1 每个水层环境因子聚类分析(红色显示差异不显著: P > 0.05) Fig. 1 UPGMA clustering analysis based on the environmental factors in each layer (the groups with no significant difference are shown by red bars) 注: Y1.5—Y1.69: Y1站位5m层至Y1站位69m层; Y2.2—Y2.72: Y2站位2m层至Y2站位72m层 |
42个测序样本共获取1160205条纤毛虫的序列, 每个样本平均序列数为27624。其中, DY2.30序列数最低, 为6683条; SRY2_1序列数最高, 为77604条。稀释性曲线显示:除SRY1_3样本外, 其他所有样本测序深度趋于饱和; 较之海水样本, 沉积物样本饱和性较低(图 2)。为确保样品间的可比性, 以下分析均基于标准化后的数据(n=6683), 标准化之后, 以97%的相似性进行聚类, 所有样本共检获651个纤毛虫的OTUs。DY2.72的OTUs数最低, 为41个; SDY1_3的OTUs数最高, 为302个。
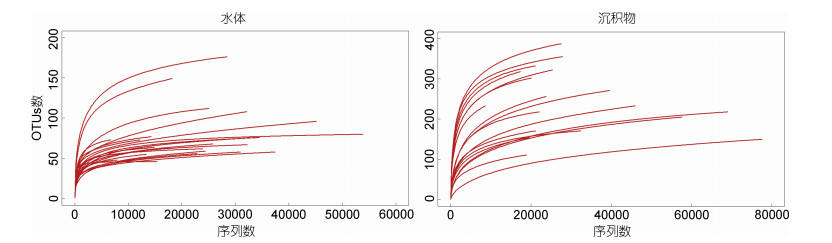 |
| 图 2 水体和沉积物中纤毛虫DNA和cDNA测序样本稀释性曲线 Fig. 2 Rarefaction analyses of all DNA and cDNA sequencing samples of ciliates in waters and sediments |
在水体中, 两种方法检获的纤毛虫OTUs数相似。DNA和cDNA测序分别获得201和218个OTUs, 182个OTUs同时通过两种方法检获, 共有OTUs序列数分别占总序列数的99.9%和99.4%(图 3a)。两种方法均显示, 较之40m以深水层, 40m以浅水层中纤毛虫OTUs数较高(图 3b, 3c)。DNA测序在40m以浅和以深水层中分别获得165和82个OTUs, 其中46个OTUs可以同时在40m以浅和以深水层中检获(图 3b)。cDNA测序在40m以浅和以深水层中分别获得196和85个OTUs, 其中63个OTUs可以同时在40m以浅和以深水层中检获(图 3c)。
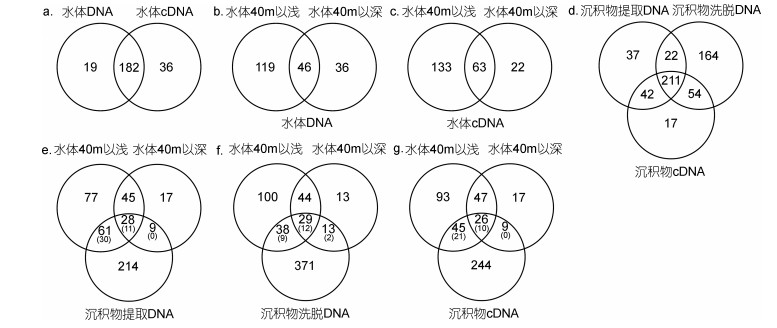 |
| 图 3 共有和特有OTUs数(括号内数字显示舞毛亚纲和寡毛亚纲纤毛虫OTUs数) Fig. 3 The number of unique and shared OTUs (the number of Choreotrichia and Oligotrichia OTUs was showed in brackets) |
与基于环境因子的聚类分析结果一致, 基于24个水体纤毛虫测序样本的聚类分析结果显示, 24个样本亦分为两大组, 40m以浅和以深水层分别聚为一组(ANOSIM: R=0.994, P=0.001)。SIMPROF分析结果显示, 除Y2站位2m层和10m层以外, 同一站位的相同分层采用DNA和cDNA测序方法所获得的样本差异不显著(图 4)。即整体上, 各个水层间的纤毛虫群落的差异大于方法学造成的群落差异。
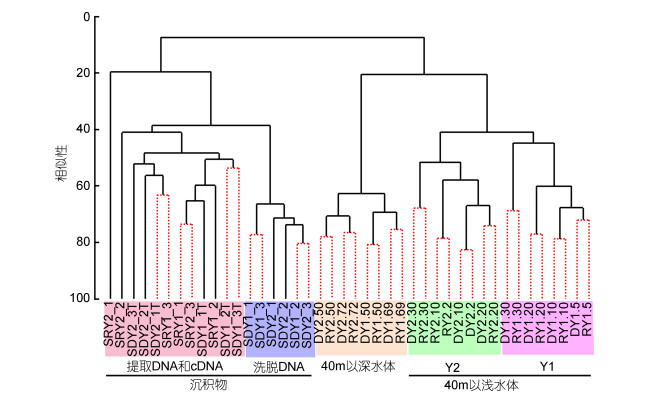 |
| 图 4 42个测序样本聚类分析和SIMPROF分析(红色虚线显示差异不显著, P > 0.05) Fig. 4 Clustering and SIMPROF analyses of all the 42 sequencing samples (the groups with no significant difference are shown with red dash lines, P > 0.05) 注:每个水层的DNA和cDNA测序样本(如D/RY1.5:基于DNA/cDNA测序Y1站位水体5m层)。每个站位沉积物提取DNA(SDY1_1T-3T)、洗脱DNA(SDY1_1-3)和cDNA(SRY1_1-3)测序各三个重复测序样本 |
DNA和cDNA测序所检获的纤毛虫均隶属于7个纲(图 5a)。两种方法均显示旋唇纲相对丰度和OTUs数最高, 且主要由舞毛亚纲和寡毛亚纲构成。比较分析40m以浅和40m以深样本, DNA和cDNA测序所揭示的不同纲/亚纲相对丰度和丰富度的变化规律一致:从40m以浅到40m以深, 舞毛亚纲、寡毛亚纲和叶咽纲相对丰度降低; 肾形纲、裂口纲、寡膜纲和前口纲相对丰度增加(图 5b)。就相对丰富度而言, 舞毛亚纲、寡毛亚纲和前口纲相对丰富度降低; 肾形纲、裂口纲、寡膜纲和叶咽纲相对丰富度增加(图 5c)。
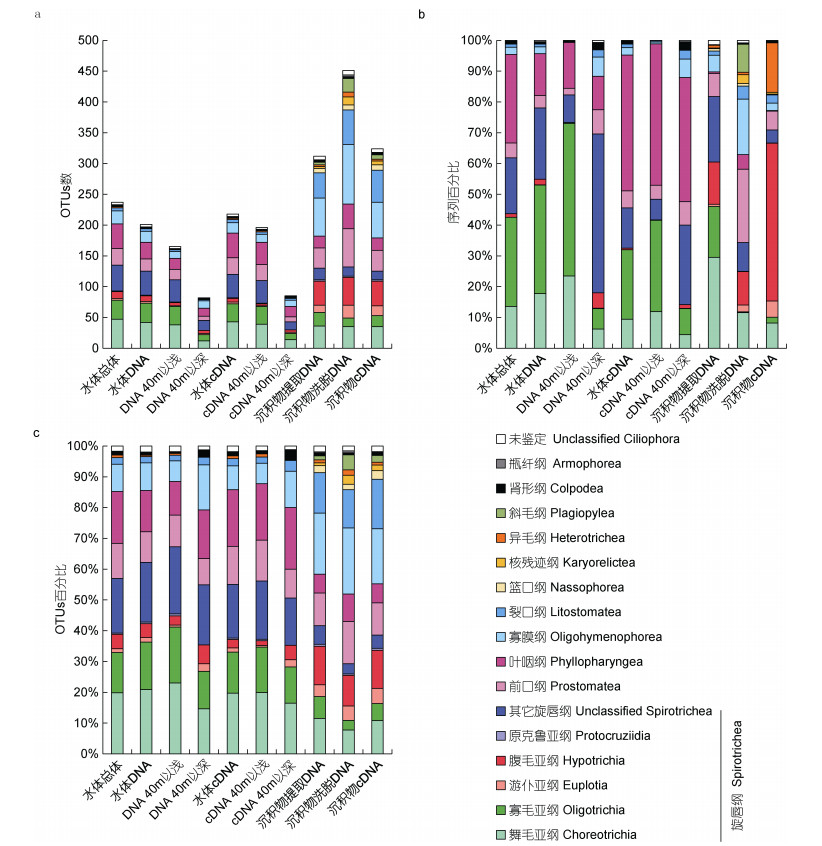 |
| 图 5 基于DNA和cDNA测序的纲/亚纲水平纤毛虫OTUs数(a)、序列百分比(b)和OTUs百分比(c) Fig. 5 The number of ciliates OTUs (a), the proportions of sequences (b) and OTUs (c) at class/subclass level based on DNA and cDNA sequencing |
在沉积物中, 提取DNA、洗脱DNA和cDNA测序分别获得312、451和324个OTUs, 211个OTUs同时通过三种方法检获, 共有OTUs序列数分别占总序列数的93.5%、79.2%和82.1% (图 3d)。164个OTUs仅通过洗脱DNA法检获, 其中146个OTUs相对丰度低于0.1%。聚类分析结果显示, 基于洗脱DNA测序的6个样本聚集在一起, 且与基于提取DNA和cDNA测序的样本分开, ANOSIM分析显示两大支群落结构差异显著(R=0.569, P=0.001) (图 4)。
提取DNA和洗脱DNA测序检获的纤毛虫均隶属于11个纲, 包括水体检获的7个纲, 以及瓶纤纲(Armophorea)、核残迹纲(Karyorelictea)、篮口纲(Nassophorea)和斜毛纲(Plagiopylea) (图 5a)。cDNA测序检获的纤毛虫隶属于10个纲, 其中瓶纤纲未获得。三种方法均显示旋唇纲相对丰度最高, 其中提取DNA测序检获的舞毛类和寡毛类相对丰度高达46.0%, OTUs数为58个, 占比为18.6%;洗脱DNA测序次之, 该两类相对丰度为11.8%, OTUs数为49个, 占比为10.9%; cDNA测序所得的该两类浮游生纤毛虫相对丰度最低为10.1%, 但OTUs数为53个, 占比为16.4% (图 5b, 5c)。提取DNA和洗脱DNA测序显示前口纲相对丰度较高, 而cDNA测序显示异毛纲相对丰度较高(图 5b)。
2.5 水体和沉积物中共有纤毛虫鉴于水体DNA和cDNA测序所得OTUs构成极其相似, 因此整合DNA和cDNA数据, 共获得237个纤毛虫的OTUs, 代表水体中纤毛虫群落, 40m以浅和以深水层分别获得211和99个OTUs。
在沉积物中, 提取DNA测序获得的312个OTUs中, 98个可以同时在水体中检获, 其中, 40m以浅水层中检获89个, 包括41个舞毛类和寡毛类OTUs; 40m以深水层中检获37个, 包括11个舞毛类和寡毛类OTUs, 且该11个OTUs均可在浅水层中检获(图 3e)。
沉积物洗脱DNA测序获得的451个OTUs中, 80个可以同时在水体中检获, 其中, 40m以浅水层中检获67个, 包括21个舞毛类和寡毛类OTUs; 40m以深水层中检获42个, 包括14个舞毛类和寡毛类OTUs, 该14个OTUs中12个可以在浅水层中检获(图 3f)。
沉积物cDNA测序获得的324个OTUs中, 80个可以同时在水体中检获, 其中, 40m以浅水层中检获71个, 包括31个舞毛类和寡毛类OTUs; 40m以深水层中检获35个, 包括10个舞毛类和寡毛类OTUs, 该10个OTUs均可在浅水层中检获(图 3g)。
在多样性构成上, 三种沉积物纤毛虫多样性评估方法显示, 水体和沉积物中共有的OTUs主要隶属于浮游纤毛虫舞毛亚纲和寡毛亚纲(图 6)。沉积物、水体40m以浅和40m以深水层共有的舞毛和寡毛类OTUs, 在水体中的相对丰度较高, 序列占总序列数的18.7%—32.7%。沉积物和40m以浅水层共有, 而未在40m以深水层中获得的舞毛和寡毛类OTUs, 在水体中的相对丰度较低, 占总序列数的0.2%—2.9%。如OTU169高斯类铃虫(Codonellopsis gaussi), 其通过三种方法均可在沉积物中检获, 同时仅存在于40m以浅水层中, 在水体中的相对丰度为0.04%。
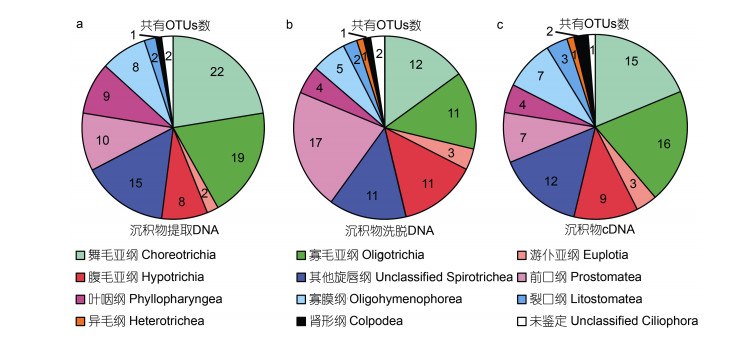 |
| 图 6 基于提取DNA (a)、洗脱DNA (b)和cDNA (c)测序的沉积物和水体中共有的纤毛虫OTUs构成 Fig. 6 The composition of the ciliate OTUs shared in waters and sediments based on the extraction DNA (a), elution DNA (b) and cDNA (c) sequencing |
水体和沉积物共有舞毛类和寡毛类OTUs, 在沉积物中总的相对丰度为3.8% (cDNA测序), 8.7% (洗脱DNA测序), 39.2% (提取DNA测序) (图 7)。水体和沉积物共有的舞毛类和寡毛类OTUs中大部分(63.4%—67.7%)在水体中的相对丰度高于在沉积物中的相对丰度, 但是OTU14拟急游虫(Strombidinopsis acuminata)在沉积物中的序列数为371(cDNA测序)—7019(提取DNA测序), 而在水体中仅获得5条序列。
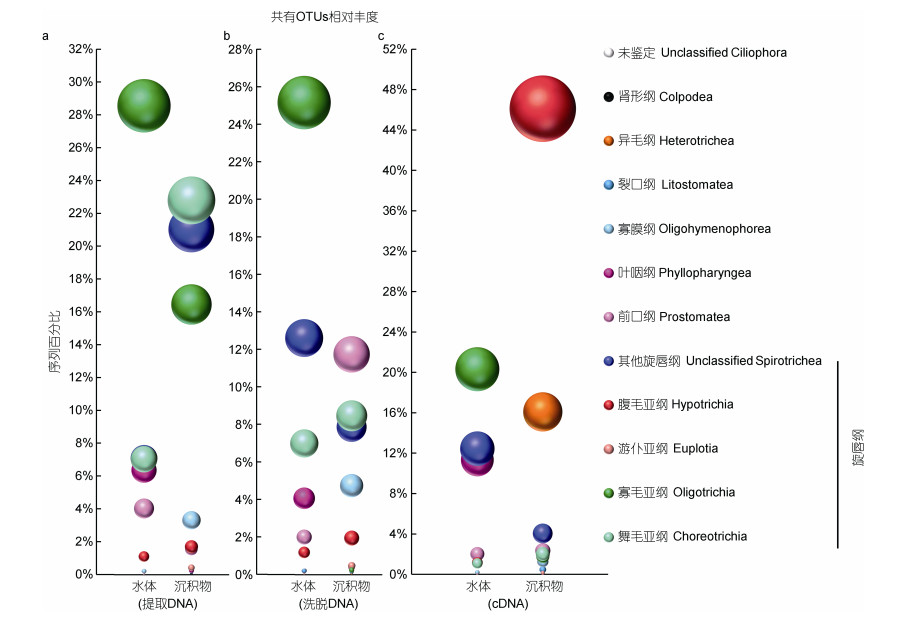 |
| 图 7 基于提取DNA (a)、洗脱DNA (b)和cDNA (c)测序的沉积物和水体中共有的纤毛虫OTUs相对丰度 Fig. 7 The relative abundance of the ciliate OTUs shared in waters and sediments based on the extraction DNA (a), elution DNA (b) and cDNA (c) sequencing |
此外, 沉积物和水体共有OTUs还包括腹毛亚纲、前口纲和异毛纲等优势类群(图 6)。沉积物洗脱DNA中, 与水体共有序列主要隶属于前口纲, 相对丰度为11.7% (图 7b), 其中, OTU40隐核虫属(Cryptocaryon sp.)贡献最大, 而其在水体中仅一条序列。沉积物cDNA中, 与水体共有序列主要隶属于腹毛亚纲和异毛纲, 其相对丰度分别为46.1%和16.1% (图 7c)。在腹毛亚纲中, OTU2缩颈半腹柱虫(Hemigastrostyla enigmatica)贡献最大, 其在水体中仅一条序列。异毛纲中, OTU7突口虫属(Condylostoma sp.)贡献最大, 其在水体中亦只有一条序列。
3 讨论 3.1 不同水层中水体纤毛虫对沉积物中纤毛虫分子多样性评估的影响本研究采用三种不同沉积物中的纤毛虫分子多样性研究方法, 结果显示沉积物中18% (洗脱DNA)到31% (提取DNA)的OTUs可以在水体中检获。这与前人报道的近海沉积物中25%—30%的真核微生物OTUs可以在上层水体中检获的结果相近(Forster et al, 2016; Chen et al, 2017)。但是, 过去的研究侧重探讨浮游和底栖原生生物地理分布模式的差异, 并未研究海水和沉积物中共有物种的构成, 且缺少不同水层水体对沉积物微生物生物多样性评估影响的研究。
本研究发现浅层水中纤毛虫对沉积物纤毛虫分子多样性评价的影响大于深层水, 沉积物与水体共有的纤毛虫OTUs绝大部分仅在40m以浅水层中检获, 而未在40m以深水层中检获(图 3e, 3f, 3g)。通常, 浅层水、深层水和沉积物共有的寡毛类和舞毛类OTUs中, 80%以上在水体中的相对丰度高于在沉积物中的相对丰度, 且一半以上的OTUs在水体中的相对丰度大于1%。优势浮游类群的扩散能力较强, 因此可以同时在浅层水和深层水中检获(Tucker et al, 2017), 且优势浮游类群的DNA和RNA可沉降到沉积物中并得以保存, 因此亦可在沉积物中检获。还有部分共有OTUs在沉积物中的相对丰度较高, 如拟急游虫(Strombidinopsis acuminata)在沉积物中检获千余条序列, 而在水体中仅检获5条。推测此类纤毛虫可能主要以包囊的形式存在于沉积物中。少数舞毛类和寡毛类纤毛虫可以包囊的形式存在于沉积物中(Doherty et al, 2010), 在环境适宜时脱包囊, 重新进行浮游生活(Massana et al, 2015)。
仅在沉积物和浅层水同时检获的寡毛类和舞毛类OTUs, 在水体中总的相对丰度较低(0.2%—2.9%)。此类稀有浮游OTUs可能主要分布于浅层水中, 温度可能是控制其分布的重要因子, 因为40m以浅水层温度为17—28℃, 而底层水温仅约8.0℃。水深也可能是限制此部分纤毛虫分布的重要因素, 如高斯类铃虫(Codonellopsis gaussi)仅在浅层水中发现, 而未见于深层水中(梁晨, 2019)。
海水和沉积物共有的OTUs除了以上浮游生舞毛类和寡毛类纤毛虫, 还包括在沉积物中占优势的腹毛亚纲等, 该类群亦偶尔在水体中检获。如缩颈半腹柱虫(Hemigastrostyla enigmatica)通常在底质表面爬行, 属周丛生纤毛虫, 该物种普遍检获于沉积物, 且具有相对较高的丰度, 而在水体中仅检获了1条序列。
3.2 不同方法对陆架海区水体和沉积物中纤毛虫多样性评估的影响DNA和cDNA测序方法检获群落的相似性, 因研究对象和研究海域的不同而有所差异(Massana et al, 2015; Xu et al, 2017; Zhao et al, 2017)。本研究首次同时提取了不同水层和沉积物中的DNA和RNA, 其中, 沉积物DNA提取采用直接提取和洗脱两种不同方法, 测序获得纤毛虫的分子多样性信息, 探讨不同方法对近海水体或沉积物中纤毛虫多样性评估的影响。
水体样品中, DNA和cDNA测序方法所检获的纤毛虫在多样性构成上较为一致, 共有序列占总序列数的99%以上, 且两种方法获得的特有OTUs均为稀有类群, 可能由于PCR扩增偏好性和反转录过程导致(Gonzalez et al, 2012)。同一站位相同分层采用不同测序方法所获得的纤毛虫群落结构差异不显著, 但不同分层间的差异极显著。然而, DNA测序中叶咽纲纤毛虫序列比例明显低于cDNA测序。Zhao等(2017)在西太平洋表层水体到2000m以深水体中亦发现类似现象, 可能由于叶咽纲纤毛虫具有较低rRNA基因拷贝数, 且相对较高的代谢活性所致(Gong et al, 2013)。
沉积物中的纤毛虫群落明显不同于水体, 而方法学导致的纤毛虫群落差异大于样品间的群落差异。洗脱DNA测序方法所获得的OTUs数明显高于提取DNA和cDNA测序方法。本研究中洗脱DNA和cDNA测序方法所用的样品量相同, 且来源于相同样品, 因此洗脱DNA方法所获得的高多样性的原因在于cDNA测序主要检获活性生物多样性, 而DNA测序还可检获胞外DNA和包囊多样性(Xu et al, 2017)。样品量则是影响洗脱DNA和直接提取DNA多样性评估的重要因素(Penton et al, 2016), 本研究中洗脱DNA测序样品量为提取DNA测序样品量的2.2倍, 因此所检获的OTUs数亦较高, 为提取DNA测序检获的OTUs数的1.4倍。
此外, 样品量不仅影响多样性, 对群落构成也具有显著影响, 不同样品量所获得的优势OTUs显著不同(Penton et al, 2016)。提取DNA测序所得的浮游生寡毛类和舞毛类纤毛虫最占优势, 相对丰度高达46.0%, 而其在洗脱DNA中的相对丰度仅为11.8%, 获得的OTUs多样性明显增加。推测增大样品量, 提高了稀有类群的检出效率, 从而相对削弱了沉降下来的水体纤毛虫的DNA的影响。Ranjard等(2003)研究指出尽管微型生物分布存在异质性, 当样品量大于1g时, 可较好地反应该生境的群落构成。
综上, 洗脱DNA和cDNA测序可显著降低水体纤毛虫对沉积物中的纤毛虫多样性评估的影响。且洗脱DNA较之cDNA测序在实际操作中具有诸多优势, 尤其适用于沉积物中纤毛虫的分子多样性研究。首先, 相同条件下RNA降解较快, 因此较之RNA, DNA易保存(Novitsky, 1986)。其次, 洗脱的DNA可直接进行扩增测序, 技术上简单易行, 而RNA需反转录成cDNA后才可扩增测序, 且反转录过程由于扩增偏好性, 可能会进一步降低稀有类群的检出效率(Gonzalez et al, 2012)。
4 结论DNA和cDNA测序对水体中纤毛虫分子多样性研究的影响不显著, 而对沉积物中纤毛虫分子多样性影响极显著。沉积物中纤毛虫多样性高于水体, 浅层水中纤毛虫多样性高于深层水。浅层水中纤毛虫对沉积物中纤毛虫多样性评价的影响大于深层水。洗脱DNA测序与cDNA测序结果类似, 可降低水体eDNA对沉积物中的纤毛虫多样性评估的影响, 且洗脱DNA法较之cDNA法操作更简便, 避免了反转录过程导致的偏差, 适用于沉积物中的纤毛虫等真核微生物的分子多样性研究。
致谢 本课题组徐雨博士生采集样品, 在此谨致谢忱。
李洁, 徐奎栋. 2016. 南黄海夏秋季纤毛虫等微小型浮游动物丰度和生物量变动及其与沙海蜇旺发的关系. 海洋与湖沼, 47(3): 612-625 |
宋微波, 沃 伦A, 胡晓钟. 2009. 中国黄渤海的自由生纤毛虫. 北京: 科学出版社, 1-515
|
周百灵, 维妙, 李菊, 等. 2016. 黄海底栖纤毛虫的群落结构与时空变化. 海洋与湖沼, 47(2): 336-345 |
黄平平, 赵峰, 徐奎栋. 2017. 基于形态学与核糖体DNA及其cDNA高通量测序的海洋沉积物中纤毛虫多样性比较. 海洋与湖沼, 48(2): 285-296 |
梁晨, 2019.南大洋不同海区浮游纤毛虫群落研究.青岛: 中国科学院海洋研究所博士学位论文, 83
|
Caporaso J G, Kuczynski J, Stombaugh J et al, 2010. QIIME allows analysis of high-throughput community sequencing data. Nature Methods, 7(5): 335-336 DOI:10.1038/nmeth.f.303 |
Chen W D, Pan Y B, Yu L Y et al, 2017. Patterns and processes in marine microeukaryotic community biogeography from Xiamen coastal waters and intertidal sediments, southeast China. Frontiers in Microbiology, 8: 1912 DOI:10.3389/fmicb.2017.01912 |
Corinaldesi C, Danovaro R, Dell'Anno A, 2005. Simultaneous recovery of extracellular and intracellular DNA suitable for molecular studies from marine sediments. Applied and Environmental Microbiology, 71(1): 46-50 |
Doherty M, Tamura M, Vriezen J A C et al, 2010. Diversity of oligotrichia and choreotrichia ciliates in coastal marine sediments and in overlying plankton. Applied and Environmental Microbiology, 76(12): 3924-3935 |
Edgar R C, Haas B J, Clemente J C et al, 2011. UCHIME improves sensitivity and speed of chimera detection. Bioinformatics, 27(16): 2194-2200 DOI:10.1093/bioinformatics/btr381 |
Fenchel T, 2008. The microbial loop-25 years later. Journal of Experimental Marine Biology and Ecology, 366(1-2): 99-103 DOI:10.1016/j.jembe.2008.07.013 |
Forster D, Dunthorn M, Mahé F et al, 2016. Benthic protists:the under-charted majority. FEMS Microbiology Ecology, 92(8): fiw120 DOI:10.1093/femsec/fiw120 |
Gimmler A, Korn R, De Vargas C et al, 2016. The Tara Oceans voyage reveals global diversity and distribution patterns of marine planktonic ciliates. Scientific Reports, 6: 33555 |
Gong J, Dong J, Liu X H et al, 2013. Extremely high copy numbers and polymorphisms of the rDNA operon estimated from single cell analysis of oligotrich and peritrich ciliates. Protist, 164(3): 369-379 DOI:10.1016/j.protis.2012.11.006 |
Gonzalez J M, Portillo M C, Belda-Ferre P et al, 2012. Amplification by PCR artificially reduces the proportion of the rare biosphere in microbial communities. PLoS One, 7(1): e29973 DOI:10.1371/journal.pone.0029973 |
Haas B J, Gevers D, Earl A M et al, 2011. Chimeric 16S rRNA sequence formation and detection in Sanger and 454-pyrosequenced PCR amplicons. Genome Research, 21(3): 494-504 DOI:10.1101/gr.112730.110 |
Lara E, Berney C, Harms H et al, 2007. Cultivation-independent analysis reveals a shift in ciliate 18S rRNA gene diversity in a polycyclic aromatic hydrocarbon-polluted soil. FEMS Microbiology Ecology, 62(3): 365-373 DOI:10.1111/j.1574-6941.2007.00387.x |
Li G H, Su L, Zhang Q Q et al, 2019. Molecular diversity and biogeography of benthic ciliates in the Bohai Sea and Yellow Sea. Acta Oceanologica Sinica, 38(2): 78-86 DOI:10.1007/s13131-018-1236-y |
Liu H X, Shen P P, Li C H et al, 2016. Composition and distribution of planktonic ciliates in the southern South China Sea during late summer:comparison between surface and 75 m deep layer. Journal of Ocean University of China, 15(1): 171-176 DOI:10.1007/s11802-016-2712-7 |
Liu Y, Song S Q, Chen T T et al, 2017. The diversity and structure of marine protists in the coastal waters of China revealed by morphological observation and 454 pyrosequencing. Estuarine, Coastal and Shelf Science, 189: 143-155 DOI:10.1016/j.ecss.2017.03.019 |
Magoč T, Salzberg S L, 2011. FLASH:fast length adjustment of short reads to improve genome assemblies. Bioinformatics, 27(21): 2957-2963 DOI:10.1093/bioinformatics/btr507 |
Massana R, Gobet A, Audic S et al, 2015. Marine protist diversity in European coastal waters and sediments as revealed by high-throughput sequencing. Environmental Microbiology, 17(10): 4035-4049 |
Meng Z C, Xu K D, Dai R H et al, 2012. Ciliate community structure, diversity and trophic role in offshore sediments from the Yellow Sea. European Journal of Protistology, 48(1): 73-84 DOI:10.1016/j.ejop.2011.08.001 |
Novitsky J A, 1986. Degradation of dead microbial biomass in a marine sediment. Applied and Environmental Microbiology, 52(3): 504-509 DOI:10.1128/AEM.52.3.504-509.1986 |
Penton C R, Gupta V V S R, Yu J L et al, 2016. Size matters:assessing optimum soil sample size for fungal and bacterial community structure analyses using high throughput sequencing of rRNA gene amplicons. Frontiers in Microbiology, 7: 824 |
Ranjard L, Lejon D P H, Mougel C et al, 2003. Sampling strategy in molecular microbial ecology:influence of soil sample size on DNA fingerprinting analysis of fungal and bacterial communities. Environmental Microbiology, 5(11): 1111-1120 DOI:10.1046/j.1462-2920.2003.00521.x |
Stock A, Edgcomb V, Orsi W et al, 2013. Evidence for isolated evolution of deep-sea ciliate communities through geological separation and environmental selection. BMC Microbiology, 13: 150 DOI:10.1186/1471-2180-13-150 |
Stoeck T, Bass D, Nebel M et al, 2010. Multiple marker parallel tag environmental DNA sequencing reveals a highly complex eukaryotic community in marine anoxic water. Molecular Ecology, 19(S1): 21-31 |
Torti A, Lever M A, Jørgensen B B, 2015. Origin, dynamics, and implications of extracellular DNA pools in marine sediments. Marine Genomics, 24: 185-196 DOI:10.1016/j.margen.2015.08.007 |
Tucker S J, McManus G B, Katz L A et al, 2017. Distribution of abundant and active planktonic ciliates in coastal and slope waters off New England. Frontiers in Microbiology, 8: 2178 DOI:10.3389/fmicb.2017.02178 |
Xin M, Ma D Y, Wang B D, 2015. Chemicohydrographic characteristics of the Yellow Sea Cold Water Mass. Acta Oceanologica Sinica, 34(6): 5-11 DOI:10.1007/s13131-015-0681-0 |
Xu D P, Li R, Hu C et al, 2017. Microbial eukaryote diversity and activity in the water column of the South China Sea based on DNA and RNA high throughput sequencing. Frontiers in Microbiology, 8: 1121 |
Zhao F, Filker S, Xu K D et al, 2017. Patterns and drivers of vertical distribution of the ciliate community from the surface to the abyssopelagic zone in the Western Pacific Ocean. Frontiers in Microbiology, 8: 2559 DOI:10.3389/fmicb.2017.02559 |
Zhou B L, Xu K D, 2016. Spatiotemporal variation in community structure of marine benthic ciliates in the Yellow Sea during and after macroalgal and giant jellyfish blooms. Chinese Journal of Oceanology and Limnology, 34(4): 629-641 |
 2020, Vol. 51
2020, Vol. 51


