
中国海洋湖沼学会主办。
文章信息
- 王广策, 王辉, 高山, 郇丽, 王旭雷, 顾文辉, 解修俊, 张建恒, 孙松, 于仁成, 何培民, 郑阵兵, 林阿朋, 牛建峰, 王立军, 张宝玉, 沈颂东, 卢山. 2020.
- WANG Guang-Ce, WANG Hui, GAO Shan, HUAN Li, WANG Xu-Lei, GU Wen-Hui, XIE Xiu-Jun, ZHANG Jian-Heng, SUN Song, YU Ren-Cheng, HE Pei-Min, ZHENG Zhen-Bing, LIN A-Peng, NIU Jian-Feng, WANG Li-Jun, ZHANG Bao-Yu, SHEN Song-Dong, LU Shan. 2020.
- 绿潮生物学机制研究
- STUDY ON THE BIOLOGICAL MECHANISM OF GREEN TIDE
- 海洋与湖沼, 51(4): 789-808
- Oceanologia et Limnologia Sinica, 51(4): 789-808.
- http://dx.doi.org/10.11693/hyhz20200300078
文章历史
-
收稿日期:2020-03-17
收修改稿日期:2020-04-29
2. 青岛海洋科学与技术试点国家实验室 海洋生物学与生物技术功能实验室 青岛 266237;
3. 中国科学院海洋研究所 海洋生态与环境科学重点实验室 青岛 266071;
4. 中国科学院海洋大科学研究中心 青岛 266071;
5. 上海海洋大学 海洋生态与环境学院 上海 201306;
6. 苏州大学 医学部基础医学与生物科学学院 苏州 215123;
7. 南京大学 生命科学学院 南京 210023
2. Laboratory for Marine Biology and Biotechnology, Pilot National Laboratory for Marine Science and Technology(Qingdao), Qingdao 266237, China;
3. Key Laboratory of Marine Ecology and Environmental Sciences, Institute of Oceanology, Chinese Academy of Sciences, Qingdao 266071, China;
4. Center for Ocean Mega-Science, Chinese Academy of Sciences, Qingdao 266071, China;
5. College of Marine ecology and Environment, Shanghai Ocean University, Shanghai 201306, China;
6. School of Biology & Basic Medical Sciences, Soochow University, Suzhou 215123, China;
7. School of Life Sciences, Nanjing University, Nanjing 210023, China
绿潮(Green tide)是由浒苔等石莼属海藻引发的海洋藻华现象, 对近海环境、滨海旅游和水产养殖等均有严重的负面影响。因此, 绿潮与海洋赤潮类似, 是一种近海生态灾害。半个多世纪以来, 绿潮在全球不同海域时有暴发(Smetacek et al, 2013)。自2007年至今, 我国黄海海域每年均有绿潮暴发, 其规模之大, 对近海生态环境影响之深, 世所罕见; 尤其2008年春夏之交, 时值2008年奥运会前夕, 青岛海域暴发大面积绿潮, 威胁奥帆赛的如期举行, 举世关注(Liu et al, 2009)。为此, 国家启动了相关研究计划, 组织了涉海科研机构, 对黄海绿潮进行了多学科和多视角的系统研究, 取得了重要进展, 为黄海绿潮的综合防控提供了科学基础。
黄海绿潮暴发后, 中国科学院海洋研究所充分发挥自身多学科交叉融合的优势, 在传统优势学科——藻类学的基础上, 组织了物理海洋和生态环境等学科的研究单元和相关专家, 通过现场调查和实验室模拟重现等技术手段, 在宏观层面(绿潮源头、漂移路径以及绿潮发生发展规律等)和微观层面(浒苔生理生化过程对环境因子的响应策略等)上开展了系统深入的研究, 科学认知了绿潮早期发生和发展的海洋学过程, 揭示了绿潮的危害效应, 提出了浒苔引发绿潮的生物学机制等。这些研究结果与国内其他兄弟单位的绿潮研究结果相互补充, 相互印证, 在黄海绿潮的溯源、成因物种的确定、绿潮的监控与预警以及绿潮生物量的处置利用等方面取得了重要进展, 为保障“奥帆赛”和“上海合作组织青岛峰会”等一系列重要活动在青岛顺利举办做出了贡献。
绿潮的发生、发展过程极其复杂, 涉及多种海洋学过程, 需要多学科协作, 在不同层次上从多角度开展系统研究, 才有可能阐明绿潮发生机制。尽管如此, 其核心原因仍是绿潮的成因物种——浒苔形成的漂浮“藻席”快速形成巨大生物量, 即何种环境因子触发了浒苔快速增殖的“开关”, 从而形成绿潮。
如果以石莼属(Ulva)海藻为主题对主要数据库进行检索, 就可发现石莼属海藻的研究工作呈现以下特点: (1)黄海绿潮的暴发使石莼属海藻的研究得到高度重视, 相关论文的数量大幅增加; 中国学者发表的研究论文主要集中在绿潮成因种浒苔, 欧美等国学者的研究则呈现多样性, 包括浒苔以外的石莼属物种。(2)在黄海绿潮暴发前, 石莼属海藻的研究主要聚焦在基础生物学方面, 研究论文主要来自欧美等国。(3)黄海绿潮暴发后, 石莼属海藻的研究以浒苔为主, 研究内容与绿潮暴发相关, 涉及学科主要为生态环境, 论文主要来自中国学者。由此可见, 2007年黄海绿潮的暴发使中国科学界充分认识到大型海藻与近海生态环境之间关系密切, 并先后启动多个重点项目, 从不同的角度开展系统研究(王宗灵等, 2018; 颜天等, 2018)。
最近, 我们根据已有的研究结果, 结合历年海洋环境变化的趋势, 提出了绿潮暴发时浒苔快速繁殖与海洋环境演变之间的协同关系(Wang et al, 2020)。本文以此为主轴, 介绍浒苔生活史、细胞对环境因子(生物因子和非生物因子)的响应及其无机碳转化途径等方面的研究进展, 并进一步阐述浒苔孢子囊形成及其与绿潮生物量剧增之间的联系, 同时对今后绿潮研究提出一些初步建议。本文试图展示绿潮形成的过程及其生物学机制, 内容或只是我国绿潮研究成果的沧海之一粟, 所提出的一些观点和理论模型有待于进一步的现场调查和实验验证。
1 浒苔生活史浒苔隶属绿藻门, 是一种大型多细胞藻类, 过去被单列为浒苔属, 拉丁学名为Enteromorpha, 包括两个字节entero和morpha, 前者表示为“肠”, 后者意为“形状”, 所以该属海藻的共同特点为肠形管状结构。Hayden等(2003)应用分子生物学对石莼科海藻进行系统学分析, 认为浒苔属(Enteromorpha)不能单列为一个属, 应归于石莼属(Ulva)。因此, 浒苔的拉丁学名就由原来的Enteromorpha prolifera修订为现在的Ulva prolifera, 目前发表的研究论文普遍采用该拉丁名, 表明浒苔隶属于石莼属的观点得到了普遍认可。
1.1 浒苔生活史简介中国科学院海洋研究所建所伊始就将藻类学作为重点研究方向, 在经济海藻栽培生物学基础以及海藻化学等研究领域取得了系列成果, 享誉国内外。就浒苔而言, 早在20世纪60年代初由曾呈奎等编著的《中国经济海藻志》(曾呈奎等, 1962)一书中就已经对此作了系统介绍, 认为浒苔盛产于闽南海区, 其中文名称沿用了闽南的俗名。该书将浒苔归于浒苔属(Enteromorpha), 但是描述浒苔的异名却为Ulva prolifera, 与Hayden等(2003)对浒苔拉丁学名的订正不谋而合, 说明浒苔单独作为一个属长期存在争议, 也表明海洋研究所早在半个多世纪前对浒苔就有系统认知。
浒苔引发的绿潮表现为其生物量的爆炸式增长, 这个过程发生在浒苔处于海面漂浮状态时, 一方面由于漂浮浒苔生长速度明显加快(丁月旻, 2014), 另一方面取决于浒苔的快速繁殖(Li et al, 2014), 其中后者更为关键。要认识这个过程, 就需有明晰的浒苔生活史描述, 涉及两个关键科学问题: (1)漂浮浒苔生物量快速积累时, 优势藻体是单倍配子体, 还是二倍孢子体?抑或二者等量存在?由此引申的问题就是漂浮藻体究竟产生的是孢子, 还是配子?(2)是什么关键因子触发了浒苔快速繁殖的“开关”, 使其生活史加速运转?要回答这些问题, 我们首先需了解浒苔生活史的研究进展情况。
综述现有文献, 2007年以前对浒苔生活史研究的论文相对较少, 但是研究的较为详细和深入, 对认识浒苔繁殖过程具有重要的参考价值, 其中代表性文献主要有Fritsch (1935)编著的《The structure and reproduction of the algae volume Ⅰ》、曾呈奎等(1962)编著的《中国经济海藻志》和崛辉三(1994)编著的《藻类の生活史集成——绿色藻类》等。综合上述文献的观点, 浒苔(石莼)生活史包括二倍的孢子体世代(2N)和单倍的配子体世代(N), 呈现明显的世代交替。成熟的浒苔孢子体与配子体均为中空管状藻体, 存在明显的主枝与分枝, 孢子体与配子体在形态上无法区分, 且均能独立生存, 因此为同型世代交替。浒苔孢子体通过减数分裂形成孢子囊, 产生孢子(N), 孢子无需相互结合, 可以直接附着到基质上, 发育为形态完全一致的雌雄配子体, 二者比例为1︰1。雌雄配子体分别通过有丝分裂产生雌雄配子。无论雌配子还是雄配子, 均可以分为两类, 一类具有趋光性, 雌雄配子相互结合后形成合子, 合子附着到基质后萌发形成新一代的孢子体; 另一类配子不具有趋光性, 沉底后通过单性生殖萌发形成新的配子体(Liu et al, 2015)。可以相互结合形成合子的雌雄配子之所以需有趋光性, 是因为雌雄配子只有趋光游到海面, 使得配子的活动范围从三维空间转变为二维平面, 雌雄配子的配对几率才会增加(Togashi et al, 1999)。形成的合子有4根鞭毛, 具负趋光性, 附着到基质后萌发形成新的孢子体。至此, 浒苔生活史可以描述为:孢子体→孢子→雌雄配子体→雌雄配子→合子→新的孢子体, 雌雄配子通过单性生殖产生新的雌雄配子体(Hiraoka et al, 2003)。
由此可见, 浒苔生活史中有三种多细胞形态和三种单细胞形态。多细胞形态分别为孢子体和雌、雄配子体, 单细胞形态则分别为孢子和雌、雄配子。三种多细胞形态的个体几乎完全一致, 很难区分。三种单细胞形态均带有鞭毛, 其中孢子有4根鞭毛, 配子有2根鞭毛。此外, 浒苔生活史包含三种生殖方式, 分别为无性生殖、有性生殖和单性生殖(也称孤雌生殖)(Lin et al, 2008)。以上为营固着生长浒苔的生活史, 对认识浒苔的生物学特征有重要的意义。然而, 如果用来解释漂浮浒苔生物量剧增时的繁殖过程, 就会遇到如下新的问题。
1.2 漂浮浒苔的藻体处于生活史哪个阶段?假定在浒苔生活史的一个周期内由孢子体产生的孢子和由雌雄配子体产生的雌雄配子的存活率一致, 具有负趋光性的配子均能寻找到合适的附着基质并发育为成体, 具有正趋光性的雌雄配子相互结合的概率是100%, 那么产生多细胞个体的比例为1(孢子体)︰1(雄配子体)︰1(雌配子体), 孢子体与配子体的比例为1︰2。然而, 在自然海域中, 不具有趋光性的配子寻找到合适基质附着的概率要远远高于雌雄配子之间的结合概率。此外, 产生配子体的来源有两个, 分别是来自孢子体减数分裂产生的减数孢子和配子体产生的不具有趋光性的配子, 雌雄配子体均是如此, 但是产生孢子体的来源只有具有正趋光性的雌雄配子结合产生的合子, 而且在自然界中雌雄结合的概率并不高。因此, 随着浒苔生活史循环的增加, 配子体的比例会进一步加大, 孢子体的比例进一步减少。据此推断, 漂浮浒苔应该是配子体占绝对优势。
然而, 上海海洋大学何培民和张建恒研究团队发现在绿潮的形成期、快速增长期和平稳期(4—6月份)漂浮浒苔基本为孢子体, 很难发现配子体(Zhao et al, 2019)。该团队首次对浒苔细胞进行了核型分析, 发现浒苔孢子体有18条染色体, 配子体有9条染色体。因此, 用细胞核型分析的方法鉴定浒苔的倍性, 证明漂浮浒苔是孢子体, 可以客观地反映漂浮浒苔的真实状况。该团队进一步将不同时期漂浮浒苔的孢子体在实验室中进行培养, 发现这些孢子体能够产生四鞭毛孢子, 孢子可以发育成为配子体并能够产生双鞭毛雌雄配子, 因而认为黄海绿潮暴发期间漂浮浒苔应该具有典型的有性繁殖生活史特征。既然漂浮浒苔具有典型的有性繁殖生活史, 就应该存在大量的配子体, 为何多次采集的样本中均未发现配子体的存在?该团队认为可能的原因有两点: (1)黄海绿潮暴发期间浒苔孢子体具有超长的生长期, 可达35.7天, 而普通海域的浒苔藻体只能维持不到一周; (2)与浒苔孢子体与配子体在黄海绿潮暴发期间的生存率差异有关, 黄海绿潮暴发期间漂浮浒苔的合子与孢子萌发率分别为91.67%和80.29%, 而配子萌发率为30%, 前者是后者的3倍, 意味着浒苔孢子体要多于配子体(Cui et al, 2018)。然而, Zhang等(2013)却发现在江苏如东海岸所采集的浒苔样本中孢子萌发率为96.1%, 配子萌发率为91.6%, 二者相差无几。
尽管Zhao等(2019)对漂浮浒苔的倍性鉴定方法科学合理, 也是目前最令人信服的研究结果, 但是文章中并没有给出浒苔样本的采集信息包括采样点的情况等。同时, Liu等(2015)根据繁殖细胞的鞭毛数量对采集的浒苔样本进行生活史研究, 发现漂浮浒苔既有四鞭毛繁殖细胞, 又有两鞭毛繁殖细胞, 似乎没有明显的规律可循。因此, 漂浮浒苔的藻体究竟处于生活史哪个阶段仍然没有明确的答案。
1.3 漂浮浒苔单细胞阶段的孢子和配子能以鞭毛数量作为鉴别标准吗?目前鉴别浒苔孢子和配子的方法主要包括: (1)根据繁殖细胞的大小, 浒苔孢子平均长为10.5μm, 宽为4.7μm; 雌配子平均长为6.7μm, 宽为4.1μm; 雄配子平均长为6μm, 宽为3.4μm, 即孢子 > 雌配子 > 雄配子(Cui et al, 2018); (2)基于繁殖细胞鞭毛的数量, 带有四根鞭毛的为孢子, 来源于孢子体的减数分裂, 所以有时也称之为减数孢子; 带有2根鞭毛的为配子, 来源于配子体的有丝分裂。对孢子体和配子体的判定也是主要基于产生单细胞繁殖细胞的鞭毛数量, 产生2根鞭毛的为配子体, 产生4根鞭毛的为孢子体。比较以上两种方法可以看出, 第一种方法在实际操作过程中很难判断, 所以一般还是基于鞭毛的数量, 比较直观。然而, 如果对单细胞阶段的孢子和配子判断错误, 将会给浒苔生活史的研究带来极大的混乱。因此, 我们需要认真考虑如何鉴别孢子和配子。
Zhao等(2019)对黄海海域的漂浮浒苔进行核型分析后确认其为孢子体, 包括有性生活史和无性生活史两种类型。该孢子体既可以产生4根鞭毛的繁殖细胞, 又可以产生2根鞭毛的繁殖细胞; 4根鞭毛的繁殖细胞均为负趋光性, 而2根鞭毛的繁殖细胞一部分具负趋光性, 另一部分具正趋光性。这些繁殖细胞附着萌发后可以发育为新一代孢/配子体。该研究结果对传统的以鞭毛数量来鉴定单细胞类型的观点带来了挑战。实际上, 早在2003年Hiraoka等(2003)从日本四国地区的四条河流中采集的约500个浒苔样本中, 就发现与Zhao等(2019)类似的现象。他们将处于相同细胞周期的浒苔细胞进行DNA精确定量, 以判断染色体的倍性, 发现浒苔孢子体分别可以形成2根鞭毛和4根鞭毛的孢子, 这些孢子均为二倍体, 萌发后发育为孢子体。即便在同一水域中采集的浒苔藻体, 均有类似的情况, 由此他们认为可能是孢子体世代失去减数分裂能力, 与环境条件关系不大(Hiraoka et al, 2003)。Liu等(2015)发现浒苔的配子体既可以产生2根鞭毛的配子, 也可以产生4根鞭毛的减数孢子。也就是说, 浒苔2根鞭毛的繁殖细胞有两个发育方向, 要么经由单性生殖发育为配子体, 其后代产生的繁殖细胞均为双鞭毛; 要么发育为孢子体, 其后代产生4根鞭毛的减数孢子。因此, 基于鞭毛数量的方法来判断孢子和配子, 进而鉴定孢子体和配子体仍然存在一些不确定性。
真核生物的鞭毛是一种细胞表面突起的亚细胞结构, 和细胞分裂呈负相关。在细胞间期中心粒逐渐演化为基体, 再由基体组装微管形成鞭毛(纤毛)(潘俊敏, 2008)。因此, 针对浒苔生活史中单细胞阶段具有2根鞭毛或者4根鞭毛的现象, 我们认为有以下两种可能。
(1) 2根鞭毛的繁殖细胞来自浒苔孢子体细胞的有丝分裂。有丝分裂过程中负责纺锤体形成的中心体(含两个相互垂直的中心粒)在分裂后期到达子细胞的端部形成了基体, 基体产生了2根鞭毛。4根鞭毛的孢子来源于浒苔细胞的减数分裂。第一次减数分裂后接着进行了第二次减数分裂, 但第二次减数分裂只完成了核分裂, 胞质并未分裂, 所以纺锤体两端的中心体中各形成两个基体, 产生4根鞭毛。
(2) 在衣藻中有丝分裂后的子细胞两端各有中心粒, 但是每个中心粒旁还有一个发育不成熟的幼中心粒, 一般保持沉默, 只有在环境因子的刺激下才能成熟并发育为鞭毛的基体。如果在浒苔单细胞阶段中子细胞的两端均存在这种幼中心粒, 一旦受激成熟, 则子细胞可以形成4根鞭毛; 若其不成熟, 则子细胞只有2根鞭毛。
如果第一种可能是正确的, 则具有4根鞭毛的孢子是减数分裂的产物, 附着后发育形成配子体(单倍体), 但是4根鞭毛的孢子本身是二倍的, 因为该孢子只完成了第一次减数分裂, 第二次减数分裂在细胞附着到基质后才开始(Wichard et al, 2015), 因此仍然是二倍染色体。这种现象与紫菜壳孢子的形成过程非常类似。由此, 以鞭毛数量可以正确判断繁殖细胞的类型, 即2根鞭毛为配子, 4根鞭毛为减数孢子。这种可能的最大问题是, 在4鞭毛减数孢子的形成过中第一次减数分裂时子细胞的两个基体应该在两端, 如何汇聚到细胞的一端, 形成4根顶生鞭毛?如果第二种可能是正确的, 则不能以鞭毛的数量来判定繁殖细胞的类型, 究竟是2根鞭毛还是4根鞭毛, 完全取决于环境条件能否促进幼中心粒的成熟。这种可能的挑战是, 浒苔繁殖细胞鞭毛的数量似乎有一定的规律性, 尚未发现环境条件可以改变鞭毛的数量。因此, 尽管在上个世纪对浒苔生活史基本形成定论, 但是仍需进行系统研究, 并进一步完善。
1.4 浒苔生活史的理论补遗众所周知, 研究一个物种的生活史极其复杂和困难, 而且非常耗时, 所以在前人已有工作的基础上, 参照相近物种的生活史, 在理论上提出方案, 具有事半功倍的效果。此外, 研究某一物种生活史时, 最合适的方案是使该物种的个体在实验室自然形成繁殖细胞, 并由繁殖细胞形成新的个体; 如果人为干预这个过程, 研究结果就有可能会出现一定的偏差。
就浒苔生活史而言, 目前的基本框架正确无疑, 但一些关键步骤尚存在一些遗漏或者不足, 需进一步完善。为此, 我们将浒苔生活史与一些相关物种进行比较分析, 在理论上描述了一个相对完整的生活史过程(图 1)。该生活史的描述仅仅基于理论想定, 正确与否, 有待更多的实验验证。
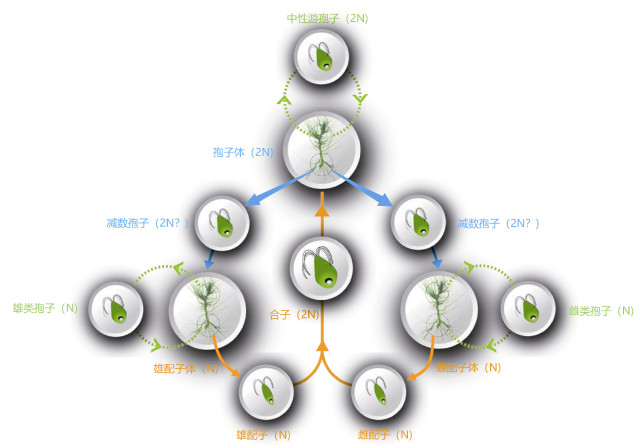 |
| 图 1 浒苔生活史的理论模型 Fig. 1 The theoretical model of the life cycle of U. prolifera |
(1) 浒苔孢子体阶段应该有自我补充机制, 也就是说产生新孢子体的来源有两个, 一个是雌雄配子结合形成合子, 合子萌发形成新的孢子体; 另一个是部分孢子体细胞分化形成“中性游孢子囊”, 成熟后释放中性游孢子(日语称之为中性游走子), 附着后萌发而成。孢子体的部分细胞通过减数分裂形成孢子囊, 成熟后产生减数孢子, 附着萌发后成长为配子体。因此, 浒苔孢子体可形成两种孢子囊, 产生两种繁殖细胞。这两种孢子囊在孢子体中产生的部位和释放孢子的时间可能不同, 也可能相同。与减数孢子囊不同, 中性游孢子囊的形成无需经过减数分裂, 表现出对环境胁迫较强的耐受性。这样就可以很好地解释了Zhao等(2019)所发现的漂浮浒苔自始至终均为孢子体占优势的原因。实际上, 在崛辉三(1994)编著的《藻类の生活史集成——绿色藻类》中对缘管浒苔(Ulva linza)孢子体的描述中也有提及。Hiraoka等(2003)和Zhao等(2019)也分别报道了浒苔孢子体可以产生两类孢子, 具有自我补充机制。
(2) 与孢子体类似, 浒苔的配子体也可以产生两类繁殖细胞, 一类是专用于结合形成合子的配子, 另一类则是用于实现自我补充的类孢子。也就是说, 浒苔配子体在不同的部位分别形成配子囊和类孢子囊, 分别释放配子和类孢子。配子囊和类孢子囊成熟的时间或者不同, 或者相同。这种理论想定的佐证是条斑紫菜单孢子囊的形成及其释放。条斑紫菜的叶状体也是单倍体, 在幼苗阶段, 其边缘部位会产生大量的单孢子囊, 释放单孢子。条斑紫菜单倍叶状体的单孢子就类似于浒苔配子体的类孢子。条斑紫菜在采苗生产时, 尽管起初采的壳孢子苗非常稀少, 但是在海上养殖时苗帘上很快会长出单孢子苗, 而且与壳孢子苗相比单孢子苗占优势。条斑紫菜单倍叶状体生长到晚期时边缘部分形成精子囊和果胞, 类似于浒苔的配子囊。我们可以做一类比:条斑紫菜单倍叶状体是单层细胞, 浒苔也是单层细胞; 条斑紫菜单倍叶状体在幼苗阶段可以产生单孢子以实现单倍叶状体的自我补充, 浒苔也应该可形成类孢子, 产生新的配子体; 条斑紫菜单倍叶状体可以产生三类繁殖细胞(单孢子、精子和果胞), 浒苔配子体也有可能形成两类繁殖细胞——类孢子和配子。虽然浒苔和条斑紫菜分属绿藻和红藻, 但是二者的生态位一致。特别值得一提的是, 条斑紫菜单孢子囊的形成也具有空间效应, 这与浒苔非常相似。据梅俊学等(2000)报道, 成熟的条斑紫菜叶状体不能形成单孢子囊, 但是一旦将其切成毫米级的碎片, 则恢复了释放单孢子的特性。浒苔的碎片极其容易形成孢子囊, 而且形成的比例与大小负相关(Gao et al, 2010)。
综上所述, 浒苔生活史中多细胞阶段的个体可以产生两类繁殖细胞, 一类用于倍性转换(二倍孢子体和单倍配子体之间的相互转化), 另一类则用于个体的自我补充(图 1)。用于倍性转换的繁殖细胞包括由孢子体产生的减数孢子和由配子体产生的配子; 用于个体自我补充的繁殖细胞包括由孢子体产生的中性孢子和由配子体产生的类孢子。减数孢子虽然是源自细胞的减数分裂, 但其只完成了第一次减数分裂, 第二次减数分裂尚未开始, 所以其染色体倍性仍为二倍。类孢子就是一些文献中所述的具负趋光性的“配子”。过去一般认为负趋光性的“配子”通过孤雌生殖(单性生殖)的方式实现配子体的自我补充。实际上, 虽然孤雌生殖在低等生物中普遍存在, 但是一般发生的概率很低, 不可能成为主要的繁殖方式, 否则就违背了生物进化的主要方向。尽管我们提出的浒苔生活史很多地方只是理论想定, 但是只要按照该描述, 目前出现的浒苔生活史中一些难以回答的问题均可迎刃而解。
2 漂浮浒苔的生长与繁殖系统研究浒苔生活史是明晰浒苔形成绿潮机制的基础, 解析漂浮浒苔生物量快速积累的过程及其与环境因子的互作关系是绿潮研究的重点。浒苔本来在潮间带营固着生活, 人类活动等因素导致其漂浮在海面上, 形成漂浮“藻席”。开始时漂浮“藻席”的生物量很少, 但是随着海流漂浮“藻席”中的浒苔快速生长繁殖, 逐渐形成绿潮(范士亮等, 2012)。绿潮的形成涉及两个过程, 一是浒苔生长速度明显加快, 二是浒苔的繁殖超快进行。前者的关键限制因子是生长过程中营养元素的供给。假定在富营养化的条件下海水中有充足的氮磷等元素供给, 漂浮浒苔生长的限制因素就是海水中的溶解无机碳(DIC), 因为浒苔快速生长导致海水中DIC消耗大幅增加。后者主要是繁殖细胞的快速形成与释放, 主要是营养细胞向孢子囊分化的速度加快。无论是浒苔的快速生长, 还是其孢子囊的加速形成与释放, 都涉及与环境因子的相互作用。因此, 本节重点阐述浒苔的生长与繁殖, 将漂浮“藻席”中浒苔对环境因子(尤其是胁迫因子)的响应单列一节介绍。
2.1 漂浮浒苔可以直接利用空气中的CO2绿潮形成的前期、中期和后期, 浒苔形成的“藻席”漂浮在海面上, 导致水气交换速率大幅下降, 甚至消失, 所以海水中的DIC浓度快速下降, 浒苔生长过程所需的大量无机碳从何而来?要回答这个问题, 只能在实验室进行, 进而解析其机理。
众所周知, 在高等植物和真核藻类中负责光合固碳的酶主要是1, 5-二磷酸核酮糖羧化/加氧酶(Rubisco), 该酶只能与CO2或者O2结合; 在CO2分压高时, 执行固碳功能。高等植物光合固碳的无机碳源是空气中的CO2, 因为高等植物叶片有蜡质层和角质层, CO2分子只能通过叶片上的气孔进入叶肉层。对于海藻, 光合固碳的无机碳源主要是海水中的DIC, 包括HCO3-、CO32-和CO2三种形式, 浓度分别为1.8、0.35mmol/L以及0.01—0.02mmol/L, 以HCO3-为主, 所以海藻光合固碳的无机碳源主要是HCO3- (何培民等, 2005; 徐军田等, 2013; 高秀秀等, 2015)。与高等植物不同, 海藻没有蜡质层和角质层, HCO3-可以通过离子交换或者碳酸酐酶(CA)催化由胞外进入胞内。海藻在固定HCO3-时, 首先需将其转化为CO2分子, 才能与Rubisco结合。HCO3-进入胞质后首先与磷酸烯醇式丙酮酸(PEP)反应形成草酰乙酸(OAA), OAA转移至叶绿体脱羧释放CO2, 消耗1个ATP分子, 同时胞质中PEP的补充也需要1个ATP分子(Badger et al, 1994)。因此, 与高等植物直接利用CO2相比, 海藻利用HCO3-需要多消耗2个ATP分子。
综上所述, 对于快速生长的海藻而言, HCO3-不是一个经济的光合固碳原料。冯子慧等(2012)报道了将湿浒苔暴露在空气中, 浒苔细胞可直接利用空气中CO2分子, 1个光周期内其光合固碳速率约为46.14 mg/(g·d)。与此相比, 浒苔在海水中利用HCO3-的光合固碳速率仅为10.92mg/(g·d), 浒苔利用空气中CO2的光合固碳速率是利用海水中HCO3-的4.23倍。如果仅仅将浒苔暴露在空气中, 短时间内浒苔表面含有海水层, 空气中的CO2通过水层进入细胞, 实际上有相当一部分CO2分子转变为HCO3-, 浒苔细胞固定的碳源是CO2和HCO3-的混合物。如果是将浒苔长时间暴露在空气中, 一旦严重失水, 光合固碳过程将停止。邹定辉(2001)也认为, 气生状态下浒苔的固碳速率受其脱水程度的影响, 脱水率越高, 固碳速率越低。
浒苔光合活性测定和蛋白质组学分析结果也支持了上述结论。Huan等(2016)报道, 浒苔在盐度为60或含水量为~80%和~60%时, 光系统Ⅱ的活性与CO2浓度呈正相关, 说明此时藻体具备利用空气中CO2的能力; 蛋白质组学结果发现, 当盐度为60时碳固定相关蛋白与对照相比没有发生显著变化, 显示藻体在遭受适度胁迫时卡尔文循环并未受到显著影响, CO2同化速率主要受限于CO2浓度。然而, 在藻体遭受严重的高盐胁迫或是失水胁迫时(盐度90、120或含水量~40%、~20%), 浒苔光系统Ⅰ和光系统Ⅱ的活性基本不受CO2浓度的影响, 此时卡尔文循环受到限制, CO2浓度已不再是碳同化作用的主要限制因素(Huan et al, 2016)。这些结果表明, 在适度胁迫条件下浒苔藻体可以利用空气中的CO2进行光合作用。
绿潮暴发时, 浒苔形成大片“藻席”漂浮在海面上, 上部藻体暴露在空气中, 由于毛细作用和海浪的拍打, 这部分藻体基本处于湿润状态(含水量不低于60%)。此外, 浒苔藻体是中空管状结构, 具有一定的保水优势, 不易产生严重脱水现象(郭赣林等, 2008)。因此, 这部分藻体可以直接利用空气中的CO2进行光合作用, 而且效率远高于浸没在海水中的浒苔藻体。这也解释了成体漂浮浒苔超快生长的原因(平均日生长率高达28%-56%)(Hiraoka et al, 2008; Liu et al, 2010; Cui et al, 2015)。
2.2 浒苔处于漂浮状态时有利于孢子囊的快速形成如前所述, 漂浮浒苔生物量的剧增与浒苔的快速繁殖密切相关, 也就是漂浮时浒苔可以将营养细胞快速转化为孢子囊, 释放孢子后形成新的藻株。从营养生长的角度来理解, 暴露在空气中的浒苔藻体无阻碍地利用空气中CO2, 进行光合固碳, 但是我们如何来理解漂浮浒苔孢子囊的快速形成?换言之, 究竟什么因素促使漂浮浒苔的营养细胞向孢子囊的转化?
Pearson等(1998)报道了大型海藻二列墨角藻(Fucus distichus)生殖细胞的释放与水动力环境之间的关系, 发现在水流平缓条件下HCO3-浓度显著下降, 生殖细胞的释放显著上升。一般认为, 这种现象是海藻在长期进化过程中对环境的适应, 因为在水流平缓条件下生殖细胞之间相互结合的概率会明显提升, 雌雄异体的海藻尤其如此。与水流湍急相比, 水流平缓时水气交换显著下降, 海水中的HCO3-浓度明显降低。细究其因, 促进二列墨角藻生殖细胞释放的因子要么是水流平缓, 要么是HCO3-浓度下降。Yamagishi等(2003)发现在实验室条件下HCO3-可以促进多核单细胞藓羽藻孢子的形成, 与Pearson等(1998)的结果似乎相反。是物种不同造成二者在繁殖细胞形成过程对HCO3-有不同的需求, 还是在营养细胞向繁殖细胞转化过程的不同阶段对HCO3-有不同的需求?
Wang等(2016)系统研究了浒苔孢子囊形成过程中光合活性的变化及其对无机碳源的需求, 发现浒苔营养细胞向孢子囊转化过程中光系统Ⅱ和光系统Ⅰ的活性变化呈现一定的规律性。如果从浒苔藻体中获得一个微小藻片, 切口处的细胞在60h左右会形成孢子囊, 并开始释放孢子。根据细胞的形态变化, 在显微水平上将从营养细胞向孢子囊的转化过程人为分为两个阶段: 0到48h为阶段Ⅰ, 48h到60h为阶段Ⅱ。阶段Ⅰ在形态上仍是营养细胞, 但其内在的代谢过程已开始了孢子囊的分化, 属于孢子囊形成的前期阶段。阶段Ⅱ已经为孢子囊, 并开始释放孢子。
光合活性测定结果表明, 在阶段Ⅰ浒苔细胞光系统Ⅱ和光系统Ⅰ活性相对稳定, 变化趋势也基本相同, 说明阶段Ⅰ中线性电子传递占整个光合电子传递的主导地位, 环式电子传递活性较弱。如果在这个阶段阻断光合电子传递, 孢子囊将无法形成。然而, 在阶段Ⅱ浒苔细胞的光系统Ⅱ和光系统Ⅰ活性变化趋势出现很大差异, 光系统Ⅱ活性显著下降, 光系统Ⅰ活性却显著上升; 进一步分析两种电子传递路径, 发现线性电子传递大幅下降, 环式电子传递则持续上升。一旦阻断线性电子传递(光系统Ⅱ), 孢子囊的形成不受影响; 但如果阻断环式电子传递, 孢子囊则无法形成(Wang et al, 2016; 王辉, 2017)。
以上研究结果表明: (1)在阶段Ⅰ浒苔孢子囊形成的前期准备阶段, 稳定的光合作用是必要条件。(2)在阶段Ⅱ孢子囊的形成阶段, 光合电子传递路径中质体醌库的氧化还原状态决定着孢子囊能否顺利形成, 处于氧化状态则可形成孢子囊, 处于还原状态则不能形成孢子囊。这与Campbell等(1993)有关质体醌库氧化还原状态可以决定蓝藻藻殖段细胞分化命运的研究结果一致。(3)阶段Ⅰ和阶段Ⅱ不同的光合活性(光系统Ⅱ和光系统Ⅰ的活性)意味着两个阶段的固碳活性有差异, 表现为对无机碳源需求的不同, 因为光合活性尤其是光系统Ⅱ活性与无机碳同化呈正相关(Genty et al, 1989; Cornic et al, 1991; Krall et al, 1992)。
王辉(2017)报道了浒苔孢子囊的形成与无机碳源HCO3-之间的协同关系, 认为在阶段Ⅰ(浒苔为营养细胞)必须有充裕的无机碳源供给, 确保光合作用顺利进行, 为孢子囊的形成提供物质和能量的储备, 否则营养细胞不能转化为孢子囊。这个结果与Yamagishi等(2003)的报道一致。然而, 阶段Ⅱ与阶段Ⅰ正好相反, 如果在阶段Ⅱ减少甚至停止无机碳源的供给, 则形成孢子囊的比例大幅上升; 如果继续供给充足的无机碳源, 则孢子囊的形成比例明显下降(表 1)。这与Pearson等(1998)有关二列墨角藻繁殖细胞的释放情况一致。如果在阶段Ⅰ与阶段Ⅱ均不提供充足的无机碳源, 则基本不能形成孢子囊。
因此, 浒苔营养细胞向孢子囊转化过程中有两个因素起重要作用:质体醌库的氧化还原状态和无机碳源的供给。那么二者关系如何呢?Wang等(2016)认为无机碳源是前提, 在阶段Ⅱ无机碳源的需求减少, 这就使质体醌库处于氧化状态, 促使了孢子囊的形成与释放。
以上我们系统分析了浒苔孢子囊形成过程中的生理变化, 阐明了无机碳源对孢子囊形成过程的影响。这些研究结果对我们理解绿潮形成时漂浮浒苔孢子囊的快速形成有着重要的启示。首先, 漂浮浒苔形成的“藻席”上层藻体暴露在空气中, 空气中的CO2保障了充足的无机碳供给, 阳光的辐照和湿润状态可确保其光合作用的进行, 孢子囊形成过程的阶段Ⅰ可以顺利完成; 由于“藻席”影响了水气交换, 其中下层藻体处于DIC“亏损”状态。其次, 由于海浪的作用“藻席”上层藻体总会有一部分转到了中部或者下部, 使得藻体环境的DIC“亏损”。即便到了夜晚, 浒苔管状结构中的氧气被消耗后藻体下沉, 其呼吸作用会释放CO2, 但是与水气界面中空气CO2进入海水中的量相比微不足道。因此, 藻体到了夜晚DIC仍然处于相对“亏损”状态, 正好促进了阶段Ⅱ孢子囊形成过程。因此, 绿潮发生时浒苔藻体的漂浮状态有利于浒苔孢子囊的形成, 加快了漂浮浒苔的繁殖速度(图 2)。
 |
| 图 2 漂浮浒苔“藻席”阻碍了水气交换, 导致海水DIC浓度降低, “藻席”部分藻体由于海流(或昼夜交替)或者漂浮海面, 或者沉入水中, 藻体所需DIC浓度的“充裕”和“不足”两个阶段交替, 促进了孢子囊的形成 Fig. 2 The "algal mat" of U. prolifera obstructed the exchange between seawater and the air, resulting in the decrease in the DIC concentration of the sea; some of the mass would float on the sea surface or sink into the sea due to the ocean current (or alternation between day and night), which promoted formation of sporangia due to the alternated phases between "abundant" and "insufficient" DIC concentration that required by the thalli |
上述漂浮浒苔有利于孢子囊形成的研究结果有着雄厚的生理生化基础以及海上观察数据的支撑。
王辉(2017)比较分析了浒苔孢子囊形成过程中阶段Ⅰ和阶段Ⅱ的蛋白质组学结果, 发现阶段Ⅰ中的蛋白质组呈现以下变化趋势: (1)抗逆相关蛋白如热休克蛋白家族(Hsp 90、Hsp 70和Hsp 60)以及抗坏血酸过氧化物酶丰度大幅上升, 与Kurtz等(1986)报道的结果一致。(2)细胞骨架蛋白(如微管蛋白和肌动蛋白)明显上调, 为孢子形成提供物质准备, 因为孢子形成尤其鞭毛合成需要大量骨架蛋白。(3)同细胞有丝分裂中心体复制与微管组织中心密切相关的中心体蛋白质在培养48h时上升, 表明孢子囊形成是在48h之后, 即阶段Ⅱ。(4)卡尔文循环相关蛋白(如Rubisco large subunit、Glyceraldehyde-3-phosphate dehydrogenase等)在阶段Ⅰ的0h到24h基本保持稳定。这些研究结果在蛋白质组学水平上说明了阶段Ⅰ是浒苔孢子囊形成的前期准备阶段。
Lin等(2011)详细分析了绿潮暴发期间从南黄海漂浮到青岛的浒苔样本。根据漂浮“藻席”中的浒苔样本中色素含量的不同将其自上而下分为浅绿、中绿和深绿三部分(表 2), 鲜重分别占48%、39%和13%。光合活性测定结果表明, 深绿部分的光合活性最低, 浅绿部分的最高(Lin et al, 2009)。显微观察发现深绿部分的浒苔细胞为营养细胞阶段, 中绿和浅绿部分处于孢子囊形成阶段。若将上述三部分藻体与定生浒苔从营养细胞向孢子囊转化过程进行比较, 可以发现从深绿到浅绿代表了漂浮浒苔从营养细胞向孢子囊的转化过程(图 3, 4)。将这三部分藻体放在实验室里培养, 均可转化为孢子囊, 其中浅绿部分最先形成。这些结果表明绿潮浒苔漂浮到青岛后藻体孢子囊形成比例显著增高。郑阵兵等(2018)报道了漂浮浒苔从南黄海向青岛转移的过程中孢子囊的比例逐渐增加, 与Lin等(2011)的研究结果一致。
| 藻体颜色 | chl a | chl b | 总chl | chl a/chl b |
| 浅绿 | 0.199 ± 0.052 | 0.123 ± 0.039 | 0.322 ± 0.092 | 1.642 |
| 中绿 | 0.228 ± 0.043 | 0.123 ± 0.011 | 0.351 ± 0.048 | 1.858 |
| 深绿 | 0.684 ± 0.116 | 0.453 ± 0.113 | 1.138 ± 0.229 | 1.528 |
| 注:引自(林阿朋, 2010) | ||||
 |
| 图 3 不同藻体颜色的漂浮浒苔(a、b和c)和处于孢子囊发育不同时期的定生浒苔(a’、b’和c’)的体细胞比较 Fig. 3 The cells of U. prolifera floating thalli with different colors (a, b, c) and the cells of thalli of U. prolifera in different phases during sporangium formation (a', b', c') 注: a:深绿藻体; b:中绿藻体; c:浅绿藻体; a’:深绿阶段; b’:中绿阶段; c’:浅绿阶段。标尺为10μm。(修订自林阿朋, 2010) |
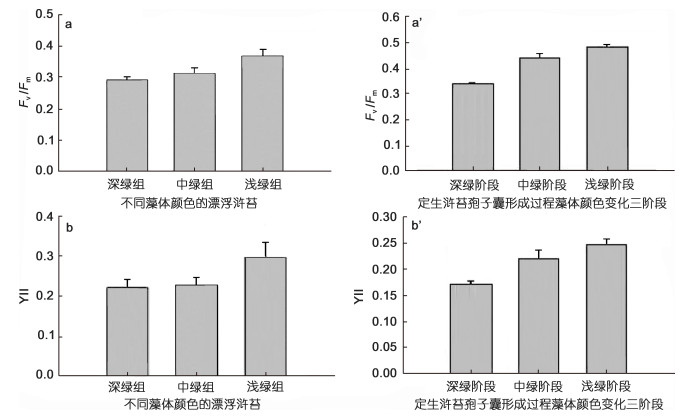 |
| 图 4 不同藻体颜色的漂浮浒苔(图a和b)和处于孢子囊不同发育阶段的定生浒苔(图a’和b’)的光合参数的比较 Fig. 4 The photosynthetic parameters of the cells of U. prolifera floating thalli with different colors (a, b) and the cells of U. prolifera attached thalli in different phases (a', b') during sporangium formation 注: a:漂浮浒苔光系统Ⅱ最大量子产量(Fv/Fm); b:漂浮浒苔光系统Ⅱ实时量子产量(YⅡub>; b’:定生浒苔YⅡ。数据值为5个测量值的平均值(修订自林阿朋, 2010) |
上述浅绿、中绿和深绿三部分实际对应的是漂浮“藻席”的上层、中层和下层藻体。如果将Lin等(2011)的研究结果和Wang等(2016)的进行对比分析, 就会发现二者相互补充和验证。浅绿和中绿部分的藻体(对应的是“藻席”上层和中层)暴露在空气中, 光照强度充足, 色素含量低, 但光合活性高, 同时也可以利用空气中的CO2, 无机碳源供给充裕, 应该是处于Wang等(2016)描述的从营养细胞到孢子囊转化过程的阶段Ⅰ。深绿部分的藻体(对应的是“藻席”的下层)浸没在海水中, 光照不足, 造成藻体色素补偿性增多, 属于孢子囊形成的早期准备阶段, 形态上还是营养细胞。
3 漂浮浒苔对胁迫因子的响应自然生长的浒苔栖息于潮间带, 对环境的适应能力很强, 因而广泛分布于全球海域。浒苔在生长发育过程中受到各种环境胁迫因子的影响, 包括生物胁迫因子和非生物胁迫因子。营固着生活的浒苔主要经受非生物胁迫因子的影响, 包括高盐、高光和失水等(朱明等, 2011; 高山, 2014; 郇丽, 2015; 郑阵兵, 2018)。一旦退潮, 浒苔藻体暴露在空气中, 其他的一些动物和微生物难以耐受失水和高盐等胁迫环境, 无法栖息在藻体上。然而, 如果浒苔处于漂浮状态, 藻体就会受到双重压力, 既有非生物胁迫因子的影响, 又会受到海洋动物的摄食压力, 其中后者更甚。为此, 本节首先介绍浒苔对生物胁迫因子的响应, 尤其介绍生物胁迫因子在浒苔繁殖中的作用, 然后简要介绍非生物胁迫因子对浒苔的影响。
3.1 漂浮浒苔的生物胁迫因子生物胁迫因子是指对海藻生长发育过程有负面影响的各种生物因素, 主要包括海洋动物的摄食压力和微生物的干扰等。暖水性无干出过程的大型海藻养殖活动的成功与否往往取决于海洋动物的摄食压力。在海藻场生态系统中, 海藻群落结构与食藻动物的丰度和摄食偏好密切相关。Geertz-Hansen等(1993)报道了海洋无脊椎动物对漂浮石莼(Ulva lactuca L.)生物量的影响, 发现在富营养化河口的内部区域石莼大规模聚集漂浮, 源自动物的摄食压力相对较小; 而在河口的外部漂浮石莼规模较小, 来自动物的摄食压力相对较大。Brawley等(1981)发现雷氏藻钩虾通过摄食可减少甚至消除一些丝状附生藻类, 如浒苔和水芸等。1987年中科院海洋研究所费修绠研究员与前来海洋所学习的Brawley在青岛的养殖场引入藻钩虾和麦秆虫, 发现它们可以有效地抑制附生藻类的繁衍(Brawley et al, 1987)。郑新庆等(2013)发现端足类强壮藻钩虾通过啃食, 极大地影响了福建厦门筼筜湖区域的海藻群落结构。因此, 这些海洋藻食性动物尤其是啃食型的甲壳动物在海藻生态系统中发挥着重要作用。
丝状浒苔在漂浮过程中相互缠结, 是食藻动物如钩虾和麦秆虫等甲壳类动物的理想栖息场所, 现场观察也发现了浒苔“藻席”上生存着大量的食藻动物。薛素燕等(2018)系统比较了中华原钩虾对几种海洋绿藻的摄食偏好性, 发现钩虾优先食用浒苔, 并以“藻席”作为产卵发育场所。从表面看, 这些食藻动物通过啃食减少了漂浮浒苔的生物量, 但是其功能可能远远不止简单的摄食压力。
Santelices等(1989)发现食藻动物排泄的粪便可再生新的组织, 或释放原生质体和孢子产生新的藻体。这种通过动物粪便进行繁殖的方式是海藻产生新个体的关键辅助手段, 具有重要的生态价值。与常规的繁殖方式相比, 这种方式更具优势, 包括沉降速度和对不良环境的适应性等。我们从钩虾的粪便中分离获得了藻片段, 同时对栖息在浒苔“藻席”中的钩虾进行连续冰冻切片观察, 发现钩虾的消化道中也存在大量大小不一的藻片段, 这些藻片段中均含有完整的浒苔细胞。此外, 钩虾啃食浒苔时, 除一部分浒苔进入消化道外, 还有很大一部分藻体被其口器啃成碎片, 散落大量浒苔片段, 这些浒苔片段要大于钩虾粪便中藻片。因此, 漂浮浒苔的“藻席”中钩虾会产生大量大小不一的藻片段。这些不同大小的藻片段在孢子(配子)囊形成过程是否有差别?如果有差别的话, 其内在的机制是什么?
Gao等(2010)对此作了较为全面深入的研究, 发现浒苔不同大小的藻片段形成孢子囊的面积明显不同。直径为0.5mm和0.75mm的藻片段基本全部形成孢子囊, 直径为1mm的藻片段中形成孢子囊的面积约为总面积的90%, 直径为2mm和2.5mm的藻片段形成孢子囊的面积分别为40%和60%, 而较大的组织块(直径为3、3.5和4mm)形成的孢子囊主要是在边缘, 且比例均小于15%。由此可见, 浒苔藻片段的大小影响孢子囊的形成比例, 较小的藻片段更倾向于形成孢子囊。另外, 孢子的释放与藻片段的大小也有密切的关系。在直径为0.5、0.75和1mm的藻片段中, 孢子的释放比例均小于36%;直径为2和2.5mm的藻片段释放孢子的比例最高, 约为85%;而较大的藻片段(直径为3、3.5和4mm)释放孢子的比例约为70%。在浒苔藻片段的营养细胞向孢子囊转化过程中, Gao等(2010)测定了细胞的光合活性, 发现新形成的藻片段伤口处正常营养细胞的光合活性比较低, 随后逐渐升高; 当孢子囊已形成时, 光合活性迅速下降, 并且孢子囊的潜在最大光合效率逐渐降到最低。另外, 还发现浒苔藻片段中营养细胞的光合活性和潜在最大光合效率均明显大于成熟的孢子囊(P < 0.05)。这个研究结果与Wang等(2016)的研究结果基本一致。
3.2 漂浮浒苔的非生物胁迫因子随着潮涨潮落, 潮间带固着浒苔每天都经历着剧烈的环境变化, 要么浸没在海水里, 要么暴露在空气中。在海水中, 浒苔生长在光照和温度相对稳定的环境中, 很少受到强光抑制和高盐失水胁迫。然而, 一旦暴露在空气中, 浒苔就将处于高光强和高盐失水等极端环境中, 海藻细胞的代谢网络必须能够快速响应, 及时调整代谢流以应对这些极端胁迫环境。高光强会引起光抑制, 海藻细胞须快速实现光保护, 避免受到强光产生的活性氧的致命伤害; 失水和高盐会导致细胞自由水减少, 影响细胞的代谢, 使细胞处于极度休眠状态。另一方面, 一旦涨潮, 浒苔又重新浸没在海水中, 细胞必须快速解除休眠。由此可见, 浒苔是极端复苏植物, 是逆境生物学的重要研究对象。正因如此, Wichard等(2015)建议将其作为研究藻类生长发育的模式材料。
浒苔对非生物胁迫因子的响应过程的部分研究工作已经进行过综述(王广策等, 2016), 在此仅介绍近期相关的研究进展。
3.2.1 漂浮浒苔对光强和光质的响应光是浒苔生长发育不可或缺的环境因子, 不同波长的光也是浒苔形态建成等生物学过程的重要信号因子(Zhao et al, 2016; Ma et al, 2019)。不同的光强和光质均可以诱导浒苔非光化学淬灭(NPQ), 其中PsbS和LhcSR蛋白是关键蛋白。在远红光(730nm)下, 浒苔积累LhcSR蛋白进而促进NPQ的升高, 但是PsbS蛋白含量却没有明显变化。进一步研究发现, LhcSR蛋白与光系统Ⅱ复合体结合, 调控两个光系统之间的能量平衡。与高盐条件下诱导的NPQ升高类似, 远红光条件下NPQ的升高依赖于跨类囊体膜质子梯度和叶黄素循环。不同的是, 远红光诱导的NPQ依赖于LhcSR而不是PsbS, 但高盐条件下NPQ的升高并不依赖于这两个蛋白的积累(Zheng et al, 2019a)。光合参数变化表明远红光条件下浒苔光合活性降低, 但是环式电子传递速率明显升高。因此, 浒苔能通过促进环式电子传递和升高NPQ应对长波长的远红光环境(郑阵兵, 2018; Zheng et al, 2019b)。
高光胁迫显著影响浒苔的光合活性(Zhao et al, 2016; 付倩倩等, 2018), 其中PsbS和LhcSR两个蛋白是浒苔响应高光胁迫的关键蛋白。在进化上相近的其他藻类中, PsbS和LhcSR基因在正常条件下表达量很低, 在高光等逆境条件诱导下才能大量表达(de Bianchi et al, 2011)。然而, 在浒苔中PsbS和LhcSR基因表达量在高光条件下并没有上升, 但其NPQ值却明显升高。免疫印迹结果表明, 在正常条件下二者的本底水平就很高, 高光条件下两个蛋白的含量没有明显的变化, 由此认定PsbS和LhcSR基因在浒苔中是组成型表达。当利用玉米黄素合成抑制剂DTT处理后, 发现浒苔NPQ值明显降低, 并且用DCCD抑制其感知质子梯度后NPQ也明显降低, 说明高光条件下的NPQ升高依赖于玉米黄素和跨类囊体膜质子梯度。跨膜质子梯度能使PsbS质子化, 并且促进紫黄素向玉米黄素的转化。研究还表明, PsbS与天线系统的相互作用需要质子梯度和玉米黄素的参与。当只有质子梯度存在时, PsbS主要与LHCⅡ三聚体结合, 但当质子梯度和玉米黄素同时存在时, PsbS会和LHCⅡ内周天线蛋白Lhcb4、Lhcb5和Lhcb6结合。因此, 浒苔在高光条件下NPQ发生机制比较独特, 与其它光合生物明显不同(Gao et al, 2020)。
3.2.2 浒苔逆境因子相关超分子复合体的分离类囊体是光合作用运转的重要场所, 许多重要的光合作用过程均发生在类囊体中。研究结果表明, 在失水和高盐胁迫过程中, 浒苔的类囊体膜蛋白组成、结构和功能均发生显著变化, 甚至引起浒苔类囊体膜蛋白的重排(Gao et al, 2019)。在高盐胁迫条件下浒苔类囊体膜蛋白重组形成了一个超分子复合体, 一旦胁迫条件解除, 该复合体随之消失。分离该超分子复合体, 并进行蛋白质组学和免疫印迹分析, 发现其主要由PSⅡ核心复合体、LHCⅡ (light-harvesting complex Ⅱ)和PSⅠ的亚基组成, 且磷酸化程度在高盐胁迫条件下显著增强。低温(77K)荧光发射光谱结果表明, 该复合体可以通过PSⅠ淬灭PSⅡ中过多的能量, 保护光合膜结构(Gao et al, 2015, 2019)。尽管Tikkanen等早在2008年就提出在光合生物可能存在PSⅡ–LHCⅡ–PSⅠ三元超分子复合体(Tikkanen et al, 2008), 但直到最近我们实验室(Gao et al, 2015, 2019)和Yokono等(2015)才分别在失水状态的浒苔和低光培养条件下的拟南芥中分离出该三元复合体, 并且认为该复合体的主要功能是平衡PSⅠ和PSⅡ之间的能量分配, 以适应低光和高盐胁迫的极端环境。
4 富营养化背景下营养盐组成的变化触发浒苔孢子囊的快速形成近海富营养化的日渐加剧驱动了由浒苔等石莼属海藻引发的绿潮发生, 优质的附着基质(如养殖设施等)促进了浒苔孢子的萌发与生长, 这在黄海海域暴发的绿潮中表现得尤为明显。绿潮除在黄海暴发外, 还相继在河北的秦皇岛海域和广西的北海海域暴发(Han et al, 2019; 南国早报, 2019年2月13日)。尽管引发秦皇岛海域、北海海域和黄海海域绿潮暴发的成因物种各不相同, 但均为石莼属绿藻, 这使得绿潮机制研究更趋复杂化。无论如何, 海洋富营养化可为绿潮成因物种的生长发育提供营养需求, 是绿潮发生的根本原因。因此, 要彻底阐明绿潮的发生机制仍需聚焦近海的富营养化。
众所周知, 黄海绿潮是世界上规模最大和影响最广的海洋生态灾害之一。同时, 到目前为止对黄海绿潮的研究也最为深入, 积累的资料也最为全面。尽管黄海绿潮源自苏北浅滩的条斑紫菜养殖设施的观点已渐成共识, 但是黄海富营养化催生绿潮发生的证据仍需强化, 主要是需回答以下三个问题: (1)黄海的富营养化早在20世纪90年代初期就变得相当严重, 为何20年后才发生绿潮?(2)从2000年起, 每年在黄海南部与东海都能发现由漂浮浒苔组成的小型“藻席”(也有文献称之为“藻垫”), 为何时隔7年之后才暴发绿潮(Hu et al, 2010)?(3)富营养化可以促进多种藻类的生长繁殖, 为何只有浒苔快速生长繁殖并形成绿潮?
要回答以上问题, 不仅需要系统研究海洋富营养化的时空变化过程, 也要研究不同营养元素比例的变动趋势, 更要探索特定营养元素不同存在形式之间的互换规律。同时, 浒苔细胞生理生化过程如何感知环境因子的变化, 并通过生长繁殖的骤变来响应这些环境变化, 也是我们认知绿潮发生的生物学机制的重要研究内容。因此, 本节从以下三个方面进行综述。
4.1 富营养化背景下黄海海域的营养盐组成的变化据不完全统计, 国际上暴发绿潮的海域一般位于快速工业化或已经完成工业化的国家周边, 且首次暴发的时间对应相关国家的快速工业化与城市化时期, 其内在的原因就是富营养化(Fletcher, 1996)。换言之, 人类活动主导了海洋富营养化的动态过程(Anderson et al, 2002; Bricker et al, 2008), 这种过程不仅体现在其时空变化规律上, 也体现在各种营养盐组分此消彼长的动态趋势上(Smith, 2003)。
黄海沿岸属于工业化和城市化快速发展的地区, 尤其是南黄海沿岸地区。2005年之前南黄海海域的铵态氮与硝态氮浓度变化趋势基本一致, 即铵态氮与硝态氮在溶解无机氮(DIN)中的比例相对稳定, 以铵态氮为主。2005年后铵态氮与硝态氮变化趋势开始出现变化, 硝态氮在DIN中的比例大幅增加, 铵态氮的占比开始下降(Li et al, 2015; Shi et al, 2015)。
究其原因, 黄海南部水体受到三个水团影响, 分别为苏北沿岸水、黄海混合水以及长江冲淡水, 其中长江冲淡水与苏北沿岸水是造成黄海南部海域富营养化的主要因素(卢健等, 2014)。长江中下游流域是中国重要的经济发展地之一, 大量营养盐直接排入或间接通过径流汇入长江。长江入海流量十分巨大, 其中流入苏北沿岸海域的DIN约占长江总羽流的十分之一, 因此长江冲淡水对黄海南部的水体质量有着重要影响(Wu et al, 2014)。随着长江中下游经济的快速发展, 长江羽流携带的营养盐逐年增加, 其中DIN增加量尤其巨大。详细分析历年的资料, 可以发现2000年后长江羽流中DIN中的氨氮、硝酸盐和亚硝酸盐三者比例出现明显变化, 硝酸盐逐渐增多, 氨氮逐渐减少。根据《中国近海环境质量状况公报》(2006—2012)与《中国海洋生态环境状况公报》(2013—2017), 每年由长江携带入海的氨氮总量从2006年的61.3万吨下降至2017年的4.2万吨, 而每年由长江携带入海的不包括氨氮在内的总氮(主要为硝酸盐与亚硝酸盐)总量却从2006年的125.2万吨上升至2012年的193.8万吨, 这种变化趋势仍在不断加强中。Li等(2010)报道了长江羽流中的硝酸盐主要来源于硝化作用(包括改性化肥)与城市废水等。此外, 苏北沿岸水则携带沿岸排放物进入黄海南部水体, 随着沿岸地区工业化与城市化的发展, 其排放也出现了新的变化特征。以青岛胶州湾为例, 海水DIN中的氨氮、硝酸盐、亚硝酸盐三者比例同样出现显著变化, 氨氮浓度在2001年达到顶峰后呈现下降趋势, 硝酸盐与亚硝酸盐浓度则自2000年后显著升高, 2005年后硝酸盐/亚硝酸盐在DIN中占优势(孙晓霞等, 2011)。由此可见, 沿岸排放与长江排放的变化趋势类似, 由此导致了黄海海域(尤其南黄海海域)的DIN中以硝态氮为主。
4.2 黄海海域中DIN中的硝态氮促进了浒苔生长繁殖绿潮浒苔自苏北浅滩漂浮至青岛, 藻体经历了不同的水体环境, 水体温度、浑浊度和营养盐浓度、等均发生变化, 浒苔生长发育状态也相应发生改变(丁月旻, 2014; 李鸿妹, 2015; Li et al, 2019)。因此, 浒苔细胞的生理生化过程对环境因子的响应决定着浒苔生长发育状态。在绿潮的源头海区, 紫菜养殖筏架上的优势藻种应该是条斑紫菜, 但是近年来时常会出现浒苔生物量超过了条斑紫菜的情况。实际上, 采苗时紫菜网帘要经过严格的处理, 以确保网帘上基本没有浒苔幼苗的附着, 所以浒苔的生长应发生在紫菜养殖中后期。由此可见, 绿潮源头海区独特的营养盐状况有利于浒苔的生长繁殖。
Wu等(2015)报道苏北浅滩南部紫菜养殖区海水硝酸盐和铵盐浓度变化趋势不同, 表现在铵盐浓度在条斑紫菜生长旺盛季节(11月至次年2月)下降幅度较大, 而硝酸盐浓度在浒苔快速生长繁殖季节(4月至6月)快速下降。该研究给我们以下两点提示: (1)条斑紫菜对海水DIN吸收的偏好形态可能是铵态氮, 浒苔则是硝态氮。(2)如前所述, 2005年后黄海的DIN以硝态氮为主, 在紫菜养殖区紫菜优先吸收铵态氮, 造成海区的硝态氮分浓度更大。换言之, 浒苔是在更高的硝态氮浓度中快速生长繁殖。Teichberg等(2010)也认为浒苔属海藻比其他大型海藻更倾向于吸收利用硝酸盐, 由此导致浒苔属海藻的快速生长与繁殖, 引起绿潮等藻华的频繁暴发; 同时, 他们还认为在欧美等受到工业化与城市化影响的海域中高浓度硝态氮主要源自处理后污水中的硝酸盐。
综上所述, 浒苔生物量的快速积累可能是细胞对富营养化背景下硝态氮浓度升高的响应。浒苔生物量的增加一方面源自浒苔个体生长速度加快, 但更重要的是源自个体数量的增多, 即繁殖速度的显著上升。因此, 硝态氮更可能是通过促进浒苔营养细胞转化为孢子(配子)囊来实现其生物量的增加。
4.3 海水DIN中硝态氮比例的升高促进浒苔孢子囊的形成众所周知, 氮元素是核酸和蛋白质等生物大分子的重要组成成分, 是藻类生长发育中重要的营养元素之一。藻类可以吸收铵态氮和硝态氮等无机氮(吴婷等, 2011)。对藻类细胞而言, 铵态氮吸收利用是较为简单的方式, 因为铵态氮可直接由谷氨酰胺合成酶(GS)催化加工成谷氨酰胺, 进入到蛋白质等生物大分子的合成代谢中。然而, 一旦藻类细胞利用硝态氮, 则需要在细胞中进行多个生化还原步骤, 将硝态氮还原为铵态氮, 才能进入蛋白质代谢中(Solomonson et al, 1990)。因此, 从代谢路径的简洁性和对还原力的消耗来看, 藻类细胞利用铵态氮似乎是较为经济的方式, 但是不同物种对无机氮形态有不同的偏好性, 如浒苔就偏好利用海水中的硝态氮。
浒苔吸收海水中的硝酸盐后, 细胞中的硝酸还原酶(NR)将其还原成亚硝酸盐, 再经亚硝酸盐还原酶作用生成铵态氮, 进入到大分子代谢中, 同时会产生一氧化氮(NO)分子。NO是一种重要的信号分子, 广泛存在于动植物细胞中, 在免疫、神经传导、植物器官分化、形态建成和对逆境的响应等方面有重要的作用。NO分子在浒苔的生长发育中也发挥着重要的作用(王辉, 2017)。
王辉(2017)利用荧光组织化学技术发现了浒苔的营养细胞在向孢子(配子)囊转化过程中NO浓度显著升高; 如果添加NO清除剂, 浒苔营养细胞基本不能转化为孢子(配子)囊; 一旦恢复NO供给, 营养细胞又可以转化为孢子(配子)囊。因此, NO与浒苔孢子(配子)囊形成正相关。也就是说, 浒苔在吸收利用海水中的硝酸盐作为氮源时, 产生了NO分子, 从而促进了营养细胞向孢子囊的转化。
实际上, 浒苔细胞有两条途径可以产生NO分子。第一条途径就是前述的NR将硝酸盐还原亚硝酸后, 再经催化反应产生NO, NR是关键。第二途径是浒苔细胞氨基酸代谢中一氧化氮合酶(NOS)将L-精氨酸经过羟基精氨酸还原为瓜氨酸时产生NO, NOS是关键。究竟在浒苔细胞中哪条途径为主?王辉(2017)利用硝酸还原酶抑制剂钨酸钠处理浒苔细胞时, 浒苔孢子(配子)囊的形成受阻, 同时荧光组织化学分析结果显示浒苔细胞的NO浓度大幅减少; 一旦利用NOS抑制剂L-NMMA处理浒苔细胞, 浒苔孢子(配子)囊不受影响, NO浓度基本没有变化。这个结果表明, 浒苔产生NO分子主要是第一条途径, 即硝酸还原酶发挥关键作用。Wang等(2012)报道在绿潮暴发时浒苔的硝酸还原酶基因表达显著上调。同时, Zhu等(2016)研究了硝酸还原酶与盐度之间的关系, 发现低盐有利于维持该酶活性。在浒苔暴发时黄海的盐度正好偏低(李鸿妹, 2015; Zhu et al, 2016; 王俊杰等, 2018)。因此, 绿潮暴发时的海况条件恰好满足了硝酸还原酶的最适条件。
海水中DIN的硝态氮除了硝酸盐外, 还有亚硝酸盐形态。亚硝酸盐在太阳紫外线的作用下可以光解催化产生NO (Zafiriou et al, 1980)。从太阳光紫外线强度来分析, 绿潮暴发的春夏季节正是太阳光中的紫外线强度最高的时期。因此, 即便海水中亚硝酸盐浓度不增加, 由光解催化产生的NO也会增多。
综上所述, 在绿潮暴发期间浒苔细胞内外的NO浓度均呈上调趋势。浒苔NR利用硝酸盐在胞内产生NO, 太阳光的紫外线光催化亚硝酸盐在细胞外产生NO。由此, 浒苔细胞转化为孢子囊的“催化剂”——NO供给充足。
5 未来黄海绿潮研究的几点初步建议黄海绿潮自2007年首次暴发至今几乎每年均有暴发, 国内的相关涉海科研单位的研究人员对此开展了大量的研究, 积累了大量的相关资料, 取得了重要成果。在此基础上, 本文从海藻生物学的角度提出以下一些初步的想法, 以供参考。
5.1 食藻动物是漂浮浒苔“藻席”中的“生态引擎”, 在绿潮消长过程中的作用不可或缺(图 5)
 |
| 图 5 “藻席”中食藻动物(如钩虾等)啃食藻体以及排泄产生大小不一的藻片段, 在“藻席”生物量的消长过程发挥重要作用 Fig. 5 The animals (e.g., Gammarus sp., etc.) from the "algal mat" gnawing and excretion both produced algal fragments in different sizes, playing an important role in the process of the growth and decrease of the "algal mat" |
根据个体大小, 海洋食藻动物可分为植食性鱼类、海胆和中等啃食者三类(Carpenter et al, 1986)。对于浒苔(尤其漂浮浒苔)而言, 主要是中等啃食者, 包括小型甲壳动物(端足类和等足类)和软体动物(腹足类)等, 以前者中的钩虾为主。薛素艳等(2018)报道了钩虾偏好浒苔为食, 对后续的研究有很好的启示。
钩虾等食藻动物对绿潮的作用表现在两个方面: (1)钩虾啃食了浒苔, 能量从浒苔流向了钩虾。尽管如此, 钩虾的啃食对绿潮中浒苔生物量的降低几乎可以忽略, 因为浒苔生物量的增长远远大于钩虾等食藻动物的消耗。(2)钩虾对浒苔藻体的啃食和排泄等活动使浒苔藻体碎片化, 产生大小不一的藻片段(郑新庆等, 2013; 薛素燕等, 2018)。这些藻片段要么悬浮于海水中(Liu et al, 2013), 要么沉降至海底(Liu et al, 2012), 形成绿潮的“种源”(Bernabe et al, 1989)。还有一部分仍然存留在漂浮的“藻席”中, 这些藻片段边缘处的营养细胞转化为孢子囊(Gao et al, 2010), 释放出孢子, 在“藻席”中萌发为新的藻体。因此, 如果将漂浮“藻席”作为一个独特的生态系统, 食藻动物实际就是这个生态系统的“引擎”, 一方面使漂浮“藻席”不断长大, 另一方面为来年“播种”。
5.2 浒苔孢子的原位萌发或者附着到母体上萌发可能是漂浮浒苔生物量快速增长的关键(图 6)
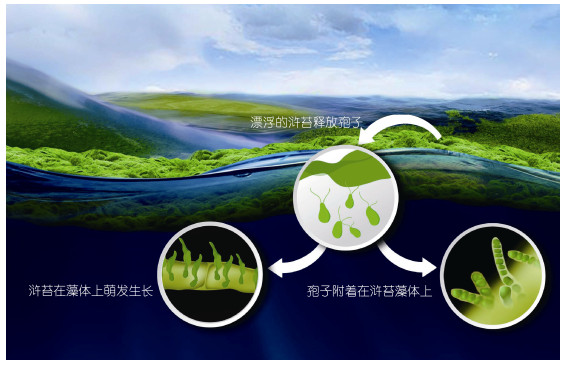 |
| 图 6 漂浮“藻席”中产生的浒苔孢子可以在母体上原位萌发, 也可以在其他浒苔藻体上附着萌发生长 Fig. 6 The spores produced from the "algal mat" could both germinate on the mother thalli (germination in situ) or on other thalli of U. prolifera |
Gao等(2010)报道了在绿潮漂浮浒苔中存在孢子原位萌发的现象, Smetacek等(2013)认为可能是浒苔藻体的表面缺乏化学阻遏物质。实际上, 这种化学阻遏物质是生物长期进化过程中获得的一种确保种群稳定的物质, 以防止某种孢子生物(如海藻)爆炸式扩张。浒苔藻体缺乏这种化学阻遏物质, 就会造成漂浮浒苔生物量的剧增。
漂浮浒苔“藻席”产生孢子囊的来源有两个: (1)完整藻体在漂浮过程中因为DIC的“充裕”和“不足”两个阶段的交替, 促进藻体的营养细胞转化为孢子囊; (2)食藻动物产生的藻片段的边缘处营养细胞极易转化为孢子囊。孢子囊释放的孢子需要有合适的附着基质, 否则就成为“废”孢子。漂浮浒苔“藻席”中最容易找到的附着基质就是浒苔藻体。如果浒苔藻体有化学阻遏物质, 孢子很难附着, 或者即便附着也会逐渐死亡。然而, 一旦浒苔藻体没有这种化学阻遏物质, 藻体本身就是附着基质, 就有可能出现一个藻体变为数百个新个体的现象, 生物量可呈几何级数增长。海上调查也发现漂浮浒苔有一部分处于“丛生”状态。实际上, 即便浒苔有超快的生长速度, 如果没有快速繁殖, 生物量增长的幅度也是有限的。
5.3 绿潮源头海区中浒苔的“种源”是研究绿潮的重要内容苏北浅滩是条斑紫菜的主要养殖区。有紫菜养殖就有浒苔伴生, 所以几十年前日本和中国的紫菜养殖工人们根据紫菜的生物学特性发明了“冷藏网”技术, 以避开海水中富含浒苔孢子的季节。由此可见, 过去浒苔孢子(配子)释放是有季节性的, 但是这几年浒苔孢子频发, 实际很难避开。尽管紫菜采苗时, 农民们会最大限度地去除杂藻, 只保留紫菜幼苗, 但是一旦进行海上养殖, 短时间内紫菜养殖筏架上大量“侵入”浒苔, 甚至出现“养殖紫菜, 收获浒苔”的局面。在实验室条件下浒苔和条斑紫菜生长速率并没有太大的差别。Li等(2016)报道, 条斑紫菜的生长速率约为20%/d, 浒苔约为14%/d。为何近几年紫菜养殖区的浒苔“种源”如此丰富?要回答这个问题, 绿潮源头海区的现场调查至关重要。近期已有多个研究团队在苏北浅滩黄海绿潮的源头海区开展工作, 也有很多重要发现(Zhang et al, 2013; Song et al, 2015; 刘峰等, 2018), 相信很快就会有明确的答案。
6 结语在黄海绿潮的源头海区, 人为或者自然因素使得浒苔等石莼属绿藻从固着变为漂浮状态, 形成小规模的“藻席”。也许半个世纪以来几乎每年均会产生这样小规模的“藻席”, 但是未必会引发绿潮。真正促使漂浮浒苔发展为绿潮的“扳机”是富营养化背景下海水DIN中高比例的硝酸盐和亚硝酸盐(Wang et al, 2020), 因为硝酸盐使浒苔细胞产生NO分子, 促进营养细胞快速转化为孢子囊, 释放孢子。与此同时, 漂浮“藻席”又有两个因素加速浒苔孢子囊的形成:首先, 食藻动物(钩虾等)产生了大量的浒苔藻片段, 这些藻片段切口处的营养细胞高比例地转化为孢子囊; 其次, 漂浮过程DIC充裕和不足两个阶段的交替更刺激了孢子囊的形成。此外, 浒苔藻体缺乏限制自身孢子附着的化学阻遏物质, 使得产生的孢子不仅可以原位萌发, 而且可以将其他浒苔藻体作为附着基质, 个体数目随之指数增长。漂浮“藻席”中上层藻体可以利用空气中的CO2作为无机碳源, 实现快速生长。因此, 漂浮“藻席”的规模不断扩大, 短时间内形成巨大生物量, 引发绿潮暴发。
正如人体因感染病菌而引发的发热症状, 绿潮实际上就是石莼属海藻对受损海洋环境的响应。漂浮浒苔“藻席”生物量的爆炸式增长类似于人体感染后的发热症状, 只是受损海洋环境的表象。绿潮暴发时, 及时处置巨大的绿潮生物量, 避免次生灾害, 意义重大。然而, 寻找绿潮“病因”, 发现引发海洋环境变异的致病因子, 对“症”施治, 才能科学防控, 精准预测预报, 减轻甚至避免绿潮暴发时产生的损失。我们相信经过全国涉海科研单位相关科研人员的共同努力, 彻底解析引发绿潮的机制指日可待。
致谢 感谢中国科学院海洋研究所的周名江研究员对本文的认真审阅, 并提出了许多建设性的意见, 对完善本文有重要的意义; 感谢清华大学生命科学院的潘俊敏教授对鞭毛发生机制的讨论与指导。
丁月旻, 2014.黄海浒苔绿潮中生源要素的迁移转化及对生态环境的影响.青岛: 中国科学院研究生院(海洋研究所)博士学位论文
|
王辉, 2017.浒苔孢子形成过程的光合作用变化及其对信号分子一氧化氮的响应.青岛: 中国科学院大学(海洋研究所)博士学位论文
|
王广策, 唐学玺, 何培民, 等. 2016. 浒苔光合作用等关键生理过程对环境因子响应途径的研究进展. 植物生理学报, 52(11): 1627-1636 |
王宗灵, 傅明珠, 肖洁, 等. 2018. 黄海浒苔绿潮研究进展. 海洋学报, 40(2): 1-13 |
王俊杰, 于志刚, 韦钦胜, 等. 2018. 2017年春、夏季南黄海西部营养盐的分布特征及其与浒苔暴发的关系. 海洋与湖沼, 49(5): 1045-1053 |
卢健, 张启龙, 李安春. 2014. 苏北沿岸流对浒苔暴发及漂移过程的影响. 海洋科学, 38(10): 83-89 DOI:10.11759/hykx20130128001 |
付倩倩, 李航霄, 吴海龙, 等. 2018. 光强对缘管浒苔(Ulva linza)光合生理特性和短期温度效应的影响. 海洋与湖沼, 49(5): 967-974 |
冯子慧, 孟阳, 陆巍, 等. 2012. 绿潮藻浒苔光合固碳与防治海水酸化的作用Ⅰ.光合固碳与海水pH值提高速率研究. 海洋学报, 34(2): 162-168 |
朱明, 刘兆普, 徐军田, 等. 2011. 浒苔孢子放散与附着萌发特性及其干出适应性的初步研究. 海洋科学, 35(7): 1-6 |
刘峰, 刘兴凤, 金柘, 等. 2018. 苏北浅滩沉积物中的大型绿藻微观繁殖体的垂直分布和物种多样性. 海洋与湖沼, 49(5): 983-990 |
孙晓霞, 孙松, 赵增霞, 等. 2011. 胶州湾营养盐浓度与结构的长期变化. 海洋与湖沼, 42(5): 662-669 |
李鸿妹, 2015.营养盐与黄海浒苔绿潮暴发关系的探究.青岛: 中国海洋大学博士学位论文
|
吴婷, 田小亭, 刘召辉, 等. 2011. 浒苔对不同氮源吸收特性的初步研究. 海洋科学, 35(4): 51-54 |
何培民, 尹顺吉, 吴庆磊, 等. 2005. 藻类CCM分子生物学研究进展. 海洋科学, 29(3): 71-75 DOI:10.3969/j.issn.1000-3096.2005.03.015 |
邹定辉. 2001. 脱水对浒苔光合作用的影响. 湛江海洋大学学报, 21(2): 30-34 DOI:10.3969/j.issn.1673-9159.2001.02.006 |
范士亮, 傅明珠, 李艳, 等. 2012. 2009-2010年黄海绿潮起源与发生过程调查研究. 海洋学报, 34(6): 187-194 |
林阿朋, 2010.海洋大型植物光合作用对主要环境因子的响应机制.青岛: 中国科学院研究生院(海洋研究所)博士学位论文
|
郇丽, 2015.浒苔响应高盐等环境胁迫因子的生理生化机制.青岛: 中国科学院研究生院(海洋研究所)博士学位论文
|
郑阵兵, 2018.高光、光质和高盐胁迫下浒苔(Ulva prolifera)非光化学淬灭响应机制的比较分析.青岛: 中国科学院大学(海洋研究所)博士学位论文
|
郑阵兵, 高山, 王广策. 2018. 2017年绿潮浒苔(Ulva prolifera)生理特征及孢子囊形成情况分析. 海洋与湖沼, 49(5): 999-1005 |
郑新庆, 黄凌风, 李元超, 等. 2013. 啃食性端足类强壮藻钩虾对筼筜湖三种大型海藻的摄食选择性. 生态学报, 33(22): 7166-7172 |
徐军田, 王学文, 钟志海, 等. 2013. 两种浒苔无机碳利用对温度响应的机制. 生态学报, 33(24): 7892-7897 |
高山, 2014.潮间带大型海藻光合作用对失水胁迫的响应.青岛: 中国科学院研究生院(海洋研究所)博士学位论文
|
高秀秀, 李亚鹤, 段维军, 等. 2015. 光强和二氧化碳浓度变化对浒苔幼苗生长及生理的影响. 海洋学报, 37(10): 80-87 DOI:10.3969/j.issn.0253-4193.2015.10.008 |
郭赣林, 董双林. 2008. 干出对潮间带不同垂直位置海藻的生长及光合作用速率的影响. 海洋湖沼通报, (4): 78-84 DOI:10.3969/j.issn.1003-6482.2008.04.012 |
梅俊学, 费修绠. 2000. 条斑紫菜离体组织再生苗的研究. 海洋科学, 24(6): 39-42 DOI:10.3969/j.issn.1000-3096.2000.06.012 |
崛辉三. 1994. 藻类の生活史集成, 第一卷.绿色藻类. 东京: 内田老鹤圃, 190-198
|
曾呈奎, 张德瑞, 张峻甫. 1962. 中国经济海藻志. 北京: 科学出版社
|
颜天, 于仁成, 周名江, 等. 2018. 黄海海域大规模绿潮成因与应对策略——"鳌山计划"研究进展. 海洋与湖沼, 49(5): 950-958 |
潘俊敏. 2008. 衣藻、纤毛与"纤毛相关疾病". 中国科学C辑:生命科学, 38(5): 399-409 |
薛素燕, 毛玉泽, 丁敬坤, 等. 2018. 中华原钩虾(Eogammarus possjeticus)对浒苔(Ulva prolifera)及其他类型饵料的摄食研究. 海洋与湖沼, 49(5): 1109-1115 |
Anderson D M, Glibert P M, Burkholder J M, 2002. Harmful algal blooms and eutrophication:nutrient sources, composition, and consequences. Estuaries, 25(4): 704-726 DOI:10.1007/BF02804901 |
Badger M R, Price G D, 1994. The role of carbonic anhydrase in photosynthesis. Annual Review of Plant Physiology and Plant Molecular Biology, 45: 369-392 DOI:10.1146/annurev.pp.45.060194.002101 |
Bernabe S, Paya I, 1989. Digestion survival of Algae:some ecological comparisions between free spores and propagules in fecal pellets. Journal of Phycology, 25(4): 693-699 DOI:10.1111/j.0022-3646.1989.00693.x |
Brawley S H, Adey W H, 1981. The effect of micrograzers on algal community structure in a coral reef microcosm. Marine Biology, 61(2-3): 167-177 DOI:10.1007/BF00386656 |
Brawley S H, Fei X G, 1987. Studies of mesoherbivory in aquaria and in an unbarricaded mariculture farm on the Chinese coast. Journal of Phycology, 23(4): 614-623 |
Bricker S B, Longstaff B, Dennison W et al, 2008. Effects of nutrient enrichment in the nation's estuaries:a decade of change. Harmful Algae, 8(1): 21-32 DOI:10.1016/j.hal.2008.08.028 |
Campbell D, Houmard J, de Marsac N T, 1993. Electron transport regulates cellular differentiation in the filamentous cyanobacterium Calothrix. The Plant Cell, 5(4): 451-463 DOI:10.2307/3869725 |
Carpenter R C, 1986. Partitioning herbivory and its effects on coral reef algal communities. Ecological Monographs, 56(4): 345-364 DOI:10.2307/1942551 |
Cornic G, Briantais J M, 1991. Partitioning of photosynthetic electron flow between CO2 and O2 reduction in a C3 leaf (Phaseolus vulgaris L.) at different CO2 concentrations and during drought stress. Planta, 183(2): 178-184 |
Cui J J, Shi J T, Zhang J H et al, 2018. Rapid expansion of Ulva blooms in the Yellow Sea, China through sexual reproduction and vegetative growth. Marine Pollution Bulletin, 130: 223-228 DOI:10.1016/j.marpolbul.2018.03.036 |
Cui J J, Zhang J H, Huo Y Z et al, 2015. Adaptability of free-floating green tide algae in the Yellow Sea to variable temperature and light intensity. Marine Pollution Bulletin, 101(2): 660-666 |
de Bianchi S, Betterle N, Kouril R et al, 2011. Arabidopsis mutants deleted in the light-harvesting protein Lhcb4 have a disrupted photosystem Ⅱ macrostructure and are defective in photoprotection. The Plant Cell, 23(7): 2659-2679 DOI:10.1105/tpc.111.087320 |
Fletcher R L, 1996. The occurrence of "green tides"-a review. In: Schramm W, Nienhuis P H eds. Marine Benthic Vegetation: Recent Changes and the Effects of Eutrophication. Berlin: Springer
|
Fritsch F E, 1935. The structure and reproduction of the algae. Volume Ⅰ. Introduction, Chlorophyceae. Xanthophyceae, Chrysophyceae, Bacillariophyceae, Cryptophyceae, Dinophyceae, Chloromonineae, Euglenineae, Colourless Flagellata. Cambridge: Cambridge University Press
|
Gao S, Chi Z, Chen H L et al, 2019. A supercomplex, of approximately 720 kDa and composed of both photosystem reaction centers, dissipates excess energy by PSI in green macroalgae under salt stress. Plant and Cell Physiology, 60(1): 166-175 DOI:10.1093/pcp/pcy201 |
Gao S, Chen X Y, Yi Q Q et al, 2010. A strategy for the proliferation of Ulva prolifera, main causative species of green tides, with formation of sporangia by fragmentation. PLoS One, 5(1): e8571 DOI:10.1371/journal.pone.0008571 |
Gao S, Gu W H, Xiong Q et al, 2015. Desiccation enhances phosphorylation of PSⅡ and affects the distribution of protein complexes in the thylakoid membrane. Physiologia Plantarum, 153(3): 492-502 DOI:10.1111/ppl.12258 |
Gao S, Zheng Z B, Wang J et al, 2020. Slow zeaxanthin accumulation and the enhancement of CP26 collectively contribute to an atypical non-photochemical quenching in macroalga Ulva prolifera under high light. Journal of Phycology, 56(2): 393-403 DOI:10.1111/jpy.12958 |
Geertz-Hansen O, Sand-Jensen K, Hansen D F et al, 1993. Growth and grazing control of abundance of the marine macroalga, Ulva lactuca L. in a eutrophic Danish estuary. Aquatic Botany, 46(2): 101-109 |
Genty B, Briantais J M, Baker N R, 1989. The relationship between the quantum yield of photosynthetic electron transport and quenching of chlorophyll fluorescence. Biochimica et Biophysica Acta (BBA)-General Subjects, 990(1): 87-92 DOI:10.1016/S0304-4165(89)80016-9 |
Han H B, Song W, Wang Z L et al, 2019. Distribution of green algae micro-propagules and their function in the formation of the green tides in the coast of Qinhuangdao, the Bohai Sea. Acta Oceanologica Sinica, 38(8): 72-77 DOI:10.1007/s13131-018-1278-1 |
Krall J P, Edwards G E, 1992. Relationship between photosystem Ⅱ activity and CO2 fixation in leaves. Physiologia Plantarum, 86(1): 180-187 DOI:10.1111/j.1399-3054.1992.tb01328.x |
Kurtz S, Rossi J, Petko L et al, 1986. An ancient developmental induction:heat-shock proteins induced in sporulation and oogenesis. Science, 231(4742): 1154-1157 DOI:10.1126/science.3511530 |
Hayden H S, Blomster J, Maggs C A et al, 2003. Linnaeus was right all along:Ulva and Enteromorpha are not distinct genera. European Journal of Phycology, 38(3): 277-294 DOI:10.1080/1364253031000136321 |
Hiraoka M, Dan A, Shimada S et al, 2003. Different life histories of Enteromorpha prolifera (Ulvales, Chlorophyta) from four rivers on Shikoku Island, Japan. Phycologia, 42(3): 275-284 DOI:10.2216/i0031-8884-42-3-275.1 |
Hiraoka M, Oka N, 2008. Tank cultivation of Ulva prolifera in deep seawater using a new "germling cluster" method. Journal of Applied Phycology, 20(1): 97-102 DOI:10.1007/s10811-007-9186-3 |
Hu C M, Li D Q, Chen C S et al, 2010. On the recurrent Ulva prolifera blooms in the Yellow Sea and East China Sea. Journal of Geophysical Research:Oceans, 115(C5): C05017 |
Huan L, Gu W H, Gao S et al, 2016. Photosynthetic activity and proteomic analysis highlights the utilization of atmospheric CO2 by Ulva prolifera (Chlorophyta) for rapid growth. Journal of Phycology, 52(6): 1103-1113 DOI:10.1111/jpy.12469 |
Li S L, Liu C Q, Li J et al, 2010. Assessment of the sources of nitrate in the Changjiang River, China using a nitrogen and oxygen isotopic approach. Environmental Science & Technology, 44(5): 1573-1578 |
Li Y, Song W, Xiao J et al, 2014. Tempo-spatial distribution and species diversity of green algae micro-propagules in the Yellow Sea during the large-scale green tide development. Harmful Algae, 39: 40-47 DOI:10.1016/j.hal.2014.05.013 |
Li X S, Xu J T, He P M, 2016. Comparative research on inorganic carbon acquisition by the macroalgae Ulva prolifera (Chlorophyta) and Pyropia yezoensis (Rhodophyta). Journal of Applied Phycology, 28(1): 491-497 DOI:10.1007/s10811-015-0603-8 |
Li H M, Zhang Y Y, Chen J et al, 2019. Nitrogen uptake and assimilation preferences of the main green tide alga Ulva prolifera in the Yellow Sea, China. Journal of Applied Phycology, 31(1): 625-635 DOI:10.1007/s10811-018-1575-2 |
Li H M, Zhang C S, Han X R et al, 2015. Changes in concentrations of oxygen, dissolved nitrogen, phosphate, and silicate in the southern Yellow Sea.. 1980-2012:sources and seaward gradients. Estuarine, Coastal and Shelf Science, 163: 44-55 |
Lin A P, Shen S D, Wang J W et al, 2008. Reproduction diversity of Enteromorpha prolifera. Journal of Integrative Plant Biology, 50(5): 622-629 DOI:10.1111/j.1744-7909.2008.00647.x |
Lin A P, Shen S D, Wang G C et al, 2011. Comparison of chlorophyll and photosynthesis parameters of floating and attached Ulva prolifera. Journal of Integrative Plant Biology, 53(1): 25-34 DOI:10.1111/j.1744-7909.2010.01002.x |
Lin A P, Wang C, Qiao H J et al, 2009. Study on the photosynthetic performances of Enteromorpha prolifera collected from the surface and bottom of the sea of Qingdao sea area. Chinese Science Bulletin, 54(3): 399-404 DOI:10.1007/s11434-009-0025-6 |
Liu D Y, Keesing J K, Dong Z J et al, 2010. Recurrence of the world's largest green-tide in 2009 in Yellow Sea, China:Porphyra yezoensis aquaculture rafts confirmed as nursery for macroalgal blooms. Marine Pollution Bulletin, 60(9): 1423-1432 DOI:10.1016/j.marpolbul.2010.05.015 |
Liu D Y, Keesing J K, Xing Q G et al, 2009. World's largest macroalgal bloom caused by expansion of seaweed aquaculture in China. Marine Pollution Bulletin, 58(6): 888-895 DOI:10.1016/j.marpolbul.2009.01.013 |
Liu F, Pang S J, Chopin T et al, 2013. Understanding the recurrent large-scale green tide in the Yellow Sea:temporal and spatial correlations between multiple geographical, aquacultural and biological factors. Marine Environmental Research, 83: 38-47 DOI:10.1016/j.marenvres.2012.10.007 |
Liu F, Pang S J, Zhao X B et al, 2012. Quantitative, molecular and growth analyses of Ulva microscopic propagules in the coastal sediment of Jiangsu province where green tides initially occurred. Marine Environmental Research, 74: 56-63 DOI:10.1016/j.marenvres.2011.12.004 |
Liu Q, Yu R C, Yan T et al, 2015. Laboratory study on the life history of bloom-forming Ulva prolifera in the Yellow Sea. Estuarine, Coastal and Shelf Science, 163: 82-88 DOI:10.1016/j.ecss.2014.08.011 |
Ma J, Wang W, Qu L M et al, 2019. Differential photosynthetic response of a green tide alga Ulva Linza to ultraviolet radiation, under short-and long-term ocean acidification regimes. Photochemistry and Photobiology, 95(4): 990-998 DOI:10.1111/php.13083 |
Pearson G A, Serrão E A, Brawley S H, 1998. Control of gamete release in fucoid algae:sensing hydrodynamic conditions via carbon acquisition. Ecology, 79(5): 1725-1739 DOI:10.1890/0012-9658(1998)079[1725:COGRIF]2.0.CO;2 |
Santelices B, Paya I, 1989. Digestion survival of algae:some ecological comparisions between free spores and propagules in fecal pellets. Journal of Phycology, 25(4): 693-699 DOI:10.1111/j.0022-3646.1989.00693.x |
Shi X Y, Qi M Y, Tang H J et al, 2015. Spatial and temporal nutrient variations in the Yellow Sea and their effects on Ulva prolifera blooms. Estuarine, Coastal and Shelf Science, 163: 36-43 DOI:10.1016/j.ecss.2015.02.007 |
Smetacek V, Zingone A, 2013. Green and golden seaweed tides on the rise. Nature, 504(7478): 84-88 DOI:10.1038/nature12860 |
Smith V H, 2003. Eutrophication of freshwater and coastal marine ecosystems a global problem. Environmental Science and Pollution Research, 10(2): 126-139 DOI:10.1065/espr2002.12.142 |
Solomonson L P, Barber M J, 1990. Assimilatory nitrate reductase:functional properties and regulation. Annual Review of Plant Physiology and Plant Molecular Biology, 41: 225-253 DOI:10.1146/annurev.pp.41.060190.001301 |
Song W, Li Y, Fang S et al, 2015. Temporal and spatial distributions of green algae micro-propagules in the coastal waters of the Subei Shoal, China. Estuarine, Coastal and Shelf Science, 163: 29-35 DOI:10.1016/j.ecss.2014.08.006 |
Teichberg M, Fox S E, Olsen Y S et al, 2010. Eutrophication and macroalgal blooms in temperate and tropical coastal waters:nutrient enrichment experiments with Ulva spp. Global Change Biology, 16(9): 2624-2637 |
Tikkanen M, Nurmi M, Suorsa M et al, 2008. Phosphorylation- dependent regulation of excitation energy distribution between the two photosystems in higher plants. Biochimica et Biophysica Acta, 1777: 425-432 DOI:10.1016/j.bbabio.2008.02.001 |
Togashi T, Motomura T, Ichimura T et al, 1999. Gametic behavior in a marine green alga, Monostroma angicava:an effect of phototaxis on mating efficiency. Sexual Plant Reproduction, 12(3): 158-163 DOI:10.1007/s004970050187 |
Wang H, Lin A P, Gu W H et al, 2016. The sporulation of the green alga Ulva prolifera is controlled by changes in photosynthetic electron transport chain. Scientific Reports, 6: 24923 DOI:10.1038/srep24923 |
Wang H, Wang G C, Gu W H, 2020. Macroalgal blooms caused by marine nutrient changes resulting from human activities. Journal of Applied Ecology, 57(4): 766-776 DOI:10.1111/1365-2664.13587 |
Wang Y, Wang Y, Zhu L et al, 2012. Comparative studies on the ecophysiological differences of two green tide macroalgae under controlled laboratory conditions. PLoS One, 7(8): e38245 DOI:10.1371/journal.pone.0038245 |
Wichard T, Charrier B, Mineur F et al, 2015. The green seaweed Ulva:a model system to study morphogenesis. Frontiers in Plant Science, 6: 72 |
Wu H L, Huo Y Z, Zhang J H et al, 2015. Bioremediation efficiency of the largest scale artificial Porphyra yezoensis cultivation in the open sea in China. Marine Pollution Bulletin, 95(1): 289-296 |
Wu H, Shen J, Zhu J R et al, 2014. Characteristics of the Changjiang plume and its extension along the Jiangsu Coast. Continental Shelf Research, 76: 108-123 DOI:10.1016/j.csr.2014.01.007 |
Yamagishi T, Hishinuma T, Kataoka H, 2003. Bicarbonate enhances synchronous division of the giant nuclei of sporophytes in Bryopsis plumosa. Journal of Plant Research, 116(4): 295-300 DOI:10.1007/s10265-003-0092-8 |
Yokono M, Takabayashi A, Akimoto S et al, 2015. A megacomplex composed of both photosystem reaction centres in higher plants. Nature Communication, 6: 6675 DOI:10.1038/ncomms7675 |
Zafiriou O C, McFarland M, Bromund R H, 1980. Nitric oxide in seawater. Science, 207(4431): 637-639 DOI:10.1126/science.207.4431.637 |
Zhang J H, Huo Y Z, Yu K F et al, 2013. Growth characteristics and reproductive capability of green tide algae in Rudong coast, China. Journal of Applied Phycology, 25(3): 795-803 DOI:10.1007/s10811-012-9972-4 |
Zhao X H, Cui J J, Zhang J H et al, 2019. Reproductive strategy of the floating alga Ulva prolifera in blooms in the Yellow Sea based on a combination of zoid and chromosome analysis. Marine Pollution Bulletin, 146: 584-590 DOI:10.1016/j.marpolbul.2019.07.018 |
Zhao X Y, Tang X X, Zhang H X et al, 2016. Photosynthetic adaptation strategy of Ulva prolifera floating on the sea surface to environmental changes. Plant Physiology and Biochemistry, 107: 116-125 DOI:10.1016/j.plaphy.2016.05.036 |
Zheng Z B, Gao S, Wang G C, 2019a. Far red light induces the expression of LHCSR to trigger nonphotochemical quenching in the intertidal green macroalgae Ulva prolifera. Algal Research, 40: 101512 DOI:10.1016/j.algal.2019.101512 |
Zheng Z B, Gao S, Wang G C, 2019b. High salt stress in the upper part of floating mats of Ulva prolifera, a species that causes green tides, enhances non-photochemical quenching. Journal of Phycology, 55(5): 1041-1049 DOI:10.1111/jpy.12881 |
Zhu M, Liu Z P, Shao H B et al, 2016. Effects of nitrogen and phosphate enrichment on the activity of nitrate reductase of Ulva prolifera in coastal zone. Acta Physiologiae Plantarum, 38(7): 169 DOI:10.1007/s11738-016-2178-7 |
 2020, Vol. 51
2020, Vol. 51

