中国海洋湖沼学会主办。
文章信息
- 张盾, 吴佳佳. 2020.
- ZHANG Dun, WU Jia-Jia. 2020.
- 海洋环境微生物腐蚀机理研究进展
- RESEARCH PROGRESS ON THE MECHANISMS OF MICROBIOLOGICALLY INFLUENCED CORROSION IN MARINE ENVIRONMENT
- 海洋与湖沼, 51(4): 821-828
- Oceanologia et Limnologia Sinica, 51(4): 821-828.
- http://dx.doi.org/10.11693/hyhz20200300061
文章历史
-
收稿日期:2020-03-08
收修改稿日期:2020-05-07
2. 中国科学院海洋大科学研究中心 青岛 266071
2. Center for Ocean Mega-Science, Chinise Academy of Sciences, Qingdao 266071, China
海洋腐蚀是人类开发利用海洋所借助的工程装备与设施必须面临的考验,由于海洋环境的腐蚀苛刻性,海洋腐蚀危害严重。一方面海洋腐蚀造成巨大的经济损失。根据我国最新的腐蚀调查结果,2014年我国由腐蚀造成的经济损失约占当年GDP的3.34% (Hou et al, 2017),而海洋腐蚀损失占总腐蚀损失的三分之一左右、数值超过7000亿元,相当于当年整个甘肃省的GDP被海洋腐蚀损失掉。另一方面海洋腐蚀威胁人身安全与海洋生态环境。由海洋腐蚀引起的英国北海“亚历山大基定德”号钻井平台坍塌、英国石油公司墨西哥湾“深水地平线”钻井平台爆炸、山东黄岛排水暗渠爆炸等事故分别造成123、11和62人遇难,“深水地平线”钻井平台爆炸还造成了超过400万桶的原油泄漏环境灾害(侯保荣等, 2016)。海洋环境的腐蚀苛刻性不仅来自海水因含有大量的盐类所具备的强电解质溶液性质,而且与其生物活性密切相关。微生物作为海洋环境生物活性的重要标志,微生物腐蚀(microbiologically influenced corrosion, MIC)在海洋工程装备与设施的金属材料的腐蚀失效中的作用不可忽视,如钢桩在紧邻低潮线下发生的低水位加速腐蚀现象就是MIC的典型实例(吴佳佳等, 2018)。
MIC是指受微生物活性影响的腐蚀。金属材料的MIC有几个显著特点:首先,MIC是一电化学过程;其次,微生物能够影响腐蚀的程度和过程;再次,MIC的发生除需要微生物外,还需要水、能量来源、碳源、电子供体、电子受体等。早在19世纪中叶到20世纪20年代,人们就已意识到了微生物参与并影响腐蚀过程,而且确定了硫酸盐还原菌(sulphate- reducing bacteria, SRB)在MIC中的重要性。随后,在20世纪20年代到60年代之间,出现许多里程碑式的研究结果,如氧化还原电位可作为MIC的重要指示、氢化酶的发现、首例由MIC导致的地下管道破坏事故的确定、SRB经典阴极去极化理论的提出等。在20世纪80年代以后,随着不同学科之间交流的加强以及研究手段的不断进步与融合,MIC研究报道在数量和质量上有了突跃发展,人们对MIC机理的认知也在不断深化。
中国科学院海洋研究所在海洋腐蚀研究方面已有近70年的积累,近十几年来,本研究组在国家973计划、国家重点研发计划、国家自然科学基金等国家级项目及中国科学院、地方政府一些项目的支持下,围绕海洋环境MIC机理开展了大量研究工作,并取得了一些重要进展。由于MIC是微生物、环境、材料共同作用的结果,因此本文将结合自己的研究积累从这三个方面对海洋环境MIC机理研究进展进行概述,以期促进该研究方向的更好发展。
1 微生物腐蚀的海洋环境依赖性海洋环境的物理、化学、生物等因子的变化具有三大梯度特征,包括从赤道到两极的维度梯度、从海面到深海海底的深度梯度、从沿岸到开阔大洋的水平梯度。由于环境是材料腐蚀必不可少的因素,环境的复杂变化可引起腐蚀过程的复杂变化,作为一种重要腐蚀形式的MIC也不例外。在海洋腐蚀研究中,人们习惯上以海面到深海海底的深度方向为基准,将海洋环境划分为五个腐蚀区带,即海洋大气区、浪花飞溅区、潮差区、海水全浸区和海底泥土区。海洋环境因子在维度与水平方向的变化,可作为一变化参量融入上述五个腐蚀区带中。
海水全浸区和海底泥土区是MIC作用最突出的区带,由于全浸区的影响范围更广、加之相较于海底泥土区其更容易在实验室条件下模拟,所以目前的海洋环境MIC研究大多以海水全浸区为背景。海水全浸区环境的物理因子主要包括温度、流速等,化学因子主要包括盐度、pH、溶解氧浓度、营养水平、污染物水平等,生物因子主要包括生物种类与数量等。其中,溶解氧浓度、营养水平对海水全浸区MIC的影响是目前研究比较多的,以下将对其分别进行概述。
1.1 溶解氧浓度溶解氧是非常重要的阴极去极化剂,海洋环境中的金属材料除镁等高反应活性材料外,在溶解氧存在的情况下大多发生氧阴极去极化腐蚀,多种因素综合作用下的溶解氧还原反应速率决定了金属材料的腐蚀速率。溶解氧浓度从热力学的角度可影响溶解氧还原反应的平衡电位,从动力学的角度可影响氧还原反应的电流密度,因而在海洋腐蚀中扮有重要角色。针对MIC,溶解氧浓度除影响阴极反应的电位和电流密度外,还可通过影响微生物的生长代谢物影响腐蚀过程。
溶解氧浓度对MIC的影响与微生物的生长代谢特征密切相关。溶解氧浓度对好氧微生物作用下金属材料腐蚀的影响相对小,这是因为MIC主要通过生物膜实现。对好氧微生物而言,其在金属材料表面的附着成膜将使得界面溶解氧浓度显著降低,进而对腐蚀产生影响;体系中溶解氧浓度的高低变化,对生物膜中溶解氧浓度的影响相对小,因而对腐蚀影响微弱。溶解氧对好氧与厌氧微生物共同作用、既可好氧又可厌氧代谢的微生物作用下金属材料腐蚀具有显著影响,且影响因微生物体系不同而不同。本研究组前期研究了以脱硫弧菌为主的混合菌体系中,不同溶解氧浓度下脱硫弧菌的生长与Q235碳钢的腐蚀,发现溶解氧浓度的增加抑制了脱硫弧菌的生长、加速了其衰亡,但使得腐蚀速率增加(Wan et al, 2010) (图 1)。我们最近的研究结果表明,溶解氧浓度可显著改变泰坦尼克号单胞菌对低合金钢腐蚀的影响,在有氧条件下,该菌株以溶解氧为最终电子受体,抑制了低合金钢的腐蚀;而在无氧条件下,泰坦尼克号单胞菌以铁氧化物为最终电子受体,促进了低合金钢的腐蚀,相关工作的论文正在评审中。
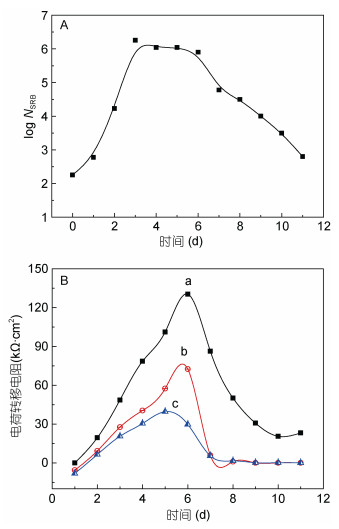 |
| 图 1 不同介质中脱硫弧菌的生长曲线(A)与浸泡在其中的Q235碳钢的电荷转移电阻随时间的变化曲线(B) (Wan et al, 2010) Fig. 1 Growth curves of Desulfovibrio sp. (A) and time-dependence of charge transfer resistance of Q235 carbon steel immersed in different media (B) (Wan et al, 2010) 注:NSRB:硫酸盐还原菌SRB的数量;a:氮气饱和介质;b:空气饱和介质;c:氧气饱和介质 |
营养水平直接影响微生物的生长代谢,因而可对海洋环境MIC产生直接影响,典型的营养物包括有机碳、无机盐等。美国俄亥俄大学的顾停月教授研究组围绕有机碳水平对脱硫弧菌等厌氧微生物作用下金属材料的腐蚀影响研究做了大量研究工作,发现当在碳钢表面预生长生物膜后暴露在不同有机碳水平的介质中时,碳饥饿会导致生物膜中微生物的数量降低,但会使得最大点蚀深度与腐蚀失重增大,即有机碳水平的降低促进了这些具有胞外电荷传递功能的微生物的腐蚀活性。当有机碳充足时,生物膜以有机碳为电子供体,而当有机碳匮乏时,微生物则会通过胞外电子传递利用铁作为电子供体,进而促进腐蚀(Xu et al, 2014; Jia et al, 2017, 2018; Dou et al, 2019)。但在不同的体系中,最大点蚀深度、腐蚀失重的峰值对应的有机碳水平不同,有的为0%有机碳(Jia et al, 2017)、有的为1%有机碳(Xu et al, 2014)、还有的为20%有机碳(Dou et al, 2019),这可能与不同体系中微生物代谢差异有关。
硝酸盐作为一种非常重要的无机盐,常被加入到用于石油工业的海水采注水中,其可通过促进硝酸盐还原菌的生长来与硫酸盐还原菌竞争有机物、抑制其生长,进而削弱由硫酸盐还原菌引起的管道腐蚀、石油酸化问题(Agrawal et al, 2012)。然而也有报道指出添加硝酸盐并不能完全阻止金属材料的腐蚀,硝酸盐对金属材料腐蚀的影响效果与其浓度和所在的环境有很大的关系。如Schwermer等(2008)进行了石油工业海水注入管道内加硝酸盐的原位试验,发现1mmol/L硝酸盐的加入使得生物膜内微生物量提高、微生物多样性降低、微生物群落的硫化物生成能力降低,使得均匀腐蚀减弱、但对点蚀无明显影响。除石油工业采注水外,随着工业、农业的不断发展,含有大量无机氮(主要是硝酸盐)的废水被排放到海洋里,造成海水的富营养化,进而可能影响海水中金属材料的腐蚀。Melchers等(2013)研究发现,钢桩的由微生物活性引起的加速低水位腐蚀的严重程度与无机氮的浓度呈正相关,即无机氮的浓度越高、加速低水位腐蚀越明显。本研究组前期开展了不同硝酸盐水平下EH40低合金钢腐蚀的研究工作,发现当天然海水中硝酸盐的添加浓度在0—100mmol/L范围时,EH40钢的腐蚀失重随硝酸盐浓度的升高而增大(图 2),硝酸盐对EH40钢腐蚀的影响被认为与其对微生物群落的影响密切相关。
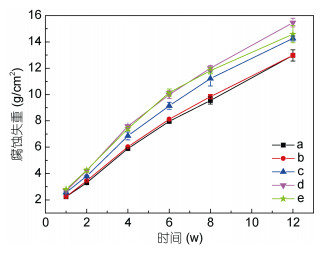 |
| 图 2 EH40钢在添加有不同浓度硝酸盐的天然海水中的腐蚀失重随时间的变化曲线 Fig. 2 The time-dependent weight loss of EH40 steel in natural seawater added with nitrate in different concentrations 注:a:0mmol/L硝酸盐;b:0.1mmol/L硝酸盐;c:1mmol/L硝酸盐;d:10mmol/L硝酸盐;e:100mmol/L硝酸盐 |
同其他自然环境一样,海洋环境中工程装备与设施的表面往往覆盖由复杂微生物群落组成的生物膜,生物膜可以为微生物的生存生长繁殖提供保护。在生物膜的不同深度,溶解氧、有机物、无机盐等的浓度不同,使得分布在不同阶层的微生物种类存在差异(图 3)。在接近流体相的生物膜表层,溶解氧含量高、营养物质供给方便,该层的微生物进行有氧代谢,降解有机物产生简单聚合物和有机酸,硝化细菌、锰氧化菌、铁氧化菌(IOB)、硫氧化菌(SOB)等均可在此层出现。随着生物膜深度的增加,溶解氧浓度降低,可以利用来自表层微生物的代谢产物的兼性厌氧菌得以生存,如某些进行发酵、反硝化代谢的微生物。在靠近金属基体的生物膜底层,溶解氧浓度非常低、处于贫氧状态,这利于厌氧微生物的生存,包括甲烷菌、硫酸盐还原菌(SRB)、铁还原菌(IRB)等。为了深层次的揭示MIC机理,人们往往采用点面结合的方式进行MIC机理研究,既从点的角度专注于某些典型微生物的腐蚀影响研究,又从面的角度融入混合菌株、复杂微生物群落的腐蚀影响,以下将从单菌株、混合菌株、复杂微生物群落三个层次概述MIC的菌株依赖性。
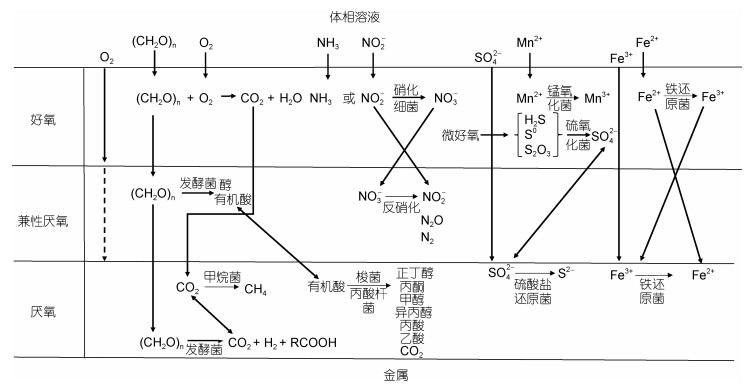 |
| 图 3 腐蚀金属表面典型生物膜的层状特征及可能的反应 Fig. 3 Layer characteristic of typical biofilm on corroded metal surface and possible reactions |
海洋环境MIC研究中涉及的微生物种类繁多,微生物的影响既可以是腐蚀促进又可以是腐蚀抑制,这与菌株特性有关。针对海洋工程最常用的碳钢、低合金钢材料,大多数在近中性pH体系中生存的好氧微生物起腐蚀抑制作用,主要的作用机制为有氧呼吸消耗溶解氧降低阴极反应速率。尽管很多好氧微生物产生有机酸导致生物膜内pH降低有利于腐蚀过程的发生,但这种腐蚀促进作用往往小于溶解氧浓度降低所引起的腐蚀抑制效应,典型代表性菌株如假交替单胞菌(Wu et al, 2016)。相反,大多数的厌氧微生物则使得碳钢、低合金钢的腐蚀速率大大提高,其中的典型代表为SRB,这类微生物是MIC研究的热点。由于微生物的腐蚀促进作用严重威胁海洋工程装备与设施的安全服役,我们在此只介绍典型的腐蚀促进菌株(如SRB、SOB、IOB、IRB等)的作用机理。
2.1.1 硫酸盐还原菌SRB长期以来被认为是最重要的厌氧腐蚀微生物,由其造成的腐蚀损失约占整个MIC损失的一半以上。SRB的突出特征为可将硫酸盐还原为硫化物从中获取能量。自1934年经典的阴极去极化理论的提出以来,已有多种腐蚀机理被报道。阴极去极化理论的核心在于氢化酶可将阴极还原产生的吸附氢利用、实现阴极的去极化,该理论第一次从电化学的角度诠释了SRB对腐蚀的影响,但其存在一定的问题,比如按照该理论腐蚀的Fe与生成的FeS的摩尔比为4︰1,但在实际情况下,比值为0.9—1。随后,硫化物的去极化作用、挥发性磷化物的加速作用、阳极去极化理论、胞外多聚物螯合金属离子理论、应力腐蚀开裂理论、硫化物的生物矿化理论等被提出,这些理论弱化了微生物的直接作用。2004年Dinh等(2004)提出了直接获取电子理论,该理论针对特定的自养型SRB物种,它们可以导致腐蚀速率的显著增加,而不需要消耗氢气。SRB一方面通过与金属材料的直接接触获取来自阳极Fe溶解释放的电子,另一方面伴随着FeS腐蚀产物的积累,SRB与基体金属材料之间被FeS隔离,但由于FeS是良好的电子导体,因而附着在和包裹于FeS的SRB依然可以直接获取来自金属基体氧化释放的电子。与其他SRB物种作用下的腐蚀产物相比,该理论下的腐蚀产物层主要以无机硬质形式存在,而不存在大量的菌体细胞和胞外多聚物。顾停月等在前人研究的基础上,创新性的从生物能量学角度出发,提出了生物催化阴极硫酸盐还原理论(Li et al, 2018; Gu et al, 2019)。该理论的核心为SRB可通过胞外电子传递以Fe为电子供体获取能量维持生存,即从生物能量学的角度很好的解释了SRB为什么要腐蚀钢铁材料,该理论极大的推动了人们对SRB腐蚀机理的认知,与其相关的胞外电荷传递机制研究依然是目前微生物电化学领域的研究热点。值得一提的是,生物催化阴极理论也适用于硝酸盐还原菌(NRB)对钢铁材料的腐蚀影响(Xu et al, 2013)。
2.1.2 硫氧化菌SOB的突出特征为利用硫化物、单质硫、硫代硫酸盐、亚硫酸盐等还原态硫化物氧化为硫酸的转变获取能量。一般认为,SOB通过酸腐蚀机理加速材料的腐蚀,其代谢产生的硫酸能够降低pH、不利于某些保护性腐蚀产物的沉积,从而促进腐蚀的发生。目前,对SOB的腐蚀研究主要集中于金属材料的加速低水位腐蚀和混凝土的加速腐蚀。
2.1.3 铁氧化菌IOB利用Fe(Ⅱ)到Fe(Ⅲ)的氧化获取能量,其往往被认为与管道中锈瘤的形成密切相关。IOB生物膜及Fe(Ⅲ)腐蚀产物在金属表面的沉积使得被覆盖部分溶解氧浓度降低成为贫氧区,而未覆盖部分溶解氧含量高作为阴极区,小阳极大阴极的结构使得覆盖区电流密度大。阳极溶解产生的金属离子发生水解产生H+使得局部pH降低,同时,大量H+的积累引起体相溶液中腐蚀性阴离子(如Cl–)向阳极区迁移,从而诱发点蚀。
2.1.4 铁还原菌IRB是一类具备将Fe(Ⅲ)还原为Fe(Ⅱ)能力的微生物,从对氧的需求角度来讲,IRB包括严格厌氧菌和兼性厌氧菌,在流动体系氧被频繁引入的情况下,兼性厌氧菌比严格厌氧菌更有竞争优势。IRB对腐蚀的影响既可以是促进,又可以是抑制。腐蚀促进可以通过将保护性的Fe(Ⅲ)氧化物还原为可溶性的Fe(Ⅱ)以破坏保护膜的方式实现(Little et al, 2002),也可通过我们课题组所提出的促进局部腐蚀的形式实现(Chen et al, 2019),还可通过与氢共存时的氢氧化理论实现(Moreira et al, 2014)。腐蚀抑制作用的发挥可通过兼性IRB的消耗溶解氧(Dubiel et al, 2002)、形成蓝铁矿等保护性产物层(Cote et al, 2015)、经由纳米线传递电子产生阴极电流(Yan et al, 2008)等途径实现。因此,在IRB的腐蚀影响机理研究中,需要特别注意菌株与环境的协同。
2.2 混合菌株海洋环境中一种微生物的生长代谢会受到与其共同生存的其他微生物的影响,因而在深入解析单菌株对金属材料腐蚀影响的基础上,研究两种或多种微生物共同作用下的腐蚀可更接近实际环境,进而为复杂海洋环境下MIC的解析提供基础。相较于单菌株,混合菌株对金属材料腐蚀的影响既可以通过菌株间的协同作用实现,又可以通过拮抗作用实现。
2.2.1 菌株间的协同作用如果一种菌株的存在对另外菌株的生长代谢有利或不同菌株的存在对彼此的生长代谢都有利,那么这些混合菌株体系下的MIC将是菌株间协同作用的结果(Jin et al, 2019)。从对溶解氧需求的角度,好氧微生物与厌氧微生物的协同作用可表现在好氧微生物代谢消耗溶解氧创造贫氧条件,为厌氧微生物的生存生长代谢提供便利,进而使其发挥腐蚀活性,典型例子如本研究组所报道的空气饱和海水中好氧微生物假交替单胞菌与厌氧微生物脱硫弧菌共同作用下Q235碳钢的局部腐蚀加速(Wu et al, 2016);好氧微生物与产氧微生物的协同作用可表现在好氧微生物代谢产生的二氧化碳可作为产氧微生物的原材料进而促进产氧微生物的生长代谢,使产氧微生物的腐蚀活性发挥,如本研究组前期报道的空气饱和海水培养基中好氧微生物假交替单胞菌与产氧微生物聚球藻共同作用下Q235碳钢的腐蚀失重加速(Tan et al, 2018)(图 4)。从元素循环的角度,当代谢过程使得某一元素价态升高的微生物与具备使同一元素价态降低代谢特征的微生物共存时,会实现对同一元素的循环利用,保障不同微生物腐蚀活性的发挥,典型例子如SRB与SOB、IOB与IRB的协同。
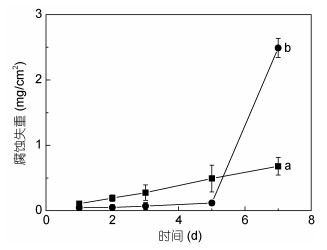 |
| 图 4 Q235碳钢在不同体系中腐蚀失重随时间的变化曲线 Fig. 4 Time dependent weight loss of Q235 carbon steel in different systems 注:a:单纯聚球藻体系;b:聚球藻与假交替单胞菌混合体系 |
如果一种菌株的存在抑制了另外菌株的生长代谢,那么菌株间通过拮抗作用对金属材料的腐蚀起作用。拮抗作用的实现方式既可以是对相同营养物质的竞争,如介质中硫酸盐与硝酸盐并存时,SRB与NRB对有机碳的竞争所产生的对腐蚀的影响;又可以是代谢产物的生长抑制,如当短芽孢杆菌与脱硫芽孢弯曲菌共存时,前者所分泌的短杆菌肽S抗生素可抑制后者的生长,进而使腐蚀速率降低20余倍(Zuo et al, 2004)。值得注意的是,混合菌株间的拮抗作用并不一定导致金属材料的腐蚀抑制,这取决于不同菌株腐蚀活性的差异和不同菌株生长代谢的受影响程度。
2.3 复杂微生物群落海洋环境中金属材料的MIC是多种微生物共同作用的结果,研究复杂微生物群落作用下金属材料的腐蚀机理更具实际应用价值。但遗憾的是,在实验室条件下难以构筑与实海环境相近的复杂微生物群落,因而复杂微生物群落作用下的金属材料腐蚀研究滞后。目前,在实验室条件下开展的海洋复杂微生物群落对腐蚀的影响研究工作,一般通过比较灭菌海水和天然海水中金属材料的腐蚀差异来实现(吴进怡等, 2010)。由于对天然海水的供应要求,海洋复杂微生物群落作用下的金属材料腐蚀研究主要集中于临海的研究单位,这就大大削弱了研究力量。加之,海洋环境微生物群落具有海域、季节等的依赖性,再现性比较差,进一步增加了这方面的研究难度。值得庆幸的是,随着现代分子生物学技术的进步,基因组学、蛋白组学、转录组学、代谢组学等手段正逐步被利用到复杂微生物群落的腐蚀影响研究中,使得微生物群落在物种多样性解析、功能预测等方面有了质的提高,实现了更加科学与全面的剖析复杂微生物群落与腐蚀的相关性(Zhang et al, 2019a, 2019b)。由于目前有关海洋环境复杂微生物群落对腐蚀影响的报道还比较少,难以提取出群落结构组成、功能等对金属材料腐蚀的调控规律,调控机制的解析则更需等待。
3 微生物腐蚀的材料性质依赖性与其他腐蚀形式相似,材料性质对海洋环境MIC具有重要影响。在相同的微生物体系中,材料性质的差异可导致腐蚀过程与机制的不同。金属材料的性质受两方面影响,一是基体化学成分与结构,二是表面处理特性,以下将从这两个方面概述海洋环境MIC的材料性质依赖性。
3.1 基体化学成分与结构出于对性能与成本的综合考虑,多种金属材料被应用于海洋工程装备与设施的构筑中,如碳钢、低合金钢、不锈钢、铜合金等。这些金属材料不可避免的遭受MIC的威胁,目前已有文献按材料种类对MIC进行了综述,突出了典型金属材料的MIC特性,如天然海水中不锈钢等钝性金属材料的腐蚀电位正移现象等(田丰等, 2018)。但是目前在相同的微生物体系中,研究不同种类金属材料腐蚀的文献并不多,根据这些文献可以总结出一些基本规律。首先,相同微生物体系下不同种类金属材料的MIC促进效应差异大,一般可形成致密保护性钝化膜的金属材料具有更好的抗MIC能力。如Javed等(2017)在相同的条件下研究了SRB对十种金属材料腐蚀的影响,发现碳钢和铜镍合金的腐蚀速率显著被提高,不锈钢、Inconel合金、钛的腐蚀基本不受影响(图 5)。其次,相同微生物体系下不同种类金属材料的MIC机理差别大,从生物能量的角度这与材料主元素的氧化还原电位密切相关。如顾停月等从生物能量的角度分析得出铁氧化与硫酸根还原的耦合在热力学上是可行的、而铜氧化与硫酸根还原的耦合在热力学上是不可行的,这预示胞外电子传递机制在SRB作用下的碳钢腐蚀中可行、而这种机制不适用于SRB作用下的铜腐蚀,进一步的实验也验证了SRB对碳钢的腐蚀促进为胞外电子传递机制、而其对铜的腐蚀促进为代谢产物机制(Dou et al, 2018)。第三,相同微生物体系下同类金属材料合金元素的差异可引起MIC行为的差异,但这种差异随合金元素与微生物种类的变化而不同。如杨柯、徐大可等围绕含铜不锈钢做了大量工作,发现合金元素铜的添加可使得铜绿假单胞菌作用下2205双相不锈钢的腐蚀被抑制(Liu et al, 2018b),但可加速硫酸盐还原菌作用下316L不锈钢的腐蚀,且这种腐蚀加速作用可因低含量合金元素镧和铈的加入而减弱(Liu et al, 2018a)。第四,相同微生物体系下同类或同种金属材料微观结构的差异可引起MIC敏感性的差异。如不锈钢的焊接接头是MIC的敏感部位,Sreekumari等(2001)发现在假单胞菌作用下304L不锈钢的焊缝区由于相较于基体金属具有更高的单位面积晶界量、而微生物倾向于在晶界处附着导致焊缝区的MIC更严重。
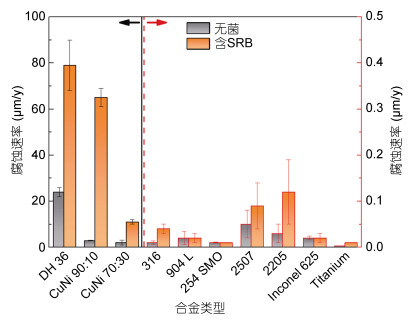 |
| 图 5 不同金属在无菌与含SRB的MB介质中浸泡90天后的腐蚀速率(Javed et al, 2017) Fig. 5 Corrosion rate of different metals under abiotic and SRB-containing MB media after 90 days of immersion (Javed et al, 2017) |
基于金属材料的MIC敏感性,为了保障其安全使用,表面处理常被用于其防护,因而表面处理特性的重要性不言而喻。与其他的腐蚀形式相比,MIC的生物膜特性赋予其某些独特的表面处理方式,这些处理方式按防护作用机制可划分两类:一类是经由表面化学活性起作用,另一类是经由表面物理活性起作用。前者主要通过在表面修饰或固载杀菌剂,通过杀菌剂对微生物的杀灭作用抑制MIC,杀菌剂的种类与数量成为影响MIC的重要因素。为了提高杀菌剂的靶向杀菌效率,智能释放防护涂层是非常重要的发展方向。我们研究组前期基于SRB的代谢特性,在铝表面构筑了具有硫离子响应的金属-多酚超分子膜层,硫离子浓度高于10mmol/L时可刺激膜层中分子阀门的打开实现对负载的三氯生杀菌剂的可控释放,从而抑制腐蚀(Cai et al, 2020)。后者主要通过改变表面的润湿性、弹性模量等物理特性来抑制微生物的附着,进而抑制MIC。这类表面的典型代表为溶胶-凝胶膜层和超滑膜层,水化层和类流体特性是这两类表面实现MIC防护的根本。针对超滑表面,我们的研究结果表明其在静态和动态条件下均可抑制SRB的附着进而抑制腐蚀,且润滑油的类型对SRB附着影响微弱(Wang et al, 2016)。
4 结语尽管人们已对MIC机理进行了大量研究,并取得了一些重要进展。但微生物种类繁多且具有强的环境适应灵活性、海洋环境的宏观时空差异性与局部潜在特殊性(如浒苔绿潮的暴发)、金属材料的多样性与微观结构复杂性使得海洋环境MIC非常复杂,MIC机理研究依然任重道远。在后续研究中,一方面可强化实验室研究与实际海洋环境的关联性,实现最大可能地揭示近实海环境下的MIC机制;另一方面可建立一涵盖微生物信息、环境特征、金属材料特性的MIC数据库,充分发挥大数据与人工智能的优势,为MIC的预测与控制提供基础。
田丰, 白秀琴, 贺小燕, 等. 2018. 海洋环境下金属材料微生物腐蚀研究进展. 表面技术, 47(8): 182-196 |
吴进怡, 柴柯, 肖伟龙, 等. 2010. 25钢在海水中的微生物单因素腐蚀. 金属学报, 46(6): 755-760 |
吴佳佳, 王鹏, 张盾. 2018. 海洋环境低水位加速腐蚀研究进展. 装备环境工程, 15(10): 27-32 |
侯保荣, 张盾, 王鹏. 2016. 海洋腐蚀防护的现状与未来. 中国科学院院刊, 31(12): 1326-1331 |
Agrawal A, Park H S, Nathoo S et al, 2012. Toluene depletion in produced oil contributes to souring control in a field subjected to nitrate injection. Environmental Science & Technology, 46(2): 1285-1292 |
Cai H Y, Wang P, Chen X T et al, 2020. Sulfide ions-induced release of biocides from a metal-phenolic supramolecular film fabricated on aluminum for inhibition of microbially influenced corrosion. Corrosion Science, 167: 108534 DOI:10.1016/j.corsci.2020.108534 |
Chen S Q, Zhang D, 2019. Corrosion behavior of Q235 carbon steel in air-saturated seawater containing Thalassospira sp. Corrosion Science, 148: 71-82 DOI:10.1016/j.corsci.2018.11.031 |
Cote C, Rosas O, Basséguy R, 2015. Geobacter sulfurreducens:an iron reducing bacterium that can protect carbon steel against corrosion?. Corrosion Science, 94: 104-113 DOI:10.1016/j.corsci.2015.01.044 |
Dinh H T, Kuever J, Mussmann M et al, 2004. Iron corrosion by novel anaerobic microorganisms. Nature, 427(6977): 829-832 DOI:10.1038/nature02321 |
Dou W W, Jia R, Jin P et al, 2018. Investigation of the mechanism and characteristics of copper corrosion by sulfate reducing bacteria. Corrosion Science, 144: 237-248 DOI:10.1016/j.corsci.2018.08.055 |
Dou W W, Liu J L, Cai W Z et al, 2019. Electrochemical investigation of increased carbon steel corrosion via extracellular electron transfer by a sulfate reducing bacterium under carbon source starvation. Corrosion Science, 150: 258-267 DOI:10.1016/j.corsci.2019.02.005 |
Dubiel M, Hsu C H, Chien C C et al, 2002. Microbial iron respiration can protect steel from corrosion. Applied and Environmental Microbiology, 68(3): 1440-1445 |
Gu T Y, Jia R, Unsal T et al, 2019. Toward a better understanding of microbiologically influenced corrosion caused by sulfate reducing bacteria. Journal of Materials Science & Technology, 35(4): 631-636 |
Hou B R, Li X G, Ma X M et al, 2017. The cost of corrosion in China. npj Materials Degradation, 1: 4 DOI:10.1038/s41529-017-0005-2 |
Javed M A, Neil W C, McAdam G et al, 2017. Effect of sulphate-reducing bacteria on the microbiologically influenced corrosion of ten different metals using constant test conditions. International Biodeterioration & Biodegradation, 125: 73-85 |
Jia R, Yang D Q, Xu D K et al, 2018. Carbon steel biocorrosion at 80℃ by a thermophilic sulfate reducing archaeon biofilm provides evidence for its utilization of elemental iron as electron donor through extracellular electron transfer. Corrosion Science, 145: 47-54 DOI:10.1016/j.corsci.2018.09.015 |
Jia R, Yang D P, Xu J et al, 2017. Microbiologically influenced corrosion of C1018 carbon steel by nitrate reducing Pseudomonas aeruginosa biofilm under organic carbon starvation. Corrosion Science, 127: 1-9 DOI:10.1016/j.corsci.2017.08.007 |
Jin Y T, Li Z, Zhou E Z et al, 2019. Sharing riboflavin as an electron shuttle enhances the corrosivity of a mixed consortium of Shewanella oneidensis and Bacillus licheniformis against 316L stainless steel. Electrochimica Acta, 316: 93-104 DOI:10.1016/j.electacta.2019.05.094 |
Li Y C, Xu D K, Chen C F et al, 2018. Anaerobic microbiologically influenced corrosion mechanisms interpreted using bioenergetics and bioelectrochemistry:a review. Journal of Materials Science & Technology, 34(10): 1713-1718 |
Little B, Ray R, 2002. A perspective on corrosion inhibition by biofilms. Corrosion, 58(5): 424-428 DOI:10.5006/1.3277632 |
Liu J L, Jia R, Zhou E Z et al, 2018b. Antimicrobial Cu-bearing 2205 duplex stainless steel against MIC by nitrate reducing Pseudomonas aeruginosa biofilm. International Biodeterioration & Biodegradation, 132: 132-138 |
Liu H W, Xu D K, Yang K et al, 2018a. Corrosion of antibacterial Cu-bearing 316L stainless steels in the presence of sulfate reducing bacteria. Corrosion Science, 132: 46-55 DOI:10.1016/j.corsci.2017.12.006 |
Melchers R E, Jeffrey R J, 2013. Accelerated low water corrosion of steel piling in harbours. Corrosion Engineering, Science and Technology, 48(7): 496-505 DOI:10.1179/1743278213Y.0000000103 |
Moreira R, Schütz M K, Libert M et al, 2014. Influence of hydrogen-oxidizing bacteria on the corrosion of low carbon steel:Local electrochemical investigations. Bioelectrochemistry, 97: 69-75 DOI:10.1016/j.bioelechem.2013.10.003 |
Schwermer C U, Lavik G, Abed R M M et al, 2008. Impact of nitrate on the structure and function of bacterial biofilm communities in pipelines used for injection of seawater into oil fields. Applied & Environmental Microbiology, 74(9): 2841-2851 |
Sreekumari K R, Nandakumar K, Kikuchi Y, 2001. Bacterial attachment to stainless steel welds:Significance of substratum microstructure. Biofouling, 17(4): 303-316 DOI:10.1080/08927010109378490 |
Tan F Q, Wu J J, Zhang D et al, 2018. Corrosion of Q235 carbon steel influenced by the introduction of aerogenic and aerobic bacteria. Materials and Corrosion, 69(9): 1196-1204 DOI:10.1002/maco.201810086 |
Wan Y, Zhang D, Liu H Q et al, 2010. Influence of sulphate-reducing bacteria on environmental parameters and marine corrosion behavior of Q235 steel in aerobic conditions. Electrochimica Acta, 55(5): 1528-1534 DOI:10.1016/j.electacta.2009.10.009 |
Wang P, Zhang D, Lu Z et al, 2016. Fabrication of slippery lubricant-infused porous surface for inhibition of microbially influenced corrosion. ACS Applied Materials & Interfaces, 8(2): 1120-1127 |
Wu J J, Zhang D, Wang P et al, 2016. The influence of Desulfovibrio sp. and Pseudoalteromonas sp. on the corrosion of Q235 carbon steel in natural seawater. Corrosion Science, 112: 552-562 DOI:10.1016/j.corsci.2016.04.047 |
Xu D K, Gu T Y, 2014. Carbon source starvation triggered more aggressive corrosion against carbon steel by the Desulfovibrio vulgaris biofilm. International Biodeterioration & Biodegradation, 91: 74-81 |
Xu D K, Li Y C, Song F M et al, 2013. Laboratory investigation of microbiologically influenced corrosion of C1018 carbon steel by nitrate reducing bacterium Bacillus licheniformis. Corrosion Science, 77: 385-390 DOI:10.1016/j.corsci.2013.07.044 |
Yan B Z, Wrenn B A, Basak S et al, 2008. Microbial reduction of Fe (Ⅲ) in hematite nanoparticles by Geobacter sulfurreducens. Environmental Science & Technology, 42(17): 6526-6531 DOI:10.1021/es800620f |
Zhang Y M, Ma Y, Duan J Z et al, 2019a. Analysis of marine microbial communities colonizing various metallic materials and rust layers. Biofouling, 35(4): 429-442 DOI:10.1080/08927014.2019.1610881 |
Zhang Y M, Ma Y, Zhang R Y et al, 2019b. Metagenomic resolution of functional diversity in copper surface- associated marine biofilms. Frontiers in Microbiology, 10: 2863 DOI:10.3389/fmicb.2019.02863 |
Zuo R J, Wood T K, 2004. Inhibiting mild steel corrosion from sulfate-reducing and iron-oxidizing bacteria using gramicidin-S-producing biofilms. Applied Microbiology and Biotechnology, 65(6): 747-753 DOI:10.1007/s00253-004-1651-1 |
 2020, Vol. 51
2020, Vol. 51


