
中国海洋湖沼学会主办。
文章信息
- 王文涛, 俞志明, 宋秀贤, 吴在兴, 袁涌铨. 2020.
- WANG Wen-Tao, YU Zhi-Ming, SONG Xiu-Xian, WU Zai-Xing, YUAN Yong-Quan. 2020.
- 长江口邻近海域氮同位素的周日变化特征及其对营养盐过程的指示
- INDICATIONS OF NUTRIENTS PROCESS REVEALED BY DIURNAL VARIATIONS OF NITROGEN ISOTOPES IN THE WATERS ADJACENT TO CHANGJIANG ESTUARINE
- 海洋与湖沼, 51(4): 909-918
- Oceanologia et Limnologia Sinica, 51(4): 909-918.
- http://dx.doi.org/10.11693/hyhz20191200270
文章历史
-
收稿日期:2019-12-21
收修改稿日期:2020-03-23
2. 青岛海洋科学与技术试点国家实验室 海洋生态与环境科学功能实验室 青岛 266237;
3. 中国科学院海洋大科学研究中心 青岛 266071;
4. 中国科学院大学 北京 100049
2. Laboratory of Marine Ecology and Environmental Science, Pilot National laboratory for Marine Science and Technology(Qingdao), Qingdao 266237, China;
3. Center for Ocean Mega-Science, Chinese Academy of Sciences, Qingdao 266071, China;
4. University of Chinese Academy of Sciences, Beijing 100049, China
长江口生态系统对于冲淡水的变化具有较高的敏感性, 然而近些年受到人类活动的影响, 长江水携带的营养物质呈现出明显的大尺度转变(Chai et al, 2006; Zhou et al, 2008;俞志明等, 2011)。尤其是长江冲淡水输入氮营养盐的年通量, 在过去数十年中增长了五倍以上, 造成了近海水体中氮磷比失衡, 极大地影响了陆海边界的水环境, 导致长江口及其邻近海域出现了一系列生态灾害(Howarth et al, 2006; Dai et al, 2011; Zhu et al, 2011)。因此氮在长江口邻近海域的迁移转化一直是学者们研究的热点问题。
鉴于氮化合形态的多样性、化合物间相互转化的复杂性及对环境的敏感性, 氮循环过程呈现出高度时空异质性, 造成传统研究方法的局限性。氮同位素示踪技术是一种海洋环境研究的先进技术, 氮在分馏作用下令不同来源的物质具有特定比值(δ15N), 并在生物地球化学过程的影响下发生相应变化, 其蕴含的丰富信息可以用于分析海洋氮的来源及其迁移转化(Sigman et al, 2009)。凭借这一技术手段, 诸多学者在长江口及邻近海域开展了一系列研究, 取得了丰硕成果。Liu等(2009)和刘丽丽等(2013)详细刻画了该海域硝态氮和铵态氮稳定同位素的时空变化, 揭示了物理、化学和生物过程对不同季节氮循环的主导作用; Chen等(2013)则发现长江口邻近海域NO3-在浮游植物同化吸收的作用下, δ15N和δ18O会按接近1︰1的比例升高; Yu等(2015)研究发现了长江口邻近海域硝化过程对NO3-补充作用的重要意义; 而此后研究进一步探明并量化了该区域不同水层的同化吸收与硝化过程及其控制因素的时空特征(Wang et al, 2017, 2018)。
目前研究已对长江口邻近海域的氮循环过程有了较为深刻的认知, 但是诸多研究都集中在中、大尺度的时间变化和长期规律, 较少关注瞬时的变化特点。潮周期连续观察则是长江口海域研究的一个重要方法, 应用范围从较早期的水文泥沙输运, 逐渐到营养物质的通量与结构, 再到较为综合的赤潮研究(沈健等, 1995;陈吉余等, 2001;王奎等, 2013), 均显示了该方法的价值。而若将连续观测周期短、稳定同位素对环境较敏感的特点相结合, 有利于在复杂环境条件下更准确地指示生物地球化学过程, 具有较大的潜力。
本研究通过在该区域开展完整潮汐周期的连续观测, 研究主要营养盐、溶解态和颗粒态氮同位素的短时刻变化特点, 精准捕捉陆源输入与外海扩散携带的营养盐及其同位素特征, 并以此指示短时间内响应的生物地球化学过程。研究结果可以与不同时间尺度的变化结果相互验证, 进一步丰富对河口区氮循环和迁移转化的认知, 以期为近海生态环境研究提供重要数据。
1 材料与方法 1.1 研究区域与采样方法通过搭载中国科学院海洋研究所科学三号考察船, 本文于2014年10月31日22:00至11月1日22:00, 在浙江省嵊山海域(122.84°E, 31.00°N)的S3站位处开展了24小时连续观测调查, 调查站位、采样情况与调查期间的潮高变化如图 1所示。观测期间每3小时采样, 使用CTD (SBE-911 plus)获取盐度、温度等水文数据, 并用采水器(12-L Niskin)采集不同深度(0、5、10、20m和底层)的海水样品。使用酸洗、450℃灼烧的GF/F滤膜过滤一定体积的海水, 滤液加入固定剂后置于-20℃冷冻保存, 用于测定氮、磷、硅等营养盐浓度; 滤膜使用锡纸包裹后置于-20℃冷冻保存, 用于测定颗粒物碳、氮同位素值。另使用普通GF/F滤膜过滤固定体积的海水样品, 滤膜使用锡纸包裹后置于-20℃冷冻保存, 用于测定叶绿素(chl a)浓度。使用碘量法在现场直接滴定溶解氧(DO)浓度, 分析的数据用于矫正CTD上携带的DO探头所取得数据, 最终得到水体中的DO浓度。
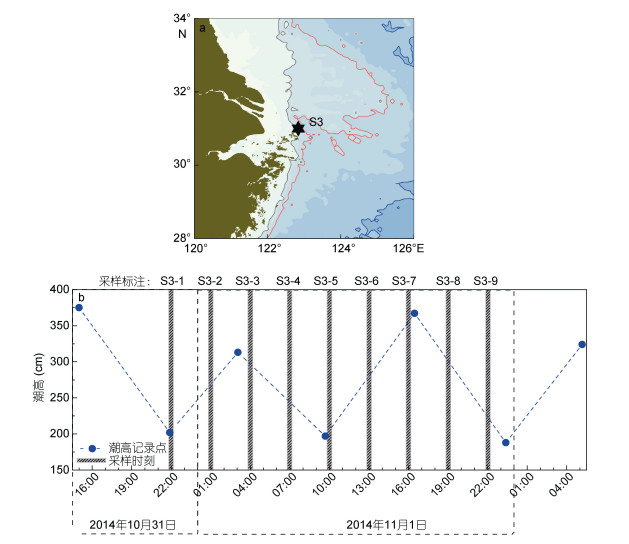 |
| 图 1 2014年10—11月长江口邻近海域连续调查站S3 (a)与采样期间嵊山站的潮汐变化(b) Fig. 1 Location of diurnal observation station S3 (a) and its height of tides (b) in waters adjacent to the Changjiang River estuarine during October to November, 2014 注: S3-1、S3-2分别表示在S3站位的第1采样时刻、第2采样时刻, 余类推。 |
营养盐的浓度借助连续流动分析仪进行测定(Skalar公司, 荷兰), 分别使用镉铜还原法测定硝酸盐, 重氮-偶氮法测定亚硝酸盐, 靛酚蓝法测定氨氮, 磷钼蓝法测定磷酸盐, 硅钼蓝法测定硅酸盐。获得的标准曲线满足相关系数≥0.999, 并借助标准溶液进行中间校准以控制数据质量。
海水样品中的δ15N-NO3-和δ18O-NO3-数据使用反硝化细菌法进行测定(Sigman et al, 2001; Casciotti et al, 2002)。鉴于这一反应会将水体中的硝酸盐和亚硝酸盐统一转化, 因此本文所提到的硝酸盐均代表NO3-与NO2-的总和。得到的δ15N-NO3-、δ18O-NO3-数据通过实验室的工作标准及国际公认标准USGS34和IAEA-N3进行矫正, 现场样品的δ15N和δ18O数据重现性分别优于±0.2‰和±0.5‰。
为测定颗粒物氮、碳同位素(δ15NP和δ13CP), 将滤膜在60℃下恒温烘干48小时, 冷却至室温后取足量的悬浮颗粒物用锡杯包裹, 使其压缩排出空气等杂质气体, 通过自动进样装置送入同位素质谱仪中进行测定。样品使用高纯度咖啡因标准品进行校正, 测量误差优于±0.5‰。
2 结果与分析 2.1 温、盐等参数的变化特征在调查期间, S3站位的盐度范围为22.3—32.7, 温度范围为20.75—21.52℃, 二者均随深度增加而逐渐升高, 分布呈现出较明显的层化特征(图 2)。表层盐度自第5采样时刻开始降低, 并在第6时刻达到最低, 应为潮汐退缩而陆源淡水涌入引起; 表层温度则在第5时刻出现最低值, 第6时刻则略微升高, 因采样时刻为13:00, 因此推测可能受到日照影响水温升高, 导致盐、温时间变化出现偏差。值得注意的是, S3站位的20m以深水层观察到两个高盐、高温水团特征, 分别出现在第2、3采样时刻和第6、7采样时刻, 盐度分别高至32.64和32.71, 而温度则分别升至21.52和21.50℃。
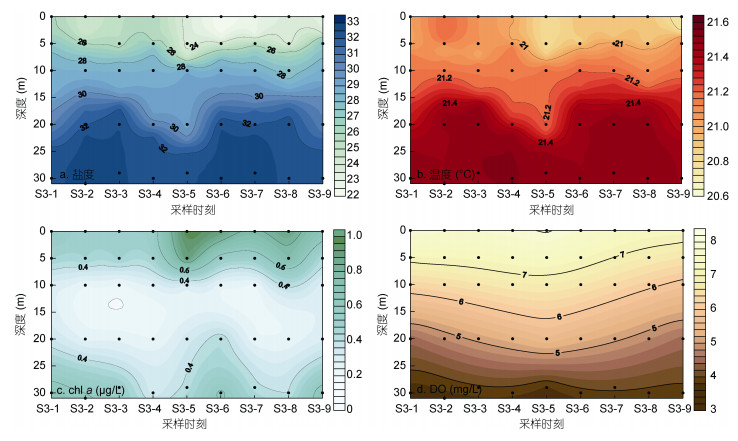 |
| 图 2 连续站S3各水层盐度、温度、chl a和DO随时间变化特征 Fig. 2 Temporal variations in salinity, temperature, chl a, and DO in station S3 |
在连续站调查期间, chl a和DO显示了不同的分布特征。Chl a在浓度范围为0.22—0.99μg/L, 高浓度分布于表层和底层, 其中最高浓度出现在第5时刻, 与低盐水出现时间一致(图 2c)。DO的浓度范围为3.65—8.05mg/L, 呈现出明显的层化现象, 自表至底浓度逐渐降低, 最高值也出现在第5时刻(图 2d)。
2.2 营养盐的连续变化特征调查期间, S3站位NO3-的浓度范围为14.09— 55.85μmol/L, 与温盐分布相反, 呈现出随深度增加而浓度降低的层化分布特征(图 3a)。在S3站位5m以浅水层持续呈现较高的NO3-浓度, 其中在第5时刻浓度明显增高, 并在第6时刻的表层达到最大值, 与低盐水团的出现时间一致。同样的, 在20m以深的水层中, NO3-出现两个浓度相对较低的水团, 分别为2—3时刻和6—7时刻, 浓度均小于18μmol/L, 与高盐水团的出现时间一致。
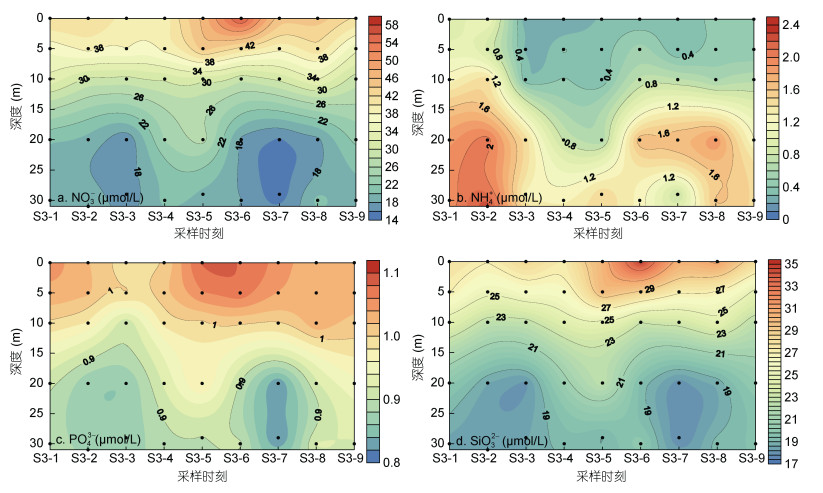 |
| 图 3 连续站S3各水层中主要营养盐随时间的变化特征 Fig. 3 Temporal variations of nutrients in station S3 |
NH4+在调查期间的浓度范围为0.21—2.26μmol/L, 分布特征与其他营养盐表现出明显不同。其中在大部分时刻, NH4+的浓度垂直分布均为表低底高, 并具有明显的层化特征(图 3b)。在5m以浅的水体中, 自第3时刻出现明显的降低后, 大部分时刻的NH4+浓度均小于0.4μmol/L。然而在20m以深的水体中, 浓度出现两个高值分布, 分别为第2时刻和第7、8时刻, 与高盐高温水团的出现时间较为接近。
本次调查期间, S3站位PO43-与SiO23-的浓度范围分别为0.82—1.08和16.80—33.85μmol/L。与NO3-的分布特征一致, 二者表现出随深度增加而浓度减小的层化特征, 且在表层的第6时刻出现最高值, 而在20m以深的水体中于第2、3和6、7时刻出现低浓度分布(图 3)。由于PO43-的浓度区间较小, 因此其变化相对不明显, 而SiO23-的分布情况与NO3-一致。
2.3 碳、氮、氧同位素的变化特征调查期间, S3站位的δ15N-NO3-值分布范围为4.7‰—11.1‰, 未呈现出明显的分布规律。其中在调查初期的5—10m处, δ15N-NO3-值达到最高(图 4a)。其后随着表层淡水的扩散和底层海水的涌入, 均向S3站位贡献了较低的δ15N-NO3-值。其中在第7时刻, 表层和5m层出现低盐水团的δ15N-NO3-值范围较为稳定, 在5.7‰—5.8‰之间。而在底层高盐水团涌入时刻, δ15N-NO3-的值范围分别为6.1‰—7.0‰(第2、3时刻)和5.9‰—6.6‰(第6、7时刻)。
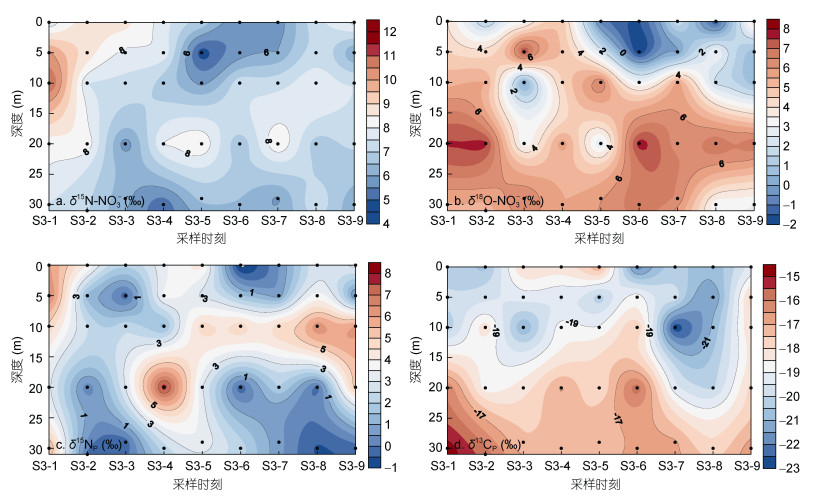 |
| 图 4 连续站S3各水层中稳定同位素的分布特征 Fig. 4 Temporal variations of stable isotopes in station S3 |
S3站位的δ18O-NO3-范围为-2.0‰—7.8‰, 与δ15N-NO3-不同, δ18O-NO3-的低值主要出现在5m以浅的水层中, 而高值则大多位于20m以深的水层(图 4b)。调查中可以发现, 低盐水输入的δ18O-NO3-值较低, 其中δ18O-NO3-的最低值出现在第6时刻的0—5m, 范围为-1.5‰— -2.0‰; 而另一方面, 高盐水输入的δ18O-NO3-值则相对略高, 在第2、3时刻和第6、7时刻, δ18O-NO3-的范围分别为5.2‰—6.5‰和6.4‰—6.8‰。
δ15NP在S3站位的范围为-1.2‰—7.9‰。尽管其未表现出明显的规律性分布特征, 但是在第6时刻, 表层出现了δ15NP的最低值(-1.2‰)(图 4c), 与δ15N-NO3-的特征相似。同样的, 在底层的2—3时刻, δ15NP也表现出了相对较低的值, 范围为-0.2‰— -0.3‰。但是与δ15N-NO3-不同, 在第6—7时刻底层的δ15NP并未出现明显低值, 而是延后到第8时刻。
调查期间, S3站位的δ13CP范围为-22.9‰— -14.7‰, 在一定程度上表现出随深度增加数值增大的特点(图 4d)。其中最低值位于第7时刻的10m处, 而最高值则出现在第1时刻的底层水。在低盐水团出现的时刻, 表层的δ13CP具有较小值, 为-21.9‰。而在高盐水团出现时, 底层δ13CP的值相对较大, 在第2时刻和第6、7时刻的值分别为-15.7‰和-16.9‰。
3 讨论 3.1 长江冲淡水对营养盐的贡献选取的S3站位位于长江口浑浊带与外海区的交界处, 盐度范围为22.3—32.7, 具有明显的咸淡水混合特点。一般情况下, 该区域营养盐的主要贡献者为陆源输入的长江冲淡水。该特征表现在S3站位营养盐的时间序列变化, 即不论NO3-、SiO32-或PO43-, 均随着低盐水出现时达到高浓度, 并在底层高盐水中表现出相对较低的浓度特点。进一步根据NO3-、SiO32-与盐度的相关性分析可以得知(图 5), 二者表现出显著负相关特征, R2值均超过0.93。而尽管PO43-与盐度的相关性R2值略低, 但仍达到0.79, 同样呈现出显著负相关特征。由此可以得知, 上述三者的主要贡献者应为长江冲淡水为主的陆源输入, 该特征与其他学者的研究结果一致(Wang et al, 2003, 2017; Zhang et al, 2007; Liu et al, 2009)。
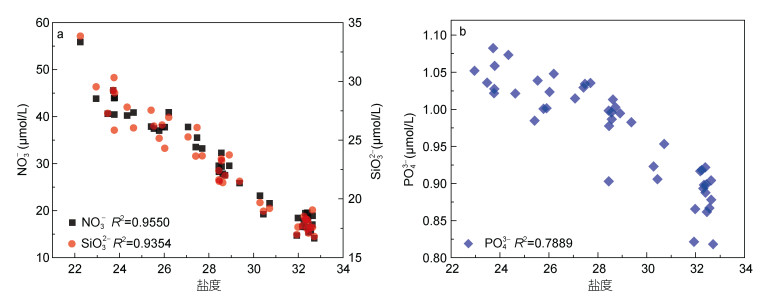 |
| 图 5 S3站位盐度与主要营养盐的相关特征 Fig. 5 Correlations between nutrients and salinity in station S3 注: a:盐度与硝酸盐、硅酸盐的相关特征; b:盐度与磷酸盐的相关特征 |
与上述营养盐相反, 全水层中的NH4+浓度与盐度呈现正相关特征, 相关性为0.57 (图 6a)。通过进一步分析NH4+在DIN (NH4++NO3-+NO2-)中所占比例[fNH4 (%)=NH4+/DIN×100]与盐度的关系发现, NH4+的比重也随盐度增加而增大, 二者变化趋势更明显(R2=0.72)。上述结果显示铵盐的来源疑似为外部高盐水的输送, 而不是陆源输入。基于这一考虑, 进一步针对深层高盐水(S > 30)中的NH4+浓度与底层盐度做时间序列分析, 结果显示二者的变化趋势呈现出一致性(图 6b), 即外海高盐水输入时NH4+浓度明显升高。此现象说明长江冲淡水可能并不是调查区域的NH4+主要贡献者, 伴随着大潮而涌入的外海水可能是NH4+的重要贡献者。
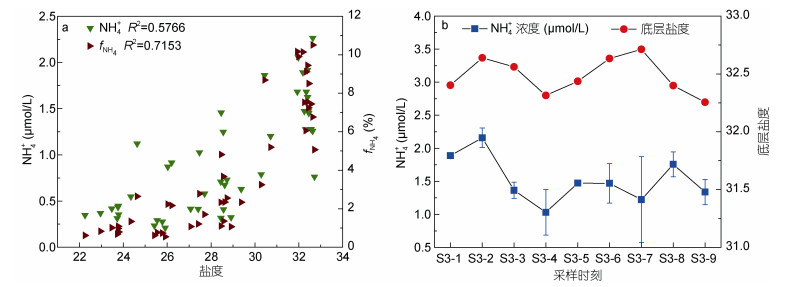 |
| 图 6 连续站S3中铵盐随盐度的变化特征 Fig. 6 Variations of ammonium concentrations with salinity in station S3 a:全水层NH4+浓度及其在DIN中所占比例随盐度的变化特点; b:不同采样时刻底层NH4+浓度和盐度的变化特点 |
根据四种稳定同位素——硝酸盐氮、氧及颗粒物氮、碳的垂直分布情况, 随低温低盐水团的输入, 四种同位素分别表现出较低值, 而在高温高盐水团输入时, 携带的同位素则各不相同(图 7)。δ15N-NO3-在盐度范围为分别为小于24、24—26、26—28、28—30、30—32和大于32中, 均值分别为6.5‰、7.5‰、8.1‰、7.7‰、8.0‰和6.4‰ (图 7a), 呈现表底低而中间高的分布; 而δ18O-NO3-在盐度自低至高的水体中均值则分别为0.9‰、2.5‰、3.4‰、3.7‰、6.8‰和5.5‰ (图 7b), 呈现逐渐升高的特征。本文调查低盐水团中的δ15N-NO3-、δ18O-NO3-值符合有机污水的输入范围(Townsend-Small et al, 2007; Xie et al, 2008), 并考虑此处仍保持较高的硝酸盐浓度, 推测该季节生物活动对同位素结果的影响较小, 符合此前的研究推论(Wang et al, 2017)。
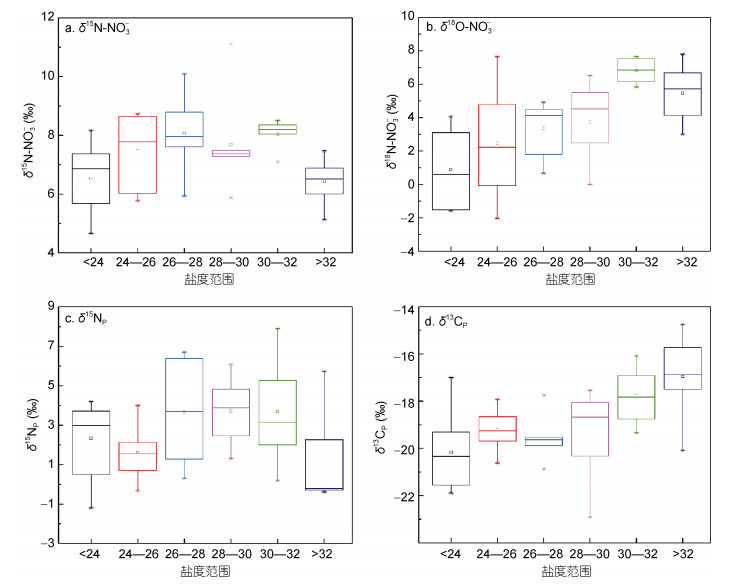 |
| 图 7 连续站S3中氮、氧、碳等稳定同位素在不同盐度范围的特征 Fig. 7 Value distributions of stable isotopes in different salinity ranges in station S3 |
在上述盐度范围内, δ15NP的平均值分别为2.3‰、1.6‰、3.7‰、3.7‰、3.7‰和1.2‰(图 7c), 与溶解态分布特点较为接近, 推测存在硝酸盐向颗粒有机质转化的过程。与长江口邻近海域调查相比本文结果较低(宋飞等, 2007;刘秀娟等, 2010;于海燕等, 2014), 但符合11月外海区的同位素特征(于海燕等, 2014)。δ13CP在不同盐度范围内的均值分别为-20.2‰、-19.2‰、-19.5‰、-19.3‰、-17.8‰和-17.0‰ (图 7d), 呈现明显的随盐度升高逐渐降低的特点。与此前研究结果相比, 低盐水体的δ13CP值略高于长江口门区域以及表层沉积物值(表 1)(刘敏等, 2004;余婕等, 2008), 而盐度30以上水体中的δ13CP值则与东海陆架区接近(Wang et al, 2008), 说明了这一区域的陆海混合特点。此外, 一般情况下典型海洋藻类的δ13CP值为-19‰— -22‰ (Fontugne et al, 1987), 本文大部分数据落在此范围内, 说明该站位有机质的主要贡献者应为海洋藻类。
| 调查时间 | δ15N-NO3-(‰) | δ18O-NO(‰) | δ13CP(‰) | δ15NP(‰) | 参考文献 |
| 2005.02—11 | - | -1.6—10.1 | 宋飞等, 2007 | ||
| 2006.02—11 | 0.4—6.5 | - | 0.6—8.2 | Liu et al, 2009;刘秀娟等, 2010 | |
| 2007.05 | -22.7— -20.5* | - | Xing et al, 2011 | ||
| 2010.02—11 | -5.5—7.0 | - | -1.1—8.6 | 于海燕等, 2014; Yu et al, 2015; | |
| 2011.03—04 | 0.5—22.3 | 0.1—27.0 | Chen et al, 2013 | ||
| 2011.07 | -23.6— -20.4* | - | Li et al, 2014 | ||
| 2012.06 | -23.6— -21.6* | - | 王金鹏等, 2015 | ||
| 2014.10 | 2.5—11.4 | -2.0—7.8 | -22.9— -14.7 | -1.2—7.9 | Wang et al, 2017;本研究 |
| 注: *表示表层沉积物数据 | |||||
为了判定在一个短暂的潮周期中该区域可能存在的生物地球化学过程, 本文进一步比较了主要氮营养盐与同位素的关系。本文已证实NO3-的主要来源为陆源输入, 当较高浓度的NO3-进入表层水后, 极可能受到浮游植物的影响而发生同化吸收过程(Zhou et al, 2008; Wang et al, 2017)。为了证实这一过程的存在, 根据chl a的垂直分布以0.4μg/L为浓度分界线(图 2), 分析大于该浓度的采样点中NO3-与其稳定同位素(δ15N-NO3-、δ18O-NO3-)存在对应关系。结果显示, 一方面, 在表层、5m和10m水层中, 硝酸盐浓度的降低会引起较为稳定的同位素值升高, 升高的斜率即为同位素分馏系数ε (图 8a, ε=6.2‰)。在此处开展的现场实验也证实, 该时期表层同化吸收速率为1.2μmol/(L·d) (Wang et al, 2018)。另一方面, 尽管在底层有一定浓度的叶绿素分布, 但是由于底层水来自于其他水团, 因此相应采样点所表征的NO3-浓度与其同位素值均呈现出与表层不同的特征。
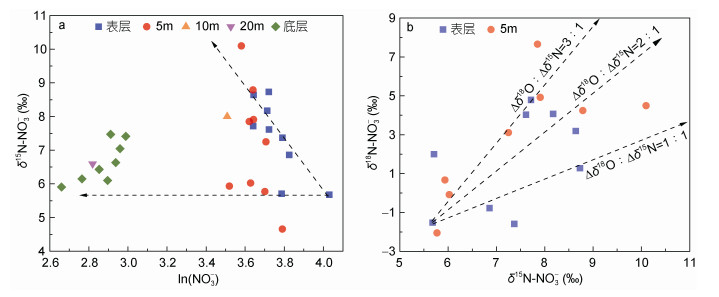 |
| 图 8 连续站位S3特定采样点(chl a > 0.4μg/L)的硝酸盐浓度及同位素的关系 Fig. 8 Correlations between concentrations and isotopes in nitrate from particular plots (chl a > 0.4 μg/L) in station S3 注: a: NO3-对数与δ15N-NO3-; b: δ15N-NO3-与δ18O-NO3- |
根据硝酸盐氮、氧稳定同位素的特性, 当硝酸盐被同化吸收时, 两种同位素会按照1︰1的比例同步升高, 但是若该过程同步伴随着硝化过程, 则会引起δ18O值的升高大于δ15N, 引起二者的“去耦合化”(Sigman et al, 2009)。据此特性, 本文对比了两种同位素在同化吸收过程显著的表层和5m层中的变化差异(图 8b), 结果显示除个别表层站点会保持1︰1的耦合变化外, 大部分样品均呈现2倍或3倍的升高差异, 说明在表层水体中仍然存在有一定程度的硝化过程对硝酸盐的消耗进行补充。
尽管5m以浅水体中可能存在硝化过程的补充, 但是多项研究表明, 长江口邻近海域的底部是硝化过程的剧烈活动区。Hsiao等(2014)研究发现, 长江口底部硝化过程会在一定程度上导致低氧的产生; Wang等(2017, 2018)则发现底部的硝化过程明显强于上层水体, 即使在秋季也大于2μmol/(L·d)。通过铵盐的垂直分布则可以发现, 当一定浓度的铵盐输入至调查站位后, 随时间推移浓度会迅速降低(图 3), 该过程既可能受到水团稀释的作用, 同时也可能受硝化作用而转化为硝酸盐。因此本文对比了NH4+在DIN中的比例(fNH4)与δ15N-NO3-的对应关系, 发现深层盐度大于31.9的水体中, fNH4与δ15N-NO3-呈负相关特征, 说明铵向硝酸盐的转化会引起δ15N的降低, 该变化特征指示了硝化过程的发生。
4 结论(1) 长江冲淡水是NO3-、PO43-和SiO32-的主要来源, 三者在短时期内均表现出与盐度较高的负相关特征; 外海输入则是NH4+的主要来源, 底部的铵盐浓度与盐度呈现出明显的变化一致的特点。
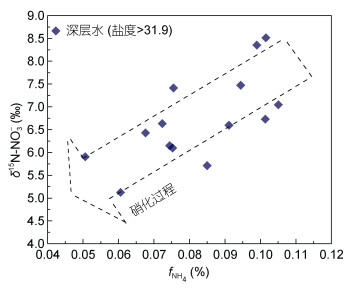 |
| 图 9 连续站S3高盐(S > 31.9)深层水中δ15N-NO3-(‰)随NH4+占比fNH4的变化特征 Fig. 9 Variation of δ15N-NO3-with the NH4+ proportion fNH4 in the high-salinity (S > 31.9) deep water in station S3 |
(2) 调查区域中δ15N-NO3-和δ18O-NO3-的范围分别为4.7‰—11.1‰和-2.0‰—7.8‰, 未显示明显的分布特征; 长江冲淡水输入的δ15NP和δ13CP则低于海水水平, 二者的范围分别为-1.2‰—7.9‰和-22.9‰— -14.7‰, 均呈现出随盐度升高而增加。
(3) 长江冲淡水输入的NO3-在较浅水层发生同化吸收过程被迅速消耗, 令NO3-浓度降低而δ15N-NO3-值升高, 且伴有一定程度的硝化过程补充, 引起了δ18O-NO3-的去耦合变化; 同样在硝化过程的影响下, 底部的NH4+自外部输入后发生了向NO3-的转化过程。
于海燕, 俞志明, 宋秀贤, 等. 2014. 长江口海域悬浮颗粒有机物的稳定氮同位素季节分布与关键生物地球化学过程. 海洋学报, 36(2): 16-22 DOI:10.3969/j.issn.0253-4193.2014.02.002 |
王奎, 陈建芳, 金海燕, 等. 2013. 长江口及邻近海区营养盐结构与限制. 海洋学报, 35(3): 128-136 DOI:10.3969/j.issn.0253-4193.2013.03.015 |
王金鹏, 姚鹏, 孟佳, 等. 2015. 基于水淘选分级的长江口及其邻近海域表层沉积物中有机碳的来源、分布和保存. 海洋学报, 37(6): 41-57 DOI:10.3969/j.issn.0253-4193.2015.06.005 |
刘敏, 侯立军, 许世远, 等. 2004. 长江口潮滩有机质来源的C、N稳定同位素示踪. 地理学报, 59(6): 918-926 DOI:10.3321/j.issn:0375-5444.2004.06.015 |
刘丽丽, 于海燕, 俞志明, 等. 2013. 海水中溶解态铵盐氮同位素分析的预处理方法. 海洋科学, 37(12): 28-33 |
刘秀娟, 俞志明, 宋秀贤, 等. 2010. 长江口海域悬浮颗粒有机物的稳定氮同位素分布及其生物地球化学意义. 海洋科学, 34(1): 11-17 |
余婕, 刘敏, 许世远, 等. 2008. 长江口潮滩有机质稳定碳同位素时空分布与来源分析. 地理研究, 27(4): 847-854 DOI:10.3321/j.issn:1000-0585.2008.04.013 |
沈健, 沈焕庭, 潘定安, 等. 1995. 长江河口最大浑浊带水沙输运机制分析. 地理学报, 6(5): 411-420 DOI:10.3321/j.issn:0375-5444.1995.05.004 |
宋飞, 宋秀贤, 俞志明. 2007. 长江口海域表层水体颗粒有机物δ15N的分布特征. 海洋与湖沼, 38(6): 521-528 DOI:10.3321/j.issn:0029-814x.2007.06.006 |
陈吉余, 陈沈良, 丁平兴, 等. 2001. 长江口南汇咀近岸水域泥沙输移途径. 长江流域资源与环境, 10(2): 166-172 DOI:10.3969/j.issn.1004-8227.2001.02.011 |
俞志明, 沈志良. 2011. 长江口水域富营养化. 北京: 科学出版社
|
Casciotti K L, Sigman D M, Hastings M G et al, 2002. Measurement of the oxygen isotopic composition of nitrate in seawater and freshwater using the denitrifier method. Analytical Chemistry, 74(19): 4905-4912 DOI:10.1021/ac020113w |
Chai C, Yu Z M, Song X X et al, 2006. The status and characteristics of eutrophication in the Yangtze River (Changjiang) estuary and the adjacent East China Sea, China. Hydrobiologia, 563(1): 313-328 DOI:10.1007/s10750-006-0021-7 |
Chen F J, Chen J F, Jia G D et al, 2013. Nitrate δ15N and δ18O evidence for active biological transformation in the Changjiang Estuary and the adjacent East China Sea. Acta Oceanologica Sinica, 32(4): 11-17 DOI:10.1007/s13131-013-0294-4 |
Dai Z J, Du J Z, Zhang X L et al, 2011. Variation of riverine material loads and environmental consequences on the Changjiang (Yangtze) Estuary in recent decades (1955−2008). Environmental Science & Technology, 45(1): 223-227 |
Fontugne M R, Jouanneau J M, 1987. Modulation of the particulate organic carbon flux to the ocean by a macrotidal estuary:Evidence from measurements of carbon isotopes in organic matter from the Gironde system. Estuarine, Coastal and Shelf Science, 24(3): 377-387 DOI:10.1016/0272-7714(87)90057-6 |
Howarth R W, Marino R, 2006. Nitrogen as the limiting nutrient for eutrophication in coastal marine ecosystems:Evolving views over three decades. Limnology and Oceanography, 51(1part2): 364-376 DOI:10.4319/lo.2006.51.1_part_2.0364 |
Hsiao S Y, Hsu T C, Liu J W et al, 2014. Nitrification and its oxygen consumption along the turbid Chang Jiang River plume. Biogeosciences, 11(7): 2083-2098 DOI:10.5194/bg-11-2083-2014 |
Li D, Yao P, Bianchi T S et al, 2014. Organic carbon cycling in sediments of the Changjiang Estuary and adjacent shelf:Implication for the influence of Three Gorges Dam. Journal of Marine System, 139: 409-419 DOI:10.1016/j.jmarsys.2014.08.009 |
Liu X J, Yu Z M, Song X X et al, 2009. The nitrogen isotopic composition of dissolved nitrate in the Yangtze River (Changjiang) estuary, China. Estuarine, Coastal and Shelf Science, 85(4): 641-650 DOI:10.1016/j.ecss.2009.09.017 |
Sigman D M, Casciotti K L, Andreani M et al, 2001. A bacterial method for the nitrogen isotopic analysis of nitrate in seawater and freshwater. Analytical Chemistry, 73(17): 4145-4153 DOI:10.1021/ac010088e |
Sigman D M, Karsh K L, Casciotti K L, 2009. Nitrogen isotopes in the ocean. In: Steele J H ed. Encyclopedia of Ocean Science. 2nd ed. Amsterdam: Elsevier
|
Townsend-Small A, McCarthy M J, Brandes J A et al, 2007. Stable isotopic composition of nitrate in Lake Taihu, China, and major inflow rivers. Hydrobiologia, 581(1): 135-140 DOI:10.1007/s10750-006-0505-5 |
Wang B D, Wang X L, Zhan R, 2003. Nutrient conditions in the Yellow Sea and the East China Sea. Estuarine, Coastal and Shelf Science, 58(1): 127-136 DOI:10.1016/S0272-7714(03)00067-2 |
Wang W T, Yu Z M, Song X X et al, 2017. Characteristics of the δ15NNO3 distribution and its drivers in the Changjiang River estuary and adjacent waters. Chinese Journal of Oceanology and Limnology, 35(2): 367-382 |
Wang W T, Yu Z M, Wu Z X et al, 2018. Rates of nitrification and nitrate assimilation in the Changjiang River estuary and adjacent waters based on the nitrogen isotope dilution method. Continental Shelf Research, 163: 35-43 DOI:10.1016/j.csr.2018.04.014 |
Wang X C, Sun M Y, Li A C, 2008. Contrasting chemical and isotopic compositions of organic matter in Changjiang (Yangtze River) estuarine and East China Sea shelf sediments. Journal of Oceanography, 64(2): 311-321 DOI:10.1007/s10872-008-0025-1 |
Xie Y X, Xiong Z Q, Xing G X et al, 2008. Source of nitrogen in wet deposition to a rice agroecosystem at Tai lake region. Atmospheric Environment, 42(21): 5182-5192 DOI:10.1016/j.atmosenv.2008.03.008 |
Xing L, Zhang H L, Yuan Z N et al, 2011. Terrestrial and marine biomarker estimates of organic matter sources and distributions in surface sediments from the East China Sea shelf. Continental Shelf Research, 31(10): 1106-1115 DOI:10.1016/j.csr.2011.04.003 |
Yu H Y, Yu Z M, Song X X et al, 2015. Seasonal variations in the nitrogen isotopic composition of dissolved nitrate in the Changjiang River estuary, China. Estuarine, Coastal and Shelf Science, 155: 148-155 DOI:10.1016/j.ecss.2015.01.017 |
Zhang J, Liu S M, Ren J L et al, 2007. Nutrient gradients from the eutrophic Changjiang (Yangtze River) Estuary to the oligotrophic Kuroshio waters and re-evaluation of budgets for the East China Sea Shelf. Progress in Oceanography, 74(4): 449-478 |
Zhou M J, Shen Z L, Yu R C, 2008. Responses of a coastal phytoplankton community to increased nutrient input from the Changjiang (Yangtze) River. Continental Shelf Research, 28(12): 1483-1489 DOI:10.1016/j.csr.2007.02.009 |
Zhu Z Y, Zhang J, Wu Y et al, 2011. Hypoxia off the Changjiang (Yangtze River) Estuary:Oxygen depletion and organic matter decomposition. Marine Chemistry, 125(1-4): 108-116 DOI:10.1016/j.marchem.2011.03.005 |
 2020, Vol. 51
2020, Vol. 51


