中国海洋湖沼学会主办。
文章信息
- 杨伟红, 郇聘, 刘保忠. 2020.
- YANG Wei-Hong, HUAN Pin, LIU Bao-Zhong. 2020.
- hedgehog基因在笠贝(Lottia goshimai)早期发育中的表达模式研究
- EXPRESSION PATTERNS OF HEDGEHOG GENE DURING EARLY DEVELOPMENT OF THE MOLLUSK LOTTIA GOSHIMAI
- 海洋与湖沼, 51(4): 960-965
- Oceanologia et Limnologia Sinica, 51(4): 960-965.
- http://dx.doi.org/10.11693/hyhz20200100005
文章历史
-
收稿日期:2020-01-06
收修改稿日期:2020-02-17
2. 青岛海洋科学与技术试点国家实验室 海洋生物学与生物技术功能实验室 青岛 266237;
3. 中国科学院大学 北京 100049
2. Laboratory for Marine Biology and Biotechnology, Pilot National Laboratory for Marine Science and Technology(Qingdao), Qingdao 266237, China;
3. University of Chinese Academy of Sciences, Beijing 100049, China
Hedgehog信号通路是调节动物发育的主要信号通路之一(Dessaud et al, 2008; Ingham et al, 2011)。从演化角度看, hedgehog基因仅发现于后生动物中, 在其近亲鞭毛虫中并不存在, 说明Hedgehog信号通路是后生动物在演化早期的一项创新, 是一类十分古老的信号通路(Ingham et al, 2011)。除脊椎动物等经历了基因组复制的类群外, Hedgehog信号通路分子在演化过程中并未发生如TGF-β(transforming growth factor β)信号通路等一样明显的复制和扩张(Ingham et al, 2011)。这一方面说明Hedgehog信号通路经历了独特的演化选择过程, 另一方面也为比较不同动物中Hedgehog信号通路的功能提供了便利。
Hedgehog信号通路参与动物早期发育过程中多种组织和器官的发育。果蝇hedgehog是一种重要的体节极性基因, 与其他基因如engrailed (en)、wingless (wg)等共同调控了体节的正确形成(Peel et al, 2005)。在脊椎动物早期胚胎中, hedgehog表达于背侧神经板的中央部位, 在形成神经管后则表达于神经管腹侧。这种表达模式导致形成了由神经管腹侧到背侧的hedgehog信号梯度, 调控了神经系统的分化(Dessaud et al, 2008)。Hedgehog信号通路还参与脊椎动物四肢的发育, 例如蛇类四肢的消失与hedgehog的区域性失活有关(Kvon et al, 2016)。此外, Hedgehog信号通路还与肌肉组织及消化道的发育相关(Ingham et al, 2011; Teixeira et al, 2018)。
hedgehog在脊椎动物和果蝇中分别参与神经系统发育和分节过程, 差异巨大。这种差异导致难以推测动物共同祖先hedgehog的功能。2002年, 研究者在软体动物中研究了hedgehog的表达, 首次发现hedgehog表达于腹侧神经外胚层的中线组织, 与脊椎动物十分类似(Nederbragt et al, 2002)。这些结果提示, Hedgehog信号系统调控神经系统发育的功能在两侧对称动物(Bilateria)的祖先中即已存在, 十分古老。这是演化发育生物学的一项重要发现, 为揭示动物身体模式的祖征及演化历史提供了重要的参考。然而自此之后相关报道比较少, 目前尚不清楚软体动物Hedgehog信号通路在其他组织中的表达情况和动态变化模式。
本文克隆了笠贝的hedgehog基因, 研究了其在原肠胚和担轮幼虫中的表达模式, 证实笠贝hedgehog基因表达于早期胚胎的神经外胚层及中/内胚层组织中。同时, 将hedgehog基因的表达模式与brachyury、soxb基因进行了比较, 展示了笠贝早期胚胎神经外胚层的结构模式, 为软体动物的发育和演化研究提供了基础支持。
1 材料与方法 1.1 笠贝幼虫的培养及固定性成熟的笠贝(Lottia goshimai)采集自青岛沿海, 运回实验室后置于新鲜海水中。待自然排精产卵后, 将精子和卵细胞悬液混合进行人工授精。受精卵置于25℃过滤海水中发育, 在不同发育阶段用筛绢过滤后用4%多聚甲醛固定, 然后转移至甲醇中冷冻保存备用。
1.2 笠贝hedgehog基因的鉴定以已知的其他动物hedgehog基因比对笠贝转录组数据库, 获得候选序列, 经聚类分析后确定笠贝hedgehog直系同源基因。利用ExPASy网站(http://www.expasy.org/tools/pi_tool.html)、SMART (http://smart.embl-heidelberg.de/)等工具分析等电点、分子量、信号肽、保守结构域等基因特征。
1.3 笠贝hedgehog、brachyury及soxb基因的表达规律研究以笠贝hedgehog、brachyury、soxb基因的片段为模板, 利用体外转录法制备地高辛标记的RNA探针, 所用引物序列如表 1所示。利用整装原位杂交技术(whole mount in situ hybridization, WMISH)研究基因在不同发育阶段的笠贝样品中的时空表达情况, 方法与本课题组前期报道相同(Huan et al, 2020)。
| 基因 | 引物序列 |
| hedgehog | F: 5′CCTCGGTGCTAGTGGTATAAGTGA3′ R: 5′CTACAACGCCGTCAACGACAATA3′ |
| brachyury | F: 5′TACGAAGAACGGCAGGAGAATGT3′ R: 5′TGAGACACAACACTAGAGGCTGAG3′ |
| soxb | F: 5′TTGCGACCGATCCTAGAGTGA3′ R: 5′TCCGTCTGTGGTGGCTTGT3′ |
从笠贝转录组中得到多个与已知hedgehog基因存在相似性的候选序列, 经聚类分析后确定了笠贝hedgehog基因。笠贝hedgehog基因编码区(coding sequence, CDS)全长1242bp, 编码413个氨基酸, 理论等电点和分子量分别为6.70和45.81kDa。预测的笠贝Hedgehog蛋白结构如图 1a所示, 1—26位氨基酸为信号肽, 之后依次为Hedgehog蛋白典型的N端signaling结构域及C端Hint (Hedgehog/Intein)结构域。成熟蛋白形成时, Hedgehog前体蛋白被酶切为N端和C段肽段, 发挥信号分子活性的是N端肽段, 该部分肽段在不同软体动物中存在很高的序列相似性(图 1b)。
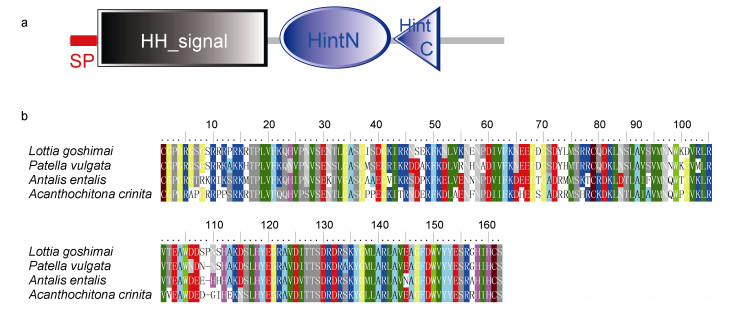 |
| 图 1 笠贝Hedgehog蛋白的结构示意图(a)和软体动物Hedgehog N端肽段的序列相似性(b) Fig. 1 The schematic diagram of L. goshimai Hedgehog (a) and the multi-alignment of the N-terminal Hedgehog signaling domains from various mollusks (b) |
聚类分析显示, 笠贝hedgehog基因与其他软体动物的hedgehog基因首先聚为软体动物分支, 之后与环节动物的hedgehog基因共同组成冠轮动物分支。水蚤、蚁、果蝇的hedgehog基因等则组成蜕皮动物/节肢动物分支, 斑马鱼、爪蟾、鸡等的hedgehog基因组成后口动物/脊椎动物分支(图 2)。以上拓扑关系与物种间的亲缘关系一致。
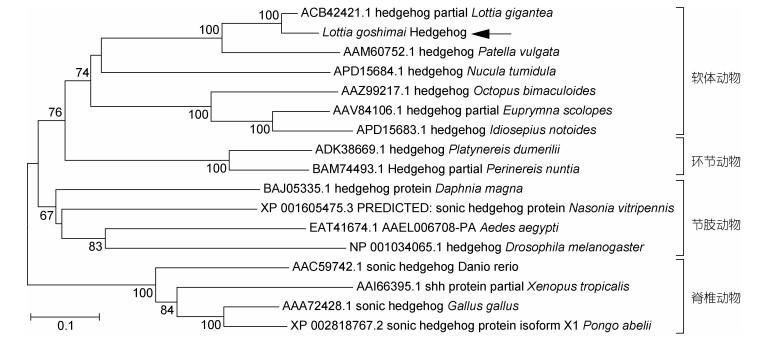 |
| 图 2 笠贝hedgehog基因的聚类分析 Fig. 2 NJ tree of L. goshimai hedgehog gene |
受精后6—10h (6—10hpf)是笠贝由早期原肠胚至担轮幼虫形成的关键发育阶段。在该阶段的笠贝胚胎中, hedgehog最显著的表达部位是神经外胚层的中线(midline)组织(图 3, 黑色箭头)。在6hpf时, 原肠作用尚在进行中, 胚孔也未形成。此时将要发育成中线组织的细胞已经形成典型的Y形结构, 这些细胞中hedgehog的表达很显著(图 3a, g)。由于原肠作用尚在早期, 此时这些组织仍位于胚胎背侧。在8hpf时, 随着外包作用的进行, 中线组织的细胞已经大半移动至腹侧, 少数尚位于胚胎底部(图 3b, h)。在10hpf时, 中线组织已完全迁移至胚胎腹侧(图 3c, i)。总之, 在原肠作用过程中, 笠贝hedgehog表达位置的变化很好地反映了相关细胞的运动模式(图 3j—l, 虚线箭头)。
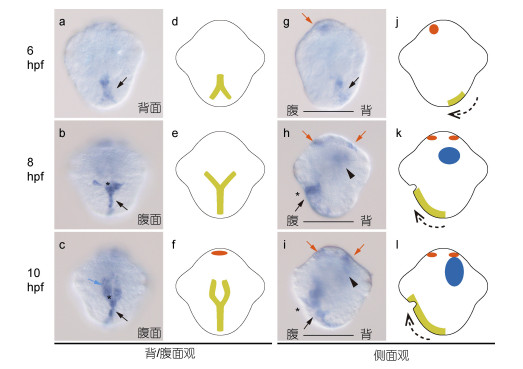 |
| 图 3 笠贝hedgehog基因在早期胚胎和幼虫中的表达模式(6—10hpf) Fig. 3 Expression patterns of hedgehog in early development of L. goshimai (6—10hpf) 注:左侧为原位杂交结果, 右侧为模式图。不同标识的含义:星号:胚孔/原口, 黑色箭头:中线组织, 红色箭头:头部外胚层组织, 蓝色箭头:原口上方组织, 无尾箭头:中/内胚层组织。其余介绍详见正文 |
除中线组织中的表达之外, 笠贝hedgehog在8及10hpf均能检测到显著的中/内胚层表达(图 3h, i, 无尾箭头)。需要说明的是, 此阶段中胚层及内胚层细胞形态类似, 在没有标记基因辅助判断的情况下难以区分。谨慎起见, 本文将这些部位的细胞统称为中/内胚层细胞。除此之外, hedgehog表达还出现在胚胎的头部外胚层组织, 可能属于头部神经组织或其前体(图 3g—i, 红色箭头)。在10hpf, 除了原口下方外(Y形结构的分叉部位), 原口上方的组织中也表达hedgehog(图 3c, 蓝色箭头)。
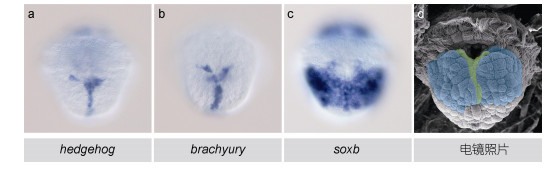
2.4 笠贝早期胚胎神经系统的结构笠贝hedgehog的早期表达与胚胎神经系统表现出明显的关联。为了全面揭示笠贝胚胎神经系统的结构模式, 进一步研究了其它两种标记基因brachyury和soxb的表达, 分析了其与hedgehog表达的关系。如图 4所示, hedgehog(图 4a)和brachyury(图 4b)的表达模式基本相同, 共表达于中线组织中; 而soxb的表达位置则覆盖了腹面外胚层的大部分区域(图 4c), 标识了整个神经外胚层的范围。基于这些结果, 对受精后8h笠贝胚胎神经系统(神经外胚层)的结构总结如下(图 4d):担轮环以下的神经外胚层位于腹面, 其中的细胞均匀地表达soxb基因。胚孔下方分布有Y形的中线组织, 除表达soxb外还表达hedgehog和brachyury, 整个神经外胚层呈左右对称分布, 这种结构模式与其他动物的神经外胚层十分相似。
神经系统发育是两侧对称动物早期发育过程的关键事件之一。除了其重要的生理功能外, 该问题还涉及动物演化的关键环节, 一直是发育和演化研究的热点问题(Denes et al, 2007; Arendt, 2018; Martín-Durán et al, 2018)。原口动物神经外胚层形成于腹侧, 由中央至侧面存在明显的分区现象, 分别表达不同的转录因子如NK2.2, Pax6、Pax3/7等(Arendt et al, 2016)。这种分区模式在两侧对称动物中存在很高的保守性, 与BMP信号通路沿背腹轴的梯度分布相关(Mizutani et al, 2008)。尽管脊椎动物神经系统分布在背侧(可能是由于演化过程中出现了背腹轴的反转) (De Robertis et al, 1996), 但其神经外胚层这种由中央至两侧的保守结构模式仍然存在。在这种结构模式当中, 位于最中央的中线组织起到了信号中心的作用, 是神经系统正确分化的关键因素之一(Dessaud et al, 2008)。中线神经组织所表达的最重要的基因之一即是hedgehog。研究表明, Hedgehog信号通路的沿中线组织向外侧的梯度分布调控了神经系统的正确形成(Dessaud et al, 2008)。
软体动物所属的冠轮动物/螺旋卵裂动物超群由于缺乏模式生物, 在早期神经系统发育及Hedgehog信号通路等方面的研究比较落后。研究者于2002年首次发现帽贝中也存在表达hedgehog的腹侧中线组织, 提示其与脊椎动物神经外胚层的中线组织同源。中线组织在软体动物和脊椎动物这两类亲缘关系很远的类群中都存在, 表明其在演化过程中承受了极大的选择压力(Nederbragt et al, 2002)。本研究以笠贝为研究对象进一步拓展了这部分研究工作, 所研究的样品覆盖了由早中期原肠胚(6hpf)到担轮幼虫(10hpf)的发育阶段, 展示了中线组织的起源和运动过程。本文结果表明, 笠贝中线组织起源于背侧外胚层, 在原肠作用中随外胚层的外包作用逐渐迁移至腹侧, 这些结果为进一步研究中线组织的分化过程提供了支撑。此外, 还发现hedgehog与brachyury的表达模式十分相似, 存在共表达关系。根据对细胞谱系的研究, brachyury的表达起始于3D、3c2、3d2等早期卵裂球(Lartillot et al, 2002), hedgehog可能也在这些卵裂球中激活。最后, 通过比较hedgehog、brachyury和soxb的表达模式, 勾勒了笠贝胚胎神经外胚层的基本结构, 这为神经系统发育的精细研究提供了基础。
除中线组织外, 在幼虫头部外胚层组织有明显的hedgehog基因表达, 这提示笠贝hedgehog基因还参与了头部神经外胚层的发育。在神经系统的发育过程中, 头部与身体部分的神经外胚层可分别激活不同的分化因子(如hox仅表达于身体部分的神经外胚层等)(Arendt et al, 2016)。然而hedgehog基因在头部和身体部分的神经外胚层均有表达, 与前后轴向的位置信息没有明显的关系, 这与目前对hedgehog对神经系统发育调控功能的认知相符合。
除参与神经系统的发育外, hedgehog基因另一个十分重要的功能是调控中、内胚层组织的发育(Ingham et al, 2011; Teixeira et al, 2018)。hedgehog和其他信号分子如FGF(fibroblast growth factors)等共同起始了肌肉干细胞的分化, 这是肌肉组织分化至关重要的一步。此外, Hedgehog通路分子表达于包括刺胞动物和脊椎动物在内的多种动物的消化道中(Matus et al, 2008; Ramalho-Santos et al, 2000), 提示其在内胚层分化中的功能也是保守的。因此, 对hedgehog基因的研究可有助于理解软体动物幼虫肌肉及消化系统的发育过程。最近在牡蛎中的研究表明, hedgehog表达于幼虫肌肉及消化道系统, 抑制hedgehog后严重影响幼虫肌肉的形成(Li et al, 2018)。虽然笠贝幼虫的肌肉系统需要到担轮幼虫时期才能检测到, 本研究发现中/内胚层组织中自8hpf起即能检测到明显的hedgehog表达, 提示该时期肌肉系统的前体细胞可能已经开始分化, 这远早于成熟肌纤维的出现时间。这个时间差可能与肌肉系统多步骤的分化模式相关。目前有报道表明腹足类软体动物的肌肉组织发育经历了复杂的分化过程(Wanninger et al, 1999; Hinman et al, 2002; Kristof et al, 2016; Kurita et al, 2016), 下一步有必要关注hedgehog具体参与调控了哪些环节。最后, hedgehog在中/内胚层的表达很可能还涉及消化系统的发育过程, 在将来的研究中, 有必要利用肌肉及消化道的标记基因与hedgehog做共表达分析, 深入研究hedgehog在内胚层器官发育中的功能。
4 结论本研究展示了hedgehog基因在笠贝不同神经外胚层组织及中/内胚层组织中的表达模式, 揭示了在早期发育过程中相关细胞的动态变化特点, 这为理解Hedgehog信号通路在软体动物早期发育中的功能以及神经、肌肉、消化道等重要器官的发生机制提供了支持。
Arendt D, 2018. Animal evolution:convergent nerve cords?. Current Biology, 28(5): R225-R227 DOI:10.1016/j.cub.2018.01.056 |
Arendt D, Tosches M A, Marlow H, 2016. From nerve net to nerve ring, nerve cord and brain-evolution of the nervous system. Nature Reviews Neuroscience, 17(1): 61-72 DOI:10.1038/nrn.2015.15 |
De Robertis E M, Sasai Y, 1996. A common plan for dorsoventral patterning in Bilateria. Nature, 380(6569): 37-40 DOI:10.1038/380037a0 |
Denes A S, Jékely G, Steinmetz P R H et al, 2007. Molecular architecture of annelid nerve cord supports common origin of nervous system centralization in Bilateria. Cell, 129(2): 277-288 DOI:10.1016/j.cell.2007.02.040 |
Dessaud E, McMahon A P, Briscoe J, 2008. Pattern formation in the vertebrate neural tube:A sonic hedgehog morphogen- regulated transcriptional network. Development, 135(15): 2489-2503 DOI:10.1242/dev.009324 |
Hinman V F, Degnan B M, 2002. Mox homeobox expression in muscle lineage of the gastropod Haliotis asinina:Evidence for a conserved role in bilaterian myogenesis. Development Genes and Evolution, 212(3): 141-144 DOI:10.1007/s00427-002-0223-6 |
Huan P, Wang Q, Tan S J et al, 2020. Dorsoventral decoupling of Hox gene expression underpins the diversification of molluscs. Proceedings of the National Academy of Sciences of the United States of America, 117(1): 503-512 DOI:10.1073/pnas.1907328117 |
Ingham P W, Nakano Y, Seger C, 2011. Mechanisms and functions of Hedgehog signalling across the metazoa. Nature Reviews Genetics, 12(6): 393-406 DOI:10.1038/nrg2984 |
Kristof A, de Oliveira A L, Kolbin K G et al, 2016. Neuromuscular development in Patellogastropoda (Mollusca:Gastropoda) and its importance for reconstructing ancestral gastropod bodyplan features. Journal of Zoological Systematics and Evolutionary Research, 54(1): 22-39 DOI:10.1111/jzs.12112 |
Kurita Y, Hashimoto N, Wada H, 2016. Evolution of the molluscan body plan:the case of the anterior adductor muscle of bivalves. Biological Journal of the Linnean Society, 119(2): 420-429 DOI:10.1111/bij.12812 |
Kvon E Z, Kamneva O K, Melo U S et al, 2016. Progressive loss of function in a limb enhancer during snake evolution. Cell, 167(3): 633-642 |
Lartillot N, Lespinet O, Vervoort M et al, 2002. Expression pattern of Brachyury in the mollusc Patella vulgata suggests a conserved role in the establishment of the AP axis in Bilateria. Development, 129(6): 1411-1421 |
Li H J, Li Q, Yu H, 2018. Molecular characterization of the hedgehog signaling pathway and its necessary function on larval myogenesis in the pacific oyster Crassostrea gigas. Frontiers in Physiology, 9: 1536 DOI:10.3389/fphys.2018.01536 |
Martín-Durán J M, Pang K, Børve A et al, 2018. Convergent evolution of bilaterian nerve cords. Nature, 553(7686): 45-50 DOI:10.1038/nature25030 |
Matus D Q, Magie C R, Pang K et al, 2008. The Hedgehog gene family of the cnidarian, Nematostella vectensis, and implications for understanding metazoan Hedgehog pathway evolution. Developmental Biology, 313(2): 501-518 DOI:10.1016/j.ydbio.2007.09.032 |
Mizutani C M, Bier E, 2008. EvoD/Vo:the origins of BMP signalling in the neuroectoderm. Nature Reviews Genetics, 9(9): 663-677 DOI:10.1038/nrg2417 |
Nederbragt A J, van Loon A E, Dictus W J A G, 2002. Hedgehog crosses the snail's midline. Nature, 417(6891): 811-812 |
Peel A D, Chipman A D, Akam M, 2005. Arthropod segmentation:beyond the Drosophila paradigm. Nature Reviews Genetics, 6(12): 905-916 DOI:10.1038/nrg1724 |
Ramalho-Santos M, Melton D A, McMahon A P, 2000. Hedgehog signals regulate multiple aspects of gastrointestinal development. Development, 127(12): 2763-2772 |
Teixeira J D, de Andrade Rosa I, Brito J et al, 2018. Sonic Hedgehog signaling and Gli-1 during embryonic chick myogenesis. Biochemical and Biophysical Research Communications, 507(1-4): 496-502 DOI:10.1016/j.bbrc.2018.11.071 |
Wanninger A, Ruthensteiner B, Lobenwein S et al, 1999. Development of the musculature in the limpet Patella (Mollusca, Patellogastropoda). Development Genes and Evolution, 209(4): 226-238 DOI:10.1007/s004270050247 |
 2020, Vol. 51
2020, Vol. 51