中国海洋湖沼学会主办。
文章信息
- 赵燕楚, 赵丽, 董逸, 张武昌, 李学刚, 赵苑, 肖天. 2020.
- ZHAO Yan-Chu, ZHAO Li, DONG Yi, ZHANG Wu-Chang, LI Xue-Gang, ZHAO Yuan, XIAO Tian. 2020.
- 热带西太平洋M4海山超微型浮游生物的生态分布特点
- ECOLOGICAL DISTRIBUTION CHARACTERISTICS OF ULTRAPLANKTON IN M4 SEAMOUNT IN THE TROPICAL WESTERN PACIFIC OCEAN
- 海洋与湖沼, 51(5): 1001-1011
- Oceanologia et Limnologia Sinica, 51(5): 1001-1011.
- http://dx.doi.org/10.11693/hyhz20191200268
文章历史
-
收稿日期:2019-12-20
收修改稿日期:2020-03-16
2. 青岛海洋科学与技术(试点)国家实验室 海洋生态与环境科学功能实验室 青岛 266237;
3. 中国科学院大学 北京 100049;
4. 中国科学院海洋大科学研究中心 青岛 266071
2. Laboratory for Marine Ecology and Environmental Sciences, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266237, China;
3. University of Chinese Academy of Sciences, Beijing 100049, China;
4. Center for Ocean Mega-science, Chinese Academy of Sciences, Qingdao 266071, China
超微型浮游生物(ultraplankton, < 10μm)包括全部的微微型浮游生物(picoplankton, 0.2—2μm)和部分微型真核浮游生物(nanoeukaryotes, 2—20μm, NEUK), 是海洋微食物网的重要组成部分(Murphy et al, 1985)。根据营养类型, 微微型浮游生物主要为微微型自养浮游生物和微微型异养浮游生物, 前者主要包括聚球藻(Synechococcus, SYN)、原绿球藻(Prochlorococcus, PRO)、微微型真核浮游生物(picoeukaryotes, PEUK); 微微型异养浮游生物主要包括细菌和古菌, 二者合称异养原核生物(heterotrophic prokaryotes, HP)(Campbell et al, 1997)。根据核酸含量的高低, 异养原核生物又分为低核酸含量异养原核生物(low nucleic acid content heterotrophic prokaryotes, LNA)和高核酸含量异养原核生物(high nucleic acid content heterotrophic prokaryotes, HNA) (Gasol et al, 1999)。微型真核浮游生物多样性非常高, 大洋中主要由普林藻纲、硅藻纲、青绿藻纲、浮生藻纲、隐藻纲的浮游生物组成(Xu et al, 2018)。尽管超微型浮游生物的体积较小, 但它们数量巨大、分布广泛, 因此是海洋生物量和生产力的主要贡献者, 也是海洋生态系统物质和能流的主要承担者(Azam et al, 2007)。在寡营养海域超微型浮游生物对总浮游植物生物量的贡献可达90%, 对初级生产力的贡献可达80% (Li et al, 1983; Agawin et al, 2000)。此外, 在大洋中它们可以通过形成聚集体或被微型浮游动物或更高营养级的中型浮游动物摄食, 通过粪便和尸体的沉降, 从表层向深海输送碳(Richardson et al, 2007);也可以通过微型生物泵将溶解有机碳转化为惰性有机碳, 在储碳过程中发挥重要作用(Jiao et al, 2010)。
海山是指自海底升高1000m, 且不露出海面的地形隆起(Rogers, 1994)。海山和洋流的相互作用会形成内波、上升流、泰勒柱、涡旋等物理过程, 这些物理过程可能会导致海山区初级生产力和浮游生物生物量升高, 从而支撑较高的鱼类和底栖生物量, 这一现象被称为“海山效应”(Dower et al, 1996; 张武昌等, 2014)。目前, 海山区浮游生态学研究比较少, 海山对浮游生物的影响也没有一致结论。在热带西太平洋Y3和M2海山研究中, 初级生产力、叶绿素a、微食物网生物等都没有在山顶附近发现升高的现象(张文静等, 2016; 代晟等, 2017; 赵丽等, 2017)。Sime-Ngando等(1992)在东太平洋亚北极的Cobb海山发现纤毛虫生物量升高。
热带西太平洋表层水温较高、营养盐含量低、受北赤道流影响, 水文环境较为复杂; 此外全球约一半的海山位于太平洋, 其中大多数在热带西太平洋海域(Yesson et al, 2011), 然而目前对该海域的海山调查研究较少。因此, 本研究选取了位于热带西太平洋的M4海山, 采用流式细胞术对0—300m水层超微型浮游生物的丰度、生物量及分布特点进行了调查, 以期了解M4海山超微型浮游生物的分布特征及与环境因子之间的关系, 为深入了解海山区浮游生态特点提供依据。
1 材料与方法 1.1 调查站位2017年8月7日—9月5日乘“科学号”调查船在热带西太平洋M4海山(10.3°—10.9°N, 139.9°— 140.4°E)进行样品采集, 共设A、B两个断面, 分别为东西向和南北向, 交叉于海山顶(图 1)。海山山顶距海面57m, 10号站最深(5999m)。
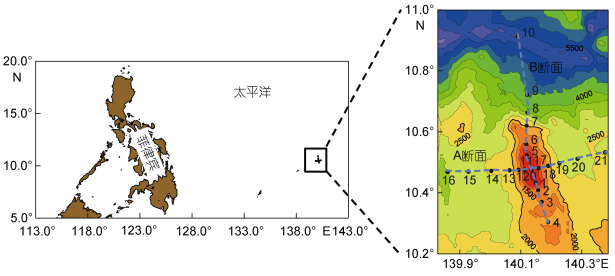 |
| 图 1 M4海山采样站位图 Fig. 1 Sampling stations in M4 Seamount 注:等值线表示深度(m) |
用CTD(Sea-Bird SBE 9, Sea-Bird公司, 美国)及附带的叶绿素浊度传感器(WET Labs公司, 美国)测量各站表层到300m的温度、盐度、水深和叶绿素a荧光值。按海洋调查规范测定营养盐浓度:在各水层采集水样250mL, 用0.7μm Whatman GF/F滤膜过滤后装入250mL高密度聚乙烯瓶, 用体积分数为2‰的氯仿固定后于–20℃中保存, 用QuAAtro连续流动分析仪(SEAL公司, 德国)分析测定溶解无机氮(DIN)和磷酸盐(PO43-)。其中DIN浓度为硝酸盐(NO3-)、亚硝酸盐(NO2-)和铵盐(NH4+)的浓度总和。
1.3 超微型浮游生物样品采集及测定在各水层采集海水4mL, 加入10%多聚甲醛固定, 终浓度为1% (V/V), 在室温下避光固定20min后放于液氮罐中保存, 用于超微型浮游生物丰度的检测。在实验室内将样品在室温下避光融化, 用流式细胞仪(BD FACSJazz, 美国)检测。分析超微型自养浮游生物时, 取2mL样品, 加入2μm荧光微球溶液(Polysciences, 美国)作为标准内参, 上机检测3min。根据前向、侧向散射光(与细胞的大小、密度和形态有关)以及红色、橙色荧光信号(与叶绿素、藻红蛋白有关), 可检测到四个超微型自养浮游生物类群(SYN, PRO, PEUK, NEUK)。对于超微型异养原核生物, 取50μL样品, 加入250μL TE (Tris-EDTA, 100mmol/L Tris-Cl, 10mmol/L EDTA, pH=8.0, Sigma, 美国)缓冲溶液稀释, 再加入4μL的SYBR Green I染料(Molecular Probes, 美国)避光染色20min后上机检测30s。根据侧向散射光和绿色荧光(与核酸含量有关)信号, 可检测两个异养原核生物类群(LNA和HNA)。
1.4 生物量超微型浮游生物的生物量是由丰度乘以单个细胞的碳转换系数得到。SYN、PRO、PEUK、NEUK、HP (LNA和HNA)的转换系数分别为: 250、49、671、3498、20fgC/cell (Campbell et al, 1997; Girault et al, 2013)。
1.5 数据处理与分析用Surfer 13和Origin 8.5软件分析超微型浮游生物的垂直分布情况。用CANOCO for Window 4.5进行冗余分析(Redundancy analysis, RDA), 研究超微型浮游生物丰度与环境因子之间的相关性, 其中超微型浮游生物丰度的数据经过以10为底的对数转换。
2 结果 2.1 水文环境M4海山0—300m的水温范围在9.68—31.00℃, 由表层至300m水层, 温度逐渐降低(图 2)。盐度范围在33.00—35.13, 平均值为34.27±0.45。等温线和等盐线在山顶处出现下凹(图 2), 在100—200m水层可观察到温度和盐度跃层。营养盐DIN和PO43-的平均值分别为5.55±3.00μmol/L和0.19±0.30μmol/L, 两者的垂直分布趋势一致, 即200m以浅浓度较低, 200m以深逐渐升高, 在东西方向山顶附近DIN和PO43-等值线上凸(图 2)。
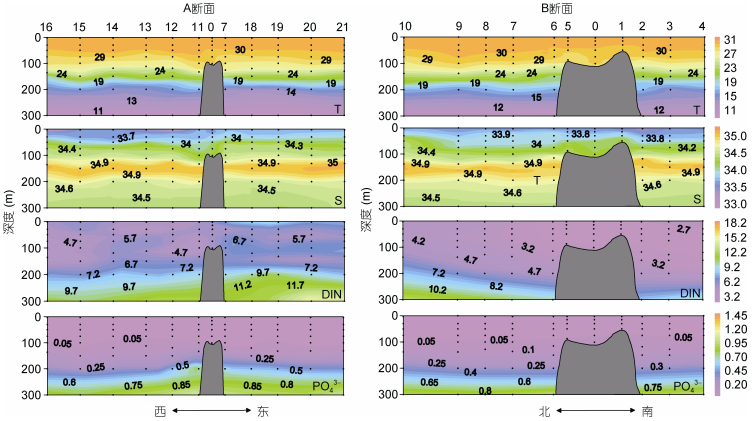 |
| 图 2 M4海山A、B断面温度(T, ℃)、盐度(S)、营养盐浓度(DIN, PO43-, μmol/L)垂直分布 Fig. 2 Vertical distributions of temperature (T, ℃), salinity (S), nutrient concentrations (DIN, PO43-, μmol/L) along Transects A and B in M4 Seamount |
叶绿素a荧光高值分布在75—200m水层, 深层叶绿素最大值(Deep Chlorophyll Maximum, DCM)位于100—150m水层, 与温度和盐度跃层的深度相近(图 3)。SYN的丰度范围在(0.01—1.49)×103cells/mL, 平均值为(0.54±0.40)×103cells/mL, 其垂直分布的高值区在0—100m水层之间。PRO是丰度最高的超微型自养浮游生物, 丰度变化范围在(0.09—153.89)× 103cells/mL, 平均值为(18.06±30.24)×103cells/mL。PRO的垂直分布与叶绿素a荧光相似, 丰度的高值分布在75—150m水层之间。PEUK的丰度范围在(0.00—3.51)×103cells/mL, 平均值为(0.73±0.55)× 103cells/mL。PEUK的垂直分布趋势与PRO类似, 丰度高值都位于DCM层附近, 但PEUK的高值区略深于PRO, 主要在100—150m水层。NEUK丰度远低于其它超微型自养浮游生物, 丰度变化范围在(0.00—0.65)×103cells/mL, 平均值为(0.31±0.19)× 103cells/mL。NEUK的垂直分布范围比较广, 从表层至150m水层丰度都较高, 在站位10、19、20、21丰度高值可深达200m (图 3)。
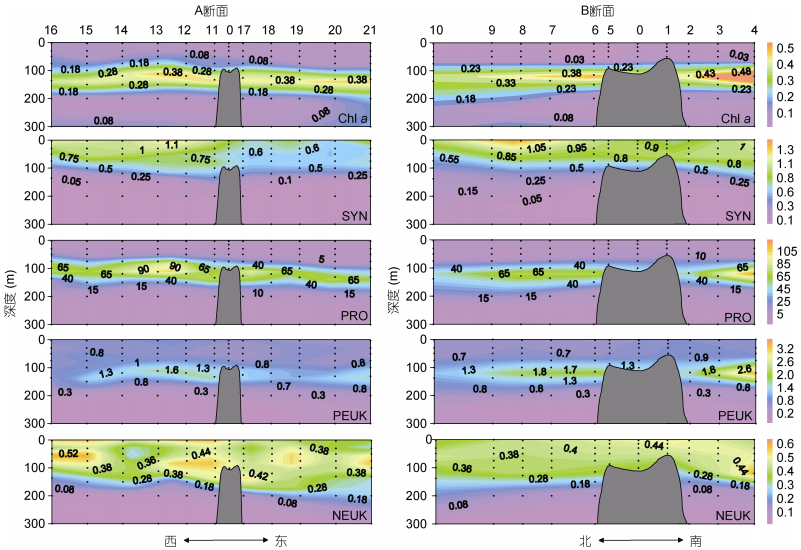 |
| 图 3 M4海山A、B断面叶绿素a荧光值(chl a), 聚球藻(SYN, ×103cells/mL)、原绿球藻(PRO, ×103cells/mL)、微微型真核浮游生物(PEUK, ×103cells/mL)、微型真核浮游生物(NEUK, ×103cells/mL)丰度垂直分布 Fig. 3 Vertical distributions in in-situ chlorophyll a fluorescence (chl a) and abundances of Synechococcus (SYN, ×103cells/mL), Prochlorococcus (PRO, ×103cells/mL), picoeukaryotes (PEUK, ×103cells/mL), and nanoeukaryotes (NEUK, ×103cells/mL) along Transects A and B in M4 Seamount |
HP是丰度最高的超微型浮游生物, 丰度范围在(0.73—7.32)×105cells/mL, 平均值为(4.07±1.94)×105cells/mL, 比超微型自养浮游生物高约两个数量级。HP的丰度在200m以浅较高, 最高值位于150m以浅水体。在各站位均检测到LNA和HNA两个异养原核生物类群。LNA和HNA的丰度平均值分别为(1.56±0.74)×105cells/mL和(2.51±1.25)×105cells/mL, 它们的垂直分布与总HP一致, 高值区均位于150m水层以浅(图 4)。LNA/HNA的比值范围在0.31—1.41, 平均值为0.65±0.17。LNA/HNA的比值在DCM层显著高于其它水层。此外, 在DCM层60个采样点中有7个该比值超过了1(即LNA的丰度高于HNA), 这7个采样点分别在站位2、3、10、16、18 (图 4)。
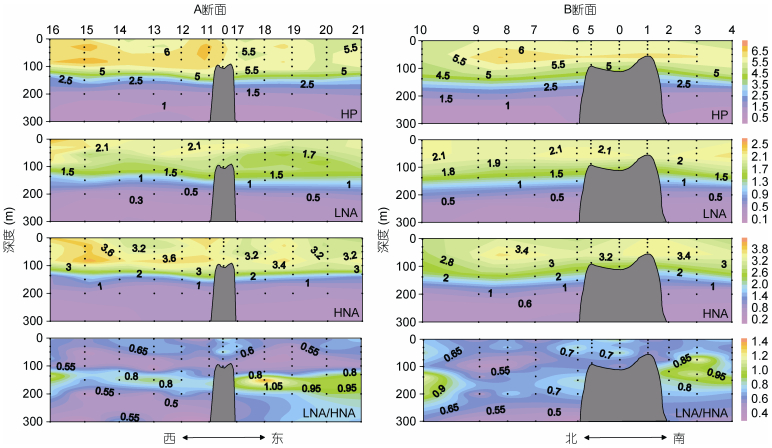 |
| 图 4 M4海山A、B断面总异养原核生物(HP, ×105cells/mL)、低核酸含量异养原核生物(LNA, ×105cells/mL)、高核酸含量异养原核生物(HNA, ×105cells/mL)丰度, 低核酸含量与高核酸含量异养原核生物丰度比值(LNA/HNA)垂直分布 Fig. 4 Vertical distributions in abundances of total heterotrophic prokaryotes (HP, ×105cells/mL), low nucleic acid content heterotrophic prokaryotes (LNA, ×105cells/mL), high nucleic acid content heterotrophic prokaryotes (HNA, ×105cells/mL), and the ratio of low and high nucleic acid content heterotrophic prokaryotes abundances (LNA/HNA) along Transects A and B in M4 Seamount |
M4海山超微型浮游生物丰度与环境因子之间的RDA分析结果显示, 第一和第二轴共解释了75.9%的超微型浮游生物的变化, 以及99.7%的超微型浮游生物与环境因子的关系(图 5)。SYN、NEUK、PEUK、LNA、HNA与温度呈正相关关系, 与深度、PO43-、DIN呈负相关关系; PRO与叶绿素a荧光值呈正相关关系。LNA占总异养原核生物的百分比与叶绿素a荧光值呈正相关关系。
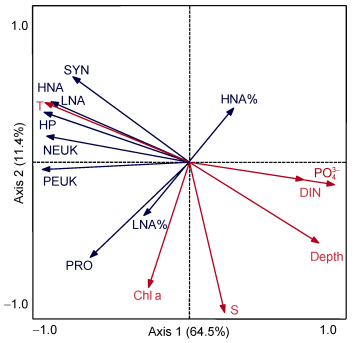 |
| 图 5 300m以浅超微型浮游生物与环境因子之间的冗余分析 Fig. 5 Redundancy analysis between ultraplankton and environmental parameters in the upper 300m water column 注:深蓝色箭头表示超微型浮游生物; 红色箭头表示环境因子 |
超微型浮游生物总生物量平均值为11.23±5.20μgC/L, 最高值为100m水层的16.31μgC/L, 最低值为300m水层的1.73μgC/L, 其中异养原核生物的生物量远高于超微型自养浮游生物。
超微型自养浮游生物的生物量范围在0.05— 6.02μgC/L之间, 平均值为2.69±1.92μgC/L。130m以浅生物量随深度增加逐渐升高, 130m以深生物量随深度增加逐渐降低(图 6)。超微型自养浮游生物各类群有不同的垂直分布模式, 生物量的主要贡献者在不同水层发生变化。75m以浅随深度增加SYN生物量逐渐降低, PRO逐渐升高, PEUK和NEUK生物量分布比较均匀; NEUK在超微型自养浮游生物中所占百分比最高为58.62%±8.53%, 其次是PEUK为20.22%±2.68%, SYN和PRO所占百分比较低分别为8.75%±2.19%和12.41%±13.28%。100—150m (DCM)水层中SYN生物量极低, PRO和PEUK明显升高, NEUK略有降低; PRO的生物量超过NEUK, 在超微型自养浮游生物中占优势(53.83%±6.32%)。DCM以深(200—300m)各类群生物量都明显下降, NEUK是生物量的主要贡献者(46.18%±7.82%)。
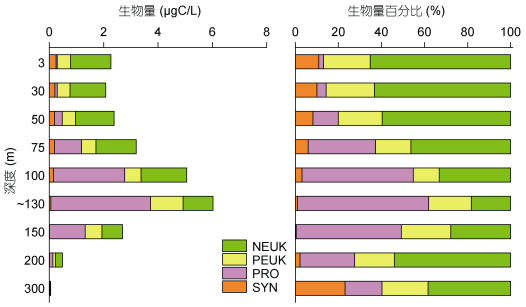 |
| 图 6 M4海山超微型自养浮游生物的生物量及百分比的垂直分布 Fig. 6 Vertical distributions of autotrophic ultraplankton biomass and percentage in M4 Seamount |
HP生物量范围为1.68—11.25μgC/L, 平均值为8.54±3.28μgC/L。100m以浅HP生物量相对较高, 100m以深生物量随深度增加逐渐降低。在HP中LNA和HNA生物量平均值分别为3.29±1.22μgC/L和5.25±2.32μgC/L, 二者的垂直分布与总HP一致。LNA在总异养原核生物中所占百分比范围在34.18%(300m)—46.59%(150m), 平均值为38.95±3.98%; HNA百分比范围在53.41%(150m)—65.82%(300m), 平均值为61.05±3.98%, 总体来说LNA所占的比例低于HNA(图 7)。
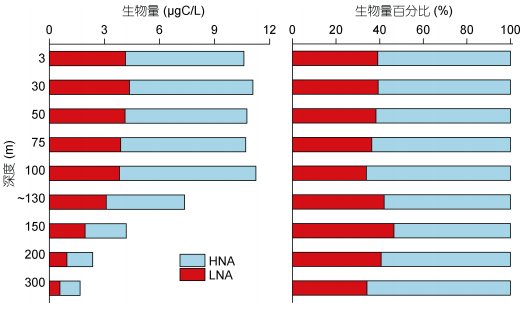 |
| 图 7 M4海山低核酸含量和高核酸含量异养原核生物的生物量及百分比的垂直分布 Fig. 7 Vertical distributions of low and high nucleic acid content heterotrophic prokaryotes in biomass and percentage in M4 Seamount |
本研究中超微型浮游生物各类群的丰度与以往大洋中报道的结果具有可比性。M4海山SYN、PRO、PEUK、NEUK、HP丰度值与热带和亚热带西太平洋、热带西太平洋Y3和M2海山、亚热带北太平洋ALOHA站、大西洋北部环流等海域检测值相近, 略低于北太平洋副热带环流西部和赤道太平洋海域(表 1)。
| 研究海区 | 经纬度 | SYN (×103cells/mL) |
PRO (×103cells/mL) |
PEUK (×103cells/mL) |
NEUK (×103cells/mL) |
HP (×105cells/mL) |
参考文献 |
| 西太平洋M4海山 | 10.3—10.9°N, 139.9—140.4°E |
0.01—1.49 (0.54±0.40) |
0.09—153.89 (18.06±30.24) |
0.00—3.51 (0.73±0.55) |
0.00—0.65 (0.31±0.19) |
0.73—7.32 (4.07±1.94) |
本研究 |
| 热带和亚热带西太平洋 | 2—23°N, 121—130°E |
0.15—63 | 0.12—100 | 0.03—2.8 | 0.2—12.8 | Liang et al, 2017 | |
| 西太平洋Y3海山 | 8.7—9.1°N, 137.6—138°E |
0.84±0.56 | 42.18±46.42 | 1.99±1.54 | 3.16±0.90 | 赵丽等, 2017 | |
| 西太平洋M2海山 | 11.1—11.5°N, 139.1—139.6°E |
0.88±0.29 | 23.89±43.15 | 1.21±1.06 | 3.73±0.82 | 赵丽等, 2017 | |
| 北太平洋副热带环流西部 | 13.25—33.6°N, 141.5°E |
1.94—27.3 | 2.05—434 | 0.05—11.5 | 0.7—3 | < 5—29 | Girault et al, 2013 |
| 赤道太平洋 | 0°N, 145°E—160°W |
最大值26 | 最大值180 | 最大值10 | Matsumoto et al, 2004 | ||
| 赤道太平洋(西部暖池) | 0°N, 167°E | < 1.5±0.1 | 最大值190 | 最大值2.3 | Blanchot et al, 2001 | ||
| 亚热带北太平洋ALOHA站 | 22°45′N, 158°W | 最大值1.1—6.3 | 最大值140—320 | 最大值0.7—6.2 | 最大值0.003—0.14 | 0.9—7.4 | Campbell et al, 1997 |
| 大西洋北部环流 | 29°21.24′N, 6°26′—48°55′W |
最大值3 | 最大值0.54 | Tarran et al, 2006 |
超微型自养浮游生物中生物量的主要贡献者因海域等不同而发生变化。在低纬度海域PRO和PEUK对总生物量贡献较大, SYN和NEUK相对较小。Painter等(2014)在亚热带北大西洋东部(26.2°N, 31.1°W)研究发现100m以浅PRO是生物量的主要贡献者, 其次是PEUK; 在100—150m水层PRO的贡献有所下降, 但仍高于PEUK; 在150—200m水层PEUK生物量的贡献超过PRO。在亚热带北太平洋ALOHA站位(22°45′N, 158°W), 表面混合层(0—50m)、DCM层(114±18m)、DCM层以深(120—175m)PRO生物量的贡献都要高于其他自养类群(Campbell et al, 1997)。然而, 一些研究发现在高纬度海域NEUK对总生物量的贡献也较高。Tarran等(2001)在东北大西洋(36°42′—59°18′N, 19°12′—20°12′W)100m以浅研究发现NEUK的生物量贡献最高, 可达61.20%。Van Oostende等(2017)在靠近亚北极(54°N, 20°W)的北大西洋发现NEUK对微微型和微型自养浮游生物的贡献高达86%。本研究结果显示在热带西太平洋M4海山(10.3—10.9°N, 139.9—140.4°E), NEUK在75m以浅(58.62%)和200—300m水层(46.18%)也是生物量的主要贡献者, 100—150m水层生物量的主要贡献者是PRO。
温度、光照和营养盐等环境因子是影响PRO和NEUK生物量分布的重要因素。M4海山位于寡营养的热带海域, 光照较强, 表层水温达到30℃; 水体长期存在物理分层, 上层营养盐含量较低。由于PRO的光系统II的热敏感性, 其适宜的生长温度高于15℃; 在表层水中强光照对PRO的生长有抑制作用(Otero-Ferrer et al, 2018)。因此, 温度适宜, 光照较弱且营养盐含量相对较高的DCM层更适合PRO的生长。NEUK生物多样性较高, 能够适应不同的光照、温度等环境条件(Marie et al, 2010)。此外, NEUK细胞体积较大, 碳含量高。这两方面因素共同导致NEUK生物量在表层和深层占优势。RDA研究结果显示超微型自养浮游生物(SYN, PEUK, NEUK)与营养盐呈负相关关系, 一是由于超微型自养浮游生物体积小, 在寡营养环境中更有竞争优势; 二是深层海水中的营养盐含量较高, 但温度低、光照弱不利于超微自养浮游生物的生长, 温度和光照是深层海域中主要的限制因素(Agawin et al, 2000)。
3.2 LNA和HNA生物量比例的变化及影响因素根据流式细胞术的绿色荧光和侧向散射光通常可以将水生生态系统中的异养原核生物分为2或3个类群(Gasol et al, 1999; Girault et al, 2015)。本研究中, 我们检测到2个具有相似的侧向散射光, 不同荧光强度的类群: LNA和HNA。从淡水到咸水、寡营养到富营养等多种环境中都有LNA和HNA的报道(Nishimura et al, 2005; Otero-Ferrer et al, 2018)。LNA和HNA的生态效应有差异。HNA细胞体积较大, 通常被认为是生长活跃的细菌, 能够对捕食压力和营养盐变化做出迅速反映。而最初的研究认为LNA可能是不活跃或者已经死亡的细菌(Gasol et al, 1999), 后来研究表明在一些寡营养环境中, LNA也具有代谢活性, 是异养原核生物的重要组成部分, 对碳生物量有重要贡献(Zubkov et al, 2001; Jochem et al, 2004)。海洋LNA和HNA的类群组成也有显著差异, HNA主要由红杆菌、拟杆菌和SAR116组成, 而其他群体如SAR11和SAR86是LNA主要组成部分(Vila-Costa et al, 2012)。目前对这两个类群的生态作用分析研究有限, 有待于深入研究。
根据以往报道, 不同海域中异养原核生物的优势类群不同。HNA通常在高生产力的近岸海域占优势, 如南澳大利亚大陆架上升流区、地中海沿岸、加利西亚沿岸上升流区(Gasol et al, 1999; Paterson et al, 2012; Otero-Ferrer et al, 2018)。LNA通常在北太平洋、大西洋中部等寡营养大洋环境中占优势(Li et al, 1995; Girault et al, 2015)。本研究中, 各站位HNA生物量百分比平均值为61.05%, 远高于LNA, 与近岸研究结果比较相似(表 2), 但在DCM层内, LNA生物量的比例明显升高, 尤其是在海山附近可高达58.64%。这种DCM层内LNA占优势的情况在地中海西北部也有出现。Scharek等(2007)在地中海西北部表层和DCM层中LNA和HNA的生长率和被摄食率研究发现, 表层HNA的生长率和被摄食率均显著高于LNA, 而DCM层LNA的生长率和被摄食率高于HNA, 但差异并不显著; HNA是表层水体中活性较高的组成部分, LNA在DCM层较为活跃。
| 研究海区 | 经纬度 | 亚群数量 | LNA% | HNA% | 参考文献 | |
| 大洋 | 西太平洋M4海山 | 10.3—10.9°N, 139.9—140.4°E |
2 | 23.66—58.51 平均值38.95 |
41.49—76.34 平均值61.05 |
本研究 |
| 北太平洋 | 13.25—33.6°N, 141.5°E |
3 | 47—63 | Girault et al, 2015 | ||
| 西南大西洋 | 13—25°S, 28—42°W | 2 | 54.83 | 45.17 | Andrade et al, 2007 | |
| 西南大西洋 | 13—25°S, 28—42°W | 2 | 59 | 41 | Andrade et al, 2003 | |
| 北大西洋中部 | 25-55°N, 0—60°W | 2 | 64 | 36 | Li et al, 1995 | |
| 热带和亚热带大西洋 | 30°N—30°S, 10—50°W |
2 | 59 | 41 | Otero-Ferrer et al, 2018 | |
| 地中海沿岸 | 2 | ~45 | ~55 | Gasol et al, 1999 | ||
| 西北地中海 | 43°25′N, 7°52′E | 2 | 42.9 | 57.1 | Winter et al, 2009 | |
| 澳大利亚大陆架 | 37°20′—38°S, 139°12′—139°48′E |
3 | 上升流区: 84.3—93.4 |
Paterson et al, 2012 | ||
| 近岸 | 加利西亚沿岸上升流 | 42°N, 4°E | 2 | 37 | 63 | Otero-Ferrer et al, 2018 |
| 瓜纳巴拉湾 | 22°41′—22°57′S, 43°02′— 43°16′W |
2 | 7—45 平均值22 |
58—93 平均值78 |
Andrade et al, 2003 | |
| 深圳近海 | 2 | 17.07—74.03 | 25.97—82.93 | 李建洋等, 2017 |
异养原核生物的分布受环境和生物两方面因素的影响。M4海山是一座典型的浅海山, 山顶距海面约57m。已有研究表明浅海山与海流的相互作用会产生水文动态变化, 产生内波、上升流、涡旋、泰勒柱等, 如在东北太平洋Cobb海山、西北太平洋Minami-Kasuga海山、西南印度洋六座海山(Genin et al, 1985; Dower et al, 1992; Read et al, 2017)。虽然目前没有关于M4海山环流的直接数据, 但Ma等(2019)在M4海山(即该文中的C4海山)观察到了营养盐等值线在山顶附近有明显的抬升, 说明营养盐存在一个自下而上的抬升过程; 同时与远离M4海山的参考站位相比, 海山区营养盐的浓度较高。这些现象表明M4海山可能存在将低温高营养盐的深层水带到浅层的局部扰动或上升流。水文条件的变化会对LNA、HNA生长产生影响。Andrade等(2007)在西南大西洋(13—25°S, 28—42°W)19°S以南的区域发现LNA占优势, 并认为这与该地区存在涡旋和上升流有关。因此在M4海山上升流的存在可能是海山附近LNA生物量比例升高的原因之一。此外, 病毒的侵染、裂解也会对异养原核生物亚群的比例产生影响。已有实验证明HNA更容易受到病毒的侵染、裂解(Bonilla-Findj et al, 2009)。在M4海山区浮游病毒的丰度在海山站显著高于大洋站(Zhao et al, 2020), 可能会导致海山站HNA死亡率较高, 从而表现为LNA生物量的比例升高。
3.3 M4海山对超微型浮游生物的影响M4海山超微型自养浮游生物和异养原核生物各类群均没有发现丰度和生物量有明显升高或等值线波动现象, 即没有观察到明显的“海山效应”; 而海山影响了异养原核生物两个类群生物量的比例, LNA的比例在海山附近升高。以往研究表明, 少数情况下在海山区能够观察到高叶绿素浓度、高浮游植物丰度等现象, 但这些现象也只是短暂的或季节性的(Rogers, 2018)。Genin等(1985)在Minami-Kasuga海山进行三次调查, 只有第一次在海山上方观察到了冷堆、叶绿素浓度增加以及高浮游动物生物量。此外, 海山并非对所有的浮游生物都能产生影响。Mendonça等(2012)对东北大西洋Seine和Sedlo海山的微生物类群调查发现:在Seine海山的水体中, 只在春季观察到大的自养生物(除PRO外)在山顶和海山站升高; 在Sedlo海山的水体中, 尽管微微型浮游生物的生物量较低, 但在夏季山顶和海山区有其峰值存在。海山区浮游生物的分布受采样时间、山顶距海面的深度、山体的形状、洋流的强度和稳定性、周围水体的温度、盐度以及营养盐等多种因素的影响。因此, 海山对超微型浮游生物的分布影响需要更多的调查进一步验证。
4 结论本研究发现M4海山超微型自养浮游生物的生物量的主要贡献者随水深发生变化。NEUK在75m以浅和200—300m水层是主要贡献者, PRO在100—150m水层是主要贡献者。超微型自养浮游生物各类群分布没有明显的“海山效应”。在异养原核生物中HNA生物量所占百分比高于LNA, 然而海山附近DCM层内LNA生物量比例明显升高。海山的存在会对异养原核生物两个类群生物量的比例产生影响。目前海山区超微型浮游生物的研究比较少, 海山对超微型浮游生物的影响还需要更深入系统的研究。
代晟, 孙晓霞, 梁俊华, 等. 2017. 2016年春季西太平洋M2海山浮游植物粒级结构与初级生产力研究. 海洋与湖沼, 48(6): 1456-1464 |
李建洋, 赵月, 谢宁栋, 等. 2017. 深圳近海表层浮游细菌分布特征及其环境影响因素. 生态学报, 37(24): 8567-8577 |
张文静, 孙晓霞, 陈芸燕, 等. 2016. 2014年冬季热带西太平洋雅浦Y3海山浮游植物叶绿素a浓度及粒级结构. 海洋与湖沼, 47(4): 739-747 |
张武昌, 于莹, 李超伦, 等. 2014. 海山区浮游生态学研究. 海洋与湖沼, 45(5): 973-978 |
赵丽, 赵燕楚, 王超锋, 等. 2017. 热带西太平洋Y3和M2海山微食物网主要类群生态分布与比较. 海洋与湖沼, 48(6): 1446-1455 |
Agawin N S R, Duarte C M, Agustí S, 2000. Nutrient and temperature control of the contribution of picoplankton to phytoplankton biomass and production. Limnology and Oceanography, 45(3): 591-600 DOI:10.4319/lo.2000.45.3.0591 |
Andrade L, Gonzalez A M, Araujo F V et al, 2003. Flow cytometry assessment of bacterioplankton in tropical marine environments. Journal of Microbiological Methods, 55(3): 841-850 DOI:10.1016/j.mimet.2003.08.002 |
Andrade L, Gonzalez A M, Rezende C E et al, 2007. Distribution of HNA and LNA bacterial groups in the Southwest Atlantic Ocean. Brazilian Journal of Microbiology, 38(2): 330-336 DOI:10.1590/S1517-83822007000200028 |
Azam F, Malfatti F, 2007. Microbial structuring of marine ecosystems. Nature Reviews Microbiology, 5(10): 782-791 DOI:10.1038/nrmicro1747 |
Blanchot J, André J M, Navarette C et al, 2001. Picophytoplankton in the equatorial Pacific:vertical distributions in the warm pool and in the high nutrient low chlorophyll conditions. Deep Sea Research Part I:Oceanographic Research Papers, 48(1): 297-314 DOI:10.1016/S0967-0637(00)00063-7 |
Bonilla-Findji O, Herndl G J, Gattuso J P et al, 2009. Viral and flagellate control of prokaryotic production and community structure in offshore mediterranean waters. Applied and Environmental Microbiology, 75(14): 4801-4812 DOI:10.1128/AEM.01376-08 |
Campbell L, Liu H B, Nolla H A et al, 1997. Annual variability of phytoplankton and bacteria in the subtropical North Pacific Ocean at station ALOHA during the 1991-1994 ENSO event. Deep Sea Research Part I:Oceanographic Research Papers, 44(2): 167-192 DOI:10.1016/S0967-0637(96)00102-1 |
Dower J, Freeland H, Juniper K, 1992. A strong biological response to oceanic flow past Cobb seamount. Deep Sea Research Part A. Oceanographic Research Papers, 39(7-8): 1139-1145 DOI:10.1016/0198-0149(92)90061-W |
Dower J F, Mackas D L, 1996. "Seamount effects" in the zooplankton community near Cobb Seamount. Deep Sea Research Part I:Oceanographic Research Papers, 43(6): 837-858 DOI:10.1016/0967-0637(96)00040-4 |
Gasol J M, Zweifel U L, Peters F et al, 1999. Significance of size and nucleic acid content heterogeneity as measured by flow cytometry in natural planktonic bacteria. Applied and Environmental Microbiology, 65(10): 4475-4483
|
Genin A, Boehlert G W, 1985. Dynamics of temperature and chlorophyll structures above a seamount:an oceanic experiment. Journal of Marine Research, 43(4): 907-924 DOI:10.1357/002224085788453868 |
Girault M, Arakawa H, Barani A et al, 2013. Distribution of ultraphytoplankton in the western part of the North Pacific subtropical gyre during a strong La Niña condition:relationship with the hydrological conditions. Biogeosciences, 10(9): 5947-5965 DOI:10.5194/bg-10-5947-2013 |
Girault M, Arakawa H, Barani A et al, 2015. Heterotrophic prokaryote distribution along a 2300 km transect in the North Pacific subtropical gyre during a strong La Niña conditions:relationship between distribution and hydrological conditions. Biogeosciences, 12(11): 3607-3621 DOI:10.5194/bg-12-3607-2015 |
Jiao N Z, Herndl G J, Hansell D A et al, 2010. Microbial production of recalcitrant dissolved organic matter:long-term carbon storage in the global ocean. Nature Reviews Microbiology, 8(8): 593-599 DOI:10.1038/nrmicro2386 |
Jochem F J, Lavrentyev P J, First M R, 2004. Growth and grazing rates of bacteria groups with different apparent DNA content in the Gulf of Mexico. Marine Biology, 145(6): 1213-1225 DOI:10.1007/s00227-004-1406-7 |
Li W K W, Jellett J F, Dickie P M, 1995. DNA distributions in planktonic bacteria stained with TOTO or TO-PRO. Limnology and Oceanography, 40(8): 1485-1495 DOI:10.4319/lo.1995.40.8.1485 |
Li W K W, Rao D V S, Harrison W G et al, 1983. Autotrophic picoplankton in the tropical ocean. Science, 219(4582): 292-295 DOI:10.1126/science.219.4582.292 |
Liang Y T, Zhang Y Y, Zhang Y et al, 2017. Distributions and relationships of virio-and picoplankton in the epi-, meso-and bathypelagic zones of the Western Pacific Ocean. FEMS Microbiology Ecology, 93(2): fiw238 DOI:10.1093/femsec/fiw238 |
Ma J, Song J M, Li X G et al, 2019. Environmental characteristics in three seamount areas of the Tropical Western Pacific Ocean:Focusing on nutrients. Marine Pollution Bulletin, 143: 163-174 DOI:10.1016/j.marpolbul.2019.04.045 |
Marie D, Shi X L, Rigaut-Jalabert F et al, 2010. Use of flow cytometric sorting to better assess the diversity of small photosynthetic eukaryotes in the English Channel. FEMS Microbiology Ecology, 72(2): 165-178 DOI:10.1111/j.1574-6941.2010.00842.x |
Matsumoto K, Furuya K, Kawano T, 2004. Association of picophytoplankton distribution with ENSO events in the equatorial Pacific between 145°E and 160°W. Deep Sea Research Part I:Oceanographic Research Papers, 51(12): 1851-1871 DOI:10.1016/j.dsr.2004.07.015 |
Mendonça A, Arístegui J, Vilas J C et al, 2012. Is there a seamount effect on microbial community structure and biomass? The case study of Seine and Sedlo Seamounts (Northeast Atlantic). PLoS One, 7(1): e29526 DOI:10.1371/journal.pone.0029526 |
Murphy L S, Haugen E M, 1985. The distribution and abundance of phototrophic ultraplankton in the North Atlantic. Limnology and Oceanography, 30(1): 47-58 DOI:10.4319/lo.1985.30.1.0047 |
Nishimura Y, Kim C, Nagata T, 2005. Vertical and seasonal variations of bacterioplankton subgroups with different nucleic acid contents:possible regulation by phosphorus. Applied and Environmental Microbiology, 71(10): 5828-5836 DOI:10.1128/AEM.71.10.5828-5836.2005 |
Otero-Ferrer J L, Cermeño P, Bode A et al, 2018. Factors controlling the community structure of picoplankton in contrasting marine environments. Biogeosciences, 15(20): 6199-6220 DOI:10.5194/bg-15-6199-2018 |
Painter S C, Patey M D, Tarran G A et al, 2014. Picoeukaryote distribution in relation to nitrate uptake in the oceanic nitracline. Aquatic Microbial Ecology, 72(3): 195-213 DOI:10.3354/ame01695 |
Paterson J S, Nayar S, Mitchell J G et al, 2012. A local upwelling controls viral and microbial community structure in South Australian continental shelf waters. Estuarine, Coastal and Shelf Science, 96: 197-208 DOI:10.1016/j.ecss.2011.11.009 |
Read J, Pollard R, 2017. An introduction to the physical oceanography of six seamounts in the southwest Indian Ocean. Deep Sea Research Part II:Topical Studies in Oceanography, 136: 44-58 DOI:10.1016/j.dsr2.2015.06.022 |
Richardson T L, Jackson G A, 2007. Small phytoplankton and carbon export from the surface ocean. Science, 315(5813): 838-840 DOI:10.1126/science.1133471 |
Rogers A D, 1994. The biology of seamounts. Advances in Marine Biology, 30: 305-350 DOI:10.1016/S0065-2881(08)60065-6 |
Rogers A D, 2018. The biology of seamounts:25 years on. Advances in Marine Biology, 79: 137-224 DOI:10.1016/bs.amb.2018.06.001 |
Scharek R, Latasa M, 2007. Growth, grazing and carbon flux of high and low nucleic acid bacteria differ in surface and deep chlorophyll maximum layers in the NW Mediterranean Sea. Aquatic Microbial Ecology, 46: 153-161 DOI:10.3354/ame046153 |
Sime-Ngando T, Juniper K, Vézina A, 1992. Ciliated protozoan communities over Cobb Seamount:increase in biomass and spatial patchiness. Marine Ecology Progress Series, 89: 37-51 DOI:10.3354/meps089037 |
Tarran G A, Heywood J L, Zubkov M V, 2006. Latitudinal changes in the standing stocks of nano-and picoeukaryotic phytoplankton in the Atlantic Ocean. Deep Sea Research Part II:Topical Studies in Oceanography, 53(14-16): 1516-1529 DOI:10.1016/j.dsr2.2006.05.004 |
Tarran G A, Zubkov M V, Sleigh M A et al, 2001. Microbial community structure and standing stocks in the NE Atlantic in June and July of 1996. Deep Sea Research Part II:Topical Studies in Oceanography, 48(4-5): 963-985 DOI:10.1016/S0967-0645(00)00104-1 |
Van Oostende N, Fawcett S E, Marconi D et al, 2017. Variation of summer phytoplankton community composition and its relationship to nitrate and regenerated nitrogen assimilation across the North Atlantic Ocean. Deep Sea Research Part I:Oceanographic Research Papers, 121: 79-94 DOI:10.1016/j.dsr.2016.12.012 |
Vila-Costa M, Gasol J M, Sharma S et al, 2012. Community analysis of high-and low-nucleic acid-containing bacteria in NW Mediterranean coastal waters using 16S rDNA pyrosequencing. Environmental Microbiology, 14(6): 1390-1402 DOI:10.1111/j.1462-2920.2012.02720.x |
Winter C, Kerros M E, Weinbauer M G, 2009. Seasonal and depth-related dynamics of prokaryotes and viruses in surface and deep waters of the northwestern Mediterranean Sea. Deep Sea Research Part I:Oceanographic Research Papers, 56(11): 1972-1982 DOI:10.1016/j.dsr.2009.07.003 |
Xu D P, Sun P, Zhang Y Z et al, 2018. Pigmented microbial eukaryotes fuel the deep sea carbon pool in the tropical Western Pacific Ocean. Environmental Microbiology, 20(10): 3811-3824 DOI:10.1111/1462-2920.14396 |
Yesson C, Clark M R, Taylor M L et al, 2011. The global distribution of seamounts based on 30 arc seconds bathymetry data. Deep Sea Research Part I:Oceanographic Research Papers, 58(4): 442-453 DOI:10.1016/j.dsr.2011.02.004 |
Zhao Y C, Zhao Y, Zheng S et al, 2020. Virioplankton distribution in the tropical western Pacific Ocean in the vicinity of a seamount. Microbiology Open DOI:10.1002/mbo3.1031 |
Zubkov M V, Fuchs B M, Burkill P H et al, 2001. Comparison of cellular and biomass specific activities of dominant bacterioplankton groups in stratified waters of the Celtic Sea. Applied and Environmental Microbiology, 67(11): 5210-5218 DOI:10.1128/AEM.67.11.5210-5218.2001 |
 2020, Vol. 51
2020, Vol. 51


