
中国海洋湖沼学会主办。
文章信息
- 王甫文, 李迎, 甄毓, 刘乾. 2020.
- WANG Fu-Wen, LI Ying, ZHEN Yu, LIU Qian. 2020.
- 多形微眼藻在不同氮源条件下固碳途径的转录组解析及与其他微藻的比对
- TRANSCRIPTOME ANALYSIS OF CARBON FIXATION PATHWAY OF MINUTOCELLUS POLYMORPHUS UNDER DIFFERENT NITROGEN SOURCE CONDITIONS AND THE COMPARISON WITH OTHER MICROALGAE
- 海洋与湖沼, 51(5): 1127-1135
- Oceanologia et Limnologia Sinica, 51(5): 1127-1135.
- http://dx.doi.org/10.11693/hyhz20191100225
文章历史
-
收稿日期:2019-11-23
收修改稿日期:2020-02-05
2. 青岛海洋科学与技术试点国家实验室 海洋生态与环境科学功能实验室 青岛 266071;
3. 中国海洋大学环境科学与工程学院 青岛 266100;
4. 中国海洋大学海洋生命学院 青岛 266003
2. Laboratory for Marine Ecology and Environmental Science, Pilot National Laboratory for Marine Science and Technology(Qingdao), Qingdao 266071, China;
3. College of Environmental Science and Engineering, Ocean University of China, Qingdao 266100, China;
4. College of Marine Life Sciences, Ocean University of China, Qingdao 266003, China
藻类通过生物碳泵调节大气与海洋的CO2通量(邓祥元等, 2015), 其中硅藻每年可固碳10亿吨(Roberts et al, 2007), 对海洋碳循环有重要意义。同时, 利用微藻固碳被认为是一种环境友好性较高的碳捕集技术(邓帅等, 2018), 可以进一步加工生产生物柴油、肥料和其他有用的产品(Pokoo-Aikins et al, 2010), 被列为我国面向2020年(郭烈锦等, 2011)、2050年(夏茗, 2008)能源可持续发展的潜力研究方向之一。因此, 海洋微藻固碳途径受到高度关注。
自然界中植物有三种固碳途径, 分别是C3途径(Calvin, 1962)、C4途径和景天酸(CAM)途径(卢笛, 2013;刘乾等, 2016), 其中C3途径是光合碳同化的最基本途径。核酮糖-1, 5-二磷酸羧化酶/氧化酶(ribulose-1, 5-bisphosphate carboxylase)是C3途径的起始限速酶(Haimovich-Dayan et al, 2013), 由于其反应底物CO2在海水表层的浓度远低于该酶半饱和常数(20—70μmoL/kg)(Badger et al, 1998), 海洋浮游植物Rubisco酶的羧化反应无法全速进行, 进而会限制浮游植物C3固碳过程。因此, 多数浮游植物为应对低CO2环境(Beardall et al, 2002), 在长期进化中形成了无机碳浓缩机制(CO2 concentrating mechanisms, CCMs)(Raven et al, 2012)。该机制主要分为生物物理机制和生物化学机制, 生物物理机制主要通过碳酸酐酶(carbonic anhydrase, CA)催化碳酸氢根分解产生CO2, 提高Rubisco酶周边的无机碳浓度, 提高整个C3途径固碳效率; 生物化学机制则是通过C4过程, 生成四碳化合物(草酰乙酸)并完成对CO2的富集。然而关于海洋微藻中是否存在C4途径, 尚有较大争议(Beardall et al, 1976; Reinfelder et al, 2000; Yool et al, 2003; Onodera et al, 2005)。Reinfelder等(2000)发现威氏海链藻(T. weissflogii)可以通过一个类似C4的途径浓缩胞内CO2; Rech等(2008)发现海氏藻(Haslea ostrearia)中存在C4代谢物; Armbrust等(2004)发现假微型海链藻中具有PEPC的编码基因和PEPCK的编码基因。生物物理和生物化学机制都为C3过程的Rubisco酶提供了更高的底物浓度, 从而加速了C3过程的固碳速度, 有效提高了微藻的固碳能力。
氮元素是支持浮游植物生长的重要营养盐, 氮的同化代谢与碳代谢直接相关(Bender et al, 2014)。一方面, 当环境中氮营养盐缺乏限制硅藻生长时, 细胞中氮含量和蛋白质水平下降, 碳氮比升高(Harrison et al, 1990; La Roche et al, 1993; Claquin et al, 2002), 从而导致细胞内氮的再循环和胞内富碳化合物的储存(Allen et al, 2011; Palmucci et al, 2011; Hockin et al, 2012), 并最终引起叶绿素的减少, 导致细胞衰亡(Kolber et al, 1988), 光合作用能力降低, 进而对碳固定和转化能力产生负面影响(Behrenfeld et al, 2008)。另一方面, 氮代谢也需要ATP和光合作用产生的还原剂(Falkowski et al, 1975), 以及TCA循环产生的碳骨架(Turpin, 1991; Behrenfeld et al, 2008; Hockin et al, 2012)。因此, 探究不同氮营养条件下微藻的固碳过程对深入理解碳氮协同效应与固碳途径具有重要意义。
褐潮(brown tide)在美国及南非的部分河口暴发而引发生态灾害已有20余年的历史(陈杨航等, 2015)。我国是第三个受褐潮侵扰的国家(Zhang et al, 2012), 2009年至2015年在秦皇岛沿海水域发生的褐潮为当地水产养殖和旅游业带来巨大损失(Zhen et al, 2016; Cui et al, 2018), 对海洋生态系统造成了破坏性影响(Huang et al, 2020; Zhang et al, 2020)。一般认为, 抑食金球藻(Aureococcus anophagefferens)是褐潮原因种。但随着对秦皇岛褐潮的深入研究, Qiao等(2017)发现, 一种体型较小的硅藻——多形微眼藻(Minutocellus polymorphus)会与抑食金球藻相伴而生, 在2013年的秦皇岛褐潮中, 最高密度可达5.92×104cells/L, 为褐潮第二大贡献藻类。综上, 本研究选择不同氮源对多形微眼藻进行条件培养, 以探究不同氮源对多形微眼藻固碳途径的影响。分析结果一方面可丰富微藻的固碳通路研究, 另一方面也可为解释多形微眼藻在群落中的竞争优势、厘清褐潮暴发原因提供依据。
1 材料与方法 1.1 藻种培养与建库多形微眼藻分离自秦皇岛褐潮暴发期间, 保存于中国海洋大学海洋环境与生态教育部重点实验室藻种室。实验前, 将多形微眼藻移入f/2培养液中, 连续接种并达到指数生长中期3次以上, 保证藻细胞维持较高的生理活性。为探究不同氮源对多形微眼藻固碳途径的影响, 本文选取尿素和硝酸钠两种氮源进行培养, 选取多形微眼藻在不同氮源下的最适生长浓度(对照组NaNO3, 882μmol/L; 实验组CH4N2O, 氮的终浓度为400μmol/L)为培养条件(李迎等, 2019), 培养基其他组分与f/2培养基相同, 每组实验做三组平行, 培养温度(20±1)℃, 光暗比12h︰12h, 光照强度80—100μmol/(m2·s)。培养用海水取自青岛近海(盐度33, pH范围7.8—8.0), 经0.22μm滤膜过滤, 120℃高压灭菌20min。取实验组和对照组的指数生长期样品, 收集后送北京诺禾致源生物信息科技有限公司提取mRNA, 经反转录和PCR, 用AMPure XP beads纯化PCR产物, 得到最终的文库, 库检合格后进行Illumina HiSeqTM双端测序。
1.2 转录组测序与分析通过CASAVA碱基识别分析得到的原始数据(raw reads), 以FASTQ文件格式存储(Cock et al, 2010)。将这些序列信息进行质量评估, 得到可用序列(clean reads), 用Trinity对其进行拼接(Grabherr et al, 2011), 将测序所得的序列拼接成转录本, 用Corset程序进行层次聚类(Davidson et al, 2014), 得到FASTA格式文件。使用diamond v0.8.22将最终结果与Nr、Swiss-Prot、KOG数据库进行比对(Buchfink et al, 2015), 进行核酸注释、同源分析及蛋白质注释和预测; 使用NCBI blast 2.2.28+将得到的序列与Nt数据库进行比对(Camacho et al, 2009), 进行核酸注释和同源分析; 使用HMMER 3.0 package比对PFAM与所得转录组序列进行蛋白质工作注释和预测(Finn et al, 2008);使用KAAS服务器将所得结果与KO及KEGG数据库进行比对(Moriya et al, 2007; Kanehisa et al, 2008), 进行通路富集分析; 使用Blast2GO v2.5将所得序列与GO数据库进行比对(Götz et al, 2008; Young et al, 2010), 完成基因功能注释。
2 结果与讨论 2.1 转录组分析结果对照组和实验组经无参基因组分析, 共得到58354条序列。删除低质量测序序列后, 共得到43341条非重复序列基因。这些序列在GO、PFAM、Nr数据库中有较高比对率, 分别为67.73%、67.02%、65.85%, 而在Nt、KO、SwissPort、KOG数据库中比对率较低, 均值约30% (表 1)。在至少一个数据库中有注释的序列占83.31%, 而同时在所有数据库中均有注释的序列只有7.35%。
| 数据库 | 基因条数 | 注释百分比(%) |
| GO | 29, 356 | 67.73 |
| PFAM | 29, 048 | 67.02 |
| Nr | 28, 541 | 65.85 |
| SwissProt | 20, 709 | 47.78 |
| KOG | 11, 364 | 26.21 |
| KO | 9, 318 | 21.49 |
| Nt | 8, 826 | 20.36 |
在光合生物碳固定途径中, 受不同培养条件影响, 实验组(氮源CH4N2O, 200μmol/L)和对照组(氮源NaNO3, 882μmol/L)在固碳通路中共注释到164个固碳相关编码基因, 比对二者发现, 有33个基因在实验组出现明显表达差异。
通过KEGG通路富集分析, 分别构建多形微眼藻的C3、C4固碳通路图(图 1, 2)。在这两种固碳途径中, 只有C3途径能够独立完成CO2的同化, C4固碳代谢途径无法脱离C3途径独自存在, C4固碳途径本质上是通过对CO2的收集和浓缩完成植物的CO2再分配(Cerling et al, 1993), C4产生的CO2经过细胞内的输送, 进入C3固碳过程完成最终固定过程。
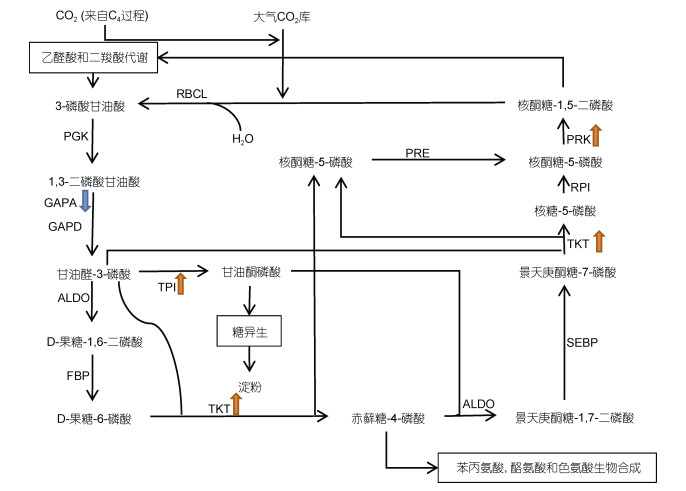 |
| 图 1 多形微眼藻C3固碳途径通路图 Fig. 1 C3 carbon fixation pathway of Minutocellus polymorphus 注:通过KEGG(京都基因与基因组百科全书)的转录组数据富集分析得到, 涉及其他通路的部分由方框圈出, 箭头上标注的为这一过程中的酶, 箭头指向的为过程产物, 蓝色箭头表示基因表达下调, 红色箭头表示基因表达上调。 |
如图 1所示, 多形微眼藻中检出羧化阶段所必需的核酮糖-1, 5-二磷酸羧化酶/加氧酶大亚基(ribulose- bisphosphate carboxylase large subunit, RBCL)编码基因, 能够进行CO2固定。检出还原阶段所必需的磷酸甘油酸激酶(phosphoglycerate kinase, PGK)编码基因、NADP+-甘油醛-3-磷酸磷酸脱氢酶[glyceraldehyde- 3-phosphate dehydrogenase (NADP+), GAPA]与3-磷酸甘油醛脱氢酶(glyceraldehyde-3-phosphatedehydrogenase, GAPD)两种同工酶编码基因, 有完成C3固碳途径还原阶段的分子基础。在实验组C3固碳途径的还原阶段中, GAPA编码基因的表达出现显著下调, 表示在有机氮源尿素中细胞可能降低了该过程的反应速度, 减缓了C3固碳作用还原阶段的发生。对于C3过程的再生阶段, 重新生成核酮糖-1, 5-二磷酸(ribulose- 1, 5-diphosphate, Rubp)过程中的关键酶核酮糖磷酸激酶(phosphoribulokinase, PRK)编码基因在尿素培养环境中发生显著上调, 表示多形微眼藻在有机氮源中可能具有更快的固碳速率, 需要加快固碳底物Rubp的生成为固定环境中的CO2提供底物。除此之外, 在C3过程的再生阶段中, 转羟乙醛酶(transketolase, TKT)编码基因和丙糖磷酸异构酶(triosephosphate isomer ase, TIM)编码基因在尿素培养条件下都有显著上调, 这同样预示着多形微眼藻在有机氮源中可能有着提升Rubp生成速度的机制。
如图 2所示, 多形微眼藻具备完整的C4固碳过程相关编码基因。含有羧化反应阶段所必需的PEPC编码基因, 推测多形微眼藻能够对CO2进行固定, 生成草酰乙酸。在C4固碳过程的羧化阶段中, PEPC编码基因在实验组(氮源CH4N2O, 200μmol/L)中出现明显下调, 表明通过C4固碳过程进行固定CO2这一行为, 在有机氮源培养环境中可能有所下降。富集到还原和转氨作用阶段所必需的AAT和苹果酸脱氢酶(malate dehydrogenase, MDH)编码基因, 但未发现细胞质AAT编码基因, 推测在多形微眼藻内可能存在草酰乙酸从细胞质到叶绿体的自转运途径(D'Aniello et al, 2005)。在C4固碳过程还原和转氨作用中, 叶绿体AAT编码基因发生显著上调, 推测在有机氮环境中多形微眼藻转化天冬氨酸生成草酰乙酸的速度加快。对于C4过程的脱羧反应阶段, 在多形微眼藻中发现了NADP-ME型、NAD-ME型和PCK型脱羧反应过程的基因表达。多形微眼藻在有机氮源里苹果酸酶(NADP+ dependent malic enzyme, MAO)编码基因有显著提高, 说明在实验组环境中, NADP-ME型脱羧反应具备提高反应速度的基础; 本文发现, NAD-ME型脱羧反应过程的重要酶丙氨酸转氨酶(alanine transaminase, ALAT)编码基因在有机氮环境中出现显著下调表达, 多形微眼藻在有机氮源中生长时通过MAO产生的丙酮酸可能主要是通过NAD-ME型和PCK型脱羧反应过程发生; 对于PCK型脱羧反应, 有机氮源培养的多形微眼藻PEPCK编码基因有显著上调, 这意味着有机氮源培养的多形微眼藻, 具备提高PEPCK将草酰乙酸转化成磷酸烯醇式丙酮酸速度的基础。在底物再生阶段中, 在转录本中检出了PPDK编码基因, 证明多形微眼藻中存在将丙酮酸转化为磷酸烯醇式丙酮酸的编码基因, 且在该过程中, 有机氮源培养的多形微眼藻PPDK编码基因表达有显著上调, 推测多形微眼藻在有机氮源中C4过程底物再生阶段的速度加快。
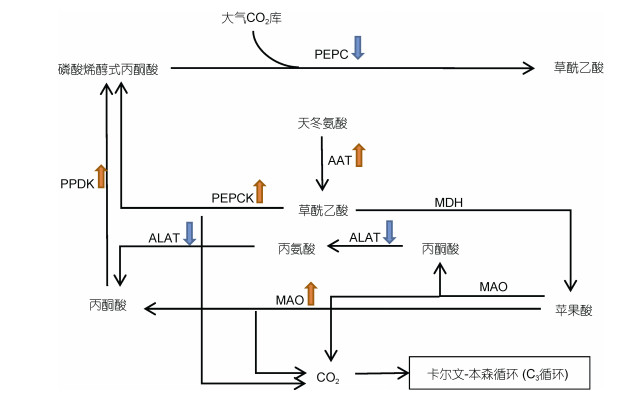 |
| 图 2 多形微眼藻C4固碳途径通路图 Fig. 2 C4 carbon fixation pathway of Minutocellus polymorphus |
为探究多形微眼藻固碳途径规律及特点, 本研究选取两种已经测序完成的硅藻中心硅藻纲的假微型海链藻(Thalassiosira pseudonana)(Armbrust et al, 2004)和羽纹硅藻纲的三角褐脂藻(Phaeodactylum tricornutum)(Bowler et al, 2008)以及与多形微眼藻在同一海域暴发的抑食金球藻(Gobler et al, 2011)作为比对对象, 分析不同微藻固碳途径的异同点。
2.3.1 多形微眼藻C3途径对比通过与三种目标藻种的C3固碳途径做比对, 我们发现在这几类微藻中都具有完整的C3固碳途径相关编码基因表达。
从图 3中可以看到, 作为固碳基本途径, 几种微藻的C3固碳途径相关编码基因都有完整表达。其中, 三角褐脂藻具有和多形微眼藻最相似的C3途径编码基因表达。除在三角褐脂藻中未发现GAPA基因外, 二者C3固碳途径在分子层面的表达基本一致。通过比对抑食金球藻和多形微眼藻 C3固碳途径编码基因表达, 我们发现在抑食金球藻中没有景天庚酮糖-1, 7-二磷酸酶(sedoheptulose-1, 7-bisphosphatase, SEBP)编码基因, 即抑食金球藻没有完成景天庚酮糖-1, 7-二磷酸到景天庚酮糖-7-磷酸转化的分子基础。通过比对假微型海链藻和多形微眼藻 C3固碳途径编码基因表达, 我们发现在假微型海链藻中, 缺乏核酮糖-3-磷酸差向异构酶(ribulose-phosphate 3-epimerase, RPE)编码基因, 没有完成核酮糖-5-磷酸转运的基础。在C3过程完整的四种藻中, 他们都具有相同的羧化、还原阶段, 但在1, 3-二磷酸甘油酸还原形成甘油醛-3-磷酸的过程中, 四种微藻分别通过同工酶GAPA或GAPD编码基因的表达, 提供1, 3-二磷酸甘油酸还原的分子基础。对于C3固碳途径再生阶段, 每种藻都具有核酮糖-1, 5-二磷酸再生的必需酶核酮糖磷酸激酶(phosphoribulokinase, PRK)编码基因的表达。除不含有景天庚酮糖激酶(sedoheptulokinase, SHPK)编码基因和(NAD(P))-甘油醛-3-磷酸磷酸脱氢酶{glyceraldehyde-3-phosphate dehydrogenase (NAD(P)), GAP2}基因外, 多形微眼藻中具有光合生物中能检出的C3固碳途径底物再生过程全部相关酶基因。
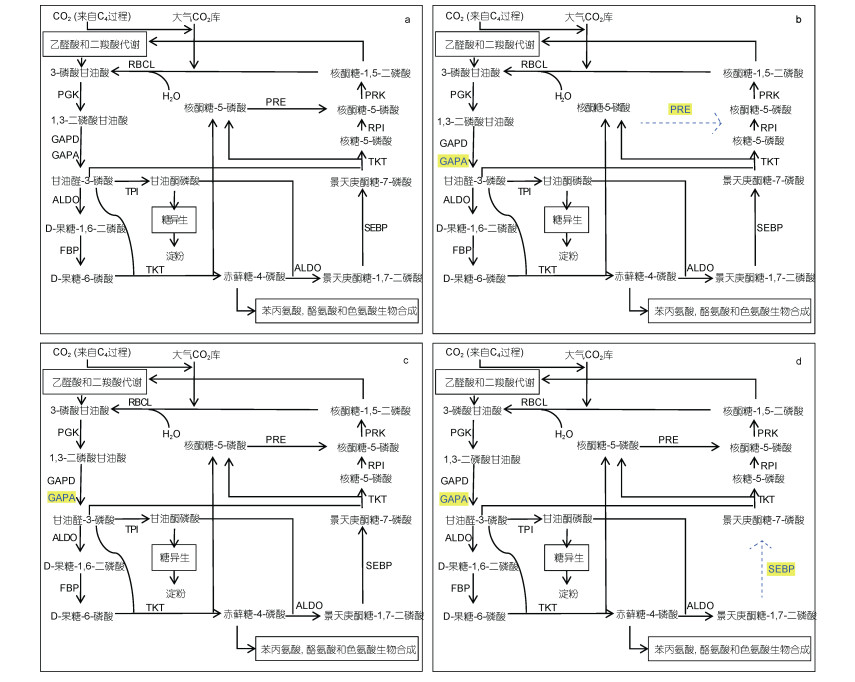 |
| 图 3 四种微藻的C3固碳途径示意图 Fig. 3 Schematic diagram of the C3 carbon fixation pathway of four microalgae 注: a:多型微眼藻; b:假微型海链藻; c:三角褐脂藻; d:抑食金球藻; 以多形微眼藻为参照, 比多形微眼藻少的酶基因和通路用蓝色表示 |
通过对比多形微眼藻、假微型海链藻(Armbrust et al, 2004)、三角褐脂藻(Bowler et al, 2008)和抑食金球藻(Gobler et al, 2011)的C4固碳途径, 本文发现在这几类微藻中都具有C4固碳途径相关编码基因的表达, 暗示其可能通过PEPC完成对大气CO2的固定, 得到草酰乙酸, 并通过还原和不同的脱羧过程形成丙酮酸(NADP-ME型、NAD-ME型脱羧)或磷酸烯醇式丙酮酸(PCK型), 随后得到的丙酮酸经PPDK作用完成底物再生, 即生成固定CO2的底物磷酸烯醇式丙酮酸, PPDK编码基因在各微藻中均有富集。
由图 4可知, 与多形微眼藻同时暴发的抑食金球藻具有与多形微眼藻更相似的C4固碳途径。除在多形微眼藻中没有检测到细胞质AAT编码基因外, 抑食金球藻拥有和多形微眼藻完全相同的C4固碳途径相关编码基因表达, 推测二者对固碳有相似的机制, 而多形微眼藻中缺乏的细胞质AAT编码基因有可能是抑食金球藻更能适应秦皇岛海域生存环境, 并在秦皇岛褐潮中成为优势种的原因。而通过对多形微眼藻和抑食金球藻的共同培养后发现, 分属于硅藻门和金藻门的两种微藻在生长过程中相互影响, 其对应的初始密度和生长时期是决定竞争优势的主要因种微藻固碳途径中C4基因的表达则为我们在转录水平上提供了有力证据。此外, 这两种藻的C4固碳途径相关编码基因表达较其他两种硅藻更加完整, 特别是抑食金球藻, 除缺少能在细胞质中将草酰乙酸转化为苹果酸的MDH外, 具有光合生物中所能检出的所有C4途径相关编码基因。与多形微眼藻和抑食金球藻相比, 假微型海链藻和三角褐脂藻的C4固碳途径只具有进行NADP-ME型脱羧过程的分子基础。
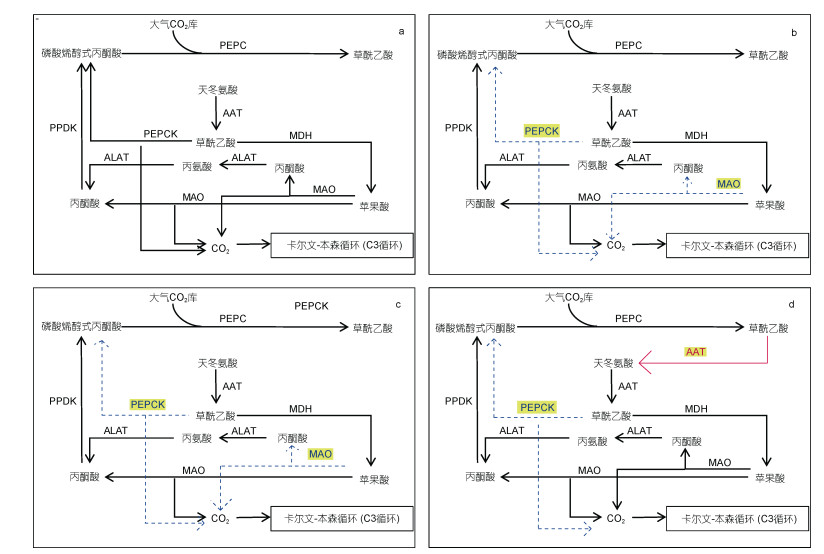 |
| 图 4 四种微藻的C4固碳途径示意图 Fig. 4 Schematic diagram of the C4 carbon fixation pathway of four microalgae 注: a:多型微眼藻; b:假微型海链藻; c:三角褐脂藻; d:抑食金球藻; 以多形微眼藻为参照, 比多形微眼藻多的酶基因和通路用红色表示, 比多形微眼藻少的酶基因和通路用蓝色表示 |
实验组多形微眼藻细胞在C4固碳羧化阶段的PEPC编码基因有显著下调, 而在C4的还原阶段、再生阶段和C3的再生阶段相关固碳编码基因如PEPCK、PPDK、PRK等均有显著上调, 这说明在有机氮源条件下, 由于C3途径再生阶段PRK、TKT等编码基因上调, 甘油醛-3-磷酸可能更多转化为Rubp固碳底物而非淀粉, 因此多形微眼藻没有发生胞内富碳化合物储存的分子基础。同时, 在硝酸盐利用方面, 实验组细胞内促进硝酸盐同化的编码基因((亚)硝酸盐转运蛋白基因、(亚)硝酸盐还原蛋白基因)表达显著上调, 而高浓度的胞内硝酸盐含量常是诱导硝酸盐还原酶高表达的因素(李迎等, 2019), 因此推测实验组多形微眼藻细胞内硝酸盐含量有显著提升; 在尿素利用方面, 实验组氰酸盐裂解酶基因显著上调(李迎等, 2019), 而氰酸盐在细胞内是氨甲磷酸和尿素的分解产生的, 因此推测实验组细胞内尿素的吸收同化量有显著提升。从这两方面看, 实验组胞内氮素含量水平有显著提高, 而高水平的胞内氮素含量将会有效规避氮缺乏引起的胞内富碳化合物储存(Allen et al, 2011; Palmucci et al, 2011; Hockin et al, 2012), 这也从氮代谢的分子途径为胞内没有发生富碳化合物储存过程提供了佐证。此外, 在氮循环中检出碳酸酐酶(carbonic anhydrase, CA)编码基因(李迎等, 2019), 该基因在氮的吸收利用中起催化氰酸盐分解为氨的作用, 并为酶反应过程提供CO2, 该酶也为固碳过程提供高浓度的CO2环境。
碳代谢同时也对氮代谢有重要作用, 氮代谢需要碳代谢产生的ATP和光合作用产生的还原剂(Falkowski et al, 1975), 以及TCA循环产生的碳骨架(Turpin, 1991; Behrenfeld et al, 2008; Hockin et al, 2012)。在本研究多形微眼藻的转录组数据中, 实验组氮代谢相关基因表达除谷氨酰胺合成酶下调外, 其余所有基因均表现上调或没有显著变化(李迎等, 2019), 这可能意味着除铵态氮转化为谷氨酸的过程外, 整体氮循环的加快, 这一过程对固碳过程提出了大量ATP、还原剂及碳骨架的需求, 故而实验组多形微眼藻固碳途径对实验条件产生响应, 提高了C3固碳过程的再生阶段的相关酶编码基因表达, 这意味着固碳所得到的有机物可能没有转化为淀粉积累到细胞中, 而是直接分解产生能量等代谢产物, 并以此为氮代谢途径提供支持。
3 结语通过分析多形微眼藻固碳途径并与其他微藻固碳途径进行对比, 本文发现多形微眼藻同时具有完整的C3、C4固碳途径的分子基础, 与三角褐脂藻具有相似的C3固碳途径编码基因表达, 而与同时在秦皇岛海区暴发的抑食金球藻具有相似的C4固碳途径编码基因表达。因此该藻能够有效固定CO2, 有可能在环境中获得竞争优势。通过分析多形微眼藻碳氮代谢途径基因表达情况, 发现两种代谢途径可以相互支撑, 存在协同效应。本研究为进一步了解海洋浮游植物固碳途径提供了基础资料, 可为进一步从蛋白质组、代谢组等角度探索固碳过程提供方向。
邓帅, 李双俊, 宋春风, 等. 2018. 微藻光合固碳效能研究:进展、挑战和解决路径. 化工进展, 37(3): 928-937 |
邓祥元, 成婕, 高坤, 等. 2015. 海洋酸化影响硅藻固碳相关基因表达的研究进展. 基因组学与应用生物学, 34(5): 1092-1096 |
刘乾, 米铁柱, 甄毓, 等. 2016. 基于玛氏骨条藻(Skeletonema marinoi)转录组的碳固定代谢途径分析. 科学通报, 61(22): 2483-2493 |
芦笛. 2013. 大型海藻光合碳代谢类型的研究进展. 自然杂志, 35(4): 264-273 |
李迎, 米铁柱, 乔玲, 等. 2019. 基于转录组测序对两种氮素营养条件下多形微眼藻氮代谢途径的解析. 海洋与湖沼, 50(6): 1241-1251 |
陈月红, 石晓勇, 韩秀荣, 等. 2015. 闽浙近岸海域赤潮暴发前后海水营养盐特征分析. 海洋通报, 34(5): 568-576 |
陈杨航, 梁君荣, 陈长平, 等. 2015. 褐潮——一种新型生态系统破坏性藻华. 生态学杂志, 34(1): 274-281 |
夏茗. 2008. 中国至2050年能源科技路线图战略研究——"太阳能热利用专题研讨会"召开. 太阳能, (3): 44 |
郭烈锦, 何雅玲, 陈斌, 等. 2011. 工程热物理与能源利用学科发展战略研究报告(2011-2020). 北京: 科学出版社
|
Allen A E, Dupont C L, Oborník et al, 2011. Evolution and metabolic significance of the urea cycle in photosynthetic diatoms. Nature, 473(7346): 203-207 DOI:10.1038/nature10074 |
Armbrust E V, Berges J A, Bowler C et al, 2004. The genome of the diatom Thalassiosira pseudonana:ecology, evolution, and metabolism. Science, 306(5693): 79-86 DOI:10.1126/science.1101156 |
Badger M R, Andrews T J, Whitney S M et al, 1998. The diversity and coevolution of Rubisco, plastids, pyrenoids, and chloroplast-based CO2-concentrating mechanisms in algae. Canadian Journal of Botany, 76(6): 1052-1071 DOI:10.1139/b98-074 |
Beardall J, Giordano M, 2002. Ecological implications of microalgal and cyanobacterial CO2 concentrating mechanisms, and their regulation. Functional Plant Biology, 29(2-3): 335-347 |
Beardall J, Mukerji D, Glover H E et al, 1976. The path of carbon in photosynthesis by marine phytoplankton. Journal of Phycology, 12(4): 409-417 |
Behrenfeld M J, Halsey K H, Milligan A J, 2008. Evolved physiological responses of phytoplankton to their integrated growth environment. Philosophical Transactions of the Royal Society B:Biological Sciences, 363(1504): 2687-2703 DOI:10.1098/rstb.2008.0019 |
Bender S J, Durkin C A, Berthiaume C T et al, 2014. Transcriptional responses of three model diatoms to nitrate limitation of growth. Frontiers in Marine Science, 1(3): 1-15 |
Bowler C, Allen A E, Badger J H et al, 2008. The Phaeodactylum genome reveals the evolutionary history of diatom genomes. Nature, 456(7219): 239-244 DOI:10.1038/nature07410 |
Buchfink B, Xie C, Huson D H, 2015. Fast and sensitive protein alignment using DIAMOND. Nature Methods, 12(1): 59-60 |
Calvin M, 1962. The path of carbon in photosynthesis. Science, 135(3507): 879-889 DOI:10.1126/science.135.3507.879 |
Camacho C, Coulouris G, Avagyan V et al, 2009. BLAST+:Architecture and applications. BMC Bioinformatics, 10: 421 DOI:10.1186/1471-2105-10-421 |
Cerling T E, Wang Y, Quade J, 1993. Expansion of C4 ecosystems as an indicator of global ecological change in the late Miocene. Nature, 361(6410): 344-345 DOI:10.1038/361344a0 |
Chen Y H, Gao Y H, Chen C P et al, 2018. Interactions between the brown tide-causing microalga Aureococcus anophagefferens and the small diatom Minutocellus polymorphus under laboratory culture. Journal of Applied Phycology, 31(3): 1793-1803 |
Claquin P, Martin-Jézéquel V, Kromkamp J C et al, 2002. Uncoupling of silicon compared with carbon and nitrogen metabolisms and the role of the cell cycle in continuous cultures of Thalassiosira pseudonana (Bacillariophyceae) under light, nitrogen, and phosphorus control. Journal of Phycology, 38(5): 922-930 DOI:10.1046/j.1529-8817.2002.t01-1-01220.x |
Cock P J A, Fields C J, Goto N et al, 2010. The Sanger FASTQ file format for sequences with quality scores, and the Solexa/Illumina FASTQ variants. Nucleic Acids Research, 38(6): 1767-1771 DOI:10.1093/nar/gkp1137 |
Cui L, Lu X X, Dong Y L et al, 2018. Relationship between phytoplankton community succession and environmental parameters in Qinhuangdao coastal areas, China:a region with recurrent brown tide outbreaks. Ecotoxicology and Environmental Safety, 159: 85-93 DOI:10.1016/j.ecoenv.2018.04.043 |
D'Aniello A, Fisher G, Migliaccio N et al, 2005. Amino acids and transaminases activity in ventricular CSF and in brain of normal and Alzheimer patients. Neuroscience Letters, 388(1): 49-53 DOI:10.1016/j.neulet.2005.06.030 |
Davidson N M, Oshlack A, 2014. Corset:enabling differential gene expression analysis for de novo assembled transcriptomes. Genome Biology, 15(7): 410 |
Falkowski P G, Stone D P, 1975. Nitrate uptake in marine phytoplankton:Energy sources and the interaction with carbon fixation. Marine Biology, 32(1): 77-84 |
Finn R D, Tate J, Mistry J et al, 2008. The Pfam protein families database. Nucleic Acids Research, 36(S1): D281-D288 |
Gobler C J, Berry D L, Dyhrman S T et al, 2011. Niche of harmful alga Aureococcus anophagefferens revealed through ecogenomics. Proceedings of the National Academy of Sciences of the United States of America, 108(11): 4352-4357 DOI:10.1073/pnas.1016106108 |
Götz S, García-Gómez J M, Terol J et al, 2008. High-throughput functional annotation and data mining with the Blast2GO suite. Nucleic Acids Research, 36(10): 3420-3435 DOI:10.1093/nar/gkn176 |
Grabherr M G, Haas B J, Yassour M et al, 2011. Trinity:reconstructing a full-length transcriptome without a genome from RNA-Seq data. Nature Biotechnology, 29(7): 644-652 DOI:10.1038/nbt.1883 |
Haimovich-Dayan M, Garfinkel N, Ewe D et al, 2013. The role of C4 metabolism in the marine diatom Phaeodactylum tricornutum. New Phytologist, 197(1): 177-185 DOI:10.1111/j.1469-8137.2012.04375.x |
Harrison P J, Thompson P A, Calderwood G S, 1990. Effects of nutrient and light limitation on the biochemical composition of phytoplankton. Journal of Applied Phycology, 2(1): 45-56 DOI:10.1007/BF02179768 |
Hockin N L, Mock T, Mulholland F et al, 2012. The response of diatom central carbon metabolism to nitrogen starvation is different from that of green algae and higher plants. Plant Physiology, 158(1): 299-312 |
Huang B Q, Liang Y L, Pan H Z et al, 2020. Hemolytic and cytotoxic activity from cultures of Aureococcus anophagefferens-a causative species of brown tides in the north-western Bohai Sea, China. Chemosphere, 247: 125819 DOI:10.1016/j.chemosphere.2020.125819 |
Kanehisa M, Araki M, Goto S et al, 2008. KEGG for linking genomes to life and the environment. Nucleic Acids Research, 36(S1): D480-D484 |
Kolber Z, Zehr J, Falkowski P, 1988. Effects of growth irradiance and nitrogen limitation on photosynthetic energy conversion in photosystem II. Plant Physiology, 88(3): 923-929 DOI:10.1104/pp.88.3.923 |
La Roche J, Geider R J, Graziano L M et al, 1993. Induction of specific proteins in eukaryotic algae grown under iron-, phosphorus-, or nitrogen-deficient conditions. Journal of Phycology, 29(6): 767-777 DOI:10.1111/j.0022-3646.1993.00767.x |
Moriya Y, Itoh M, Okuda S et al, 2007. KAAS:An automatic genome annotation and pathway reconstruction server. Nucleic Acids Research, 35(S2): W182-W185 |
Onodera J, Takahashi K, Honda M C, 2005. Pelagic and coastal diatom fluxes and the environmental changes in the northwestern North Pacific during December 1997-May 2000. Deep Sea Research Part II:Topical Studies in Oceanography, 52(16-18): 2218-2239 DOI:10.1016/j.dsr2.2005.07.005 |
Palmucci M, Ratti S, Giordano M, 2011. Ecological and evolutionary implications of carbon allocation in marine phytoplankton as a function of nitrogen availability:a Fourier transform infrared spectroscopy approach. Journal of Phycology, 47(2): 313-323 DOI:10.1111/j.1529-8817.2011.00963.x |
Pokoo-Aikins G, Nadim A, El-Halwagi M M et al, 2010. Design and analysis of biodiesel production from algae grown through carbon sequestration. Clean Technologies and Environmental Policy, 12(3): 239-254 DOI:10.1007/s10098-009-0215-6 |
Qiao L, Chen Y C, Mi T Z et al, 2017. Quantitative PCR analysis of the spatiotemporal dynamics of Aureococcus anophagefferens and Minutocellus polymorphus and the relationship between brown tides and nutrients in the coastal waters of Qinhuangdao, China. Journal of Applied Phycology, 29(1): 297-308 DOI:10.1007/s10811-016-0959-4 |
Raven J A, Hurd C L, 2012. Ecophysiology of photosynthesis in macroalgae. Photosynthesis Research, 113(1-3): 105-125 DOI:10.1007/s11120-012-9768-z |
Rech M, Morant-Manceau A, Tremblin G, 2008. Carbon fixation and carbonic anhydrase activity in Haslea ostrearia (Bacillariophyceae) in relation to growth irradiance. Photosynthetica, 46(1): 56-62 |
Reinfelder J R, Kraepiel A M L, Morel F M M, 2000. Unicellular C4 photosynthesis in a marine diatom. Nature, 407(6807): 996-999 DOI:10.1038/35039612 |
Roberts K, Granum E, Leegood R C et al, 2007. C3 and C4 pathways of photosynthetic carbon assimilation in marine diatoms are under genetic, not environmental, control. Plant Physiology, 145(1): 230-235 |
Turpin D H, 1991. Effects of inorganic N availability on algal photosynthesis and carbon metabolism. Journal of Phycology, 27(1): 14-20 DOI:10.1111/j.0022-3646.1991.00014.x |
Yool A, Tyrrell T, 2003. Role of diatoms in regulating the ocean's silicon cycle. Global Biogeochemical Cycles, 17(4): 1103 |
Young M D, Wakefield M J, Smyth G K et al, 2010. Gene ontology analysis for RNA-seq:accounting for selection bias. Genome Biology, 11(2): R14 DOI:10.1186/gb-2010-11-2-r14 |
Zhang Q C, Qiu L M, Yu R C et al, 2012. Emergence of brown tides caused by Aureococcus anophagefferens Hargraves et Sieburth in China. Harmful Algae, 19: 117-124 DOI:10.1016/j.hal.2012.06.007 |
Zhen Y, Qiao L, Gu B et al, 2016. Characteristics of eukaryotic microalgal community and its abiotic influencing factors during brown tide blooms near Qinhuangdao, China. Harmful Algae, 57: 1-12 |
 2020, Vol. 51
2020, Vol. 51


