中国海洋湖沼学会主办。
文章信息
- 李训猛, 章守宇, 王凯, 陈亮然, 陈天华. 2020.
- LI Xun-Meng, ZHANG Shou-Yu, WANG Kai, CHEN Liang-Ran, CHEN Tian-Hua. 2020.
- 周年温度变化对枸杞岛铜藻生长特性的影响
- EFFECT OF ANNUAL TEMPERATURE VARIATION ON GROWTH OF SARGASSUM HORNERI IN GOUQI ISLAND
- 海洋与湖沼, 51(5): 1136-1143
- Oceanologia et Limnologia Sinica, 51(5): 1136-1143.
- http://dx.doi.org/10.11693/hyhz20191000197
文章历史
-
收稿日期:2019-10-28
收修改稿日期:2020-03-27
2. 北京林业大学生态与自然保护学院 北京 100083;
3. 浙江省海洋监测预报中心 杭州 310007
2. School of Ecology and Nature Conservation, Beijing Forestry University, Beijing 100083, China;
3. Zhejiang Ocean Monitoring and Forecasting Center, Hangzhou 310007, China
铜藻(Sargassum horneri)属褐藻门(Phaeophyta), 马尾藻属(Sargassum)(曾呈奎, 2000), 主要生长在潮流通畅、风浪较为平静的潮下带岩礁基质上(孙建璋等, 2008)。生长繁盛的铜藻群落与周围其他生物有机体共同构成了独特的近岸海藻场生态系统。海藻场是海洋牧场生境建设过程中的重要组成部分, 与人工鱼礁建设共同作为海洋牧场区生物栖息地生态改善手段, 我国近岸以瓦氏马尾藻、铜藻等大型褐藻种群为主构建的海藻场为海洋牧场中大泷六线鱼、褐菖鲉、许氏平鲉等目标种的养护、增殖和产出提供了良好的避敌、繁殖、生存空间, 是其摄食、产卵、栖息的优良场所(Airoldi et al, 1995; Terawaki et al, 2001)。生长于浙江省枸杞岛海域的铜藻, 属北太平洋西部特有暖温带性藻种, 每年秋冬季开始生长, 翌年夏季进入繁盛期(陈亮然等, 2015)。这种以铜藻为优势藻种的海藻场生态系统为枸杞岛渔业资源保护、海洋生态修复提供强了有力的支撑。
适宜的温度是植物生命活动不可或缺的条件之一, 海洋藻类的代谢、性成熟、生长发育及数量分布都与温度有着密切联系, 在水温变化较大海区, 优势藻种一年中变化较大(赵淑江, 2014)。目前, 国内外关于海藻生长与温度间关系研究主要集中在藻体内生化组成(Murakami et al, 2011)、最适生长温度(Uchida, 1993; Choi et al, 2008; Zhang et al, 2009;马兴宇等, 2013)及分布特征、季节变化(孙建璋等, 2009;毕远新等, 2014;陈亮然等, 2015)等方面, 且大多基于条件可控的室内实验, 而关于自然生长状态下完整生命周期藻体对温度作用时间的响应机制研究较少。法国林学家德列奥米尔(1735)首次发现, 植物完成其生命周期, 需要一定的积温, 即要求一定量的日平均温度的累积, 特别要求有特定的有效积温, 以完成有机体某一生育期或完整生命史过程。基于积温学观点, 同样, 在其他条件满足的前提下, 温度对藻类的生长发育起主导作用, 生长温度需要满足其下限温度, 且需一定的温度总量才能完成生命周期。
本文通过探究枸杞岛铜藻完整生命周期生长特性与积温变化关系, 有效反映了不同生长阶段铜藻对热量的需求, 为新地区铜藻引种、预测地理分布及藻场修复提供科学依据。
1 材料与方法 1.1 研究区域概况枸杞岛(30°41′—30°44′N, 122°44′—122°48′E), 位于舟山市嵊泗县马鞍列岛, 海洋渔业资源丰富, 岛礁周边铜藻生物量较大, 约35.81—1568.44g/m2(诸逦莹等, 2012)。由于常年受长江冲淡水及台湾暖流交互影响, 海水温度年变化较大, 约7—25℃, 平均水温17—19℃。每年7—8月, 铜藻幼苗开始生长, 翌年3—5月进入繁盛期, 5月下旬藻体出现衰老凋亡。
1.2 站点选择基于历年枸杞岛沿岸藻场分布调查可知, 铜藻主要分布于枸杞岛西北侧及东南侧, 且呈斑块状不连续分布。西北侧及南侧大面积养殖贻贝, 铜藻生长环境受人类活动影响较大, 故本研究站点选取在枸杞岛东南侧小石浦(30°42′25.03″N, 122°46′57.63″E), 该处铜藻生长繁盛, 生物量较大, 且贻贝养殖量较少, 具有一定代表性(图 1)。
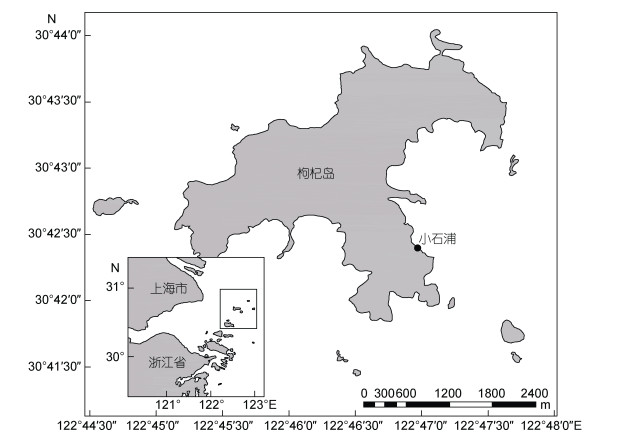 |
| 图 1 小石浦调查站点 Fig. 1 Sampling station of Xiaoshipu |
陈亮然、毕远新等人曾多次对枸杞岛岩礁铜藻生态特征及分布特征进行潜水调查研究, 总结得出每年6月底至7月初, 枸杞岛海域铜藻完成卵子散放(毕远新等, 2013;陈亮然等, 2015)。故本文于2013年8月—2014年6月(受制于海况条件, 2014年2月未能有效进行铜藻采样)枸杞岛铜藻幼苗至成藻阶段, 每月一次随机采集30株铜藻样本(图 2), 保存于甲醛含量为7%的海水中。带回实验室后用毛刷擦拭藻体表面, 除去杂藻及砂石杂物, 并用吸水纸吸干藻体表面游离水份, 株高采用游标卡尺测量, 生物量采用烘箱经100℃条件下24h烘干测定(陈亮然等, 2015)。枸杞岛水温数据由浙江省海洋监测预报中心提供。
 |
| 图 2 铜藻 Fig. 2 Sargassum horneri 注: a.铜藻形态图; b.铜藻生态图 |
温度通过影响海藻机体内酶促反应, 影响生命活动(赵淑江, 2014)。通常, 在适温范围内, 藻体代谢速率随温度的升高而加强; 高出或低于适温范围, 代谢强度减弱; 温度高于生物学上限温度或低于生物学下限温度, 藻体生长发育停止甚至衰亡(张婧, 2012)。本文铜藻生物学下限温度及上限温度分别取值7.1℃和25.0℃ (孙建璋等, 2008;吴祖立等, 2019)。
有效温度是指活动温度与生物学下限温度的差值, 生育时期内有效温度的总和即为有效积温(牛翠娟等, 2007)。
有效积温K计算表达式为
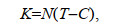 (1)
(1)式中, K为有效积温, N为发育历期, 即生长发育所需时间; T为发育期间平均温度; C为发育起点温度(下限温度)。
2 结果与分析 2.1 铜藻生长历期有效积温季节变化枸杞岛附近海域, 由于地处长江口, 常年受台湾暖流及长江冲淡水交互作用, 多年平均水温约17—19℃, 8—9月水温较高, 达25℃左右, 2月水温较低, 约7—8℃ (图 3)。每年8月初枸杞岛水温23—25℃, 适宜铜藻早期幼孢子体生长, 生长到一定阶段后, 较大的藻体对低温适应能力较强, 生长迅速; 翌年1—2月, 海水温度较低, 藻体内酶促反应受到抑制, 生长缓慢; 3月中旬至4月中旬, 海水温度受气温影响逐渐回升, 铜藻又进入快速生长期, 此时藻体大, 生长快; 5月底6月初, 铜藻进入衰老凋亡阶段。
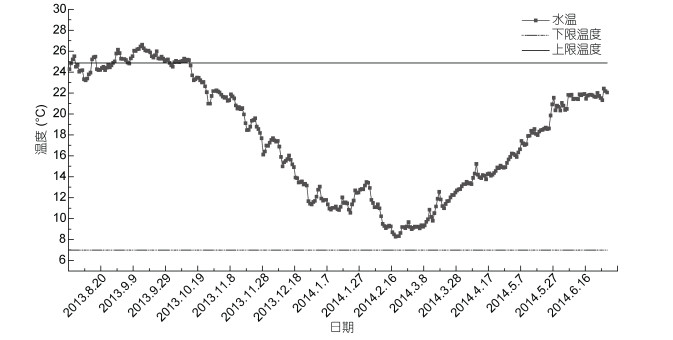 |
| 图 3 枸杞岛水温变化 Fig. 3 Variation in water temperature of Gouqi Island |
逐月采集枸杞岛铜藻样本, 测定株高、个体生物量等生物学参数(表 1)。2013年8月, 铜藻株高(8.20±1.42)cm, 至翌年6月, 生长至(77.91±18.26)cm, 平均生物量由0.15g增长至6.76g, 铜藻个体株高、生物量均具有明显的季节变动规律。藻体完整生命阶段, 有效积温从8月的544.5℃·d增长至翌年6月的3609.8℃·d。
| 时间 | 株高(cm) | 生物量(g) | 有效积温(℃·d) |
| 2013年8月 | 8.20±1.42 | 0.15±0.06 | 544.5 |
| 2013年9月 | 17.71±4.02 | 0.45±0.17 | 1104.2 |
| 2013年10月 | 30.15±7.37 | 0.55±0.24 | 1623.8 |
| 2013年11月 | 37.73±10.44 | 0.75±0.24 | 2014.6 |
| 2013年12月 | 43.54±12.04 | 1.02±0.31 | 2258.5 |
| 2014年1月 | 45.85±9.85 | 1.22±0.45 | 2406.3 |
| 2014年3月 | 51.31±13.10 | 1.64±1.25 | 2609.1 |
| 2014年4月 | 60.16±15.67 | 2.95±1.79 | 2826.3 |
| 2014年5月 | 66.49±15.73 | 5.79±3.59 | 3172.5 |
| 2014年6月 | 77.91±18.26 | 6.76±4.35 | 3609.8 |
2013年8月至2014年6月铜藻完整生命周期内, 有效积温逐渐累积(图 4)。分析可知, 有效积温随铜藻生长时间呈三次函数增长, 8—11月海水温度逐渐降低, 有效积温增长率随之减小; 12月至翌年2月, 水温最低, 铜藻进入低温生长减慢期; 3—5月海水温度迅速上升, 恢复至生长适温, 藻体快速增长。
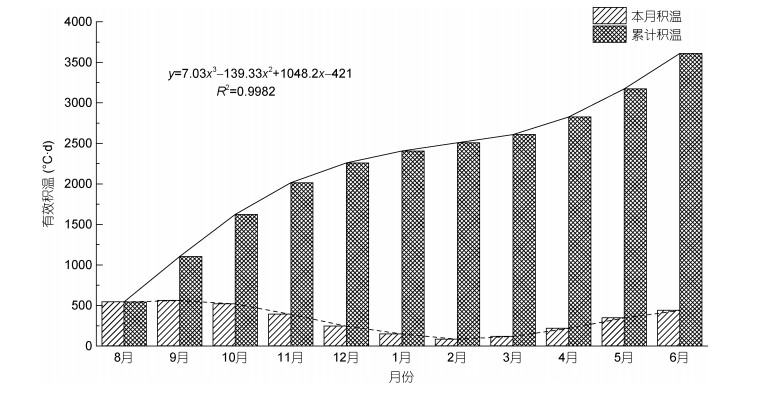 |
| 图 4 有效积温逐月变化 Fig. 4 Monthly variation of effective accumulated temperature |
在铜藻完整生命史过程中, 随着生长历期的增加, 藻体株高也逐渐增长, 气囊、生殖托随之出现, 个体生物量增大。生物量增长率先增大后减小, 株高为51.31—66.49cm时, 植株个体生物量(干重)增长速率最大。分析可知, 8月至翌年3月间, 铜藻从幼苗开始生长, 且水温处于下降阶段, 在3—5月, 水温逐渐回升, 生殖托出现, 生物学结构逐渐完善, 个体生物量快速增加。5月末6月初水温受气温影响上升至22—23℃, 藻体植株不断老化并伴随着生物结构解体, 但由于部分未成熟藻体补充速率大于凋零速率, 整体生物量仍保持低速增长。
2.2 铜藻株高与有效积温变化关系图 5给出了枸杞岛铜藻株高季节变化情况, 8月至翌年6月, 铜藻株高由(8.20±1.42)cm增长至(77.91±18.26)cm。8—11月株高增速较大, 12—3月增速缓慢, 4—6月株高增长速率继续增加。由图 5b可知, 铜藻株高与有效积温呈线性递增关系, 有效积温大于2609.1℃·d后, 株高增长较快, 此时海水温度12—14℃, 铜藻生殖托出现, 进入快速生长阶段。
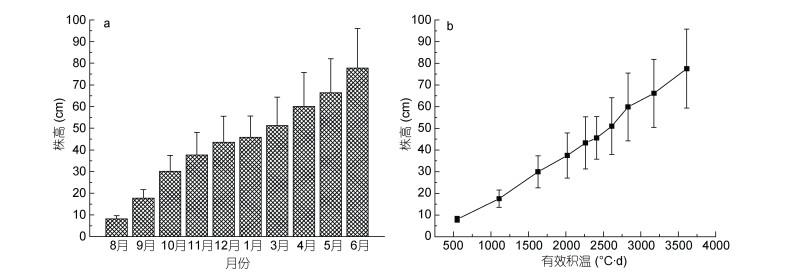 |
| 图 5 铜藻逐月株高与有效积温变化 Fig. 5 Monthly variation in individual length and effective accumulated temperature of Sargassum horneri 注: a.铜藻株高逐月变化; b.株高与有效积温变化 |
铜藻生物量在7月至翌年3月与生长历期呈正相关关系, 3—5月增速较大, 5月末至6月, 生物量增长缓慢(图 6a)。翌年3月, 海水温度回升, 约11—13℃, 生物量快速增长。铜藻完整生长历程中, 各阶段生物量增长速率(V): V3—5月>V5—6月>V6—翌年3月。图 6b给出了有效积温与铜藻生物量变化关系, 由图可知, 铜藻生物量快速增长转折点对应的时间节点为3月中下旬, 有效积温约为2600℃·d。3—5月, 水温较适宜藻体生长, 随着有效温度的累积, 生物量快速增加, 5月末至6月, 增长率放缓。综合表 1与图 6可知, 5月为铜藻生长繁盛期“顶点”, 对应有效积温为3172.5℃·d。
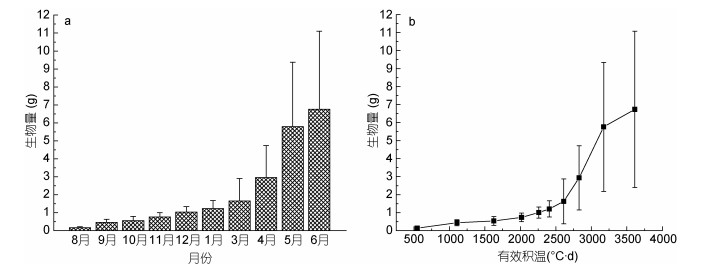 |
| 图 6 铜藻逐月生物量与有效积温变化 Fig. 6 Monthly variation in individual biomass and effective accumulated temperature of Sargassum horneri 注: a.铜藻生物量逐月变化; b.生物量与有效积温变化 |
不同生长阶段的铜藻, 在同一温度下, 生长速率不同; 同样, 不同生长温度下, 相同生长阶段的铜藻对温度适应能力也不同(Choi et al, 2008;张婧, 2012;李慧, 2018)。较小铜藻藻体耐高温能力强于较大藻体, 高温条件下, 小藻体生长速率较大。根据铜藻生长适温范围、株高、生物量及自然水温变化规律, 可将铜藻生长过程划分为:第一适温期、低温期、第二适温期和高温衰亡期(图 7)。枸杞岛海域每年7—8月, 水温23—25℃, 铜藻早期幼孢子体开始生长。由于海水受气温、海流等因素影响, 温度逐渐降低, 1月中下旬水温约10—11℃。8月至翌年1月, 水温较适宜铜藻生长, 此阶段可划分为铜藻第一适温期。1月末至2月中下旬, 藻体生长发育缓慢, 甚至可能出现生长停滞(仍可维持基本生命), 此阶段可划分为铜藻低温期。当藻体生长进入3月中旬至5月中下旬, 海水温度逐渐回升, 铜藻又进入快速生长阶段, 此时藻体较大, 生长较快, 可划分为铜藻第二适温期。5月末6月初及以后, 水温继续升高, 大于22—23℃, 藻体植株不断老化并伴随着生物结构解体、凋零, 此阶段可划分为铜藻高温衰亡期。
 |
| 图 7 铜藻生长阶段划分 Fig. 7 Growth stage division of Sargassum horneri 注: a.第一适温期样本; b.低温期样本; c.第二适温期样本; d.高温衰亡期样本 |
海水温度往往决定着海藻生长的季节变动与生长演替(McCourt, 1984; Hurtado et al, 1999; Díaz-Villa et al, 2005; Rivera et al, 2006), 同一藻种随各地海水温度变化, 生殖期不尽相同(Taylor, 1960; Deysher, 1984), 海水温度控制着海洋藻类的生物地理分布(Ang, 2006; Komatsu et al, 2014;赵淑江, 2014)。每年7—8月, 海水温度23—25℃, 枸杞岛铜藻幼苗开始生长, 植株增长率约1.52mm/d, 生长繁盛期为每年3—5月, 水温9—22℃, 平均增长率达3.80mm/d。
3.2 有效积温藻类生长主要受生长基质、水温、光照、海流等环境因子影响。其分布范围受温度制约, 我国黄海、渤海海域多属温带性藻种, 东海区多为亚热带藻种, 南海区多为热带性藻种(Umezaki et al, 1984)。铜藻在不同生长阶段所需有效积温不同, 日平均温度高于生育起始温度时, 温度因子对藻类有机体的生长发育起促进作用。8月至翌年6月, 枸杞岛铜藻完成生长发育所需有效积温约3600—3700℃·d, 8—12月, 铜藻株高、生物量均与有效积温呈正相关关系。铜藻繁盛期(3—5月)有效积温约2609.1—3172.5℃·d, 藻体生长进入繁盛期转折点积温约为2600℃·d。根据有效积温与铜藻生物量变化关系(图 6b)可知, 3—5月铜藻生物量增长率较大, 5月后, 生物量增长放缓, 但由于部分未成熟藻体补充, 部分植株增长速率大于衰老凋亡速率, 生物量仍小幅度上升。
1—3月, 枸杞岛水温较低, 最低水温约7—8℃, 枸杞岛铜藻生长速率较低, 低温累积对藻体生理变化的影响尚不明确。其次, 5月及以后, 铜藻受高温影响, 开始衰老凋亡, 其凋亡过程与温度、有效积温变化情况, 还有待进一步研究。
4 结论本文通过探究2013年8月—2014年6月枸杞岛铜藻生长水温变化情况, 分析出铜藻完成生长发育所需有效积温为3600—3700℃·d, 藻体生长进入繁盛期转折点积温约为2600℃·d。依据有效积温变化情况, 铜藻完整生命史过程可划分为:第一适温期(7—12月)、低温期(1—2月)、第二适温期(3—5)和高温衰亡期(6月及以后)。8月至翌年6月, 铜藻株高、生物量与有效积温呈正相关关系, 3—5月为生长繁盛期, 5月下旬出现生长“顶点”, 6月藻体出现衰老凋亡, 各阶段生物量增长关系为: V3—5月>V5—6月>V6—翌年3月。
马兴宇, 梁洲瑞, 刘福利, 等. 2013. 环境因子对鼠尾藻生殖托生长及光合特性的影响. 中国水产科学, 20(4): 851-858 |
牛翠娟, 娄安如, 孙儒泳, 等. 2007. 基础生态学. 2版. 北京: 高等教育出版社
|
毕远新, 章守宇, 王伟定, 等. 2014. 枸杞岛铜藻垂直分布格局及成因分析. 生态学报, 34(17): 4931-4937 |
毕远新, 章守宇, 吴祖立. 2013. 枸杞岛铜藻种群分布的季节变化. 生态学杂志, 32(5): 1255-1259 |
孙建璋, 庄定根, 王铁干, 等. 2009. 南麂列岛铜藻的研究. 现代渔业信息, 24(5): 19-21 |
孙建璋, 陈万东, 庄定根, 等. 2008. 中国南麂列岛铜藻Sargassum horneri实地生态学的初步研究. 南方水产, 4(3): 58-63 |
李慧, 2018.环境因子对铜藻生长、生化组分和氮吸收的影响.温州: 温州大学硕士学位论文, 4-5
|
张婧, 2012.瓦氏马尾藻与铜藻的室内人工培育.上海: 上海海洋大学硕士学位论文, 50-51
|
陈亮然, 章守宇, 陈彦, 等. 2015. 枸杞岛马尾藻场铜藻的生命史与形态特征. 水产学报, 39(8): 1218-1229 |
吴祖立, 章守宇. 2019. 台风对浙江枸杞岛大型底栖海藻分布的影像分析. 中国农业科技导报, 21(9): 159-168 |
赵淑江. 2014. 海洋藻类生态学. 北京: 海洋出版社
|
诸逦莹, 刘洪生, 张婧雯. 2012. 枸杞岛周围底栖海藻分布的回声探测及其插值研究. 上海海洋大学学报, 21(3): 445-451 |
曾呈奎. 2000. 中国海藻志. 第三卷(第二册). 北京: 科学出版社
|
Airoldi L, Rindi F, Cinelli F et al, 1995. Structure, seasonal dynamics and reproductive phenology of a filamentous turf assemblage on a sediment influenced, rocky subtidal shore. Botanica Marina, 38(3): 227-237 |
Ang Jr P O, 2006. Phenology of Sargassum spp. in Tung Ping Chau Marine Park, Hong Kong SAR, China. Journal of Applied Phycology, 18(3-5): 629-636 DOI:10.1007/s10811-006-9071-5 |
Choi H G, Lee K H, Yoo H I et al, 2008. Physiological differences in the growth of Sargassum horneri between the germling and adult stages. Journal of Applied Phycology, 20(5): 729-735 DOI:10.1007/s10811-007-9281-5 |
Deysher L E, 1984. Reproductive phenology of newly introduced populations of the brown alga, Sargassum muticum (Yendo) Fensholt. Hydrobiologia, 116-117(1): 403-407 DOI:10.1007/BF00027710 |
Díaz-Villa T, Sansón M, Afonso-Carrillo J, 2005. Seasonal variations in growth and reproduction of Sargassum orotavicum (Fucales, Phaeophyceae) from the Canary Islands. Botanica Marina, 48(1): 18-29 |
Hurtado A Q, Ragaza A R, 1999. Sargassum studies in Currimao, Ilocos Norte, Northern Philippines I. Seasonal variations in the biomass of Sargassum carpophyllum J. Agardh, Sargassum ilicifolium (Turner) C. Agardh and Sargassum siliquosum J. Agardh(Phaeophyta, Sargassaceae). Botanica Marina, 42(4): 321-325 |
Komatsu T, Fukuda M, Mikami A et al, 2014. Possible change in distribution of seaweed, Sargassum horneri, in northeast Asia under A2 scenario of global warming and consequent effect on some fish. Marine Pollution Bulletin, 85(2): 317-324 |
McCourt R M, 1984. Seasonal patterns of abundance, distributions, and phenology in relation to growth strategies of three Sargassum species. Journal of Experimental Marine Biology and Ecology, 74(2): 141-156 DOI:10.1016/0022-0981(84)90082-0 |
Murakami K, Yamaguchi Y, Noda K et al, 2011. Seasonal variation in the chemical composition of a marine brown alga, Sargassum horneri (Turner) C. Agardh. Journal of Food Composition and Analysis, 24(2): 231-236 DOI:10.1016/j.jfca.2010.08.004 |
Rivera M, Scrosati R, 2006. Population dynamics of Sargassum lapazeanum (Fucales, Phaeophyta) from the Gulf of California, Mexico. Phycologia, 45(2): 178-189 DOI:10.2216/05-47.1 |
Taylor W R, 1960. Marine Algae of the Eastern Tropical and Subtropical Coasts of the Americas. Michigan: University of Michigan Press
|
Terawaki T, Hasegawa H, Arai S et al, 2001. Management-free techniques for restoration of Eisenia and Ecklonia beds along the central Pacific coast of Japan. Journal of Applied Phycology, 13(1): 13-17 DOI:10.1023/A:1008135515037 |
Uchida T, 1993. The life cycle of Sargassum horneri (phaeophyta) in laboratory culture. Journal of Phycology, 29(2): 231-235 DOI:10.1111/j.0022-3646.1993.00231.x |
Umezaki I, 1984. Ecological studies of Sargassum horneri (TURNER) C. AGARDH in Obama Bay, Japan Sea. Bulletin of the Japanese Society of Scientific Fisheries, 50(7): 1193-1200 |
Zhang Q S, Li W, Liu S et al, 2009. Size-dependence of reproductive allocation of Sargassum thunbergii (Sargassaceae, Phaeophyta) in Bohai Bay, China. Aquatic Botany, 91(3): 194-198 DOI:10.1016/j.aquabot.2009.06.003 |
 2020, Vol. 51
2020, Vol. 51


