
中国海洋湖沼学会主办。
文章信息
- 严润玄, 冯明, 王晓波, 韩庆喜. 2020.
- YAN Run-Xuan, FENG Ming, WANG Xiao-Bo, HAN Qing-Xi. 2020.
- 浙江北部海域大型底栖动物优势种的时空分布
- TEMPORAL AND SPATIAL DISTRIBUTION OF DOMINANT MACROZOOBENTHOS SPECIES IN THE SEA AREA OFF NORTHERN ZHEJIANG PROVINCE
- 海洋与湖沼, 51(5): 1162-1174
- Oceanologia et Limnologia Sinica, 51(5): 1162-1174.
- http://dx.doi.org/10.11693/hyhz20191200253
文章历史
-
收稿日期:2019-12-10
收修改稿日期:2020-02-27
2. 国家海洋局宁波海洋环境监测中心站 宁波 315012
2. Marine Environmental Monitoring Centre of Ningbo, SOA, Ningbo 315012, China
大型底栖动物(Macrozoobenthos)在海洋生态系统能量流动和物质循环中有着重要作用(Brey, 2012; Fuhrmann et al, 2015; Shojaei et al, 2016), 其群落参数被广泛应用于沿海污染和有机积累监测(Han et al, 2013)。大型底栖动物的优势种在群落结构中占据重要地位, 对群落结构和群落环境的形成有明显的控制作用, 与群落的演变密切相关(Santos et al, 1983; Ruiz-Navarro et al, 2019)。优势种的变化反映了底栖群落结构变化及其所处环境的变迁(Fukumori et al, 2008), 海洋大型底栖动物优势种长期演变的研究, 是对海洋生物多样性及生态动力学过程研究的重要补充(蔡文倩等, 2013;彭松耀等, 2017)。
浙江北部海域位于宽阔的东海大陆架, 地形复杂, 岛屿众多, 受到长江冲淡水等沿海径流和台湾暖流等海流的强烈影响(Gong et al, 1996; Ichikawa et al, 2002;王晓波等, 2016)。长江冲淡水是东海沿岸硝酸盐和硅酸盐的主要来源, 冬季沿海岸线南下, 将高营养区限制在123°E以西(Han et al, 2019)。夏季进入汛期, 长江冲淡水通过海水表层向东扩散到东海, 台湾暖流的入侵成为重要的磷酸盐补充来源(Fan et al, 2014)。营养盐的输入促进了该海域饵料生物的大量繁殖与生长, 形成了中国著名的舟山渔场。近年来, 由于浙江沿海区域经济高速发展, 对浙江沿岸水域海洋生态环境产生了较大影响, 浙江北部海域经历了剧烈的人为扰动和环境变化(罗民波, 2008;刘录三等, 2012)。
本研究根据2012—2016年浙江北部海域5个航次的大型底栖动物调查资料, 结合该海域大型底栖动物群落结构及演变的历史资料和已有研究结果, 分析大型底栖动物优势种的时空变化, 旨在为我国近海大型底栖动物群落的演变机理研究提供基础数据和资料。
1 材料方法 1.1 调查区域和时间本研究对近海、内湾和岛屿邻近海域等典型区域和不同生态系统类型进行分区研究。分别于2012年、2013年、2014年、2015年、2016年的8月(共5个航次), 对杭州湾、舟山海域、象山海域和近海共计35个站位进行大型底栖动物的调查工作。站位设置为杭州湾9个, 舟山海域9个, 象山海域12个, 近海5个(图 1)。
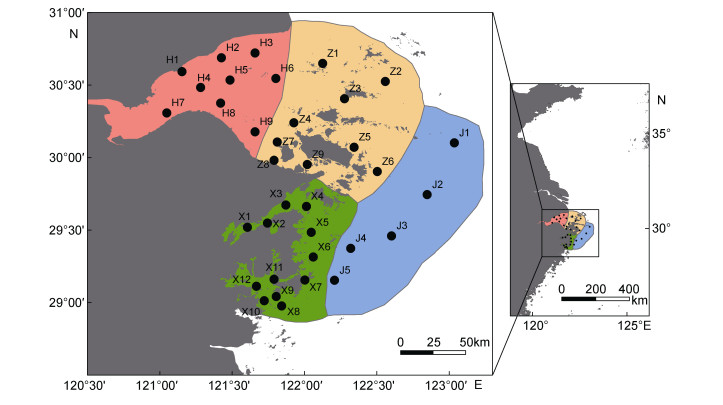 |
| 图 1 2012—2016年间浙江北部海域采样站位分布图 Fig. 1 Location of sampling stations in the sea area off northern Zhejiang Province during 2012—2016 |
采用0.1m2的箱式采泥器进行大型底栖动物样品采集, 成功采样两次计为一个样品, 用0.5mm孔径的筛网进行分选冲洗, 将所得大型底栖动物样品用95%的酒精固定。在实验室用1%的虎红溶液对样品进行染色, 挑选大型底栖动物, 在体视显微镜(型号: SMZ-168 BL; 生产公司: MOTIC CHINA GROUP CO., LTD; 产地:厦门)下对其进行形态学鉴定, 尽量鉴定到种, 对每一物种分别计数, 并采用电子天平(型号: JY3002;生产公司:上海浦春计量仪器有限公司; 产地:上海; 精度: 0.01g)对其湿重进行称量。计数时, 易断的纽形动物和多毛类按头部计数; 称重时, 管栖多毛类动物剥去栖管, 软体动物不去贝壳。计算每个物种的丰度(ind./m2)和生物量(g/m2)。样品的处理、鉴定、称重等均按《海洋调查规范》(GB 12763.6-91)进行。
1.3 数据处理运用优势度计算公式对大型底栖动物优势种进行分析。优势度Y计算公式(徐兆礼等, 1989)如下:
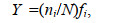 (1)
(1)式中, N为采获样品中所有种类的总个体数, ni为第i种的个体数, fi 为该种出现的站位数与总站位数的比率。当物种优势度Y > 0.02时, 该种即为优势种。
采样站位分布图采用软件ArcGIS Desktop 10.5绘制; 优势度计算、柱形图制作采用Microsoft Excel 2010;优势种的分布图采用Golden software Surfer 16.0制作; 聚类(Cluster)分析和非度量多维尺度分析(nonmetric multidimensional scaling, nMDS)采用生物多元统计软件PRIMER(Plymouth Routines in Multivariate Ecological Research)6.0。
2 结果 2.1 优势种组成2012年至2016年在浙江北部海域共发现优势种29种, 其中多毛类动物13种, 软体动物7种, 甲壳动物2种, 鱼类2种, 纽形动物2种, 棘皮动物2种, 刺胞动物1种。多毛类动物是出现最多的优势种, 占44.83%, 其次是软体动物, 占24.14%。
杭州湾的优势种变化如图 2a所示, 2012年有优势种3种, 分别为软体动物的半褶织纹螺Nassarius sinarus、黑龙江河篮蛤Potamocorbula amurensis和圆筒原盒螺Cylichna biplicata; 2013年的优势种为鱼类的红狼牙鰕虎鱼Odontamblyopus rubicundus和软体动物的黑龙江河篮蛤; 2014年的优势种为多毛类动物的不倒翁虫Sternaspis scutata、棘皮动物的金氏真蛇尾Ophiura kinbergi、纽形动物的纵沟纽虫Lineus sp.和纽虫Nemertea一种; 2015年的优势种为软体动物的半褶织纹螺、光滑河篮蛤Potamocorbula laevis和多毛类动物的西方似蛰虫Amaeana occidentalis、中华内卷齿蚕Aglaophamus sinensis; 2016年优势种仅有软体动物的笋螺Terebra sp.。该海域优势种数量变化明显, 最高的年份(2014年和2015年)有优势种4种, 到2016年优势种仅1种。
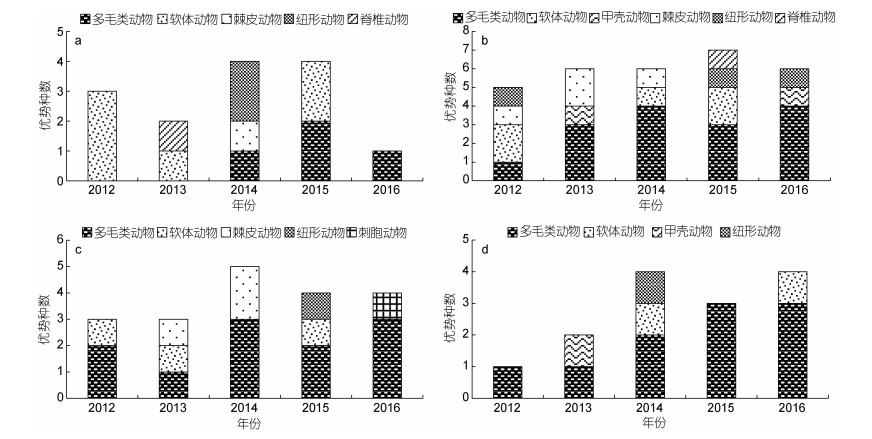 |
| 图 2 2012—2016年浙江北部海域优势种组成 Fig. 2 Composition of dominant species in the sea area off northern Zhejiang Province during 2012—2016 |
近海的优势种在这4个区域中最为丰富, 在2012—2016年的调查中共出现优势种20种, 包含多毛类动物、甲壳动物、棘皮动物、软体动物、鱼类和纽形动物(图 2b)。2012年的优势种有半褶织纹螺、圆筒原盒螺、背蚓虫Notomastus latericeus、金氏真蛇尾和纽虫一种; 2013年的优势种有埃刺梳鳞虫Ehlersileanira incisa、不倒翁虫、异足索沙蚕Kuwaita heteropoda、棘刺锚参Protankyra bidentata、金氏真蛇尾和钩虾Gammaridea一种; 2014年的优势种有不倒翁虫、彩虹明樱蛤Moerella iridescens、棘刺锚参、双鳃内卷齿蚕Aglaophamus dibranchis、双形拟单指虫Cossura dimorpha和异足索沙蚕; 2015年的优势种有彩虹明樱蛤、双鳃内卷齿蚕、双形拟单指虫、细丝鳃虫Aphelochaeta filiformis、圆筒原盒螺、凹鳍孔鰕虎鱼Ctenotrypauchen chinensis和纵沟纽虫; 2016年的优势种有持真节虫Euclymene annandalei、日本鼓虾Alpheus japonicus、双鳃内卷齿蚕、西方似蛰虫、角海蛹Ophelina acuminata和纵沟纽虫。
象山海域的优势种以多毛类动物居多, 每年都至少有一种多毛类动物(图 2c)。2012年的优势种是半褶织纹螺、不倒翁虫和扁蛰虫Loimia medusa; 2013年的优势种是半褶织纹螺、不倒翁虫和金氏真蛇尾; 2014年的优势种是不倒翁虫、双鳃内卷齿蚕、异足索沙蚕、棘刺锚参和金氏真蛇尾; 2015年的优势种是不倒翁虫、双鳃内卷齿蚕、圆筒原盒螺和纽虫一种; 2016年的优势种是不倒翁虫、双鳃内卷齿蚕、西方似蛰虫和海笔Pennatula phosphorea。
舟山海域的优势种分属多毛类动物、软体动物、甲壳动物和纽形动物4个类群(图 2d)。2012年的优势种仅为不倒翁虫1种; 2013年的优势种是不倒翁虫和日本鼓虾; 2014年的优势种是不倒翁虫、纵沟纽虫、豆形胡桃蛤Nucula faba和圆锯齿吻沙蚕Nephtys glabra; 2015年的优势种是不倒翁虫、异足索沙蚕和圆锯齿吻沙蚕; 2016年的优势种是不倒翁虫、西方似蛰虫、双鳃内卷齿蚕和圆筒原盒螺。多毛类优势种的数量逐年增加。可以看出, 在舟山海域, 不倒翁虫在各个调查航次均为群落的优势种。
2.2 优势种的优势度及其分布优势度如表 1所示, 近海、象山海域和舟山海域出现的数据明显多于杭州湾海域, 说明在杭州湾海域, 优势种分布较少。在4个海域中均有分布的优势种有6种, 分别是半褶织纹螺、不倒翁虫、金氏真蛇尾、西方似蛰虫、圆筒原盒螺和中华内卷齿蚕; 仅分布在1个海域中的优势种有光滑河篮蛤、笋螺、角海蛹和黑龙江河篮蛤, 其中除角海蛹分布于近海外, 其余3种都分布于杭州湾。
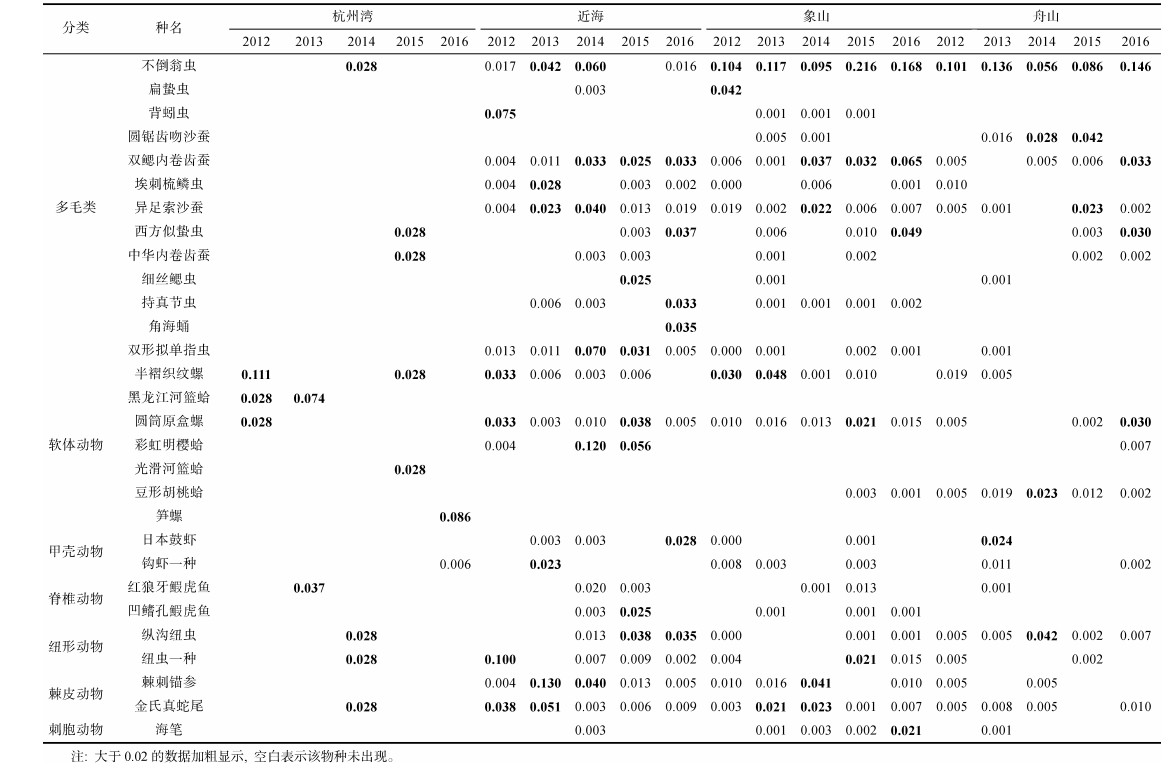
|
优势度最高的物种是不倒翁虫, 在2015年的象山海域、2016年的象山海域、2016年的舟山海域以及2013年的舟山海域, 其优势度分别为0.216、0.168、0.146和0.136, 其次是棘刺锚参, 2013年其在近海的优势度为0.130。优势度超过0.1的物种还有彩虹明樱蛤和半褶织纹螺, 最高优势度分别为0.120 (2014年近海)和0.111 (2012年杭州湾)(表 1)。
不倒翁虫在浙江北部海域分布极广, 其空间分布变化较小, 但丰度变化明显(图 3), 同为多毛类动物的异足索沙蚕, 其空间分布变化较大(图 4)。双鳃内卷齿蚕的分布由2012年的4个站位扩大至2016年的13个站位, 丰度明显增加(图 5)。半褶织纹螺的分布呈现缩小的趋势(图 6), 2016年调查未发现该种。棘刺锚参和彩虹明樱蛤分别在2013年和2014年的近海站位上有极高的丰度(图 7)。
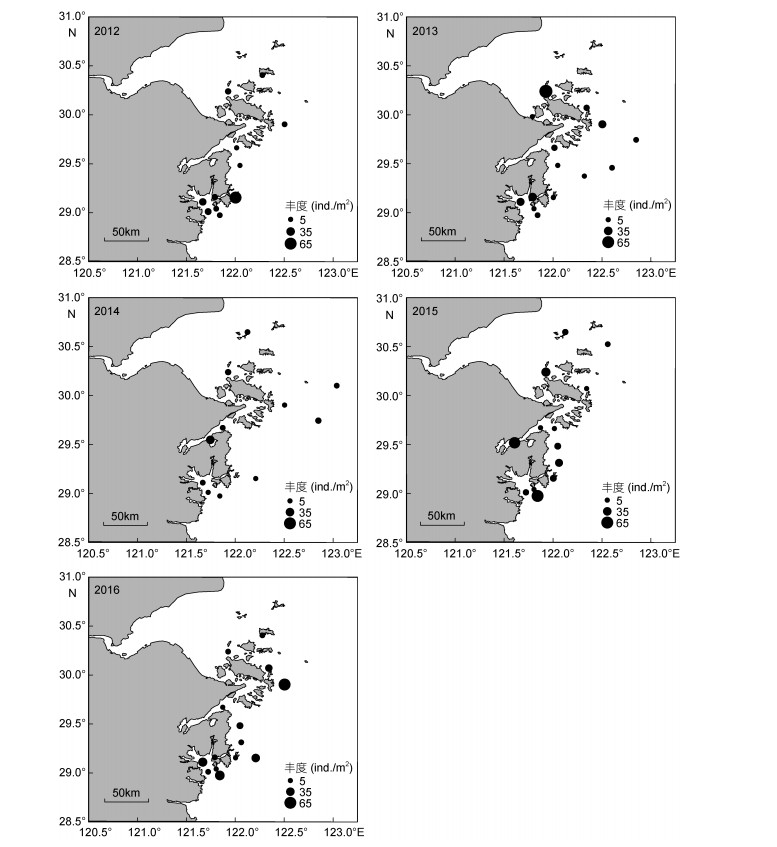 |
| 图 3 不倒翁虫的时空分布 Fig. 3 Spatial and temporal distribution of Sternaspis scutata |
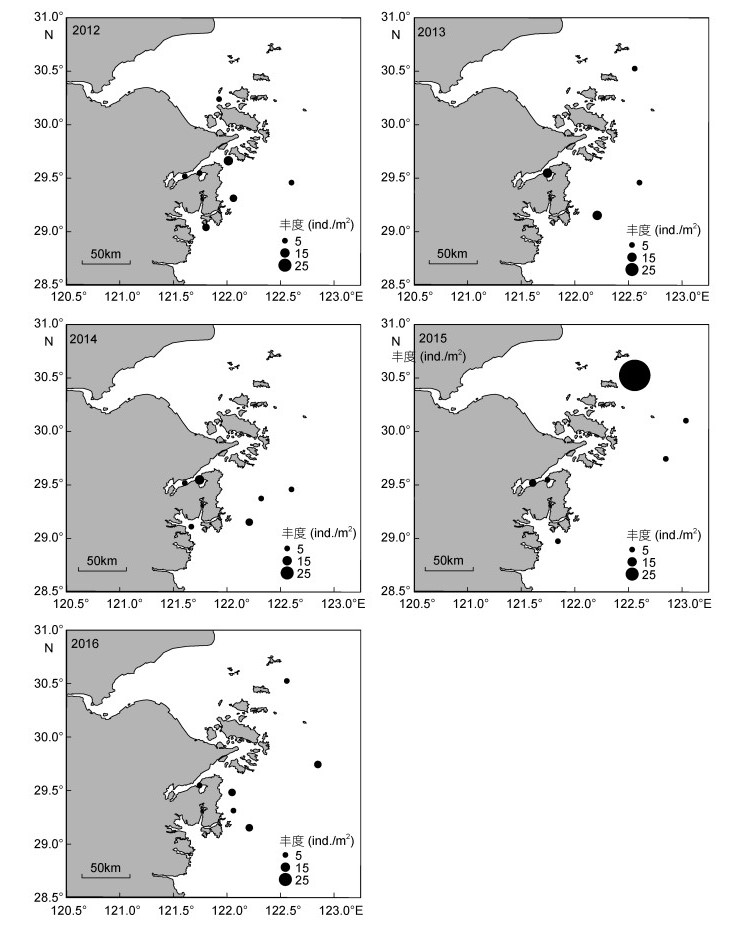 |
| 图 4 异足索沙蚕的时空分布 Fig. 4 Spatial and temporal distribution of Kuwaita heteropoda |
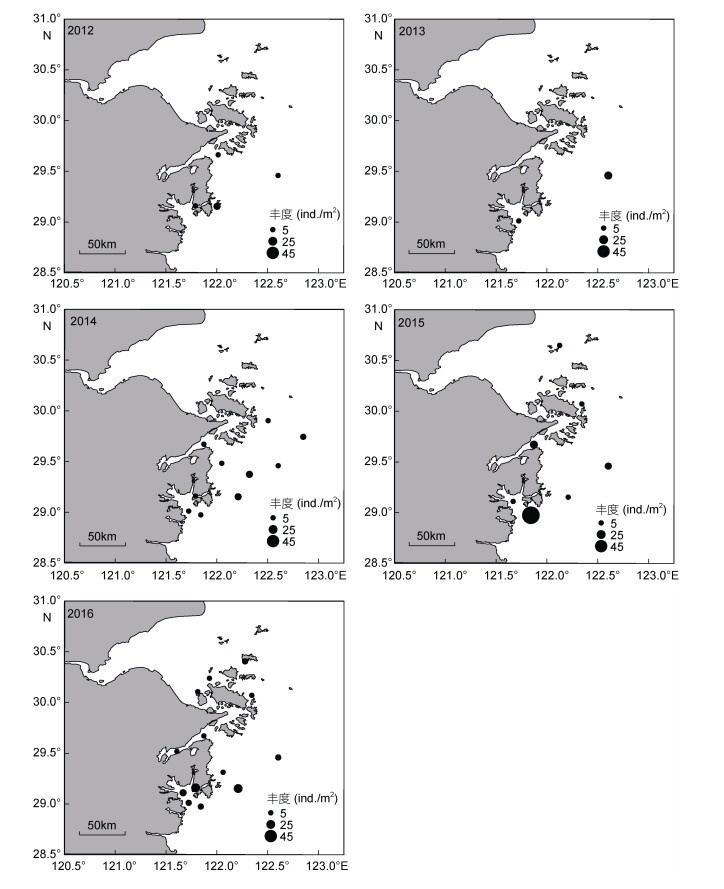 |
| 图 5 双鳃内卷齿蚕的时空分布 Fig. 5 Spatial and temporal distribution of Aglaophamus dibranchis |
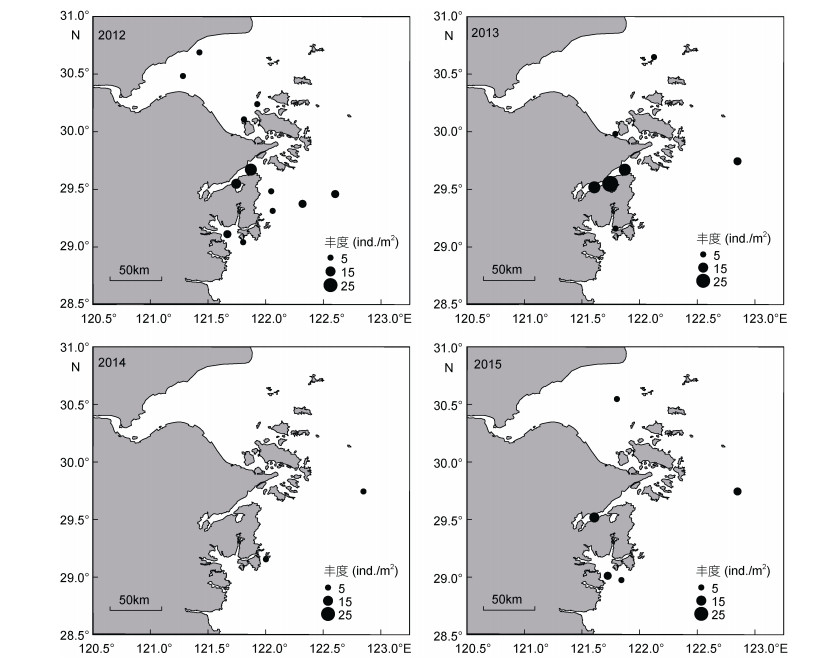 |
| 图 6 半褶织纹螺的时空分布 Fig. 6 Spatial and temporal distribution of Nassarius sinarus |
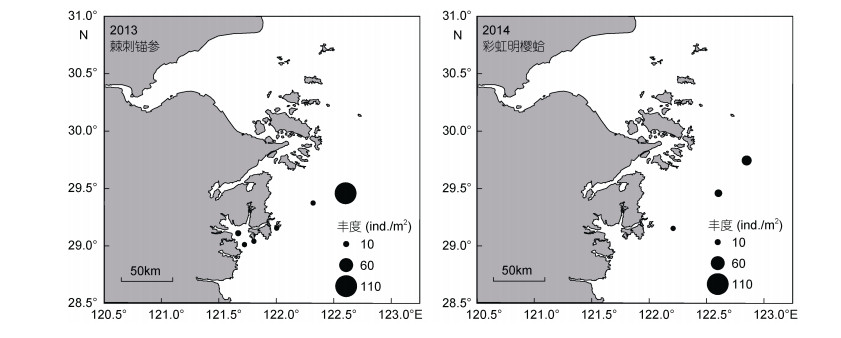 |
| 图 7 棘刺锚参(2013年)和彩虹明樱蛤(2014年)的时空分布 Fig. 7 Spatial distribution of Protankyra bidentata and Moerella iridescens in 2013 and 2014, respectively |
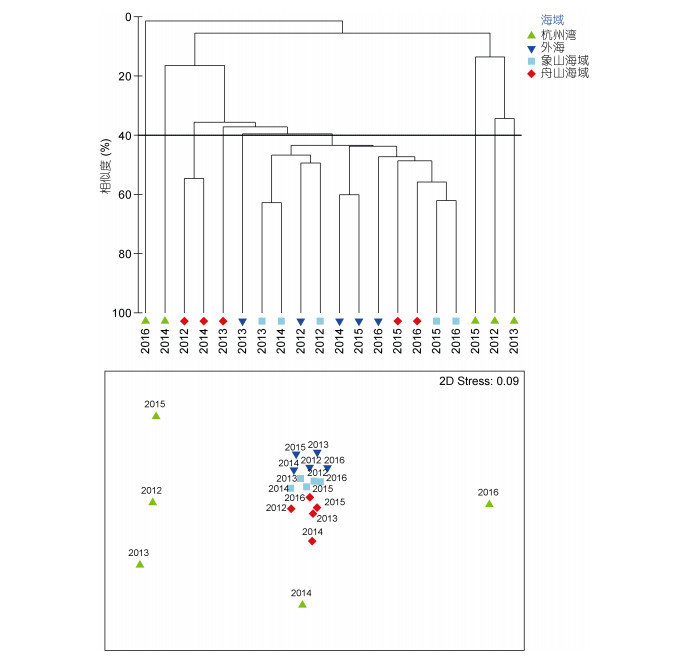
浙江北部海域大型底栖动物丰度数据经过平方根转换和标准化, 转化为Bray-Curtis相似性矩阵, 再进行聚类分析和非度量多维尺度分析, 排序图中压力系数Stress值小于0.2, 可认为图形具有解释意义(周红等, 2003;刘迅等, 2017), 图 8的Stress值为0.09, 分析结果可信。在40%相似度水平下浙江北部海域2012—2016年的大型底栖动物群落可以划分为9个聚类组:杭州湾2012—2016年的大型底栖动物群落在不同年份分别单独为一组, 2012年和2014年的舟山海域大型底栖动物群落一组, 2013年的舟山海域大型底栖动物群落单独一组, 2013年的近海大型底栖动物群落单独一组, 其他大型底栖动物群落一组。
 |
| 图 8 浙江北部海域大型底栖动物聚类分析和非度量多维尺度分析 Fig. 8 Cluster analysis and nMDS analysis of macrozoobenthos in the sea area off northern Zhejiang Province |
本研究中浙江北部海域的优势种主要是多毛类动物, 其次是软体动物, 其他类群优势种较少。与该海域及邻近海域的历史研究相比(表 2), 2003年浙江沿岸(余方平等, 2006)、2005—2006年舟山海区(刘录三等, 2008)和2009年浙江南部近岸海域(贾海波等, 2011)大型底栖动物优势种的组成与本研究比较相近, 均以多毛类动物为主要优势种。1983—1984年浙江北部海域的大型底栖动物优势种主要是软体动物, 多毛类动物优势种仅有不倒翁虫一种(王海明等, 1996)。20世纪80年代初我国的经济发展尚处于起步阶段, 对海洋环境扰动小, 所以浙江北部海域的大型底栖动物优势种有不少体型较大的软体动物。随着经济的快速发展和人类活动的增加, 底栖动物群落受到的扰动越来越大, 到了21世纪初, 优势种以适应力强的多毛类动物(机会种)为主。2003年浙北海区的优势种是甲壳动物的葛氏长臂虾和口虾蛄(胡颢琰等, 2006), 与表 2中的其他文献及本研究出现的优势种差异明显, 原因是该研究使用阿氏拖网采集了大量以游泳类生物为主的大型底上动物。2011年西门岛的大型底栖动物优势种与1983—1984年的浙江北部海域一样都是以软体动物为主(廖一波等, 2013), 多毛类动物等机会种并没有成为优势种, 说明2005年由国家海洋局批准建立的西门岛海洋特别保护区对底栖动物群落的保护卓有成效, 对于浙北海域生物多样性的保护也可以采取设立保护区的方法。
| 海域 | 年份 | 优势种 | 参考文献 |
| 浙江北部海域 | 1983年6月—1984年3月 | 不倒翁虫、白龙骨乐飞螺Lophiotoma leucotropis、薄云母蛤Yoldia similis、凸镜蛤Pelecyora nana、黑龙江河篮蛤、菲律宾蛤仔Ruditapes philippinarum等 | 王海明等, 1996 |
| 杭州湾海区 | 2003年春季 | 光滑河篮蛤 | 胡颢琰等, 2006 |
| 浙北海区 | 2003年春季 | 葛氏长臂虾Palaemon gravieri、口虾蛄Oratosquilla oratoria | 胡颢琰等, 2006 |
| 浙中海区 | 2003年春季 | 小荚蛏Siliqua minima、海仙人掌Cavernularia habereri、沙箸Virgularia sp. | 胡颢琰等, 2006 |
| 浙南海区 | 2003年春季 | 红狼牙鰕虎鱼 | 胡颢琰等, 2006 |
| 浙江沿岸 | 2003年夏季 | 不倒翁虫、背引虫、西方似蛰虫、双鳃内卷齿蚕、西格织纹螺Nassarius siquijorensis、变化柄锚参Oestergrenia variabilis、薄云母蛤、金毛丝鳃虫Protocirrineris chrysoderma | 余方平等, 2006 |
| 杭州湾 | 2005年、2006年 | 星虫Sipunculidae sp. | 刘录三等, 2008 |
| 舟山海域 | 2005年、2006年 | 圆筒原盒螺、不倒翁虫、丝异须虫Heteromastus filiformis、红狼牙鰕虎鱼等 | 刘录三等, 2008 |
| 浙江近海 | 2005年、2006年 | 胶州湾角贝Episiphon kiaochowwanense、东方缝栖蛤Hiatella arctica、小指阳遂足Amphiura digitula、尖叶长手沙蚕Magelona cincta | 刘录三等, 2008 |
| 舟山海域 | 2009年春季 | 双鳃内卷齿蚕、斑角吻沙蚕Goniada maculata、双形拟单指虫等 | 贾海波等, 2011 |
| 浙江西门岛邻近海域 | 2011年春季、秋季 | 春季:河篮蛤属一种Potamocorbula sp.、短拟沼螺Optediceros breviculum和缢蛏Sinonovacula constricta; 秋季:短拟沼螺和河篮蛤属 | 廖一波等, 2013 |
杭州湾的优势种在2012—2016年间几乎每年都有较大的变化。2014年和2016年的优势种与其他年份的优势种都不相同, 2012年与2013年的相同优势种仅为1种。杭州湾受长江、钱塘江冲淡水影响, 又有苏北沿岸流和台湾暖流的作用, 河口环境复杂多变, 潮流急、潮差大、浮泥厚、粉砂底质且底质不稳定, 不利于大型底栖动物群落的稳定(戴国梁, 1991;寿鹿等, 2012;贾海波等, 2014), 这可能是杭州湾大型底栖动物优势种变化大的主要原因。湾内环境极不稳定也导致了大型底栖动物资源的匮乏, 2012—2016年杭州湾9个站位一共只采到了13种生物, 每年至多采到4种生物, 2013年仅采到2种生物。
近海的大型底栖动物种类丰富, 5个站位5年间出现优势种20种, 且连续两年出现的优势种种数仅占该海域优势种总种数的40%, 一定程度上也反应出该海域群落结构的变化之快。2012年的优势种中软体动物有半褶织纹螺和圆筒原盒螺, 是优势种的主要成分, 多毛类动物仅有背蚓虫。到了5年后的2016年, 多毛类优势种出现3种, 分别是持真节虫、双鳃内卷齿蚕和西方似蛰虫, 未出现任何软体动物优势种, 多毛类已取代软体动物成为群落结构中的主要成分, 说明近海的底栖生境发生了较大的变化。
象山海域大型底栖动物优势种始终以多毛类动物为主, 优势种变化较小, 其中不倒翁虫占绝对优势地位, 5年间始终保持优势度最高。不倒翁虫以底泥中有机物质为食, 具有适应性强和耐污染等特点, 是转化外源性化学物质的重要物种(齐爱民, 2015), 其优势地位反应出该海域底质有机质含量高的特点, 象山县大量海水养殖产业产生的残饵及养殖生物代谢物可能是有机质的重要来源(Yokoyama, 2002)。
舟山海域的情况与象山海域相似, 不倒翁虫为绝对优势种, 不同之处是舟山海域的多毛类动物优势种逐年增加。多毛类动物大多为小型种, 生命周期短, 繁殖快, 对有机污染适应力强(Belan, 2003; Gusmao et al, 2016; van der Linden et al, 2017), 多毛类优势种的增加可能是因为舟山海域长江长期输入以及养殖区生产造成的底质有机质积累。底层鱼类锐减也会导致多毛类动物的增加(Zhou et al, 2007), 舟山海域一直是我国重要的渔场, 长期的过度捕捞造成鱼类资源量锐减, 且难以在短期内恢复。
综上, 浙江北部海域大型底栖动物优势种变化在时间角度上以多毛类动物优势种的增加为主要特征, 不同区域的情况又有所区别。多毛类动物优势种的增加是该海域有机扰动愈发严重的重要证据。
3.2 浙江北部海域大型底栖动物优势种时空变化2012—2016年, 以不倒翁虫和双鳃内卷齿蚕为代表的多毛类动物在象山海域、近海和舟山海域的丰度有增加的趋势(图 3, 5), 这3个海域的多毛类动物在群落中的重要性增加。根据聚类分析结果, 近海、象山海域和舟山海域大型底栖动物群落在2015年以后都被分在一个聚类组中, 不同海域(杭州湾除外)大型底栖动物群落结构随时间的推移越来越接近(图 8)。该结果和浙江北部海域的多毛类动物的时空分布变化相对应, 表现出优势种和整个群落变化的联系, 体现优势种对群落结构的控制。大型底栖动物的分布与底质环境关系极为密切(吴耀泉, 1983;王金宝等, 2006), 其分布变化能在一定程度上反应海洋底质环境的变迁。多毛类动物中相当多的种类为悬浮食性(Fauchald et al, 1979; Jumars et al, 2015), 往往适宜在以粉砂-黏土为主、有机物含量丰富的海域生活(王金宝等, 2006), 据此可推测, 象山海域、近海和舟山海域的底质可能发生了相应的变化。异足索沙蚕在AMBI (AZTI’s Marine Biotic Index)生态组(Ecological Group, EG)分类中属于EG II, 即干扰不敏感种(disturbance-indifferent species), 对有机物过度累积并不敏感, 但是过量的有机物还是会影响其生存(Borja et al, 2005, 2011)。浙江北部海域接受长江输入的大量有机物, 长江有机物输入在不同年份有着较大的差异(邢建伟等, 2014), 这可能是异足索沙蚕分布变化的主要原因。
2012—2016年间分布变化最明显的优势种为半褶织纹螺: 2012年其分布极广, 在浙江北部4个海域都有出现, 2013年分布范围开始缩小, 2016年完全消失。半褶织纹螺是一种有毒的中小型软体动物(郑典元, 2006), 肉食性, 喜生活在礁石附近和泥沙底。半褶织纹螺的分布范围明显缩小, 可能有以下原因:一、半褶织纹螺以水生动物的尸体为食, 鱼类等大型动物的减少可能会引起其食物短缺; 二、人类的捕捞行为会对半褶织纹螺种群产生一定影响; 三、海洋底质环境发生变化, 使其难以适应。因为织纹螺属(Nassarius)容易积累毒性而引发不少中毒事件, 卫生部下发了禁止销售织纹螺的公告, 捕捞半褶织纹螺往往是使用拖网时误捕, 所以影响半褶织纹螺分布的主要原因可能是底质环境的改变, 这与多毛类动物的分布变化互相印证。底质环境是海洋环境的重要组成部分, 其变化的具体情况以及成因和影响值得深入研究。
3.3 浙江北部海域食物网与营养级生态系统中错综复杂的食物联系形成食物网, 能量通过食物网转化为各营养层次生物生产力, 形成生态系统生物资源, 并对生态系统的服务、产出及其动态产生影响(徐超等, 2019)。因此, 食物网及其营养动力学过程是海洋生态系统动力学研究的重要内容, 进而为研究海域生物资源优势种的交替机制提供理论依据(唐启升, 1999)。从食物网的角度分析优势种的变化, 发现高营养级的优势种分布范围缩小, 优势地位被低营养级的物种所取代(以肉食性的半褶织纹螺的优势地位被悬浮食性的多毛类所取代为代表), 浙江北部海域的食物网营养级整体下降。一般认为, 复杂的食物网相对简单食物网更加稳定, 对扰动的抵抗力更强。营养级的下降意味着食物链缩短、食物网结构趋向简单, 这会导致生态系统变得脆弱敏感, 加剧扰动对生态系统的破坏, 使之失去恢复能力(Ryder et al, 1981)。
浙江北部海域生产力高, 有着极其丰富的生物资源, 是我国重要的渔业生产基地, 复杂的食物网和稳定的生态系统是渔获的基础。水生生物营养级下降是生物资源衰退、食物网结构简化的表现, 不利于我国近海渔业的可持续发展。深入研究食物网结构, 合理利用渔业资源, 加强生态监测, 对保护渔业生产力以及生物多样性具有重要意义。
4 结论2012—2016年在浙江北部海域进行大型底栖动物调查, 共发现优势种29种, 包括13种多毛类动物, 7种软体动物, 2种甲壳动物, 2种鱼类, 2种纽形动物, 2种棘皮动物和1种刺胞动物。不倒翁虫在该海域占据明显的优势地位, 最高优势度达0.216(2015年象山海域), 其他优势度超过0.1的物种有棘刺锚参(2013年近海, 优势度为0.130)、彩虹明樱蛤(2014年近海, 优势度为0.120)和半褶织纹螺(2012年杭州湾, 优势度为0.111)。多毛类动物的优势种分布范围扩大, 丰度增加; 肉食性的半褶织纹螺分布范围缩小。
大型底栖动物优势种的变化总体上以多毛类动物优势种比例的增加为主要特征, 不同区域的情况又有所区别:杭州湾出现的优势种最少, 每年优势种的分布变化大; 近海优势种种类丰富, 更替快; 象山海域的优势种较单调, 始终以多毛类动物为主; 舟山海域的多毛类动物优势种逐年增加。结合历史资料, 发现多毛类取代软体动物成为浙江北部海域的主要优势种。作为环境耐受种和群落初级演替先锋种, 多毛类动物优势种的大量出现及优势种小型化可能与浙江北部海域的有机质积累和底质环境改变有关, 并导致大型底栖动物群落结构稳定性的降低及底栖食物网营养特征改变, 是浙江北部海域生态环境恶化的表征。
王金宝, 李新正, 王洪法. 2006. 胶州湾多毛类环节动物优势种的生态特点. 动物学报, 52(1): 63-69 |
王晓波, 江河, 李伯康, 等. 2016. 浙江渔山列岛海域大型底栖动物群落组成和结构研究. 海洋通报, 35(6): 666-673 |
王海明, 蔡如星, 曾地刚, 等. 1996. 浙北潮下带(0~-5m)大型底栖生物生态. 东海海洋, 14(4): 67-77 |
邢建伟, 线薇薇, 沈志良, 等. 2014. 秋季长江口水体颗粒有机碳年际变化及影响因素分析. 海洋与湖沼, 45(5): 964-972 |
刘迅, 王莉, 顾晓英, 等. 2017. 浙江檀头山岛周围海域夏、秋季大型底栖动物群落结构特征. 海洋与湖沼, 48(3): 553-567 |
刘录三, 郑丙辉, 李宝泉, 等. 2012. 长江口大型底栖动物群落的演变过程及原因探讨. 海洋学报, 34(3): 134-145 |
刘录三, 孟伟, 田自强, 等. 2008. 长江口及毗邻海域大型底栖动物的空间分布与历史演变. 生态学报, 28(7): 3027-3034 |
齐爱民, 2015.不倒翁虫CYP4基因克隆及在黄渤海不同PAHs污染海域的响应表达.大连海洋大学硕士学位论文, 6-9
|
寿鹿, 曾江宁, 廖一波, 等. 2012. 杭州湾大型底栖动物季节分布及环境相关性分析. 海洋学报, 34(6): 151-159 |
吴耀泉. 1983. 关于浅海底栖动物的生态分布和底质环境关系的概述. 海洋科学, 7(6): 58-61 |
余方平, 王伟定, 金海卫, 等. 2006. 2003年夏季浙江沿岸大型底栖生物生态分布特征. 上海水产大学学报, 15(1): 59-64 |
罗民波, 2008.长江河口底栖动物群落对大型工程的响应与生态修复研究.上海: 华东师范大学博士学位论文, 112-113
|
周红, 张志南. 2003. 大型多元统计软件PRIMER的方法原理及其在底栖群落生态学中的应用. 青岛海洋大学学报, 33(1): 58-64 |
郑典元. 2006. 不同海滩栖息地半褶织纹螺毒力调查. 中国公共卫生, 22(10): 1262-1262 |
胡颢琰, 唐静亮, 李秋里, 等. 2006. 浙江省近岸海域底栖生物生态研究. 海洋学研究, 24(3): 76-89 |
贾海波, 胡颢琰, 唐静亮, 等. 2011. 陆源有机污染对舟山海域大型底栖生物分布的影响. 中国环境监测, 27(5): 65-69 |
贾海波, 唐静亮, 胡颢琰. 2014. 1992-2012杭州湾海域生物多样性的变化趋势及原因分析. 海洋学报, 36(12): 111-118 |
徐超, 王思凯, 赵峰, 等. 2019. 长江口水生动物食物网营养结构及其变化. 水生生物学报, 43(1): 155-164 |
徐兆礼, 陈亚瞿. 1989. 东黄海秋季浮游动物优势种聚集强度与鲐鲹渔场的关系. 生态学杂志, 8(4): 13-15 |
唐启升. 1999. 海洋食物网与高营养层次营养动力学研究策略. 海洋水产研究, 20(2): 1-6 |
彭松耀, 李新正, 徐勇, 等. 2017. 十年间黄海大型底栖动物优势种的变化. 海洋与湖沼, 48(3): 536-542 |
蔡文倩, 孟伟, 刘录三, 等. 2013. 渤海湾大型底栖动物群落优势种长期变化研究. 环境科学学报, 33(8): 2332-2340 |
廖一波, 寿鹿, 曾江宁, 等. 2013. 浙江西门岛海洋特别保护区大型底栖动物功能群特征及其与环境的关系. 生物多样性, 21(1): 3-10 |
戴国梁. 1991. 长江口及其邻近水域底栖动物生态特点. 水产学报, 15(2): 104-116 |
Belan T A, 2003. Benthos abundance pattern and species composition in conditions of pollution in Amursky Bay (the Peter the Great Bay, the Sea of Japan). Marine Pollution Bulletin, 46(9): 1111-1119 DOI:10.1016/S0025-326X(03)00242-X |
Borja A, Muxika I, 2005. Guidelines for the use of AMBI (AZTI's Marine Biotic Index) in the assessment of the benthic ecological quality. Marine Pollution Bulletin, 50(7): 787-789 DOI:10.1016/j.marpolbul.2005.04.040 |
Borja A, Tunberg B G, 2011. Assessing benthic health in stressed subtropical estuaries, eastern Florida, USA using AMBI and M-AMBI. Ecological Indicators, 11(2): 295-303 DOI:10.1016/j.ecolind.2010.05.007 |
Brey T, 2012. A multi-parameter artificial neural network model to estimate macrobenthic invertebrate productivity and production. Limnology and Oceanography:Methods, 10: 581-589 DOI:10.4319/lom.2012.10.581 |
Fan W, Song J B, 2014. A numerical study of the seasonal variations of nutrients in the Changjiang River estuary and its adjacent sea area. Ecological Modelling, 291: 69-81 DOI:10.1016/j.ecolmodel.2014.07.026 |
Fauchald K, Jumars P A, 1979. The diet of worms:a study of polychaete feeding guilds. Oceanography and Marine Biology Annual Review, 17: 193-284 |
Fuhrmann M M, Pedersen T, Ramasco V et al, 2015. Macrobenthic biomass and production in a heterogenic subarctic fjord after invasion by the red king crab. Journal of Sea Research, 106: 1-13 DOI:10.1016/j.seares.2015.09.003 |
Fukumori K, Oi M, Doi H et al, 2008. Bivalve tissue as a carbon and nitrogen isotope baseline indicator in coastal ecosystems. Estuarine, Coastal and Shelf Science, 79(1): 45-50 DOI:10.1016/j.ecss.2008.03.004 |
Gong G C, Chen Y L L, Liu K K, 1996. Chemical hydrography and chlorophyll a distribution in the East China Sea in summer:implications in nutrient dynamics. Continental Shelf Research, 16(12): 1561-1590 DOI:10.1016/0278-4343(96)00005-2 |
Gusmao J B, Brauko K M, Eriksson B K et al, 2016. Functional diversity of macrobenthic assemblages decreases in response to sewage discharges. Ecological indicators, 66: 65-75 DOI:10.1016/j.ecolind.2016.01.003 |
Han Q X, Wang X B, 2019. Macrobenthic biomass and secondary production in the northern East China Sea and the relative importance of environmental variables. Pacific Science, 73(2): 249-259 |
Han Q X, Wang Y Q, Zhang Y et al, 2013. Effects of intensive scallop mariculture on macrobenthic assemblages in Sishili Bay, the northern Yellow Sea of China. Hydrobiologia, 718(1): 1-15 DOI:10.1007/s10750-013-1590-x |
Ichikawa H, Beardsley R C, 2002. The current system in the Yellow and East China Seas. Journal of Oceanography, 58(1): 77-92 DOI:10.1023/A:1015876701363 |
Jumars P A, Dorgan K M, Lindsay S M, 2015. Diet of worms emended:an update of polychaete feeding guilds. Annual Review of Marine Science, 7: 497-520 DOI:10.1146/annurev-marine-010814-020007 |
Ruiz-Navarro A, Fernández V, Abadía J et al, 2019. Foliar fertilization of two dominant species in a semiarid ecosystem improves their ecophysiological status and the use efficiency of a water pulse. Environmental and Experimental Botany, 167: 103854 DOI:10.1016/j.envexpbot.2019.103854 |
Ryder R A, Kerr S R, Taylor W W et al, 1981. Community consequences of fish stock diversity. Canadian Journal of Fisheries and Aquatic Sciences, 38(12): 1856-1866 DOI:10.1139/f81-231 |
Santos S L, Bloom S A, 1983. Evaluation of succession in an estuarine macrobenthic soft-bottom community near Tampa, Florida. Internationale Revue der gesamten Hydrobiologie und Hydrographie, 68(5): 617-632 DOI:10.1002/iroh.3510680503 |
Shojaei M G, Gutow L, Dannheim J et al, 2016. Common trends in German Bight benthic macrofaunal communities:Assessing temporal variability and the relative importance of environmental variables. Journal of Sea Research, 107: 25-33 DOI:10.1016/j.seares.2015.11.002 |
van der Linden P, Marchini A, Smith C J et al, 2017. Functional changes in polychaete and mollusc communities in two tropical estuaries. Estuarine, Coastal and Shelf Science, 187: 62-73 DOI:10.1016/j.ecss.2016.12.019 |
Yokoyama H, 2002. Impact of fish and pearl farming on the benthic environments in Gokasho Bay:evaluation from seasonal fluctuations of the macrobenthos. Fisheries Science, 68(2): 258-268 |
Zhou H, Zhang Z N, Liu X S et al, 2007. Changes in the shelf macrobenthic community over large temporal and spatial scales in the Bohai Sea, China. Journal of Marine Systems, 67(3-4): 312-321 DOI:10.1016/j.jmarsys.2006.04.018 |
 2020, Vol. 51
2020, Vol. 51


