中国海洋湖沼学会主办。
文章信息
- 孙娇, 聂力, 苗亮, 陈炯. 2020.
- SUN Jiao, NIE Li, MIAO Liang, CHEN Jiong. 2020.
- 香鱼(Plecoglossus altivelis)脾脏酪氨酸激酶SYK的鉴定及其介导的MAPK信号通路研究
- MOLECULAR CHARACTERIZATION OF A SYK HOMOLOGUE FROM AYU, PLECOGLOSSUS ALTIVELIS: INSIGHTS INTO ITS CONSERVED ROLE IN MAPK SIGNALING ACTIVATION
- 海洋与湖沼, 51(5): 1182-1193
- Oceanologia et Limnologia Sinica, 51(5): 1182-1193.
- http://dx.doi.org/10.11693/hyhz20191200249
文章历史
-
收稿日期:2019-12-04
收修改稿日期:2020-01-19
2. 宁波大学海洋学院 应用海洋生物技术教育部重点实验室 宁波 315832
2. Key Laboratory of Applied Marine Biotechnology of Ministry of Education, Ningbo University, Ningbo 315832, China
固有免疫是抵抗病原体入侵的第一道防线(Lemaitre et al, 1996)。宿主通过免疫反应来阻止病原体的感染与复制, 并将病原彻底清除。这种反应的前提是固有免疫系统的模式识别受体(pattern recognition receptor, PRR)识别病原相关分子模式(pathogen associated molecule patterns, PAMPs), 发生受体配体反应, 从而诱导产生一系列相关的细胞因子来介导宿主的抗病原机制(Uematsu et al, 2006)。
酪氨酸激酶蛋白(protein tyrosine kinase, PTK)是一类具有酪氨酸激酶活性的蛋白质, 它们能催化蛋白质的酪氨酸残基使其发生磷酸化反应, PTK包括受体型和非受体型两种(Huang et al, 2005)。脾脏酪氨酸激酶(SYK)是一种非受体型酪氨酸激酶(non-receptor tyrosine kinase, NRTK), 它与ZAP-70关系最近, 同属SYK家族(Bolen et al, 1997)。来自细胞外的信号通过SYK到达细胞质从而介导一连串信号转导过程(Berton et al, 2005)。SYK含有N端的两个SH2结构域和一个C端激酶结构域(Wong, 2005)。免疫受体信号需要SYK的激酶活性以及两个SH2结构域进行传导。SYK的激酶结构域在蛋白质的静息状态下是不活跃的, 但是可以通过将两个SH2结构域结合到双磷酸化的ITAM上而被激活(Mócsai et al, 2010)。
研究表明, SYK在信号转导过程中至关重要。在B细胞信号转导中, SYK被激活后进一步激活鸟嘌呤核苷交换因子(guanine nucleotide exchangefactor, GEF), GEF激活Ras和Rac, 经促分裂素原活化蛋白激酶(mitogen-activatedproteinkinases, MAPK)途径激活相关基因(Buhl et al, 1997)。在T细胞信号转导中, SYK可与磷酸化ITAM结合, 进而启动下游pre-T细胞受体信号转导(Palacios et al, 2007)。在Fc信号转导中, SYK参与了FcεRI介导的Ca2+内流和分泌、细胞因子产生、脱粒等代谢过程(Zhang et al, 1996)。整合素是一个异二聚体跨膜受体家族, 参与白细胞粘附和迁移等, 在缺乏SYK的中性粒细胞(Attila et al, 2006)、单核细胞、巨噬细胞(Vines et al, 2001)、血小板(Obergfell et al, 2002)和破骨细胞(Zou et al, 2008)中, 整合素介导的信号转导受到抑制。同时, SYK还调控了病原体活化的先天免疫信号通路。在真菌识别方面, Dectin-1与β-葡聚糖结合后促使SYK活化, 随后MAPK、NF-κβ发生磷酸化被激活, 并促进TNF-α、IL-6、IL-10等炎症细胞因子的分泌, 增强抗真菌免疫能力(Drummond et al, 2011)。除此之外, SYK还可以识别组织损伤, 研究发现CLEC9A与SYK偶联后能够识别细胞损伤相关分子并介导下游信号转导(Sancho et al, 2009)。
相比于在哺乳动物中较深透的研究, SYK在硬骨鱼中的功能研究相对较少较浅。虽然在石斑鱼(Epinephelus coioides)(Mo et al, 2016)、尼罗罗非鱼(Oreochromis niloticus)(Bian et al, 2018)等硬骨鱼中有所报道, 但是研究均集中在对该蛋白的生物信息学分析、不同应激条件下组织表达水平的研究, 而对其信号通路方面的研究, 特别是硬骨鱼类SYK是否也能像哺乳动物一样激活MAPK信号通路的研究几乎未有涉及。
香鱼(Plecoglossus altivelis)是东亚地区重要的经济鱼类(史雨红等, 2017)。在香鱼养殖产业中, 由鳗弧菌(Vibrio anguillarum)引起的细菌性疾病是造成损失的主要原因(Lu et al, 2016)。考虑到SYK在免疫应答中的关键作用, 研究香鱼SYK(PaSYK)的结构功能和活化的信号通路对后续的免疫防治至关重要。本研究分析了香鱼SYK基因的序列特征及其进化地位; 研究了不同健康组织及鳗弧菌感染后免疫组织中PaSYK基因mRNA的表达变化; 采用激光共聚焦技术确定了PaSYK的亚细胞定位; 除此之外, 研究了PaSYK对MAPK信号通路的活化作用及对炎症细胞因子表达的影响, 从而分析其在进化过程中功能的保守性。
1 材料与方法 1.1 实验用香鱼本研究使用的香鱼(Plecoglossus altivelis)购自浙江省宁波市宁海县某渔场, 选择体重40-50g的健康鱼。实验前在20-22℃的循环水系统中暂喂养两周。所有实验均按照中国实验动物管理法进行, 并经宁波大学动物伦理委员会批准。
1.2 PaSYK基因cDNA序列测定及分析提取香鱼健康组织的RNA并反转录获得cDNA。从香鱼头肾单核/巨噬细胞(Monocyte/macrophage, MO/MΦ)的转录组数据获得PaSYK序列。使用Primer 5.0软件设计特异性引物(SYK F1/R1, 表 1), 以获得的cDNA为模板扩增其开放阅读框(ORF), 然后进行克隆和测序。PCR反应体系如下: cDNA 1μL, 上下游引物各1μL, dNTP (2.5mmol) 3.5μL, 10 × La Buffer 2.5μL, La Taq 0.25μL, ddH2O 15.75μL。PCR程序如下:预变性94℃ 2min; 变性94℃ 30s, 退火56℃ 30s, 延伸72℃ 2min, 30个循环; 延伸72℃ 10min。使用BioEdit软件将克隆的SYK蛋白质序列与GenBank数据库进行比对。使用ProtParam在线分析其分子量和等电点。使用Clustal W软件对PaSYK进行多重序列比对和同源性分析。使用MEGA 6.0软件以邻接法(NJ)制作分子系统进化树。本研究中使用的序列如表 2所示。
| 引物 | 基因名称 | 核苷酸序列(5′—3′) | 扩增长度(bp) |
| SYK F1 | PaSYK | ATGGCTGACAAAGTAAACA | 1857 |
| SYK R1 | CGCTGAGCTATATCATAGTAATAATCTCTC | ||
| SYK F2 | PaSYK | ATGCGCGGCCGCAATGGCTGACAAAGTAAACA | 1857 |
| SYK R2 | ATGCGCGATCGCCTGAGCTATATCATAGTAATAATCTCTC | ||
| SYK F3 | PaSYK | CGGAATTCGCCACCATGGCTGACAAAGTAAACA | 1857 |
| SYK R3 | CGGGATCCCGCTGAGCTATATCATAGTAATAATCTCTC | ||
| SYK qRT F | PaSYK | GCTGGTGTGTCTACTGAAAAAG | 259 |
| SYK qRT R | TCTGAGCCACGCCTACAAAGTG | ||
| TNF-α qRT F | PaTNF-α | ACATGGGAGCTGTGTTCCTC | 115 |
| TNF-α qRT R | GCAAACACACCGAAAAAGGT | ||
| IL-1β qRT F | PaIL-1β | TACCGGTTGGTACATCAGCA | 104 |
| IL-1β qRT R | TGACGGTAAAGTTGGTGCAA | ||
| TGF-β qRT F | PaTGF-β | CTGGAATGCCGAGAACAAAT | 88 |
| TGF-β qRT R | GATCCAGAACCTGAGGGACA | ||
| IL-10 qRT F | PaIL-10 | TGCTGGTGGTGCTGTTTATGTGT | 73 |
| IL-10 qRT R | AAGGAGCAGCAGCGGTCAGAA | ||
| 18S rRNA qRT F | Pa18S rRNA | GAATGTCTGCCCTATCAACT | 103 |
| 18S rRNA qRT R | GATGTGGTAGCCGTTTCT |
| 登录号 | 物种 | 蛋白 | |
| 拉丁名 | 英文名 | ||
| MN599065 | Plecoglossus altivelis | ayu | SYK |
| XP_020474432.1 | Monopterus albus | swamp eel | SYK |
| XP_022600342.1 | Seriola dumerili | greater amberjack | SYK |
| XP_019937198.1 | Paralichthys olivaceus | Japanese flounder | SYK |
| XP_010749830.1 | Larimichthys crocea | large yellow croaker | SYK |
| XP_026195406.1 | Anabas testudineus | climbing perch | SYK |
| XP_004564629.1 | Maylandia zebra | zebra mbuna | SYK |
| XP_005449474.1 | Oreochromis niloticus | Nile tilapia | SYK |
| XP_023142075.1 | Amphiprion ocellaris | clown anemonefish | SYK |
| XP_023816381.1 | Oryzias latipes | Japanese medaka | SYK |
| XP_021457254.1 | Oncorhynchus mykiss | rainbow trout | SYK |
| XP_020313159.1 | Oncorhynchus kisutch | coho salmon | SYK |
| XP_024237245.1 | Oncorhynchus tshawytscha | chinook salmon | SYK |
| XP_029566306.1 | Salmo trutta | river trout | SYK |
| NP_001167144.1 | Salmo salar | Atlantic salmon | SYK |
| XP_018600403.1 | Scleropages formosus | Asian bonytongue | SYK |
| XP_005155595.1 | Danio rerio | zebrafish | SYK |
| XP_018937248.1 | Cyprinus carpio | common carp | SYK |
| XP_022521290.1 | Astyanax mexicanus | Mexican tetra | SYK |
| XP_026864836.1 | Electrophorus electricus | electric eel | SYK |
| XP_026798309.1 | Pangasianodon hypophthalmus | striped catfish | SYK |
| NP_035648.2 | Mus musculus | mouse | SYK |
| NP_001032542.1 | Bos taurus | cattle | SYK |
| NP_003168.2 | Homo sapiens | human | SYK |
| NP_001086665.1 | Xenopus laevis | African clawed frog | SYK |
| XP_002937073.2 | Xenopus tropicalis | tropical clawed frog | SYK |
| XP_028604765.1 | Podarcis muralis | common wall lizard | SYK |
| XP_025044887.1 | Pelodiscus sinensis | Chinese softshell turtle | SYK |
利用Primer 5.0软件分别设计真核表达引物(SYK F2/R2)及荧光载体引物(SYK F3/R3), PCR扩增获得相应片段。将获得的片段分别利用Not I/SfaA I以及EcoR I/BamH I进行双酶切, 克隆至真核表达载体pcDNA3.1-flag及绿色荧光载体pEGFP-N1上, 构建真核表达质粒及荧光表达质粒。构建的所有质粒均经测序验证。使用EZNA™质粒Midi试剂盒(Omega Bio-Tek, 美国)制备用于转染的无内毒素质粒。
1.4 鳗弧菌感染与组织收集鳗弧菌培养方法参考文献(Zhang et al, 2018)。简述如下:把鳗弧菌接种到营养肉汤培养基中, 28℃恒温摇床过夜培养; 按照1︰100的比例继续扩大培养, 在对数生长阶段收集菌体后用无菌的PBS洗涤、计数, 并用PBS将菌体稀释至最适浓度。感染组的每只香鱼腹腔注射100μL含有1.2×104 colony forming units (CFUs)鳗弧菌的PBS, 对照组的香鱼注射等量的PBS。在感染后4、8、12、24和48hpi (hours post infection)收集香鱼的鳃、脾、头肾、肝和肠进行RNA提取。此外, 收集肠、脾、肝、鳃、头肾和皮肤等健康组织提取RNA并进行组织表达分析。
1.5 实时荧光定量PCR(RT-qPCR)RT-qPCR方法参考文献(Chen et al, 2016)。简述如下:香鱼组织或细胞的总RNA抽提采用RNAiso试剂(TaKaRa, 大连), 反转录成cDNA放在-20℃冰箱备用。以上述cDNA为模板, 采用SYBR预混料Ex Taq DNA聚合酶(TaKaRa, 大连)利用ABI Stepone RT-qPCR系统(Applied Biosystems, 美国)进行RT-qPCR反应(引物见表 1)。PCR反应条件如下: 95℃ 30s, 60℃ 20s, 72℃ 30s, 共40个扩增循环; 随后进行熔解曲线94℃ 30s, 72℃ 30s, 94℃ 30s。采取2-ΔΔCt的方法计算基因的相对表达, 以Pa18S rRNA作为标准化的内参。每组实验至少重复三次。
1.6 香鱼头肾单核/巨噬细胞培养收集健康香鱼的头肾, 洗涤和研磨后利用Ficoll (Invitrogen, 上海)密度梯度离心[(1.077±0.001)g/mL]获得头肾白细胞富集组分, 按照2×107/mL的浓度将细胞接种到35mm培养皿中(Corning, 美国), 在含5% CO2的培养箱中24℃过夜培养。去除未贴壁细胞, 贴壁细胞在完全培养基[RPMI 1640 (Invitrogen, 上海); 5% (V/V) FBS (Gibco, Life Technologies, 美国); 5% (V/V)香鱼血清; 青霉素(100U/mL)和链霉素(100μg/mL)]中继续培养。HEK293T细胞在含有10% (V/V) FBS、青霉素和链霉素的DMEM (Invitrogen, 上海)的培养基中, 在37℃含5% CO2的培养箱中培养。
1.7 瞬时细胞转染HEK293T细胞和香鱼头肾MO/MΦ按照1×105/mL的浓度接种到6孔板(Corning, 美国)中, 细胞融合到70%-90%后使用Lipofectamine 3000 (Invitrogen, 上海)转染试剂将真核表达或绿色荧光载体转染进细胞中。
1.8 亚细胞定位HEK293T细胞接种在6孔板中的圆形盖玻片上。细胞培养12h后, 转染pEGFP-PaSYK重组质粒。连续培育36h, 用PBS洗涤细胞两次, 并在4% (V/V)多聚甲醛中固定15min。PBS洗涤两次, 用Dil (Beyotime, 中国)染细胞膜10min, PBS洗两次, DAPI (Sigma, 美国)染核5min。在激光共聚焦显微镜(Zeiss LSM710 NLO, Carl Zeiss, 美国)下观察细胞荧光图像。
1.9 炎症细胞因子mRNA表达测定将pcDNA3.1-PaSYK重组质粒转染至香鱼头肾MO/MΦ, 转染pcDNA3.1-flag空白质粒作为对照。分别在24、36和48hpt (hours post transfection)时收集细胞, RT-qPCR检测炎症细胞因子TNF-α、IL-1β、TGF-β和IL-10的mRNA表达。每组实验至少重复三次。
1.10 Western blot分析将pcDNA3.1-PaSYK重组质粒转染至HEK293T细胞和香鱼头肾MO/MΦ中, 转染pcDNA3.1-flag空白质粒作为对照。在6、12、24和48hpt时收集细胞, 加入100μL蛋白裂解液提取总蛋白, 使用Bradford法测定蛋白质浓度。取15μL蛋白样品进行SDS-PAGE电泳, 并将蛋白转移至PVDF膜上(甲醇活化); 将PVDF膜置于含5%脱脂奶粉(W/V)的TBST中室温封闭1h, 一抗孵育过夜。TBST溶液洗膜3次, 每次15min; 二抗采用山羊抗兔IgG-HRP, 室温孵育1.5h, TBST溶液洗膜3次, 每次15min。利用ECL发光液进行显色。用到的一抗为兔抗phospho-p38 MAPK (Thr180/Tyr182)、兔抗p38 MAPK、兔抗phospho-JNK1/2 (Thr183/Tyr185)、兔抗JNK1/2、兔抗phospho-p44/42 MAPK (ERK1/2)(Thr202/Tyr204)和兔抗P44/42 MAPK (ERK1/2)(Cell Signaling Technology, 上海)。
1.11 数据分析实验结果表示为平均值±标准误(mean±SEM), 采用SPSS 13.0软件中的单因素方差分析(One-way ANOVA)进行统计, *P < 0.05和**P < 0.01被认为具有统计学意义。
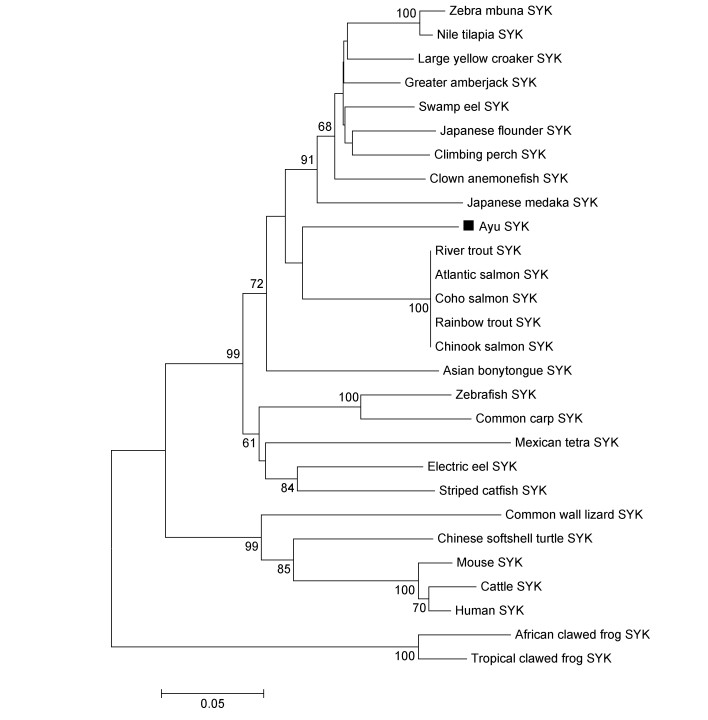
2 结果 2.1 PaSYK基因cDNA序列测定及分析PaSYK的ORF长度为1857bp, 编码的蛋白质含有618个氨基酸。该蛋白质的分子量(MW)为70.78kDa, 等电点(pI)为8.27。PaSYK由两个N端的SH2结构域和一个C末端的激酶结构域组成。多重序列比对结果表明SYK的蛋白质序列和结构域在进化过程中是高度保守的, PaSYK与河鳟SYK氨基酸序列相似度最高(82%)(图 1)。系统进化树分析显示, 所有鱼类的SYK归为一簇, 哺乳类、两栖类和爬行类各为一簇, PaSYK与河鳟的SYK进化关系最为密切(图 2)。
在健康香鱼的肠、脾、肝、鳃、头肾和皮肤中均检测到PaSYK的mRNA表达, PaSYK在皮肤中的表达量最高, 随后依次为头肾、鳃、肝、脾、肠(图 3a)。腹腔感染鳗弧菌后, 在所有检测的组织中PaSYK的mRNA表达均以时间依赖性方式显著上调。其中, 鳃组织中的PaSYK表达量在4hpi时上调, 24hpi时表达最高。在脾脏中, 8hpi时PaSYK表达上调, 12hpi时表达最高, 24hpi时其表达下降并恢复至正常水平。在头肾中, 8hpi时PaSYK表达上调, 并随着感染的持续表达量逐渐增加。在肝脏中, PaSYK表达在8hpi时上调至最高, 然后逐渐降低至对照值水平。在24hpi时, 肠中的PaSYK表达上调最高(图 3b-f)。
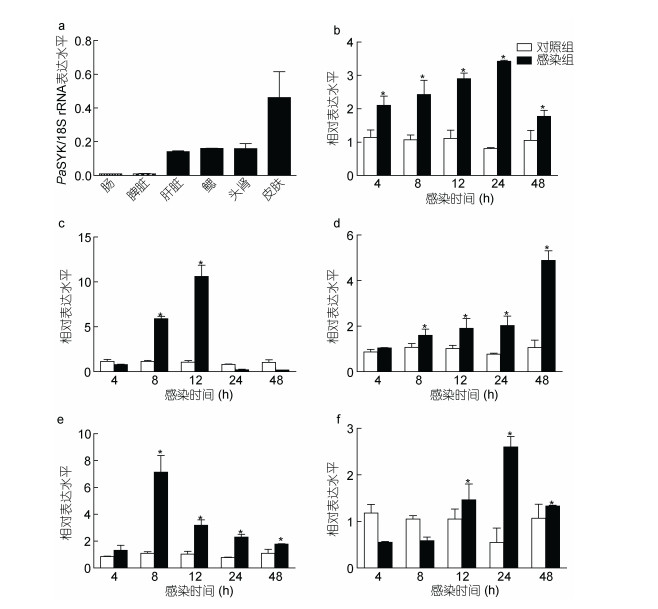 |
| 图 3 健康香鱼组织和鳗弧菌感染后免疫组织中PaSYK表达模式 Fig. 3 The expression patterns of PaSYK in healthy ayu tissues and immune tissues after V. anguillarum infection 注: a.不同健康的香鱼组织(肠、脾、肝、鳃、头肾和皮肤)PaSYK对18S rRNA的相对表达。相对表达以三次重复的平均值计算, 每个重复包括三个香鱼样本。b—f.鳗弧菌感染前后PaSYK基因mRNA的表达差异。PBS注射组为对照组, 4h PBS注射组的mRNA水平正常化为1。数据是三次重复结果的平均值±SEM。*P < 0.05, **P < 0.01 |
HEK293T细胞转染荧光载体pEGFP-PaSYK, 激光共聚焦显微镜下观察PaSYK的亚细胞定位(图 4)。结果显示PaSYK主要分布在细胞质中, 少量分布在细胞膜上, 与DAPI(细胞核指示剂)无共定位信号。
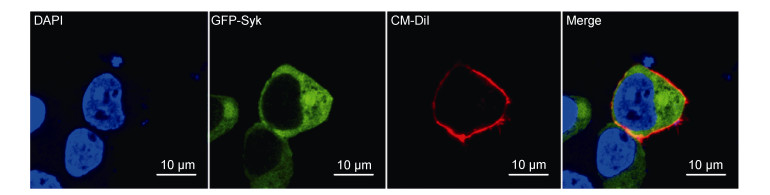 |
| 图 4 PaSYK亚细胞定位 Fig. 4 Subcellular localization of PaSYK 注:比例尺为10μm, 原始放大倍数×640 |
炎症是机体受到病原体破坏或入侵时炎症细胞被激活, 并分泌多种炎症细胞因子的保护反应。促炎因子TNF-α、IL-1β以及抑炎因子TGF-β、IL-10是巨噬细胞分泌的重要炎症因子。研究TNF-α、IL-1β、TGF-β和IL-10的mRNA表达水平, 旨在探讨PaSYK对机体炎症反应的调控作用。结果显示, 在香鱼头肾MO/MΦ中, PaSYK过表达后会显著诱导TNF-α和IL-1β的表达, 对抑炎因子的表达没有起促进作用甚至有略微的抑制(图 5a-d)。
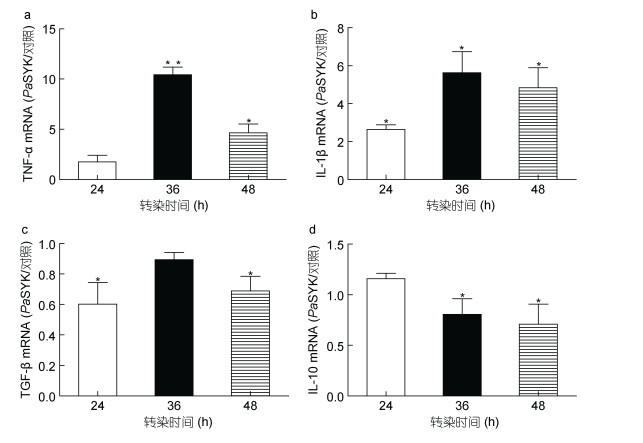 |
| 图 5 PaSYK影响炎症细胞因子mRNA表达 Fig. 5 The cytokine mRNA expression affected by PaSYK 注:数值为平均值±SEM; *P < 0.05, **P < 0.01 |
我们进一步研究了SYK活化的信号通路是否在进化过程中具有保守性。MAPK信号通路是哺乳动物SYK激活的经典信号通路。我们分别在HEK293T细胞及香鱼头肾MO/MΦ中转染SYK以研究三条典型的MAPK信号通路p38 MAPK、ERK1/2 MAPK和JNK1/2 MAPK的活化情况。结果显示, 在HEK293T细胞和香鱼头肾MO/MΦ中过表达PaSYK后均能检测到三种MAP激酶的磷酸化, 代表相应的MAPK信号通路被激活。在HEK293T细胞中, 12hpt时p38的磷酸化水平上升, 在24hpt时到达最大值, 随后磷酸化水平降低(图 6a)。ERK1/2的磷酸化在12hpt达到最大值, 随后逐渐降低(图 6b)。JNK1/2的磷酸化水平也在12hpt时呈现上升趋势, 在36hpt达到最大值后降低(图 6c)。香鱼头肾MO/MΦ在静息状态下能观察到JNK1/2磷酸化, 但在一个相对较低的水平(图 6f)。过表达PaSYK后, p38和ERK1/2的磷酸化在12hpt时升高, 24hpt达到最大值, 随后逐渐降低(图 6d-e)。JNK1/2的磷酸化也在12hpt时显著升高, 24hpt达到最大值, 随后维持相似的活化程度(图 6f)。
 |
| 图 6 PaSYK激活MAPK信号 Fig. 6 Activation of MAPK signaling by PaSYK 注: HEK293T细胞(a, b, c)和香鱼头肾MO/MΦ(d, e, f)用pcDNA3.1-PaSYK或空白质粒转染。柱状图显示了磷酸化p38、ERK1/2和JNK1/2与其相应的总蛋白(磷酸化和非磷酸化)的相对带强度的变化。数值为平均值±SEM; *P < 0.05, **P < 0.01 |
脾脏酪氨酸激酶SYK在免疫信号转导中起着关键的作用。本研究从分子、蛋白质和细胞水平对香鱼SYK进行了分析, 结果表明香鱼SYK参与了鳗弧菌感染的免疫反应, 并能诱导炎症细胞因子的表达和激活MAPK信号通路。
本研究通过香鱼头肾MO/MΦ转录组测序结果获得SYK基因的cDNA序列。多重序列比对分析表明, PaSYK具有典型的SYK结构特征, PaSYK包含两个N端的SH2结构域和一个C端的激酶结构域, 这与以往关于人(Law et al, 1994)、七鳃鳗(Liu et al, 2015)、石斑鱼(Mo et al, 2016)、尼罗罗非鱼(Bian et al, 2018)等其他物种的报道一致。系统进化树分析表明, 哺乳动物、鸟类、两栖类和鱼类的SYK分别成簇, PaSYK位于鱼类SYK这一个大簇, 且与河鳟SYK进化关系最近。
SYK基因最开始是由Taniguchi等(1991)从猪脾cDNA中克隆出来。SYK在人类的造血细胞中的表达量最高(Yanagi et al, 2001)。最初认为SYK只在造血细胞中表达, 后来研究发现SYK在乳腺上皮细胞(Coopman et al, 2000)、气道上皮细胞(Wang et al, 2005)、鼻成纤维细胞(Yamada et al, 2001)、血管内皮细胞(Crowley et al, 1997)、神经样细胞(Tsujimura et al, 2001)、肝细胞(Tsuchida et al, 2000)及黑色素细胞(Hoeller et al, 2005)等非造血细胞中也有广泛表达。
在七鳃鳗中, SYK在神经上髓样体和白细胞中表达最高(Liu et al, 2015)。在石斑鱼中, SYK的mRNA表达广泛, 其中在肝脏和免疫器官(包括脾脏和肾脏)中高表达(Mo et al, 2016), 尼罗罗非鱼与其结果相似(Bian et al, 2018)。本研究中, PaSYK的mRNA在皮肤中的表达量最高, 随后依次为头肾、鳃、肝、脾、肠。此外, 鳗弧菌感染后鳃、脾、头肾、肝和肠免疫组织PaSYK基因mRNA表达量均呈现上调趋势。
炎症是一种病理过程, 病原体作用于机体后, 不仅会引发细胞的损坏, 也会使系统抗病能力提高, 从而到达清除病原体, 修复受损细胞的作用。在炎症反应中, 细胞能产生炎症细胞因子来抵抗外界的侵袭, TNF-α、IL-1β、TGF-β和IL-10是巨噬细胞分泌的重要炎症因子。本研究结果表明, 将SYK基因转染到香鱼MO/MΦ中, 促炎因子TNF-α和IL-1β的mRNA表达显著上调, 而抑炎因子TGF-β和IL-10的mRNA表达却受到略微的抑制。PaSYK能够显著诱导促炎因子TNF-α和IL-1β的表达, 说明机体受到病原体入侵时, SYK能够参与香鱼头肾MO/MΦ的炎症反应。
细胞对外界变化做出的反应是通过一连串胞内信号转导来传导的, 信号通路整合各种信号, 通过基因和生理的改变来应对外界刺激。MAPK被激活后会参与细胞增殖、分化及凋亡的调节, 并与炎症、肿瘤等多种疾病的发生密切相关(Takada et al, 2004)。Ras作为一种GTP酶, 是MAPK磷酸化级联反应的主要调节分子。Ras-Raf-MAPK信号级联是人和哺乳动物细胞中主要的信号转导系统。有研究表明, 肥大细胞的FcεRI受体与抗原结合后, 依赖SYK衔接蛋白Shc磷酸化, 从而激活Ras-Raf-MAPK级联(Jabril-Cuenod et al, 1996)。为了探究香鱼SYK是否也能像哺乳动物那样激活MAPK信号通路, 本研究将SYK转染到HEK293T细胞和香鱼头肾MO/MΦ中, Western blot的结果表示, PaSYK过度表达后三种传统的MAP激酶均被激活, 说明PaSYK可以激活MAPK信号, 其在进化过程中高度保守。
4 结论本研究从香鱼中克隆得到SYK基因, 通过蛋白序列分析发现, 在SYK存在典型的两个连接的SH2结构域和一个激酶结构域。通过表达分析发现, PaSYK的表达会受到鳗弧菌感染的影响。亚细胞定位分析发现, PaSYK分布于细胞质中, 细胞膜上也有少量的分布。RT-qPCR结果分析发现, PaSYK的过表达会促进促炎因子的表达并且抑制抑炎因子的表达。Western blot结果证明, PaSYK与其哺乳动物中的同源物一样, 能够活化MAPK信号通路, 说明了其在进化过程中, 结构及功能的保守性。
史雨红, 马海玲, 梁亚芳, 等. 2017. PaCLR介导PaLECT2激活脂多糖刺激的香鱼(Plecoglossus altivelis)单核巨噬细胞功能. 海洋与湖沼, 48(3): 583-588 |
Berton G, Mócsai A, Lowell C A, 2005. Src and Syk kinases:key regulators of phagocytic cell activation. Trends in Immunology, 26(4): 208-214 DOI:10.1016/j.it.2005.02.002 |
Bian X, Wu L T, Mu L L et al, 2018. Spleen tyrosine kinase from Nile tilapia (Oreochromis niloticus):Molecular characterization, expression pattern upon bacterial infection and the potential role in BCR signaling and inflammatory response. Fish & Shellfish Immunology, 82: 162-172 |
Bolen J B, Brugge J S, 1997. Leukocyte protein tyrosine kinases:potential targets for drug discovery. Annual Review of Immunology, 15: 371-404 DOI:10.1146/annurev.immunol.15.1.371 |
Buhl A M, Cambier J C, 1997. Co-receptor and accessory regulation of B-cell antigen receptor signal transduction. Immunological Reviews, 160(1): 127-138 |
Chen J, Chen Q, Lu X J et al, 2016. The protection effect of LEAP-2 on the mudskipper (Boleophthalmus pectinirostris) against Edwardsiella tarda infection is associated with its immunomodulatory activity on monocytes/macrophages. Fish & Shellfish Immunology, 59: 66-76 |
Coopman P J P, Do M T H, Barth M et al, 2000. The Syk tyrosine kinase suppresses malignant growth of human breast cancer cells. Nature, 406(6797): 742-747 DOI:10.1038/35021086 |
Crowley M T, Costello P S, Fitzer-Attas C J et al, 1997. A critical role for Syk in signal transduction and phagocytosis mediated by Fcγ receptors on macrophages. Journal of Experimental Medicine, 186(7): 1027-1039 DOI:10.1084/jem.186.7.1027 |
Drummond R A, Saijo S, Iwakura Y et al, 2011. The role of Syk/CARD9 coupled C-type lectins in antifungal immunity. European Journal of Immunology, 41(2): 276-281 |
Hoeller C, Thallinger C, Pratscher B et al, 2005. The non-receptor-associated tyrosine kinase Syk is a regulator of metastatic behavior in human melanoma cells. Journal of Investigative Dermatology, 124(6): 1293-1299 DOI:10.1111/j.0022-202X.2005.23685.x |
Huang W L, Zhu X F, 2005. Signal Transduction. Beijing: People's Medical Publishing House, 151-199
|
Jabril-Cuenod B, Zhang C, Scharenberg A M et al, 1996. Syk-dependent Phosphorylation of Shc. A potential link between FcεRI and the Ras/mitogen-activated protein kinase signaling pathway through SOS and Grb2. Journal of Biological Chemistry, 271(27): 16268-16272 |
Law C L, Sidorenko S P, Chandran K A et al, 1994. Molecular cloning of human Syk. A B cell protein-tyrosine kinase associated with the surface immunoglobulin M-B cell receptor complex. Journal of Biological Chemistry, 269(16): 12310-12319 |
Lemaitre B, Nicolas E, Michaut L et al, 1996. The dorsoventral regulatory gene cassette spätzle/Toll/cactus controls the potent antifungal response in Drosophila adults. Cell, 86(6): 973-983 DOI:10.1016/S0092-8674(00)80172-5 |
Liu C, Su P, Li R R et al, 2015. Molecular cloning, expression pattern, and molecular evolution of the spleen tyrosine kinase in lamprey, Lampetra japonica. Development Genes and Evolution, 225(2): 113-120 DOI:10.1007/s00427-015-0492-5 |
Lu X J, Chen Q, Rong Y J et al, 2016. Mobilisation and dysfunction of haematopoietic stem/progenitor cells after Listonella anguillarum infection in ayu, Plecoglossus altivelis. Scientific Reports, 6: 28082 DOI:10.1038/srep28082 |
Mócsai A, Abram C L, Jakus Z et al, 2006. Integrin signaling in neutrophils and macrophages uses adaptors containing immunoreceptor tyrosine-based activation motifs. Nature Immunology, 7(12): 1326-1333 DOI:10.1038/ni1407 |
Mócsai A, Ruland J, Tybulewicz V L J, 2010. The SYK tyrosine kinase:a crucial player in diverse biological functions. Nature Reviews Immunology, 10(6): 387-402 DOI:10.1038/nri2765 |
Mo Z Q, Yang M, Wang H Q et al, 2016. Grouper (Epinephelus coioides) BCR signaling pathway was involved in response against Cryptocaryon irritans infection. Fish & Shellfish Immunology, 57: 198-205 |
Obergfell A, Eto K, Mocsai A et al, 2002. Coordinate interactions of Csk, Src, and Syk kinases with αIIbβ3 initiate integrin signaling to the cytoskeleton. The Journal of Cell Biology, 157(2): 265-275 DOI:10.1083/jcb.200112113 |
Palacios E H, Weiss A, 2007. Distinct roles for Syk and ZAP-70 during early thymocyte development. Journal of Experimental Medicine, 204(7): 1703-1715 DOI:10.1084/jem.20070405 |
Sancho D, Joffre O P, Keller A M et al, 2009. Identification of a dendritic cell receptor that couples sensing of necrosis to immunity. Nature, 458(7240): 899-903 DOI:10.1038/nature07750 |
Takada Y, Aggarwal B B, 2004. TNF activates Syk protein tyrosine kinase leading to TNF-induced MAPK activation, NF-κB activation, and apoptosis. The Journal of Immunology, 173(2): 1066-1077 DOI:10.4049/jimmunol.173.2.1066 |
Taniguchi T, Kobayashi T, Kondo J et al, 1991. Molecular cloning of a porcine gene Syk that encodes a 72-kDa protein-tyrosine kinase showing high susceptibility to proteolysis. Journal of Biological Chemistry, 266(24): 15790-15796 |
Tsuchida S, Yanagi S, Inatome R et al, 2000. Purification of a 72-kDa protein-tyrosine kinase from rat liver and its identification as Syk:involvement of Syk in signaling events of hepatocytes. The Journal of Biochemistry, 127(2): 321-327 |
Tsujimura T, Yanagi S, Inatome R et al, 2001. Syk protein-tyrosine kinase is involved in neuron-like differentiation of embryonal carcinoma P19 cells. FEBS Letters, 489(2-3): 129-133 DOI:10.1016/S0014-5793(01)02097-X |
Uematsu S, Akira S, 2006. PRRs in pathogen recognition. Central European Journal of Biology, 1(3): 299-313 |
Wang G R, Guo X X, Floros J, 2005. Differences in the translation efficiency and mRNA stability mediated by 5'-UTR splice variants of human SP-A1 and SP-A2 genes. American Journal of Physiology-Lung Cellular and Molecular Physiology, 289(3): L497-L508 DOI:10.1152/ajplung.00100.2005 |
Vines C M, Potter J W, Xu Y et al, 2001. Inhibition of β2 integrin receptor and SYK kinase signaling in monocytes by the Src family kinase Fgr. Immunity, 15(4): 507-519 DOI:10.1016/S1074-7613(01)00221-7 |
Wong W S F, 2005. Inhibitors of the tyrosine kinase signaling cascade for asthma. Current Opinion in Pharmacology, 5(3): 264-271 DOI:10.1016/j.coph.2005.01.009 |
Yamada T, Fujieda S, Yanagi S et al, 2001. Protein-tyrosine kinase Syk expressed in human nasal fibroblasts and its effect on RANTES production. The Journal of Immunology, 166(1): 538-543 DOI:10.4049/jimmunol.166.1.538 |
Yanagi S, Inatome R, Takano T et al, 2001. Syk expression and novel function in a wide variety of tissues. Biochemical and Biophysical Research Communications, 288(3): 495-498 DOI:10.1006/bbrc.2001.5788 |
Zhang J, Berenstein E H, Evans R L et al, 1996. Transfection of Syk protein tyrosine kinase reconstitutes high affinity IgE receptor-mediated degranulation in a Syk-negative variant of rat basophilic leukemia RBL-2H3 cells. Journal of Experimental Medicine, 184(1): 71-79 DOI:10.1084/jem.184.1.71 |
Zhang L, Nie L, Cai SY et al, 2018. Role of a macrophage receptor with collagenous structure (MARCO) in regulating monocyte/macrophage functions in ayu, Plecoglossus altivelis. Fish & Shellfish Immunology, 74: 141-151 |
Zou W, Reeve J L, Liu Y L et al, 2008. DAP12 couples c-Fms activation to the osteoclast cytoskeleton by recruitment of Syk. Molecular Cell, 31(3): 422-431 DOI:10.1016/j.molcel.2008.06.023 |
 2020, Vol. 51
2020, Vol. 51