中国海洋湖沼学会主办。
文章信息
- 李海昆, 刘洋, 李春华, 王永旺, 于瑞海. 2020.
- LI Hai-Kun, LIU Yang, LI Chun-Hua, WANG Yong-Wang, YU Rui-Hai. 2020.
- 6-DMAP诱导黄河口近江牡蛎(Crassostrea ariakensis)三倍体的研究
- STUDY ON 6-DMAP INDUCED TRIPLOID OF CRASSOSTREA ARIAKENSIS FROM HUANGHE RIVER ESTUARY
- 海洋与湖沼, 51(5): 1194-1202
- Oceanologia et Limnologia Sinica, 51(5): 1194-1202.
- http://dx.doi.org/10.11693/hyhz20191200259
文章历史
-
收稿日期:2019-12-14
收修改稿日期:2020-03-10
自1981年首次报道用细胞松弛素B(CB)成功诱导美洲牡蛎(Crassostrea virginica)的三倍体以来, 牡蛎的多倍体育种就成为了牡蛎育种的重要研究方向(Stanley et al, 1981)。三倍体牡蛎育性差, 在繁殖季节不会因繁殖活动导致软体部消瘦, 因而可以全年保持较好的品质(Allen et al, 1986a; Nell, 2002);三倍体牡蛎在最适的生存条件下要比二倍体牡蛎生长快, 且在繁殖季节死亡率低(Piferrer et al, 2009; Dégremont et al, 2012; Peachey et al, 2016);此外, 三倍体的不育性还可避免基因污染, 具有一定的生态优势(Piferrer et al, 2009; Peachey et al, 2016)。这些有益的生态价值和经济价值, 使三倍体牡蛎深受国内外养殖者的欢迎, 其养殖产量在世界牡蛎养殖产量的占比不断提高(Peachey et al, 2016)。目前获得三倍体牡蛎的方法有两种, 一种是通过物理方法(Allen et al, 1986b)或者化学方法(Downing et al, 1987; Gérard et al, 1999)诱导获得, 另一种是用四倍体和二倍体杂交获得100%的全三倍体(Guo et al, 1994, 1996)。获得全三倍体牡蛎的关键是四倍体的获得, 而四倍体诱导离不开三倍体牡蛎(Guo et al, 1994), 因此三倍体牡蛎的高效诱导是牡蛎多倍体育种的前提。目前, 国内学者已经利用不同方法对我国常见的几种巨牡蛎属牡蛎开展了三倍体的研究, 包括长牡蛎(C. gigas)(于瑞海等, 2000;王康, 2014)、近江牡蛎(王康, 2014)、香港牡蛎(C. hongkongensis)(秦艳平等, 2017)、熊本牡蛎(C. sikamea)(武祥伟等, 2019)。
近江牡蛎主要分布于太平洋西海岸的河口区, 由于其具有生长快、抗病性强的特点, 曾被美国考虑作为一个新的养殖对象引进(Calvo et al, 2001; Yoon et al, 2008)。近江牡蛎在我国的南北方均有分布, 是我国自然分布的几种比较重要的巨牡蛎属牡蛎之一(张跃环等, 2014)。目前国内关于近江牡蛎的育种研究主要集中于杂交育种上, 关于近江牡蛎的多倍体育种的研究较少。
三倍体近江牡蛎具有生长快、存活率高、抗病性强的特点(Calvo et al, 2001), 开展近江牡蛎的三倍体的诱导研究对开展近江牡蛎的三倍体育种, 进一步提高我国养殖牡蛎的质量具有重要意义。早在2008年, 杨春玲等(2008)就已经进行了6-DMAP诱导近江牡蛎三倍体的研究, 但是当时的“近江牡蛎(C. rivularis)”还没有与香港牡蛎完全区分开, 实验中所用的近江牡蛎可能混有香港牡蛎(Lam et al, 2003; Wang et al, 2004;王海艳等, 2007), 且研究评估6-DMAP诱导效果的指标单一, 研究内容不够完善。本实验中, 近江牡蛎取自东营市黄河三角洲地区河口区域, 具有个体较大、壳厚重的特点(Xiao et al, 2010), 为真正意义上的北方近江牡蛎; 使用的诱导药物为Desrosiers等(1993)提出的毒害作用较小的6-DMAP。本次研究从诱导浓度、起始诱导时间、诱导持续时间三个水平探究6-DMAP对近江牡蛎的诱导效果, 并结合卵裂率、孵化率、三倍体率和诱导后诱导组幼虫的生长率、存活率、三倍体率变化情况6个评估指标, 建立了6-DMAP诱导近江牡蛎三倍体的方法, 为黄河口近江牡蛎的多倍体育种提供理论依据。
1 材料与方法 1.1 亲贝暂养近江牡蛎亲贝采自东营市黄河三角洲, 4—5龄, 挑选无损伤、左壳凹凸明显的个体作为实验亲贝。2019年5月1日运至莱州市长渔水产有限公司育苗车间进行暂养, 暂养期间投喂新月菱形藻(Nitzschia closterium)和亚心形扁藻(Platymonas subcordiformis), 每天移池换水一次。5月底性腺同步成熟进行实验。
1.2 解剖获取精卵、受精解剖亲贝后, 用牙签挑破性腺, 蘸取性腺滴于载玻片的水滴上, 若呈烟雾状为雄性个体, 若呈颗粒状则为雌性个体。在显微镜下观察每个个体的卵子质量以及精子活力。选择卵子梨形或卵圆形、卵颜色较深的个体作为母本, 卵液先用200目的筛绢过滤较大的杂质, 然后用500目的筛绢洗卵3次, 最后将洗好的卵置于过滤海水(温度25℃, 盐度29)中促熟30min; 选择精子活力较强的个体作为父本, 精液用200目的筛绢过滤。受精前检查卵子是否污染, 受精时保证每个卵子周围6—10个精子。
1.3 6-DMAP的诱导处理所有的诱导实验均在3L的塑料桶中进行, 诱导密度为3.0×107个/mL, 温度均为25℃; 参考Desrosiers等(1993)、Gèrard等(1999)、秦艳平等(2017)对6-DMAP的使用, 设计诱导浓度、诱导时机、诱导持续时间3个因素, 每个因素设计4个水平, 每组实验均重复3次。
1.3.1 诱导浓度实验受精后将受精卵平均分成4份, 受精后18min将四份受精卵分别在150、300、450和600μmol/L的6-DMAP中诱导处理15min。
1.3.2 诱导时机实验受精后将受精卵平均分成4份, 分别在受精后10、14、18和22min用浓度实验中获得最佳诱导浓度进行诱导, 诱导持续15min。
1.3.3 诱导持续时间实验受精后将受精卵平均分成4份, 采用诱导浓度实验、诱导时机实验中获得最佳诱导条件进行诱导, 分别持续诱导10、15、20和25min。
诱导结束后用500目筛绢洗受精卵3次, 之后将受精卵转移至60L的塑料桶中进行孵化, 孵化过程中连续充气, 并每间隔2h搅动一次小桶, 避免受精卵下沉。受精2h后取样测量各组的卵裂率。24h后测量各组的孵化率, 并将孵化获得的一部分D形幼虫制成细胞悬液固定于75%的酒精中, 用流式细胞仪(Beckman CoulterCytoFLEX, 美国)检测倍率。
1.4 幼虫培育将不同诱导浓度、不同起始诱导时间、不同诱导持续时间获得的D形幼虫继续培养。幼虫培育期间, 投喂球等鞭金藻(Isochrysis galbana), 每天投喂6次, 日投饵量6000—8000cells/mL; 水温25—27℃, 每天换水两次, 每次换水50%。每隔4天随机取30个幼虫测量壳高, 同时测每组的存活率, 连续观察至第25天; 在50%壳顶期幼虫和50%眼点幼虫两个时期, 收集幼虫制成细胞悬液固定于75%酒精中, 用于倍率检测。
1.5 数据处理用SPSS18.0进行数据处理, 进行单因素方差分析比较不同处理的诱导效果, 并进行Duncan多重比较分析不同处理下卵裂率、孵化率、三倍体率、幼虫的壳高和存活率指标的差异, 显著水平设为0.05。
2 结果 2.1 6-DMAP对近江牡蛎三倍体的诱导效果 2.1.1 诱导浓度随诱导浓度的增加受精卵的卵裂率逐渐降低; 诱导浓度150、300和450μmol/L组的孵化率无显著性差异(P > 0.05), 诱导浓度为600μmol/L时的孵化率显著小于诱导浓度为150μmol/L和300μmol/L时的孵化率(P < 0.05);诱导浓度为300、450和600μmol/L时的三倍体率无显著性差异(P > 0.05), 但均显著高于诱导浓度为150μmol/L时的三倍体率(P < 0.05);诱导浓度为450μmol/L时诱导获得三倍体率最高达60.67%±5.63%(图 1)。
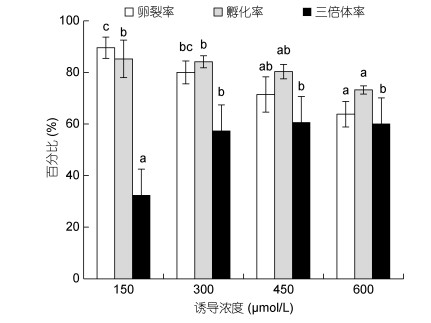 |
| 图 1 不同的诱导浓度下卵裂率、孵化率和三倍体率 Fig. 1 Cleavage rate, hatching rate, and triploid rate in different induction concentrations 注:上标不同小写字母表示差异显著(P < 0.05)。下同 |
起始诱导时间对卵裂率影响较小, 起始诱导时间14、18和22min时的卵裂率无显著性差异(P > 0.05), 但均显著低于起始诱导时间10min时的卵裂率; 不同的起始诱导时间下的三倍体率差异较大, 起始诱导时间为受精后14min时, 诱导获得的三倍体率最高为69.34%±2.11%(图 2)。
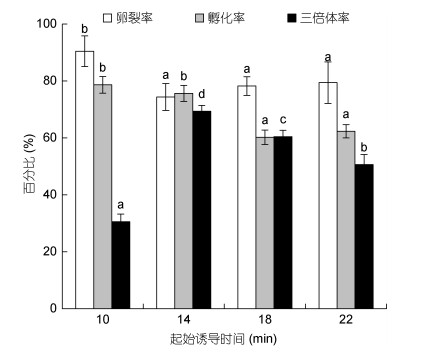 |
| 图 2 不同的起始诱导时间下卵裂率、孵化率和三倍体率 Fig. 2 Cleavage rate, hatching rate, and triploid rate in different initial induction times |
随诱导持续时间的增加, 卵裂率和孵化率均降低; 诱导持续时间25min时, 卵裂率和孵化率均不到60%。持续诱导时间15min和20min两组的三倍体率显著高于另外两组的三倍体率(P < 0.05), 但两组内的三倍体率无显著性差异(P > 0.05), 持续诱导时间为20min时, 诱导获得三倍体率最高为60.32%±2.01%(图 3)。
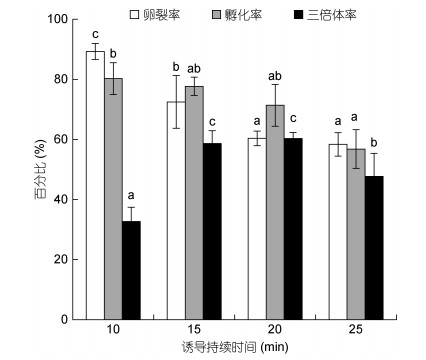 |
| 图 3 不同的诱导持续时间下卵裂率、孵化率和三倍体率 Fig. 3 Cleavage rate, hatching rate, and triploid rate in different induction durations |
幼虫培育的前5天, 不同诱导浓度下的诱导组幼虫壳高均无显著性差异(P > 0.05);培育的第10—20天, 诱导浓度为600μmol/L时的诱导组幼虫壳高最小, 显著小于诱导浓度为300μmol/L时幼虫的壳高(P < 0.05), 诱导浓度为150、300和450μmol/L时的诱导组幼虫的壳高无显著性差异(P > 0.05);培育的第20—25天, 诱导浓度150、300和450μmol/L时诱导组幼虫的壳高无显著性差异(P > 0.05), 但均高于浓度为600μmol/L时幼虫的壳高(图 4)。
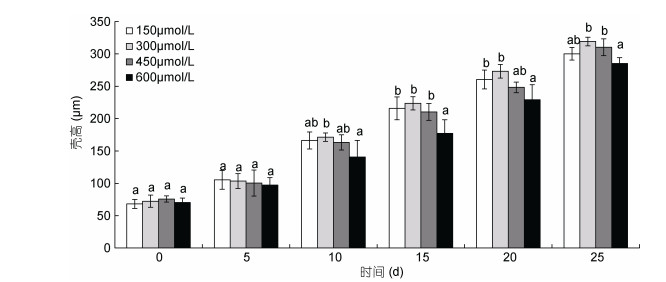 |
| 图 4 不同的诱导浓度下三倍体诱导组幼虫的生长情况 Fig. 4 The growth of triploid induced larvae under different induction concentrations |
在培育的25天内, 起始诱导时间为受精后14、18和22min时诱导组幼虫的壳高始终无显著性差异(P > 0.05);幼虫培育的前10天, 不同的诱导起始时间下诱导组幼虫的壳高均无显著性的差异(P > 0.05);培育的第15—20天, 起始诱导时间10min时诱导组幼虫的壳高均显著高于起始诱导时间18min时诱导组幼虫的壳高(P < 0.05)(图 5)。
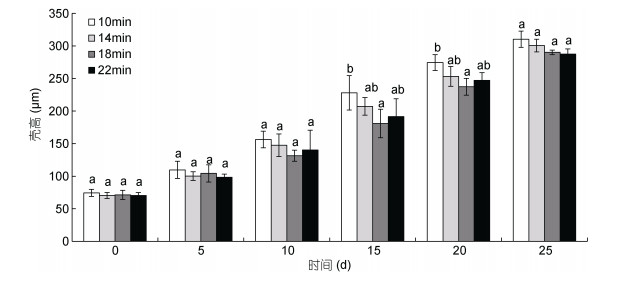 |
| 图 5 不同的起始诱导时间下三倍体诱导组幼虫的生长情况 Fig. 5 The growth of triploid induced larvae under different initial induction times |
在培育的25天内, 诱导持续时间为10、15和20min时诱导组幼虫的壳高无显著性差异(P > 0.05);在培育的前10天, 不同的诱导持续时间下的诱导组幼虫的壳高无显著性差异(P > 0.05);在培育的第15—20天, 诱导持续时间为10、15和20min的诱导组幼虫壳高均显著高于持续诱导时间为25min时幼虫的壳高(P < 0.05);培育的25天内, 持续诱导时间为25min时的诱导组幼虫壳高均最小(图 6)。
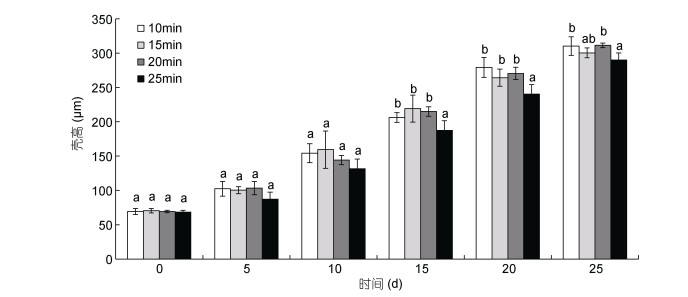 |
| 图 6 不同的持续诱导时间下三倍体诱导组幼虫的生长情况 Fig. 6 The growth of triploid induced larvae under different induction durations |
在培育的25天内, 诱导浓度150、300和450μmol/L时的诱导组幼虫存活率均无显著性差异(P > 0.05);在培育的15—25天, 诱导浓度150、300和450μmol/L时的诱导组幼虫的存活率均显著高于诱导浓度600μmol/L时的诱导组幼虫存活率(P < 0.05)。起始诱导时间对幼虫存活影响较小, 在培育第15天之后各起始诱导时间之间的诱导组幼虫的存活率均无显著性差异(P > 0.05);在培育的第10天, 起始诱导时间10min时的诱导组幼虫的存活率显著低于其他各诱导组幼虫存活率(P < 0.05)。在培育的前20天内, 持续诱导时间10、15和20min时的诱导组幼虫的存活率无显著性差异(P > 0.05), 但均显著高于持续诱导时间25min时诱导组幼虫的存活率(P < 0.05)(表 1)。
| 项目 | 条件 | 5d | 10d | 15d | 20d | 25d |
| 诱导浓度(μmol/L) | 150 | 86.34±5.68a | 79.33±3.75b | 79.15±6.81b | 75.7±13.77b | 70.27±5.05b |
| 300 | 82.33±3.61a | 74.20±8.69ab | 73.32±5.40b | 69.23±5.33b | 67.45±3.35b | |
| 450 | 83.29±5.52a | 76.17±9.60ab | 70.13±9.19b | 67.46±2.76b | 66.34±4.24b | |
| 600 | 74.30±8.69a | 65.35±6.05a | 55.78±2.54a | 54.45±4.13a | 52.12±5.19a | |
| 起始诱导时间(min) | 10 | 71.78±5.76a | 61.23±4.37a | 57.46±1.69a | 55.35±3.18a | 54.57±5.02a |
| 14 | 82.45±5.65b | 74.33±3.35b | 67.34±7.50a | 64.23±5.68a | 62.79±3.33a | |
| 18 | 83.33±6.21b | 70.34±4.67b | 65.34±2.77a | 63.47±2.76a | 63.33±4.41a | |
| 22 | 80.2±2.38ab | 69.23±2.99b | 60.12±2.79a | 60.01±6.24a | 58.89±4.77a | |
| 诱导持续时间(min) | 10 | 83.19±6.09b | 73.15±6.80b | 70.19±5.17b | 68.13±3.53b | 68.12±5.28b |
| 15 | 85.27±3.57b | 77.49±6.23b | 72.11±5.14b | 64.21±4.64b | 60.26±4.06ab | |
| 20 | 80.14±3.57b | 70.12±4.27b | 70.07±4.76b | 66.33±3.19b | 65.10±4.43ab | |
| 25 | 63.12±5.28a | 56.13±3.53a | 55.12±3.50a | 55.01±2.58a | 54.23±3.59a | |
| 注:数据上标字母不同表示组间存在显著差异(P < 0.05)。下同 | ||||||
不同的6-DMAP诱导组合下的三倍体诱导组幼虫的日平均生长率无显著性差异(P > 0.05)。培育25天内, 诱导浓度为150、300和450μmol/L的三倍体诱导组幼虫平均存活率无显著性差异(P > 0.05), 但均显著高于诱导浓度为600μmol/L时的三倍体诱导组幼虫的平均存活率(P < 0.05)。起始诱导时间为10min时的三倍体诱导组幼虫的平均存活率显著小于起始诱导时间为14min时的三倍体诱导组幼虫的平均存活率(P < 0.05)。不同的持续诱导时间下, 三倍体诱导组幼虫的平均存活率差异较小, 诱导持续10、15和20min时的三倍体诱导组幼虫的平均存活率无显著性差异(P > 0.05), 但均显著高于诱导持续时间为25min时的三倍体诱导组幼虫的平均存活率(P < 0.05)(表 2)。
| 项目 | 条件 | 日平均生长率(μm/d) | 平均存活率(%) |
| 诱导浓度(μmol/L) | 150 | 9.28±1.89a | 78.18±5.86b |
| 300 | 9.88±2.63a | 73.29±5.73b | |
| 450 | 9.38±3.25a | 72.68±7.65b | |
| 600 | 8.59±2.32a | 60.40±9.27a | |
| 起始诱导时间(min) | 10 | 9.44±2.94a | 60.08±7.03a |
| 14 | 9.20±2.12a | 70.23±8.15b | |
| 18 | 8.76±2.58a | 69.16±8.41ab | |
| 22 | 8.68±2.15a | 65.70±9.14ab | |
| 诱导持续时间(min) | 10 | 9.64±3.40a | 72.56±6.29b |
| 15 | 9.20±2.69a | 71.87±10.06b | |
| 20 | 9.68±2.94a | 70.35±5.91b | |
| 25 | 8.87±2.96a | 56.72±3.64a |
不同的诱导持续时间对卵裂率产生极显著差异影响(P < 0.01), 且对应的极差最大, 因此诱导持续时间对卵裂率的影响程度最大, 三个诱导条件对卵裂率的影响程度为诱导持续时间 > 诱导浓度 > 起始诱导时间; 三个诱导条件对孵化率的影响程度为起始诱导时间 > 诱导浓度 > 诱导持续时间; 三个诱导条件对三倍体率的影响程度为起始诱导时间 > 诱导浓度 > 诱导持续时间。诱导浓度和诱导持续时间是影响幼虫平均存活率的主要因素(表 3)。
| 项目 | 条件 | 方差分析(P值) | 最大值 | 最小值 | 极差 |
| 卵裂率(%) | 诱导浓度(μmol/L) | 0.002** | 93.34 | 58.20 | 35.14 |
| 起始诱导时间(min) | 0.031* | 96.67 | 69.86 | 26.81 | |
| 诱导持续时间(min) | 0.000** | 91.56 | 54.39 | 37.17 | |
| 孵化率(%) | 诱导浓度(μmol/L) | 0.028* | 93.59 | 71.56 | 21.03 |
| 起始诱导时间(min) | 0.000** | 80.94 | 57.33 | 23.61 | |
| 诱导持续时间(min) | 0.07 | 85.81 | 59.35 | 26.46 | |
| 三倍体率(%) | 诱导浓度(μmol/L) | 0.001** | 66.77 | 28.23 | 38.54 |
| 起始诱导时间(min) | 0.000** | 68.78 | 28.66 | 40.12 | |
| 诱导持续时间(min) | 0.001** | 62.43 | 29.45 | 32.98 | |
| 日平均生长率(μm/d) | 诱导浓度(μmol/L) | 0.877 | 13.56 | 4.92 | 8.64 |
| 起始诱导时间(min) | 0.955 | 14.31 | 5.60 | 8.71 | |
| 诱导持续时间(min) | 0.969 | 14.57 | 3.79 | 10.78 | |
| 平均存活率(%) | 诱导浓度(μmol/L) | 0.008* | 86.34 | 52.12 | 34.22 |
| 起始诱导时间(min) | 0.241 | 74.33 | 54.57 | 19.76 | |
| 诱导持续时间(min) | 0.006* | 85.27 | 54.23 | 31.04 | |
| 注: *表示差异显著(P < 0.05), **表示差异极显著(P < 0.01) | |||||
幼虫培育期间, 各三倍体诱导组幼虫的三倍体率均有所下降, 诱导浓度600μmol/L和诱导持续时间25min两组的三倍体率下降超过10%, 其他各组三倍体率下降均为超过10%, 变化不显著(P > 0.05)。多数情况下, 三倍体率的下降主要集中于壳顶期幼虫之前, 壳顶期幼虫之后三倍体率变化较小(图 7)。
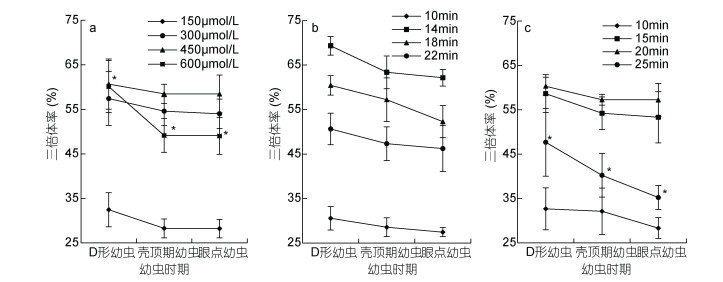 |
| 图 7 不同的诱导条件下三倍体诱导组幼虫的三倍体率的变化 Fig. 7 Variation of triploid rate of triploid induced larvae in different induced conditions 注: a、b、c分别表示不同的诱导浓度、不同的起始诱导时间、不同的诱导持续时间时幼虫的三倍体率变化, *表示该条件下不同的幼虫时期的三倍体率差异显著(P < 0.05) |
从三倍体诱导原理上看, 起始诱导时间的控制是把握极体排放时机的关键, 诱导浓度是作用强度的体现, 这两个因素是决定三倍体率的主要因素, 本次实验的结果也证明了这一点。杨春玲等(2008)诱导“近江牡蛎(C. rivularis)”三倍体时, 也认为起始诱导时间和诱导浓度是决定诱导三倍体率的主要因素。田传远等(1999)认为诱导持续时间对长牡蛎三倍体诱导率无显著性影响, 而本实验中诱导持续时间是三因素中对三倍体率影响最小的因素, 这说明诱导持续时间是三个因素中对诱导三倍体率影响最小的一个因素。持续诱导时间和诱导浓度是影响卵裂率的主要因素, 推测原因是较高的诱导浓度和较长的诱导时间使受精卵受到一定的毒害作用, 受精卵不能正常分裂(田传远等, 1998)。持续诱导时间对胚胎的孵化率没有显著性的影响, 这与CB诱导熊本牡蛎的结论相反, 推测原因是6-DMAP毒性比CB的毒性小, 其毒害作用是瞬间的, 因此其毒害作用主要集中于受精卵时期, 而对胚胎的影响较小, 因此卵裂率受该因素的影响较大, 而孵化率几乎不受该因素的影响(田传远等, 1998;武祥伟等, 2019)。综合来看, 三个诱导条件对三倍体诱导效果的影响程度为起始诱导时间 > 诱导持续时间 > 诱导浓度。
较高的诱导浓度(600μmol/L)和较长的持续诱导时间(25min)下三倍体诱导组幼虫生长慢且存活率显著低, 若以三倍体诱导组幼虫的生长、存活和三倍体率变化作为考量诱导效果的指标, 只能说明诱导浓度600μmol/L、诱导持续时间25min两个条件下诱导效果较差, 而其他的条件下均无显著性差异。综合三倍体D形幼虫的产量和诱导组幼虫的情况来看, 6-DMAP诱导黄河口近江牡蛎三倍体的最佳组合是:诱导浓度为300—450μmol/L, 起始诱导时间为受精后14min, 持续诱导时间为15min。
3.2 三倍体诱导组幼虫的生长存活探讨从幼虫壳高变化看, 诱导浓度600μmol/L和持续诱导时间25min时的幼虫在培育的第5—15天内, 生长速度明显减慢, 幼虫壳高显著小于组内其他条件下幼虫的壳高。武祥伟等(2019)用CB诱导获得的熊本牡蛎三倍体群幼虫在培育前期出现大量死亡现象, 作者认为死亡率高的原因之一是CB的毒性大, 对胚胎产生了毒害作用。虽然本实验中用到的6-DMAP的毒性小, 但当诱导浓度过大和诱导时间过长时, 胚胎处于极度不适应的环境中, 会受到潜在的伤害, 而这种潜在的伤害会在D形幼虫初期表现出来—生长迟滞和高死亡率(田传远等, 2000)。在培育的前期, 幼虫的死亡率急剧下降, 尤其是诱导强度较强时(高诱导浓度和长的诱导持续时间), 这种现象尤为明显。由于极体排放不同步, 高强度的诱导使得第一极体被抑制的几率大大增加, 导致染色体多级分离产生非整倍体(Guo et al, 1992;田传远等, 1999), 这些非整倍体幼虫虽然不存在生长迟滞现象(Guo et al, 1996; Wang et al, 1999), 但是其存活能力低(武祥伟等, 2019), 造成整组在培育初期存活率急剧下降。
3.3 三倍体诱导组幼虫的三倍体率变化情况分析培育至眼点幼虫时期, 多数情况下幼虫三倍体率下降幅度较小, 均未超过10%, 只有诱导强度过大时三倍体率下降显著。诱导浓度600μmol/L和持续诱导时间25min两组幼虫时幼虫死亡率均较高, 同时三倍体率急剧下降, 较高的诱导强度获得了较多的非整倍体, 非整倍体存在会降低三倍体率(He et al, 2000)。因此在用6-DMAP诱导近江牡蛎三倍体时, 诱导浓度不能太大且诱导持续时间不能太长, 否则三倍体产量会大大下降。此外, 三倍体染色体的丢失也是造成三倍体率下降的重要原因, 多倍体牡蛎由于体内多了一套染色体而具备了许多二倍体牡蛎不具有的特点, 但其额外的染色体组使其细胞分裂紊乱的几率增加, 容易产生非整倍体嵌合体, 甚至逆转回二倍体(de Sousa et al, 2016)。
4 结论本研究认为, 温度25℃, 盐度29的条件下, 诱导浓度为300—450μmol/L, 起始诱导时间为受精后14min, 诱导持续时间为15min时, 6-DMAP诱导黄河口近江牡蛎三倍体的效果较好。
于瑞海, 王昭萍, 王如才, 等. 2000. 三种化学诱导剂诱导太平洋牡蛎三倍体的比较研究. 青岛海洋大学学报, 30(4): 589-592 |
王康, 2014.盐度诱导太平洋牡蛎和近江牡蛎三倍体的研究.青岛: 中国海洋大学硕士学位论文, 38-67
|
王海燕, 郭希明, 刘晓, 等. 2007. 中国近海"近江牡蛎"的分类和订名. 海洋科学, 31(9): 85-86 |
田传远, 王如才, 梁英, 等. 1999. 6-DMAP诱导太平洋牡蛎三倍体——抑制受精卵第二极体释放. 中国水产科学, 6(2): 1-4 |
田传远, 梁英, 王如才, 等. 1998. 6-DMAP诱导太平洋牡蛎三倍体5.孵化率和D幼畸形率与三倍体诱导率的关系. 青岛海洋大学学报, 28(3): 421-425 |
田传远, 梁英, 王如才, 等. 2000. 6-DMAP诱导太平洋牡蛎三倍体——诱导因素对孵化率和D幼畸形率的影响. 中国水产科学, 7(1): 110-112 |
杨春玲, 陈晓汉, 李咏梅, 等. 2008. 应用6-DMAP人工诱导近江牡蛎三倍体的初步研究. 西南农业学报, 21(3): 825-828 |
张跃环, 王昭萍, 喻子牛, 等. 2014. 养殖牡蛎种间杂交的研究概况与最新进展. 水产学报, 38(4): 613-624 |
武祥伟, 张跃环, 肖述, 等. 2019. CB诱导熊本牡蛎三倍体及其存活率与倍化率的变化关系. 水产学报, 43(4): 1029-1037 |
秦艳平, 张跃环, 周颖力, 等. 2017. CB与6-DMAP诱导香港牡蛎三倍体的效果比较. 水产学报, 41(2): 250-257 |
Allen Jr S K, Downing S L, 1986a. Performance of triploid Pacific oysters, Crassostrea gigas (Thunberg). I. Survival, growth, glycogen content, and sexual maturation in yearlings. Journal of Experimental Marine Biology and Ecology, 102(2-3): 197-208 DOI:10.1016/0022-0981(86)90176-0 |
Allen Jr S K, Downing S L, Chaiton J et al, 1986b. Chemically and pressure-induced triploidy in the Pacific oyster Crassostrea gigas. Aquaculture, 57(1-4): 359-360 |
Calvo G W, Luckenbach M W, Allen S K Jr et al, 2001. A comparative field study of Crassostrea ariakensis (Fujita 1913) and Crassostrea virginica (Gmelin 1791) in relation to salinity in Virginia. Journal of Shellfish Research, 20(1): 221-229 |
de Sousa J T, Allen Jr S K, Baker H et al, 2016. Aneuploid progeny of the American oyster, Crassostrea virginica, produced by tetraploid×diploid crosses:another example of chromosome instability in polyploid oysters. Genome, 59(5): 327-338 DOI:10.1139/gen-2015-0222 |
Dégremont L, Garcia C, Frank-Lawale A et al, 2012. Triploid oysters in the Chesapeake Bay:comparison of diploid and triploid Crassostrea virginica. Journal of Shellfish Research, 31(1): 21-32 DOI:10.2983/035.031.0103 |
Downing S L, Allen Jr S K, 1987. Induced triploidy in the Pacific oyster, Crassostrea gigas:optimal treatments with cytochalasin B depend on temperature. Aquaculture, 61(1): 1-15 DOI:10.1016/0044-8486(87)90332-2 |
Desrosiers R R, Gérard A, Peignon J M et al, 1993. A novel method to produce triploids in bivalve molluscs by the use of 6-dimethylaminopurine. Journal of Experimental Marine Biology and Ecology, 170(1): 29-43 DOI:10.1016/0022-0981(93)90127-A |
Gérard A, Ledu C, Phélipot P et al, 1999. The induction of MI and MII triploids in the Pacific oyster Crassostrea gigas with 6-DMAP or CB. Aquaculture, 174(3-4): 229-242 DOI:10.1016/S0044-8486(99)00032-0 |
Guo X M, Allen Jr S K, 1994. Viable tetraploids in the Pacific oyster (Crassostrea gigas Thunberg) produced by inhibiting polar body 1 in eggs from triploids. Molecular Marine Biology and Biotechnology, 3(1): 42-50 |
Guo X M, Cooper K, Hershberger W K et al, 1992. Genetic consequences of blocking polar body I with cytochalasin B in fertilized eggs of the Pacific oyster, Crassostrea gigas:I. Ploidy of resultant embryos. The Biological Bulletin, 183(3): 381-386 |
Guo X M, DeBrosse G A, Allen Jr S K, 1996. All-triploid Pacific oysters (Crassostrea gigas Thunberg) produced by mating tetraploids and diploids. Aquaculture, 142(3-4): 149-161 DOI:10.1016/0044-8486(95)01243-5 |
He M X, Lin Y G, Shen Q et al, 2000. Production of tetraploid pearl oyster (Pinctada martensii Dunker) by inhibiting the first polar body in eggs from triploids. Journal of Shellfish Research, 19(1): 147-151 |
Lam K, Morton B, 2003. Mitochondrial DNA and morphological identification of a new species of Crassostrea (Bivalvia:Ostreidae) cultured for centuries in the Peral River Delta, Hong Kong, China. Aquaculture, 228(1-4): 1-13 DOI:10.1016/S0044-8486(03)00215-1 |
Nell J A, 2002. Farming triploid oysters. Aquaculture, 210(1-4): 69-88 DOI:10.1016/S0044-8486(01)00861-4 |
Peachey B L, Allen Jr S K, 2016. Evaluation of cytochalasin B and 6-dimethylaminopurine for tetraploidy induction in the Eastern oyster, Crassostrea virginica. Aquaculture, 450: 199-205 DOI:10.1016/j.aquaculture.2015.07.034 |
Piferrer F, Beaumont A, Falguière J C et al, 2009. Polyploid fish and shellfish:production, biology and applications to aquaculture for performance improvement and genetic containment. Aquaculture, 293(3-4): 125-156 DOI:10.1016/j.aquaculture.2009.04.036 |
Stanley J G, Allen Jr S K, Hidu H, 1981. Polyploidy induced in the American oyster, Crassostrea virginica, with cytochalasin B. Aquaculture, 23(1-4): 1-10 DOI:10.1016/0044-8486(81)90002-8 |
Wang H Y, Guo X M, Zhang G F et al, 2004. Classification of Jinjiang oysters Crassostrea rivularis (Gould. 1861) from China, based on morphology and phylogenetic analysis. Aquaculture, 242(1-4): 137-155 DOI:10.1016/j.aquaculture.2004.09.014 |
Wang Z P, Guo X M, Allen Jr S K et al, 1999. Aneuploid Pacific oyster (Crassostrea gigas Thunberg) as incidentals from triploid production. Aquaculture, 173(1-4): 347-357 DOI:10.1016/S0044-8486(98)00457-8 |
Xiao J, Cordes J F, Wang H Y et al, 2010. Population genetics of Crassostrea ariakensis in Asia inferred from microsatellite markers. Marine Biology, 157(8): 1767-1781 DOI:10.1007/s00227-010-1449-x |
Yoon H S, Jung H T, Choi S D, 2008. Suminoe Oyster (Crassostrea ariakensis) Culture in Korea. Journal of Shellfish Research, 27(3): 505-508 DOI:10.2983/0730-8000(2008)27[505:SOCACI]2.0.CO;2 |
 2020, Vol. 51
2020, Vol. 51


