
中国海洋湖沼学会主办。
文章信息
- 董甜甜, 崔彦婷, 王忠凯, 龙劲男, 陈怡更, 王聪, 赵楠楠, 王仁杰, 李玉全. 2020.
- DONG Tian-Tian, CUI Yan-Ting, WANG Zhong-Kai, LONG Jin-Nan, CHEN Yi-Geng, WANG Cong, ZHAO Nan-Nan, WANG Ren-Jie, LI Yu-Quan. 2020.
- 高盐胁迫对凡纳滨对虾(Litopenaeus vannamei)生长、代谢和抗氧化酶活力的影响
- EFFECT OF HIGH-SALINITY STREE ON GROWTH, METABOLISM, AND ANTIOXIDANT ENZYME ACTIVITIES OF LITOPENAEUS VANNAMEI
- 海洋与湖沼, 51(5): 1239-1245
- Oceanologia et Limnologia Sinica, 51(5): 1239-1245.
- http://dx.doi.org/10.11693/hyhz20200300082
文章历史
-
收稿日期:2020-03-20
收修改稿日期:2020-04-27
凡纳滨对虾(Litopenaeus vannamei)俗称南美白对虾, 原产于拉丁美洲的热带太平洋海岸, 具有适应性强、生长速度快、抗病能力强等特点, 且耐盐性非常广, 可耐受盐度范围为2—78(张伟权, 1990), 是目前世界养殖产量最高的三大优良虾种之一, 也是中国对虾养殖的主要种类(栾生等, 2013; 黄永春等, 2013)。但是随着养殖规模、地域的扩大, 凡纳滨对虾养殖出现环境恶化、生长速率减慢和病害频发等问题(冯东岳等, 2011; Reverter et al, 2014)。研究者们努力探寻对虾养殖的新环境和新模式。在山东、河北及天津等沿海, 以及西北地区存在大面积高盐水域, 可在这些高盐水域进行凡纳滨对虾养殖, 并且高盐水体养殖的对虾口感、品质都优于低盐水体, 更受消费者的喜爱, 具有很好的发展前景。因此, 高盐水体对虾养殖也引起许多学者的关注与研究(李娜等, 2018; 赵玉超等, 2019)。
盐度是直接影响虾类生长、代谢和抗氧化等的重要环境因子。李二超(2008)研究发现, 盐度能够显著影响凡纳滨对虾的增长率与成活率; 李婷等(2011)报道, 凡纳滨对虾在适宜盐度范围内, 随着盐度的上升, 能量消耗减少, 摄入能量的利用率提高; 李华等(2007)研究表明, 凡纳滨对虾在低盐(盐度4)环境中SOD活力高于高盐(盐度32)环境。通常情况下, 可以通过测定甘油三酯(TG)、胆固醇(TC)、ATP的含量和苹果酸脱氢酶(MDH)活力等代谢指标, 超氧化物歧化酶(SOD)和过氧化氢酶(CAT)等抗氧化酶活力来了解内外因子对甲壳动物的影响(张艳等, 2005; 刘群芳等, 2013; 龙晓文等, 2019)。目前, 关于盐度对凡纳滨对虾生长、代谢和抗氧化方面的研究主要集中在低盐度(王妤等, 2011; Gao et al, 2016), 高盐度方面的研究报道较少, 鉴于此, 本实验拟以凡纳滨对虾为实验材料, 分析高盐胁迫对凡纳滨对虾生长指标、代谢物质含量及代谢、抗氧化相关酶活力的影响, 以丰富对虾生物学基础知识, 同时为高盐水域凡纳滨对虾养殖提供理论参考。
1 材料与方法 1.1 实验动物实验所用凡纳滨对虾购自山东省海阳市某养殖场, 运至青岛农业大学海洋科学与工程学院养殖实验室后, 暂养于PVC水桶(300L)中。暂养期间所用海水盐度34, pH 8.0±0.5, 用加热棒将温度控制在(28±0.5)℃, 每天投喂四次(7:00, 12:00, 17:00, 22:00), 每日换水1次, 每次换水50%, 24h充气泵充氧。暂养7d后, 每天以2个盐度的速度由34逐渐驯化至实验设计盐度梯度。高盐度海水由天然海水(盐度23左右)与海水素(潍坊海之绚水族用品科技有限公司)调配而成。实验开始时对虾初始体长(7.6±0.2)cm, 体重(3.0±0.4)g。
1.2 实验设计实验设置25、35、45、55四个盐度梯度, 其中盐度25作为对照组, 每个盐度组设3个平行, 每个平行放入大小均匀、健康的凡纳滨对虾30尾。每天投喂四次, 投喂等日常管理同暂养。每天上午10:00换水1次, 换水量为50%。实验为期30d, 每隔10d测定1次体长和体重, 每个平行取3尾对虾取血淋巴和肝胰腺。
1.3 样品收集实验结束前24h停止投喂。实验结束时, 每个平行中随机取3尾对虾, 用一次性注射器(l.0mL)从对虾心脏抽取血淋巴1︰1加入抗凝剂混合, 放入1.5mL的Eppendorf管中, 4℃过夜后4000r/min离心15min, 取上清液(血清)置于–80℃冰箱保存备用。取其肝胰脏装入Eppendorf管中, 迅速投入液氮冷冻, 再转移到–80℃冰箱保存, 以上操作均在冰盘中进行。组织样品先用剪刀剪碎, 准确称重后置于匀浆管中, 加入9倍体积的生理盐水, 匀浆机匀浆后冷冻离心机3000r/min离心10min, 分别稀释至所需浓度后进行ATP含量的测定。
1.4 指标测定及数据处理增重率、增长率、特定生长率和存活率的计算方法:
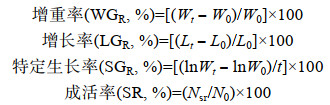
式中, W0为初始平均体重(g), Wt为终末平均体重(g), L0为初始平均体长(cm), Lt为终末平均体长(cm), t为实验时间(d)。Nsr为存活的个体数目, N0为起始放入的总个体数。
甘油三酯、胆固醇、ATP的含量和苹果酸脱氢酶、总超氧化物歧化酶、过氧化氢酶活力测定均采用南京建成生物工程研究所的试剂盒测定, 样品前处理、试剂配制和测定步骤严格按照操作说明书进行。
所得数据用SPSS22.0软件进行单因子方差(ANOVA)及Duncan多重比较进行分析处理, 以P < 0.05作为差异显著水平。
2 结果 2.1 高盐胁迫对生长指标的影响高盐胁迫对凡纳滨对虾生长指标的影响见表 1。从表 1可以看出, 随着盐度的升高, 凡纳滨对虾的增重率与特定生长率均逐渐降低, 盐度25时增重率与特定生长率最高, 盐度35和盐度45时次之, 盐度55时最低, 且各处理组较对照组降低显著(P < 0.05);凡纳滨对虾的增长率也随着盐度的升高逐渐降低, 且45盐度组和55盐度组显著低于对照组(P < 0.05), 但35盐度组与对照组间差异不显著(P > 0.05);成活率呈逐渐降低的趋势, 在盐度25时最高, 为65.67%, 盐度55时最低, 为43%, 且55盐度组显著低于对照组(P < 0.05), 其他组间差异不显著(P > 0.05)。
| 指标 | 盐度 | |||
| 25 | 35 | 45 | 55 | |
| 初始体重(g) | 3.06±0.17a | 2.92±0.34a | 3.06±0.17a | 3.09±0.09a |
| 终末体重(g) | 5.64±0.38a | 4.66±0.30b | 3.53±0.32c | 3.42±0.03c |
| 增重率(%) | 84.39±3.06a | 60.31±10.15b | 15.43±7.59c | 10.79±3.40c |
| 增长率(%) | 24.85±2.23a | 18.16±1.75a | 7.12±5.29b | 3.98±4.15b |
| 特定增长率(%) | 2.04±0.06a | 1.57±0.20b | 0.47±0.22c | 0.34±0.10c |
| 成活率(%) | 65.67±5.13a | 60.00±7.00a | 54.67±6.81ab | 43.00±10.00b |
| 注:同行数据中上标字母不同表示差异显著(P < 0.05) | ||||
高盐胁迫对凡纳滨对虾TG含量的影响见图 1。从图 1可以看出, 随着实验时间的增加, 各处理组TG含量整体上呈现先下降后上升的趋势, 10d时TG含量随着盐度的增加逐渐降低, 55盐度组显著低于对照组(P < 0.05)。20d和30d时各盐度组TG的含量逐渐升高, 55盐度组显著高于对照组(P < 0.05)。
 |
| 图 1 高盐胁迫对凡纳滨对虾TG含量的影响 Fig. 1 Effect of high-salinity stress on TG content in L. vannamei 注:同一时间点标有不同小写字母者表示组间有显著性差异(P < 0.05), 标有相同小写字母者表示组间无显著性差异(P > 0. 05)。下同 |
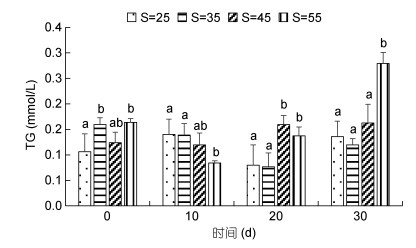
高盐胁迫对凡纳滨对虾TC含量的影响见图 2。从图 2可以看出, 10d时TC含量随着盐度的增加总体上逐渐升高, 20d和30d时35盐度组、45盐度组较对照组下降, 且除对照组外其余各组随盐度升高呈上升趋势。55盐度组TC含量相较于其他组最高, 且30d时显著高于其他组(P < 0.05)。
 |
| 图 2 高盐胁迫对凡纳滨对虾TC含量的影响 Fig. 2 Effect of high-salinity stress on TC content in L. vannamei |
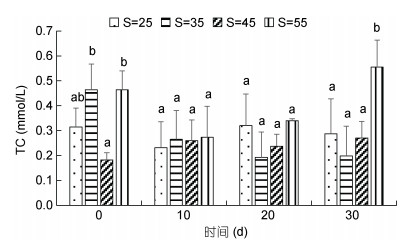
高盐胁迫对凡纳滨对虾MDH活力的影响见图 3。从图 3可以看出, 10d时MDH活力随着盐度的增加逐渐降低, 45盐度组和55盐度组显著低于对照组(P < 0.05)。随着实验时间的增加, 各处理组MDH活力逐渐高于对照组, 呈现随盐度升高活力增加的趋势, 在20d、30d时活力较高, 且45盐度组和55盐度组显著高于其他组(P < 0.05), 其余各处理组之间均无显著性差异(P > 0.05)。
 |
| 图 3 高盐胁迫对凡纳滨对虾MDH活力的影响 Fig. 3 Effect of high-salinity stress on MDH activity of L. vannamei |
高盐胁迫对凡纳滨对虾ATP含量的影响见图 4。由图 4可以看出, 0d、10d和20d时各处理组ATP含量总体升高, 随盐度的增加呈先上升后下降的趋势, 盐度45时出现最大值, 且35盐度组、45盐度组显著高于对照组(P < 0.05)。30d时各处理组ATP含量较对照组下降, 55盐度组下降显著(P < 0.05)。
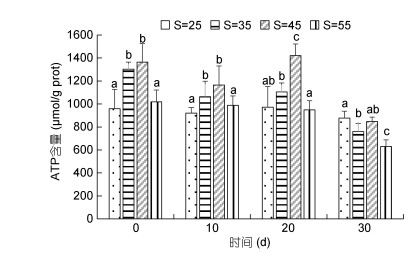 |
| 图 4 高盐胁迫对凡纳滨对虾ATP含量的影响 Fig. 4 Effect of high-salinity stress on ATP content in L. vannamei |
高盐胁迫对凡纳滨对虾T-SOD活力的影响见图 5。从图 5可以看出, 0d和10d时55盐度组T-SOD活力与其他组差异显著(P < 0.05), 其他各时间点各处理组间差异均不显著(P > 0.05), 但随着时间的增加, 呈现上升的趋势, 30d时出现最大值。
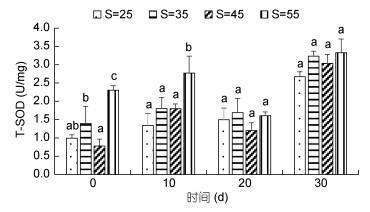 |
| 图 5 高盐胁迫对凡纳滨对虾T-SOD活力的影响 Fig. 5 Effect of high-salinity stress on T-SOD activity of L. vannamei |
高盐胁迫对凡纳滨对虾CAT活力的影响见图 6。由图 6可以看出, 随着实验时间的增加, 各处理组CAT活力总体呈先上升后下降再上升趋势, 30d时出现最大值。20d和30d时CAT活力整体高于对照组, 但差异并不显著(P > 0.05)。
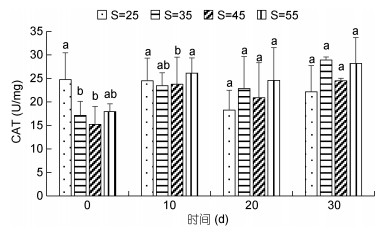 |
| 图 6 高盐胁迫对凡纳滨对虾CAT活力的影响 Fig. 6 Effect of high-salinity stress on CAT activity of L. vannamei |
盐度是影响甲壳类动物生长和存活的重要环境因子。大多数甲壳动物都有一定的盐度耐受范围, 在适宜的盐度范围内生长良好, 但当盐度超出可承受范围时, 机体会产生应激, 严重时甚至会导致死亡。李二超等(2009)研究表明, 当水体盐度高于或低于自身渗透压时, 甲壳类动物为了调节自身渗透压平衡会消耗更多的能量, 从而使用于生长发育的能量减少, 生长受到抑制。凡纳滨对虾属于广盐生物, 朱春华(2002)研究发现, 凡纳滨对虾的等渗点在14—22盐度范围内, 此范围内用于渗透压调节的耗能较少, 当盐度超出这个范围时, 体内外会形成较大的渗透压梯度差, 对虾为了维持自身渗透平衡会消耗更多的能量, 从而影响对虾生长。本实验中, 随着盐度的增加, 凡纳滨对虾的增重率、增长率与特定生长率均显著降低, 说明在远离对虾等渗点时, 对虾需要更多的能量以维持机体渗透平衡, 导致生长减慢。这与李二超等(2009)和朱春华(2002)的研究结果一致; 凡纳滨对虾的成活率随盐度的变化表现为25 > 35 > 45 > 55, 说明过高的盐度会影响对虾的存活。这与李娜等(2017)、沈敏等(2019)的研究结果一致。
3.2 高盐胁迫对凡纳滨对虾脂类代谢物质含量的影响动物体的代谢包括三大营养物质代谢, 脂类代谢是其中重要的一种。血浆甘油三酯和胆固醇是血脂的重要组成成分, 能够给机体提供能量, 合成某些酶、维生素和激素等, 是维持正常生命活动所必需的物质(Likimani et al, 1982)。因此, 甘油三酯和胆固醇含量的变化在一定程度上能够反映脂类代谢的情况。当外界环境改变时, 机体为克服胁迫会动用脂类提供能量。甘油三酯能够分解成甘油和脂肪酸, 这一过程伴随着能量的释放(Racotta et al, 1998)。贾小燕等(2012)研究发现, 中华绒螯蟹(Eriocheir sinensis)由淡水进入盐度12的水体6h后, TG含量显著下降, 表明TG消耗增多, 说明此阶段脂类作为能源物质的比例加大, 机体加速动用脂类以分解供能。本实验中, 10d时各盐度组TG的含量随着盐度的增加逐渐降低, 表明对虾体内TG消耗量增多, 说明在这一阶段对虾分解脂类提供能量, 且盐度越高, 对虾用以调节渗透压平衡所需的能量越高, 所以TG含量消耗越多。20d和30d时甘油三酯的含量逐渐升高, 推测可能是随着时间的增加, 脂类代谢不再是主要的供能来源, 蛋白质代谢或糖类代谢开始发挥作用, 或者是脂类的合成增加, 从而使TG含量累积, 具体原因有待进一步研究。胆固醇是甲壳动物发育过程中重要的激素前体和细胞膜组成物质, 对甲壳动物性腺发育、蜕皮及代谢等具有重要的调节作用(Sheen, 2000; Gong et al, 2004; 田志环等, 2013)。本实验中, 55盐度组的TC含量相较于其他组最高, 可能是由于血液胆固醇水平与机体免疫代谢密切相关, 高盐度胁迫下凡纳滨对虾生理状况不佳, 对虾通过提高胆固醇代谢水平从而维持自身的生理健康(龙晓文等, 2013)。
3.3 高盐胁迫对凡纳滨对虾MDH活力的影响三羧酸循环(TAC)又称柠檬酸循环, 是动物体糖类代谢过程中重要的一环, 它参与糖的有氧氧化之后的代谢过程, 能够将丙酮酸生成的代谢底物乙酰辅酶A进一步氧化为水和二氧化碳。苹果酸脱氢酶是TAC的关键酶之一, 其主要作用是可以催化苹果酸和草酰乙酸(可与乙酰辅酶A生成柠檬酸)之间的可逆转换, 这一过程伴随着能量的生成(汪新颖等, 2009)。它也是调节糖代谢效率的关键酶之一, 其活力能够在一定程度上反映出糖代谢水平的高低。本实验中, 45盐度组和55盐度组MDH活力在10d时显著低于对照组, 可能是在这一时间糖代谢不是主要功能途径, TAC功能受到抑制。20d、30d时, 45盐度组和55盐度组的MDH活力显著高于对照组, 且盐度越高, 活力越强, 说明随着盐度的增加, 对虾用于维持正常生理需求所需的能量增加, 从而使TAC作用加强。这与房子恒等(2016)在半滑舌鳎上的研究结果相一致。
3.4 高盐胁迫对凡纳滨对虾ATP含量的影响三磷酸腺苷(adenosine triphosphate, ATP)作为生物体能量的直接供应者, 是生物活性的主要标志。本实验中, 10d、20d时35盐度组、45盐度组显著高于对照组, 说明高盐胁迫下凡纳滨对虾需要更多的能量供给, 继而水解释放出大量的ATP, ATP含量升高(Shen et al, 2020)。30d时各处理组ATP含量下降, 推测可能是在此时间段对虾已经逐渐适应盐度胁迫, 也可能是前20d对虾的代谢以有氧代谢为主, ATP释放量大, 而30d时无氧代谢发挥主要作用(施兆鸿等, 2015), 具体原因还需进一步研究证实。
3.5 高盐胁迫对凡纳滨对虾抗氧化酶活力的影响当环境因子发生变化时, 水产动物机体会受到氧化胁迫而引起氧化应激反应(Tomanek et al, 2011), 与此同时机体的抗氧化酶活力也会发生改变。超氧化物歧化酶(SOD)和过氧化氢酶(CAT)是重要的抗氧化酶。它们广泛存在于需氧和耐氧生物体内(杨细兰, 2011)。SOD是抗氧化反应的第一道防御屏障, 其作用机理是通过2O2-+2H+→H2O2+O2反应达到清除体内过量氧自由基的目的, 在平衡氧化与抗氧化过程中有至关重要的作用(徐靖, 2013)。CAT是抗氧化酵素系统的重要一员, 也是过氧化物酶体的标志酶, 它可以加速过氧化氢的分解, 阻止氢氧自由基有毒物质的产生, 对保护抗氧化系统的功能和动物体的生长发育和代谢活动具有重要意义。CAT可将超氧化物歧化酶的作用产物进一步还原, 两者相互作用从而保护机体不受活性氧自由基的伤害(Fridovich, 1995; 张克烽等, 2007)。本实验中, 在高盐胁迫下, T-SOD活力与CAT活力都发生不同程度的变化, 且随着时间的增加各处理组的酶活力总体呈现上升的趋势, 说明高盐胁迫能够激活凡纳滨对虾的抗氧化能力, 且随着时间的增加有适应性的变化。在20d和30d时, 各处理组T-SOD活力与CAT活力整体高于对照组, 推测可能是因为长期的高盐胁迫导致对虾体内产生大量活性氧自由基, 机体为了保护体内细胞不受伤害从而诱导SOD、CAT活力升高以清除这些活性氧自由基(王晓杰等, 2005; 王芸等, 2018)。
4 结论综上所述, 高盐胁迫会影响凡纳滨对虾的生长与存活, 盐度越高, 生长越慢, 存活率越低; 会使T-SOD和CAT的活力升高, 激发凡纳滨对虾的抗氧化系统。高盐水体中, 渗透压调节需要更多能量, 凡纳滨对虾会通过脂类代谢和糖类代谢等释放能量, 维持自身的生理需求。本实验只分析了脂类代谢和糖代谢中的三羧酸循环过程, 并不能完全了解高盐条件下对虾的生理变化, 还需要从蛋白质代谢以及其它糖类代谢过程等方面做进一步的研究。
王芸, 李正, 段亚飞, 等. 2018. 红景天提取物对凡纳滨对虾抗氧化系统及抗低盐度胁迫的影响. 南方水产科学, 14(1): 9-19 |
王妤, 庄平, 章龙珍, 等. 2011. 盐度对点篮子鱼的存活、生长及抗氧化防御系统的影响. 水产学报, 35(1): 66-73 |
王晓杰, 张秀梅, 李文涛. 2005. 盐度胁迫对许氏平鲉血液免疫酶活力的影响. 海洋水产研究, 26(6): 17-21 |
龙晓文, 王秋举, 汉雪梅, 等. 2013. 豆粕基础饲料中添加胆固醇促进鱼类生长机理的研究进展. 安徽农业科学, 41(7): 2954-2955 |
龙晓文, 吴仁福, 侯文杰, 等. 2019. 水体盐度对雌性三疣梭子蟹生长、卵巢发育、渗透压调节、代谢和抗氧化能力的影响. 水产学报, 43(8): 1768-1780 |
田志环, 康现江, 焦传珍. 2013. 中华绒螯蟹蜕皮过程中体壁结构和主要成分的变化. 水生生物学报, 37(5): 899-904 |
冯东岳, 钱冬. 2011. 2005~2009年凡纳滨对虾白斑综合征和桃拉综合征的流行情况分析. 南方水产科学, 7(1): 78-83 |
朱春华. 2002. 盐度对南美白对虾生长性能的影响. 水产养殖, (3): 25-27 |
刘群芳, 曹俊明, 黄燕华, 等. 2013. β-葡聚糖与硒、维生素E联合添加对凡纳滨对虾生长、血清免疫和抗氧化指标及抗病力的影响. 中国水产科学, 20(5): 997-1006 |
李华, 李强, 曲健凤, 等. 2007. 不同盐度下凡纳滨对虾血淋巴免疫生理指标比较. 中国海洋大学学报, 37(6): 927-930 |
李娜, 王仁杰, 赵玉超, 等. 2017. 高盐胁迫对凡纳滨对虾生长指标、血浆渗透压及Na+-K+-ATP酶活力的影响. 浙江海洋学院学报(自然科学版), 36(3): 196-201 |
李娜, 赵玉超, 王仁杰, 等. 2018. 高盐胁迫对凡纳滨对虾消化及免疫相关酶活力的影响. 生态学报, 38(4): 1411-1417 |
李婷, 梁堪富, 李义军, 等. 2011. 不同条件下凡纳滨对虾(Litopenaeus vannamei)能量代谢研究. 海洋与湖沼, 42(1): 41-46 |
李二超, 2008.盐度对凡纳滨对虾的生理影响及其营养调节.上海: 华东师范大学博士学位论文, 46-54
|
李二超, 陈立侨, 曾嶒, 等. 2009. 盐度对凡纳滨对虾体组织蛋白质积累、氨基酸组成和转氨酶活性的影响. 水生生物学报, 33(3): 532-538 |
杨细兰, 2011.褶纹冠蚌过氧化氢酶基因克隆、原核表达及酶活性分析.南昌: 南昌大学硕士学位论文, 1-2
|
汪新颖, 王波, 侯松涛, 等. 2009. 苹果酸脱氢酶的结构及功能. 生物学杂志, 26(4): 69-72 |
沈敏, 赵玉超, 凌涛, 等. 2019. 高盐突变对凡纳滨对虾(Litopenaeus vannamei)生长性能及相关酶活力的影响. 海洋与湖沼, 50(1): 204-209 |
张艳, 张志南, 邓可, 等. 2005. 青岛岩礁附植小型底栖动物ATP含量的研究. 中国海洋大学学报, 35(5): 799-806 |
张伟权. 1990. 世界重要养殖品种——南美白对虾生物学简介. 海洋科学, (3): 69-72 |
张克烽, 张子平, 陈芸, 等. 2007. 动物抗氧化系统中主要抗氧化酶基因的研究进展. 动物学杂志, 42(2): 153-160 |
房子恒, 田相利, 董双林. 2016. 低盐驯化对半滑舌鳎幼鱼生长、渗透生理及糖代谢酶活力影响的研究. 中国海洋大学学报, 46(8): 19-27 |
赵玉超, 王仁杰, 沈敏, 等. 2019. 高盐对凡纳滨对虾仔虾生长、渗透调节及免疫相关酶活性的影响. 水产学报, 43(4): 833-840 |
施兆鸿, 张晨捷, 彭士明, 等. 2015. 低盐胁迫对黄姑鱼(Nibea albiflora)幼鱼鳃离子调节、呼吸代谢酶和皮质醇的影响. 渔业科学进展, 36(6): 22-28 |
贾小燕, 庄平, 冯广朋, 等. 2012. 中华绒螯蟹雌性亲蟹血淋巴生化指标与盐度的关系. 水产学报, 36(1): 91-97 |
徐靖. 2013. 超氧化物歧化酶及其应用的研究进展. 食品工业科技, 34(12): 387-391 |
栾生, 罗坤, 阮晓红, 等. 2013. 凡纳滨对虾(Litopenaeus vannamei)体重、存活性状的遗传参数和基因型与环境互作效应. 海洋与湖沼, 44(2): 445-452 |
黄永春, 艾华水, 潘忠诚, 等. 2013. 凡纳滨对虾抗WSSV选育家系的建立及其抗病特性. 水产学报, 37(3): 359-366 |
Fridovich I, 1995. Superoxide radical and superoxide dismutases. Annual Review of Biochemistry, 64: 97-112 DOI:10.1146/annurev.bi.64.070195.000525 |
Gao W H, Tian L, Huang T H et al, 2016. Effect of salinity on the growth performance, osmolarity and metabolism-related gene expression in white shrimp Litopenaeus vannamei. Aquaculture Reports, 4: 125-129 DOI:10.1016/j.aqrep.2016.09.001 |
Gong H, Jiang D H, Lightner D V et al, 2004. A dietary modification approach to improve the osmoregulatory capacity of Litopenaeus vannamei cultured in the Arizona desert. Aquaculture Nutrition, 10(4): 227-236 DOI:10.1111/j.1365-2095.2004.00294.x |
Likimani T A, Wilson R P, 1982. Effects of diet on lipogenic enzyme activities in channel catfish hepatic and adipose tissue. The Journal of Nutrition, 112(1): 112-117 DOI:10.1093/jn/112.1.112 |
Racotta I S, Palacios E, 1998. Hemolymph metabolic variables in response to experimental manipulation stress and serotonin injection in Penaeus vannamei. Journal of the World Aquaculture Society, 29(3): 351-356 DOI:10.1111/j.1749-7345.1998.tb00658.x |
Reverter M, Bontemps N, Lecchini D et al, 2014. Use of plant extracts in fish aquaculture as an alternative to chemotherapy:current status and future perspectives. Aquaculture, 433: 50-61 DOI:10.1016/j.aquaculture.2014.05.048 |
Sheen S S, 2000. Dietary cholesterol requirement of juvenile mud crab Scylla serrata. Aquaculture, 189(3-4): 277-285 DOI:10.1016/S0044-8486(00)00379-3 |
Shen M, Cui Y T, Wang R J et al, 2020. Acute response of Pacific white shrimp Litopenaeus vannamei to high-salinity reductions in osmosis-, metabolism-, and immune-related enzyme activities. Aquaculture International, 28: 31-39 DOI:10.1007/s10499-019-00441-y |
Tomanek L, Zuzow M J, Ivanina A V et al, 2011. Proteomic response to elevated PCO2 level in eastern oysters, Crassostrea virginica:evidence for oxidative stress. Journal of Experimental Biology, 214(11): 1836-1844 DOI:10.1242/jeb.055475 |
 2020, Vol. 51
2020, Vol. 51


