
中国海洋湖沼学会主办。
文章信息
- 李艺师, 陈树果, 薛程, 张亭禄, 张雨潇. 2020.
- LI Yi-Shi, CHEN Shu-Guo, XUE Cheng, ZHANG Ting-Lu, ZHANG Yu-Xiao. 2020.
- 黄渤海夏季生物发光强度分布特征及其影响因素分析
- DISTRIBUTION OF BIOLUMINESCENCE INTENSITY AND THE DRIVING FACTOR ANALYSIS IN THE YELLOW SEA AND BOHAI SEA IN SUMMER
- 海洋与湖沼, 51(6): 1391-1401
- Oceanologia et Limnologia Sinica, 51(6): 1391-1401.
- http://dx.doi.org/10.11693/hyhz20200200036
文章历史
-
收稿日期:2020-02-06
收修改稿日期:2020-04-15
2. 中国海洋大学三亚海洋研究院 三亚 572024;
3. 青岛海洋科学与技术试点国家实验室 区域海洋动力学与数值模拟功能实验室 青岛 266237
2. Sanya Ocean Institute, Ocean University of China, Sanya 572024, China;
3. Laboratory for Regional Oceanography and Numerical Modeling, Pilot National Laboratory for Marine Science and Technology(Qingdao), Qingdao 266237, China
海洋中的生物发光现象非常迷人而又特别, 其最早是被水手们所发现并记录下来。后来, 一些海洋学家开始研究这一现象。早期针对海洋生物发光的研究主要集中于生物发光的生理机制及其生态优势上(Alberte, 1993)。如Hastings(1983)探讨了生物发光系统的多样性及其化学反应机理; Morin(1983)研究了近岸海域生物发光的分布形式和功能; Herring(1987)系统地分析了具有生物发光能力的生物物种分布。这些早期研究表明海洋中拥有发光能力的生物有机体具有广泛的物种分布, 小到单细胞的细菌, 大到脊椎动物。随着生物发光测量技术的发展, 一些测量浮游生物发光的仪器被研制出来, 整个水体剖面的生物发光强度分布得以展现, 其在海洋生态中的重要性也逐渐体现出来, 包括对赤潮的研究和预测(Shulman et al, 2005; Kim et al, 2006; Jester et al, 2009; Ryan et al, 2009)、海洋薄层的生态研究(Widder et al, 1999; Benoit-Bird et al, 2010; Moline et al, 2010)、浮游生物种类的区分(Moline et al, 2009; Johnsen et al, 2014)以及极地生态学研究(Cronin et al, 2016)等。海洋生物发光除了在海洋生态领域具有重要的研究价值外, 由于大多数具有发光能力的海洋生物在受到机械刺激时都会发光, 生物发光因此还可用于夜间探测水下或水面目标, 对海军作战和国家安全具有重要意义(Lynch, 1981; Nealson, 1993; Lapota, 2003, 2005)。基于此, 围绕机械刺激所致的生物发光的强度分布及其辐射传输特性(Moline et al, 2007; Oliver et al, 2007)、探测可行性(Gordon, 1984, 1987; Yi et al, 1992; Miller et al, 2005)及预测(Shulman et al, 2003, 2011, 2017)开展了广泛而深入的研究。
然而, 对于不同区域性水体, 受不同物理、生物地球化学等海洋过程的影响, 其发光生物的分布必然不同, 进而导致其无论在海洋生态上的应用还是夜间目标探测上的应用均有所不同。因此, 对于某一特定海域, 首先需要充分认识该海域生物发光强度的分布特征及生物发光物种。
在我国沿岸海域, 海洋物种分布广泛, 数量丰富。在近海典型海域经常见到生物发光的新闻报道, 并且在海上科学考察实验中经常见到科考船夜间航行的尾流导致明显的生物发光。然而, 对我国近岸海域生物发光的定量研究尚未见报道。目前国内关于海洋生物发光的研究主要集中在发光细菌在污染环境监测及污染环境风险评估方面(张进兴等, 2007)。仅曹静等(2011, 2012)对南海海域舰船尾流所致生物发光通过视觉观察的方法结合海水表层环境要素信息进行了初步分析, 在实验室对几种海洋发光物种的发射光谱进行了测试分析; 韩晶等(2014)基于实验室水槽模拟实验利用简单的相机拍照方式探讨了温度变化及船舶噪声激励下的夜光藻的发光特性。针对我国近海生物发光的时空分布及其影响机制的研究较少, 缺乏相关的定量研究和系统分析。
本研究的目的是通过对黄渤海夏季水体的现场测量揭示其生物发光强度的三维空间分布特征, 并结合同步测量的环境参数及种群特征进一步明确其影响因素, 以期研究结果为未来的进一步应用提供支持。
1 材料与方法 1.1 研究区域和仪器在国家自然科学基金的资助下, 搭载国家自然科学基金黄渤海夏季共享航次于2018年夏季(航次具体执行时间为2018年7月24日-8月8日)在我国黄海和渤海开展了海上现场测量实验。具体站位如图 1a所示, 在每个测量站位, 利用海洋光学综合测量剖面笼(图 1b)获取水体剖面机械刺激所致生物发光强度、温度、盐度、叶绿素a浓度以及其他固有光学性质等数据, 具体布防时, 为保证获取足够高的垂向分辨数据, 使用绞车以0.15m/s的下降速度将海洋光学综合测量剖面笼从水面下放至距海底3m处的深度(避免仪器触底遭受损坏)。海洋光学综合测量剖面笼具体配置仪器信息如下表 1所示。
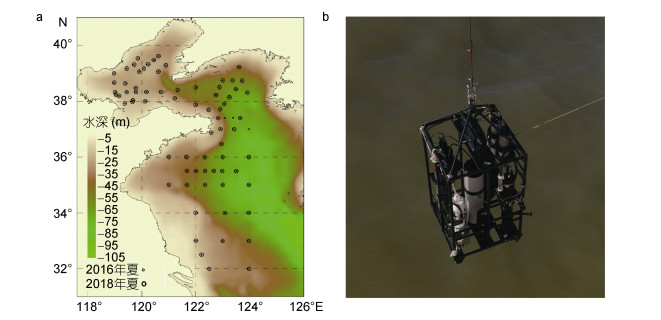 |
| 图 1 黄渤海夏季航次测量站位分布图(a)和海洋光学综合测量剖面笼现场吊放图(b) Fig. 1 The distribution of sites in the field survey in the Yellow Sea and Bohai Sea (a) and the deployment of the integrated profiler cage for marine optical measurement (b) |
| 序号 | 仪器名称 | 测量参数 |
| 1 | 生物发光分析仪(UBAT, WET Labs Inc.) | 机械刺激所致生物发光强度(The mechanical-stimulated bioluminescence potential, MBP) |
| 2 | 叶绿素荧光仪(BB7FL2, WET Labs Inc.) | 叶绿素a浓度、后向散射系数 |
| 3 | 温盐深测量仪(Seabird SBE19plus, Seabird Inc.) | 温度、盐度 |
| 4 | 高光谱吸收衰减测量仪(ACS, WET Labs Inc.) | 吸收衰减系数 |
此外, 在每个站位, 同步使用SBE-911温盐深剖面仪对不同深度的水样进行同步采样。采集得到的水样被分为两部分:其中一部分现场进行过滤保存处理, 带回实验室使用萃取荧光法(Li et al, 2011)进行测量, 用来校正现场活体荧光法测量的数据(叶绿素荧光仪); 另一部分水样(2L)使用筛娟(孔径20μm)浓缩至250mL倒入采样瓶中, 立即用5%浓度的甲醛溶液进行固定, 将固定后的水样带到陆地实验室, 通过显微镜进行浮游植物物种鉴定和计数。
需特别指出的是, 虽然进行了海洋光学综合参数的剖面测量, 但是本文研究并未用到后向散射和吸收衰减的数据。
此外, 除了上述所列数据外, 2016年夏季搭载国家自然科学基金黄渤海夏季共享航次(2016年6月29日-7月19日)利用同样的海洋光学综合测量剖面笼进行了现场剖面测量, 其站位分布与2018年大致相同(图 1a)。但当时并未进行同步的水样采集, 缺少对应的浮游植物种群数据, 因此, 2016年黄渤海夏季航次数据主要用于比较不同年际间生物发光强度的差异, 排除一个航次数据获取的偶然性。
1.2 数据处理方法本研究所使用的生物发光分析仪(underwater bioluminescence assessment tool, UBAT)是美国WET Labs公司所开发的一款商业化仪器(图 2)。该仪器的具体信息可参考WETLabs官方网站(https://www.seabird.com/underwater-bioluminescence-assessment-tool-ubat/product?id=54627923896)。本节主要就其结构组成和工作原理进行概述。
 |
| 图 2 UBAT结构组成(WET Labs, 2015) Fig. 2 Structure of UBAT (underwater bioluminescence assessment tool) (WET Labs, 2015) |
UBAT主要由六部分构成(图 2), 包括: S形避光进样管道、样品流通叶轮、机械刺激叶轮、积分球样品腔、光电倍增管探测单元及出水口。其工作原理如下:外部海水样品在流通叶轮的驱动下由S形避光进样管道进入积分球样品腔, 在进入积分样品腔前会经过机械刺激叶轮转动产生的涡动, 然后光电倍增管检测单元对进入积分球样品腔的水样所发出的光进行测量, 最后水样经出水口排出。
UBAT直接测量的是单位时间内平均生物发光发出的光子数。而海洋水体生物发光强度的计量需要考虑水的体积。一般, 机械刺激所致生物发光强度(mechanically stimulated bioluminescence potential, MBP)指的是单位体积水体内单位时间在一定机械刺激下所产生的光子数, 其单位是photons/(s·L)。故UBAT所测量的数据需要进行转换才能得到有效的MBP。计算公式如下:
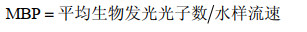 (1)
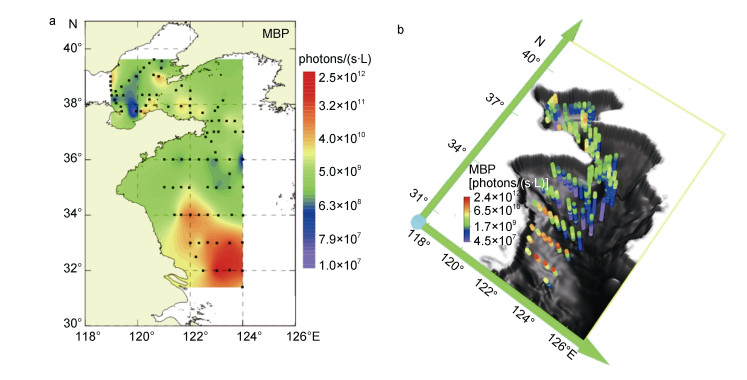
(1)如图 3所示, 黄渤海表层水体MBP的空间分布得以较好的展现。夏季黄渤海表层水体的MBP整体较高, 其平均值约为5.65×1010photons/(s·L), 最大值约为1.52×1012photons/(s·L)。在整个黄渤海范围内, 存在三个MBP较高的区域:第一个位于黄海南部长江口附近海域(图 3区域A), 也是整个黄渤海水体中MBP最高的海域; 第二个位于渤海海峡及其附近海域, 尤其是山东半岛周围的海域(图 3区域B); 第三个高值区位于渤海西北部海域(图 3区域C)。
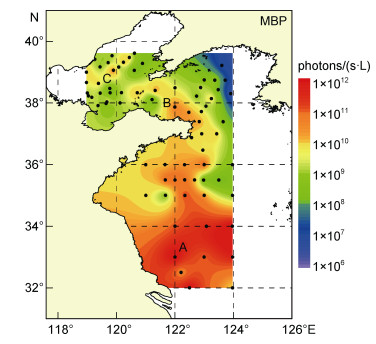 |
| 图 3 2018年夏季MBP在黄渤海的表层分布图 Fig. 3 Contours of the spatial distribution of the MBP in the surface waters of the Yellow Sea and Bohai Sea in summer 2018 注: A、B、C为黄渤海范围内MBP含量较高的三个区域 |
在三维空间上(图 4), 整个黄渤海范围内的MBP的平均值约为4×1010photons/(s·L), 最大值约为2×1012photons/(s·L)。垂向上一般海表面的MBP具有较高值, 而底层MBP值相对较低, 在南黄海中部海域, 这种现象尤为突出。但是在近岸较浅的海域中, MBP在底层水体中也存在较高值, 如黄海南部近岸海域。此外, 底层水体中MBP的垂向分布具有不均匀性, 如某些深度的MBP呈现高值, 而相邻深度的MBP呈现低值。
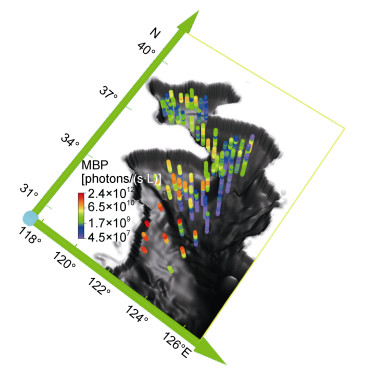 |
| 图 4 2018年夏季MBP在黄渤海的三维分布图 Fig. 4 The 3D spatial distribution of the MBP in the Yellow Sea and Bohai Sea in summer 2018 |
将夏季黄渤海的整体测量结果与国外其他海域的测量结果相比, 夏季黄渤海的MBP处于较高水平(图 5)。Shulman等(2005)在2000年8月和2003年8月使用定制的光度计测量了加州蒙特利湾中的生物发光强度, 该海域生物发光强度的最大值约为1011photons/(s·L), 平均值约为2×1010photons/(s·L); Lapota (2003)于2002年2月使用生物发光传感器测量了圣地亚哥湾的生物发光强度, 该海域生物发光强度的最大值约为1013photons/(s·L), 平均值约为1011photons/(s·L); Moline等(2007)于2002-2004年夏季在加州蒙特利湾和奥比斯波湾使用生物发光测量仪进行了4500公里水下自动测量, 根据其采集的数据, 这两个海域生物发光强度的最大值约为1011photons/(s·L), 平均值约为5×109photons/(s·L); Shulman等(2017)于2015年7月和8月使用UBAT测量了特拉华湾的生物发光强度, 该海域生物发光强度的最大值约为5×1011photons/(s·L), 平均值约为1010photons/(s·L)。与以上研究结果相比, 黄渤海海域生物发光强度的最大值高于大部分海域中生物发光强度的最大值, 其平均值也高于除圣地亚哥湾之外的其他海域的MBP平均值, 这进一步表明夏季黄渤海的MBP处于较高水平。
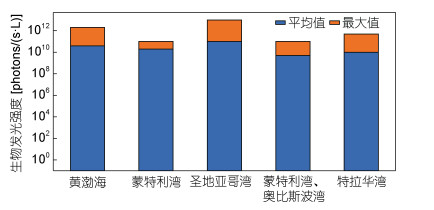 |
| 图 5 黄渤海与其他海域生物发光测量值的对比 Fig. 5 Comparison of in bioluminescence values between the Yellow Sea and Bohai Sea and other sea areas |
图 6是2016年现场测量的MBP在黄渤海的表层及三维空间分布, 可以看出, 与2018年夏季测量的分布结果(图 3, 4)十分相似, 在水平和垂直尺度上可以看到相似的分布模式(图 6a, 6b)。在数值上, 2016年黄渤海海域内夏季MBP的平均值约为3×1010photons/(s·L), 最大值约为2×1012photons/(s·L); 2018年黄渤海海域内夏季MBP的平均值约为4×1010photons/(s·L), 最大值约为2×1012photons/(s·L)。可见年际间黄渤海夏季MBP在数值上也相当。此外, 从时间上, 两个夏季航次的现场测量时间在一年内的时间差异很小, 即非常相近的月份。这表明本文所描述和分析的生物发光并非偶然事件, 而是MBP在黄渤海典型的夏季分布特征。
 |
| 图 6 2016年夏季MBP在黄渤海的表层分布(a)和三维分布(b) Fig. 6 Surface (a) and 3D (b) spatial distribution of MBP in the Yellow Sea and Bohai Sea in summer 2016 |
在描述了黄渤海水体夏季MBP的三维空间分布特征的基础上, 本节结合与MBP同步测量的环境参数, 如温度、盐度、总生物量(叶绿素浓度)和浮游植物丰度数据, 进一步分析导致MBP分布的可能影响因素。
3.1 MBP与环境因子和总生物量的关系由图 7可以看出, 在海水表层, MBP与温度(图 7a)、盐度(图 7b)以及叶绿素浓度(图 7c)并无显著联系。在空间分布上, 南黄海中部的底层海水中MBP较低, 同时温度也很低, 但在其他区域MBP与温度无明显关联(图 7d)。这表明在夏季的黄渤海中, 除温度极低(6℃左右)海域外, MBP均能广泛分布; MBP的分布与盐度的分布之间没有明显的关联(图 7e), 说明盐度对MBP的影响较小; 以叶绿素浓度为代表的浮游植物总生物量与MBP之间也未呈现显著联系(图 7f), 在黄海中部的底层海域, 叶绿素浓度和MBP都较低, 但从整个黄渤海的空间尺度上看, 叶绿素浓度的高值除了分布在沿岸附近海域外, 黄海中部也出现一些高值, 而MBP的高值主要位于海表。相关性分析也表明MBP与上述环境因子和总生物量之间的相关性都比较弱(图 7g-7i)。
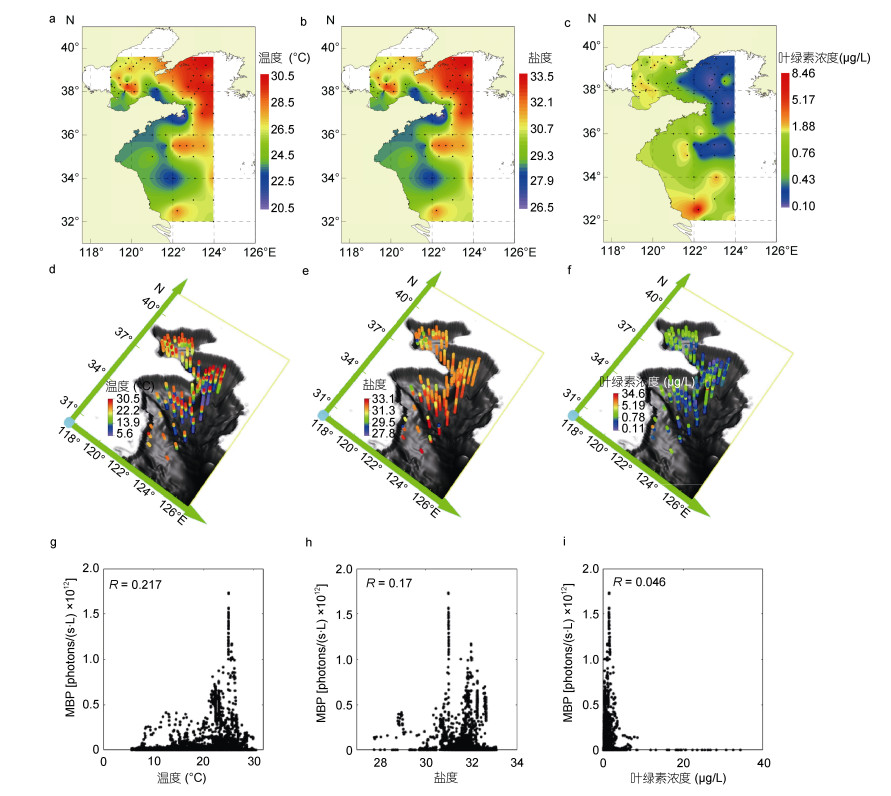 |
| 图 7 2018年夏季温度、盐度、叶绿素浓度在黄渤海的分布以及与MBP的散点图 Fig. 7 Scatter diagrams showing distribution of temperature, salinity, and chlorophyll, vs MBP in the the Yellow Sea and Bohai Sea in summer 2018 注: a.温度表层分布; b.盐度表层分布; c.叶绿素浓度表层分布; d.温度三维分布; e.盐度三维分布; f.叶绿素浓度三维分布; g.温度与MBP; h.盐度与MBP; i.叶绿素浓度与MBP |
依据目前的文献报道所确立的具有发光能力的甲藻藻种有:夜光藻、夜光梨甲藻、梭梨甲藻、新月梨甲藻、梭角藻、粗刺新角藻、叉角藻、多纹膝沟藻、原多甲藻、亚历山大藻、多边舌甲藻、多刺角甲藻等(Swift et al, 1995; Latz et al, 2004; Valiadi et al, 2013)。分析夏季航次采集水样中的浮游植物种类和丰度, 在黄渤海表层具有较高丰度的浮游植物分别是:夜光藻(图 8a)、梭角藻(图 8b)、粗刺新角藻(图 8c)、叉角藻(图 8d)、多纹膝沟藻(图 8e)和原多甲藻(图 8f)。除此之外, 黄渤海也存在亚历山大藻、多边舌甲藻及多刺角甲藻, 但由于它们在整个调查海域中检测到的最大丰度低于4cells/L, 出现频率和发光能力都较低, 因此未将这三种甲藻作为分析研究对象。在黄海南部的海水表层, 夜光藻、梭角藻、叉角藻和粗刺新角藻主要分布于黄海南部海域, 尤其在长江口附近海域, 在山东半岛附近海域也有分布(图 8a-8d); 原多甲藻在黄渤海中广泛存在, 其丰度高值区位于黄海南部长江口附近海域(图 8f); 多纹膝沟藻在黄海南部海域、渤海近岸海域以及渤海海峡北部海域具有较高丰度(图 8e)。
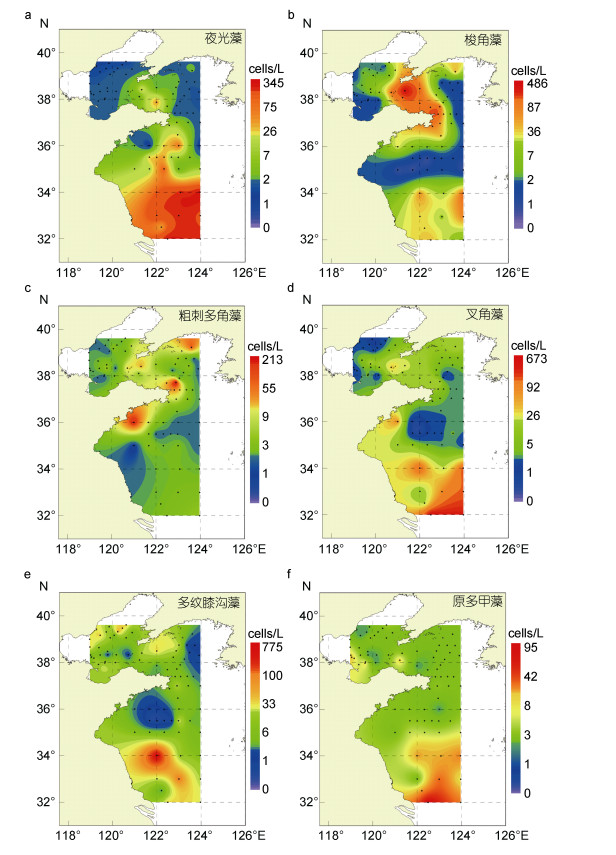 |
| 图 8 2018年夏季发光浮游植物在黄渤海的表层分布 Fig. 8 The distribution of bioluminescent phytoplankton species in abundance in the Yellow Sea and Bohai Sea in summer 2018 注: a.夜光藻; b.梭角藻; c.粗刺新角藻; d.叉角藻; e.多纹膝沟藻; f.原多甲藻 |
综上所述, 黄渤海存在的发光浮游生物种类丰富, 分布广泛。根据文献中关于甲藻发光能力的研究结果(Swift et al, 1995), 黄渤海中发光浮游植物的发光能力存在很大的差异。叉角藻、梭角藻、粗刺新角藻、多纹膝沟藻的发光能力较弱, 机械刺激下每个细胞的发光量级约为108光子(Buskey et al, 1990; Swift et al, 1995), 原多甲藻在机械刺激下每个细胞能够发出约108-109个光子, 夜光藻的发光能力在黄渤海存在的发光浮游植物中最高, 机械刺激下每个细胞能够发出约109-1010个光子(Sweeney, 1971; Buskey et al, 1992)。由于夜光藻具有较强发光能力且它在黄海具有较高丰度, 黄海MBP的分布特征与夜光藻的分布特征较为相似(图 3, 8a); 在渤海, 夜光藻的丰度较低, MBP主要由多纹膝沟藻和原多甲藻产生, 而多纹膝沟藻和原多甲藻的发光能力低于夜光藻, 导致渤海的MBP整体低于南黄海。为进一步说明夏季黄渤海中MBP与发光浮游物种之间的关系, 分别将MBP与几种发光浮游植物的丰度进行定量分析(图 9), 经过计算, 夜光藻丰度与MBP之间具有强相关性, 其决定系数达到0.86 (图 9a), 远高于其他发光浮游物种与MBP之间的决定系数, 该结果表明夏季黄渤海中影响MBP的决定性因素为夜光藻丰度。
4 讨论根据夏季MBP与发光甲藻的相关性分析结果, 夜光藻是夏季MBP的主导因素; 在夜光藻丰度较低的渤海, 多纹膝沟藻和原多甲藻对MBP的贡献较大。除此之外, 黄渤海也存在一些能发光的浮游动物, 如磷虾、水母等(徐兆礼, 2011), 它们贡献了部分MBP。现场测量所获取的是水体中所有发光生物受到机械刺激引起的生物发光强度, 而采集水样中主要对浮游植物进行物种鉴定和计数实验, 并未对浮游动物进行计数, 因此在本研究中没有出现MBP与发光动物的分析。但是从图 9可以看出, 夜光藻与MBP具有强相关性, 这说明MBP主要由夜光藻等浮游植物决定, 发光动物对MBP的影响较小。此外, 由于UBAT自身入水口尺寸限制, 大型发光生物体也无法进入仪器腔体。
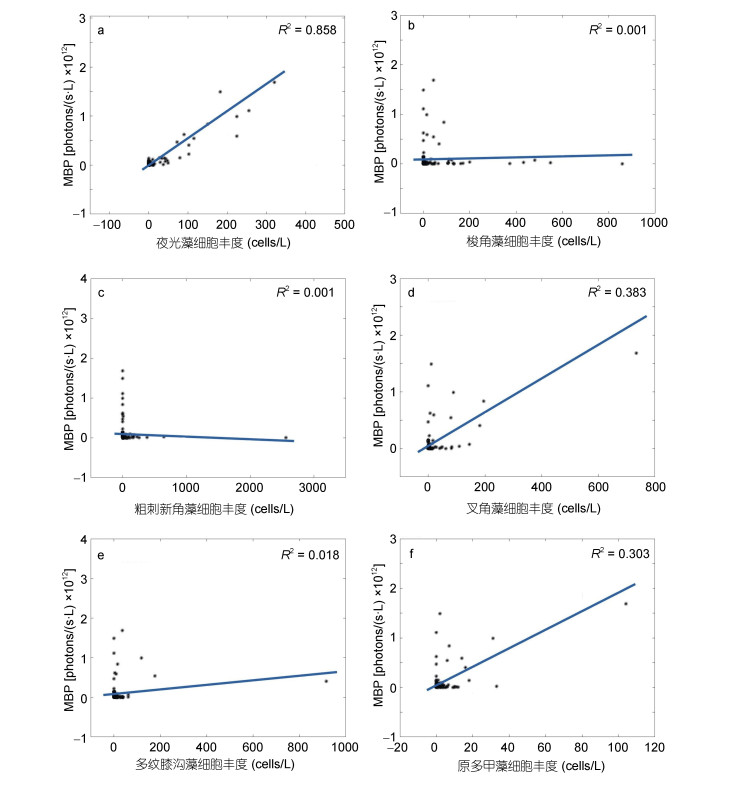 |
| 图 9 MBP与发光浮游植物丰度的关系 Fig. 9 Correlation between the MBP and the abundance of bioluminescent phytoplankton species 注: a.夜光藻; b.梭角藻; c.粗刺新角藻; d.叉角藻; e.多纹膝沟藻; f.原多甲藻 |
由于主导夏季黄渤海MBP的因素是夜光藻丰度, 而夜光藻的生长取决于温度、盐度、光照、营养物质和其他浮游植物种类, 是由多种因素共同决定的(黄长江等, 1997)。Wang等(2018)对近10年黄海沿海水域实测数据的分析结果也表明, 夜光藻丰度与单个环境因子之间并不存在显著的相关性。因此, MBP对温度、盐度和总生物量等单一条件的依赖性较弱, 需要结合多因素进行更复杂的分析。本研究在夏季航次获取的数据并不支持这种综合分析, 未来我们将利用不同季节的更多数据来探讨MBP的影响机制。
此外, 长江口及浙江周边海域发生的赤潮主要由夜光藻引起(Zhou et al, 2008; Tseng et al, 2011; Wang et al, 2018), 本研究中MBP与夜光藻丰度的强相关性揭示, 可以通过获取海域中的MBP来监测夜光藻赤潮的发生。由于浮游植物的生长强烈依赖于环境条件, 当季节变化时, 环境条件的剧烈变化对发光浮游植物的生长具有较大影响, 因此发光浮游植物的种类和丰度在不同季节会表现出较大差异, 进而导致MBP的分布也呈现出季节性差异。在未来, 我们将就MBP的季节变化及其影响机制进行进一步研究。
5 结论本研究利用实测数据, 对黄渤海夏季的MBP分布进行了定量分析, 同时利用同步测量的环境参数、浮游植物总生物量和浮游植物物种丰度数据, 分析了影响MBP的主要因素。整体上, 夏季黄渤海的生物发光具有较高强度, 平均MBP约为4× 1010photons/(s·L), 最大值约为2×1012photons/(s·L), 存在三个生物发光高值区, 分别是MBP值最高的黄海南部海域(以长江口附近海域表现最为显著)、渤海海峡(包含相近的山东半岛附近海域)以及渤海西北部海域。MBP的分布对温度、盐度以及总生物量的依赖性较低。夏季黄渤海中MBP主要由甲藻产生, 而夜光藻由于其具有较强的发光能力, 是夏季黄渤海中MBP分布格局的主要影响因素。
致谢 在此感谢进行现场测量的所有研究人员, 感谢中国海洋大学的杨世民正高级实验师和赵海龙老师在识别浮游植物物种方面提供的指导和帮助。
张进兴, 逄爱梅, 孙修勤, 等. 2007. 海洋发光细菌的发光及其应用. 发光学报, 28(2): 167-172 |
徐兆礼. 2011. 中国近海浮游动物多样性研究的过去和未来. 生物多样性, 19(6): 635-645 |
黄长江, 杞桑, 齐雨藻, 等. 1997. 南海大鹏湾夜光藻种群在其生态群落中的地位和功能. 海洋与湖沼, 28(4): 348-355 |
曹静, 王江安, 罗华强. 2011. 影响舰船尾流生物致光的海洋环境要素研究. 舰船科学技术, 33(10): 29-32 |
曹静, 宗思光, 王江安, 等. 2012. 流场刺激下海洋生物发光的光学特性及数理模型. 发光学报, 33(10): 1039-1048 |
韩晶, 李桂娟, 张学刚, 等. 2014. 船舶噪声激励夜光虫发光特性实验研究. 发光学报, 35(5): 623-626 |
Alberte R S, 1993. Bioluminescence:The fascination, phenomena, and fundamentals. Naval Research Reviews, 45: 2-12 |
Benoit-Bird K J, Moline M A, Waluk C M et al, 2010. Integrated measurements of acoustical and optical thin layers I:Vertical scales of association. Continental Shelf Research, 30(1): 17-28 DOI:10.1016/j.csr.2009.08.001 |
Buskey E J, Strom S, Coulter C, 1992. Biolumiscence of heterotrophic dinoflagellates from Texas coastal waters. Journal of Experimental Marine Biology and Ecology, 159(1): 37-49 DOI:10.1016/0022-0981(92)90256-A |
Buskey E J, Swift E, 1990. An encounter model to predict natural planktonic bioluminescence. Limnology and Oceanography, 35(7): 1469-1485 DOI:10.4319/lo.1990.35.7.1469 |
Gordon H R, 1984. Remote sensing marine bioluminescence:The role of the in-water scaler irradiance. Applied Optics, 23(11): 1694-1696 DOI:10.1364/AO.23.001694 |
Gordon H R, 1987. Bio-optical model describing the distribution of irradiance at the sea surface resulting from a point source embedded in the ocean. Applied Optics, 26(19): 4133-4148 DOI:10.1364/AO.26.004133 |
Cronin H A, Cohen J H, Berge J et al, 2016. Bioluminescence as an ecological factor during high Arctic polar night. Scientific Reports, 6: 36374 DOI:10.1038/srep36374 |
Hastings J W, 1983. Biological diversity, chemical mechanisms, and the evolutionary origins of bioluminescent systems. Journal of Molecular Evolution, 19(5): 309-321 DOI:10.1007/BF02101634 |
Herring P J, 1987. Systematic distribution of bioluminescence in living organisms. Journal of Bioluminescence and Chemiluminescence, 1(3): 147-163 DOI:10.1002/bio.1170010303 |
Jester R, Lefebvre K, Langlois G et al, 2009. A shift in the dominant toxin-producing algal species in central California alters phycotoxins in food webs. Harmful Algae, 8(2): 291-298 DOI:10.1016/j.hal.2008.07.001 |
Johnsen G, Candeloro M, Berge J et al, 2014. Glowing in the dark:discriminating patterns of bioluminescence from different taxa during the Arctic polar night. Polar Biology, 37(5): 707-713 DOI:10.1007/s00300-014-1471-4 |
Kim G, Lee Y W, Joung D J et al, 2006. Real-time monitoring of nutrient concentrations and red-tide outbreaks in the southern sea of Korea. Geophysical Research Letters, 33(13) |
Lapota D, 2003. Buoy-mounted bioluminescence sensor (BioBuoy) for special operations, Tech. Doc, 3155. San Diego, CA: Space and Naval Warfare Center, 142-145
|
Lapota D, 2005. Night time surveillance of harbors and coastal areas using bioluminescence camera and buoy systems. In: Proceedings Volume 5780, Photonics for Port and Harbor Security. Orlando, Florida, United States: SPIE, 5780: 128-137
|
Latz M I, Nauen J C, Rohr J, 2004. Bioluminescence response of four species of dinoflagellates to fully developed pipe flow. Journal of Plankton Research, 26(12): 1529-1546 DOI:10.1093/plankt/fbh141 |
Li J B, Li P Y, Chen S et al, 2011. Series of national standards on specifications for oceanographic survey. China Standardization, (2): 34-38 |
Lynch R V, 1981. Patterns of bioluminescence in the oceans. NRL Rep, 8475. Washington: Naval Res. Lab
|
Miller S D, Haddock S H D, Elvidge C D et al, 2005. Detection of a bioluminescent milky sea from space. Proceedings of the National Academy of Sciences of the United States of America, 102(40): 14181-14184 DOI:10.1073/pnas.0507253102 |
Moline M A, Benoit-Bird K J, Robbins I C et al, 2010. Integrated measurements of acoustical and optical thin layers II:Horizontal length scales. Continental Shelf Research, 30(1): 29-38 DOI:10.1016/j.csr.2009.08.004 |
Moline M A, Blackwell S M, Case J F et al, 2009. Bioluminescence to reveal structure and interaction of coastal planktonic communities. Deep Sea Research Part II:Topical Studies in Oceanography, 56(3-5): 232-245 DOI:10.1016/j.dsr2.2008.08.002 |
Moline M A, Oliver M J, Mobley C D et al, 2007. Bioluminescence in a complex coastal environment:1. Temporal dynamics of nighttime water-leaving radiance. Journal of Geophysical Research:Oceans, 112(C11): C11016 |
Morin J G, 1983. Coastal bioluminescence:patterns and functions. Bulletin of Marine Science, 33(4): 787-817 |
Nealson K H, 1993. Bacterial bioluminescence:three decades of enlightenment. Naval Research Reviews, 45: 13-30 |
Oliver M J, Moline M A, Mobley C D et al, 2007. Bioluminescence in a complex coastal environment:2. Prediction of bioluminescent source depth from spectral water-leaving radiance. Journal of Geophysical Research:Oceans, 112(C11): C11017 |
Ryan J P, Fischer A M, Kudela R M et al, 2009. Influences of upwelling and downwelling winds on red tide bloom dynamics in Monterey Bay, California. Continental Shelf Research, 29(5-6): 785-795 DOI:10.1016/j.csr.2008.11.006 |
Shulman I, Haddock S H D, McGillicuddy Jr D J et al, 2003. Numerical modeling of bioluminescence distributions in the Coastal Ocean. Journal of Atmospheric and Oceanic Technology, 20(7): 1060-1068 DOI:10.1175/1468.1 |
Shulman I, Kindle J C, McGillicuddy Jr D J et al, 2005. Bioluminescence intensity modeling and sampling strategy optimization. Journal of Atmospheric and Oceanic Technology, 22(8): 1267-1281 DOI:10.1175/JTECH1760.1 |
Shulman I, Moline M A, Anderson S et al, 2017. A study case of bioluminescence potential dynamics in the Delaware Bay with observations and modeling. Ocean Dynamics, 67(3-4): 383-396 DOI:10.1007/s10236-017-1045-4 |
Shulman I, Moline M A, Penta B et al, 2011. Observed and modeled bio-optical, bioluminescent, and physical properties during a coastal upwelling event in Monterey Bay, California. Journal of Geophysical Research:Oceans, 116(C1): C01018 |
Sweeney B M, 1971. Laboratory studies of a green Noctiluca from New Guinea. Journal of Phycology, 7(1): 53-58 |
Swift E, Sullivan J M, Batchelder H P et al, 1995. Bioluminescent organisms and bioluminescence measurements in the North Atlantic Ocean near latitude 59.5°N, longitude 21°W. Journal of Geophysical Research:Oceans, 100(C4): 6527-6547 DOI:10.1029/94JC01870 |
Tseng L C, Kumar R, Chen Q C et al, 2011. Summer distribution of Noctiluca scintillans and mesozooplankton in the Western and Southern East China Sea prior to the Three Gorges Dam operation. Hydrobiologia, 666(1): 239-256 DOI:10.1007/s10750-010-0587-y |
Valiadi M, Iglesias-Rodriguez D, 2013. Understanding bioluminescence in dinoflagellates-how far have we come?. Microorganisms, 1(1): 3-25 DOI:10.3390/microorganisms1010003 |
Wang W C, Sun S, Sun X X et al, 2018. Seasonal phenology of the heterotrophic dinoflagellate Noctiluca scintillans (Macartney) in Jiaozhou Bay and adjacent coastal Yellow Sea, China. Journal of Oceanology and Limnology, 36(4): 1280-1293 DOI:10.1007/s00343-018-6350-3 |
Widder E A, Johnsen S, Bernstein S A et al, 1999. Thin layers of bioluminescent copepods found at density discontinuities in the water column. Marine Biology, 134(3): 429-437 DOI:10.1007/s002270050559 |
Yi H C, Sanchez R, McCormick N J, 1992. Bioluminescence estimation from ocean in situ irradiances. Applied Optics, 31(6): 822-830 DOI:10.1364/AO.31.000822 |
Zhou M J, Shen Z L, Yu R C, 2008. Responses of a coastal phytoplankton community to increased nutrient input from the Changjiang (Yangtze) River. Continental Shelf Research, 28(12): 1483-1489 DOI:10.1016/j.csr.2007.02.009 |
 2020, Vol. 51
2020, Vol. 51


