中国海洋湖沼学会主办。
文章信息
- 林雅柔, 岑竞仪, 王建艳, 梁芊艳, 吕颂辉. 2020.
- LIN Ya-Rou, CEN Jing-Yi, WANG Jian-Yan, LIANG Qian-Yan, LYU Song-Hui. 2020.
- 中国南海四种凯伦藻种间作用与溶血活性初步研究
- PRELIMINARY STUDY ON INTERSPECIFIC RELATIONSHIP AND HEMOLYTIC ACTIVITY OF FOUR KARENIA SPECIES FROM SOUTH CHINA SEA
- 海洋与湖沼, 51(6): 1402-1411
- Oceanologia et Limnologia Sinica, 51(6): 1402-1411.
- http://dx.doi.org/10.11693/hyhz20200100002
文章历史
-
收稿日期:2020-01-03
收修改稿日期:2020-07-25
2. 北京自然博物馆 科学研究部 北京 100010
2. Department of Science Research, Beijing Museum of Natural History, Beijing 100010, China
凯伦藻属(Karenia)隶属于裸甲藻目(Gymnodiniales)凯伦藻科(Kareniaceae), 该属多个种类在世界范围内频繁暴发有毒有害赤潮, 备受各界关注(Brand et al, 2012;俞志明等, 2019; Li et al, 2019)。凯伦藻属的种类大多具有毒性, 目前已报道的12种中有10种曾引发有毒有害赤潮, 灾害效应包括致使养殖鱼类和贝类等海洋生物死亡, 引起食用者产生腹泻、痉挛、麻痹昏迷或引起呼吸困难综合症等(Brand et al, 2012)。凯伦藻可产短裸甲藻毒素(Brevetoxin)、溶血毒素(Hemotoxin)、细胞毒素(Cytotoxin)、环亚胺毒素(Gymnodimine)和鱼毒素等毒素(Baden et al, 1979; Baden, 1989; Haywood et al, 2004)。
短凯伦藻(Karenia brevis)和米氏凯伦藻(K. mikimotoi)是凯伦藻属下最早也是受关注最多的两个种类。资料显示, 1946-1947年在美国佛罗里达西海岸暴发持续了将近11个月的短凯伦藻赤潮, 导致大型鲨鱼及海洋生物死亡, 是历史上最严重的赤潮之一(Steidinger, 2009)。米氏凯伦藻最早于1935年报道自日本海域, 目前已在挪威、新西兰、澳大利亚、南美、北非和中国等海域引发过赤潮, 该种是全球范围内凯伦藻类赤潮的主要肇事种(Oda, 1935; Seki et al, 1995; Sellem et al, 2000; Yang et al, 2004; Mitchell et al, 2007; Li et al, 2019)。
在我国近海, 米氏凯伦藻也是典型的有害赤潮致灾种。自20世纪90年代起, 米氏凯伦藻在我国近海海域(特别在我国东海海域)多次暴发有害赤潮(Lu et al, 2014; Li et al, 2019)。仅2006-2018年间, 在我国沿海报道的米氏凯伦藻赤潮事件超过100起, 其中在2012年尤其严重, 致使养殖鲍鱼大面积死亡, 总经济损失达20.11亿元(Li et al, 2017;中国海洋灾害公报, 2013)。米氏凯伦藻会对鱼类和哺乳动物造成负面影响, 抑制浮游动物的生长发育、摄食和采卵, 从而降低捕食者对其的摄食压力; 并会抑制某些敏感贝类幼体早期发育, 严重时可致其幼体和成体死亡(王朝晖等, 2001;孙军等, 2007; Mitchell et al, 2007;孙科等, 2010; Basti et al, 2015; Lin et al, 2015; Li et al, 2017)。
近年来, 随着研究的深入, 越来越多的凯伦藻种类被分离并鉴定, 多个种类共同形成赤潮的现象也时有发生。如, 在2007-2008年佛罗里达西海岸的短凯伦藻赤潮事件中, 共分离鉴定出4种凯伦藻等, 包括米氏凯伦藻、鞍形凯伦藻(K. selliformis)、蝶形凯伦藻(K. papilionacea)和1种未知凯伦藻(Karenia sp.)(Wolny et al, 2015)。2003年5月在澳大利亚沿岸也曾暴发了一起由5种凯伦藻(K. longicanalis、K. asterichroma及其他3种Karenia spp.)混合组成的赤潮(de Salas et al, 2004)。在我国近海, 复合型凯伦藻赤潮也有发生, 如1998年暴发于香港海域的凯伦藻赤潮, 其优势种为米氏凯伦藻和指沟凯伦藻(K. digitata, 现已修订为指沟卡罗藻Karlodinium digitatum)(Lu et al, 2004)。
溶血毒素是一种结构和成分较为复杂的多成分混合物, 目前已知的组成成分有糖脂类(glycolipids)、糖苷类和多不饱和脂肪酸类化合物、肽类和蛋白质类物质等(刘桂英等, 2015)。1994年Arzul等(1994)首次报道米氏凯伦藻法国株系对鳟鱼红细胞具有溶血活性, 随后研究者发现不同地理株系(英格兰、美国、日本和中国)的米氏凯伦藻对鱼类及陆生哺乳动物红细胞也具有溶血活性(Cho et al, 2017)。已报道具有溶血活性的凯伦藻种类有米氏凯伦藻、协和凯伦藻(K. concordia)和短凯伦藻, 而其他凯伦藻是否具有溶血活性目前尚未见报道(Neely et al, 2016; Tatters et al, 2010; Brand et al, 2012)。
2016年1月1日至2月8日, 在中国香港吐露港海域暴发凯伦藻赤潮, 其主要肇事种为米氏凯伦藻和少量蝶形凯伦藻, 此次赤潮导致大量养殖鱼死亡(渔农自然护理署, 2016)。本文作者从此次赤潮香港吐露港海域以及邻近香港的大鹏湾海域采集的样品中分离出4种凯伦藻(蝶形凯伦藻、鞍形凯伦藻、长沟凯伦藻和米氏凯伦藻)。本文对此4种凯伦藻的混合生长特性和溶血活性进行研究, 比较分析不同凯伦藻混合培养对溶血活性的影响, 旨在探究单一凯伦藻和复合型凯伦藻赤潮溶血活性的差异, 为我国有害赤潮的防治与研究提供理论依据。
1 材料与方法 1.1 实验藻种本实验所用4种凯伦藻分别为蝶形凯伦藻CCHA-12 (Genbank: MT754557)、鞍形凯伦藻CCHA-7 (Genbank: MT754561)、长沟凯伦藻CCHA-9 (Genbank: MT754556)和米氏凯伦藻CCHA-1 (Genbank: MT754546)。蝶形凯伦藻和鞍形凯伦藻为2016年1月底香港赤潮时分离, 米氏凯伦藻和长沟凯伦藻于2016年4月底分离自香港邻近的大鹏湾海域。单细胞克隆培养后, 在电镜及光镜下对其形态观察。藻种保存于暨南大学赤潮与海洋生物学研究中心藻类种质资源库。所有实验在光照培养箱中进行, 培养条件为:培养液为L1培养基, 光照强度为3500-3800lx, 光暗比为12h︰12h, 温度为(20±1)℃。同时, 以东海原甲藻(Prorocentrum donghaiense)为阴性对照藻种(已知东海原甲藻的超声破碎细胞提取液无溶血活性)(周成旭等, 2007)。每个实验组设置3个生物学重复。
1.2 扫描电镜及光学显微镜方法扫描电镜:用浓度为2. 5%戊二醛固定, 4℃冰箱静置12h。然后依次用30%、50%、70%、80%、90%、95%、100% (2次)的乙醇进行梯度脱水, 再经二氧化碳临界点干燥和喷金导电, 最后在扫描电镜观察(wang et al, 2018)。
光学显微镜:通过奥林巴斯正置显微对指数期的藻细胞进行观察, 并采集照片, 使用image - pro Plus 6.0图像采集和分析软件(QImaging, Surrey, BC, Canada)测量细胞长度和宽度(wang et al, 2018)。
1.3 比生长速率计算方法比生长速率μ (单位: /d)计算公式如下:
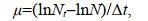 (1)
(1)式中, Nt为培养t天的藻细胞密度; N为起始的藻细胞密度; Δt表示培养时间间隔。
1.4 凯伦藻溶血毒素的提取取指数生长期的凯伦藻藻液, 于倒置显微镜下用细胞计数板统计密度后(表 1), 用以检测单种凯伦藻溶血活性。另外, 将此密度下的4种凯伦藻按照表 2列出的不同混合方式等体积混合, 共培养3天后, 在光学显微镜下根据四种凯伦藻不同形态区分并统计各自密度, 离心收集藻细胞。
| 藻株 | 蝶形凯伦藻 | 鞍形凯伦藻 | 长沟凯伦藻 | 米氏凯伦藻 | 东海原甲藻 |
| 藻密度(×106cells/L) | 2.46 | 3.26 | 1.80 | 4.38 | 35.06 |
| 组别 | 初始凯伦藻密度(×106cells/L) | 总计 | 三天后凯伦藻密度(×106cells/L) | 总计 | |||||||
| 蝶形 凯伦藻 |
鞍形凯 伦藻 |
长沟凯伦藻 | 米氏 凯伦藻 |
蝶形 凯伦藻 |
鞍形 凯伦藻 |
长沟 凯伦藻 |
米氏 凯伦藻 |
||||
| A | \ | 1.63 | \ | 2.19 | 3.82 | \ | 2.40 | \ | 4.25 | 6.65 | |
| B | 1.23 | 1.63 | \ | \ | 2.86 | 2.80 | 1.90 | \ | \ | 4.70 | |
| C | \ | 1.63 | 0.90 | \ | 2.53 | \ | 2.80 | 0.60 | \ | 3.40 | |
| D | \ | \ | 0.90 | 2.19 | 3.09 | \ | \ | 0.70 | 2.50 | 3.20 | |
| E | 1.23 | \ | 0.90 | \ | 2.13 | 6.75 | \ | 2.30 | \ | 9.05 | |
| F | 1.23 | \ | \ | 2.19 | 3.42 | 3.00 | \ | \ | 2.35 | 5.35 | |
| G | \ | 1.09 | 0.60 | 1.46 | 3.15 | \ | 4.05 | 0.40 | 2.40 | 6.85 | |
| H | 0.82 | 1.09 | \ | 1.46 | 3.37 | 1.05 | 0.90 | \ | 1.15 | 3.10 | |
| I | 0.82 | 1.09 | 0.60 | \ | 2.51 | 2.50 | 1.05 | 0.55 | \ | 4.10 | |
| J | 0.82 | \ | 0.60 | 1.46 | 2.88 | 1.65 | \ | 1.15 | 2.15 | 4.95 | |
| K | 0.62 | 0.82 | 0.45 | 1.10 | 2.98 | 2.45 | 2.15 | 0.90 | 2.55 | 8.05 | |
| 注: A-F:两种藻混合; G-J:三种藻混合; K:四种藻混合 | |||||||||||
显微镜计数方法: 1mL藻液加入鲁格氏试剂染色, 然后用漩涡混匀器将其充分混匀, 准确吸取藻液细胞0.1mL, 置于容量为0.1mL、表面积为20mm×20mm的计数框内, 在200倍显微镜下全部计数, 计数3次取其平均值(张士璀等, 1997;周永欣等, 1989)。
溶血毒素提取方法参照Eschbach等(2001), 将收集的藻细胞重悬于400μL缓冲液中, 于超声破碎仪中冰浴破碎(破碎功率10%, 时长5min, 每次脉冲2s, 脉冲间隔1s), 获得细胞破碎液用于溶血毒素提取液。
1.5 凯伦藻溶血活性检测称取8g NaCl、0.2g KCl、3.58g Na2HPO4·12 H2O和0.215g KH2PO4, 溶解至1L高纯水中, 用0.1mol/L HCL盐酸调pH 7.4, 制备成兔血红细胞缓冲液, 储存于4℃冰箱备用。
称取8.775g NaCl、0.238g KCl、0.15g MgSO4、0.551g CaCl2·2H2O和1.476g TRIS溶解至1L高纯水中, 用0.1mol/L HCL盐酸调pH 7.4, 制备成溶血毒素缓冲液, 置于4℃冰箱储存备用。
取购买自蕊特生物公司的EDTA抗凝兔血100mL, 800r/min离心洗涤两次, 每次10min。以兔血缓冲液为溶剂, 配制成0.6%的兔血红细胞溶液。
溶血活性测定参照周成旭等(2007)方法并略有改进。取150μL溶血毒素提取液和150μL 0.6%的兔血红细胞于1.5mL离心管中混匀, 置于20℃, 光照强度为100μmol(m2·s)的条件下反应5h;再于20℃下, 3000r/min, 离心10min, 取上清液于酶标仪414nm处检测其吸光值。每个反应设置3个平行样。
溶血活性计算公式为:
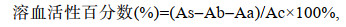 (2)
(2)式中, As: 150μL的溶血毒素提取液与150μL 0.6%的兔血红细胞置于上述条件下反应后的离心上清液的吸光值; Aa: 150μL的溶血毒素的缓冲液与150μL 0.6%的兔血红细胞置于上述条件下相同时间后离心上清液的吸光值; Ab: 150μL的溶血毒素提取液与150μL兔血红细胞缓冲液置于上述条件下相同时间后离心上清液的吸光值; Ac: 150μL TritonX·100与150μL 0.6%兔血红细胞置于上述条件下相同时间后离心上清液的吸光值。
 (3)
(3)使用origin 2018软件绘图, 数据使用SPSS软件ANOVA、LSD功能进行方差分析, 对各实验与对照组均值之间的差异性进行显著性检验。结果表示为平均值±标准偏差。
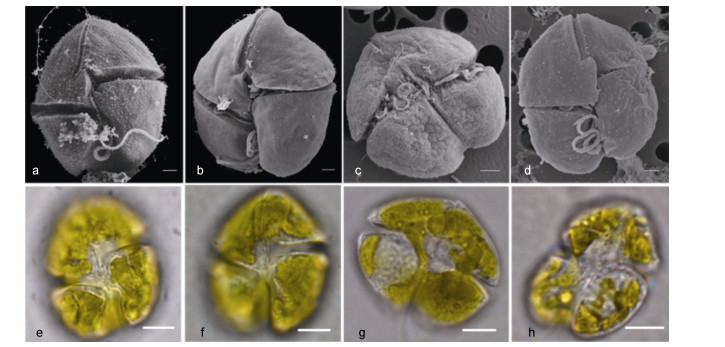
2 结果与分析 2.1 种凯伦藻形态学特征长沟凯伦藻, 单细胞, 细胞长21.7-31.7μm, 宽15.6-26.3μm。细胞呈近圆球形或卵圆形, 背腹扁平程度低, 上下壳部均呈现半球形。顶沟长, 腹面达到横沟上边缘之下。上壳部具有放射状的犁沟, 纵沟在上壳部具有指状入侵(图 1a, 1e)。
 |
|
图 1 四种凯伦藻形态照片 Fig. 1 The images of strains of four Karenia species 注: a、e:长沟凯伦藻; b、f:米氏凯伦藻; c、g:蝶形凯伦藻; d、h:鞍形凯伦藻。 a-d为四种凯伦藻电镜照片, 比例尺=2μm; e-h为四种凯伦藻扫描光镜照片, 比例尺=10μm。 |
米氏凯伦藻, 单细胞, 细胞长15.6-31.2μm, 宽13.2-24μm。细胞背腹面呈近宽卵圆形, 背腹略显扁平, 上锥部为半球形或略宽的圆锥形。纵沟入侵上壳部呈指状。顶沟平直, 其顶端有一个缺口(图 1b, 1f)。
蝶形凯伦藻, 单细胞, 长18-32μm, 宽18-48μm, 长宽比约为1︰1, 部分细胞宽大于长。细胞背腹扁平, 上顶端突出形成龙骨突状, 下壳部腹面凹进, 背面凸起, 两裂片状(图 1c, 1g)。
鞍形凯伦藻, 单细胞, 细胞平均长20-30μm, 宽16-30μm。上壳部扁平, 半圆形或圆锥形, 顶端不突出, 无龙骨突。下壳部底部不平截, 中央凹陷深, 底端两裂片呈马鞍形(图 1d, 1h)。
2.2 凯伦藻比生长速率及种间作用取培养3天的不同凯伦藻混合组藻液, 于显微镜下镜检细胞密度, 结果如表 2所示。培养3天后各组藻密度均维持在106cells/L左右, 但未达到107cells/L。分析发现, 当两种不同的凯伦藻进行混合培养时存在种间相互作用:长沟凯伦藻会抑制米氏凯伦藻和鞍形凯伦藻生长, 促进蝶形凯伦藻的生长(图 2a); 蝶形凯伦藻会抑制米氏凯伦藻和鞍形凯伦藻生长(图 2b); 鞍形凯伦藻会抑制长沟凯伦藻生长, 对米氏凯伦藻和蝶形凯伦藻生长无明显影响(图 2c); 米氏凯伦藻抑制长沟凯伦藻生长, 微弱地抑制鞍形凯伦藻生长, 而对蝶形凯伦藻生长无明显的影响(图 2d)。
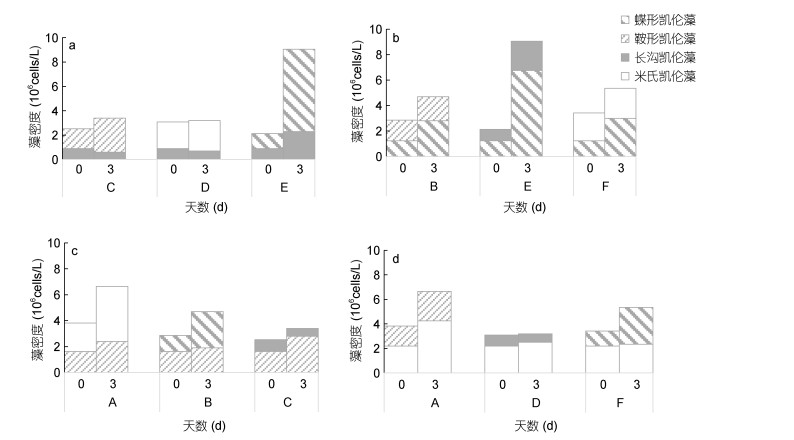 |
| 图 2 四种凯伦藻对其他藻化感作用 Fig. 2 The allelopathic effects of four species of Karensis on other algae |
对各实验组的比生长速率进行分析, 结果表明, 4种凯伦藻按照不同组合混合3天的平均比生长速率差异较大, 混合组内凯伦藻间存在种间相互影响。比生长速率最高组为E混合组(0.48/d), 其次为G组和K组, 分别为0.26和0.29/d。各凯伦藻比生长速率范围为:米氏凯伦藻-0.21-0.22/d、蝶形凯伦藻-0.05- 0.58/d、长沟凯伦藻-0.27-0.31/d、鞍形凯伦藻-0.20- 0.30/d。其中E组内的蝶形凯伦藻生长速率为0.58/d, 高于其单种指数生长期平均生长速率(0.48/d), 说明蝶形凯伦藻与长沟凯伦藻混合后提高其比生长速率。混合组H的比生长速率为-0.03/d, 混合组内的米氏凯伦藻(-0.21/d), 鞍形凯伦藻(-0.20/d)和蝶形凯伦藻(-0.05/d), 比生长速率为负值, 说明混合3天后三种藻的细胞密度都比初始值低, 3种凯伦藻间存在相互抑制作用(表 3)。
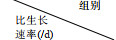
|
单种藻 | 混合藻 | ||||||||||
| A | B | C | D | E | F | G | H | I | J | K | ||
| 鞍形凯伦藻 | 0.53 | 0.13 | 0.05 | 0.18 | \ | \ | \ | 0.3 | -0.2 | -0.15 | \ | 0.09 |
| 长沟凯伦藻 | 0.49 | \ | \ | -0.14 | -0.08 | 0.31 | \ | -0.27 | \ | -0.16 | 0.08 | 0 |
| 蝶形凯伦藻 | 0.48 | \ | 0.27 | \ | \ | 0.57 | 0.3 | \ | -0.05 | 0.07 | 0.1 | 0.05 |
| 米氏凯伦藻 | 0.51 | 0.22 | \ | \ | 0.04 | \ | 0.02 | 0.03 | -0.21 | \ | -0.01 | 0.05 |
| 平均比生长速率 | \ | 0.18 | 0.17 | 0.1 | 0.01 | 0.48 | 0.15 | 0.26 | -0.03 | 0.07 | 0.18 | 0.29 |
4种凯伦藻单独培养时与对照组(海水组、东海原甲藻组)相比, 表现出明显的溶血活性。4种凯伦藻的溶血活性百分数从高到低依次为长沟凯伦藻(46.36%±1.02%), 鞍形凯伦藻(42.33%±0.66%), 米氏凯伦藻(37.81%±0.82%)和蝶形凯伦藻(37.02%± 0.64%)(图 3)。本研究的米氏凯伦藻大鹏湾株的溶血活性(0.33×104cells/mL)与中国福建株系(1.2×104cells/mL)和日本(Suo Nada)株系对兔血的溶血活性相近, 为37.81%±0.82% (表 4)。
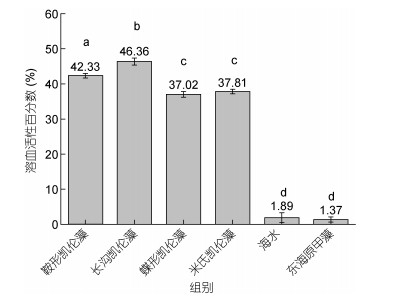 |
| 图 3 四株凯伦藻的溶血活性及每细胞溶血活性 Fig. 3 Hemolytic activity of four Karenia species 注: a、b、c、d表示组之间具有显著差异, P≤0.05 |
| 藻种名 | 分离地点 | 对兔血溶血活性 | 密度(104cells/mL) | 引用 |
| 米氏凯伦藻 | 日本Fukuoka Bay | 无溶血活性 | 4-5 | Zou et al, 2010 |
| 米氏凯伦藻 | 日本Suo Nada | 39% | 8-10 | Zou et al, 2010 |
| 米氏凯伦藻 | 日本Hiroshima Bay | 10%-20% | 0.02 | Cho et al, 2017 |
| 米氏凯伦藻 | 日本Kyushu Island | 70% | 2 | Kim et al, 2020 |
| 米氏凯伦藻 | 中国福建海域 | 38.67%±10.69 52.44%±2.67 | 1.2 3.8 | Li et al, 2017 |
| 米氏凯伦藻 | 中国深圳大鹏湾海域 | 37.81%±0.82% | 0.326 | 本文 |
| 鞍形凯伦藻 | 中国香港海域 | 42.33%±0.66% | 0.246 | 本文 |
| 长沟凯伦藻 | 中国深圳大鹏湾海域 | 46.36%±1.02% | 0.180 | 本文 |
| 蝶形凯伦藻 | 中国香港海域 | 37.02%±0.64% | 0.438 | 本文 |
与对照组相比, 两种凯伦藻共培养实验组(A-F组)均表现出溶血活性。溶血活性最高的前三组依次为D组(长沟凯伦藻与米氏凯伦藻共培养)、C组(长沟凯伦藻与鞍形凯伦藻共培养)和B组(长沟凯伦藻与蝶形凯伦藻共培养), 溶血活性依次为56.54%±1.49%、56.44%±1.09%和53.70%±1.13%。三种凯伦藻共培养实验组(G-J组)的溶血活性百分数与对照组相比均有显著差异, 其中G组(长沟凯伦藻、鞍形凯伦藻、米氏凯伦藻)和I组(长沟凯伦藻、鞍形凯伦藻、蝶形凯伦藻)溶血活性超过50% (分别为52.49%±0.62%和50.57%±0.73%)。四种凯伦藻混合组(K组)测得的溶血活性溶血百分数为57.05%±1.13% (图 4)。
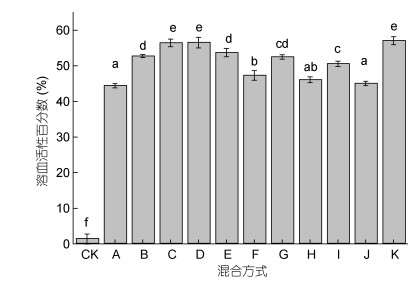 |
| 图 4 混合组凯伦藻溶血活性 Fig. 4 Hemolytic activity of four Karenia species mixed 注: CK为东海原甲藻组, 不同小写字母(a-f)表示组间具有显著差异, P≤0.05 |
每细胞溶血活性计算结果表明, 4种凯伦藻单一培养时每细胞活性从高到低为长沟凯伦藻 > 蝶形凯伦藻 > 鞍形凯伦藻 > 米氏凯伦藻, 每细胞溶血活性分别为2.58、1.51、1.30和0.86×10–3%/cell。混合后每细胞溶血活性百分数为(0.59-1.77)×10–3%/cell, 与单种相比表现出下降的趋势。混合组D组(长沟凯伦藻和米氏凯伦藻)每细胞溶血活性最高, 为1.77× 10–3%/cell, E组(长沟凯伦藻和蝶形凯伦藻)每细胞溶血活性最低, 为0.59×10–3%/cell。4种凯伦藻间相互混合能够增加对兔血的溶血活性, 但不会提高单位细胞溶血活性(图 5)。
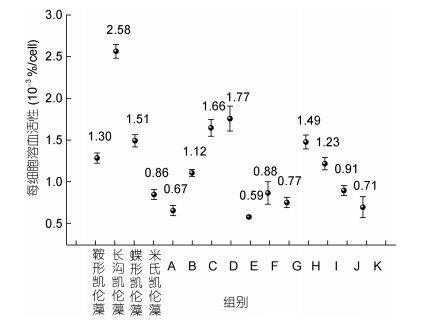 |
| 图 5 不同混合方式凯伦藻每细胞溶血活性 Fig. 5 Hemolytic activity per cell of Karenia species in different mixing methods |
赤潮是海洋中某种或某几种生物在短时间内大量聚集或者异常增殖而引起海水变色的现象, 其归根结底是赤潮优势种在各种理化条件下获得竞争优势, 从而占据生态位的过程。赤潮生物种群演替也是赤潮生物之间的种间竞争的结果。海洋微藻通过产生胞外活性物质参与种间竞争(化感作用), 进而间接实现藻类与其他生物类群之间、藻类不同种群间的相互作用, 从而影响藻类群落的组成、演替和平衡。藻类的化感作用可能是促使其形成赤潮的动力学的机制之一(Smayda, 1997; Legrand et al, 2003)。研究报道, 大约有40种有毒有害浮游藻类(海洋和淡水种类)对其它藻类存在化感作用(Granéli et al, 2008; Poulin et al, 2018)。本研究中分离自中国南海的4种凯伦藻相互间都具有化感作用, 并存在种间差异。其中鞍形凯伦藻和米氏凯伦藻分别与长沟凯伦藻混合时, 都会抑制长沟凯伦藻的生长(比生长速率分别为-0.14和-0.08/d); 蝶形凯伦藻与长沟凯伦藻混合时, 蝶形凯伦藻的比生长速率高于单种藻平均生长速率, 可见长沟凯伦藻促进其生长。3种凯伦藻混合组内种间也有相互抑制生长的化感作用, 其中鞍形凯伦藻、蝶形凯伦藻和长沟凯伦藻混合组的抑制作用最明显, 比生长速率都为负值。
实验室研究发现, 同一种藻可对不同藻类产生化感作用。如, 米氏凯伦藻与东海原甲藻, 塔玛亚历山大藻(Alexandrium tamarense), 中肋骨条藻(Skeletonema costatum), 球等鞭金藻(Isochrysis galbana), 杜氏藻(Dunaliella tertiolecta)等藻类共培养时会抑制其生长(Gentien et al, 1990; Uchida et al, 1999; Yang et al, 2011; He et al, 2016)。同一种藻对其他不同藻类的化感作用具有种间差异。如, 新月筒柱藻(Cylindrotheca clostetium)会抑制东海原甲藻生长, 但对心形原甲藻(Prorocentrum cordatum), 球等鞭金藻和旋链角毛藻(Chaetoceros curvisetus)化感作用不明显(Xu et al, 2019)。短凯伦藻会抑制假微海链藻(Thalassiosira pseudonana)生长, 但对冰河拟星杆藻(Asterionellopsis glacialis)的化感作用不明显(Poulson-Ellestad et al, 2014)。进一步研究发现, 即便同一株系对同一种藻的化感作用也是可变的。Poulin等(2018)对短凯伦藻5个不同的株系(CCMP 2228, CCMP 2229, CCMP 2281, TxB3, TxB4)开展化感作用研究, 5个株系的短凯伦藻对冰河拟星杆藻的化感作用是高度可变, 同一株系可以强烈抑制冰河拟星杆藻生长或无化感作用或极其微弱的促进作用, 研究还表明这种化感作用的可变性与短凯伦藻的几种代谢物浓度相关。
溶血毒素被认为是凯伦藻赤潮引起海洋鱼类及其他海洋生物的大量死亡的主要原因之一(Li et al, 2017, 2019)。海洋藻类溶血毒素是其次生代谢的产物, 该类物质种类繁多, 结构和成分复杂。已明确具有溶血活性的凯伦藻类有米氏凯伦藻、短凯伦藻和鞍形凯伦藻(Tatters et al, 2010; Brand et al, 2012)。其中米氏凯伦藻溶血毒素包括两种糖脂类物质(monogalactosyl diacylglycerol和digalactosyl diacylglycerol)和一种脂类物质(octadecapentaenoic acid)(Parrish et al, 1998)。本研究结果表明, 分离于中国南海海域的4种凯伦藻对兔血细胞都具有溶血活性, 其中蝶形凯伦藻和长沟凯伦藻的溶血活性为首次报道。海洋微藻引起的溶血活性及鱼毒性与多聚不饱和脂肪酸(Polyunsaturated fatty acids, PUFA)相关, 研究发现米氏凯伦藻中分离的PUFA具有溶血活性, 而蝶形凯伦藻和伞辐凯伦藻(K. umbrella)(现修订为长沟凯伦藻)也能产生PUFA, 这可能是它们具有溶血活性的原因(Yasumoto et al, 1990; Fu et al, 2004; Hyun et al, 2016; Wang et al, 2018)。在本研究中, 长沟凯伦藻的溶血活性在四种凯伦藻中溶血活性最高, 且在每种混合培养方式中(两种、三种、四种混合培养), 溶血活性最高的混合组皆为含有长沟凯伦藻的组。但目前尚未有长沟凯伦藻可产毒素的报道, 也没有表明对人类有伤害, 仅对鱼有致死现象(Brand et al, 2012)。
不同株系的米氏凯伦藻的溶血活性存在差异, 同一株系对不同生物红细胞的溶血活性也存在差异(Zou et al, 2010)。本研究的深圳大鹏湾株的米氏凯伦藻溶血活性为37.81%与中国福建海域株系(1.2×104cell/L)对兔血的溶血活性(38.67%)相近(Li et al, 2017)。米氏凯伦藻英国株系和美国德州株系对红鱼(Sciaenops ocellatus)血细胞的溶血活性约为50%对分离于日本不同海湾的6株米氏凯伦藻溶血活性研究发现, 其中3株对兔血无溶血活性, 而另外3株对兔血的溶血活性差异较大分别为10%-20%、39%及70% (Zou et al, 2010; Cho et al, 2017; Kima et al, 2020)。Yang等(2011)研究发现, 米氏凯伦藻与东海原甲藻、塔玛亚历山大藻混合培养后, 会增加米氏凯伦藻溶血活性。同样, 本研究结果表明, 4种凯伦藻相互混合培养后其溶血活性相对于单种凯伦藻会有显著增加, 其中4种凯伦藻共培养的溶血活性溶血最高。
据统计, 1934-2018年全球有明确记录的米氏凯伦藻赤潮事件有87起, 其中导致鱼类死亡的34件, 导致贝类死亡的有13件, 导致其他生物死亡的有10件, 无报道生物死亡的有49件(Li et al, 2019)。凯伦藻个体小, 不同种藻细胞形态差异小, 在光学显微镜下很难区别。因此, 在野外条件下常常无法准确判定赤潮肇事种为某一凯伦藻还是多种凯伦藻混合, 故也难以判定赤潮灾害是由单一藻种还是混合藻种所致。2007年9月至2008年1月, 美国佛罗里达州东海岸暴发了一次以短凯伦藻为主并混合其他4种凯伦藻的赤潮, 研究人员从海域养殖贝壳中检测出神经性贝类毒素(neurotoxic shellfish poisoning), 并且赤潮过程中导致鱼类死亡及人类呼吸系统疾病等(Wolny et al, 2015)。2019年5月我国福建海域暴发以东海原甲藻和“米氏凯伦藻”为主要肇事种的赤潮, 该赤潮导致2700万人民币损失(中国海洋灾害公报, 2020), 而对赤潮优势种进一步分析发现, 此次赤潮的肇事种以指沟卡罗藻和东海原甲藻为主, 同时混有蝶形凯伦藻及其他凯伦藻科种类(Cen et al, 2020)。结合本研究结果--米氏凯伦藻、鞍形凯伦藻、蝶形凯伦藻和长沟凯伦藻4种凯伦藻, 不论是两种、还是三种、四种共同培养时, 溶血活性都显著高于单一藻种, 可见, 混合型凯伦藻赤潮的致灾效应更为严重, 其成灾机制还需进一步深入研究。
4 结论对分离于中国南海的4种凯伦藻(蝶形凯伦藻、鞍形凯伦藻、长沟凯伦藻和米氏凯伦藻)进行种间作用和溶血活性研究表明, 该4种凯伦藻均对兔血均具有溶血活性; 该4种凯伦藻不论是两种、还是三种、四种共同培养时, 溶血活性都显著高于单一藻种。混合培养时, 凯伦藻存在种间相互作用, 长沟凯伦藻会促进蝶形凯伦藻的生长, 鞍形凯伦藻和米氏凯伦藻会抑制长沟凯伦藻生长。
王朝晖, 尹伊伟, 齐雨藻, 等. 2001. 珠海桂山岛米氏裸甲藻赤潮对鱼鳃损伤的病理学组织观察. 海洋学报, 23(1): 133-138 |
中国海洋灾害公报, 2013.2012年中国海洋灾害公报.中华人民共和国自然资源部. http://gc.mnr.gov.cn/201806/t20180619_1798016.html
|
中国海洋灾害公报, 2020.2019年中国海洋灾害公报.中华人民共和国自然资源部. http://gi.mnr.gov.cn/202004/t20200430_2510979.html
|
刘桂英, 葛坤, 宋伦, 等. 2015. 米氏凯伦藻的研究进展. 海洋科学, 39(9): 117-122 |
孙军, 宋书群, 徐兆礼, 等. 2007. 东海米氏凯伦藻水华中中华哲水蚤的选择性摄食. 海洋与湖沼, 38(6): 536-541 |
孙科, 颜天, 周名江, 等. 2010. 米氏凯伦藻对褶皱臂尾轮虫、卤虫和黑褐新糠虾存活的影响. 海洋科学, 34(9): 76-81 |
张士璀, 马军英, 范晓. 1997. 海洋生物技术原理和应用. 北京: 海洋出版社, 96-100
|
周永欣, 章宗涉. 1989. 水生生物毒性试验方法. 北京: 农业出版社, 170-190
|
周成旭, 傅永静, 严小军. 2007. 4种典型有害赤潮原因种的溶血特性研究. 生态毒理学报, 2(1): 78-82 |
俞志明, 陈楠生. 2019. 国内外赤潮的发展趋势与研究热点. 海洋与湖沼, 50(3): 474-486 |
渔农自然护理署, 2016. http://redtide.afcd.gov.hk/index_tc.html?mode=0
|
Arzul G, Gentien P, Crassous M P, 1994. A haemolytic test to assay toxins excreted by the marine dinoflagellate Gyrodinium cf. Aureolum. Water Research, 28(4): 961-965 DOI:10.1016/0043-1354(94)90105-8 |
Baden D G, 1989. Brevetoxins:unique polyether dinoflagellate toxins. The FASEB Journal, 3(7): 1807-1817 DOI:10.1096/fasebj.3.7.2565840 |
Baden D G, Mende T J, Block R E, 1979. Two similar toxins isolated from Gymnodinium breve. In: Toxic Dinoflagellate Blooms. New York: Elsevier, 327-334
|
Basti L, Nagai S, Go J et al, 2015. Differential inimical effects of Alexandrium spp. and Karenia spp. on cleavage, hatching, and two larval stages of Japanese pearl oyster Pinctada fucata martensii. Harmful Algae, 43: 1-12 DOI:10.1016/j.hal.2014.12.004 |
Brand L E, Campbell L, Bresnan E, 2012. Karenia:The biology and ecology of a toxic genus. Harmful Algae, 14: 156-178 DOI:10.1016/j.hal.2011.10.020 |
Cen J Y, Wang J Y, Huang L F et al, 2020. Who is the "murderer" of the bloom in coastal waters of Fujian, China, in 2019?. Journal of Oceanology and Limnology, 38(3): 722-732 DOI:10.1007/s00343-019-9178-6 |
Cho K, Kasaoka T, Ueno M et al, 2017. Haemolytic activity and reactive oxygen species production of four harmful algal bloom species. European Journal of Phycology, 52(3): 311-319 DOI:10.1080/09670262.2017.1286525 |
de Salas M F, Bolch C J S, Hallegraeff G M, 2004. Karenia umbella sp. nov. (Gymnodiniales, Dinophyceae), a new potentially ichthyotoxic dinoflagellate species from Tasmania, Australia. Phycologia, 43(2): 166-175 DOI:10.2216/i0031-8884-43-2-166.1 |
Eschbach E, Scharsack J P, John U et al, 2001. Improved erythrocyte lysis assay in microtitre plates for sensitive detection and efficient measurement of haemolytic compounds from ichthyotoxic algae. Journal of Applied Toxicology, 21(6): 513-519 DOI:10.1002/jat.797 |
Fu M, Koulman A, van Rijssel M et al, 2004. Chemical characterisation of three haemolytic compounds from the microalgal species Fibrocapsa japonica (Raphidophyceae). Toxicon, 43: 355-363 DOI:10.1016/j.toxicon.2003.09.012 |
Gentien P, Arzul G, 1990. Exotoxin production by Gyrodinium Cf. aureolum (Dinophyceae). Journal of the Marine Biological Association of the United Kingdom, 70(3): 571-581 DOI:10.1017/S0025315400036596 |
Granéli E, Weberg M, Salomon P S, 2008. Harmful algal blooms of allelopathic microalgal species:The role of eutrophication. Harmful Algae, 8(1): 94-102 |
Haywood A J, Steidinger K A, Truby E W et al, 2004. Comparative morphology and molecular phylogenetic analysis of three new species of the genus Karenia (Dinophyceae) from New Zealand. Journal of Phycology, 40(1): 165-179 DOI:10.1111/j.0022-3646.2004.02-149.x |
He D, Liu J, Hao Q et al, 2016. Interspecific competition and allelopathic interaction between Karenia mikimotoi and Dunaliella salina in laboratory culture. Chinese Journal of Oceanology and Limnology, 34(2): 301-313 DOI:10.1007/s00343-016-4320-1 |
Hyun B, Ju S J, Ko A R et al, 2016. Thermal effects on the growth and fatty acid composition of four harmful algal bloom species:Possible implications for ichthyotoxicity. Ocean Science Journal, 51(3): 333-342 DOI:10.1007/s12601-016-0029-5 |
Kim D, Li W C, Matsuyama Y et al, 2020. Strain-dependent lethal effects on abalone and haemolytic activities of the dinoflagellate Karenia mikimotoi. Aquaculture, 520: 734953 DOI:10.1016/j.aquaculture.2020.734953 |
Legrand C, Rengefors K, Fistarol G O et al, 2003. Allelopathy in phytoplankton-biochemical, ecological and evolutionary aspects. Phycologia, 42(4): 406-419 DOI:10.2216/i0031-8884-42-4-406.1 |
Lin J N, Song J J, Yan T et al, 2015. Large-scale dinoflagellate bloom species Prorocentrum donghaiense and Karenia mikimotoi reduce the survival and reproduction of copepod Calanus sinicus. Journal of the Marine Biological Association of the United Kingdom, 95(6): 1071-1079 DOI:10.1017/S0025315415000533 |
Li X D, Yan T, Lin J N et al, 2017. Detrimental impacts of the dinoflagellate Karenia mikimotoi in Fujian coastal waters on typical marine organisms. Harmful Algae, 61: 1-12 DOI:10.1016/j.hal.2016.11.011 |
Li X D, Yan T, Yu R C et al, 2019. A review of Karenia mikimotoi:bloom events, physiology, toxicity and toxic mechanism. Harmful Algae, 90: 101702 DOI:10.1016/j.hal.2019.101702 |
Lu D D, Qi Y Z, Gu H F et al, 2014. Causative species of harmful algal blooms in Chinese coastal waters. Algological Studies, 145-146(1): 145-168 |
Lu S H, Hodgkiss I J, 2004. Harmful algal bloom causative collected from Hong Kong waters. Hydrobiologia, 512(1-3): 231-238 DOI:10.1023/B:HYDR.0000020331.75003.18 |
Mitchell S, Rodger H, 2007. Pathology of wild and cultured fish affected by a Karenia mikimotoi bloom in Ireland. Bulletin-European Association of Fish Pathologists, 27(1): 39-42 |
Mooney B D, Nichols P D, de Salas M F et al, 2007. Lipid, Fatty acid, and sterol composition of eight species of Kareniaceae (Dinophyta):Chemotaxonomy and Putative lipid phycotoxins. Journal of Phycology, 43(1): 101-111 DOI:10.1111/j.1529-8817.2006.00312.x |
Neely T, Campbell L, 2006. A modified assay to determine hemolytic toxin variability among Karenia clones isolated from the Gulf of Mexico. Harmful Algae, 5(5): 592-598 DOI:10.1016/j.hal.2005.11.006 |
Oda M, 1935. The red tide of Gymnodinium mikimotoi sp. (MS) and the efect of mtefing copper sulphate to prevent the growth of it. Dobutsugaku Zasshi, Zoolological Society of Japan,, 47(555): 35-48
|
Parrish C C, Bodennec G, Gentien P, 1998. Haemolytic glycoglycerolipids from gymnodinium species. Phytochemistry, 47(5): 783-787 DOI:10.1016/S0031-9422(97)00661-4 |
Poulin R X, Poulson-Ellestad K L, Roy J S et al, 2018. Variable allelopathy among phytoplankton reflected in red tide metabolome. Harmful Algae, 71: 50-56 DOI:10.1016/j.hal.2017.12.002 |
Poulson-Ellestad K L, Jones C M, Roy J et al, 2014. Metabolomics and proteomics reveal impacts of chemically mediated competition on marine plankton. Proceedings of the National Academy of Sciences of the United States of America, 111(24): 9009-9014 DOI:10.1073/pnas.1402130111 |
Seki T, Masayuki S, Mackenzie L et al, 1995. Gymnodimine, a new marine toxin of unprecedented structure isolated from New Zealand oysters and the dinoflagellate, Gymnodinium sp.. Tetrahedron Letters, 36(39): 7093-7096 DOI:10.1016/0040-4039(95)01434-J |
Sellem F, Pesando D, Bodennec G et al, 2000. Toxic effects of Gymnodinium cf. mikimotoi unsaturated fatty acids to gametes and embryos of the sea urchin Paracentrotus lividus. Water Research, 34(2): 550-556 DOI:10.1016/S0043-1354(99)00181-5 |
Smayda T J, 1997. Harmful algal blooms:Their ecophysiology and general relevance to phytoplankton blooms in the sea. Limnology and Oceanography, 42: 1137-1153 DOI:10.4319/lo.1997.42.5_part_2.1137 |
Steidinger K A, 2009. Historical perspective on Karenia brevis red tide research in the Gulf of Mexico. Harmful Algae, 8(4): 549-561 DOI:10.1016/j.hal.2008.11.009 |
Tatters A O, Muhlstein H I, Tomas C R, 2010. The hemolytic activity of Karenia selliformis and two clones of Karenia brevis throughout a growth cycle. Journal of Applied Phycology, 22(4): 435-442 DOI:10.1007/s10811-009-9476-z |
Uchida T, Toda S, Matsuyama Y et al, 1999. Interactions between the red tide dinoflagellates Heterocapsa circularisquama and Gymnodinium mikimotoi in laboratory culture. Journal of Experimental Marine Biology and Ecology, 241(2): 285-299 DOI:10.1016/S0022-0981(99)00088-X |
Wang J Y, Cen J Y, Li S et al, 2018. A re-investigation of the bloom-forming unarmored dinoflagellate Karenia longicanalis (syn. Karenia umbella) from Chinese coastal waters. Journal of Oceanology and Limnology, 36(6): 2202-2215 DOI:10.1007/s00343-019-7191-4 |
Wolny J L, Scott P S, Tustison J et al, 2015. Monitoring the 2007 Florida east coast Karenia brevis (Dinophyceae) red tide and neurotoxic shellfish poisoning (NSP) event. Algae, 30(1): 49-58 DOI:10.4490/algae.2015.30.1.049 |
Xu W J, Wang J T, Tan L J et al, 2019. Variation in allelopathy of extracellular compounds produced by Cylindrotheca closterium against the harmful-algal-bloom dinoflagellate Prorocentrum donghaiense. Marine Environmental Research, 148: 19-25 DOI:10.1016/j.marenvres.2019.05.005 |
Yang W D, Zhang N S, Cui W M et al, 2011. Effects of co-existing microalgae and grazers on the production of hemolytic toxins in Karenia mikimotoi. Chinese Journal of Oceanology and Limnology, 29(6): 1155-1163 DOI:10.1007/s00343-011-0274-5 |
Yang Z B, Hodgkiss I J, 2004. Hong Kong's worst "red tide"-causative factors reflected in a phytoplankton study at Port Shelter station in 1998. Harmful Algae, 3(2): 149-161 |
Yasumoto T, Underdal B, Aune T et al, 1990. Screening for hemolytic and ichthyotoxic components of Chrysochromulina polylepis and Gyrodinium aureolum from Norwegian coastal waters. In: Graneli E, Sundstrom B, Edler L et al eds. Toxic Marine Phytoplankton. New York: Elsevier, 436-440
|
Zou Y, Yamasaki Y, Matsuyama Y et al, 2010. Possible involvement of hemolytic activity in the contact-dependent lethal effects of the dinoflagellate Karenia mikimotoi on the rotifer Brachionus plicatilis. Harmful Algae, 9(4): 367-373 DOI:10.1016/j.hal.2010.01.005 |
 2020, Vol. 51
2020, Vol. 51


