中国海洋湖沼学会主办。
文章信息
- 董晨帆, 吴海燕, 李清云, 顾海峰, 谭志军. 2020.
- DONG Chen-Fan, WU Hai-Yan, LI Qing-Yun, GU Hai-Feng, TAN Zhi-Jun. 2020.
- 栉孔扇贝对氮杂螺环酸毒素代谢解毒的生理应激响应
- PHYSIOLOGICAL RESPONSE OF SCALLOP CHLAMYS FARRERI TO THE METABOLIC DETOXIFICATION OF AZASPIRACIDS
- 海洋与湖沼, 51(6): 1422-1431
- Oceanologia et Limnologia Sinica, 51(6): 1422-1431.
- http://dx.doi.org/10.11693/hyhz20200200037
文章历史
-
收稿日期:2020-02-07
收修改稿日期:2020-03-20
2. 农业部水产品质量安全检测与评价重点实验室 中国水产科学研究院黄海水产研究所 青岛 266071;
3. 自然资源部第三海洋研究所 厦门 361005
2. Key Laboratory of Testing and Evaluation for Aquatic Product Safety and Quality, Ministry of Agriculture; Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao 266071, China;
3. Third Institute of Oceanography, MNR, Xiamen 361005, China
氮杂螺环酸毒素(Azaspiracid, AZAs)是1995年在欧洲发现的一类具有独特螺环结构的含氮聚醚类毒素(McMahon et al, 1995), 由甲藻(Azadinium)类腹孔环胺藻属产生(Tillmann et al, 2009)。研究发现, AZAs极易在海洋贝类中蓄积, 且会导致消费者出现呕吐、腹泻等不良症状, 其与腹泻性贝类毒素诱发的症状相似, 但毒性更强(James et al, 2002)。因此, 欧盟针对AZAs建立了160.0μg AZA1 eq/kg的限量标准并被多个国家采用(McCarron et al, 2009), 而我国还未设立该毒素的限量标准。但是, 我国沿海地区已陆续发现20多种腹孔环胺藻, 且超过86%的藻株可产AZAs, 分布范围基本覆盖我国四大近海海域(Gu et al, 2013; Krock et al, 2014)。近年调查发现, 我国广州及大连等地采集的贝类中已检测到AZAs残留, 其中尤以北黄海和渤海区域主产的栉孔扇贝中AZAs检出情况最为普遍, 且部分样品中AZAs含量超过欧盟限量, 表明AZAs已成为影响我国栉孔扇贝等海洋贝类安全的新风险因子。
AZAs进入到贝体后, 通过分布、代谢及消除作用, 形成终端代谢产物并决定其安全风险大小(Jauffrais et al, 2013)。而作为一个外源毒素, AZAs在贝类中的代谢不仅对宿主直接产生危害, 而且还可以诱导产生过量的活性氧自由基, 从而对宿主贝类造成氧化胁迫毒性(Ji et al, 2018)。研究发现, 为了最大化消除AZAs代谢过程中对自身的危害, 宿主贝类除了通过醛酸化、谷胱甘肽等途径加速消除AZAs残留水平, 还会加速清除过量活性氧自由基以尽快恢复体内氧化还原态势。在自由基清除方面, 贝类主要依赖其先天免疫系统, 主要包括细胞吞噬与凋亡和抗氧化系统应激。其中血细胞主要发挥吞噬作用, 在消除外源危害的同时也会诱导新自由基的产生(Canesi et al, 2002; Ellis et al, 2011)。随后, 贝类进入第二阶段的抗氧化作用, 主要通过激活抗氧化系统酶活以清除自由基。有学者研究发现, AZAs可诱导扇贝和贻贝中的SOD活性(Ji et al, 2018), 但该毒素对其免疫系统的抗氧化作用还未见系统报道, 限制了对于AZAs在贝类中代谢诱导的氧化胁迫毒性机制必要的科学认知。
因此, 本实验以分离自我国南海的一株产AZAs的腹孔环胺藻属(A. poporum, AZDY06株)为研究对象(Gu et al, 2013), 以目前我国AZAs残留严重的栉孔扇贝(C. farreri)为受试动物, 采用实验室暴露的方式, 研究了AZAs在栉孔扇贝代谢过程中, 栉孔扇贝血细胞数量及关键酶抗氧化活性的变化, 并通过对这一过程中栉孔扇贝靶组织细胞超微结构的变化, 解析栉孔扇贝对AZAs氧化胁迫的应激效应。期望通过该研究, 科学评价AZAs对栉孔扇贝产生的次生毒害效应及其应激机理, 为下一步建立生态和食品安全风险评价技术提供科学依据。
1 材料与方法 1.1 实验材料自然资源部第三海洋研究所提供实验所需AZDY06株产毒藻, 以液相色谱-串联质谱法测得该株产毒藻主产AZA2, 检出限10μg/kg (S/N=3)。实验室以f/2培养液, 温度(20±1)℃, 光照6000lx, 光暗比12h︰12h的条件进行单种培养(吴海燕等, 2017)。并以同样条件培养饵料藻三角褐指藻(Phaeodactylum tricornutum)。
以经测定未受AZAs污染的、产自青岛市胶南灵山湾养殖海域的2龄栉孔扇贝为实验动物, 其平均贝肉湿重为(13.9±1.1)g, 壳长(66.5±0.8)mm, 壳宽(59.3±1.1)mm, 壳高(18.9±1.0)mm。以(16±1)℃水温, 不间断充气暂养两天, 不投喂饵料藻, 之后用于实验。
实验所需酶活试剂盒均购买于南京建成生物工程公司。实验用NaH2PO4·H2O、EDTA、冰乙酸、NaCl、KH2PO4、KCl、Na2HPO4·2H2O和Na2HPO4等试剂均购买于国药集团化学试剂有限公司, 均为优级纯。实验用主要仪器为Q-Exactive四级杆静电场轨道阱高分辨质谱仪、日本岛津公司的紫外可见分光光度计, 型号UV2550。
1.2 实验方法 1.2.1 栉孔扇贝暴露实验随机选取共240只栉孔扇贝平均分为4组, 放置在各盛有30L海水的8个养殖容器中进行实验。实验持续30天, 主要分为两个阶段, 包括蓄积阶段6天, 代谢阶段24天。实验均采用等生物量的方式进行, 其中对照组全过程投喂饵料藻, 实验组暴露阶段投喂方式分别为:
(1) 低暴露组:产毒藻AZDY06密度为1.0× 107cells/(ind.·d), 并以饵料藻补足生物量;
(2) 中暴露组:产毒藻AZDY06密度为2.0× 107cells/(ind.·d), 并以饵料藻补足生物量;
(3) 高暴露组:产毒藻AZDY06密度为4.0× 107cells/(ind.·d), 并以饵料藻补足生物量。
在投喂AZDY06后12h采样镜检以确认藻细胞是否全部被摄食。暴露实验结束后, 全部投喂等生物量小球藻直至实验结束。分别在实验过程中的0.5、1、3、5、6、7、10、14、18、22、26、30d分别采样。每次随机取4只贝, 清除其污泥和寄生物, 并测量其贝肉湿重与壳长、壳宽、壳高, 现场取淋巴血细胞制备血细胞样品, 并将其内脏团、鳃和外套膜组织分离均质, -80℃冻存。
1.2.2 血细胞样品的制备参考文献(李清云, 2017)用内含抗凝剂(0.02mol/L EDTA, 0.14mol/L NaCl, 3mmol/L KCl, 8mmol/L Na2HPO4, 1.5mmol/L KH2PO4, pH=7.4)的无菌注射器从扇贝包心团中按体积比1︰1抽血, 每只扇贝抽取0.1—0.2mL血淋巴。混合液均分两份, 一份于4℃、750r/min、离心10min, 分装(1mL/管), -80℃冻存; 一份按血淋巴︰抗凝剂=1︰10的比例加入抗凝剂重悬并充分混匀, 以血球计数板进行血细胞计数, 绘制4组栉孔扇贝血细胞数量(Total Hemocyte Counts, THC)变化曲线。
1.2.3 抗氧化系统酶活性的测定各组织分别称取1g, 以质量(g)︰体积(mL)=1︰9加入任氏生理盐水, 在冰水浴下匀浆得10%组织匀浆液, 在4℃条件下离心匀浆液(2500r/min, 10min), 取上清液按照试剂盒说明书(南京建成生物工程研究所)进行操作, 测定栉孔扇贝血清和内脏团、鳃组织中超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)、过氧化物酶(POD)、酸性磷酸酶(ACP)活性大小。
1.2.4 透射电镜组织切片的制备与处理选取1、3、6、14、22、30d鳃和内脏团样品, 参考文献(李清云, 2017)在蜡片上切块(2nm×2nm×2nm), 以2.5%戊二醛(0.1mol/L磷酸缓冲液配制, pH 7.4)固定。随后进行锇酸后固定、树脂包埋、超薄切片、醋酸铀染色处理后, 用透射电镜(TEM)进行观察。
1.3 数据处理参考文献计算栉孔扇贝的生长率(湿重生长率、壳长增长率)与摄食率(贾秋红等, 2015), 根据毒素当量因子(Pelin et al, 2018)(toxic equivalency factor, TEF)换算毒素蓄积含量, 根据公式计算毒素蓄积速度以及残留率。实验数据采用SPSS 23和Excel 2015等软件整理分析, 结果均采用单因素方差分析, 以平均值±标准差(means±SD)表示。采用Origin 8.5软件作图说明。
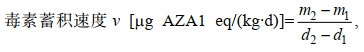 (1)
(1)式中, m1为蓄积d1天时扇贝体内的毒素含量, m2为蓄积d2天时扇贝体内的毒素含量。
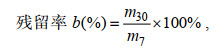 (2)
(2)式中, m7为贝体内蓄积的最高毒素含量(蓄积第7天); m30为代谢30天后贝体内的毒素含量。
2 结果与分析 2.1 AZAs在栉孔扇贝的代谢及对其生长的影响结果表明, AZAs产毒藻暴露对扇贝生长和存活等基本生理表征具有显著影响。实验30天结束后, 对照组栉孔扇贝壳长和湿重增长率分别为2.1%和13.2%, 而毒素暴露组分别为0.3%—0.4% (P > 0.05)和0.5%—4.0%。壳长和湿重增长率与暴露剂量呈负相关, 即高暴露组增长最少。另外, 高暴露组的产毒藻直接导致栉孔扇贝的高死亡率, 可达20.0% (7d)与88.3% (30d), 而其他暴露组死亡率均小于20.0%。
栉孔扇贝对AZAs的蓄积能力较强, 且与其暴露水平基本呈正相关。其中, 高暴露组蓄积含量最高, 可达303.6μg AZA1 eq/kg, 其次分别是中、低暴露组282.6和175.0μg AZA1 eq/kg。从摄食率水平分析, 低暴露组转化率最高, 可将17.3%产毒藻转化为AZAs。AZAs可在栉孔扇贝体内缓慢代谢, 主要转化为AZA6、AZA12、AZA19和AZA23 4种组分, 其中主要代谢产物为AZA19和AZA12。
不同暴露组AZAs在栉孔扇贝中的蓄积代谢趋势一致, 组间差异不显著。由图 1可看出, 整个实验过程可划分为3个阶段: Ⅰ阶段为快速蓄积期(1—7d), 中暴露组蓄积速率最快[28.2μg AZA1 eq/(kg·d)], 而低暴露组蓄积速率最慢, 三组均于暴露第7天毒素含量达最高; Ⅱ阶段为慢速代谢期(7—18d), 毒素含量平稳下降; Ⅲ阶段为快速代谢期(18—22d), 毒素代谢速度显著提高可达Ⅱ阶段的4—7倍。试验22天后毒素含量再无显著变化, 直至代谢实验结束残留率仍为11.9%—17.3%。由此可知, 栉孔扇贝对AZAs具有较强的蓄积能力, 短时间内即可超过限量标准; 但其对AZAs的代谢消除能力较弱, 经过24天的代谢消除仍然存在较高含量的AZAs。
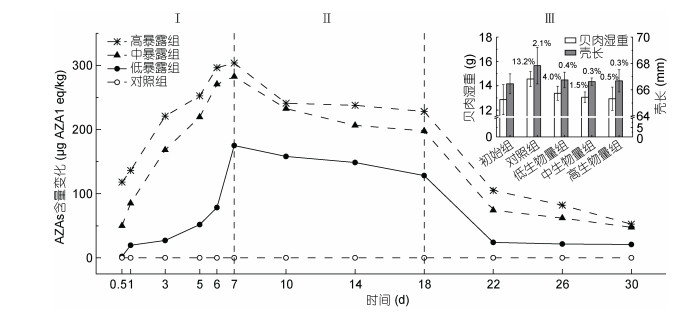 |
| 图 1 栉孔扇贝的AZAs代谢曲线与生长生理影响(x%为增长率) Fig. 1 Metabolism of AZAs in C. farreri and its effect on the growth of C. farreri (x% is growth rate) |
本研究发现, 栉孔扇贝血细胞对AZAs应激响应十分迅速, 暴露后即出现应激反应, 数量显著上升。血细胞总数(total hemocyte counts, THC)随时间变化趋势总体一致, 先迅速上升, 3天时达到首峰, 随后开始缓慢下降, 第6天起降低到对照组以下并在较长时间内保持一个稳定水平, 第14天时又迅速上升并在实验结束时达到最高水平, 实验组血细胞数量可达对照组的2—3倍(图 2)。
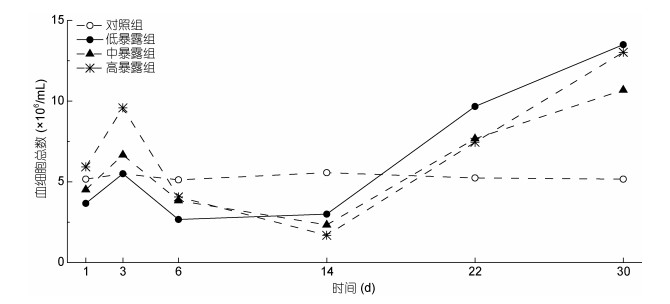 |
| 图 2 AZAs暴露对栉孔扇贝血细胞总数的影响 Fig. 2 Effects of AZAs on total hemocyte counts in C. farreri |
本研究重点评价了栉孔扇贝SOD、GSH-Px、POD及ACP抗氧化酶活性变化情况。在血液中, 四种酶的对照酶活水平相差很大, 活性最高的酶是GSH-Px, 其酶活为(756.4±27.1)U/mg·prot, 其分别可达到SOD、POD以及ACP酶活的12、47、135倍左右。以对照组酶活为基准, 以诱导/抑制率指标将四种酶的暴露组数据统一量纲(图 3)。总体发现, 与对照组相比, 暴露组中4种酶活性均表现出一定的应激反应。但比较而言, SOD和ACP活性整体处于被抑制状态, 而POD和GSH-Px则呈现出诱导效应。其中, SOD对AZAs胁迫不敏感, 其诱导与毒素蓄积量有关, 从暴露第6天起, 仅中、高暴露组出现一定的诱导效应, 且高暴露组在暴露14天时出现明显诱导效果, 对应的诱导剂量为74.2—168.2μg AZA1 eq/kg, 诱导率最高为15.7%;与SOD不同的是, ACP对AZAs十分敏感, 低暴露组暴露第3天就出现应激反应, 但持续时间短暂, 第6天左右ACP就被抑制至实验结束。虽然POD和GSH-Px在整个实验过程中表现出持续性诱导效应, 但两者仍然出现一定的差异性:在蓄积阶段(I), 二者响应相反, 且高暴露组响应最为激烈。在代谢阶段(Ⅱ与Ⅲ), 二者诱导强度呈波动上升趋势。在最后平稳阶段, 二者诱导强度陡然上升。
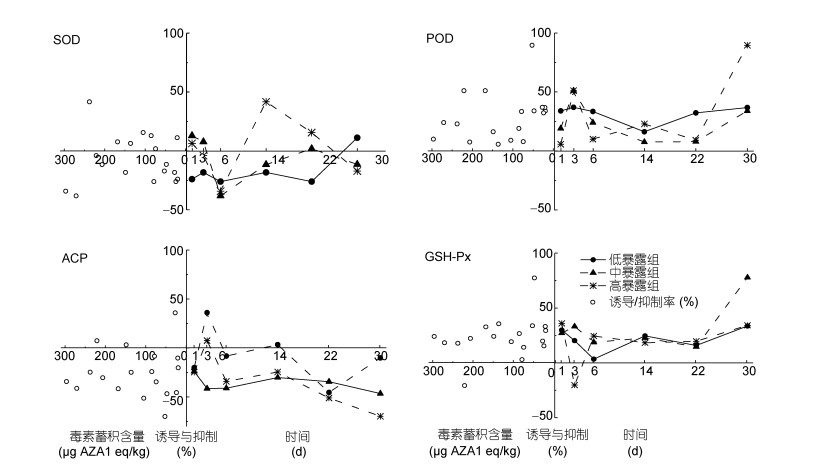 |
| 图 3 AZAs暴露时间及含量对扇贝四种抗氧化酶活性的影响 Fig. 3 Effects of AZAs exposure time and contents on activities of four antioxidant enzymes in C. farreri |
针对GSH-Px和POD的高诱导效果, 本实验对二者在血液、内脏、鳃组织中的活性变化情况进一步比较研究(图 4)。对照组酶活数据表明, GSH-Px与POD在血液中呈高活性优势, 活性分别可达其他组织的25、32倍, 而在内脏和鳃中活性低且组织间差异甚微。暴露AZAs后发现依然是血液中这两种酶活性变化最为显著, GSH-Px和POD活性分别为内脏的23—30倍, 为鳃的32—48倍, 表明血液应是最主要的应激部位。POD应激与AZAs存在显著剂量效应关系。中、高暴露组酶活波动幅度更为强烈, 在暴露1d可达到波动首峰, 6d后达到酶活最高。与之相反, 低暴露组酶活波动幅度小, 首峰值与最高值延至3d和14d。与POD相比, GSH-Px应激无显著剂量效应关系。但其在整个蓄积代谢阶段均有高活性应激, 在血液中, GSH-Px活性最高可达POD的50倍。
 |
| 图 4 GSH-Px与POD在扇贝不同组织的抗氧化酶活性对比 Fig. 4 Comparison in activities of GSH-Px and POD in different tissues of C. farreri 注:字母不同则实验组间差异显著; *代表该组与对照组差异显著, P < 0.05 |
本研究观察了AZAs胁迫对栉孔扇贝内脏和鳃细胞超微结构的影响。结果发现, 三种胁迫强度下, 栉孔扇贝目标组织细胞超微结构均发生一定变化, 主要表现在线粒体等重要细胞器和膜结构的损伤、破坏, 其变化程度与AZAs的暴露程度呈一定的相关性, 说明高暴露组栉孔扇贝受到的氧化胁迫伤害更大。而从实验过程来看, 毒素蓄积阶段变化程度最为剧烈, 其中高暴露组导致的损伤最大; 而代谢阶段, 低剂量组随着时间延长, 栉孔扇贝的内脏和鳃超微结构均出现一定的自我修复现象, 但高暴露组则在实验全过程均无自我修复现象, 呈现出不可逆状态。
作为栉孔扇贝摄入氧气和食物的重要器官, 鳃首先接触到AZAs, 且敏感易损伤。正常栉孔扇贝鳃上皮组织(图 5a)细胞排列整齐, 各种细胞器如溶酶体、线粒体等结构正常清晰。低暴露组Ⅰ阶段末期(图 5b)鳃上皮组织细胞开始损伤, 出现多处透明空泡, 线粒体出现轻微肿胀且数量减少, 细胞中溶酶体增多, 血细胞向管壁聚集。Ⅲ阶段末期(图 5c), 鳃细胞受损现象明显改善, 细胞空泡化减轻, 大部分细胞趋于正常, 但仍可观察到少数固缩细胞核。而中高暴露组对鳃组织损伤严重, 组间差异不显著且无修复现象。
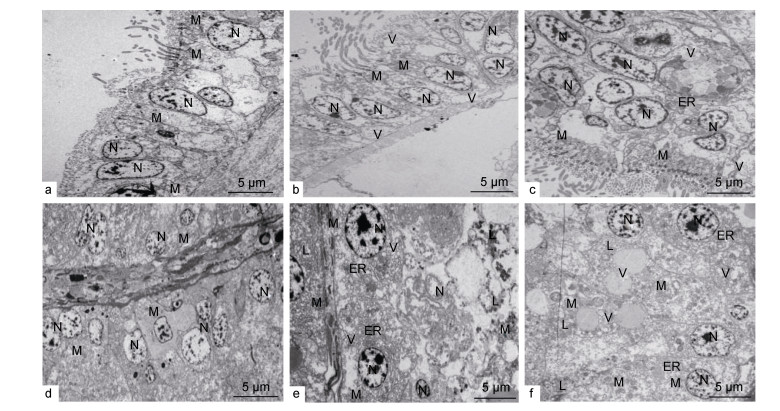 |
| 图 5 AZAs对扇贝内脏和鳃细胞超微结构的影响 Fig. 5 Effects of AZAs on the ultrastructure of viscera and gill cells 注: a:空白组鳃电镜图; b:低暴露组实验6天鳃组织电镜图; c:低暴露组实验30天鳃组织电镜图; d:空白组内脏电镜图; e:高暴露组实验6天内脏组织电镜图; f:高暴露组实验30天内脏组织电镜图; N:细胞核; M:线粒体; L:溶酶体; V:透明空泡; ER:内质网 |
内脏团是栉孔扇贝蓄积和代谢靶器官, 对AZAs耐受能力更强。正常栉孔扇贝内脏组织(图 5d)上皮细胞排列紧密, 细胞质均匀, 细胞器观察清晰, 肠腔中不同腔室紧密连接, 腔中纤毛清晰可辨。中低暴露组出现轻微损伤与修复, 与鳃组织低暴露组变化情况基本一致, 而高暴露组结构损伤较为严重。在Ⅰ阶段末期(图 5e), 高暴露组细胞线粒体数量下降且肿胀明显, 并出现密集空泡化, 内质网片段化, 溶酶体大量增加, 细胞核中染色质凝集。Ⅲ阶段末期(图 5f), AZAs已对细胞造成不可逆损伤, 细胞膜破损, 内容物逸散, 仅留少数细胞形态完整, 可观察到细胞坏死后残留的固缩细胞核及大量聚集的透明空泡与溶酶体。
3 讨论 3.1 AZAs对栉孔扇贝生长代谢的影响AZAs作为一种典型的脂溶性贝类毒素, 其在海洋贝类中具有较强的蓄积能力, 但代谢速度却相对缓慢, 现有结果发现其消除半衰期长达11d左右, 因此自然条件下可长时间存在于贝类中(Kittler et al, 2010)。而本研究中, 以2.0×107cells/(ind.·d)生物量的产毒藻暴露3天后, 栉孔扇贝中AZAs毒素含量已超过其限量标准, 连续暴露6天其毒素积累可超过限量标准的2—3倍。随后经过第一阶段的代谢(7—18d), 毒素水平下降至限量标准以下, 这一阶段的消除速率为(6.3±1.3)μg AZA1 eq/(kg·d); 第二阶段代谢过程(18—22d), 其毒素以更快的速度消除下降, 可达(29.3±2.1)μg AZA1 eq/(kg·d)。由此可知, AZAs在栉孔扇贝中的相对代谢速度呈现出由慢到快的过程, 整体消除速率为17.8μg AZA1 eq/(kg·d), 与其他研究的结果较为相似(邴晓菲等, 2017)。
此外, 腹孔环胺藻产生的AZAs在栉孔扇贝出现了显著的生物转化作用, 共代谢生成AZA6、AZA12、AZA19和AZA23四种低毒代谢产物; 初步研究表明这些代谢产物与AZA2相比, 极性增加, 从而加速了毒素的排出, 最终降低了AZAs对栉孔扇贝自身的危害性(Kittler et al, 2010; Hess et al, 2016)。但栉孔扇贝对AZAs的代谢消除虽然在一定程度上降低了自身的危害性, 仍然对其正常的生理生化活动造成了不利影响。本研究直接暴露时间仅为6天, 但毒素的累积仍然造成其生长、摄食等生理活动受到抑制, 且存在一定的剂量效应关系。显著体现在低暴露对应低死亡率及高摄食转化率/高暴露对应高死亡率及低摄食转化率现象。推测可能原因是低含量AZAs对扇贝的生理结构破坏最小, 因此对其生理活动影响程度较低。这与其他毒素对贝类生长代谢影响相对一致。产麻痹性贝类毒素PSTs的塔玛亚历山大藻(A. tamarense)可对扇贝生理活动(摄食、爬升、附着率等)产生不良影响, 且与产毒藻细胞密度呈正相关关系, 以10000cells/mL暴露后扇贝生长抑制率高达68% (Yan et al, 2003)。有学者认为, 贝类应对胁迫的部分成本投入是以其负面生理影响为代价的(Fellowes et al, 2000; Moret et al, 2000)。分析表明, 本研究中AZAs胁迫使得扇贝体内能量供给方式发生改变, 可能是将细胞水平的能量从生理功能(包括繁殖、生长等)中转为促代谢模式, 从而导致其出现存活下降和生长迟缓的现象。
3.2 AZAs对栉孔扇贝抗氧化酶应激的影响除了栉孔扇贝表现出的生长迟缓等不利现象, AZAs胁迫也造成了栉孔扇贝血细胞数量及抗氧化系统酶活性等变化。首先, 外源毒素会激活扇贝机体细胞免疫应答, 其首要防御手段是血细胞的吞噬作用(陈慕雁, 2007)。在本研究中, AZAs胁迫过程中血细胞数量上升、吞噬活性增强, 并产生大量的活性氧(reactive oxygen species, ROS), 导致内平衡破坏。而Ⅲ阶段, 血细胞数量迅速上升, 以促进正常生理机能恢复。此外, 血细胞与体液免疫同样关系密切, 可进一步将体液因子通过脱颗粒的方式分泌到血浆中, 激活扇贝的体液免疫(抗氧化酶、凝集素等)。
贝类等生物的抗氧化系统中, SOD和ACP作为初级代谢酶, 在氧化应激反应中清除ROS。在Ji等(2018)和本研究中AZAs对扇贝和贻贝进行暴露, SOD应激迟缓, 诱导强度微弱。但贝类对其他异源物质的应激反应中, SOD应激高效。贻贝暴露麻痹性贝类毒素(PST)后, SOD在24h内高效应激, 其酶活被持续诱导(Qiu et al, 2013)。全氟化学品(PFCs)低水平(0—100mg/L)暴露翡翠贻贝后SOD被快速激活(Liu et al, 2014)。以不同浓度的苯并芘与金属协同暴露贻贝, SOD显示出很高的暴露敏感性, 且已有理论证实, SOD被ROS激活, 可将其转化为过氧化物, 减轻组织损伤(李虎, 2017)。已知本实验中过氧化物酶都具有高效应激性。由此推测, SOD极有可能在AZAs暴露后24h内已快速应激, 应激效应强度与毒素暴露剂量有关。而ACP是一种对胁迫相当敏感的典型的溶酶体酶, 是刺激抗氧化系统应激的重要体液因子, 在本研究中, ACP被显著抑制。其原因可能是AZAs胁迫使溶酶体膜完整性被破坏, 引起细胞脱颗粒(Zhang et al, 2006)。
POD与GSH-Px协同清除过氧化物, 以减轻细胞膜脂过氧化的伤害。二者应激剂量存在差异。重金属暴露牡蛎(Ferreira et al, 2019)实验证实, 低剂量暴露下GSH-Px有良好的应激反应, 可指示重金属早期污染。而斑马鱼暴露高浓度铜时POD活性诱导效果更为显著(郭京君, 2018)。本研究结果显示, 血液中GSH-Px高效应激, Ⅱ和Ⅲ阶段酶活呈波动上升诱导趋势, 与毒素代谢过程密切相关。而POD虽有相似趋势, 但上升幅度较小, 酶活力相对较低, 推测是因为暴露剂量未达到POD高效诱导水平或其对AZAs不敏感。二者在代谢后期细胞结构恢复阶段诱导效果陡升, 或与细胞修复相关。
3.3 AZAs对栉孔扇贝组织细胞的损伤被异源物质胁迫后, 栉孔扇贝为维持组织稳态激活机体细胞凋亡(Romero et al, 2015)。细胞超微结构显示, AZAs蓄积过程中, 栉孔扇贝核内染色质浓缩, 细胞内出现空泡化、内质网片段化等质膜异化现象, 这是细胞凋亡的典型表观特征。贝类主要有两种凋亡途径:一是死亡受体(外源性)途径, 其中最具特征的配体/死亡受体FasL/FasR已在栉孔扇贝中证实(Li et al, 2009); 二是线粒体(内源性)途径, 活性氧积累、线粒体损伤、环境污染物刺激等都可激发这一途径(Quon et al, 2001)。两种凋亡途径最终都集中在放大凋亡信号, 触发天冬氨酸蛋白水解酶(Caspases)自催化活化(Feig et al, 2007)。Cd2+通过线粒体/caspase途径以剂量依赖的方式诱导了紫贻贝鳃细胞和牡蛎血细胞的凋亡(Pruski et al, 2002); 在除草剂等环境污染物的作用下, 静水椎实螺的血细胞由凝集素和ROS的产生介导发生凋亡(Châtel et al, 2011)。麻痹性贝类毒素STX可通过Caspase依赖途径靶向作用于细胞质, 以非ROS方式诱导牡蛎免疫细胞凋亡(Abi-Khalil et al, 2017)。本研究中, 抗氧化酶高效应激证实了ROS的积累, 同时电镜结果显示线粒体出现数量减少、外廓肿胀、空泡化等损伤现象, 且次级溶酶体增多, 其异噬和自噬作用进一步证实AZAs对细胞胁迫造成细胞内部损伤。由此初步证实AZAs胁迫栉孔扇贝产生ROS、损伤线粒体, 启动内源性细胞凋亡途径。而线粒体与细胞的能量代谢密切相关(Green et al, 1998, 2014), 因此进一步推断其凋亡过程与能量代谢有关。
有学者提出, AZAs对细胞的毒性作用是不可逆的损伤细胞骨架(Vilariño, 2008), 目前未有直接证据。但部分毒理学实验有相反的实验结果。比如, 小鼠口服AZAs 24h后上皮细胞开始恢复, 表现出可逆性毒性作用(Ito et al, 2000)。实际上, 细胞结构损伤后的自我修复功能也已在多个研究中得到证实(Ito et al, 1994; 黄燕霞, 2016; 王燕等, 2018), 因此这一看似矛盾的结果, 可能与毒素的暴露剂量和毒性有关, 超过一定剂量的毒素可能会造成细胞功能的永久性损伤, 且导致其生理功能完全丧失, 但一定剂量范围内可能会产生自我修复功能。本研究中, 我们也发现了这一现象。如在Ⅲ阶段末期, 低暴露组组栉孔扇贝的受损细胞结构出现自我修复现象, 而高生物量组细胞损伤严重几乎没有修复。与之相对应, 实验过程中高暴露组栉孔扇贝出现大量的死亡现象, 而低暴露组的生理活动变化程度不大。由此推测, 不同AZAs对栉孔扇贝细胞超微结构的损伤具有一定的剂量效应关系。另外考虑到自然界中, AZAs可在贝类中长期存在, 因此即便低剂量AZAs对海洋贝类的长期胁迫, 可能也会导致贝类细胞超微结构的不可逆损伤, 从而对其生理生化活动造成严重影响, 最终也可能会造成贝类种群和生物量的下降。因此, 需要进一步加强自然水平下AZAs长期胁迫对贝类的相关影响, 有助于准确评价其生态毒理效应。
4 结语栉孔扇贝暴露于氮杂螺环酸毒素AZAs产毒藻-腹孔环胺藻后, 可对其所产生的AZAs毒素进行蓄积代谢, 并生成新的代谢产物, 以加速对内源性AZAs的消除速度并最大化保护自身安全。但栉孔扇贝仍然受到不利影响, 其生理生化均出现不同程度的应激响应, 主要表现在存活率降低、生长迟缓、血细胞数量改变、抗氧化系统酶活性及靶组织细胞超微结构发生变化等, 且多个指标均表现出一定的剂量效应关系。相关现象的发生, 与外源毒素AZAs在栉孔扇贝中的代谢消除有密切的关联性, 即AZAs在栉孔扇贝中的代谢不仅直接对栉孔扇贝造成一定的危害, 而且其诱导产生的过氧化物对扇贝也带来二次危害, 从而影响其维持正常生理活动的能力。
王燕, 黄燕霞, 许娜, 等. 2018. 低剂量蓖麻毒素吸入诱导的小鼠肺损伤及修复. 中国生物制品学杂志, 31(12): 1313-1316 |
李虎, 2017.卡帕藻和麒麟菜光合和抗氧化系统对温度胁迫的响应.青岛: 中国科学院海洋研究所博士学位论文, 49-52
|
李清云, 2017.一株氮杂螺环酸产毒藻的产毒生理学及食品安全评价.青岛: 青岛科技大学硕士学位论文, 39-40
|
邴晓菲, 吴海燕, 王群, 等. 2017. 麻痹性贝类毒素在栉孔扇贝体内的代谢轮廓. 中国水产科学, 24(3): 623-632 |
吴海燕, 李清云, 邴晓菲, 等. 2017. 氮杂螺环酸毒素在栉孔扇贝体内的代谢规律. 中国水产科学, 24(6): 1298-1306 |
陈慕雁, 2007.栉孔扇贝Chlamys farreri生态免疫机制的基础研究.青岛: 中国科学院海洋研究所博士学位论文, 7-9
|
贾秋红, 李晓春, 宋佳, 等. 2015. 不同海藻磨碎液对栉孔扇贝性腺发育及增重效果的比较. 河北渔业, (7): 9-10, 23 |
郭京君. 2018. Cu2+对斑马鱼SOD及POD酶活的影响研究. 农业科学, 8(4): 397-405 |
黄燕霞, 2016.蓖麻毒素诱导小鼠肺损伤修复及致炎机制初步研究.北京: 中国人民解放军军事医学科学院硕士学位论文, 40
|
Abi-Khalil C, Finkelstein D S, Conejero G et al, 2017. The paralytic shellfish toxin, saxitoxin, enters the cytoplasm and induces apoptosis of oyster immune cells through a caspase-dependent pathway. Aquatic Toxicology, 190: 133-141 DOI:10.1016/j.aquatox.2017.07.001 |
Canesi L, Gallo G, Gavioli M et al, 2002. Bacteria-hemocyte interactions and phagocytosis in marine bivalves. Microscopy Research & Technique, 57(6): 469-476 |
Châtel A, Hamer B, Jakšić Ž et al, 2011. Induction of apoptosis in mussel Mytilus galloprovincialis gills by model cytotoxic agents. Ecotoxicology, 20(8): 2030-2041 DOI:10.1007/s10646-011-0746-6 |
EFSA, 2009. Marine biotoxins in shellfish-Summary on regulated marine biotoxins. EFSA Journal, 7(8): 1306 DOI:10.2903/j.efsa.2009.1306 |
Ellis R P, Parry H, Spicer J I et al, 2011. Immunological function in marine invertebrates:Responses to environmental perturbation. Fish & Shellfish Immunology, 30(6): 1209-1222 |
Feig C, Peter M E, 2007. How apoptosis got the immune system in shape. European Journal of Immunology, 37(S1): S61-S70 DOI:10.1002/eji.200737462 |
Fellowes M D E, Godfray H C J, 2000. The evolutionary ecology of resistance to parasitoids by Drosophila. Heredity, 84(1): 1-8 DOI:10.1046/j.1365-2540.2000.00685.x |
Ferreira C P, Lima D, Paiva R et al, 2019. Metal bioaccumulation, oxidative stress and antioxidant responses in oysters Crassostrea gasar transplanted to an estuary in southern Brazil. Science of the Total Environment, 685: 332-344 DOI:10.1016/j.scitotenv.2019.05.384 |
Green D R, Galluzzi L, Kroemer G, 2014. Metabolic control of cell death. Science, 345(6203): 1250256 DOI:10.1126/science.1250256 |
Green D, Kroemer G, 1998. The central executioners of apoptosis:caspases or mitochondria?. Trends in Cell Biology, 8(7): 267-271 DOI:10.1016/S0962-8924(98)01273-2 |
Gu H F, Luo Z H, Krock B et al, 2013. Morphology, phylogeny and azaspiracid profile of Azadinium poporum (Dinophyceae) from the China Sea. Harmful Algae, 21-22: 64-75 DOI:10.1016/j.hal.2012.11.009 |
Hess P, Twiner M J, Kilcoyne J et al, 2016. Azaspiracid toxins: toxicological profile. In: Gopalakrishnakone P, Haddad V Jr, Kem W R et al eds. Marine and Freshwater Toxins. Dordrecht: Springer, 4-5
|
Ito E, Satake M, Ofuji K et al, 2000. Multiple organ damage caused by a new toxin azaspiracid, isolated from mussels produced in Ireland. Toxicon, 38(7): 917-930 DOI:10.1016/S0041-0101(99)00203-2 |
Ito E, Terao K, 1994. Injury and recovery process of intestine caused by okadaic acid and related compounds. Natural Toxins, 2(6): 371-377 |
James K J, Lehane M, Moroney C et al, 2002. Azaspiracid shellfish poisoning:unusual toxin dynamics in shellfish and the increased risk of acute human intoxications. Food Additives & Contaminants, 19(6): 555-561 |
Jauffrais T, Séchet V, Herrenknecht C et al, 2013. Effect of environmental and nutritional factors on growth and azaspiracid production of the dinoflagellate Azadinium spinosum. Harmful Algae, 27: 138-148 DOI:10.1016/j.hal.2013.05.009 |
Ji Y, Qiu J B, Xie T et al, 2018. Accumulation and transformation of azaspiracids in scallops (Chlamys farreri) and mussels (Mytilus galloprovincialis) fed with Azadinium poporum, and response of antioxidant enzymes. Toxicon, 143: 20-28 DOI:10.1016/j.toxicon.2017.12.040 |
Kittler K, Preiss-Weigert A, These A, 2010. Identification strategy using combined mass spectrometric techniques for elucidation of phase I and phase Ⅱ in vitro metabolites of lipophilic marine biotoxins. Analytical Chemistry, 82(22): 9329-9335 DOI:10.1021/ac101864u |
Krock B, Tillmann U, Witt M et al, 2014. Azaspiracid variability of Azadinium poporum (Dinophyceae) from the China Sea. Harmful Algae, 36: 22-28 DOI:10.1016/j.hal.2014.04.012 |
Li L, Qiu L M, Song L S et al, 2009. First molluscan TNFR homologue in Zhikong scallop:Molecular characterization and expression analysis. Fish & Shellfish Immunology, 27(5): 625-632 |
Liu C H, Chang V W C, Gin K Y H, 2014. Oxidative toxicity of perfluorinated chemicals in green mussel and bioaccumulation factor dependent quantitative structure-activity relationship. Environmental Toxicology and Chemistry, 33(10): 2323-2332 DOI:10.1002/etc.2679 |
McCarron P, Kilcoyne J, Miles C O et al, 2009. Formation of azaspiracids-3, -4, -6, and -9 via decarboxylation of carboxyazaspiracid metabolites from shellfish. Journal of Agricultural and Food Chemistry, 57(1): 160-169 DOI:10.1021/jf8025138 |
McMahon T, Silke J, 1995. Winter toxicity of unknown aetiology in mussels. Harmful Algae News, 14: 2 |
Moret Y, Schmid-Hempel P, 2000. Survival for immunity:The price of immune system activation for bumblebee workers. Science, 290(5494): 1166-1168 DOI:10.1126/science.290.5494.1166 |
Pelin M, Kilcoyne J, Nulty C et al, 2018. Toxic equivalency factors (TEFs) after acute oral exposure of azaspiracid 1, -2 and-3 in mice. Toxicology Letters, 282: 136-146 DOI:10.1016/j.toxlet.2017.10.016 |
Pruski A M, Dixon D R, 2002. Effects of cadmium on nuclear integrity and DNA repair efficiency in the gill cells of Mytilus edulis L. Aquatic Toxicology, 57(3): 127-137 DOI:10.1016/S0166-445X(01)00192-8 |
Qiu J B, Ma F F, Fan H et al, 2013. Effects of feeding Alexandrium tamarense, a paralytic shellfish toxin producer, on antioxidant enzymes in scallops (Patinopecten yessoensis) and mussels (Mytilus galloprovincialis). Aquaculture, 396-399: 76-81 DOI:10.1016/j.aquaculture.2013.02.040 |
Quon K C, Berns A, 2001. Haplo-insufficiency? Let me count the ways. Genes & Development, 15(22): 2917-2921 |
Romero A, Novoa B, Figueras A, 2015. The complexity of apoptotic cell death in mollusks:An update. Fish & Shellfish Immunology, 46(1): 79-87 |
Tillmann U, Elbrächter M, Krock B et al, 2009. Azadinium spinosum gen. et sp. nov. (Dinophyceae) identified as a primary producer of azaspiracid toxins. European Journal of Phycology, 44(1): 63-79 DOI:10.1080/09670260802578534 |
Vilariño N, 2008. Marine toxins and the cytoskeleton:azaspiracids. FEBS Journal, 275(24): 6075-6081 DOI:10.1111/j.1742-4658.2008.06713.x |
Yan T, Zhou M J, Fu M et al, 2003. Effects of the dinoflagellate Alexandrium tamarense on early development of the scallop Argopecten irradians concentricus. Aquaculture, 217(1-4): 167-178 DOI:10.1016/S0044-8486(02)00117-5 |
Zhang Z H, Li X X, 2006. Evaluation of the effects of grading and starvation on the lysosomal membrane stability in pacific oysters, Crassostrea gigas (Thunberg) by using neutral red retention assay. Aquaculture, 256(1-4): 537-541 DOI:10.1016/j.aquaculture.2006.02.002 |
 2020, Vol. 51
2020, Vol. 51


