中国海洋湖沼学会主办。
文章信息
- 赵海霞, 王学颖, 杜腾飞, 周莉, 徐世宏, 王彦丰, 肖永双, 刘清华, 李军. 2020.
- ZHAO Hai-Xia, WANG Xue-Ying, DU Teng-Fei, ZHOU Li, XU Shi-Hong, WANG Yan-Feng, XIAO Yong-Shuang, LIU Qing-Hua, LI Jun. 2020.
- 体内受精许氏平鲉(Sebastes schlegelii)和体外受精大菱鲆(Scophthalmus maximus)精子结构及生理特性比较
- SPERM ULTRASTRUCTURAL AND PHYSIOLOGICAL DIFFERENCES BETWEEN INTERNALLY FERTILIZED BLACK ROCKFISH (SEBASTES SCHLEGELII) AND EXTERNALLY FERTILIZED TURBOT (SCOPHTHALMUS MAXIMUS)
- 海洋与湖沼, 51(6): 1513-1519
- Oceanologia et Limnologia Sinica, 51(6): 1513-1519.
- http://dx.doi.org/10.11693/hyhz20200300087
文章历史
-
收稿日期:2020-03-23
收修改稿日期:2020-04-27
2. 青岛海洋科学与技术国家实验室海洋生物学与生物技术功能实验室 青岛 266237;
3. 中国科学院大学 北京 100049
2. Laboratory for Marine Biology and Biotechnology, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266237, China;
3. University of Chinese Academy of Sciences, Beijing 100049, China
精子是由雄性个体产生并传递其遗传物质的一种高度分化的细胞, 目前研究表明, 精子结构具有极高的多样性, 物种的生殖方式和系统发育地位共同决定它特殊的形态结构(乔志刚等, 2017)。精子的多样性反映在有无顶体, 头部形状, 线粒体的数量、形状和位置以及鞭毛的数量、长度中(Guo et al, 2016)。通常认为, 体外受精卵生硬骨鱼精子有着球形或椭球形的头部, 较短的中部以及长度有物种特异性的鞭毛与侧鳍(李君等, 1998)。目前研究中, 将受精方式列为区分精子结构的重要分界岭, 普遍认为体内受精物种精子有着细长的头部以及发育良好的中段, 例如, 在爬行动物龟中, 演化出了有线粒体单层垛叠, 同心排列的中段, 被认为是在长时间储存期间支持精子活力的一种适应(Nicander, 1970; Hess et al, 1991)。
硬骨鱼种类繁多, 其受精方式也不尽相同(Hart, 1990)。体外受精, 硬骨鱼精子与卵子分别被排入水体, 精子受到水体渗透压及离子刺激激活, 剧烈运动, 精子通过受精孔, 完成受精过程。整个过程在精卵排出后瞬间完成, 精子的存活寿命非常短, 卵生硬骨鱼基本都是以这种方式完成受精, 例如鲽形目、鲤形目、鲈形目的绝大部分硬骨鱼均属于此类(尤永隆等, 1996; 张永忠等, 2004; 张涛等, 2015)。体内受精, 亲鱼通过交尾将精子排入雌鱼生殖道, 精子受到生殖道体液刺激获能, 进而继续运动直到受精场所。由于卵子发育状态以及外界环境变化的影响, 受精过程并非即刻发生(Pusey et al, 1989; Pavlov et al, 1997)。因此这种特殊的精子储存行为要求其精子拥有更长的寿命, 以及特殊结构和能量代谢方式来支持完成受精过程, 卵胎生以及胎生鱼类拥有体内受精的受精方式, 例如平鲉属、杜父鱼科, 以及花鳉科的鱼类属于此类物种(Gardiner, 1978; 林丹军等, 1998; Fishelson et al, 2007)。许氏平鲉为胎生硬骨鱼, 有着典型的体内受精的受精方式, 精子在雌鱼体内的生存时间长达6个月(蔺玉珍, 2013)。但是, 对于体内受精鱼类精子的特化结构以及精子储存的支撑结构并不明晰。
本研究对比典型卵生硬骨鱼类大菱鲆精子及其他体外受精的硬骨鱼类精子结构, 阐明体内受精鱼类许氏平鲉与其长期贮存能力相适应的精子超微结构及其生理特征, 以期为海水鱼类受精生物学以及繁殖发育生物学研究积累资料。
1 材料与方法 1.1 亲鱼来源及精液采集实验用6条性成熟雄性许氏平鲉于2019年11月捕获自青岛近海, 其后暂养于青岛市中国科学院海洋研究所一号楼养殖室, 以供取精。采集精液时, 使用浓度为120µg/mL间氨基苯甲酸乙酯甲磺酸盐(MS222)作为麻醉剂, 使亲鱼迅速深度麻醉, 剖出带有完整生殖道的精巢, 用滤纸擦净表面血渍, 轻压输精管, 将精液采集到离心管中。实验用6条性成熟雄性大菱鲆于2019年9月采自威海市圣航水产有限公司。采集精液时, 先用蒸馏水将生殖孔周边海水冲净, 用滤纸擦净生殖孔周边, 轻压鱼腹流出的干净黏稠精液移入离心管备用。所采集到的精液均用0.1mol/L pH 7.2—7.4的磷酸缓冲液(PBS)漂洗三次, 置于预冷的2.5%戊二醛固定液(使用磷酸缓冲液配制)中备用。
1.2 方法 1.2.1 扫描电镜样品的制备将精液于预冷的2.5%戊二醛固定液4℃固定4h后, PBS缓冲液漂洗3次, 每次10min。梯度乙醇脱水(30%, 50%, 70%, 80%, 90%, 100%), 每次10min。使用无水乙醇重复脱水两次, 每次20min。二氧化碳临界点干燥, 干燥后的样品放入离子镀膜仪中喷金镀膜。在扫描电镜(日立-4800)下观察并拍照。
1.2.2 透射电镜样品的制备精液于预冷的2.5%戊二醛固定液4℃固定4h, PBS缓冲液漂洗3次。梯度乙醇脱水, 其后使用无水乙醇重复脱水2次。最后样品环氧树脂包埋, 温箱固化, 使用Ultracut E超薄切片机半薄切片, 甲苯胺蓝染色, 半薄定位。醋酸双氧铀硝酸铅染色后, 样品使用JEM-1200 EX透射电镜(JEOL, Japan)进行观察拍照。
1.2.3 精子运动指标观测许氏平鲉精液使用Hank’s平衡液作为稀释液稀释至1×106, 使用5%雄鱼血清作为激活剂; 大菱鲆使用自然海水稀释精子至1×106并激活。许氏平鲉和大菱鲆精子激活后30s在10倍相差显微镜(Nikon-eclipse-E20)下观察精子的运动情况, 并用计算机辅助分析系统(CASA)采集相关数据并进行统计。
1.2.4 数据分析本实验超微结构测量与运动指标数据使用SPSS22统计软件进行处理, 所有数据均表示为平均数±标准差。平均数的比较采用One-Way ANOVA分析法检验, P < 0.05为差异显著。
2 结果 2.1 许氏平鲉与大菱鲆精子超微结构比较许氏平鮋和大菱鲆超微结构数据经统计如表 1所示。许氏平鲉与大菱鲆的精子均由头部、中段和尾部构成, 无顶体。许氏平鲉精子头部细长, 弯向一侧, 长径为(3.15±0.17)µm, 短径(1.44±0.10)µm (图 1a, 1b, 1c)。精子头部无顶体, 主要由染色较深的电子致密物组成, 细胞核核质于线粒体侧排列较稀疏, 在非线粒体侧排列较为致密, 无核空泡(图 1b, c)。细胞核外由双层质膜包裹并与质膜相连, 细胞核呈细长短棒状, 近鞭毛端向内凹陷形成较浅的植入窝(图 1b)。大菱鲆精子的头部为椭圆形, 长径为(1.48±0.06)µm, 短径为(0.97±0.15)µm。精子头部中央向内凹陷, 无顶体存在(图 2a, a′)。细胞核位于其头部顶端, 充斥着染色较深的电子致密物质, 核空泡位于细胞核顶端(图 2b)。质膜包裹在核膜外, 大量细胞质基质分布其中。植入窝约占1/2头长, 主要由近端中心粒与远端中心粒(基体)构成的中心粒复合体和部分鞭毛构成, 鞭毛的质膜内侧与头部质膜内侧均分布着大量囊泡状结构(图 2b)。
| 种类 | 许氏平鲉 | 大菱鲆 |
| 头部长径(µm) | 3.15±0.17* | 1.48±0.06 |
| 头部短径(µm) | 1.44±0.10 | 0.97±0.15 |
| 中段长(µm) | 1.23±0.48* | 0.62±0.11 |
| 鞭毛长(µm) | 22.10±1.18 | 48.29±1.31* |
| 鞭毛直径(µm) | 0.18±0.02 | 0.15±0.01 |
| 全长(µm) | 26.48±2.83 | 50.40±1.29* |
| 线粒体个数 | 30—40 | 10—20 |
| 精子密度 | (32.79±2.31)×1012/mL* | (10.27±1.49)×109/mL |
| 激活剂 | 5%雄鱼血清 | 海水 |
| 体外激活精子寿命 | ~56—82h* | ~2min |
| 注: “*”示许氏平鲉精子“头部长径”、“中段长”、“精子密度”、“体外激活精子寿命”显著高于大菱鲆精子, 大菱鲆精子“鞭毛长”和“全长”显著高于许氏平鲉精子 | ||
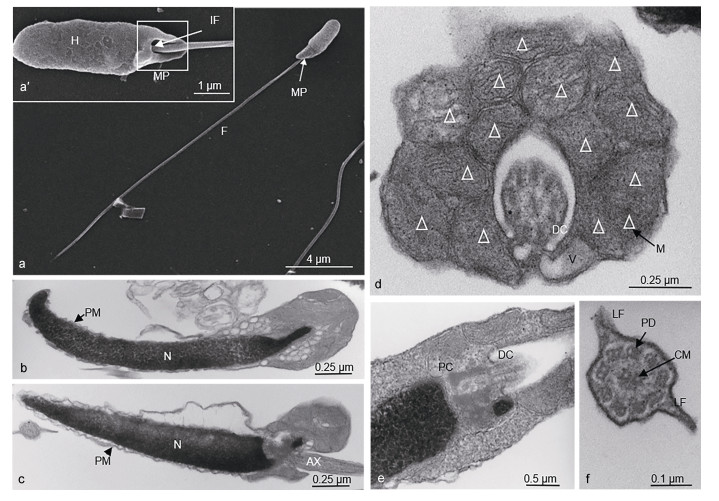 |
| 图 1 许氏平鲉精子超微结构 Fig. 1 Ultrastructure of sperm in black rockfish S. schlegelii 注: a, a’:扫描电镜示许氏平鲉精子; a:示许氏平鲉精子, 示头部(H), 中段(MP), 尾部(F); a’:扫描电镜示短棒状头部, 植入窝(IF)。b—f:透射电镜示许氏平鲉精子内部结构; b, c:精子纵切, 示不同角度下精子头部和中段的细胞核(N), 质膜(PM), 轴丝(AX); d:中段横切, 示线粒体及远端中心粒结构; e:头部前端纵切, 示近端中心粒(PC), 远端中心粒(DC), 线粒体(M); f:尾部横切, 鞭毛“9+2”微管结构, 示中心微管(CM), 双联体微管(PD)及侧鳍(LF) |
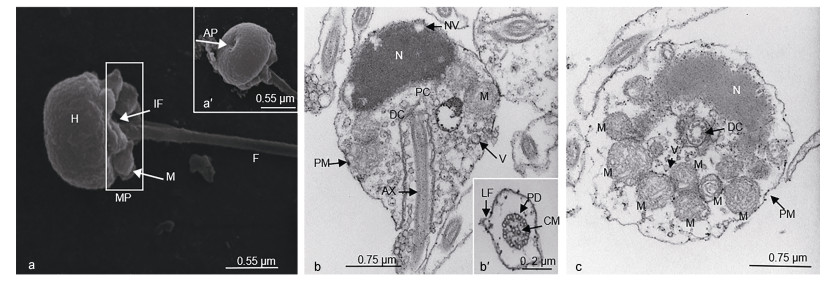 |
| 图 2 大菱鲆精子超微结构 Fig. 2 Ultrastructure of sperm in turbot S. maximus 注: a—c:扫描电镜示大菱鲆精子; a:精子头部(H), 中段(MP), 植入窝(IF); a′:精子头部核前凹陷(AP); b, c:透射电镜示大菱鲆精子内部结构; b:精子纵切, 示精子头部, 示细胞核(N), 近端中心粒(PC), 远端中心粒(DC), 轴丝(AX), 囊泡(V), 核空泡(NV)等结构; b′:示精子尾部横切, 示鞭毛“9+2”微管结构, 示中心微管(CM), 双联体微管(DM)及侧鳍(LF); H:大菱鲆头部后端横切, 示线粒体(M)与远端中心粒 |
许氏平鲉精子中段长度为(1.23±0.48)µm, 纵截面呈三角形, 非对称结构, 主要由质膜包裹的半袖套结构与中心粒复合体组成(图 1c)。袖套结构呈不对称囊袋状, 一侧袖套膨起, 大量圆球形线粒体多层垒叠, 紧密摆列, 其中一个截面大约有15个线粒体(白色三角所示), 数量约有30—40个(图 1d)。线粒体内膜向内折叠形成嵴, 大大增加了线粒体膜面积。袖套未膨起侧也有线粒体随机排列其中。中心粒复合体位于植入窝内, 由近端中心粒和远端中心粒(基体)组成, 始于植入窝末端, 远端中心粒向后延伸出轴丝(图 1e)。大菱鲆精子中段较短, 质膜包裹着向外突出的线粒体, 形成“半袖套”结构。线粒体为圆球形, 均匀散布在鞭毛周边, 一个精子中约有10—20个线粒体(图 2c)。
许氏平鲉精子的尾部长度为(22.10±1.18)µm, 尾部鞭毛细长, 约占全长的83.46%。鞭毛由质膜包裹的轴丝组成, 轴丝为典型的“9+2”微管结构, 即9组外周二联微管和一对中央微管构成。在鞭毛的外侧, 质膜向两侧扩展形成较为发达的侧鳍(图 1f)。大菱鲆精子尾部鞭毛细长, 长度为(48.29±1.31)µm, 约占全长的95.81%, 显著高于许氏平鲉。鞭毛部分伸入植入窝进入袖套内, 绝大部分鞭毛位于袖套以外。远端中心粒延伸出的鞭毛的轴丝具有典型的“9+2”微管结构(图 2b)。
2.2 许氏平鲉与大菱鲆精子生理特性及运动特征比较在自然状态下, 许氏平鲉精子与大菱鲆精子在生理活性方面具有显著差异。许氏平鲉精液呈乳白色膏状, 密度高达(32.79±2.31)×1012/mL, 而大菱鲆精液为浅白色黏稠液体, 较为稀薄, 密度为(10.27±1.49)×109/mL。大菱鲆为典型的卵生硬骨鱼, 其精子成熟排出体外后, 在海水(渗透压为939mOsm/kg)的刺激下, 开始迅速运动, 在几秒内使卵子受精, 其寿命在2min左右。对于许氏平鲉, 亲鱼在11月份交尾后, 精子一直保留在雌性亲鱼的卵巢内, 次年4月在雌性卵巢内使卵子受精, 精子寿命长达6个月左右(表 1)。
许氏平鲉和大菱鲆精子激活30s的运动特征参数经统计如表 2所示。本实验将体内受精许氏平鲉与体外受精大菱鲆精子在激活后的运动指标进行对比, 其中许氏平鲉和大菱鲆精子的活动率、前向运动率(PR)、精子头侧摆幅度(ALH)、运动的直线性(LIN)、运动的摆动性(WOB)、运动的前向性(STR)、精子平均鞭打频率(BCF)差异不显著, 而许氏平鲉精子的平均曲线运动速度(VCL)、平均直线运动速度(VSL)和平均路径速度(VAP)显著低于大菱鲆精子。
| 运动特征参数 | 许氏平鲉 | 大菱鲆 |
| 活动率(%) | 68.29±3.14 | 82.41±2.79 |
| 前向运动率(PR, %) | 46.61±2.75 | 57.64±4.03 |
| 平均曲线速度(VCL, µm/s) | 32.86±2.39 | 60.33±3.11* |
| 平均直线运动速度(VSL, µm/s) | 27.02±2.19 | 52.12±2.51* |
| 平均路径速度(VAP, µm/s) | 29.93±2.35 | 56.71±1.97* |
| 运动的直线性(LIN, %) | 74.32±0.77 | 71.38±1.13 |
| 运动的前向性(STR, %) | 83.87±0.56 | 82.27±0.86 |
| 运动的摆动性(WOB, %) | 86.03±0.61 | 83.22±0.77 |
| 精子平均头侧摆幅度(ALH, µm) | 1.21±0.04 | 1.38±0.12 |
| 精子平均鞭打频率(BCF, Hz) | 4.88±0.29 | 6.07±1.03 |
为比较体内受精硬骨鱼类精子与体外受精硬骨鱼精子的结构差异, 本研究将精子超微结构特征汇总比较(表 3)。体外受精硬骨鱼精子与体内受精精子结构差异主要体现在精子头部形状、中段长度与线粒体数量中。许氏平鲉为体内受精硬骨鱼, 具有长达6个月的精子储存时间, 其精子也有着与之相适应的结构。
| 生殖方式 | 种名 | 分类 | 顶体 | 头部形状 | 中段长度(µm) | 线粒体数(个数) | 轴丝结构 | 全长(µm) | 文献 |
| 淡水(体外受精) | 草鱼(Ctenopharyngodon idellus) | 鲤形目鲤科 | 无 | 圆形或 长圆形 | 2.525±0.197 | 6—9 | “9+2”二联微管 | — | (林光华等, 1998) |
| 鲇(Silurus asotu) | 鲇形目鲇科 | 无 | 近球形 | 无中段 | 4—5 | “9+2”二联微管 | 44.30 — 50.70 | (乔志刚等, 2016) | |
| 大口黑鲈(Micropterus salmoides) | 鲈形目太阳鱼科 | 无 | 球型 | 中段不明显 | 17±4 | “9+2”二联微管 | 25. 07±4. 93 | (乔志刚等, 2017) | |
| 尼罗罗非鱼(Oreochromis niloticus) | 鲈形目丽鱼科 | 无 | 不规则球形 | 0.71±0.14 | 5—9 | “9+2”二联微管 | 14.57±2.65 | (张涛等, 2015) | |
| 海水(体外受精) | 圆斑星鲽(Verasper variegate) | 鲽形目鲽科 | 无 | 近球形 | 0.3—0.4 | 14—20 | “9+2”二联微管 | 41.47±3.50 | (张永忠等, 2004) |
| 点带石斑鱼(Epinephelus malabaricus) | 鲈形目鮨科 | 无 | 近圆形 | 中段不明显 | 2 | “9+2”二联微管 | 16.8 | (王小刚等, 2013) | |
| 大黄鱼(Pseudosciaena crocea) | 鲈形目石首鱼科 | 无 | 椭圆形 | 0.59±0.06 | 4—5 | “9+2”二联微管 | 38.63±2.26 | (胡谋等, 2014) | |
| 河川沙塘鳢(Odontobutis potamophila) | 鲈形目沙塘鳢科 | 无 | 前端略方的长椭圆形 | 中段不明显 | 2—3 | “9+2”二联微管 | 30.09 — 40.00 | (王茜等, 2015) | |
| 海水(体内受精) | 胎鳚(Clinidae, Blennioidei) | 鲈形目黄鳚科 | 无 | 头部细长 | —1.8 | — | “9+2”二联微管 | 102.00 — 113.50 | (Fishelson et al, 2007) |
| 海鱮(Cymatogaster aggregate) | 鲈形目海鲫科 | 无 | 头部细长 | 3.5 | 6 | “9+2”二联微管 | 50.00 | (Gardiner, 1978) | |
| 狼鱼(Anarhichas lupus) | 鲈形目海鳚科 | 无 | 头部细长, 椭圆形 | —2.1 | — | “9+2”二联微管 | 21.20 | (Pavlov et al, 1997) | |
| 褐菖鲉(Sebastiscus marmoratus) | 鲉形目鲉科 | 无 | 长椭圆形 | — | 30—40 | — | — | (林丹军等, 1998) | |
| 淡水(体内受精) | 孔雀鱼(Poecilia reticulata) | 鳉形目花鳉科 | 无 | 长锥形 | — | 30—40 | — | — | (郭明申等, 2006) |
| 剑尾鱼(Xiphophorus helleri) | 鳉形目花鳉科 | 无 | 头部细长, 椭圆形 | — | — | — | — | (温茹淑等, 2012) |
体外受精硬骨鱼精子头部呈圆形或椭圆形, 但在体内受精硬骨鱼精子通常拥有细长的头部。绝大多数硬骨鱼精子并不具备顶体结构(Mattei, 1991)。本研究中, 大菱鲆的精子头部呈椭圆形[长径: (1.48±0.06)µm, 短径(0.97±0.15)µm], 无顶体, 符合典型的卵生硬骨鱼特征, 与草鱼(林光华等, 1998)、鲇(乔志刚等, 2016)、大口黑鲈(乔志刚等, 2017)等淡水体外受精硬骨鱼与海水体外受精硬骨鱼精子头部形状相同, 而许氏平鲉精子拥有细长的头部[长径: (3.15±0.17)µm, 短径: (1.44±0.10)µm], 与胎鳚(Fishelson et al, 2007)、海鱮(Gardiner, 1978)、狼鱼(Pavlov et al, 1997)等海水体外受精硬骨鱼精子和褐菖鲉(林丹军等, 1998)、孔雀鱼(郭明申等, 2006)、剑尾鱼(温茹淑等, 2012)在内的淡水体内受精硬骨鱼精子相同。体内受精鱼类精子在交尾后, 需要穿过生殖道到达卵巢和精子储存的位置, 待卵子成熟后方可穿过受精孔进行受精, 细长的头部为精子运动减少了极大阻力, 为受精过程提供了良好的结构支撑。
值得注意的是, 体内受精鱼类精子中段较长, 线粒体数量较多, 但体外受精鱼类精子均具有不明显或者较短的中段, 线粒体数量较少。许氏平鲉精子中段较长, 达(1.23±0.48)µm, 纵截面呈不对称三角形, 一侧膨起并含有大量圆球状线粒体。线粒体层层垛叠, 大约有三到四层, 每层有10—15个线粒体紧密排列, 共约有30—40个线粒体。许氏平鲉与鲈形目进化关系较近, 这种不对称精子符合典型的鲈形目精子特征, 精子结构也与褐菖鲉非常相似(Mattei, 1991; 李君等, 1998)。同时在其他体内受精鱼类孔雀鱼和褐菖鲉精子中均发现了30—40个线粒体。对于大菱鲆精子而言, 中部较短[(0.62±0.11)µm], 线粒体呈环状排列在植入窝内鞭毛周边, 可达10—20个。普遍而言, 对于硬骨鱼, 线粒体通常在8个以内(胡谋等, 2014)(表 3)。线粒体的数量与精子的能量供应情况息息相关, 许氏平鲉精子线粒体的数量极多, 这与许氏平鲉体内受精的受精方式和长达6个月精子储存时间的能量供应相适应。在硬骨鱼中, 精子的全长具有物种特异性, 与受精方式关联性较小。
许氏平鲉和大菱鲆精子在激活后, 运动特征参数表现出一定差异。在活动率和前向运动率没有显著性差异的情况下, 许氏平鲉精子的VCL、VSL、VAP显著低于大菱鲆精子, 其中精子BCF也有小幅度差异, 表明许氏平鲉精子在激活后速度更低。受精过程中精子间的竞争推动了不同种类脊椎动物中与精子大小、游泳速度、精子发生和能量学相关的结构和功能特化的进化(Parker et al, 2010)。来自许多比较研究的证据大多支持中段更大, 线粒体更为丰富, 运动速度更高, 具有较大尾头比的精子具有较大的竞争力(Stockley et al, 1997)。许氏平鲉精子尾部鞭毛长(22.10±1.18)µm, 显著短于大菱鲆精子[(48.29±1.31)µm], 大菱鲆精子较长的尾部推动精子有着更高的VCL、VSL和VAP。许氏平鲉与大菱鲆精子的鞭毛轴丝均具有典型的“9+2”的二联微管结构, 质膜向外扩张形成侧鳍。Mattei(1988)指出了鞭毛侧鳍也具有提高精子的活动能力作用。
4 结论许氏平鲉与大菱鲆的精子均由头部, 中段和尾部构成, 且头部无顶体, 尾部鞭毛轴丝为“9+2”微管结构。体内受精硬骨鱼许氏平鲉精子头部细长, 长径: (3.15±0.17)µm, 短径: (1.44±0.10)µm; 中段长(1.23±0.48)µm, 两侧不对称, 呈囊袋状, 线粒体呈垛叠状紧密排列在中段, 约有3—4层, 共30—40个线粒体, 为长达6个月的精子储存以及受精过程提供能量; 尾部侧鳍较发达。体外受精硬骨鱼大菱鲆精子头部呈椭圆形, 头部, 大量囊泡分布其中; 中段较短[(0.62±0.11)µm], 向外突出的线粒体包裹鞭毛形成“半袖套”结构; 尾部侧鳍不发达。许氏平鲉精子密度和体外激活寿命均显著高于大菱鲆精子, 而激活后精子的平均曲线速度(VCL)、平均直线运动速度(VSL)、平均路径速度(VAP)显著低于大菱鲆精子。
王茜, 王小刚, 李鹏, 等. 2015. 4种虾虎鱼类精子超微结构的研究与比较. 江苏农业科学, 43: 320-322 |
王小刚, 骆剑, 尹绍武, 等. 2013. 点带石斑鱼的精子活力及超低温冷冻前后精子超微结构的比较. 海洋科学, 37: 70-75 |
尤永隆, 林丹军. 1996. 鲤鱼精子超微结构的研究. 动物学研究, 17(4): 377-383 |
乔志刚, 刘淑琰, 沈方方. 2016. 鲇精子超微结构及pH、温度对其精子活力的影响. 大连海洋大学学报, 31(6): 602-606 |
乔志刚, 张晓光, 沈方方, 等. 2017. 大口黑鲈精子超微结构研究. 四川动物, 36(6): 686-690 |
李君, 蔡亚非. 1998. 动物精子形态的进化趋向. 安徽师大学报(自然科学版), 21(2): 101-104 |
张涛, 邹桂伟, 梁宏伟, 等. 2015. 四种罗非鱼精子超微结构的比较. 淡水渔业, 45(5): 29-34 |
张永忠, 徐永江, 柳学舟, 等. 2004. 圆斑星鲽精子的超微结构及核前区特殊结构(英文). 动物学报, 50(4): 630-637 |
林丹军, 尤永隆. 1998. 褐菖鲉精细胞晚期的变化及精子结构研究. 动物学研究, 19(5): 359-366 |
林光华, 林琼, 胡成钰, 等. 1998. 草鱼、兴国红鲤和革胡子鲇精子超微结构的比较研究. 南昌大学学报(理科版), 22(3): 283-287 |
胡谋, 苗亮, 李明云, 等. 2014. 黄姑鱼(Nibea albiflora)与大黄鱼(Pseudosciaena crocea)精子超微结构的观察与比较. 生物学杂志, 31(2): 1-4 |
郭明申, 刘龙, 穆淑梅, 等. 2006. 孔雀鱼精子发生的显微与超微结构. 河北大学学报(自然科学版), 26(6): 653-658 |
温茹淑, 曾德莉, 方展强. 2012. 剑尾鱼精巢的显微和超微结构观察. 华南师范大学学报(自然科学版), 44(4): 113-116 |
蔺玉珍, 2013.许氏平鲉繁殖生理及发育生物学研究.青岛: 中国海洋大学硕士学位论文
|
Fishelson L, Gon O, Holdengreber V et al, 2007. Comparative spermatogenesis, spermatocytogenesis, and spermatozeugmata formation in males of viviparous species of clinid fishes (Teleostei:Clinidae, Blennioidei). The Anatomical Record:Advances in Integrative Anatomy and Evolutionary Biology, 290(3): 311-323 DOI:10.1002/ar.20412 |
Gardiner D M, 1978. Fine structure of the spermatozoon of the viviparous teleost, Cymatogaster aggregata. Journal of Fish Biology, 13(4): 435-438 DOI:10.1111/j.1095-8649.1978.tb03452.x |
Guo W, Shao J, Li P et al, 2016. Morphology and ultrastructure of Brachymystax lenok tsinlingensis spermatozoa by scanning and transmission electron microscopy. Tissue and Cell, 48(4): 321-327 DOI:10.1016/j.tice.2016.05.009 |
Hart N H, 1990. Fertilization in teleost fishes:mechanisms of sperm-egg interactions. International Review of Cytology, 121: 1-66 DOI:10.1016/S0074-7696(08)60658-0 |
Hess R A, Thurston R J, Gist D H, 1991. Ultrastructure of the turtle spermatozoon. Anatomical Record, 229(4): 473-481 DOI:10.1002/ar.1092290406 |
Mattei X, 1988. The flagellar apparatus of spermatozoa in fish. Ultrastructure and evolution. Biology of the Cell, 63(2): 151-158 |
Mattei X, 1991. Spermatozoon ultrastructure and its systematic implications in fishes. Canadian Journal of Zoology, 69(12): 3038-3055 DOI:10.1139/z91-428 |
Nicander L, 1970. Comparative studies on the fine structure of vertebrate spermatozoa. In: Baccetti B ed. Comparative Spermatology. New York: Academic Press
|
Parker G A, Pizzari T, 2010. Sperm competition and ejaculate economics. Biological Reviews, 85(4): 897-934 |
Pavlov D A, Knudsen P, Emel'yanova N G et al, 1997. Spermatozoon ultrastructure and sperm production in wolffish (Anarhichas lupus), a species with internal fertilization. Aquatic Living Resources, 10(3): 187-194 DOI:10.1051/alr:1997020 |
Pusey B J, Stewart T, 1989. Internal fertilization in Lepidogalaxias salamandroides Mees (Pisces:Lepidogalaxiidae). Zoological Journal of the Linnean Society, 97(1): 69-79 DOI:10.1111/j.1096-3642.1989.tb00554.x |
Stockley P, Gage M J G, Parker G A et al, 1997. Sperm competition in fishes:the evolution of testis size and ejaculate characteristics. The American Naturalist, 149(5): 933-954 DOI:10.1086/286031 |
 2020, Vol. 51
2020, Vol. 51


