
中国海洋湖沼学会主办。
文章信息
- 郭少鹏, 江兴龙, 王泽旭, 魏金生. 2020.
- GUO Shao-Peng, JIANG Xing-Long, WANG Ze-Xu, WEI Jin-Sheng. 2020.
- 高效硝化与反硝化功能菌株的分离筛选及其性能研究
- ISOLATION AND SCREENING OF HIGH-EFFICIENCY NITRIFICATION AND DENITRIFICATION FUNCTIONAL STRAINS AND EFFECT EVALUATION
- 海洋与湖沼, 51(6): 1520-1529
- Oceanologia et Limnologia Sinica, 51(6): 1520-1529.
- http://dx.doi.org/10.11693/hyhz20200400106
文章历史
-
收稿日期:2020-04-02
收修改稿日期:2020-04-29
2. 鳗鲡现代产业技术教育部工程研究中心 厦门 361021
2. Engineering Research Center of the Modern Technology for Eel Industry, Ministry of Education, Xiamen 361021, China
氮元素在水中的积累是养殖水体恶化的主要原因, 其中氨氮和亚硝态氮对养殖动物具有很强的毒性(易弋等, 2011)。氨氮会影响养殖动物体内的酶反应和细胞膜的稳定, 还会影响鳃对氧的传递性, 破坏水生动物的排泄系统和渗透平衡(薛菲菲, 2014)。亚硝酸盐氮是水环境生态系统循环中的一种中间产物(王鸿泰等, 1989; 余瑞兰等, 1999; 高明辉等, 2008), 是诱发水产动物暴发性疾病的重要环境因子(凌歌, 2010)。而在局部缺氧环境中, 硝酸盐氮会被转化为亚硝酸盐氮, 亚硝酸盐氮的致癌性使得原本毒性很小的污染物毒性增强, 造成水质恶化, 伴随着滋生大量的病毒、细菌、浮游生物等微生物(邵可, 2017)。传统的生物脱氮过程分为硝化作用(NH4+→NO2-→NO3-)和厌氧反硝化作用(NO3-→NO2-→NO→N2O→N2)两个过程, 需要分别在好氧和厌氧条件下完成(Khardenavis et al, 2007; Takenaka et al, 2007)。反硝化细菌是去除环境中对生物有毒害作用亚硝酸盐氮的重要菌群, 通过好氧或厌氧反硝化过程将硝酸盐氮或亚硝酸盐氮转化成N2O或N2, 从根本上解决水体中氮污染的问题(何腾霞等, 2015; Guo et al, 2016)。由集美大学江兴龙教授发明的生物膜净水栅(专利号CN201120032516.6)已广泛应用于改善鳗鲡及对虾养殖水体水质, 在凡纳滨对虾养殖池塘中设置生物膜净水栅, 结果表明水体的氨氮和亚硝酸盐氮等浓度显著降低, 水质得到显著改善, 达到了节水减排、增产增收的效果(江兴龙等, 2013); 通过使用生物膜净水栅建立室内工厂化花鳗鲡生物膜低碳养殖新模式, 结果表明减少换水量85%, 氨氮和亚硝酸盐氮等浓度显著降低, 达到了节水减排、改良水质、提高单产的效果(尼逸伦, 2015)。进入21世纪以来, 循环水养殖模式的相关研究取得突破性的进展, 循环水处理工艺与养殖种类日益丰富, 并逐渐规模化、工厂化。工厂化循环水养殖设备主要由养殖桶、集水池、反冲过滤器、生物滤池等组成(王峰等, 2013)。循环水养殖系统不仅可以显著改善养殖水体水质, 而且可以将养殖水的循环率提高到95%以上(朱峰, 2015)。生物膜净水栅及循环水水处理系统的净水原理, 除了物理过滤之外, 微生物处理是其主要的作用方式。在养殖过程中, 生物膜净水栅的生物膜和循环水水处理系统的生物滤池中存在大量硝化细菌与反硝化细菌, 但罕有研究报道对脱氮细菌开展筛选、分离、扩培和强化, 以提高其脱氮性能。
本研究通过应用选择培养基的方法, 分别从鳗鲡精养殖水体的生物膜净水栅和循环水水处理系统生物滤池生物填料的生物膜上, 分离筛选出具有高效硝化与反硝化功能的两个菌株NB-1和DB-1, 对其进行菌种鉴定及硝化与反硝化性能的研究, 探索提高脱氮效率的方法, 为提高养殖水体水质调控效果及水处理系统的脱氮效率提供指导。
1 材料与方法 1.1 材料 1.1.1 菌株本试验中的硝化细菌菌株NB-1、厌氧反硝化细菌菌株DB-1分别分离筛选于鳗鲡精养殖水体中设置的生物膜净水栅及鳗鲡循环水水处理系统反硝化处理单元的生物填料。
1.1.2 培养基应用硝化细菌培养基(周鲜娇等, 2016)筛选生物膜净水栅生物膜上的硝化细菌。应用厌氧反硝化细菌培养基(蒋欣燃, 2017)筛选生物填料生物膜上的厌氧反硝化细菌。
1.2 方法 1.2.1 菌株的筛选、分离与鉴定 1.2.1.1 硝化细菌的筛选分离与菌种鉴定用无菌剪刀剪下10g生物膜净水栅尼龙丝, 并装入盛有100mL灭菌水的蓝盖瓶中, 超声波震荡30min后获得菌悬液。参考类似研究方法(熊焰等, 2010; 李永芹等, 2013), 将菌悬液按10%比例接入已灭菌的亚硝酸盐富集培养基中, 30℃, 180r/min恒温振荡培养, 每天加入5%的亚硝酸钠溶液2mL, 富集培养1周, 用平板稀释法分离纯化。取分离纯化后得到的单菌落菌株置于装有50mL普通肉汤培养基中, 80℃水浴加热处理30min, 杀死微生物营养体细胞。然后30℃, 180r/min恒温振荡培养24h, 将增殖培养液置于80℃水浴加热30min, 再次杀死不形成芽孢的营养体细胞。取1mL处理液以梯度稀释法分别稀释到10–3, 10–4, 10–5等。分别取0.1mL菌液涂布于普通肉汤固体培养基上, 于30℃恒温培养箱中培养24h后, 挑选单菌落, 划线接种至普通肉汤固体培养基中培养24h, 并分离纯化三次。接种至固体斜面培养基中培养并4℃保藏, 备用。
挑取菌株单菌落接种在LB液体培养基中30℃条件下170r/min振荡培养12h后, 离心收集菌体, 利用细菌DNA提取试剂盒(天根生化, 北京)提取菌株的基因组DNA, 利用通用引物27F (5′-AGAGTTT GATCCTGGCTCAG-3′)和1492R (5′-GGTTACCTTGT TACGACTT-3′)进行16S rRNA基因的PCR扩增, PCR反应条件为: 95℃预变性5min, 30个循环(95℃ 1min, 53℃ 1min, 72℃ 1.5min), 72℃延伸10min。用胶回收试剂盒(天根生化, 北京)纯化大约1.5kb的目的片段, 将纯化后的PCR产物送至美吉生物进行测序, 将所得序列经NCBI网站的BLAST (http://www.ncbi.nlm.nih.gov/blast)进行在线比对分析, 利用MEGA X软件中的Neighbor-Joining方法构建系统发育树, 确定菌株的种属。
1.2.1.2 厌氧反硝化细菌的筛选分离与菌种鉴定取10g鳗鲡循环水水处理系统生物滤池底部(环境溶解氧低于1.0mg/L)的生物填料, 加入装有100mL富集培养液体培养基的灭菌蓝盖瓶中, 在低温摇床上20℃培养48h后取菌液, 每24h测定培养基中硝酸盐氮浓度, 当硝酸盐氮转化达90%以上时, 菌液用于细菌分离。通过系列稀释法和平板划线法从富集后的菌液中分离反硝化细菌, 并选取BTB培养基上菌落周围出现蓝色晕圈的菌株, 在分离纯化培养基上进行划线分离, 如此数次操作, 直到单菌落长出。
厌氧反硝化细菌的基因组DNA提取、基因组测序、菌种鉴定步骤同1.2.1.1。
1.2.2 菌株的硝化及反硝化性能研究 1.2.2.1 硝化细菌的硝化性能研究挑取菌株NB-1单菌落接于灭菌LB液体培养基中, 30℃条件下170r/min振荡培养24h。在1L养殖废水中接种0.025% NB-1菌液, 另一组同时还添加红糖, 定时采集水样离心取上清液测定24h氨氮和CODMn浓度的变化情况。
按0.025%的接种量接种菌液于1L养殖废水中后培养24h, 定时采集水样离心取上清液测定亚硝酸盐氮的降解率。
在1L养殖废水中接种0.025% NB-1菌液, 并添加梯度浓度(800, 400, 200, 100, 10, 1, 0mg/L)的红糖, 测定亚硝酸盐氮降解率的变化情况。
1.2.2.2 厌氧反硝化细菌的反硝化性能研究挑取菌株DB-1单菌落接于灭菌LB液体培养基中, 30℃条件下170r/min振荡培养24h后, 按照1%的接种量接于1L养殖废水中进行厌氧培养24h, 定时采集水样离心取上清液, 测定氨氮、亚硝酸盐氮、硝酸盐氮、总氮的浓度, 并测算降解率。以对菌株生长和脱氮影响比较显著的接种量、C/N和硝酸盐氮浓度为单因素变量, 对菌株DB-1的脱氮条件进行优化。接种量分别按照0.2%、0.4%、0.6%、0.8%和1%的比例添加菌液; C/N利用红糖将1L试验水体的C/N调整为4、8、12、16、20;硝酸盐氮浓度则将1L试验水体的硝酸盐氮浓度设置为5、10、15、20、25mg/L, 菌株DB-1的接种量为0.6%, 试验水体的本底养殖废水C/N为12。脱氮优化试验的测量指标为硝酸盐氮和总氮。
1.2.3 水质检测方法氨氮的测定用纳氏试剂光度法, 亚硝酸盐氮的测定用分光光度法, 硝酸盐氮的测定用紫外分光光度法, 总氮的测定用碱性过硫酸钾消解紫外分光光度法, CODMn测定用高锰酸钾法(国家环境保护总局等, 2002)。
1.2.4 数据统计与分析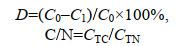
式中, D为水质因子(例如氨氮、亚硝酸盐氮、硝酸盐氮、总氮、高锰酸盐指数)的降解率(%); C0为水质因子起始浓度(mg/L); C1为水质因子终浓度(mg/L)。C/N为碳氮比; CTC为高锰酸盐指数浓度(CODMn) (mg/L); CTN为总氮浓度(TN) (mg/L)。
采用Excel软件对试验数据进行统计分析, 并作图。应用SPSS 22.0统计分析软件进行分析, 视情况对处理组与对照组的试验数据进行差异显著水平的单因素方法分析或t-test检验。
2 结果 2.1 菌株的筛选及鉴定 2.1.1 菌株NB-1的筛选及鉴定经富集培养、平板初筛和摇瓶培养测定菌株脱氮效率的复筛, 最终确定一株硝化细菌菌株, 编号为NB-1。以菌株NB-1的基因组DNA为模板, 以16S rRNA基因的通用引物进行PCR扩增, PCR产物经测序后获得1412bp的碱基序列, 将该序列在NCBI网站进行BLAST同源序列比对, 菌株NB-1与Bacillus相似性高达99.93%, 利用MEGA X构建的系统发育进化树见图 1。
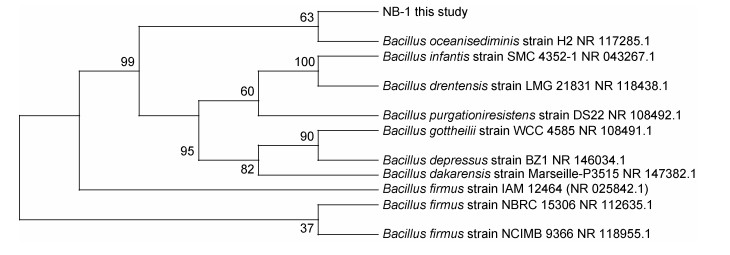 |
| 图 1 菌株NB-1基于16S rRNA基因序列的的系统发育进化树 Fig. 1 Phylogenetic tree of NB-1 strain based on 16S rRNA gene sequence |
经富集培养、平板初筛和摇瓶培养测定菌株脱氮效率的复筛, 最终确定一株厌氧反硝化细菌菌株, 编号为DB-1。以菌株DB-1的基因组DNA为模板, 以16S rRNA基因的通用引物进行PCR扩增, PCR产物经测序后获得1389bp的碱基序列, 将该序列在NCBI网站进行BLAST同源序列比对, 菌株DB-1与Pseudomonas putida JCM 13061相似性高达100%, 利用MEGA X构建的系统发育进化树见图 2。
 |
| 图 2 菌株DB-1基于16S rRNA基因序列的的系统发育进化树 Fig. 2 Phylogenetic evolutionary tree of DB-1 strain based on 16S rRNA gene sequence |
因此, 确定已筛选的菌株NB-1属于芽孢杆菌属(Bacillus), 菌株DB-1(Pseudomonas putida)是恶臭假单胞菌。
2.2 菌株NB-1的硝化作用性能 2.2.1 亚硝化及硝化作用的能力开展水体氨氮降解对照试验, 按0.025%的接种量接种菌株NB-1到1L养殖废水中(氨氮浓度为2.28mg/L, DO浓度为5.0mg/L), 另一组同时还添加100mg/L红糖, 对照组为不接种菌及不加红糖。结果见图 3, 24h添加菌液组的氨氮浓度降至0.695mg/L(降解率69.5%), 添加菌液和红糖组的氨氮浓度降至0.208mg/L(降解率90.8%), 而对照组的氨氮降浓度降至2.18mg/L(降解率4.39%)。添加菌液组和添加菌液红糖组的氨氮浓度分别极显著低于对照组43.8%和52.0%(P < 0.01)。表明菌株NB-1具有亚硝化作用性能, 进行了亚硝化反应: NH4++O2→NO2-+H2O+2H+。
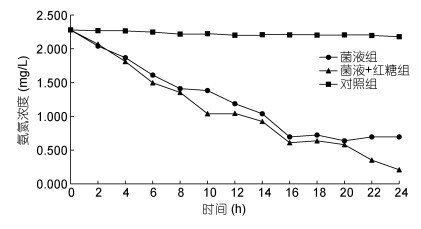 |
| 图 3 24h氨氮降解情况 Fig. 3 Ammonia nitrogen concentration degradation in 24h |
应用菌株NB-1开展水体亚硝酸盐氮降解对照试验, 按0.025%的接种量接种菌株NB-1到1L养殖废水中(亚硝酸盐氮浓度为2.28mg/L, DO浓度为5.0mg/L), 对照组不接种菌。结果见图 4, 亚硝酸盐氮的浓度在第12h时低于0.2mg/L, 第16h时低于0.05mg/L, 至24h亚硝酸盐氮一直保持极低的状态(降解率为99.2%); 对照组的亚硝酸盐浓度在24h时为2.144mg/L(降解率为6.32%)。添加菌液组的亚硝酸盐氮浓度极显著低于对照组57.1% (P < 0.01)。表明菌株NB-1具有良好的硝化作用性能, 发生硝化反应: NO2-+O2→NO3-。综上, 表明菌株NB-1具有良好的亚硝化作用及硝化作用的功能, 在投菌量为0.025%时, 24h对氨氮和亚硝酸盐氮的降解率为69.5%和99.2%。
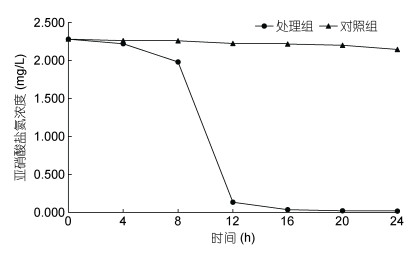 |
| 图 4 24h亚硝酸盐氮降解情况 Fig. 4 Degradation of nitrite nitrogen concentration in 24h |
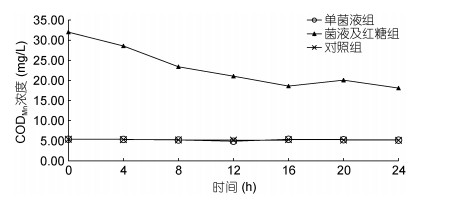
为确定菌株NB-1是自养菌或异养菌, 应用菌株NB-1开展水体CODMn降解对照试验, 按0.025%的接种量接种菌株NB-1到1L养殖废水中(CODMn浓度为5.3mg/L, 低碳组), 另一组处理同时添加100mg/L红糖为高碳组, 对照组不做处理。检测24h的CODMn浓度的变化情况。结果见图 5, 高碳组的CODMn为32.00mg/L, 24h CODMn逐渐降低至18.09mg/L。而低碳组CODMn浓度无明显变化, 终浓度仍为5.16mg/L, 对照组的CODMn和低碳组无显著差异。表明菌株NB-1没有利用有机物, 属于自养菌。而在高碳组中, 高浓度的有机碳源导致水体中的异养菌数量迅速扩增, 通过同化利用有机物而降低了CODMn浓度。综上, 结果表明, 菌株NB-1属自养菌, 进行硝化反应时不消耗水中的碳源。
 |
| 图 5 24h CODMn变化情况 Fig. 5 Variation of CODMn concentration in 24h |
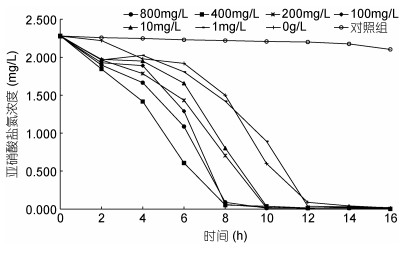
图 3的试验结果, NB-1菌液和红糖组的氨氮降解率高于NB-1菌液组, 表明高浓度的有机碳源导致水体中的异养菌数量迅速扩增, 异养菌同化利用氨氮而进一步降低了氨氮浓度。应用菌株NB-1开展16h水体亚硝酸盐氮降解试验, 在1L养殖废水中, 添加菌株NB-1和梯度浓度的红糖(红糖浓度由高到低分别编号为A1、A2、A3、A4、A5、A6、A7、A8组, A8组为不添加菌液的对照组)。碳源红糖浓度对亚硝酸盐降解率的影响见表 1及图 6, 8h亚硝酸盐的降解率, A1、A2、A4组显著高于A3组, A3组又显著高于A5组, A5组又显著高于A6组, A6组又显著高于A7组, A7组又显著高于A8组; 16h亚硝酸盐的降解率, A1、A2、A3组均显著高于A4、A5、A6、A7组, 它们又显著高于A8组。结果表明, 补充碳源红糖的投加, 促进了亚硝酸盐氮降解。由于菌株NB-1是自养型细菌, 碳源应该是促进了水中异养细菌的数量扩增, 之后异养细菌同化利用了亚硝酸盐氮; 当补充碳源红糖浓度在100mg/L以上时, 对亚硝酸盐氮的降解无显著差异, 表明水体中的异养细菌对有机碳源的同化利用已达上限, 上限浓度是100mg/L。综上, 结果表明添加有机碳源可以提高菌株NB-1在8h时对亚硝酸盐氮的降解率。
| 组别 | 亚硝酸盐氮起始浓度(mg/L) | 8h浓度(mg/L) | 16h浓度(mg/L) | 8h降解率(%) | 16h降解率(%) |
| A1 | 2.281±0.005a | 0.097±0.002a | 0.010±0.002a | 96.1±0.4a | 99.6±0.1a |
| A2 | 2.284±0.002a | 0.045±0.002b | 0.015±0.003a | 97.7±0.4a | 99.4±0.1a |
| A3 | 2.278±0.002a | 0.709±0.013c | 0.012±0.004a | 69.1±0.9b | 99.5±0.2a |
| A4 | 2.276±0.001a | 0.058±0.009b | 0.023±0.003a | 97.4±1.1a | 99.0±0.2b |
| A5 | 2.276±0.004a | 0.807±0.012d | 0.024±0.003a | 64.8±16c | 99.0±0.1b |
| A6 | 2.284±0.007a | 1.424±0.014e | 0.031±0.002b | 37.7±1.6d | 98.6±0.2b |
| A7 | 2.279±0.011a | 1.498±0.015f | 0.024±0.002a | 34.2±0.3e | 99.0±0.2b |
| A8 | 2.280±0.002a | 2.218±0.017g | 2.141±0.033c | 2.6±0.3f | 5.2±0.8c |
| 注:同一列中不同上标字母表示数值之间有显著差异(P < 0.05), 相同上标字母表示无显著差异(P > 0.05) | |||||
 |
| 图 6 16h红糖浓度和添加NB-1菌对亚硝酸盐氮降解情况 Fig. 6 Degradation on nitrite nitrogen concentration by brown sugar and NB-1 strain in 16h |
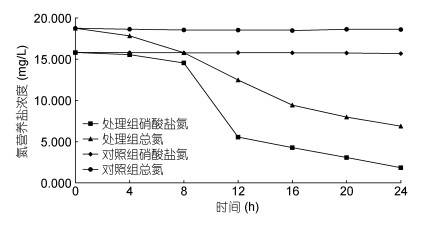
应用菌株DB-1开展水体硝酸盐氮及总氮降解试验, 按1%的接种量在1L养殖废水(硝酸盐氮浓度为15.8mg/L, 总氮浓度为18.7mg/L, DO浓度 < 0.5mg/L, CODMn为288.60mg/L, C/N=15.43)中接种菌株DB-1后进行厌氧培养24h, 对照组不接种菌。24h水质因子浓度的变化情况见表 2及图 7, 处理组硝酸盐氮和总氮的降解率均极显著高于对照组(P < 0.01), 处理组24h水体中硝酸盐氮降解率为88.3%, 总氮降解率为63.3%, 氨氮无积累, 产生的亚硝酸盐氮积累为硝酸盐氮降解量的13.7%;而对照组的各水质因子浓度无明显变化, 变化幅度不超过5%。综上, 结果表明菌株DB-1具有良好的厌氧反硝化作用功能, 发生反硝化反应: 2NO3-+4H++4e–→NO2-+2H2O, 2NO2-+4H++2e–→2NO+2H2O, 2NO+ 2H++2e→N2O+H2O, N2O+2H++2e→N2+H2O (Wilson et al, 1997)。
| 水质因子 | 起始浓度(mg/L) | 处理组浓度(mg/L) | 对照组浓度(mg/L) | 处理组降解率(%) | 对照组降解率(%) |
| 氨氮 | 1.134±0.014 | 1.171±0.014 | 1.153±0.011 | –3.3±2.3a | –1.7±2.2b |
| 亚硝酸盐氮 | 1.589±0.011 | 3.495±0.059 | 1.641±0.012 | –120±5.2c | –3.3±1.5d |
| 硝酸盐氮 | 15.813±0.026 | 1.847±0.029 | 15.679±0.036 | 88.3±0.2e | 0.8±0.1f |
| 总氮 | 18.747±0.024 | 6.881±0.056 | 18.597±0.056 | 63.3±0.3g | 0.8±0.4h |
| 注:处理组和对照组的硝酸盐氮和总氮24h的降解率均有极显著差异(P < 0.01) | |||||
 |
| 图 7 24h氮营养盐浓度变化情况 Fig. 7 Variation of nitrogen nutrient concentration in 24h |
应用菌株DB-1开展水体硝酸盐氮及总氮降解试验, 按0.2%、0.4%、0.6%、0.8%、1.0%(分别编号为B1、B2、B3、B4、B5组)的接种量在1L养殖废水中接种菌株DB-1后进行厌氧培养48h, 并调节试验水体的C/N为16。24h不同接种量硝酸盐氮和总氮的降解效果见表 3, B3、B4、B5组的硝酸盐氮降解率显著高于B1、B2组; B5组的总氮降解率显著高于B3、B4组, 他们又显著高于B2组, B2组又显著高于B1组。48h不同接种量硝酸盐氮和总氮的降解效果见表 4, B5组的硝酸盐氮降解率显著高于B3组, B3又显著高于B4组, B4又显著高于B2组, B2组又显著高于B1组; B5组的总氮降解率显著高于B4组, B4又显著高于B3组, B3又显著高于B2组, B2组又显著高于B1组。接种量在0.4%以下时, 反硝化作用不明显。接种量在0.6%时, 硝酸盐氮24h的降解率为83.9%, 提高接种量或者增加24h的反应时间, 1%接种量对硝酸盐氮的降解率提高到91.6%;而总氮的降解率随接种量的增多而升高, 在接种量为1%时, 总氮48h时的降解率为56.1%。因此, 得出菌株DB-1降解硝酸盐氮及总氮的适宜接种量为0.6%。
| 组别 | 硝酸盐氮初始浓度(mg/L) | 总氮初始浓度(mg/L) | CODMn初始浓度(mg/L) | C/N | 硝酸盐氮降解率(%) | 总氮降解率(%) |
| B1 | 19.621±0.030a | 21.904±0.026a | 349.71±0.57a | 16.0±0.0a | 0.2±0.1a | 8.8±0.5a |
| B2 | 19.620±0.017a | 21.916±0.014a | 350.33±0.92a | 16.0±0.1a | 16.4±0.4a | 10.8±0.6b |
| B3 | 19.630±0.018a | 21.924±0.020a | 350.58±0.97a | 16.0±0.1a | 83.7±0.7b | 16.8±0.9c |
| B4 | 19.631±0.012a | 21.930±0.022a | 350.18±0.70a | 16.0±0.0a | 83.3±0.6b | 16.4±0.8c |
| B5 | 19.636±0.011a | 21.886±0.020a | 350.41±0.38a | 16.0±0.0a | 83.5±0.4b | 42.5±0.8d |
| 注:同一列中不同上标字母表示数值之间有显著差异(P < 0.05), 相同上标字母表示无显著差异(P > 0.05) | ||||||
| 组别 | 硝酸盐氮初始浓度(mg/L) | 总氮初始浓度(mg/L) | CODMn初始浓度(mg/L) | C/N | 硝酸盐氮降解率(%) | 总氮降解率(%) |
| B1 | 19.621±0.030a | 21.904±0.026a | 349.71±0.57a | 16.0±0.0a | 0.6±0.2a | 12.8±0.4a |
| B2 | 19.620±0.017a | 21.916±0.014a | 350.33±0.92a | 16.0±0.1a | 25.2±1.0b | 18.4±0.8b |
| B3 | 19.630±0.018a | 21.924±0.020a | 350.58±0.97a | 16.0±0.1a | 88.6±0.8c | 30.3±0.9c |
| B4 | 19.631±0.012a | 21.930±0.022a | 350.18±0.70a | 16.0±0.0a | 85.5±1.0d | 33.8±1.2d |
| B5 | 19.636±0.011a | 21.886±0.020a | 350.41±0.38a | 16.0±0.0a | 91.6±0.5e | 56.4±0.5e |
| 注:同一列中不同上标字母表示数值之间有显著差异(P < 0.05), 相同上标字母表示无显著差异(P > 0.05) | ||||||
应用菌株DB-1开展水体硝酸盐氮及总氮降解试验,按0.6%的接种量在1L养殖废水中接种菌株DB-1后进行厌氧培养48h,并调节试验水体的C/N为4、8、12、16、20(分别编号为C1、C2、C3、C4、C5组)。不同C/N在24h对菌株DB-1降解硝酸盐氮和总氮的影响见表 5,C3组的硝酸盐氮降解率显著高于C5组,C5组又显著高于C2、C4组, 它们又显著高于C1组; C5组的总氮降解率显著高于C3、C4组, 他们又显著高于C1、C2组。不同C/N在48h对菌株DB-1降解硝酸盐氮和总氮的影响见表 6, C3、C5组的硝酸盐氮降解率显著高于C1、C4组, 他们又显著高于C2组; C4、C5组的总氮降解率显著高于C3组, C3组又显著高于C1、C2组。在接种量为0.6%的条件下, C/N为12组在24h的硝酸盐氮的降解率为93.4%, 总氮降解率为65.3%;在48h时, 硝酸盐氮和总氮的降解率也仅提高为94.6%和65.2%。继续提高C/N, C/N为20时48h硝酸盐氮的降解率为95.8%, 总氮降解率为64.2%。而C/N为4和8时, 硝酸盐氮和总氮降解速率较慢, 且总氮的最终降解率也偏低。因此, 得出菌株DB-1降解硝酸盐氮及总氮的适宜C/N为12。
| 组别 | 硝酸盐氮初始浓度(mg/L) | 总氮初始浓度(mg/L) | CODMn初始浓度(mg/L) | C/N | 硝酸盐氮降解率(%) | 总氮降解率(%) |
| C1 | 19.633±0.008a | 21.905±0.018a | 87.86±0.07 | 4.0±0.1 | 66.3±0.6a | 44.2±0.8a |
| C2 | 19.637±0.012a | 21.907±0.011a | 173.24±0.08 | 7.9±0.1 | 82.6±0.4b | 43.7±1.0a |
| C3 | 19.636±0.009a | 21.914±0.017a | 258.60±0.20 | 11.8±0.2 | 93.4±0.6c | 62.8±1.0b |
| C4 | 19.625±0.008a | 21.906±0.004a | 346.59±0.06 | 15.8±0.1 | 83.6±0.4b | 62.6±0.6b |
| C5 | 19.634±0.009a | 21.909±0.014a | 436.18±0.29 | 19.9±0.3 | 90.9±0.9d | 65.2±0.3c |
| 注:同一列中不同上标字母表示数值之间有显著差异(P < 0.05), 相同上标字母表示无显著差异(P > 0.05) | ||||||
| 组别 | 硝酸盐氮初始浓度(mg/L) | 总氮初始浓度(mg/L) | CODMn初始浓度(mg/L) | C/N | 硝酸盐氮降解率(%) | 总氮降解率(%) |
| C1 | 19.633±0.008a | 21.905±0.018a | 87.86±0.07 | 4.0±0.1 | 90.5±1.2a | 61.9±0.7a |
| C2 | 19.637±0.012a | 21.907±0.011a | 173.24±0.08 | 7.9±0.1 | 88.6±0.7b | 60.9±0.4a |
| C3 | 19.636±0.009a | 21.914±0.017a | 258.60±0.20 | 11.8±0.2 | 94.6±0.6c | 64.0±0.2b |
| C4 | 19.625±0.008a | 21.906±0.004a | 346.59±0.06 | 15.8±0.1 | 91.6±0.9a | 68.6±0.9c |
| C5 | 19.634±0.009a | 21.909±0.014a | 436.18±0.29 | 19.9±0.3 | 95.8±0.6c | 67.8±0.6c |
| 注:同一列中不同上标字母表示数值之间有显著差异(P < 0.05), 相同上标字母表示无显著差异(P > 0.05) | ||||||
应用菌株DB-1开展水体硝酸盐氮及总氮降解试验, 按0.6%的接种量在1L养殖废水中接种菌株DB-1, 调节水体的C/N为12后进行厌氧培养24h, 并调节试验水体的硝酸盐氮浓度为5、10、15、20、25mg/L(分别编号为D1、D2、D3、D4、D5组)。不同浓度的硝酸盐及总氮的降解效果见表 7。D3组的硝酸盐氮降解率显著高于D2组, D2组又显著高于D5组, D5组又显著高于D1组, D1组又显著高于D4组; D3组的总氮降解率显著高于D2组, D2组又显著高于D4、D5组, 它们又显著高于D1组。对15mg/L的硝酸盐氮和总氮的降解率均为各处理组中最高。因此表明, 菌株DB-1对硝酸盐氮及总氮均有良好的降解效果, 对硝酸盐氮的降解率为73.3%—90.1%, 对总氮的降解率为56.8%—76.4%。
| 组别 | 硝酸盐氮初始浓度(mg/L) | 总氮初始浓度(mg/L) | CODMn初始浓度(mg/L) | C/N | 硝酸盐氮24h降解率(%) | 总氮24h降解率(%) |
| D1 | 4.872±0.013 | 5.474±0.016 | 65.83±0.43 | 12.0±0.1 | 75.9±0.6a | 56.8±0.6a |
| D2 | 9.847±0.018 | 10.936±0.017 | 133.71±0.51 | 12.2±0.0 | 84.3±1.2b | 68.4±1.2b |
| D3 | 14.882±0.010 | 16.643±0.015 | 196.77±0.31 | 11.8±0.0 | 90.1±0.7c | 76.4±1.1c |
| D4 | 19.820±0.008 | 21.891±0.008 | 264.27±0.51 | 12.1±0.0 | 73.3±1.2d | 60.9±1.7d |
| D5 | 24.971±0.011 | 27.366±0.007 | 325.19±0.34 | 11.9±0.0 | 81.9±0.7e | 61.3±1.0d |
| 注:同一列中不同上标字母表示数值之间有显著差异(P < 0.05), 相同上标字母表示无显著差异(P > 0.05) | ||||||
综上, 试验结果表明菌株DB-1具有良好的厌氧反硝化作用功能, 降解硝酸盐氮和总氮最适接种量为0.6%, 最适C/N为12, 且对硝酸盐氮及总氮均有良好的降解效果, 对硝酸盐氮的降解率为73.3%— 90.1%, 对总氮的降解率为56.8%—76.4%。
3 讨论 3.1 菌株NB-1的硝化性能分析氨氮与亚硝酸盐氮是危害水产养殖水体水质及养殖生物最严重的水质理化因子, 浓度过高时容易导致鱼虾大批患病甚至死亡, 严重影响水质和水产品安全(万红等, 2006; 张卫强等, 2012)。很多水产养殖者都通过选择采用微生态制剂来改善水体环境, 缓解水质恶化产生的经济损失及环境污染。众多研究也发现, 从养殖废水或养殖污泥中筛选出的土著微生物的脱氮性能更加高效。从养殖尾水中筛选的菌株, 按5%的接种量接种于亚硝酸盐氮浓度为5mg/L的水体中进行培养72h, 亚硝酸盐氮的降解率为98.5% (周鲜娇等, 2016)。从养殖水体中分离出一株巨大芽孢杆菌(Bacillus megaterium), 将已活化的菌株接种到50mg/L的氨氮培养基中, 24h氨氮的降解率为97.7%(易弋等, 2011)。自养硝化与异养硝化的区别是其不需要任何有机营养物, 以无机碳(CO2)作为唯一碳源(郑士民等, 1983)。本研究分离筛选出的NB-1菌株属于自养型细菌。菌株NB-1在投菌量为0.025%时, 24h对氨氮的降解率为69.5%。表明, NB-1具有良好的亚硝化功能, 而再增添100mg/L红糖后, 氨氮的降解率提高为90.8%, 可能是试验水体中的异养细菌获得碳源后迅速扩增种群, 增加了吸收同化氨氮的量。传统的亚硝化细菌一般都是营自养亚硝化的, 但目前已有一些研究从环境中分离出了异养亚硝化细菌(肖维伟等, 2008; 胡修贵等, 2013)。菌株NB-1在投菌量为0.025%时, 24h对亚硝酸盐氮的降解率为99.2%, 表明NB-1菌株具有良好的硝化作用功能。在试验水体中添加碳源(红糖)可以加快亚硝酸盐氮的降解速率, 原因可能是水体中的异养细菌吸收亚硝酸盐氮, 促进了亚硝酸盐氮的降解(温东辉等, 2003)。本试验水体中的亚硝酸盐氮的降解率在一定范围内和碳源(红糖)添加量成正比关系, 但碳源添加量大于100mg/L后, 亚硝酸盐氮降解率没有进一步提高, 可能是在高碳源浓度条件下水体中的异养硝化细菌已扩增至较大数量, 抑制了自养硝化细菌的种群扩增, 抑制了硝化细菌的硝化作用。综上, 本研究分离筛选出的菌株NB-1可同时营自养亚硝化及自养硝化, 且对氨氮和亚硝酸盐氮的降解率都较高, 类似研究的报道较少。
3.2 菌株DB-1的厌氧反硝化性能分析硝酸盐氮是含氮有机物硝化反应的最终产物, 毒性较低, 只在较高浓度的时候才会对鱼虾产生毒害作用(宋协法等, 2019)。但随着环境资源保护意识的提升及环保政策的落实, 养殖尾水排放标准对总氮浓度的要求日益严格(宋长太, 2018), 这就要求水产养殖者需要关注排放水体中硝酸盐氮浓度的变化情况。硝酸盐氮的去除方式主要是反硝化细菌通过反硝化反应将硝酸盐氮经过一系列中间产物最终产生氮气排出水体, 需要在厌氧条件下进行(2NO3-+ 10e– +12H+→N2 + 6H2O)。从海水循环水养殖系统中的水处理单元分离出的厌氧反硝化细菌Vibrio及Halomonas, 在接种量为400%及厌氧条件下, 硝态氮和亚硝态氮在3h的降解率分别为82.9%和82.8% (蒋欣燃, 2017)。从红树林中筛选出的厌氧反硝化细菌Pseudomonas等7个菌属在1%接种量的条件下表现出对硝酸盐氮的高效降解(林娜等, 2012)。本研究菌株DB-1在接种量为1%时, 24h对硝酸盐氮的降解率为89.5%, 也有中间产物亚硝酸盐氮的积累, 积累量为硝酸盐氮降解量的13.7%, 不能实现完全充分的反硝化反应。分离筛选出的异养反硝化细菌在脱氮试验时投菌量均在1%以上, 甚至高达10%, 且需要额外添加碳源(何芳等, 2008; 陈朋, 2009; 康鹏亮等, 2018)。本研究在C/N为16的条件下, 菌株DB-1 24h降解90.0%硝酸盐氮的接种量仅需0.6%, 优于其他类似研究报道结果。反硝化细菌一般营异养反硝化, 其反硝化性能受到C/N的制约, 反硝化细菌的普遍最适C/N为14—16 (赵惊鸿等, 2015; 孙智毅, 2017; 张婷月等, 2018; 张霓, 2019)。如果C/N太低, 硝酸盐氮无法转化或者大量转化为亚硝酸盐氮, 无法真正脱氮; 如果C/N太高, 也会造成资源浪费和环境污染。本研究在投菌量为0.6%的基础上, 菌株DB-1在C/N为4以下时反硝化速率较低, 而在C/N为12时对硝酸盐氮降解率为93.4%, 继续提高C/N对反硝化性能没有提升。本研究菌株DB-1的最适C/N为12, 与其他研究结果不同的原因可能是菌株的新陈代谢的特征和面临的环境不同(Chiu et al, 2003), 菌株DB-1的最适C/N较其他研究报道的C/N 14—16更低, 可有效降低补充碳源的使用成本。水产养殖的主要模式有池塘养殖和工厂化养殖等, 养殖水体中的C/N一般不大于2。本研究的菌株DB-1对硝酸盐氮和总氮均有显著的降解效果, 且所需要的投菌量低, 补充碳源量低, 可以降低使用成本。综上, 表明该菌株可广泛应用于水产养殖水质调控, 具有应用推广价值。
3.3 高效硝化和反硝化细菌在水体原位修复中的应用前景在水产养殖中, 最初所使用的微生态制剂成分大多数仅为光合细菌、乳酸菌和芽孢杆菌中的一种或多种, 品种较为单一(张元, 2018)。有研究发现, 将具有硝化和反硝化功能的不同菌种按照合理的比例配比复合后使用, 对无机氮的降解效果十分显著。当光合细菌、枯草芽孢杆菌和反硝化细菌按菌液体积比为1 : 2 : 1进行复配利于水中溶解氧的提高和COD、氨氮、亚硝态氮、硝态氮的降解(谢凤行等, 2012)。推测其原因, 可能是生物特性的互补(施大林等, 2009)。本研究分离筛选的硝化细菌NB-1同时具有自营亚硝化和自营硝化的功能, 在投菌量0.025%时, 24h对氨氮的降解率为69.5%, 对亚硝酸盐氮的降解率为99.2%, 具有投菌比例低, 可大幅度降解氨氮和亚硝酸盐氮的优点。厌氧反硝化菌株DB-1具有营异养反硝化作用的功能, 在投菌量为0.6%, C/N为12时, 对硝酸盐氮和总氮的降解率为94.6%和65.3%。具有投菌量低、补充碳源量低、降低使用成本的优点。水产养殖水体中存在着低溶氧区域(陈仲晗等, 2016)。因此, 它们都可以广泛应用于池塘和工厂化养殖水体的原位水质调控。也可应用于养殖水的水处理系统的硝化单元和反硝化单元中, 提高相应的水处理能力, 具有广泛的市场应用前景。
4 结论本研究分离筛选出的菌株NB-1和DB-1, 经16S rRNA基因的序列分析和鉴定分别属于芽孢杆菌属(Bacillus)和恶臭假单胞菌(Pseudomonas putida)。
菌株NB-1属自养型细菌, 可同时营自养亚硝化和自养硝化, 在投菌量为0.025%时对氨氮的降解率为69.5%, 对亚硝酸盐氮的降解率为99.2%。
菌株DB-1属异养厌氧反硝化细菌, 营异养反硝化, 最适投菌量为0.6%, 最适C/N为12, 对硝酸盐氮和总氮的降解率分别为94.6%和65.3%。
万红, 宋碧玉, 杨毅, 等. 2006. 水产养殖废水的生物处理技术及其应用. 水产科技情报, 33(3): 99-103 |
王峰, 雷霁霖, 高淳仁, 等. 2013. 国内外工厂化循环水养殖研究进展. 中国水产科学, 20(5): 1100-1111 |
王鸿泰, 胡德高. 1989. 池塘中亚硝酸盐对草鱼种的毒害及防治. 水产学报, 13(3): 207-214 |
尼逸伦, 2015.池塘生物膜低碳养殖新模式应用研究.厦门: 集美大学硕士学位论文
|
朱峰, 2015.大黄鱼工厂化循环水养殖技术研究.厦门: 集美大学硕士学位论文
|
江兴龙, 邓来富. 2013. 凡纳滨对虾(Litopenaeus vannamei)池塘生物膜低碳养殖技术研究. 海洋与湖沼, 44(6): 1536-1543 |
孙智毅, 2017.一株异养硝化-好氧反硝化Cupriavidus sp.S1的筛选及降解特性研究.太原: 太原理工大学硕士学位论文
|
李永芹, 许乐乐, 陈克卫. 2013. 1株芽孢杆菌的筛选鉴定及其净水效果研究. 水生态学杂志, 34(1): 96-100 |
肖维伟, 曹立群, 喻其林, 等. 2008. 鸡粪好氧发酵中异养亚硝化细菌的筛选及转化能力. 中国农业大学学报, 13(3): 85-89 |
何芳, 康贻军, 单君, 等. 2008. 一株高耐氧反硝化细菌的筛选及其反硝化产物确定. 微生物学通报, 35(1): 35-39 |
何腾霞, 李振轮, 杨珊. 2015. 好氧反硝化细菌及其去除亚硝酸盐的作用机理研究进展. 过程工程学报, 15(1): 174-180 |
余瑞兰, 聂湘平, 魏泰莉, 等. 1999. 分子氨和亚硝酸盐对鱼类的危害及其对策. 中国水产科学, 6(3): 73-77 |
宋长太. 2018. 淡水养殖尾水达标排放相关知识解读. 渔业致富指南, (20): 20-22 |
宋协法, 杨晓晗, 黄志涛. 2019. 硝酸盐对鱼类毒性研究进展. 中国海洋大学学报自然科学版, 49(9): 34-41 |
张元. 2018. 池塘养殖水体中土著反硝化细菌的分离与初步鉴定. 水生态学杂志, 39(5): 111-115 |
张霓, 2019.异养硝化-好氧反硝化细菌Pseudomonas putida ZN1的脱氮及耐重金属特性研究.太原: 太原理工大学硕士学位论文
|
张卫强, 朱英. 2012. 养殖水体中氨氮的危害及其检测方法研究进展. 环境卫生学杂志, 2(6): 324-327 |
张婷月, 丁钰, 黄民生. 2018. 异养硝化-好氧反硝化细菌的筛选及其脱氮性能研究. 华东师范大学学报(自然科学版), (6): 22-31, 87 |
陈朋, 2009.反硝化细菌的筛选、鉴定及其强化处理硝酸盐废水的研究.济南: 山东大学硕士学位论文
|
陈仲晗, 徐海升, 刘翔, 等. 2016. 南方某水库底层溶解氧分布特征及低氧成因分析. 水资源保护, 32(1): 108-114 |
邵可, 2017.好氧反硝化菌的筛选及其脱氮性能的研究.北京: 中国石油大学(北京)硕士学位论文
|
林娜, 郭楚玲, 郭延萍, 等. 2012. 红树林湿地中好氧-厌氧反硝化菌脱氮特性及其种群结构分析. 环境科学学报, 32(1): 173-181 |
国家环境保护总局. 2002. 水和废水监测分析方法. 4版. 北京: 中国环境科学出版社
|
易弋, 容元平, 程谦伟, 等. 2011. 养殖水体氨氮降解菌的分离和初步鉴定. 贵州农业科学, 39(2): 154-157 |
周鲜娇, 全丽谦. 2016. 一株芽孢杆菌降解亚硝酸盐的特性研究. 岭南师范学院学报, 37(6): 77-85 |
郑士民, 钱新民, 颜望明. 1983. 自养细菌在处理工业废水中的作用. 环境保护, (11): 20-22 |
赵惊鸿, 黄少斌. 2015. 一株耐高温好氧反硝化菌的筛选及特性研究. 环境科学与技术, 38(1): 6-10, 67 |
胡修贵, 赵培, 李玉宏, 等. 2013. 生物絮团中异养亚硝化菌的分离鉴定及其特性. 渔业科学进展, 34(5): 97-103 |
施大林, 何义进, 孙梅, 等. 2009. 四联活菌制剂对养殖水体中氨氮及亚硝酸盐的降解. 水产科学, 28(11): 663-666 |
凌歌. 2010. 一种亚硝酸盐降解新方案及其在水产养殖上的应用. 渔业致富指南, (12): 27-28 |
高明辉, 马立保, 葛立安, 等. 2008. 亚硝酸盐在水生动物体内的吸收机制及蓄积的影响因素. 南方水产, 4(4): 73-79 |
康鹏亮, 陈胜男, 黄廷林, 等. 2018. 好/厌氧条件下反硝化细菌脱氮特性与功能基因. 环境科学, 39(8): 3789-3796 |
蒋欣燃, 2017.厌氧反硝化细菌的分离鉴定及其对水产养殖废水脱氮作用的初步研究.大连: 大连海洋大学硕士学位论文
|
温东辉, 唐孝炎. 2003. 异养硝化及其在污水脱氮中的作用. 环境污染与防治, 25(5): 283-285 |
谢凤行, 张峰峰, 周可, 等. 2012. 水质净化高效复合微生态制剂的研制. 环境工程学报, 6(2): 477-482 |
熊焰, 刘力源, 罗睿, 等. 2010. 1株亚硝酸盐降解菌的筛选、鉴定、降解条件及效果. 中国水产科学, 17(6): 1264-1271 |
薛菲菲, 2014.养殖池塘中氨氮降解有益微生物的分离与鉴定.青岛: 中国海洋大学硕士学位论文
|
Chiu Y C, Chung M S, 2003. Determination of optimal COD/Nitrate ratio for biological denitrification. International Biodeterioration & Biodegradation, 51(1): 43-49 |
Guo L J, Zhao B, An Q et al, 2016. Characteristics of a novel aerobic denitrifying bacterium, Enterobacter cloacae strain HNR. Applied Biochemistry and Biotechnology, 178(5): 947-959 DOI:10.1007/s12010-015-1920-8 |
Khardenavis A A, Kapley A, Purohit H J, 2007. Simultaneous nitrification and denitrification by diverse Diaphorobacter sp. Applied Microbiology and Biotechnology, 77(2): 403-409 DOI:10.1007/s00253-007-1176-5 |
Takenaka S, Zhou Q, Kuntiya A et al, 2007. Isolation and characterization of thermotolerant bacterium utilizing ammonium and nitrate ions under aerobic conditions. Biotechnology Letters, 29(3): 385-390 DOI:10.1007/s10529-006-9255-8 |
Wilson L P, Bouwer E J, 1997. Biodegradation of aromatic compounds under mixed oxygen/denitrifying conditions:a review. Journal of Industrial Microbiology & Biotechnology, 18(2): 116-130 |
 2020, Vol. 51
2020, Vol. 51


