中国海洋湖沼学会主办。
文章信息
- 王俊健, 王楠, 王彦涛, 王孝程, 李超伦. 2021.
- WANG Jun-Jian, WANG Nan, WANG Yan-Tao, WANG Xiao-Cheng, LI Chao-Lun. 2021.
- 红沿河海域常见水母的食物组成分析——基于稳定同位素和脂肪酸标记法
- FOOD COMPOSITION OF COMMON JELLYFISH SPECIES IN HONGYANHE AREA REVEALED BY FATTY ACID BIOMARKERS AND STABLE CARBON AND NITROGEN ISOTOPES
- 海洋与湖沼, 52(1): 132-143
- Oceanologia et Limnologia Sinica, 52(1): 132-143.
- http://dx.doi.org/10.11693/hyhz20200500135
文章历史
-
收稿日期:2020-05-06
收修改稿日期:2020-06-24
2. 青岛海洋科学与技术试点国家实验室 海洋生态与环境科学功能实验室 青岛 266237;
3. 中国科学院大学 北京 100049;
4. 中国科学院海洋大科学中心 青岛 266071;
5. 国家海洋环境监测中心 大连 116023;
6. 自然资源部海洋灾害预报技术重点实验室 北京 100081
2. Laboratory for Marine Ecology and Environmental Science, Pilot National Laboratory for Marine Science and Technology(Qingdao), Qingdao 266237, China;
3. University of Chinese Academy of Sciences, Beijing 100049, China;
4. Center for Ocean Mega-Science, Chinese Academy of Sciences, Qingdao 266071, China;
5. National Marine Environmental Monitoring Center, Dalian 116023, China;
6. Key Laboratory of Marine Hazards Forecasting Ministry of Natural Resources, Beijing 100081, China
近年来, 在气候变化和人类活动的影响下, 水母暴发已经成为全球性的环境问题(Mills, 2001; Purcell et al, 2007)。我国近海水母类数量也呈现增多的趋势, 对沿岸渔业、水产养殖业、工业及旅游业等造成严重危害(孙松, 2012)。水母这一胶质类浮游动物食性广, 摄食率高, 日生长率是其他同样大小的非胶质浮游动物的3.5倍(Pitt et al, 2008)。在种群快速增长过程中需要大量的饵料支撑, 直接导致浮游生物数量急剧下降(Greve, 1994), 引起浮游生物群落结构的改变。此外, 水母可摄食鱼卵和仔稚鱼、与鱼类竞争饵料, 给渔业资源带来负面影响(Duffy et al, 1997; Hansson et al, 2005)。目前水母暴发的机制以及水母暴发对生态系统的影响机理尚不清楚。因此, 查明自然环境中水母的食物来源并量化各食物的营养贡献, 可为探究水母暴发与海洋生态系统营养结构改变之间关系、揭示水母暴发机理提供基础。
水母食性分析传统方法主要有胃含物分析法及摄食试验法, 这两种方法都有各自的局限性。胃含物分析法只能反映短期内水母摄食的食物种类, 难以分辨软质易消化的食物, 无法确定食物的吸收利用情况, 不能准确定量每种食物的贡献比例(Ōmori et al, 1984; Landry et al, 1994; Perissinotto et al, 1997)。由于沙海蜇、霞水母等大型水母个体较大, 为了更为准确地模拟野外摄食情况, 所需的培养水体体积及饵料生物用量均较大, 导致摄食试验在实际实施过程中存在一定的难度。近年来稳定同位素和脂肪酸标记法被广泛地应用于海洋生态系统食物网研究中(El-Sabaawi et al, 2009; Allan et al, 2010; Connelly et al, 2014)。相比于传统的食性分析方法, 稳定同位素和脂肪酸标记法具有明显优势, 能够区分摄食的食物中被吸收的成分, 量化食物的相对贡献率, 反映捕食者长期的摄食情况及其在食物网中所处的营养位置(Kling et al, 1992; Cabana et al, 1996; Teuber et al, 2014; Henschke et al, 2015; Yang et al, 2016)。该方法也已被成功地应用在水母食物来源研究中。Milisenda等(2018)发现了夜光游水母(Pelagia noctiluca)在季节上的摄食与营养变化, 揭示了夜光游水母的无差别摄食习性以及对微型浮游动物的依赖性; Cui等(2012)调查分析了黄海三种大型水母的同位素和脂肪酸特征, 分析了水母的食性; 金鑫等(2012)研究了东海6个水母常见种的脂肪酸组成及碳氮稳定同位素特征, 分析了这些水母的食性及营养级地位。孙明等(2016)应用稳定同位素技术分析了渤海辽东湾海蜇的食物组成及营养级, 同时定量了6种可能食物的贡献率。目前, 尚未见应用稳定同位素与脂肪酸技术对渤海其他常见水母进行食性研究的报道。
渤海辽东湾水母近年来大量暴发, 直接对该区域渔业资源造成影响(丁峰元等, 2005; 吴颖等, 2008; Zhang et al, 2012), 威胁到红沿河核电站及其他沿岸设施的正常运行。为明确该海域水母种群快速增长的营养来源, 本研究于2017—2018年两年5个航次开展水母样品采集, 利用碳氮稳定同位素和脂肪酸标记法分析了该海域7种常见水母的食物来源, 运用基于R语言的稳定同位素分析(stable isotope analysis in R, SIAR)模型, 定量分析了红沿河海域水母的营养来源, 并结合同期作为食物来源的浮游生物及水体颗粒有机物(POM)同位素特征, 分析了水母暴发对浮游生态系统的潜在影响。本研究旨在揭示水母暴发对浮游食物网及海洋生态系统物质循环和能量流动的影响, 为量化受水母影响的浮游食物网能流图谱提供理论依据, 为深入研究水母暴发对海洋生态系统营养结构的影响提供基础资料。
1 材料与方法 1.1 样品采集本研究调查区域位于渤海辽东湾红沿河海域, 7种水母样品分别采集于2017年8月、9月, 2018年5月、6月、9月(表 1), 采集站位如图 1所示。大型水母样品使用手抄网采集, 现场切除胃部, 取伞部组织后立即用经0.45μm混合滤膜过滤的海水清洗, 放入冻存管中液氮冻存。小型水母样品及浮游动物样品分别采用浅水Ⅰ型(网口直径50 cm, 孔径500 μm)和浅水Ⅱ型(网口直径31.6 cm, 孔径160 μm)浮游生物网从海底拖至表面采集。解剖镜下挑选单一物种, 在过滤海水中暂养2 h后, 放入冻存管中液氮冻存。同月份的水母以及浮游动物分别做好标记, 进行分析水母食物组成时取用同月份采集的浮游动物作为饵料生物进行稳定同位素和脂肪酸分析。在采集水母的站位取10 L水样, 先经过200 µm的网筛滤去个体较大的动物等, 再过滤样品至已经过450℃灼烧4 h的Whatman GF/F滤膜上, 取得用于分析的POM样品。将滤膜放入冻存管后置于液氮中保存。
| 种类 | 采集时间(年.月) | 样品数目(个) |
| 沙海蜇(Nemopilema nomurai) | 2017.08 | 6(伞部) |
| 卡玛拉水母(Malagazzia carolinae) | 2017.09 | 10 |
| 球形侧腕水母(Pleurobrachia globosa) | 2017.09 | 10 |
| 帽铃水母(Tiaricodon coeruleus) | 2018.05 | 10 |
| 海月水母(Aurelia aurita) | 2018.06 | 6(伞部) |
| 半球美螅水母(Clytia hemisphaerica) | 2018.06 | 10 |
| 白色霞水母(Cyanea nozakii) | 2018.09 | 6(伞部) |
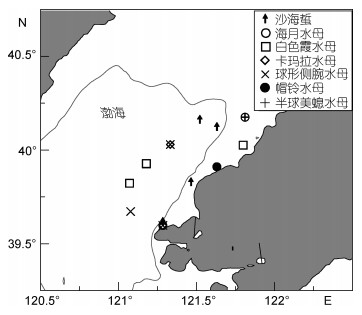 |
| 图 1 采样站位图 Fig. 1 Sampling stations in the Hongyanhe area |
将采集的水母样品用真空冷冻干燥机冷冻干燥48 h至恒重, 冻干后的样品分为两份, 一份进行脂肪酸分析, 另一份用于同位素分析。脂类提取过程参照Kattner等(1986)及El-Sabaawi等(2009)的方法进行。用19:0饱和脂肪酸(Sigma公司)作为内标。样品中加入15 mL二氯甲烷、甲醇和水的混合物(8:4:3, 体积比例)后进行超声波破碎, 再进行离心(2400 r/min), 将脂质收集到有机层中, 然后吸取下层有机相汇入新试管中, 以上流程重复三次。将有机相合并后用氮气吹干, 然后加入0.2 mL含3%硫酸的甲醇溶液, 在80℃水浴中甲酯化4 h。冷却后加入正己烷萃取脂肪酸甲酯, 样品定容至0.5 mL待测。使用安捷伦7890A型气相色谱仪测定脂肪酸组成和含量。根据内标标准曲线法计算样品中脂肪酸的绝对含量, 再将脂肪酸的绝对含量换算成百分比含量。通过主成分分析(principal component analysis, PCA)研究水母的脂肪酸组成特征。用多不饱和脂肪酸的总和(PUFA)/饱和脂肪酸的总和(SFA)来表示消费者的食肉程度(Stevens et al, 2004); 用DHA/EPA(C22:6ω3 / C20:5ω3)鉴别消费者对鞭毛藻和硅藻源食物的依赖程度(Budge et al, 1998); 脂肪酸C15:0 + C17:0的比例用于鉴定细菌类的食物贡献程度(Kaneda, 1991); C18:2ω6+C18:3ω3和C20:4ω6分别用来鉴别消费者食物中的陆源物质和碎屑来源物质(Dalsgaard et al, 2003)。
1.3 同位素样品处理与分析使用Thermo Delta IV同位素比率质谱仪(Thermo Fisher Scientific, Inc., 不来梅, 德国)测定冻干后样品的碳氮稳定同位素。样品在元素分析仪中高温燃烧后生成CO2和N2, 用质谱仪检测后计算出气体中的13C/12C以及15N/14N比率, 并与国际标准物对比后计算出样本的δ13C和δ15N值。具体公式如下:
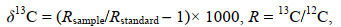 (1)
(1)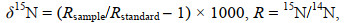 (2)
(2)式中, Rsample为样品的13C和15N检测值。Rstandard为标准参考物质的13C和15N值, 分别从美国南卡罗莱纳州的美洲拟箭石化石(Pee Dee belemnite)(PDB)和大气N2中测得。
在同位素检测前并没有移除脂质(Schukat et al, 2014)。由于脂质的13C含量较低, 检测时可能导致生物δ13C值的结果偏低(DeNiro et al, 1978; Post et al, 2007)。且各类生物脂质含量不同, 且用未优化处理的δ13C数据进行后续分析可能会导致对生物食物来源解读出现偏差(DeNiro et al, 1978; Logan et al, 2008)。针对这个问题通常可以采用去脂化和脂质校正两种常用办法来解决。去脂化处理在稳定同位素检测之前进行, 然而处理会给δ15N数值带来多大影响尚不明确(Post et al, 2007; Logan et al, 2008; Mintenbeck et al, 2008; Jia et al, 2016)。相比之下, 采用数据校正的处理方法更为方便有效。因此, 本研究使用Logan等(2008)提出的数学校正模型来规避脂质引起的δ13C数据误差。模型具体如下:
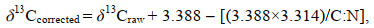 (3)
(3)式中, δ13Ccorrected为校正后的δ13C值, δ13Craw为原始数据。
由于稳定同位素的酸化处理具有争议, 且处理对样品碳氮同位素的具体影响尚不明晰(Mintenbeck et al, 2008; Brodie et al, 2011), 因此本文浮游动物样本没有做酸化处理。
本研究使用Parnell等(2010)建立的SIAR模型计算不同食物对水母的食物贡献比例。由于模型计算使用的是食物源物种的同位素信息(Parnell et al, 2010), 因此模型无法反映由食物源物种实际丰度差异导致的食物贡献差异。为避免低丰度食物源物种影响模型检测结果, 且防止代入模型的食物组数过多, 在分析之前, 根据Sun等(2010)结合Li等(2013)的划分方法将食物物种定义四个粒级组: < 200 μm (微小型生物)、200—1000 m (小型桡足类)、1000—5000 μm (大中型桡足类)及 > 5000 μm (巨型甲壳动物)。毛颚类由于营养级较高的凶猛肉食动物, 其游动速度快, 并且多数月份并非优势种, 因此在模型计算时不将其作为水母的食物考虑。其中, 微小型生物组用POM代表, 其他三组取各自粒径范围内优势度最高的物种为代表, 当优势度最高物种与次高物种优势度接近时, 将二者都取作食物源。2017年小型桡足类种类较多, 没有发现明显的优势物种, 因此2017年的小型桡足类组取用所有小型桡足类的混合样本作为食物源。将分组后各生物样品的δ13Ccorrected和δ15N值导入SIAR模型作为食物源的稳定同位素数据。各类水母的稳定同位素值作为消费者的数据。δ13C和δ15N的分馏指数分别采用0.5‰±0.13‰和1.4‰±0.21‰ (McCutchan et al, 2003), 用于同位素组成分析以及SIAR模型分析。不同月份采集的水体POM样品具有不同的δ13C值(表 3), 说明不同月份的POM来源及组成存在差异。为更加真实准确地反应食物的贡献情况, 本研究使用水母采集同期的食物的稳定同位素数据代入SIAR模型进行食物贡献率的分析。
1.4 其他数据处理用优势度指数(Y)来计算每个月份物种的优势度(Odum, 1959), 具体公式如下:
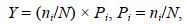 (4)
(4)式中, ni:物种的丰度; N:所有浮游动物总丰度; Pi:物种出现频度。当Y > 0.02时即认为是优势物种(Odum, 1959)。体长大于1 mm的浮游动物使用浅水Ⅰ型网采得的样品计算其丰度, 其他浮游动物丰度使用浅水Ⅱ型网采得的样品计算。
文中表格以及稳定同位素散点图通过Microsoft 2016制作, 数据统计分析通过SPSS (Version22)完成, 水母脂肪酸的主成分分析通过PRIMER 6.0软件完成, SIAR混合模型分析在R语言中进行。
2 结果在2017年8、9月和2018年5、6、9月五个调查航次中, 共采集到浮游动物60种, 包含19类浮游幼体和41种成体浮游动物。月份间的浮游动物群落变化较大, 并没有出现共有的优势物种。2017年8月优势种为中华哲水蚤、小拟哲水蚤、双毛纺锤水蚤桡足类幼体也有较高的优势度, 达0.265。9月夜光虫为优势度最高物种, 优势度达0.26, 桡足类优势种为小拟蜇水蚤。2018年5月优势种为夜光虫、中华哲水蚤、帽铃水母、克氏纺锤水蚤、墨氏胸刺水蚤和拟长腹剑水蚤。6月优势种为夜光虫、中华哲水蚤、克氏纺锤水蚤、墨氏胸刺水蚤和拟长腹剑水蚤。9月优势种为强壮箭虫、真刺唇角水蚤、中华哲水蚤、中国毛虾、克氏纺锤水蚤、拟长腹剑水蚤、近缘大眼剑水蚤和异体住囊虫。
2.1 红沿河海域常见水母的脂肪酸组成红沿河海域常见水母的脂肪酸组成如表 2所示, 由于半球美螅水母样品量过少, 未测得其脂肪酸数据。
| 脂肪酸 | 卡玛拉水母 M. carolinae |
球形侧腕水母 P. globosa |
帽铃水母 T. coeruleus |
海月水母 A. aurita |
白色霞水母 C. nozakii |
沙海蜇 N. nomurai |
| C12:0 | 0±0 | 0±0 | 0±0 | 0.04±0.10 | 0.01±0.01 | 0.04±0.05 |
| C14:0 | 3.80±0.14 | 2.98±0.57 | 2.18±0.33 | 1.55±0.25 | 0.83±0.48 | 7.26±1.33 |
| C14:1 | 0±0 | 0±0 | 0±0 | 0±0 | 0±0 | 0.02±0.04 |
| C15:0 | 0±0 | 0±0 | 0±0 | 0.06±0.16 | 0.52±1.36 | 0.26±0.52 |
| C16:0 | 16.85±2.4 | 20.13±1.41 | 15.63±1.08 | 25.89±6.43 | 23.61±5.49 | 32.72±5.52 |
| C16:1 | 4.69±1.11 | 3.40±0.07 | 1.23±0.16 | 4.85±2.05 | 4.26±2.26 | 1.64±1.44 |
| C16:2ω4 | 0±0 | 0.54±0.08 | 0±0 | 0.29±0.70 | 0.78±1.64 | 0.16±0.18 |
| C17:0 | 0±0 | 0±0 | 0.68±0 | 1.10±0.77 | 1.39±1.36 | 0±0 |
| C17:1 | 0±0 | 0.22±0.21 | 0±0 | 0.23±0.46 | 0.34±0.48 | 0.08±0.10 |
| C18:0 | 10.25±0.12 | 12.23±1.07 | 8.4±0.04 | 12.83±2.31 | 14.32±6.77 | 5.55±6.41 |
| C18:1ω9 | 5.08±1.21 | 3.24±0.60 | 3.12±0.17 | 4.82±3.67 | 3.19±1.83 | 1.59±1.98 |
| C18:1ω7 | 2.87±0.53 | 0.90±0.08 | 1.68±0.15 | 3.34±2.11 | 2.28±1.32 | 4.87±2.29 |
| C18:2ω6t | 0±0 | 0±0 | 3.30±4.15 | 0.03±0.08 | 0.09±0.13 | 0.10±0.14 |
| C18:2ω6c | 1.09±0.37 | 0.65±0.10 | 2.37±2.26 | 0.74±0.29 | 0.56±0.37 | 1.09±0.97 |
| C18:2ω4 | 0±0 | 0±0 | 0±0 | 0.03±0.09 | 0.09±0.17 | 0.64±1.26 |
| C18:3ω6 | 3.89±5.50 | 2.07±2.18 | 1.37±0.98 | 1.30±1.04 | 1.16±1.76 | 5.66±3.2 |
| C18:3ω3 | 3.31±2.89 | 3.37±4.88 | 0.41±0.05 | 0.51±0.37 | 1.39±3.16 | 0.65±0.67 |
| C18:4ω3 | 0.92±1.30 | 0.4±0.70 | 0.78±0.16 | 0.58±0.42 | 0.02±0.04 | 1.50±2.95 |
| C20:0 | 0.38±0.54 | 0.38±0.33 | 2.08±0.31 | 0.45±0.37 | 1.53±0.92 | 0.14±0.24 |
| C20:1ω9 | 1.59±2.24 | 0.08±0.15 | 0.58±0.07 | 0.58±0.32 | 0.70±0.50 | 1.13±1.73 |
| C20:1ω7 | 0±0 | 0±0 | 0±0 | 0.52±1.36 | 0.16±0.25 | 0.04±0.05 |
| C20:2 | 0±0 | 0±0 | 0±0 | 0±0 | 0.03±0.07 | 0.19±0.22 |
| C20:3ω6 | 0±0 | 0±0 | 0.13±0.19 | 0±0 | 0±0 | 0.05±0.06 |
| C21:0 | 0±0 | 0±0 | 0±0 | 0.03±0.09 | 0.09±0.11 | 0.08±0.09 |
| C20:4ω6 | 14.1±1.38 | 1.95±0.28 | 3.3±0.23 | 3.24±1.17 | 19.62±11.86 | 11.71±8.43 |
| C20:3ω3 | 0.66±0.93 | 0.32±0.28 | 1.31±0.12 | 0.48±0.47 | 0.27±0.24 | 0.08±0.09 |
| C20:4ω3 | 0.78±1.10 | 0.50±0.22 | 2.78±0.29 | 0.59±0.28 | 0.32±0.57 | 0.26±0.39 |
| C20:5ω3(EPA) | 10.23±0.27 | 12.99±0.94 | 16.62±1.18 | 20.08±2.55 | 4.01±2.51 | 9.97±6.82 |
| C22:0 | 0±0 | 0.30±0.27 | 0±0 | 0.38±0.94 | 0.06±0.10 | 0.31±0.37 |
| C22:1ω9 | 1.07±1.52 | 0±0 | 0±0 | 0.01±0.03 | 0.02±0.04 | 0.21±0.33 |
| C22:1ω11 | 0±0 | 0.31±0.27 | 0.69±0.04 | 0.23±0.24 | 0.06±0.14 | 0.20±0.23 |
| C22:5ω3 | 1.85±0.04 | 1.68±0.27 | 4.39±0.45 | 3.3±1.34 | 2.42±1.53 | 1.27±0.91 |
| C22:6ω3(DHA) | 16.6±6.71 | 31.33±2.7 | 26.97±2.59 | 11.93±1.95 | 5.88±3.81 | 10.53±7.02 |
| SFA | 31.28±2.96 | 36.02±2.44 | 28.96±1.68 | 42.33±7.89 | 42.34±8.11 | 46.35±1.05 |
| MUFA | 15.30±4.40 | 8.17±0.48 | 7.30±0.45 | 14.58±7.2 | 11.01±2.51 | 9.78±1.91 |
| PUFA | 53.42±1.44 | 55.81±1.98 | 63.74±2.13 | 43.09±4.27 | 46.65±9.02 | 43.86±1.32 |
| PUFA/SFA | 1.71±0.12 | 1.56±0.16 | 2.21±0.20 | 1.06±0.27 | 1.17±0.43 | 0.95±0.03 |
| DHA/EPA | 1.62±0.61 | 2.41±0.11 | 1.62±0.04 | 0.6±0.09 | 1.81±0.08 | 1.65±0.05 |
| C18:2ω6+C18:3ω3 | 4.40±2.52 | 4.02±4.95 | 6.08±6.35 | 1.28±0.52 | 2.05±3.43 | 1.85±1.51 |
| Σω3 | 34.33±8.70 | 50.59±1.82 | 53.27±4.84 | 37.47±4.14 | 14.31±7.31 | 24.26±7.47 |
| Σω6 | 19.08±7.25 | 4.68±1.99 | 10.48±6.97 | 5.31±1.36 | 31.44±11.89 | 18.61±5.71 |
| Σω6/Σω3 | 0.60±0.36 | 0.09±0.04 | 0.20±0.15 | 0.14±0.03 | 2.86±1.97 | 0.93±0.71 |
| Bacteria FAs | 0.05±0.01 | 0.07±0.02 | 0.68±0.05 | 1.16±0.82 | 1.90±2.4 | 0.26±0.52 |
| 注:半球美螅水母脂肪酸组成未测得。 | ||||||
从脂肪酸构成上来看, PUFA占水母总脂肪酸含量均在43.09%以上(表 2)。除沙海蜇外, 另外5种水母的脂肪酸以PUFA为主, 含量高于SFA和(单不饱和脂肪酸)MUFA。小型水母PUFA含量普遍高于大型水母(ANOVA, P < 0.05), 其中帽铃水母PUFA含量最高, 达到63.74% (表 2)。与之对应, 大型水母SFA含量普遍高于小型水母(ANOVA, P < 0.01), 其中沙海蜇SFA含量最高, 为46.35%。从PUFA/SFA来看, 小型水母与大型水母之间差异显著(ANOVA, P < 0.05), 小型水母明显高于大型水母, 帽铃水母的PUFA/SFA值最高(2.21), 沙海蜇最低(0.95)。另外两种大型水母PUFA/SFA值也比较低, 海月水母和白色霞水母分别为1.06和1.17。在所有水母的PUFA中, DHA、EPA和C20:4ω6是含量最高的三类脂肪酸。球形侧腕水母和帽铃水母中DHA含量最高, 超过25%, 其次为卡玛拉水母, 含量为16.6%。海月水母的EPA含量在所有水母中最高, 达20.08%。球形侧腕水母DHA/EPA值显著高于其他水母(ANOVA, p < 0.01)。在六种水母中Σω3系列脂肪酸与Σω6系列脂肪酸含量存在显著差异(P < 0.05)。除了白色霞水母外, 其余五种水母的Σω3脂肪酸含量高于Σω6脂肪酸含量。从Σω6/Σω3值来看, 只有白色霞水母的Σω6/Σω3值超过1, 为2.86。沙海蜇Σω6/Σω3值适中, 为0.93。C18:2ω6+C18:3ω3在三类小水母中含量均在4.0以上, 高于大型水母。卡玛拉水母, 白色霞水母和沙海蜇的C20:4ω6占总脂肪酸百分比均超过了10%, 相比之下, C20:4ω6在其他三种水母中含量较低, 均未超过4%。
将6种水母的脂肪酸数据进行主成分分析(图 2)。通过主成分分析的降维处理, 可以更直观显示水母脂肪酸的统计学差异。结果显示, 主成分1和2共可解释水母脂肪酸组成总变异的94.8%, 其中主成分1可解释78.9% (图 2)。主成分1维度正向上的因子主要有Σω3和DHA, 负向上主要有C20:4ω6和Σω6。主成分2维度正向上主要有SFA和EPA, 负向上主要为PUFA。6种水母在主成分分析图上比较分散。海月水母、球形侧腕水母和帽铃水母主要分布在主成分1正向维度上, 说明Σω3, DHA, EPA在它们的脂肪酸中占比重很大。沙海蜇在主成分2维度正向上分布, SFA对其脂肪酸贡献较大。白色霞水母、沙海蜇在主成分1负向上分布, 说明两者与三种正向上分布的水母脂肪酸含量差异较大, C20:4ω6、Σω6的含量较高。
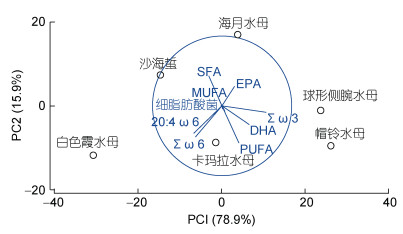 |
| 图 2 红沿河海域6种常见水母脂肪酸组成的主成分分析 Fig. 2 Principal component analysis based on the fatty acid compositions of six common jellyfish species sampled from Hongyanhe area in the Bohai Sea SFA:饱和脂肪酸; MUFA:单不饱和脂肪酸; PUFA:多不饱和脂肪酸; DHA: C22:6ω3; EPA: C20:5ω3。 |
红沿河海域7种水母和同时采集的POM的碳稳定同位素比值(δ13C)如表 3所示。7种水母的δ13C值有极显著差异(ANOVA, P < 0.01)。δ13C变化范围为-23.14‰— -16.55‰。在所有水母样本中, 球形侧腕水母的δ13C值最高, 为-16.55‰。其次为卡玛拉水母(-17.10‰)。二者均采自2017年9月, 同月份POM的δ13C值也为POM中最高(-19.57‰)。2018年6月采集的海月水母的δ13C值最低, 为-23.14‰, 同月份采集的半球美螅水母次低, 为-22.49‰。且此月份POM的δ13C值也非常低, 为-24.20‰, 仅高于2018年5月(-24.49‰)(图 3)。
| 物种 | δ13C | δ15N | δ13CPOM | δ15NPOM | δ15N (水母与POM差值) |
| 卡玛拉水母 | -17.10±0.50 | 7.25±0.94 | -19.57±0.55 | 5.10±0.22 | 2.15 |
| 球形侧腕水母 | -16.55±0.51 | 8.70±1.01 | -19.57±0.55 | 5.10±0.22 | 3.60 |
| 帽铃水母 | -19.94±0.02 | 7.87±0.96 | -24.49±1.77 | 4.37±0.94 | 3.50 |
| 沙海蜇 | -19.87±0.32 | 6.79±0.92 | -21.46±1.31 | 4.04±0.86 | 2.75 |
| 海月水母 | -23.14±1.56 | 7.38±1.63 | -24.20±1.67 | 4.35±1.33 | 3.03 |
| 白色霞水母 | -17.88±1.19 | 7.95±1.53 | -20.36±0.15 | 4.92±1.36 | 3.03 |
| 半球美螅水母 | -22.49±0.50 | 8.45±0.80 | -24.20±1.67 | 4.35±1.33 | 4.10 |
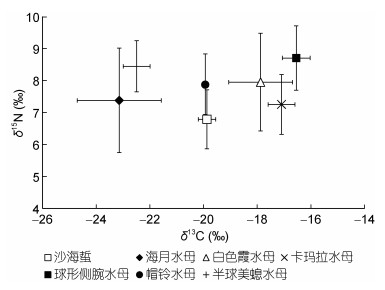 |
| 图 3 红沿河海域7种水母的稳定同位素散点图 Fig. 3 The scatter plot of average δ13C and average δ15N for 7 jellyfish species from Hongyanhe area |
7种水母的氮稳定同位素比值(δ15N)变化范围为6.79‰—8.70‰ (表 3)。其中, 球形侧腕水母的δ15N值最高(8.70‰), 其次为半球美螅水母(8.45‰), 二者差异并不显著(ANOVA, P > 0.05)。沙海蜇的δ15N值最低, 为6.79‰, 与除卡玛拉水母之外的其余五组水母有极显著差异(ANOVA, P < 0.01)。沙海蜇也是唯一δ15N值低于7‰的水母(图 3)。7种水母与同时期POM的δ15N值之差介于2.15‰—4.10‰之间。球型侧腕水母和半球美螅水母与同时期水体POM的δ15N值之差分别为3.60‰和4.10‰, 该差值也是所有差值中最高的两个, 其后为帽铃水母(3.50‰)。
在采样月份中, 红沿河海域分布的大型桡足类主要是中华哲水蚤, 除了2018年9月以外, 中华哲水蚤的丰度均占大中型桡足类总丰度的90%以上。2018年9月中华哲水蚤与真刺唇角水蚤在采样月份中丰度较高, 二者共同占大中型桡足类总丰度的87.5%, 因此将二者用作本月份大中型桡足类组的食物源代表。2017年的两个月份, 小型桡足类物种种类较多, 且有许多幼体难以鉴定, 因此取混合样品作为食物来源。2018年克氏纺锤水蚤在小型桡足类类群中丰度所占比例超过70%, 远高于其他小型桡足类, 因此在模型分析中将克氏纺锤水蚤作为小型桡足类的代表生物。另外, 2017年8月短额超刺糠虾和2017年9月长尾类幼虫在巨型浮游动物中丰度占比最高, 分别为70.08%和91.73%, 因此选取这两种浮游动物作为当月巨型甲壳动物组饵料的代表生物。2018年9月长尾类幼虫和中国毛虾共同贡献了巨型甲壳动物组丰度的82.57%, 二者均选作本组饵料的代表生物。
SIAR模型结果显示, 在大型水母沙海蜇的食物构成中, POM的贡献率高达56%, 小型桡足类、中华哲水蚤和短额超刺糠虾贡献率分别为12%、3%和10%(图 4)。相比之下, POM对白色霞水母贡献率较低, 与克氏纺锤水蚤, 中华哲水蚤, 真刺唇角水蚤食物贡献率相近, 在21%—22%之间。长尾类幼体和毛虾对白色霞水母的食物贡献较低(2%—3%)。6月采集的海月水母对POM的摄食较多, POM贡献率为45%, 克氏纺锤水蚤和中华哲水蚤贡献率分别为34%和29%。小型水母中, 与海月水母同月份采集的小型水母半球美螅水母的主要食物贡献来自克氏纺锤水蚤和中华哲水蚤, POM对其食物贡献相对较少。2018年5月大量出现的帽铃水母与半球美螅水母的食物组成比例相似, 浮游桡足类对两者的食物贡献率较高。2017年9月同时出现的卡玛拉水母和球形侧腕水母食物比较均衡, 四类食物对其食物贡献率接近, 在22%—32%之间。二者区别在于小型桡足类对球形侧腕水母食物贡献率较低(24%), 长尾类幼体对卡玛拉水母的食物贡献率较低(22%)(图 4)。
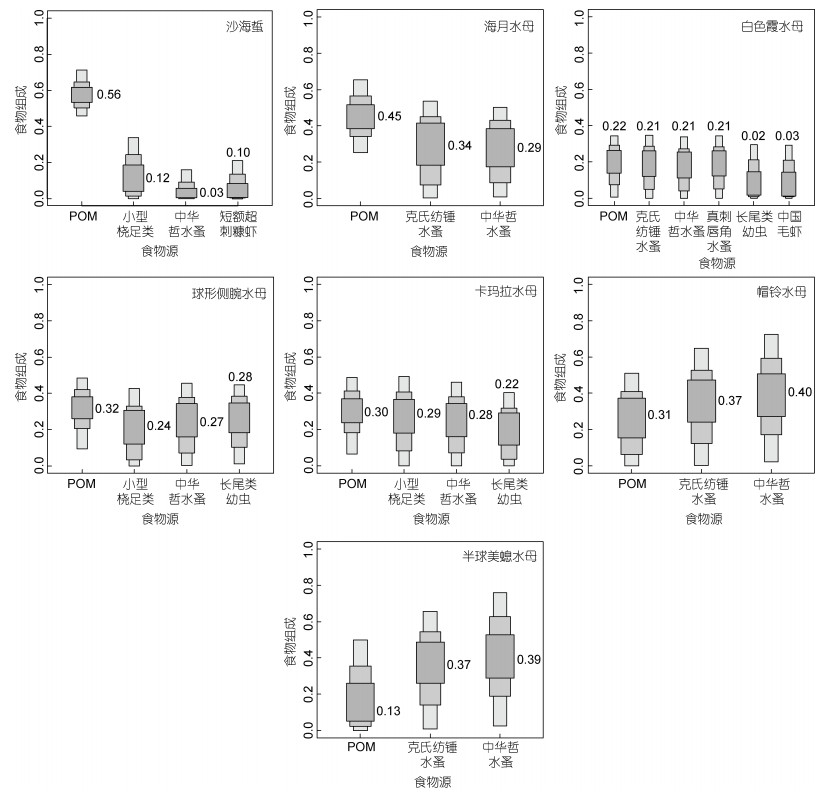 |
| 图 4 基于SIAR模型的各类饵料对红沿河海域常见水母食物的贡献比例 Fig. 4 SIAR box-plots showing the proportion of sources for jellyfish from Hongyanhe area in the Bohai Sea |
本研究采集的三种大型水母均属于钵水母纲(Scyphozoa), 其中白色霞水母和海月水母均属于旗口水母目。此类水母下伞部中央具有带状的口腕, 腕上有许多刺胞作为捕食器官, 漂浮时口腕飘荡如旗帜。白色霞水母成熟个体通常伞径大于50 cm(董婧等, 2005), 海月水母较小, 通常伞径在10—40 cm(郑凤英等, 2010)。而沙海蜇属于根口水母目, 与旗口水母不同, 成熟沙海蜇的口腕基部愈合, 口腕管道开口改为大量丝状附属管(鲁男等, 1992)。沙海蜇的伞径可达1 m以上(Uye, 2008)。四种小型水母中, 卡玛拉水母、半球美螅水母和帽铃水母均属于水螅水母纲(Hydrozoa), 与钵水母区别在于本纲水母体较小, 且具有缘膜, 常常成群出现(赵文, 2005)。球形侧腕水母属于栉水母纲(Ctenophora), 体型呈球状, 周身具有栉板, 以栉板作为行动器官(丘书院, 1957)。这几种水母摄食器官形态及摄食行为的不同导致它们可摄食的饵料种类及粒径范围均存在差异, 在食物网中所处的营养地位也不同。
由于7种水母大量出现时间和采样地点并不一致, 所在环境伴随着浮游生物群落结构的变化, 因此各类食物的可获得性可能会有不同。为避免因此导致的误差, 本研究在采集水母样本的同时, 对浮游动物和POM进行同步采集, 在进行分析时仅将同期的浮游动物和POM作为水母的可能食物来源。
3.1 红沿河海域水母的食物来源在沙海蜇、海月水母、白色霞水母三种大型水母中, 白色霞水母对肉食性饵料摄食最多, 海月水母次之, 沙海蜇最低。本研究的脂肪酸结果证明了这一点。多不饱和脂肪酸(PUFA)与饱和脂肪酸(SFA)之比可以用作脂肪酸标记来指示动物的营养来源于肉食还是草食(Cripps et al, 2000; Stevens et al, 2004)。白色霞水母的PUFA/SFA值高于海月水母和沙海蜇, 说明白色霞水母食物组成中的动物性饵料的贡献要比其他两种水母高。同位素结果也支持这一观点。由于15N会随着生物摄食产生分馏效应, δ15N值通常会随着营养等级升高而富集(Peterson et al, 1987), 因此δ15N可以用来指示生物的营养级高低, 生物的营养级越低, 说明其食物中植物性食物更多。大型水母中, 白色霞水母的δ15N值最高, 沙海蜇δ15N值最低。两种证据均表明, 白色霞水母摄食肉食性饵料多于海月水母, 更多于沙海蜇。这可能与三者的摄食方式、摄食器官大小和食物来源有关。白色霞水母和海月水母同为旗口水母, 中央口不愈合, 可以摄入的食物粒径范围较大。白色霞水母有很多触手丝, 可以通过刺细胞主动刺伤捕获浮游动物(Suchman et al, 2000), 与通过过滤海水滤食食物的海月水母相比(Bailey et al, 1983; Stoecker et al, 1987), 白色霞水母主动捕食浮游动物的能力更强。与旗口水母相比, 作为根口水母的沙海蜇在成长过程中中央口愈合(鲁男等, 1992), 无论个体大小, 其口腕的末端口的直径都在1mm左右(Lee et al, 2008), 限制了沙海蜇可摄食的食物粒径上限, 粒径较大的动物饵料难以摄入。对同属于根口水母目的海蜇食物来源研究结果也证实, 粒径1000 μm以下的浮游动物的食物贡献率是粒径1000 μm以上浮游动物的4.9倍(孙明等, 2016)。本研究中, 沙海蜇PUFA/SFA值在三种大型水母中也是最低的, 这说明相比于其他水母, 植物性饵料为沙海蜇提供了更多营养。其原因可能是摄食器官限制了沙海蜇对大粒径的动物性食物的摄入, 而由于渤海夏季丰水期的POM主要由浮游植物提供(于靖等, 2017), 大量摄入POM导致沙海蜇食物来源偏向植物性。
小型水母摄食了较多的动物性食物。从δ15N值来看, 小型水母比沙海蜇和海月水母两种大型水母更倾向于肉食食性。与大型水母中摄食动物性食物最多的白色霞水母相比, 半球美螅水母和球形侧腕水母对动物性食物摄食更多, 而帽铃水母与白色霞水母肉食程度接近。脂肪酸PUFA/SFA结果也显示, 除半球美螅水母未获得数值之外, 其余3种小型水母比沙海蜇和海月水母摄食更多的动物性食物, 与δ15N结果一致。半球美螅水母, 球形侧腕水母等小型水母靠中央口摄食(Matsakis et al, 1991; 陈丽华等, 2003), 使小型水母的食物不止局限于小颗粒的浮游植物和碎屑。球型侧腕水母肠道内含物分析结果显示, 该水母摄食范围很广, 且主要以浮游甲壳动物为食, 其肠含物内饵料个数超过80%为桡足类(陈丽华等, 2003)。郑慧苑等(1990)报道厦门海峡的球型侧腕水母可以摄食除水母和栉水母外海区所有的浮游动物, 体长5 mm以下的毛虾也可以被其摄食。而半球美螅水母以追击式摄食方式为主, 且可以摄食桡足类与卤虫等动物性饵料(Matsakis et al, 1991; 冯颂等, 2012)。因此, 两种小型水母本身的摄食方式决定了它们食物来源中动物性食物所占比例较大。金鑫等(2012)采用脂肪酸标记法和稳定同位素法分析了东海蝶水母、瓜水母和四叶小舌水母等小型水母的食性, 发现瓜水母和四叶小舌水母δ15N值高于东海的大型水母沙海蜇。Colin等(2005)对半口壮丽水母(Aglaura hemistoma)肠道内含物分析发现该水母为杂食食性, 食物中原生生物成分很高。综合来看, 小型水母种类多为杂食食性, 且对动物性食物有较强的摄食偏好。
3.2 红沿河海域各饵料生物对水母的食物贡献率7种水母与POM的δ15N值之差介于2.15‰— 4.10‰之间。考虑到水母的食物中动物性食物通常占有较大比例(郑慧苑等, 1990; Sullivan et al, 1994; Uye, 2008), 所以水母应该比以浮游植物为主的POM高出一个营养级以上。因此将传统的分馏指数值3.4‰ (Post, 2002)用作水母食物δ15N的分馏指数显得过高, McCutchan等(2003)提出的1.4‰作为δ15N的分馏指数更合适研究水母食物来源, 并且1.4‰也是McCutchan等(2003)对作为饵料的无脊椎动物及其捕食者的δ15N进行统计得出的δ15N分馏指数。因此, 本研究在SIAR模型中使用1.4‰作为水母食物源的δ15N分馏指数, 以便更准确地反映各类食物对水母的贡献率。
白色霞水母的食物中浮游桡足类贡献率最高(> 60%), 不同大小桡足类的贡献率接近, POM的贡献率相对较低(图 4)。这主要是由于白色霞水母的摄食方式是以主动捕食为主(Suchman et al, 2000), 此外作为旗口水母, 对食物的大小没有限制。相比于白色霞水母, POM对海月水母的食物贡献率为45%, 这可能是由于虽然也是旗口水母, 海月水母主要以滤食方式为主, 容易滤食悬浮于水体中的有机颗粒物。在沙海蜇的各食物来源中, POM的贡献率高达56%, 是所有水母中最高的, 而个体相对较大的浮游动物对沙海蜇总食物贡献率为25%, 是所有水母中最低的。基于脂肪酸标志物分析, 金鑫等(2012)提出东海沙海蜇食物组成中包括较多的有机碎屑。本研究中沙海蜇体内也含有大量的指示碎屑食性的脂肪酸C20:4ω6 (Fukuda et al, 2001), 说明POM中的悬浮碎屑的确为沙海蜇提供了营养。已有关于沙海蜇肠道内含物的分析结果发现沙海蜇食物组成以小型的桡足类和带壳软体动物居多(Uye, 2008), 这可能是由于小型桡足类和带壳软体动物的外壳消化速度慢, 在肠道内含物中存在时间较长, 较容易被检出, 而POM中的碎屑等多种成分难以被肠道内含物法检出(Ōmori et al, 1984; Landry et al, 1994; Perissinotto et al, 1997)。综合来看, 大型水母中, 白色霞水母和海月水母主要摄食浮游动物, 而沙海蜇则更多地摄食粒径相对较小的POM。
小型水母的食物中, 肉食性饵料的贡献率较大。半球美螅水母主要以小型桡足类和大中型桡足类为食, 二者贡献率之和高达76%, 而POM的贡献较低(13%)。帽铃水母与半球美螅水母类似, 相比另两种小型水母更偏向动物性的食物来源。但是POM对帽铃水母的食物贡献率也达到31%, 高于对半球美螅水母的食物贡献。与半球美螅水母相比, 帽铃水母分布区域离岸边更近, 可能因此滤食了较多的陆源POM。这一点脂肪酸结果可以证明, 陆源营养中含有较多的脂肪酸C18:2ω6和C18:3ω3 (Budge et al, 1998), 在帽铃水母中脂肪酸C18:2ω6+C18:3ω3占总脂肪酸的比例高于其他水母(表 2), 证明了帽铃水母对陆源营养的摄食吸收。球形侧腕水母和卡玛拉水母均采于2017年9月, 各粒径食物对球形侧腕水母和卡玛拉水母的食物贡献率相近, 大中型动物性饵料的食物贡献率是POM的2.5倍多, 可见这两类水母对动物性食物摄食更多。总的来说, 4种小型水母对浮游动物的摄食均高于POM。
近年来水母数量增多甚至暴发的现象日趋频繁。从本研究结果可以看出, 不同水母暴发对浮游生态系统的潜在影响有一定差异。红沿河海域小型水母和白色霞水母主要捕食桡足类等浮游动物, 因此它们的暴发都会直接影响浮游动物的生物量。海月水母饵料的粒级选择性不显著, 其暴发对不同大小的浮游生物均会产生一定的影响。而沙海蜇的暴发主要会大量摄食 < 1 mm的小型浮游生物和POM, 对大中型浮游动物以及更高营养层生物(鱼类等)的影响可能是通过蜇伤以及饵料竞争导致的。此外, 从水母暴发的食物基础来看, 沙海蜇更依赖于小型浮游生物, 因此近海富营养化等导致的浮游生物小型化将进一步有利于沙海蜇的暴发。
4 结论本文利用2017、2018年春夏季在辽东湾红沿河海域五个航次采集的水母样本, 结合稳定同位素法和脂肪酸分析法对沙海蜇、海月水母、白色霞水母、卡玛拉水母、球形侧腕水母、帽铃水母和半球美螅水母食物组成进行了研究。结果显示, 白色霞水母、卡玛拉水母、球形侧腕水母、帽铃水母和半球美螅水母的食物组成中动物性食物贡献较大, 水母偏肉食食性。海月水母对食物的粒级没有明显的选择性, 其食物中动物性食物贡献低于以上五类水母。动物性食物对沙海蜇食物贡献最少, 沙海蜇主要摄食小于1 mm粒级的食物。可见红沿河海域不同水母所摄食的食物有一定的差异, 因此水母暴发对浮游生态系统的影响方式也并不相同, 针对不同水母暴发制定防治措施时需要区别考量。
丁峰元, 程家骅. 2005. 东海区夏、秋季大型水母分布区渔业资源特征分析. 海洋渔业, 27(2): 120-128 DOI:10.3969/j.issn.1004-2490.2005.02.006 |
于靖, 张华. 2017. 渤海及北黄海河流悬浮颗粒碳氮同位素时空分布及源解析. 海洋科学, 41(5): 93-102 |
丘书院. 1957. 中国南海栉水母类初志. 动物学报, 9(1): 85-100 |
冯颂, 孙松, 李超伦, 等. 2012. 胶州湾半球美螅水母(Clytia hemisphaerica)数量周年变动及对浮游动物摄食压力估算. 海洋与湖沼, 43(3): 464-470 |
孙松. 2012. 对黄、东海水母暴发机理的新认知. 海洋与湖沼, 43(3): 406-410 |
孙明, 王彬, 李玉龙, 等. 2016. 基于碳氮稳定同位素技术研究辽东湾海蜇的食性和营养级. 应用生态学报, 27(4): 1103-1108 |
吴颖, 李惠玉, 李圣法, 等. 2008. 大型水母的研究现状及展望. 海洋渔业, 30(1): 80-87 DOI:10.3969/j.issn.1004-2490.2008.01.014 |
陈丽华, 陈钢, 李少菁, 等. 2003. 厦门港球型侧腕水母(Pleurobrachia globosa)的摄食研究. 厦门大学学报(自然科学版), 42(2): 228-232 DOI:10.3321/j.issn:0438-0479.2003.02.023 |
金鑫, 李超伦, 刘梦坛. 2012. 基于脂肪酸标记法和碳氮稳定同位素比值法的东海水母常见种的食性分析. 海洋与湖沼, 43(3): 486-493 |
郑凤英, 陈四清, 倪佳. 2010. 海月水母的生物学特征及其爆发. 海洋科学进展, 28(1): 126-132 DOI:10.3969/j.issn.1671-6647.2010.01.017 |
郑慧苑, 丘书院. 1990. 厦门港球型侧腕水母Pleurobrachia globosa摄食的初步研究. 台湾海峡, 9(3): 200-205 |
赵文. 2005. 水生生物学. 北京: 中国农业出版社, 520
|
董婧, 刘春洋, 李文泉, 等. 2005. 白色霞水母的形态与结构. 水产科学, 24(2): 22-23 |
鲁男, 赵英明, 蒋双. 1992. 沙海蜇的形态与结构. 水产科学, 11(1): 5-8 |
Allan E L, Ambrose S T, Richoux N B et al, 2010. Determining spatial changes in the diet of nearshore suspension-feeders along the South African coastline:stable isotope and fatty acid signatures. Estuarine, Coastal and Shelf Science, 87(3): 463-471 DOI:10.1016/j.ecss.2010.02.004 |
Bailey K M, Batty R S, 1983. A laboratory study of predation by Aurelia aurita on larval herring (Clupea harengus):experimental observations compared with model predictions. Marine Biology, 72(3): 295-301 DOI:10.1007/BF00396835 |
Brodie C R, Leng M J, Casford J S L et al, 2011. Evidence for bias in C and N concentrations and δ13C composition of terrestrial and aquatic organic materials due to pre-analysis acid preparation methods. Chemical Geology, 282(3-4): 67-83 DOI:10.1016/j.chemgeo.2011.01.007 |
Budge S M, Parrish C C, 1998. Lipid biogeochemistry of plankton, settling matter and sediments in Trinity Bay, Newfoundland. Ⅱ. Fatty acids. Organic Geochemistry, 29(5-7): 1547-1559 DOI:10.1016/S0146-6380(98)00177-6 |
Cabana G, Rasmussen J B, 1996. Comparison of aquatic food chains using nitrogen isotopes. Proceedings of the National Academy of Sciences of the United States of America, 93(20): 10844-10847 DOI:10.1073/pnas.93.20.10844 |
Colin S P, Costello J H, Graham W M et al, 2005. Omnivory by the small cosmopolitan hydromedusa Aglaura hemistoma. Limnology and Oceanography, 50(4): 1264-1268 DOI:10.4319/lo.2005.50.4.1264 |
Connelly T L, Deibel D, Parrish C C, 2014. Trophic interactions in the benthic boundary layer of the Beaufort Sea shelf, Arctic Ocean:combining bulk stable isotope and fatty acid signatures. Progress in Oceanography, 120: 79-92 DOI:10.1016/j.pocean.2013.07.032 |
Cripps G C, Atkinson A, 2000. Fatty acid composition as an indicator of carnivory in Antarctic krill, Euphausia superba. Canadian Journal of Fisheries and Aquatic Sciences, 57(S3): 31-37 DOI:10.1139/f00-167 |
Cui Y, Wu Y, Zhang J et al, 2012. Potential dietary influence on the stable isotopes and fatty acid compositions of jellyfishes in the Yellow Sea. Journal of the Marine Biological Association of the United Kingdom, 92(6): 1325-1333 DOI:10.1017/S0025315412000082 |
Dalsgaard J, John M S, Kattner G et al, 2003. Fatty acid trophic markers in the pelagic marine environment. Advances in Marine Biology, 46: 225-340 |
DeNiro M J, Epstein S, 1978. Influence of diet on the distribution of carbon isotopes in animals. Geochimica et Cosmochimica Acta, 42(5): 495-506 DOI:10.1016/0016-7037(78)90199-0 |
Duffy J T, Epifanio C E, Fuiman L A, 1997. Mortality rates imposed by three scyphozoans on red drum (Sciaenops ocellatus Linnaeus) larvae in field enclosures. Journal of Experimental Marine Biology and Ecology, 212(1): 123-131 DOI:10.1016/S0022-0981(96)02741-4 |
El-Sabaawi R, Dower J F, Kainz M et al, 2009. Characterizing dietary variability and trophic positions of coastal calanoid copepods:insight from stable isotopes and fatty acids. Marine Biology, 156(3): 225-237 DOI:10.1007/s00227-008-1073-1 |
Fukuda Y, Naganuma T, 2001. Potential dietary effects on the fatty acid composition of the common jellyfish Aurelia aurita. Marine Biology, 138(5): 1029-1035 DOI:10.1007/s002270000512 |
Greve W, 1994. The 1989 German Bight invasion of Muggiaea atlantica. Ices Journal of Marine Science, 51: 355-358 DOI:10.1006/jmsc.1994.1037 |
Hansson L J, Moeslund O, Kiørboe T et al, 2005. Clearance rates of jellyfish and their potential predation impact on zooplankton and fish larvae in a neritic ecosystem (Limfjorden, Denmark). Marine Ecology Progress Series, 304: 117-131 DOI:10.3354/meps304117 |
Henschke N, Everett J D, Suthers I M et al, 2015. Zooplankton trophic niches respond to different water types of the western Tasman Sea:a stable isotope analysis. Deep Sea Research Part Ⅰ:Oceanographic Research Papers, 104: 1-8 DOI:10.1016/j.dsr.2015.06.010 |
Jia Z N, Swadling K M, Meiners K M et al, 2016. The zooplankton food web under East Antarctic pack ice-A stable isotope study. Deep Sea Research Part Ⅱ:Topical Studies in Oceanography, 131: 189-202 DOI:10.1016/j.dsr2.2015.10.010 |
Kaneda T, 1991. Iso- and anteiso-fatty acids in bacteria:biosynthesis, function, and taxonomic significance. Microbiological Reviews, 55(2): 288-302 DOI:10.1128/MR.55.2.288-302.1991 |
Kattner G, Fricke H S G, 1986. Simple gas-liquid chromatographic method for the simultaneous determination of fatty acids and alcohols in wax esters of marine organisms. Journal of Chromatography A, 361: 263-268 DOI:10.1016/S0021-9673(01)86914-4 |
Kling G W, Fry B, O'Brien W J, 1992. Stable isotopes and planktonic trophic structure in Arctic lakes. Ecology, 73(2): 561-566 DOI:10.2307/1940762 |
Landry M R, Peterson W K, Fagerness V L, 1994. Mesozooplankton grazing in the Southern California Bight. I. Population abundances and gut pigment contents. Marine Ecology Progress Series, 115: 55-71 DOI:10.3354/meps115055 |
Lee H E, Yoon W D, Lim D, 2008. Description of feeding apparatus and mechanism in Nemopilema nomurai Kishinouye (Scyphozoa:Rhizostomeae). Ocean Science Journal, 43: 61-65 DOI:10.1007/BF03022432 |
Li C L, Yang G, Ning J et al, 2013. Response of copepod grazing and reproduction to different taxa of spring bloom phytoplankton in the Southern Yellow Sea. Deep Sea Research Part Ⅱ:Topical Studies in Oceanography, 97: 101-108 DOI:10.1016/j.dsr2.2013.05.018 |
Logan J M, Jardine T D, Miller T J et al, 2008. Lipid corrections in carbon and nitrogen stable isotope analyses:comparison of chemical extraction and modelling methods. Journal of Animal Ecology, 77(4): 838-846 DOI:10.1111/j.1365-2656.2008.01394.x |
Matsakis S, Conover R J, 1991. Abundance and feeding of medusae and their potential impact as predators on other zooplankton in Bedford Basin (Nova Scotia, Canada) during spring. Canadian Journal of Fisheries and Aquatic Sciences, 48(8): 1419-1430 DOI:10.1139/f91-169 |
McCutchan Jr J H, Lewis Jr W M, Kendall C et al, 2003. Variation in trophic shift for stable isotope ratios of carbon, nitrogen, and sulfur. Oikos, 102(2): 378-390 DOI:10.1034/j.1600-0706.2003.12098.x |
Milisenda G, Rossi S, Vizzini S et al, 2018. Seasonal variability of diet and trophic level of the gelatinous predator Pelagia noctiluca (Scyphozoa). Scientific Reports, 8(1): 12140 DOI:10.1038/s41598-018-30474-x |
Mills C E, 2001. Jellyfish blooms:are populations increasing globally in response to Changing Ocean conditions?. Hydrobiologia, 451(1-3): 55-68 |
Mintenbeck K, Brey T, Jacob U et al, 2008. How to account for the lipid effect on carbon stable-isotope ratio (δ13C):Sample treatment effects and model bias. Journal of Fish Biology, 72(4): 815-830 DOI:10.1111/j.1095-8649.2007.01754.x |
Odum E P, 1959. Fundamentals of Ecology. Philadelphia: Saunders, 384
|
Ōmori M, Ikeda T, 1984. Methods in Marine Zooplankton Ecology. New York: Wiley
|
Parnell A C, Inger R, Bearhop S et al, 2010. Source partitioning using stable isotopes:coping with too much variation. PLoS One, 5(3): e9672 DOI:10.1371/journal.pone.0009672 |
Perissinotto R, Pakhomov E A, 1997. Feeding association of the copepod Rhincalanus gigas with the tunicate salp Salpa thompsoni in the southern ocean. Marine Biology, 127(3): 479-483 DOI:10.1007/s002270050036 |
Peterson B J, Fry B, 1987. Stable isotopes in ecosystem studies. Annual Review of Ecology and Systematics, 18: 293-320 DOI:10.1146/annurev.es.18.110187.001453 |
Pitt K A, Clement A L, Connolly R M et al, 2008. Predation by jellyfish on large and emergent zooplankton:implications for benthic-pelagic coupling. Estuarine, Coastal and Shelf Science, 76(4): 827-833 DOI:10.1016/j.ecss.2007.08.011 |
Post D M, 2002. Using stable isotopes to estimate trophic position:models, methods, and assumptions. Ecology, 83(3): 703-718 DOI:10.1890/0012-9658(2002)083[0703:USITET]2.0.CO;2 |
Post D M, Layman C A, Arrington D A et al, 2007. Getting to the fat of the matter:models, methods and assumptions for dealing with lipids in stable isotope analyses. Oecologia, 152(1): 179-189 DOI:10.1007/s00442-006-0630-x |
Purcell J E, Uye S I, Lo W T, 2007. Anthropogenic causes of jellyfish blooms and their direct consequences for humans:a review. Marine Ecology Progress Series, 350: 153-174 DOI:10.3354/meps07093 |
Schukat A, Auel H, Teuber L et al, 2014. Complex trophic interactions of calanoid copepods in the Benguela upwelling system. Journal of Sea Research, 85: 186-196 DOI:10.1016/j.seares.2013.04.018 |
Stevens C J, Deibel D, Parrish C C, 2004. Incorporation of bacterial fatty acids and changes in a wax ester-based omnivory index during a long-term incubation experiment with Calanus glacialis Jaschnov. Journal of Experimental Marine Biology and Ecology, 303(2): 135-156 DOI:10.1016/j.jembe.2003.11.008 |
Stoecker D K, Michaels A E, Davis L H, 1987. Grazing by the jellyfish, Aurelia aurita, on microzooplankton. Journal of Plankton Research, 9(5): 901-915 DOI:10.1093/plankt/9.5.901 |
Suchman C L, Sullivan B K, 2000. Effect of prey size on vulnerability of copepods to predation by the scyphomedusae Aurelia aurita and Cyanea sp. Journal of Plankton Research, 22(12): 2289-2306 DOI:10.1093/plankt/22.12.2289 |
Sullivan B K, Garcia J R, Klein-MacPhee G, 1994. Prey selection by the scyphomedusan predator Aurelia aurita.. Marine Biology, 121(2): 335-341 DOI:10.1007/BF00346742 |
Sun S, Huo Y Z, Yang B, 2010. Zooplankton functional groups on the continental shelf of the Yellow Sea. Deep Sea Research Part Ⅱ:Topical Studies in Oceanography, 57(11-12): 1006-1016 DOI:10.1016/j.dsr2.2010.02.002 |
Teuber L, Schukat A, Hagen W et al, 2014. Trophic interactions and life strategies of epi- to bathypelagic calanoid copepods in the tropical Atlantic Ocean. Journal of Plankton Research, 36(4): 1109-1123 DOI:10.1093/plankt/fbu030 |
Uye S I, 2008. Blooms of the giant jellyfish Nemopilema nomurai:a threat to the fisheries sustainability of the East Asian Marginal Seas. Plankton & Benthos Research, 3(S1): 125-131 |
Yang G, Li C L, Guilini K et al, 2016. Feeding strategies of four dominant copepod species in Prydz Bay, Antarctica:insights from a combined fatty acid biomarker and stable isotopic approach. Deep Sea Research Part Ⅰ:Oceanographic Research Papers, 114: 55-63 DOI:10.1016/j.dsr.2016.04.016 |
Zhang F, Sun S, Jin X S et al, 2012. Associations of large jellyfish distributions with temperature and salinity in the Yellow Sea and East China Sea. Hydrobiologia, 690(1): 81-96 DOI:10.1007/s10750-012-1057-5 |
 2021, Vol. 52
2021, Vol. 52


