中国海洋湖沼学会主办。
文章信息
- 孙世鹏, 孔超, 陆欣鑫, 范亚文. 2021.
- SUN Shi-Peng, KONG Chao, LU Xin-Xin, FAN Ya-Wen. 2021.
- 暴雨期前后库里泡底栖硅藻群落结构变化及其环境因子相关性
- CHANGES IN COMMUNITY STRUCTURE OF BENTHIC DIATOM AND THE ENVIRONMENTAL FACTORS BEFORE AND AFTER RAINSTORM SEASON IN THE KULIPAO LAKE
- 海洋与湖沼, 52(1): 162-174
- Oceanologia et Limnologia Sinica, 52(1): 162-174.
- http://dx.doi.org/10.11693/hyhz20200500134
文章历史
-
收稿日期:2020-05-03
收修改稿日期:2020-07-26
2. 黑龙江省水生生物多样性研究重点实验室 哈尔滨 150025
2. Heilongjiang Provincial Key Laboratory for Hydrobiological Research, Harbin 150025, China
底栖硅藻是淡水生态系统的初级生产者, 除能通过光合作用供给好氧生物氧气外, 亦是水生生物食物网中主要的能量流动环节(Raphael et al, 2002)。由于底栖硅藻具有稳定基质、为其他生物提供栖息场地以及对环境变化敏感等生态属性, 因此常被作为指示生物应用于水域生态研究中(Dixit et al, 1992; Potapova et al, 2002)。底栖硅藻对水温(van Dam et al, 1994)、营养盐(Schmidt et al, 2011)、光照(Van Luijn et al, 1995)及酸碱度(Smith et al, 2000)变化敏感, 其种类组成、群落结构和生物完整性被广泛应用于湖泊(Andrén et al, 2008)、湿地(Kingston et al, 1983)、河流(Lane et al, 2009)及水库(Potapova et al, 2003)的水体营养状况及污染特征。在不同的水位、流量及流速环境下, 底栖硅藻群落差异明显, 其群落结构的改变往往是构建湖库暴雨期多样性变化模式的有效生态学信号(Leynaert et al, 2011)。
库里泡(45°47′-45°58′N, 124°46′-124°53′E)地处黑龙江省大庆市大同区、肇源县、肇州县三地的交界处, 水域呈“葫芦”状, 南北长约16 km, 东西最宽处约5 km, 面积约81 km2, 平均水深约1.0 m, 最大库容量约9.1×107 m3, 是串联在安肇新河的最大湖库(曹文钟等, 2019)。大庆市的城市污水通过安肇新河汇入库里泡后排入松花江, 作为大庆市重要的纳污、泄洪湖泊, 库里泡对整个大庆市污水和洪水的排放起着重要的作用。库里泡水质的营养状态不仅直接影响松花江干流水质, 而且对居民饮用水的安全也产生重大影响(曹文钟等, 2012)。2019年自进入8月份以来, 大庆市遭遇了近十年来罕见的大暴雨, 日平均降雨量达到120 mm, 连续的强降雨持续了一周左右的时间。大暴雨对库里泡流域内水文条件、营养盐特征及生物多样性产生明显改变。目前, 有关降雨对浮游植物多样性保护及群落演替的研究多有报道(Tas et al, 2009; 王为民等, 2014), 然而对底栖硅藻群落在暴雨期间响应模式的针对性研究较少。本文对暴雨前后库里泡底栖硅藻群落结构及其生态分布特征进行研究, 分析暴雨前、后底栖硅藻群落变化及水体理化因子的耦合关系, 并结合多样性指数探讨库里泡水环境的营养状况。这对从不同尺度掌握暴雨对湖库水质、底栖硅藻群落结构、和生态系统过程的研究具有一定的理论参考和实际应用的意义。
1 材料与方法 1.1 采样点设置我们于2019年7月27日(暴雨前)和8月11日(暴雨后)分别对库里泡进行水样及底栖硅藻样品的采集工作。并通过查阅本底数据, 根据库里泡生态环境特点, 共设置12个采样点(图 1)。采样点涉及库里泡的入水口(S12)、出水口(S1)、湖库中央位置(S5)及典型人为活动干扰区(S2-S4、S6-S11), 基本涵盖了库里泡的生境特征。采样点的定位采用GPS全球卫星定位系统。
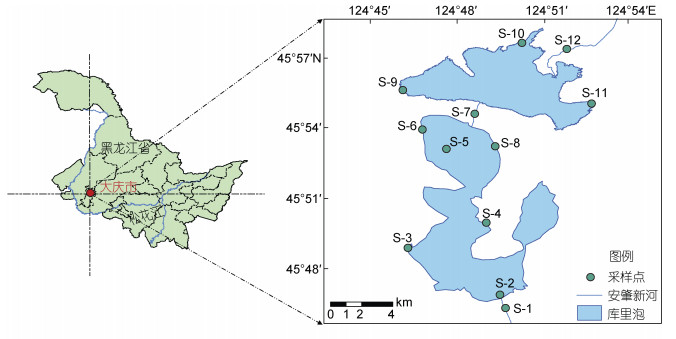 |
| 图 1 库里泡采样点分布图 Fig. 1 Location map of sample sites in Kulipao Lake |
在采集过程中, 随机选取3个受人为影响较小、抗水流冲刷能力较强的石块作为底栖硅藻的附着基质。从每个石块上用毛刷、吸管等工具刷取面积约为25 cm2的样品, 经纯净水冲洗多次后, 转移至标本瓶中并定容到100 mL, 现场用4%的甲醛固定保存。
1.3 水体理化指标的测定使用YSI多参数水质分析仪对水温(WT)、电导率(SpCond)、溶解氧(DO)以及pH进行现场测定; 使用便携式浊度仪进行浊度(Tur.)的测定。在实验室中, 水样需在24 h之内测定化学需氧量(CODMn)、总氮(TN)和总磷(TP)等理化指标; 5日后进行生物需氧量(BOD5)的测定。其中, CODMn、TN以及TP含量均参照中华人民共和国地表水环境质量标准进行测定。
1.4 样品计数与鉴定在实验室对定性样品加入过量的浓硝酸, 于(130±5)℃下加热1-3 h直至样品呈现白色絮状沉淀, 用蒸馏水清洗5-7次使上清pH接近7后, 接着进行离心、弃上清, 沉淀使用95%的酒精保存, 最后取适量沉淀用Naphrax胶制成永久封片。每张封片需在10×100倍的油镜下随机选取不少于50个视野进行计数, 个别封片由于硅藻数量较少, 计数低于50个视野, 在计数过程中排除破损面积超过1/4的壳体。参照McNaughton对优势度指数(Y)的计算, 将Y≥0.02的种确定为优势种(Lampitt et al, 1993), 并依据《中国淡水藻类--系统、分类及生态》对底栖硅藻进行种类的分类与鉴定。
1.5 数据处理与分析(1) 底栖硅藻丰度的计算公式:
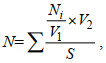 (1)
(1)式中, N为100 mL藻类样品中底栖硅藻的丰度(ind./cm2); Ni为物种i的个体数; V1为15 μL硅藻样品; V2为100 mL (105 μL)藻类样品; S为刮去的石头面积(75 cm2);
(2) 修正的营养状态指数TSIM(j)的计算公式(金相灿等, 1995):
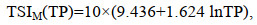 (2)
(2)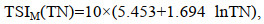 (3)
(3)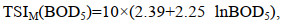 (4)
(4)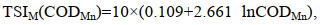 (5)
(5)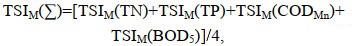 (6)
(6)式中, TSIM(j)分别是以TN、TP、COD5、BODMn的营养状态指数, 环境变量单位为mg/L。
经纬度信息通过GPS全球定位系统结合Google Earth获取; 采样点地图以及基于GIS的地统计分析通过ArcMap 10.2及反距离权重插值法完成; 底栖硅藻群落结构分析采用多种非参数变量分析方法, 包括单因素交叉相似性分析(one-way crossed ANOSIM)以及相似性百分比(SIMPER)分析。该分析中生物群落结构相似性矩阵的构建基础为Bray-Curtis相似性系数, 以上分析均由PRIMER 5.0软件完成。独立样本T检验(T-test)使用SPSS 22.0软件完成。运用Origin 2018对底栖硅藻优势种类群进行层次聚类分析(hierarchical cluster analysis)。去趋势分析(DCA)和典范对应分析(CCA)采用软件CANOCO 4.5进行, 在进行排序前, 对解释变量和响应变量数据进行log2(x+1)转换, 使样本总体趋于正态分布。通过蒙特卡洛置换检验, 筛选出影响底栖硅藻群落结构的主要环境变量。
2 结果与分析 2.1 库里泡底栖硅藻种类组成本次研究期间共鉴定底栖硅藻71种, 隶属于2纲6目10科30属。其中以羽纹纲(Pennatae)的种类最多, 共27属67种, 占总种类数的94%;而中心纲(Centricae)的种类则相对单一, 仅3属4种, 占总种类数的6%。从组成类群上看, 暴雨前后均以舟形藻属(Navicula Bory)和菱形藻属(Nitzschia Hassall)的一些种类占优, 且底栖硅藻物种丰富度较为稳定, 分别为55种和58种。
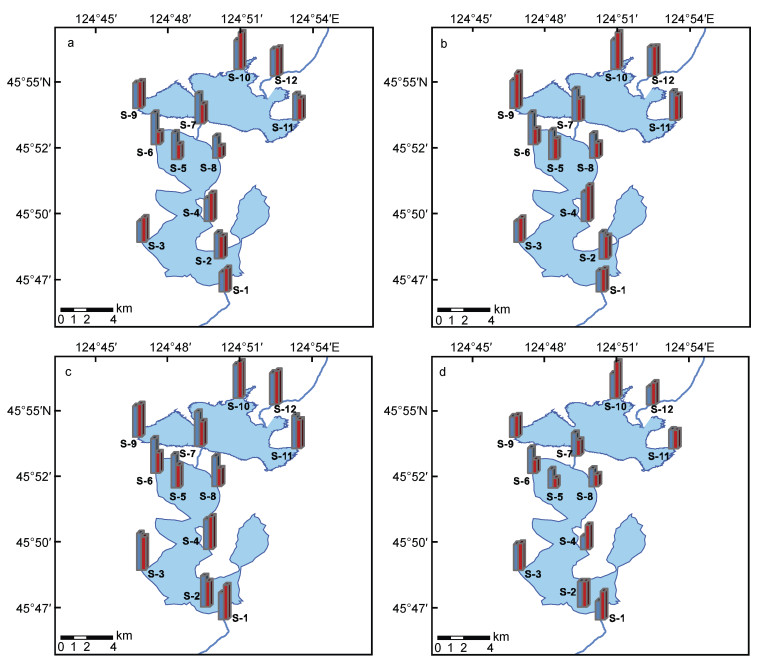
2.2 暴雨期前后底栖硅藻的丰度变化暴雨期前后各采样点的细胞丰度整体呈现出下降的规律(图 2)。暴雨期前平均丰度较高为2.06× 104 ind./cm2, 变化范围在(1.21-5.03)×104 ind./cm2之间; 暴雨期后平均丰度较低为1.39×104 ind./cm2, 变化范围在(0.1-2.67)×104 ind./cm2之间。
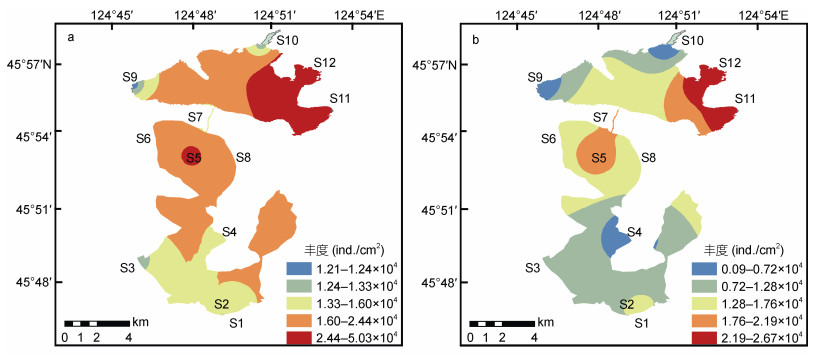 |
| 图 2 暴雨期前后库里泡各采样点底栖硅藻丰度的变化 Fig. 2 Changes of benthic diatom abundance before and after the rainstorm season in Kulipao Lake 注: a.暴雨前; b.暴雨后 |
研究期间共鉴定底栖硅藻优势种15种, 其中暴雨期前13种, 暴雨期后7种。梅尼小环藻(Cyclotella meneghiniana Kützing)、细布纹藻[Gyrosigma kuetzingii (Grunow) Cleve]、谷皮菱形藻[Nitzschia palea (Kützing) Smith]、Gomphonema exilissimum (Grunow) Lange- Bertalot & Reichardt和细端菱形藻[Nitzschia dissipata (Kützing) Rabenhorst]在暴雨期前后均为优势种, 而系带舟形藻[Navicula cincta (Ehrenberg) Ralfs]、反曲菱形藻(Nitzschia reversa Smith)则在暴雨期后成为新的优势种群。暴雨期后, 梅尼小环藻、系带舟形藻以及反曲菱形藻的丰度升高; 细布纹藻的丰度相对平稳; 而虱形双眉藻[Amphora pediculus(Kützing) Grunow]、蓝色双眉藻(Amphora veneta Kützing)、Navicula associata Lange-Bertalot和毡帽菱形藻(Nitzschia homburgiensis Lange-Bertalot)则呈现出显著降低的规律(表 1)。通过SIMPER分析得到造成暴雨前后库里泡底栖硅藻群落结构差异的主要贡献物种, 结果显示, 梅尼小环藻、系带舟形藻和谷皮菱形藻是造成暴雨期前后底栖硅藻群落结构差异的主要贡献物种(表 2)。
| 种类 | 丰度(ind./cm2) | |
| 暴雨前 | 暴雨后 | |
| Cyclotella meneghiniana Kützing | ++ | +++ |
| Gyrosigma kuetzingii (Grunow) Cleve | + | + |
| Nitzschia palea (Kützing) Smith | +++ | + |
| Gomphonema exilissimum (Grunow) Lange-Bertalot & Reichardt | ++ | + |
| Nitzschia dissipata (Kützing) Rabenhorst | ++ | + |
| Amphora pediculus (Kützing) Grunow | + | – |
| Amphora veneta Kützing | + | – |
| Navicula associata Lange-Bertalot | +++ | + |
| Nitzschia capitellata Hustedt | ++ | + |
| Navicula menisculus Schumann | + | + |
| Nitzschia homburgiensis Lange-Bertalot | ++ | + |
| Nitzschia microcephala Grunow | + | + |
| Nitzschia umbonata (Ehrenberg) Lange-Bertalot | ++ | + |
| Navicula cincta (Ehrenberg) Ralfs | ++ | +++ |
| Nitzschia reversa Smith | + | ++ |
| 注: –: 0-0.1×104 ind./cm2; +: 0.1-1×104 ind./cm2; ++: 1-3×104 ind./cm2; +++: 3-5×104 ind./cm2 | ||
| 总差异(R) | 显著性水平(P) | 平均相似度 | 平均相异度 | 主要贡献物种 | |
| 暴雨前 | 0.279 | 0.001 | |||
| 18.07 | Navicula associata Lange-Bertalot | ||||
| Nitzschia palea (Kützing) Smith | |||||
| Nitzschia umbonata (Ehrenberg) Lange-Bertalot | |||||
| 暴雨后 | 27.86 | Cyclotella meneghiniana Kützing | |||
| Navicula cincta (Ehrenberg) Ralfs | |||||
| 暴雨前*暴雨后 | 91.26 | Cyclotella meneghiniana Kützing | |||
| Navicula cincta (Ehrenberg) Ralfs | |||||
| Nitzschia palea (Kützing) Smith |
暴雨期前后库里泡各采样点的水环境变量及其独立样本T检验结果见表 3。在本次研究期间, 库里泡水温、电导率、pH、浊度、总磷和总氮在暴雨期前后差异显著(P < 0.05)。而溶解氧、化学需氧量和生物需氧量则在统计分析上差异不明显(P > 0.05), 在暴雨期前后表现相对稳定。库里泡各样点在暴雨期前的平均水温为30.95℃, 明显高于暴雨期后的平均水温22.44℃。暴雨期前, 各采样点的电导率平均值为2031 μs/cm, 变化范围在1337-2550 μs/cm之间; 暴雨期后, 电导率呈显著下降的规律, 平均值为1141μs/cm, 变化范围在853-1270 μs/cm之间。暴雨期前后库里泡水体酸碱度均呈弱碱性状态, 平均值分别为8.89和8.35。暴雨前后浊度差异极其显著(P < 0.01), 平均浊度由98.21 NTU突降为37.68 NTU, 变化范围分别为63.10-138.10 NTU和10.9-42.10 NTU。暴雨过后, 总磷值呈现出降低的规律, 平均值由1.01 mg/L降低到0.47 mg/L; 与2015年夏季库里泡水体的总磷值(平均值3 mg/L)相比(杨双, 2016), 本次研究结果反应出库里泡水体富营养化已在一定程度上得到改善。总氮值呈现出升高的规律, 平均值由0.73 mg/L升高到0.84 mg/L(图 3)。
| 样点 | 水温(℃) | 溶解氧(mg/L) | 电导率(μs/cm) | pH | 浊度(NTU) | 生物需氧量(mg/L) | 总磷(mg/L) | 化学需氧量(mg/L) | 总氮(mg/L) | |
| 暴雨前 | S1 | 29.30 | 5.20 | 2550.00 | 7.82 | 107.90 | 2.30 | 1.11 | 11.48 | 0.78 |
| S2 | 30.30 | 6.40 | 2050.00 | 9.20 | 63.10 | 1.60 | 0.79 | 29.69 | 0.75 | |
| S3 | 28.70 | 6.10 | 1337.00 | 8.58 | 137.10 | 2.20 | 0.88 | 11.71 | 0.70 | |
| S4 | 29.70 | 6.00 | 1995.00 | 9.20 | 110.50 | 2.10 | 0.89 | 24.49 | 0.70 | |
| S5 | 33.70 | 6.90 | 1925.00 | 9.32 | 79.40 | 1.00 | 0.48 | 21.44 | 0.76 | |
| S6 | 33.10 | 5.70 | 1856.00 | 9.34 | 138.10 | 0.20 | 0.55 | 12.54 | 0.70 | |
| S7 | 31.60 | 5.30 | 2020.00 | 8.99 | 127.40 | 0.60 | 1.11 | 12.04 | 0.74 | |
| S8 | 35.20 | 5.80 | 2460.00 | 9.34 | 67.00 | 0.90 | 0.74 | 24.25 | 0.74 | |
| S9 | 28.67 | 6.20 | 2000.00 | 8.59 | 83.30 | 1.00 | 1.45 | 16.49 | 0.73 | |
| S10 | 30.80 | 6.40 | 2230.00 | 8.78 | 80.30 | 1.80 | 1.29 | 16.59 | 0.74 | |
| S11 | 29.50 | 6.10 | 1988.00 | 8.32 | 85.70 | 1.80 | 1.55 | 20.78 | 0.73 | |
| S12 | 30.80 | 6.10 | 1964.00 | 9.14 | 98.70 | 0.80 | 1.28 | 12.95 | 0.73 | |
| 暴雨后 | S1 | 20.30 | 6.60 | 1192.00 | 8.54 | 38.30 | 2.00 | 0.54 | 13.69 | 0.88 |
| S2 | 20.90 | 5.80 | 1270.00 | 8.37 | 20.60 | 1.30 | 0.29 | 14.19 | 0.84 | |
| S3 | 19.20 | 5.80 | 1178.00 | 8.17 | 78.60 | 0.70 | 0.42 | 10.72 | 0.88 | |
| S4 | 24.70 | 6.20 | 1237.00 | 8.79 | 27.60 | 0.80 | 0.50 | 12.45 | 0.85 | |
| S5 | 22.90 | 7.10 | 1100.00 | 8.36 | 33.70 | 2.70 | 0.48 | 13.20 | 0.85 | |
| S6 | 23.90 | 5.30 | 1260.00 | 8.14 | 42.10 | 1.00 | 0.47 | 14.19 | 0.83 | |
| S7 | 23.80 | 7.00 | 1143.00 | 8.23 | 22.90 | 2.20 | 0.50 | 12.87 | 0.83 | |
| S8 | 23.20 | 6.00 | 1214.00 | 8.21 | 18.40 | 1.30 | 0.62 | 13.03 | 0.80 | |
| S9 | 26.70 | 6.80 | 853.00 | 8.27 | 23.00 | 2.00 | 0.45 | 11.71 | 0.80 | |
| S10 | 22.40 | 6.40 | 1183.00 | 8.46 | 34.80 | 1.40 | 0.52 | 13.70 | 0.87 | |
| S11 | 18.50 | 6.60 | 930.00 | 8.19 | 80.90 | 1.80 | 0.41 | 13.20 | 0.81 | |
| S12 | 22.80 | 5.90 | 1129.00 | 8.41 | 31.20 | 1.30 | 0.50 | 12.60 | 0.80 | |
| 独立样本T检验暴雨前*暴雨后 | < 0.05 | >0.05 | < 0.05 | < 0.05 | < 0.05 | >0.05 | < 0.05 | >0.05 | < 0.05 | |
| 注:加粗字体表示存在显著差异(P < 0.05) | ||||||||||
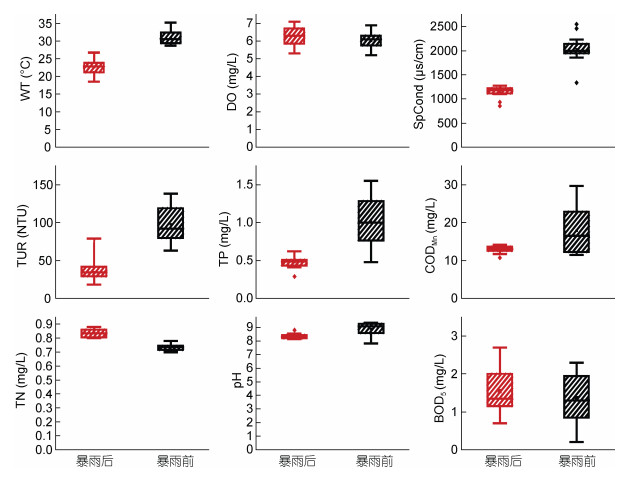 |
| 图 3 暴雨期前后库里泡水环境变量的箱体分布图 Fig. 3 Box distribution map of water environmental variables before and after the rainstorm season in Kulipao Lake |
暴雨期前, 库里泡各样点的Shannon-Weaver指数变化范围在2.1-3.35之间, 平均值为2.73; Margalef物种丰富度指数变化范围在1.31-2.58之间, 平均值为2.06; Pielou均匀度指数变化范围在0.50-0.76之间, 平均值为0.65; Simpson’s生态优势度指数变化范围在0.66-0.90之间, 平均值为0.79。暴雨期后, Shannon-Weaver指数、Pielou均匀度指数以及Simpson’s生态优势度指数均呈现出下降的规律, 平均值分别降低到2.43、0.60和0.71; Margalef物种丰富度指数略有升高, 变化范围在0.98-3.63之间, 平均值为2.11(图 4)。
 |
| 图 4 暴雨期前后库里泡各采样点生物多样性指数的变化 Fig. 4 Changes of biodiversity index before and after the rainstorm season in Kulipao Lake 注:蓝色柱状表示暴雨前, 红色柱状表示暴雨后。a. Shannon-Weaver指数; b. Pielou均匀度指数; c. Simpson’s生态优势度指数; d. Margalef物种丰富度指数 |
在本次研究中, 采用TN、TP、CODMn和BOD5四种环境变量对库里泡水体营养状态进行初步评价, 通过计算得到修正的营养状态指数TSIM(表 4)。研究发现, 暴雨期后库里泡所设置的12个采样点的水体营养状态普遍呈降低的规律。具体为:暴雨期前库里泡水体普遍呈中度富营养化状态; 少数呈轻度富营养状态和中营养状态。暴雨期后库里泡水体普遍呈中营养状态, 少数呈轻度富营养状态(图 5)。
| 营养类别 | 贫营养 | 中营养 | 轻度富营养 | 中度富营养 | 重度富营养 |
| TSIM | TSIM < 30 | 30≤TSIM≤50 | 50 < TSIM≤60 | 60 < TSIM≤70 | TSIM>70 |
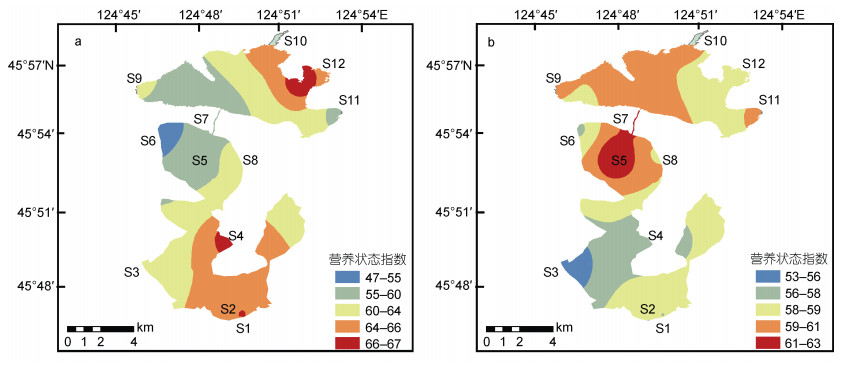 |
| 图 5 暴雨期前后库里泡各采样点水体营养状态指数的变化 Fig. 5 Changes in nutritional status index of Kulipao Lake before and after the rainstorm season 注: a.暴雨前; b.暴雨后 |
聚类分析可以将无序个体按相似程度进行归类(Donar et al, 1996), 本研究将库里泡采集区域的底栖硅藻优势种类群以及种群间的相似性程度进行聚类分析, 得到各样点在暴雨期前后的聚类树状图(图 6)。研究结果显示, 在暴雨期前和暴雨期后库里泡底栖硅藻优势种类群的细胞密度差异显著, 聚类分析清晰地将其划分为两大类; 以相似性距离300为标准, 聚类分析又将Nitzschia microcephala、Naviculamenisculus、蓝色双眉藻、虱形双眉藻、小头端菱形藻、细布纹藻、细端菱形藻、毡帽菱形藻以及脐形菱形藻划分在同一组群, 说明在暴雨期前后一些种类对环境的耐受程度具有生态适应的相似性。
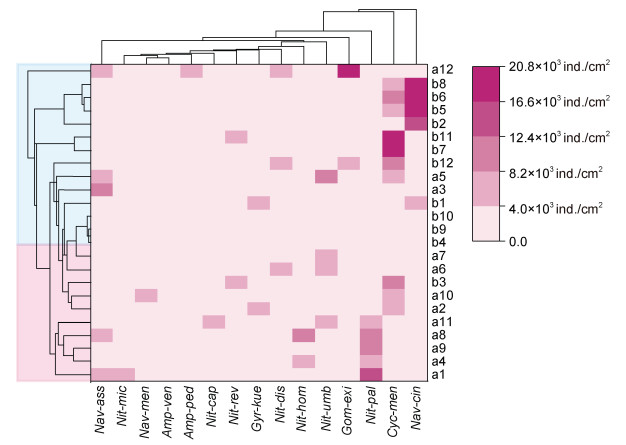 |
| 图 6 暴雨期前后库里泡各采样点底栖硅藻群落相似性聚类图 Fig. 6 Similarity cluster diagram of benthic dia tom communities before and after the rainstorm season in Kulipao Lake 注: Nav-ass: Navicula associata Lange-Bertalot; Nit-mic: Nitzschia microcephala Grunow; Nit-pal: Nitzschia palea (Kützing) Smith; Cyc-men: Cyclotella meneghiniana Kützing; Gyr-kue: Gyrosigma kuetzingii (Grunow) Cleve; Nav-cin: Navicula cincta (Ehrenberg) Ralfs; Nit-umb: Nitzschia umbonate (Ehrenberg) Lange-Bertalot; Nit-dis: Nitzschia dissipata (Kützing) Rabenhorst; Nit-hom: Nitzschia homburgiensis Lange-Bertalot; Nit-cap: Nitzschia capitellata Hustedt; Nit-rev: Nitzschia reversa Smith; Nav-men: Navicula menisculus Schumann; Amp-ven: Amphora veneta Kützing; Gom-exi: Gomphonema exilissimum (Grunow) Lange-Bertalot & Reichardt; Amp-ped: Amphora pediculus (Kützing) Grunow |
对库里泡水温、总氮、总磷、BOD5、溶解氧、电导率、pH、CODMn和浊度共9个环境因子与底栖硅藻优势种进行排序分析, 研究库里泡底栖硅藻群落在暴雨期前后的分布规律, 并探索驱动底栖硅藻群落发生变化的主要环境因子。将库里泡底栖硅藻优势种进行去趋势分析(DCA), 排序结果显示四个轴最大长度为5.759, 因此属于单峰模型的典范对应分析(CCA), 可更准确的分析暴雨期前后库里泡各采样点底栖硅藻群落结构的分布规律。CCA结果表明, 排序轴1、轴2的特征值分别为0.701和0.507, 种类与环境因子间的相关系数分别为0.909和0.860, 前四个排序轴共解释75.3%的累计种类环境变量百分比。说明本次CCA排序结果可靠, 基本反映了研究期间库里泡底栖硅藻群落与环境变量之间的生态关系。经蒙特卡洛检验, pH和总氮(P < 0.01)是驱动底栖硅藻群落结构变化的主要环境变量, 此外浊度和水温(P < 0.05)也与群落结构变化密切相关(图 7)。
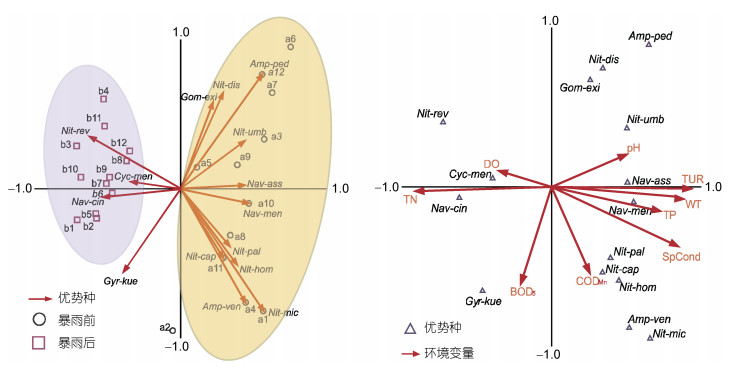 |
| 图 7 底栖硅藻优势种与环境变量的CCA分析 Fig. 7 CCA of dominant species and environmental variables in Kulipao Lake |
底栖硅藻分布格局及结构特征是水域生态过程的有效指示者, 一方面体现在水环境特征会限制底栖硅藻群落分布, 另一方面底栖硅藻也会通过上行效应适应环境的滤过作用(王勇等, 2000)。因此, 底栖硅藻独特的生态属性往往是分析水域健康状况的有效方式(Petranich et al, 2018)。
在本次研究中库里泡底栖硅藻群落结构在暴雨期前后的变化特征为, 由谷皮菱形藻和Navicula associata占绝对优势转变为由以梅尼小环藻和系带舟形藻组成的绝对优势种。此外, 底栖硅藻丰度、物种多样性指数以及优势种群丰富度在暴雨期后均呈现出下降的规律, 这与Bracht-Flyr等(2012)对美国四个湖库中底栖硅藻群落结构变化的研究结果一致。其原因在于暴雨影响了水域的换水周期, 从而影响藻类生物量的积累过程。暴雨期间, 随着降雨量的增大, 库里泡水体滞留时间缩短, 导致藻类生物量的积累程度降低。此外, 暴雨影响外源营养盐和内源营养盐的补给, 对于水力滞留时间相对较短的库里泡而言, 水体氮、磷等营养盐水平与外源输入量具有明显的相关性。从流域河道水质状况、植被及水土保持能力、降雨的季节情况等分析, 暴雨过程对库里泡外源营养盐的摄入量存在一定的限制作用。比如春季农耕季节降雨量大一般意味着更高的外源负荷; 而夏季暴雨则可能导致水体氮、磷负荷降低, 从而影响藻类植物对营养盐的吸收(Bramburger et al, 2008)。物种多样性指数揭示了群落组成的物种数和个体数, 常用于反应生物群落的稳定性及复杂程度(马永红等, 2012)。研究期间, 位于库里泡中央区域附近的样点(S5-S8)物种多样性指数呈显著下降的规律, 这主要因为该区域受渔业、人为活动污染较为明显, 水体中氮含量较高, 导致底栖硅藻群落结构失去了原有的稳定性, 不同种类分布的集中程度升高, 从而使优势种属的地位更加突出(孙军等, 2002; Spellerberg et al, 2003)。因此, 一些适应在暴雨下生长且抗逆性能力较高的种类(如梅尼小环藻、系带舟形藻)在暴雨期后其优势地位更加显著。
持续的大暴雨导致库里泡的水位迅猛上涨, 流速持续升高。据大庆市水文部门统计, 水位最高时已超出警戒线0.59 m。而底栖硅藻群落特征可以在一定程度上指示暴雨强度, 伴随着强降雨的发生, 一些特殊藻类植物的丰度会增减(Reid et al, 2009)。在本次调查期间, 小环藻属的梅尼小环藻和舟形藻属的系带舟形藻的细胞密度在暴雨期后升高, 造成以上两个种密度升高的原因为:一方面流速通过影响水体温度间接影响藻类的生长(Sinokrot et al, 2000); 另一方面则是水体扰动有助于藻类植物对营养盐(氮、磷)的吸收(Liu et al, 2012)。而梅尼小环藻适应生活在水温较低的环境特征, 系带舟形藻又对水体中氮含量反应敏感(邓培雁等, 2015)。因此, 在暴雨期后伴随着水温的降低以及氮含量的升高, 梅尼小环藻和系带舟形藻表现出对暴雨具有较强的耐受性。据相关研究报道, 菱形藻属种类的细胞密度在暴雨期后普遍下降(Richardson et al, 2019)。然而在本次研究中, 反曲菱形藻的细胞密度却表现为升高, 并成为新的优势种群。暴雨期后, 反曲菱形藻大多出现在S3和S11样点, 生境类型均为浑浊较浅的水体, 并与梅尼小环藻共同作为优势种群, 分析认为其可能与梅尼小环藻的某些生态特性相似(如对低温、弱光条件具有较强的适应性)。目前有关于反曲菱形藻的相关研究较少, 考虑到藻类植物的分布还与气候变化及水环境因子等多种因素密切相关, 因此要准确分析反曲菱形藻种群对暴雨的响应程度, 仍需通过长期的监测进行深入研究。
3.2 底栖硅藻群落结构变化与水环境因子的相关性底栖硅藻的生长和代谢受多种环境变量的共同作用, 如水温、pH以及营养盐等, 在不同环境变量的驱动下, 可使底栖硅藻群落发生规律性的变化(Potapova et al, 2003; Lindholm et al, 2018)。在CCA排序图中, 采样点沿着排序轴的分布情况体现了该样点中所有物种的贡献率及对环境梯度的响应过程(Lu et al, 2017)。本研究中, 暴雨期前、后库里泡各采样点沿着CCA排序轴分布特征明显, 且蒙特卡洛检验指出pH和总氮(P < 0.01)是驱动底栖硅藻群落结构发生变化的主要影响因子, 水温和浊度(P < 0.05)也在一定程度上指示了底栖硅藻群落的变化过程。
库里泡位于黑龙江省中南部, 属于干旱地区。同时受地下水位低、排水不畅等影响, 极易造成土壤缺乏补给。而当少量降水溶入大量易溶盐分, 并随地面蒸发带向地表, 从而形成盐碱地(司振江等, 2010)。硅藻的许多属种对某些水环境指标都有其特定的最佳值和忍耐值, 能很好地指示水环境的变化, 如水体酸碱化和营养状态等(Lim et al, 2017)。而水体pH值, 特别是在偏碱性的水体中, 常常作为影响底栖硅藻群落结构发生变化的一个重要因素(陈向等, 2017)。本研究发现暴雨期前后库里泡水域整体上均呈弱碱性状态, 期间出现的硅藻植物主要以淡水至半咸水、喜弱碱的种类为主, 如脐形菱形藻(李宇航等, 2017)、系带舟形藻(黎佛林等, 2015)以及Navicula associate (Diamantini et al, 2018)等。其中系带舟形藻的生境类型多为微盐、适碱的水体, 在富营养化的水体中也有存在。而脐形菱形藻和Navicula associata则在排序轴中呈现出与pH呈正相关的趋势, 且在暴雨期后丧失了原有的优势地位。已有研究表明脐形菱形藻和Navicula associata适应在pH较高的水环境下生长, 在群落中占据较宽的生态幅, 并对水体pH的变化反应敏感(Sienkiewicz et al, 2017)。调查期间由于雨水不断地冲刷, 导致水体pH略有下降, 加之水文状况的不稳定, 致使其细胞密度出现大幅度的下降。而另外一些在暴雨前优势度较高的种类(如Gomphonema exilissimum和谷皮菱形藻)也同样适应在弱碱性水体中生长(Dalu et al, 2017; Tolotti et al, 2019), 由此可以看出研究区域底栖硅藻优势种群与水体酸碱度存在一定的响应关系, 说明库里泡底栖硅藻群落的变化受水体酸碱化的影响明显。
总氮是评估水体富营养化的重要参数, 作为底栖硅藻生长代谢所需的大量元素之一, 当水体中氮含量过高或过低时, 往往会成为影响底栖硅藻群落结构发生变化的主要因子, 而这种影响又与氮、磷的供应量以及暴雨频率有关(Chu et al, 2017)。一般情况下, 处在水文特征不稳定期的底栖硅藻群落对氮、磷的供应量更为敏感(Sun et al, 2017)。CCA结果显示, 系带舟形藻与水体中氮含量呈正相关关系。暴雨期后随着库里泡水体中氮含量的升高, 系带舟形藻的丰度也随之升高, 这种现象在其他的一些研究中也得到相同的结论(Marra et al, 2018)。系带舟形藻的丰度之所以在暴雨期后呈现升高的规律, 一方面与其自身生理特征有关, 而另一方面则是与生态系统内物理、化学和生物环境有关。据有关研究表明, 系带舟形藻对氮的吸收能力较强, 且在氮含量高而磷含量相对较低的水体中比其他硅藻种类更有优势(黎征武等, 2017)。因此, 在暴雨期间水环境的变化为系带舟形藻的生长提供了充足条件。此外, 水体中氮磷比的含量会影响藻类植物种群适应及群落组成, 天然水体中的藻类进行光合作用, 合成本身的藻类原生质: C106H263Nl6P1, 临界的氮磷比按元素计为16︰1, 按质量计为7︰1 (Redfield, 1960)。当氮磷比大于7︰1时, 磷将限制藻类的生长; 否则, 氮则可认为是藻类增长的限制因素(Lau et al, 2002)。在本次调查中, 库里泡水域平均氮磷比均小于7︰1, 水体属于氮限制。可见降雨过程对水体中TN含量具有明显的调控作用, 这也是影响库里泡底栖硅藻群落结构变化的关键水环境因子之一。
浊度反映了水体对光线通过时所产生的阻碍程度, 它包括悬浮物对光的散射和溶质分子对光的吸收。水的浊度不仅与水中悬浮物的含量有关, 而且与它们的大小、形状及折射系数等有关, 它们可以降低水体的透光率(Dupont et al, 1994)。浊度的高低直接影响着藻类植物对光的吸收, 浊度过高会降低藻类植物的光合作用, 从而抑制藻类的生长和繁殖(Tapolczai et al, 2017)。在本次研究中, 浊度在暴雨期后呈显著下降的规律, 这与库里泡水位在暴雨后的快速上涨以及其流速、流量的加大有关。浊度的降低虽然可以促进藻类植物的生长, 但调查期间库里泡水文情况复杂, 且藻类植物的生长还要受水体中其他因子的共同影响, 因此暴雨后的库里泡水域浊度虽然有所降低但其底栖硅藻丰度却未见明显升高。CCA结果显示水温在一定程度上也影响着底栖硅藻群落结构的变化, 而硅藻物种数量及分布会随着水温的改变而发生显著的变化(Abonyi et al, 2018)。整体上看, 库里泡水温在暴雨期后呈现出下降的趋势, 因而一些适合在低温条件下生长的藻类(如:梅尼小环藻)便会大量繁殖。从形态学特征分析, 梅尼小环藻的形态有利于维持其高水平的表面积与体积(S/V)比值, 同时该种具有高效的捕光能力(Mitrovic et al, 2003)。因此在低温条件下, 梅尼小环藻便在与其他藻类的竞争中占据优势, 继而成为优势种群。
物种多样性指数是群落结构独特的生物学特征, 在水质监测工作中常用来指示水环境变化(Woelfel et al, 2007)。但通常多样性指数仅定量的考虑了群落的物种数及个体数, 不能很好地揭示水体的具体污染类型, 因此结合理化指标能更好地评价水质状况(Castillejo et al, 2018)。本研究应用硅藻多样性指数、优势度指数以及均匀度指数等指标对库里泡水域营养状况进行分析, 根据国内外湖泊营养分级标准(Munawar et al, 2011), 综合各指数分析, 表明库里泡在暴雨期后普遍呈中营养状态, 其中样点5、样点7呈中度富营养状态。样点5位于库里泡的中心处, 该样点附近有人工养蟹蓄养池。暴雨过后渔民开始加速对河蟹的生产和养殖, 从而使水体中营养盐浓度升高; 样点7位于库里泡河道的最窄处, 附近受人为影响较大, 加之水位较浅, 流速缓慢, 造成该样点水体中营养盐沉降, 促使水体呈中度富营养状况。
4 结论综合本研究结果, 可以看出暴雨期前后库里泡底栖硅藻丰度、优势种个数以及物种多样性指数呈现出显著下降的规律。说明暴雨过程对环境中的pH、总氮、浊度以及水温等所产生的综合环境过滤过程与底栖硅藻本身的结构特征、生活周期以及对环境的适应性密切相关。未来在对于暴雨期与底栖硅藻群落相关性的研究中, 也需加强暴雨前后水文条件的变化及空间过程的改变对于硅藻种群水平的限制作用的研究。
马永红, 曾燏, 任丽萍, 等. 2012. 嘉陵江四川段藻类植物群落结构及水质评价. 应用生态学报, 23(9): 2573-2579 |
王勇, 焦念志. 2000. 营养盐对浮游植物生长上行效应机制的研究进展. 海洋科学, 24(10): 30-33 DOI:10.3969/j.issn.1000-3096.2000.10.012 |
王为民, 陈洪举, 梁生康, 等. 2014. 夏季强降雨对胶州湾浮游硅藻群落结构的影响. 海洋科学, 38(2): 46-52 |
邓培雁, 张婉, 王旭涛, 等. 2015. 水质对东江流域附生硅藻群落的影响. 生态学报, 38(6): 1852-1861 |
司振江, 张忠学, 黄彦. 2010. 大庆市盐碱土深松改良生态修复试验研究. 土壤通报, 41(4): 952-956 |
孙军, 刘东艳, 杨世民, 等. 2002. 渤海中部和渤海海峡及邻近海域浮游植物群落结构的初步研究. 海洋与湖沼, 33(5): 461-471 DOI:10.3321/j.issn:0029-814X.2002.05.002 |
李宇航, 陈万东, 蔡厚才, 等. 2017. 南麂列岛砂质潮间带底栖硅藻多样性与群落结构的时空变化. 生物多样性, 25(9): 981-989 |
杨双, 2016.大庆库里泡藻类植物群落结构多样性变化研究.哈尔滨: 哈尔滨师范大学硕士学位论文
|
陈向, 周伟奇, 李伟峰. 2017. 北京河流底栖硅藻沿城乡梯度带空间分布及其季节变化. 生态学报, 37(10): 3586-3595 |
金相灿, 刘树坤, 章宗涉, 等. 1995. 中国湖泊环境(第一册). 北京: 海洋出版社
|
曹文钟, 孙玉凤. 2012. 库里泡富营养化现状分析及修复对策. 东北林业大学学报, 40(11): 159-162 DOI:10.3969/j.issn.1000-5382.2012.11.039 |
曹文钟, 孙玉凤, 杨双, 等. 2019. 大庆库里泡浮游植物群落结构及多样性研究. 生态科学, 38(2): 206-211 |
黎佛林, 蔡德所. 2015. 附生硅藻作为指示生物的研究进展. 水资源保护, 31(6): 128-134 |
黎征武, 曹然, 毛建忠, 等. 2017. 适于北江水质生物评价的附着硅藻指数研究. 生态环境学报, 26(2): 275-284 |
Abonyi A, Ács É, Hidas A et al, 2018. Functional diversity of phytoplankton highlights long-term gradual regime shift in the middle section of the Danube River due to global warming, human impacts and oligotrophication. Freshwater Biology, 63(5): 456-472 DOI:10.1111/fwb.13084 |
Andrén C, Jarlman A, 2008. Benthic diatoms as indicators of acidity in streams. Fundamental and Applied Limnology, 173(3): 237-253 |
Barbour M T, Gerritsen J, Snyder B D et al, 1999. Rapid Bioassessment Protocols for Use in Streams and Wadeable Rivers:Periphyton, Benthic Macroinvertebrates and Fish. 2nd ed. Washington US: Environmental Protection Agency, Office of Water
|
Bracht-Flyr B, Fritz S C, 2012. Synchronous climatic change inferred from diatom records in four western Montana lakes in the U.S. Rocky Mountains. Quaternary Research, 77(3): 456-467 DOI:10.1016/j.yqres.2011.12.005 |
Bramburger A J, Hamilton P B, Hehanussa P E et al, 2008. Processes regulating the community composition and relative abundance of taxa in the diatom communities of the Malili Lakes, Sulawesi Island, Indonesia. Hydrobiologia, 615(1): 215-224 DOI:10.1007/s10750-008-9562-2 |
Castillejo P, Chamorro S, Paz L et al, 2018. Response of epilithic diatom communities to environmental gradients along an Ecuadorian Andean River. Comptes Rendus Biologies, 341(4): 256-263 DOI:10.1016/j.crvi.2018.03.008 |
Chu Q C, Wang Q Q, Qiao S B et al, 2017. Spatial-temporal characteristics of the "cumulative effect" of torrential rain over South China. Theoretical and Applied Climatology, 127(3-4): 911-921 DOI:10.1007/s00704-015-1669-6 |
Dalu T, Wasserman R J, Magoro M L et al, 2017. Variation partitioning of benthic diatom community matrices:Effects of multiple variables on benthic diatom communities in an Austral temperate river system. Science of the Total Environment, 601-602: 73-82 DOI:10.1016/j.scitotenv.2017.05.162 |
Diamantini E, Lutz S R, Mallucci S et al, 2018. Driver detection of water quality trends in three large European river basins. Science of the Total Environment, 612: 49-62 DOI:10.1016/j.scitotenv.2017.08.172 |
Dixit S S, Smol J P, Kingston J C et al, 1992. Diatoms:powerful indicators of environmental change. Environmental Science & Technology, 26(1): 22-33 |
Donar C M, Neely R K, Stoermer E F, 1996. Diatom succession in an urban reservoir system. Journal of Paleolimnology, 15(3): 237-243 DOI:10.1007/BF00213043 |
Dupont J P, Lafite R, Huault M F et al, 1994. Continental/marine ratio changes in suspended and settled matter across a macrotidal estuary (the Seine estuary, northwestern France). Marine Geology, 120(1-2): 27-40 DOI:10.1016/0025-3227(94)90075-2 |
Kingston J C, Lowe R L, Stoermer E F et al, 1983. Spatial and temporal distribution of benthic diatoms in Northern Lake Michigan. Ecology, 64(6): 1566-1580 DOI:10.2307/1937511 |
Lampitt R S, Wishner K F, Turley C M et al, 1993. Marine snow studies in the Northeast Atlantic Ocean:distribution, composition and role as a food source for migrating plankton. Marine Biology, 116(4): 689-702 DOI:10.1007/BF00355486 |
Lane C R, Reiss K C, DeCelles S et al, 2009. Benthic diatom composition in isolated forested wetlands subject to drying:Implications for monitoring and assessment. Ecological Indicators, 9(6): 1121-1128 DOI:10.1016/j.ecolind.2008.12.010 |
Lau S S S, Lane S N, 2002. Biological and chemical factors influencing shallow lake eutrophication:a long-term study. Science of the Total Environment, 288(3): 167-181 DOI:10.1016/S0048-9697(01)00957-3 |
Leynaert A, Longphuirt S N, An S et al, 2011. Tidal variability in benthic silicic acid fluxes and microphytobenthos uptake in intertidal sediment. Estuarine, Coastal and Shelf Science, 95(1): 59-66 DOI:10.1016/j.ecss.2011.08.005 |
Lim J H, Lee C W, 2017. Effects of eutrophication on diatom abundance, biovolume and diversity in tropical coastal waters. Environmental Monitoring and Assessment, 189(9): 432 DOI:10.1007/s10661-017-6147-4 |
Lindholm M, Grönroos M, Hjort J et al, 2018. Different species trait groups of stream diatoms show divergent responses to spatial and environmental factors in a subarctic drainage basin. Hydrobiologia, 816(1): 213-230 DOI:10.1007/s10750-018-3585-0 |
Liu J, Lin Z W, Zhang H J et al, 2012. Hydrodynamic change recorded by diatoms in sediments of Liuxihe Reservoir, southern China. Journal of Paleolimnology, 47(1): 17-27 DOI:10.1007/s10933-011-9543-8 |
Lu X T, Song S, Lu Y L et al, 2017. Response of the phytoplankton community to water quality in a local alpine glacial lake of Xinjiang Tianchi, China:potential drivers and management implications. Environmental Science:Processes & Impacts, 19(10): 1300-1311 |
Marra R C, Algarte V M, Ludwig T A V et al, 2018. Diatom diversity at multiple scales in urban reservoirs in Southern Brazil reveals the likely role of trophic state. Limnologica, 70: 49-57 DOI:10.1016/j.limno.2018.04.001 |
Mitrovic S M, Howden C G, Bowling L C et al, 2003. Unusual allometry between in situ growth of freshwater phytoplankton under static and fluctuating light environments:possible implications for dominance. Journal of Plankton Research, 25(5): 517-526 DOI:10.1093/plankt/25.5.517 |
Munawar M, Fitzpatrick M, 2011. The application of Vollenweider's eutrophication models for assessing ecosystem health:Hamilton Harbour (Lake Ontario) example. Aquatic Ecosystem Health & Management, 14(2): 204-208 |
Petranich E, Covelli S, Acquavita A et al, 2018. Evaluation of mercury biogeochemical cycling at the sediment-water interface in anthropogenically modified lagoon environments. Journal of Environmental Sciences, 68: 5-23 DOI:10.1016/j.jes.2017.11.014 |
Potapova M G, Charles D F, 2002. Benthic diatoms in USA rivers:Distributions along spatial and environmental gradients. Journal of Biogeography, 29(2): 167-187 DOI:10.1046/j.1365-2699.2002.00668.x |
Potapova M, Charles D F, 2003. Distribution of benthic diatoms in U.S. Rivers in relation to conductivity and ionic composition. Freshwater Biology, 48(8): 1311-1328 DOI:10.1046/j.1365-2427.2003.01080.x |
Raphael S, Matschullat J, Oeste F D, 2002. The diatoms:Applications for the environmental and earth sciences. Journal of Soils and Sediments, 2(2): 103-104 DOI:10.1007/BF02987879 |
Redfield A C, 1960. The biological control of chemical factors in the environment. Science Progress, 11: 150-170 |
Reid M A, Ogden R W, 2009. Factors affecting diatom distribution in floodplain lakes of the southeast Murray Basin, Australia and implications for palaeolimnological studies. Journal of Paleolimnology, 41(3): 453-470 DOI:10.1007/s10933-008-9236-0 |
Richardson J, Feuchtmayr H, Miller C et al, 2019. Response of cyanobacteria and phytoplankton abundance to warming, extreme rainfall events and nutrient enrichment. Global Change Biology, 25(10): 3365-3380 DOI:10.1111/gcb.14701 |
Schmidt C, Heinz P, Kucera M et al, 2011. Temperature-induced stress leads to bleaching in larger benthic foraminifera hosting endosymbiotic diatoms. Limnology and Oceanography, 56(5): 1587-1602 DOI:10.4319/lo.2011.56.5.1587 |
Sienkiewicz E, Gąsiorowski M, Migała K, 2017. Unusual reaction of diatom assemblage on climate changes during the last millennium:a record from Spitsbergen Lake. Journal of Paleolimnology, 58(1): 73-87 DOI:10.1007/s10933-017-9962-2 |
Sinokrot B A, Gulliver J S, 2000. In-stream flow impact on river water temperatures. Journal of Hydraulic Research, 38(5): 339-349 DOI:10.1080/00221680009498315 |
Smith D J, Underwood G J C, 2000. The production of extracellular carbohydrates by estuarine benthic diatoms:The effects of growth phase and light and dark treatment. Journal of Phycology, 36(2): 321-333 |
Spellerberg I F, Fedor P J, 2003. A tribute to Claude Shannon (1916-2001) and a plea for more rigorous use of species richness, species diversity and the 'Shannon-Wiener' Index. Global Ecology and Biogeography, 12(3): 177-179 DOI:10.1046/j.1466-822X.2003.00015.x |
Sun X M, Wu N C, Faber C et al, 2017. Hydrological variables play a remarkable role in temporal dynamics of daily sampled diatom community in a German lowland river. In: Proceedings of the 19th EGU General Assembly. Vienna: European Geosciences Union, 46-66
|
Tapolczai K, Bouchez A, Stenger-Kovács C et al, 2017. Taxonomy- or trait-based ecological assessment for tropical rivers? Case study on benthic diatoms in Mayotte Island (France, Indian Ocean). Science of the Total Environment, 607-608: 1293-1303 DOI:10.1016/j.scitotenv.2017.07.093 |
Tas S, Yilmaz I N, Okus E, 2009. Phytoplankton as an indicator of improving water quality in the golden horn estuary. Estuaries and Coasts, 32(6): 1205-1224 DOI:10.1007/s12237-009-9207-3 |
Tolotti R, Consani S, Carbone C et al, 2019. Benthic diatom community response to metal contamination from an abandoned Cu mine:Case study of the Gromolo Torrent (Italy). Journal of Environmental Sciences, 75: 233-246 DOI:10.1016/j.jes.2018.03.034 |
van Dam H, Mertens A, Sinkeldam J, 1994. A coded checklist and ecological indicator values of freshwater diatoms from The Netherlands. Netherland Journal of Aquatic Ecology, 28(1): 117-133 DOI:10.1007/BF02334251 |
Van Luijn F, Van der Molen D T, Luttmer W J et al, 1995. Influence of benthic diatoms on the nutrient release from sediments of shallow lakes recovering from eutrophication. Water Science and Technology, 32(4): 89-97 DOI:10.2166/wst.1995.0169 |
Woelfel J, Schumann R, Adler S et al, 2007. Diatoms inhabiting a wind flat of the Baltic Sea:Species diversity and seasonal succession. Estuarine, Coastal and Shelf Science, 75(3): 296-307 DOI:10.1016/j.ecss.2007.04.033 |
 2021, Vol. 52
2021, Vol. 52


