
中国海洋湖沼学会主办。
文章信息
- 王再明, 王健鑫, 苑文凤, 李鹏. 2021.
- WANG Zai-Ming, WANG Jian-Xin, YUAN Wen-Feng, LI Peng. 2021.
- 兼性厌氧海洋细菌Shewanella sp.N3B_R的分离鉴定及产电性能分析研究
- ISOLATION AND IDENTIFICATION OF FACULTATIVE ANAEROBIC MARINE BACTERIUM SHEWANELLA SP. N3B_R AND ANALYSIS OF ITS ELECTRICAL PERFORMANCE IN A TWO-COMPARTMENT MICROBIAL FUEL CELL
- 海洋与湖沼, 52(1): 175-185
- Oceanologia et Limnologia Sinica, 52(1): 175-185.
- http://dx.doi.org/10.11693/hyhz20200500143
文章历史
-
收稿日期:2020-05-21
收修改稿日期:2020-06-28
产电菌是能将电子传递给最终电子受体, 并产生电流的一类微生物。这类微生物具备电化学活性, 因此常被用来作为微生物燃料电池(MFCs)的阳极菌进行研究(Logan, 2009)。大多数产电微生物是厌氧或兼性厌氧细菌, 由于某些厌氧菌株具有致病性, 兼性厌氧细菌更适合在MFC中应用。常见的产电微生物主要有希瓦氏属Shewanella (Ringeisen et al, 2006)、地杆菌属Geobacter (Bond et al, 2003)、红育菌属Rhodoferax (Chaudhuri et al, 2003)、芽孢杆菌属Bacillus (Nimje et al, 2009); 绿弯菌门属Chloroflexi、根瘤菌属Rhizobium、甲烷杆菌属Methanobacterium等也有报道(Rezaei et al, 2007; Rismani-Yazdi et al, 2007; Ishii et al, 2008)。Takeuchi等(2017)利用Cellulomonas spp.作为产电菌, 以纤维素作为营养基质应用于MFC。Dai等(2017)利用厚壁菌门菌作为阳极产电菌, 研究发现其MFC开路电位约为650 mV, 最大功率密度为437 mW/m2。Nor等(2015)从好氧棕榈油厂废水中分离出铜绿假单胞菌株(Pseudomonas aeruginosa)ZH1, 结果显示其最大功率密度为85.11 mW/m2, 电流密度为91.12 mA/m2。阳极液和阳极材料的选择也影响产电细菌的性能。Zhang等(2017a)研究发现, 在阳极液中添加富马酸盐后, 阳极电极表面细菌增多, 功率密度是不添加富马酸盐的2.41倍。Chen等(2015)通过共聚焦扫描激光显微镜和循环伏安实验证明石墨烯修饰的阳极对希瓦氏菌MR生物膜的生长具有明显的抗菌作用。
海水养殖逐渐规模化, 高度密集化, 在带来经济收益的同时, 对海洋环境的影响也随之增加, 如近海海水的氨氮含量增加、重金属含量增加, 甚至产生海水酸化现象(刘晓辉等, 2017)。MFCs是一种很有前途的从废水或污染物中获取能量的技术(Watanabe, 2008), 它能将化学能转化为电能(Samsudeen et al, 2016)。双室MFC采用中间的阳离子交换膜Nafion(美国杜邦公司)将阳极和阴极进行分隔(Esfandyari et al, 2017; Zhang et al, 2017b)。产电菌附着在阳极表面, 而阳极材料往往是影响产电菌生长和产电性能的重要因素。碳布因其良好的导电性而被用作MFCs的阳极材料, 但其较差的生物相容性限制了其应用。通过选择合适的改性碳布阳极材料, 能够有效提高MFCs的性能(Quan et al, 2015; Huang et al, 2016; Zhang et al, 2017c)。聚苯胺(PANI)具有良好的导电性、生物相容性和环境稳定性(Hou et al, 2013; Cao et al, 2017), 可以改善细菌附着, 增强细胞外电子转移(Mashkour et al, 2016), 用聚苯胺等材料改性的碳布阳极可以增大产电菌接触面表面积, 提高输出电压(Zhang et al, 2014)。
近年来, 不断有各种导电性能良好的新材料被应用于阳极的改性。Hidalgo等(2016)用四个月时间来测试三种不同的阳极材料的MFC电池性能, 结果表明, 阳极电极改性碳涂层鞍形填料提供优秀的高导电性。Liu等(2017)研究表明, 具有良好电化学活性的PANI纳米可以降低电荷转移电阻。然而, 由于材料成本高, 大规模的应用在MFCs仍是有限的。
本研究分离鉴定了1株来源于海水养殖场的海洋产电菌, 经过鉴定为希瓦氏菌。初步的发电实验表明, 希瓦氏菌N3B_R的输出电压是其他菌的2-3倍。Shewanella sp. N3B_R是一种从海水养殖池塘中分离到的兼性厌氧海洋细菌, 具有独特的优势和研究前景。利用响应面法(RSM)来提高阳极室在MFC运行过程中的功率密度。很少有研究报道使用RSM的BBD来改善MFC的性能。此研究为处理海水污染和人工养殖废水提供了新的途径, 期望实现资源的循环利用。
1 材料与方法 1.1 菌株的分离该菌株是从舟山海水养殖池塘的废水和污泥中分离得到。样本富集培养基在厌氧环境中。富集培养基配方如下(每升海水):蛋白胨(8.0 g/L), 酵母提取物(1.0 g/L), 醋酸钠(16.0 g/L), 氯化钠(5.0 g/L), 氯化钙(0.1 g/L), 氯化镁(0.1 g/L), 磷酸钾(1.2 g/L), 半胱氨酸(1.0 g/L), 柠檬酸铁(4.8 g/L)。培养基初始pH值调整为7.0±0.2, 高压蒸汽灭菌20 min。1 mL已处理污泥和废水养接种于适量富集培养基厌氧管中, 30℃培养3周, 直到培养基颜色从棕色改变到黑色, 富集培养后, 用平板法分离得到分离菌株。
1.2 菌株的鉴定利用试剂盒提取染色体DNA后, 使用通用16S rDNA引物扩增分离株的16S rDNA基因, 并在PCR扩增仪(TaKaRa Thermal Cycler Dice TP600, TaKaRa Biomedical Technology (Beijing) Co., Ltd.)进行PCR扩增。PCR混合物包含25 μL PCR预混料、0.5 μL底物和反向引物(20 pmoL/μL)和23个μL 16s-free H2O。使用DNA片段PCR试剂盒进行提纯(TaKaRa, 大连, 中国)。菌株N3B_R的586 bp 16S rRNA基因序列由大连TaKaRa生物技术有限公司鉴定。利用BLAST程序将获得的基因序列与GenBank中的序列进行比对。采用MEGA 7.0的邻接方法构建系统发育树(Kimura, 1980; Felsenstein, 1985; Tamura et al, 2007)。采用API 20NE进行标准生化分析。用扫描电镜(SEM, ZEISS, EVO MA10)观察了阳极电极表面的菌株形态。
1.3 阳极电极的修饰在修饰之前, 碳布(W0S1002, 中国台湾)电极(碳布块大小0.9 cm×1.4 cm)浸泡在丙酮试剂中10 h去除杂质和油脂, 后用去离子水冲洗, 并在65℃干燥10 h。将3个碳布电极分别浸泡在0.05 mol/L、0.15 mol/L、0.2 mol/L的苯胺单体(阿拉丁, 上海)溶液中(用1.0 mol/L盐酸调节pH至1.0), 以铂电极作为对电极, 饱和甘汞电极作为参比电极。利用循环伏安法电沉积聚苯胺, 采用电化学工作站(Bio-Logic, sp-300, 法国), 扫描频率为-0.1-1.0 V, 频率为20 mV/s(30), 循环指数为10。沉积后的电极用去离子水洗涤, 在65℃下干燥10 h。并以未修饰的碳布电极作为对照。四组不同阳极电极的燃料电池反应器分别记为R0(未修饰)、R1(0.05 mol/L)、R2(0.2 mol/L)、R3(0.15 mol/L)。
1.4 MFC的组装MFC由阳极室和阴极室(每个室100 mL)组成, 阳极室和阴极室之间用质子交换膜Nafion117隔开(有效面积约为12.56 cm2)。阳极和阴极电极由铜导线连接并外接电阻为1000 Ω, 输出电压的数据采集由与计算机相连的数据采集系统(上海U00249)完成。阳极和阴极室分别填充了60 mL的LB肉汤培养基(pH调节至7.0±0.2)和50 mm的铁氰化钾。海洋产电细菌在30℃ LB培养基中培养, 于振荡培养箱中培养至光密度1.5 (OD600)。在MFCs开始工作之前, 将0.1 mL菌悬液接种到阳极液中, 运行MFC以获得稳定的电位生成, 获得稳定电位后, 测量极化、功率密度。阴极电极均为未修饰的碳布。
1.5 双室燃料电池电化学性能测试阳极和阴极室分别填充了60 mL的LB肉汤培养基和50 mm的铁氰化钾。将阳极溶液pH调节至7.0±0.2。海洋产电细菌在30℃ LB培养基中, 在振荡培养箱中培养至光密度1.5 (OD600)。在MFCs开始工作之前, 将0.1 mL菌悬液接种到阳极液中。运行MFC以获得稳定的电位生成。获得稳定电位后测量极化、功率密度。
电压变化记录每30 min使用数据采集系统在外接电阻1000 Ω下进行记录采集。极化曲线利用外接电阻变化法测试, 外部电阻从10 kΩ-100 Ω通过测量稳定电压生成, 其中每个电阻测30 min。电流密度和功率密度是电流和功率除以阳极面积, 电流密度I(A/m2) = V/P(RA)和功率密度(W/m2) = V2/(RA), 其中R是外部阻力(Ω), V是测量电压(mV), A是阳极电极的面积(m2)。
为了测定阳极菌的电化学活性, 在电化学工作站(Bio-Logic, SP-300, 法国)进行了循环伏安(CV)分析。分别以四个MFC中的阳极电极作为工作电极, 以银电极(Ag/AgCl)作为参比电极, 铂电极为对电极。CV实验在接种阳极菌的液体培养基中以100 mV/s的扫描速率进行, 扫描范围为-1 V到1 V。
采用传统三电极系统分析MFC系统的电化学阻抗谱(EIS), 阳极与工作电极连接, 参比电极与铂对电极分别与参比电极、对电极连接。EIS测试是在扫描频率为1.0-100 kHz, 0.005 V的情况下使用恒电位器进行的。
1.6 响应面分析响应面法(Response surface method, RSM)是一种减少研究工作量的统计方法。本研究采用RSM的Box-Behnken Design (Design-expert 8.05 USA)设计确定了阳极室阳极菌输出电流功率密度的最佳条件, 以提高MFCs系统的输出功率。
2 结果与分析 2.1 菌株的鉴定对PCR扩增产物进行16S rDNA序列分析(586 bp), 鉴定菌株由上海美吉生物制药科技有限公司进行。该菌株已在CGMCC (CGMCC1.16968)中保藏。分离菌株的生化特征为革兰氏阴性, 具有杆状结构。API (API 20NE)的结果如表 1所示。表 1中, NO3表示硝酸盐反应, TRP表示色氨酸反应, GLU表示葡萄糖产酸, ADH表示乙醇脱氢酶反应, URE表示尿素反应, GEL表示凝胶酶反应, MAN表示甘露醇产酸试验, ESC表示七叶灵反应, PNG表示对硝基半乳糖反应, ARA表示阿拉伯糖反应, MNE表示甘露糖反应, NAG表示N-乙酰-葡萄糖胺反应, MAL表示麦芽糖反应, GNT表示葡萄糖酸盐反应, CAP表示葵酸反应, ADI表示乙二酸反应, MLT表示苹果酸反应, CIT表示柠檬酸反应, PAC表示苯乙酸反应, OX表示细胞色素氧化酶反应。
| 项目 | 结果 |
| NO3 | + |
| TRP | _ |
| GLU | _ |
| ADH | _ |
| URE | ± |
| ESC | + |
| GEL | _ |
| PNG | _ |
| GLU | _ |
| ARA | _ |
| MNE | _ |
| MAN | _ |
| NAG | + |
| MAL | _ |
| GNT | _ |
| CAP | + |
| ADI | _ |
| MLT | + |
| CIT | + |
| PAC | _ |
| OX | + |
| 注:下划横线表示该反应需要液体石蜡封口 | |
由表 1可知, 该菌株对可利用D-葡萄糖、D-果糖、D-甘露糖、D-核糖、D-半乳糖、L-阿拉伯糖、乳糖、蔗糖、麦芽糖、海藻糖、蜜二糖melibiose、纤维二糖cellobiose、棉子糖、甘露醇、esculin、水杨酸、苦杏仁苷(单一碳源试验)。API鉴定结果显示, 该菌属于Shewanella属的可信度达到了97%。
该基因序列已上传至NCBI的GenBank, 获取的登录号为MK053884。利用Clustalx1.83软件进行序列比对, 将比对后结果利用MEGA 7.0的邻接方法, 基于16S rRNA序列构建了系统发育树, 如图 1所示。系统进化树结果显示, 该菌株在进化地位上与Shewanella algae hiro1、Shewanella algae PSB-05和Shewanella sp. EM0501密切相关, 与该两株菌的相似性达到99%以上, 鉴定结果该菌株为Shewanella属, 命名为Shewanella sp. N3B_R。
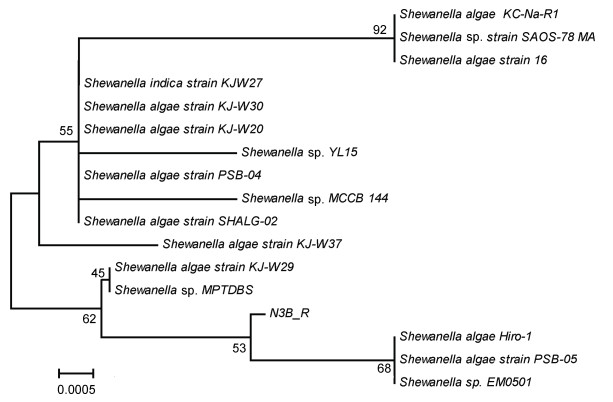 |
| 图 1 菌株N3B_R的系统发育树 Fig. 1 Phylogenetic tree based on the 16S rDNA sequencing |
利用戊二醛对产电菌吸附的阳极电极进行固定, 送上海皓扬生物有限公司进行扫描电镜(SEM)扫描, 图 2表征了聚苯胺修饰电极海洋产电菌吸附形态和未修饰电极表面的形貌。从图中可以清晰看到经过聚苯胺修饰电极的阳极表面, 吸附较多的希瓦氏Shewanella sp. N3B_R, 该菌呈现明显的杆状、短杆状形态, 还可观察到形成的生物膜, 以及丝状物质、颗粒状物, 该物质很可能是聚苯胺与菌株代谢物结合产生, 起到一定的固定细胞、增加吸附力以及产电输出的作用。未经修饰的碳布表面则无物质吸附, 呈条状结果, 符合碳布的结构组分特点。
 |
| 图 2 未修饰电极表面和聚苯胺修饰电极表面电镜扫描图 Fig. 2 SEM images of carbon cloth, showing the surface of the polyaniline-modified electrode and unmodified electrode 注: a.空白碳布电极(未接种产电菌N3B_R的阳极碳布电极); b.接种产电菌N3B_R后, 输出电压稳定后的阳极碳布电极 |
将电沉积后的阳极电极分别组装与MFC中, 接种产电菌, 20 h后进行电压数据收集, 结果显示用0.15 mol/L苯胺修饰的碳布电极具有最大的电压输出, 最大电压为140 mV, 为其他三组电极的2-6倍。
为了测试阳极产电菌的最大输出功率, 当MFC时达到稳定状态时, 功率密度测量的通过改变外接电阻(10 kΩ-100 Ω)进行, 如图 3所示, 当达到稳定时, 最大的输出功率密度为反应器R3, 达到517.5 mW/m2, 该结果与电压输出结果吻合较好, 这有力地说明导电聚苯胺在本研究中使MFC输出具有优越的性能。根据公式计算, 测得R3反应器的内电阻为34.5 Ω。
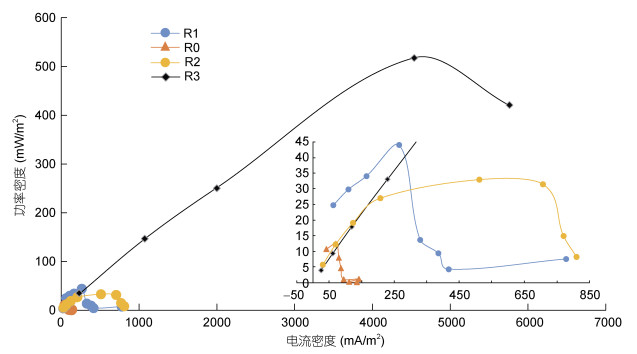 |
| 图 3 四组MFC的功率密度曲线 Fig. 3 The power density curve of microbial fuel cell (MFC) |
为了探讨四种不同电极的电子转移性能, 采用循环伏安法分别对四个电极进行CV测试, 来观察不同阳极电极上的氧化还原反应。四种不同阳极电极的MFCs的CV曲线如图 4所示。0.15 mol/L聚苯胺修饰电极的MFC具有更显著的氧化还原峰, 其氧化峰为(0.58 mA/0.35 V)。与其他三种表现出亚峰(尤其是未修饰电极)的MFC相比, R3电极表现出明显的氧化还原峰, 且明显CV曲线包含的面积更大, 说明R3电极作为一个电容器具有很好的应用价值。对照未经修饰的碳布电极, 几乎观察不到明显的氧化还原峰, 说明碳布电极上的电子转移较少, 在电极两端施加电压后, 电极表面无明显的氧化还原现象。图像表明0.15 mol/L浓度的聚苯胺很大程度地影响了MFC中电流产生的性能。
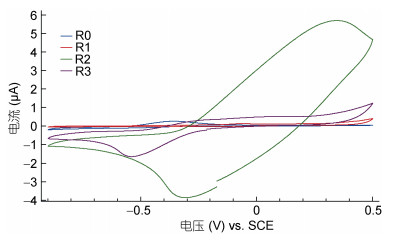 |
| 图 4 四种阳极电极的CV曲线图 Fig. 4 The cyclic voltammetry of four anode electrodes 注: SCE指饱和甘汞电极 |
电化学阻抗谱EIS, 也称交流阻抗法, 是指给电化学系统施加一个频率不同的小振幅的交流电势波, 测量交流电势与电流信号的比值(此比值即为系统的阻抗)随正弦波频率ω的变化利用, 主要用于研究研究电极材料的扩散、内阻、电容、腐蚀等。本项目也通过测试阻抗谱, 研究了不同电极的MFC系统在电化学反应中的内阻。
图 5为不同阳极MFC的Nyquist图。0.15 mol/L浓度聚苯胺修饰电极MFC高频区域的半圆直径是四个MFC中最小的, 这表面该电极的内阻越小。
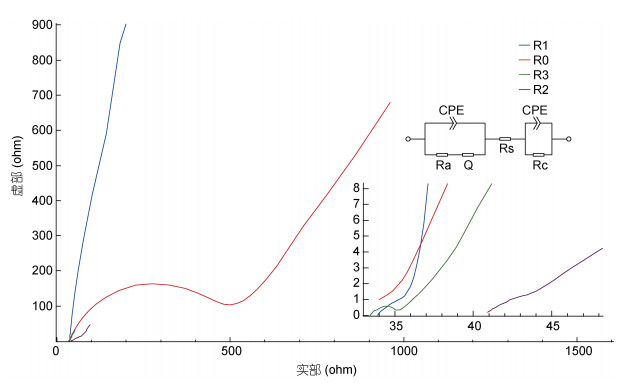 |
| 图 5 四种不同阳极电池的阻抗图 Fig. 5 The EIS (electrochemical impedance spectroscopy) of the four MFCs using a Bio-Logic SP-300 |
低频区倾斜的直线代表的是扩散阻抗, 理论上斜率应该为1(也就是倾角为45°)。若倾角小于45°, 说明存在一定的弥散效应; 若倾角大于45°, 则说明存在一定的电容行为。
实验结果显示, 四个电极在低频区域的趋势线基本相同, 其中R0的斜率最大, 说明其扩散阻抗最小, 也一定程度证明, 碳布材料作为电容的可行性。R3反应器的电荷转移电阻比其他阳极的电荷转移电阻小。通过电极修饰可以明显改变高频区半圆直径, 减少电极材料的内阻, 提高电荷转移效率, 从而提升产电性能。利用0.15 mol/L聚苯胺改性碳布阳极的内阻最低, 而其他三种MFC的内阻较高。
2.3 响应面设计(BBD)为了优化阳极室条件对产电菌输出功率的影响, 参考温度、苯胺单体浓度、和氯化钠浓度三个因素, 使用Box-Behnken设计的响应面方法对其进行最优化设计。设计如表 2所示。输出功率密度的响应值选输出电压保持稳定在10 d后。
| 实验 | 因素1 A:温度(℃) | 因素2 B:苯胺(mol/L) | 因素3 C: NaCl(g/L) | 响应值功率密度(mW/m2) |
| 1 | 45.00 | 0.225 | 5.00 | 389.00 |
| 2 | 25.00 | 0.150 | 9.00 | 433.00 |
| 3 | 35.00 | 0.075 | 1.00 | 510.00 |
| 4 | 35.00 | 0.225 | 1.00 | 508.00 |
| 5 | 25.00 | 0.150 | 1.00 | 505.00 |
| 6 | 45.00 | 0.100 | 5.00 | 375.00 |
| 7 | 25.00 | 0.225 | 5.00 | 510.60 |
| 8 | 35.00 | 0.150 | 5.00 | 518.20 |
| 9 | 35.00 | 0.150 | 5.00 | 520.70 |
| 10 | 35.00 | 0.150 | 5.00 | 519.80 |
| 11 | 35.00 | 0.100 | 9.00 | 428.00 |
| 12 | 35.00 | 0.150 | 5.00 | 522.10 |
| 13 | 35.00 | 0.225 | 9.00 | 450.00 |
| 14 | 35.00 | 0.150 | 5.00 | 520.90 |
| 15 | 45.00 | 0.150 | 9.00 | 301.00 |
| 16 | 25.00 | 0.100 | 5.00 | 510.00 |
| 17 | 45.00 | 0.200 | 1.00 | 385.00 |
多项式表达式得到如下: Y = 520.34-63.57A+ 4.33B-37.00C+3.35AB-3.00AC+6.00BC-71.10A2-3.1B2-43.24C2
其中, A、B、C分别表示温度、苯胺浓度、NaCl浓度。利用公式的功率密度预测水平与实验数据如表 2所示。
方差分析结果(ANOVA)见表 3。实验重复三次。P值表示各参数的相互作用强度。P值的模型 < 0.0001, 说明该模型意义重大, 适合当前的实验。“Prob > F”的值小于0.0500表明模型项是显著的。在这种情况下, A、B、C(线性模型项)、AB、BC(交互模型项)和A2、B2、C2(二次模型项)是重要的模型项。大于0.1000的值表示模型项不显著。6.07的“缺拟合f值”意味着相对于纯误差缺拟合不显著, 二阶模型适用。
| 来源 | 平方和 | df | 均方和 | F值 | P值(prob > F) | |
| 模型 | 74642.55 | 9 | 8293.62 | 1243.10 | < 0.0001 | 显著 |
| A-温度 | 32334.24 | 1 | 32334.24 | 4846.47 | < 0.0001 | |
| B-苯胺 | 149.64 | 1 | 149.64 | 22.43 | 0.0021 | |
| C-NaCl | 10952.00 | 1 | 10952.00 | 1641.56 | < 0.0001 | |
| AB | 44.89 | 1 | 44.89 | 6.73 | 0.0357 | |
| AC | 36.00 | 1 | 36.00 | 5.40 | 0.0532 | |
| BC | 144.00 | 1 | 144.00 | 21.58 | 0.0024 | |
| A2 | 21282.10 | 1 | 21282.10 | 3189.90 | < 0.0001 | |
| B2 | 40.33 | 1 | 40.33 | 6.05 | 0.0435 | |
| C2 | 7874.23 | 1 | 7874.23 | 1180.24 | < 0.0001 | |
| 残差 | 46.70 | 7 | 6.67 | |||
| 失拟项 | 38.29 | 3 | 12.76 | 6.07 | 0.0570 | 不显著 |
| 纯误差 | 8.41 | 4 | 2.10 | |||
| 总离差 | 74689.25 | 16 |
预测R2为0.9916, 调整R2为0.9986, 表明两者之间是合理一致的。Adeq精度测量的是信噪比, 110.000表示信号充足。低的C.V.值0.56%表明了实验的高可靠性, 参见表 4。
| 标准差 | 平均值 | 变异系数C.V.(%) | 压力 |
| 2.58 | 465.80 | 0.56 | 625.78 |
| R2 | 调整R2 | 预测R2 | Adeq精度 |
| 0.9994 | 0.9986 | 0.9916 | 110.0000 |
图 6显示了模型的良好拟合性以及实际值与预测值之间的一致相关性。由图 6可知, 预测值与真实值基本都位于一条直线上, 从此图也进一步验证了模型的可信度。
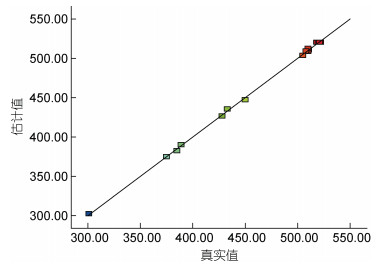 |
| 图 6 真实值与估计值的误差分析 Fig. 6 Plot of the predicted vs. the actual obtained by the Box-Behnken design |
3D模型图如图 7、图 8、图 9所示。其中图 7显示苯胺浓度和温度交互作用的影响。当保持盐度不变时, 随着温度增加, 输出功率先逐渐上升, 后降低, 且超过40℃后下降速度明显增加。
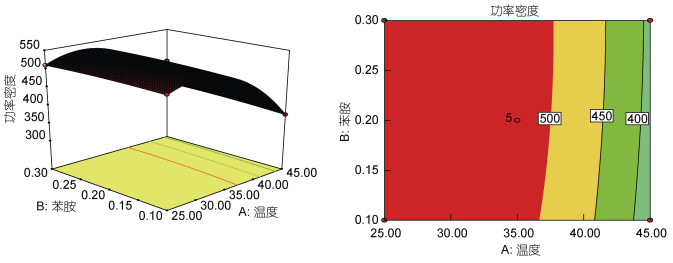 |
| 图 7 苯胺浓度与温度之间的功率密度的三维响应面和二维等值线图 Fig. 7 The 3D-response surface and 2D-contour plots of power density (mW/m2) between aniline and temperature |
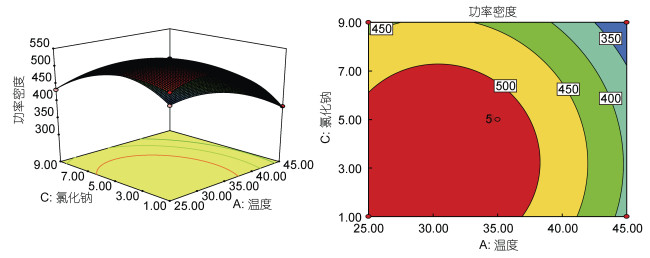 |
| 图 8 氯化钠浓度与温度之间的功率密度的三维响应面和二维等值线图 Fig. 8 The 3D-response surface and 2D-contour plots of power density (mW/m2) between NaCl and temperature |
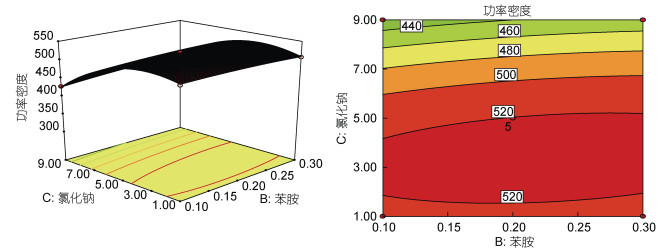 |
| 图 9 氯化钠浓度与苯胺浓度之间的功率密度的三维响应面和二维等值线图 Fig. 9 The 3D response surface and 2D-contour plots of power density (mW/m2) between aniline and NaCl |
图 8表示NaCl浓度和温度的交互作用, 当保持苯胺浓度为0.15 mol/L不变时, 随着NaCl浓度增加, 温度升高, 输出功率密度升高后逐渐下降。
图 9表示NaCl浓度和苯胺浓度的交互作用, 当保持温度为35℃不变。随着NaCl和苯胺浓度的增加, 产率继续增加, 后降低。
3 讨论 3.1 海洋产电菌多样性分析从舟山海域海水养殖场中分离筛选到一株海洋兼性厌氧细菌, 利用16S rRNA基因序列和API 20NE生化分析进行鉴定, 采用扫描电镜进行菌株形态的观察, 鉴定结果为Shewanella sp. N3B_R, 研究表明该菌株表现出较好的产电活性, 输出的最大功率密度达到517.5 mW/m2。电镜扫描显示该菌株在碳布表面具有较好的吸附性, 电极材料对其生长未表现出明显的抑制作用。目前, 对海洋产电菌产电性能研究的相关报道较少, 希瓦氏菌是典型的海洋产电细菌, 有部分来源深海及热泉附近(Wei et al, 2007)。王彪等(2010)从厦门白城海域的潮间带表面沉积物中筛选到一株海洋产电菌Shewanella sp. S2, 输出电压最高为150 mV, 相应的电流密度为66.1 mA/m2。邹聪慧等(2011)发现海洋产电菌Shewanella marisflavi EP1在高盐度下具有优良的降解脱色特性, 这为海洋产电菌在处理染料废水方面的研究提供了支持。海洋来源的产电菌具有耐高压、耐盐、耐渗透压等特点, 具有与陆生微生物不同的代谢途径, 这为海洋细菌的应用提供了更广的前景。
目前对污水的处理方法常见的有物理、化学以及生物法, 物理和化学方法很容易造成对环境的二次污染, 造成水体中有害物质含量升高, 且成本较高。生物法(如活性污泥等方法)尽管不易造成二次污染, 但是处理的效率往往不高, 且后期对活性污泥的回收利用、处理堆放也是一个难题。尽管目前已可以利用处理过污水的活性污泥进行堆肥发酵后, 应用于种植, 但其中的部分有害物质去除较为困难, 易造成土壤的污染。
在本研究中, 我们使用海洋兼性厌氧菌Shewanella sp. N3B_R通过双室MFC系统来研究其产电性能。检测不同浓度聚苯胺修饰碳布电极后对MFC反应系统的影响。研究表明海洋阳极产电菌及阳极电池的特性对MFC的性能有重要影响。功率密度曲线显示, 0.15 mol/L浓度聚苯胺改性碳布阳极MFC的发电量明显最高(517.5 mW/m2)。通过循环伏安法和电化学阻抗谱分析表明, 与未修饰聚苯胺的阳极相比, 改善了MFC的性能。
3.2 响应面设计的应用响应面分析法是一种常见的优化条件的方法(Myers, 2003), 软件选择Design-Expert。当影响结果的因素较多时, 往往先采用Plackett-Burman法, 对各单因素进行考察, 获得影响因素最大的几个单因素, 按照中心组合设计原理进行响应面的分析, 常见的响应面分析方法有CCD (central composite design)、BBD (Box-Behnken design)及HDD (historical data design)等, 上述方法可以精确地表述因素和响应值之间的关系, 在确定实验因素及其交互作用对指标响应值的影响时, 几种方法各有特点。BBD是体现各个因素和响应值之间非线性关系的一种试验方法, 相对于CCD来说, 该方法重复试验减少, 操作简便且更经济, 尤其适合影响因素较少(本实验研究的影响因素为3个)的优化设计。响应面BBD系统设计对开发低成本和合适的MFC应用程序非常有用。本项目研究的响应面分析结果显示, 当最佳温度分别为35℃、5 g/L、0.15 mol/L NaCl和苯胺浓度时, 得到的功率密度最高值为522.1 mW/m2。
3.3 海洋微生物在MFC中应用的展望微生物燃料电池技术可以从废水或污染物中获取能量, 阳极产电菌可以将废水或污染物中的化学能转变成电能, 并通过MFC装置进行输出, 达到处理废水循环利用, 产生清洁能源的目的。目前的海水养殖都是将养殖废水直接排入海水, 造成海洋环境的污染, 利用海水来源的阳极产电菌, 可以将养殖废水中存在的高浓度氮磷等有害物质, 通过MFC技术转变为电能, 实现污水的循环利用。
海洋环境的特殊性造就了海洋来源的微生物具有独特的代谢系统, 目前对于海洋微生物在MFC中的应用研究多集中于阳极产电菌。而阳极产电菌厌氧和兼性厌氧的特点使得菌株的筛选培养较为困难, 尤其大部分的厌氧菌都为致病菌, 使得实验室的进一步应用受到限制。
微生物燃料电池中对于微生物的研究基本集中在阳极产电菌的产电性能上, 近年来的研究也未发现新的具有高产电能力的产电菌菌株, 而产电菌的产电性能受阳极电极和MFC系统的影响较大, 因此, 很多学者逐渐转向对电极材料、阴极电解液等方面的研究, 而电极的性能受限于成本, 使得MFC的大规模应用受到了很大的限制。
微生物燃料电池的生物阴极研究已经成为热点, 生物阴极室利用微生物催化阴极反应, 与传统的阴极电极相比, 具有以下优点: (1)微生物直接作为催化剂参与电子传递, 无需添加其他阴极催化剂, 节省大量成本, 简化MFC构造。(2)微生物补充方便, 使MFC的运行更为稳定(Rabaey et al, 2005)。(3)生物阴极进行的反应, 如反硝化细菌, 可以应用于污水处理, 达到除氮的目的, 盛建海等(2018)从凡纳滨对虾(Litopenaeus vannamei)养殖水体的生物絮团中分离到一株具产絮能力的脱氮菌xt1, 鉴定为短小芽孢杆菌(Bacillus pumilus), 对氨氮、硝态氮去除率分别达69.95%和49.50%。Hasvold等(1997)发现细菌在阴极上沉积并催化氧还原; Bergel等(2005)报告了生物膜的存在, 使MFCs的阴极表面电流密度大幅提高。研究表明海洋藻类作为生物阴极, 经过连续光照21 h, 开路电压为0.96 V, 短路电流密度为75 μA/cm2, 而这些电能的输出仅占藻类细胞吸收辐射能的0.1%-0.2%, 如何提高海洋藻类将光能转化为电能的效率也是今后的研究方向。
4 结论本研究从舟山海域养殖池中采用养殖污泥与废水, 利用富集后厌氧培养, 经分离纯化后获得一株高产电的海洋产电菌希瓦氏菌Shewanella sp. N3B_R, 该菌株表现出良好的阳极产电活性。电镜扫描结果显示该菌在碳布表面呈现良好的吸附现象。通过阳极电极材料修饰, 再研究该菌株的产电性能, 结果显示, 0.15 mol/L苯胺修饰的阳极电极, 在MFC体系中展现更好的产电性能, CV以及EIS结果显示, 接种Shewanella sp. N3B_R的MFC体系具有更小的内阻以及更高的功率密度。利用BBD优化产电性能, 结果显示BBD响应面设计适用于MFC的因素优化。
王彪, 黄杰勋, 章晓波, 等. 2010. 一株海洋产电菌Shewanella sp. S2的筛选和产电分析.微生物学通报, 37(3): 342-348 |
刘晓辉, 孙丹青, 黄备, 等. 2017. 东海沿岸海域表层海水酸化趋势及影响因素研究. 海洋与湖沼, 48(2): 398-405 |
邹聪慧, 徐方成, 陈新华. 2011. 海洋产电菌Shewanella marisflavi EP1的脱色特性. 微生物学通报, 38(1): 2-7 |
盛建海, 韩涛, 王骥腾, 等. 2018. 源自生物絮团产絮凝剂的异养硝化-好氧反硝化菌xt1的鉴定及其脱氮特性. 海洋与湖沼, 49(2): 375-383 |
Bergel A, Féron D, Mollica A, 2005. Catalysis of oxygen reduction in PEM fuel cell by seawater biofilm. Electrochemistry Communications, 7(9): 900-904 DOI:10.1016/j.elecom.2005.06.006 |
Bond D R, Lovley D R, 2003. Electricity production by Geobacter sulfurreducens attached to electrodes. Applied and Environmental Microbiology, 69(3): 1548-1555 DOI:10.1128/AEM.69.3.1548-1555.2003 |
Cao C, Wei L L, Wang G et al, 2017. In-situ growing NiCO2O4 nanoplatelets on carbon cloth as binder-free catalyst air-cathode for high-performance microbial fuel cells. Electrochimica Acta, 231: 609-616 DOI:10.1016/j.electacta.2017.02.117 |
Chaudhuri S K, Lovley D R, 2003. Electricity generation by direct oxidation of glucose in mediatorless microbial fuel cells. Nature Biotechnology, 21(10): 1229-1232 DOI:10.1038/nbt867 |
Chen J, Deng F, Hu Y Y et al, 2015. Antibacterial activity of graphene-modified anode on Shewanella oneidensis MR-1 biofilm in microbial fuel cell. Journal of Power Sources, 290: 80-86 DOI:10.1016/j.jpowsour.2015.03.033 |
Dai K, Wen J L, Zhang F et al, 2017. Electricity production and microbial characterization of thermophilic microbial fuel cells. Bioresource Technology, 243: 512-519 DOI:10.1016/j.biortech.2017.06.167 |
Esfandyari M, Fanaei M A, Gheshlaghi R et al, 2017. Dynamic modeling of a continuous two-chamber microbial fuel cell with pure culture of Shewanella. International Journal of Hydrogen Energy, 42(33): 21198-21202 DOI:10.1016/j.ijhydene.2017.07.042 |
Felsenstein J, 1985. Confidence limits on phylogenies:an approach using the bootstrap. Evolution, 39(4): 783-791 DOI:10.1111/j.1558-5646.1985.tb00420.x |
Hasvold Ø, Henriksen H, Melv˦r E et al, 1997. Sea-water battery for subsea control systems. Journal of Power Sources, 65(1-2): 253-261 DOI:10.1016/S0378-7753(97)02477-4 |
Hidalgo D, Tommasi T, Velayutham K et al, 2016. Long term testing of Microbial Fuel Cells:Comparison of different anode materials. Bioresource Technology, 219: 37-44 DOI:10.1016/j.biortech.2016.07.084 |
Hou J X, Liu Z L, Zhang P Y, 2013. A new method for fabrication of graphene/polyaniline nanocomplex modified microbial fuel cell anodes. Journal of Power Sources, 224: 139-144 DOI:10.1016/j.jpowsour.2012.09.091 |
Huang L H, Li X F, Ren Y P et al, 2016. In-situ modified carbon cloth with polyaniline/graphene as anode to enhance performance of microbial fuel cell. International Journal of Hydrogen Energy, 41(26): 11369-11379 DOI:10.1016/j.ijhydene.2016.05.048 |
Ishii S, Shimoyama T, Hotta Y, 2008. Characterization of a filamentous biofilm community established in a cellulose-fed microbial fuel cell. BMC Microbiology, 8: 6 DOI:10.1186/1471-2180-8-6 |
Kimura M, 1980. A simple method for estimating evolutionary rates of base substitutions through comparative studies of nucleotide sequences. Journal of Molecular Evolution, 16(2): 111-120 DOI:10.1007/BF01731581 |
Liu X, Zhao X H, Yu Y Y et al, 2017. Facile fabrication of conductive polyaniline nanoflower modified electrode and its application for microbial energy harvesting. Electrochimica Acta, 255: 41-47 DOI:10.1016/j.electacta.2017.09.153 |
Logan B E, 2009. Exoelectrogenic bacteria that power microbial fuel cells. Nature Reviews Microbiology, 7(5): 375-381 DOI:10.1038/nrmicro2113 |
Mashkour M, Rahimnejad M, Mashkour M, 2016. Bacterial cellulose-polyaniline nano-biocomposite:A porous media hydrogel bioanode enhancing the performance of microbial fuel cell. Journal of Power Sources, 325: 322-328 DOI:10.1016/j.jpowsour.2016.06.063 |
Myers W R, 2003. Encycloedia of Biopharmaceutical Statistics. New York: Marcel Dekker, 858-869
|
Nimje V R, Chen C Y, Chen C C et al, 2009. Stable and high energy generation by a strain of Bacillus subtilis in a microbial fuel cell. Journal of Power Sources, 190(2): 258-263 DOI:10.1016/j.jpowsour.2009.01.019 |
Nor M H M, Mubarak M F M, Elmi H S A et al, 2015. Bioelectricity generation in microbial fuel cell using natural microflora and isolated pure culture bacteria from anaerobic palm oil mill effluent sludge. Bioresource Technology, 190: 458-465 DOI:10.1016/j.biortech.2015.02.103 |
Quan X C, Sun B, Xu H D, 2015. Anode decoration with biogenic Pd nanoparticles improved power generation in microbial fuel cells. Electrochimica Acta, 182: 815-820 DOI:10.1016/j.electacta.2015.09.157 |
Rabaey K, Versterarte W, 2005. Microbial fuel cells:novel biotechnology for energy generation. Trends in Biotechnology, 23(6): 291-298 DOI:10.1016/j.tibtech.2005.04.008 |
Rezaei F, Richard T L, Brennan R A et al, 2007. Substrate-enhanced microbial fuel cells for improved remote power generation from sediment-based systems. Environmental Science & Technology, 41(11): 4053-4058 |
Ringeisen B R, Henderson E, Wu P K et al, 2006. High power density from a miniature microbial fuel cell using Shewanella oneidensis DSP10. Environmental Science & Technology, 40(8): 2629-2634 |
Rismani-Yazdi H, Christy A D, Dehority B A et al, 2007. Electricity generation from cellulose by rumen microorganisms in microbial fuel cells. Biotechnology and Bioengineering, 97(6): 1398-1407 DOI:10.1002/bit.21366 |
Samsudeen N, Radhakrishnan T K, Matheswaran M, 2016. Effect of isolated bacterial strains from distillery wastewater on power generation in microbial fuel cell. Process Biochemistry, 51(11): 1876-1884 DOI:10.1016/j.procbio.2016.06.007 |
Takeuchi Y, Khawdas W, Aso Y et al, 2017. Microbial fuel cells using Cellulomonas spp. with cellulose as fuel. Journal of Bioscience and Bioengineering, 123(3): 358-363 DOI:10.1016/j.jbiosc.2016.10.009 |
Tamura K, Dudley J, Nei M et al, 2007. MEGA4:Molecular evolutionary genetics analysis (MEGA) software version 4.0. Molecular Biology and Evolution, 24(8): 1596-1599 DOI:10.1093/molbev/msm092 |
Watanabe K, 2008. Recent developments in microbial fuel cell technologies for sustainable bioenergy. Journal of Bioscience and Bioengineering, 106(6): 528-536 DOI:10.1263/jbb.106.528 |
Wei D, Zhang X, 2007. Current production by a deep-sea strain Shewanella sp. DS1. Current Microbiology, 55(6): 497-500 DOI:10.1007/s00284-007-9019-2 |
Zhang G D, Feng S S, Jiao Y et al, 2017a. Cathodic reducing bacteria of dual-chambered microbial fuel cell. International Journal of Hydrogen Energy, 42(45): 27607-27617 DOI:10.1016/j.ijhydene.2017.06.095 |
Zhang H M, Zhang R, Zhang G Y et al, 2014. Modified graphite electrode by polyaniline/tourmaline improves the performance of bio-cathode microbial fuel cell. International Journal of Hydrogen Energy, 39(21): 11250-11257 DOI:10.1016/j.ijhydene.2014.05.057 |
Zhang P, Liu J, Qu Y P et al, 2017b. Enhanced Shewanella oneidensis MR-1 anode performance by adding fumarate in microbial fuel cell. Chemical Engineering Journal, 328: 697-702 DOI:10.1016/j.cej.2017.07.008 |
Zhang W Z, Xie B Z, Yang L G et al, 2017c. Brush-like polyaniline nanoarray modified anode for improvement of power output in microbial fuel cell. Bioresource Technology, 233: 291-295 DOI:10.1016/j.biortech.2017.02.124 |
 2021, Vol. 52
2021, Vol. 52


