中国海洋湖沼学会主办。
文章信息
- 肖燃, 宋长普, 朱阳, 黄伟, 郑利兵, 迟长凤, 楼宝. 2021.
- XIAO Ran, SONG Chang-Pu, ZHU Yang, HUANG Wei, ZHENG Li-Bing, CHI Chang-Feng, LOU Bao. 2021.
- 神经肽FF在小黄鱼(Larimichthys polyactis)性腺发育早期的表达与定位分析
- EXPRESSION AND LOCALIZATION OF THE NEUROPEPTIDE FF GENE FROM LARIMICHTHYS POLYACTIS DURING PRIMITIVE GONADAL PERIOD
- 海洋与湖沼, 52(1): 213-221
- Oceanologia et Limnologia Sinica, 52(1): 213-221.
- http://dx.doi.org/10.11693/hyhz20200500146
文章历史
-
收稿日期:2020-05-24
收修改稿日期:2020-06-30
2. 浙江省农业科学院水生生物研究所 杭州 310021
2. Institute of Hydrobiology, Zhejiang Academy of Agricultural Sciences, Hangzhou 310021, China
神经肽FF(Neuropeptide FF, FLFQPQRFa-NH2, NPFF)是一种类酰胺化神经肽, 属于RF氨基肽家族(Fukusumi et al, 2006)。神经肽FF与促性腺激素抑制激素(GnIH)同源, 具有丰富的生理活性, 在调节应激对生殖的影响(Ubuka et al, 2018)、性成熟(Shahjahan et al, 2015)、调节血压(Allard et al, 1995)、体液平衡(Majane et al, 1991; Kalliomäki et al, 2004)、体温(Moulédous et al, 2010)、消化道运动(Decker et al, 1997)、抗炎(Yang et al, 2003)、心血管功能(Laguzzi et al, 1996)、脂肪细胞分化(Lefrère et al, 2002)和内分泌(Jhamandas et al, 2013)等方面发挥着重要作用。
小黄鱼(Larimichthys polyactis)又名小黄花, 属于石首鱼科(Sciaenidae)黄鱼属(Larimichthys), 与带鱼(Trichiurus lepturus)、曼氏无针乌贼(Sepiella japonica)、大黄鱼(Larimichthys crocea)同被誉为东海“四大海产”之一(Park et al, 2019)。目前各国学者研究主要集中在小黄鱼的资源分布等方面, 但对小黄鱼生殖调控的研究还相对较少(蒙子宁等, 2003; Wang et al, 2009)。由于过度捕捞、环境污染、气候环境变化等原因, 小黄鱼捕捞量急剧下降, 捕获的小黄鱼表现出日趋小型化、性成熟等现象, 种质资源退化严重, 已经无法满足人们的消费需求(Chen et al, 1997; 严利平等, 2014)。目前已有学者对小黄鱼生殖周期、精液特性和精子结构等进行了研究(Lim et al, 2010; Le et al, 2011)。Wang进一步通过实验发现KIF3A可能在精子发生过程中参与核重塑和尾巴形成(Wang et al, 2019), 但关于小黄鱼在生殖方面的研究十分有限。研究表明促性腺激素能与脑垂体生长激素受体相互作用, 说明神经内分泌调节能影响鱼类生长及性腺的发育(林浩然, 2000), 而神经肽FF能同时调节神经内分泌和性腺发育。因此, 本实验开展神经肽FF在小黄鱼性腺发育过程中的潜在功能研究, 分析神经肽FF基因在性腺发育早期的表达与定位, 为开展神经肽FF的深入研究奠定基础。
1 材料与方法 1.1 材料 1.1.1 实验动物小黄鱼样品采自浙江省宁波市象山港水产育种有限公司。选取健康有活力的第Ⅱ期小黄鱼[体长为(11±2) cm, 体重为(16±2) g], 取出脑、头肾、心、鳃、皮肤、性腺、脾脏、肝脏、胃、肌肉、肠道等组织(n=3), 立即在室温下RNA保存液浸泡1 h, 液氮中保存24 h, 然后转移至–80℃冰箱中, 直至提取总RNA反转录合成cDNA, 备用。脑、性腺(卵巢)放在预冷的4%多聚甲醛中固定, 用冰袋运回实验室, 4℃冰箱保存备用。
1.1.2 实验试剂RNA保存液、RNAiso Plus、Ex Taq Mix、Reverse Transcriptase M-MLV (RNase H-)、TB GreenTM Premix Ex TaqTM Ⅱ均购于TaKaRa公司、Riboprobe® Combination System-试剂盒购于Promega科技有限公司、DIG RNA Labeling Mix、Anti- Digoxigenin-AP conjugate、BCIP/NBT显色试剂盒均购于Roche科技有限公司、Anti-FMRFamide购于ImmuoStar公司、SABC试剂盒购于上海生物工程股份有限公司。
1.2 实验方法 1.2.1 小黄鱼神经肽FF基因组织表达特异性分析采用M-MLVRTase cDNA Synthesis Kit反转录试剂盒合成cDNA第一条链, –20℃冰箱备用。选取小黄鱼β-actin、18S基因作为内参, 通过实时荧光定量PCR(qRT-PCR)分析小黄鱼神经肽FF基因在不同组织中表达的差异性。根据所得神经肽FF基因cDNA全长, 设计其qRT-PCR特异性引物, 引物序列见表 1。选择第Ⅱ期性未成熟的小黄鱼三只做3次生物学重复, 每次反应做3次机械重复。qRT-PCR实验操作参考SYBR Premix Ex Taq Ⅱ (Tli RNaseH Plus)试剂说明书进行。qRT-PCR结果以2–ΔΔCT方法换算成相对表达量, 单因素方差分析分析(One-way ANOVA)运用软件SPSS 17.0来实现, 显著性差异分析则通过SPSS17.0的Duncan法得出, P < 0.05为显著差异; 利用Origin 8.1软件进行柱状图绘图。
| 引物名称 | 引物序列 |
| LpNPFF-PCR-F | 5′-TAACCCTTGATTTGGACGG-3′ |
| LpNPFF-PCR-R | 5′-GACTGCCTTGGATGTGAA-3′ |
| β-actin-F | 5′-TCGTCGGTCCAGGCATCAG-3′ |
| β-actin-R | 5′-ATGGCGTGCAGAGCGTAACC-3′ |
| 18S-F | 5′-TTGTCCGAAGCGTTTACT-3′ |
| 18S-R | 5′-TCACCTCTAGCGGCACGTT-3′ |
在小黄鱼神经肽FF基因的ORF区内设计原位杂交探针的引物, 反义探针(用A表示)需在下游引物前加上T7启动子序列, 正义探针(用S表示)需在上游引物前加上T7启动子序列, 引物序列参见表 2。探针根据Riboprobe® CombinationSystem-SP6/T7 RNA Polymerase试剂盒以及DIG RNA Labeling Mix说明书进行操作。在杂交前对组织切片进行脱蜡、复水、通透处理, 并且在预杂交液中孵育1 h (42℃); 暗盒中50℃杂交过夜; 滴加二抗(抗地高辛-AP抗体, 稀释1︰2000), 室温暗盒中静置3 h; BCIP/NBT染色封片后显微观察。
| 引物名称 | 引物序列 |
| A-LpNF-F | TGGCGTCAGTCGTGCTCTT |
| A-LpNF-R | GATCACTAATACGACTCACTATAGGGGCACTCATCAACATGCTTT |
| S-LpNF-F | GATCACTAATACGACTCACTATAGGTGGCGTCAGTCGTGCTCTT |
| S-LpNF-R | GGCACTCATCAACATGCTTT |
通过间接免疫过氧化物酶方法处理切片:将组织去石蜡、复水, 然后在pH 7.4的0.1 mol/L PBS中洗涤; 切片用0.3% H2O2处理以封闭内源性过氧化物酶。与胎牛血清孵育20 min后, 切片在4℃下与兔FMRFamide多克隆抗体(1︰2000稀释)在湿盒中孵育过夜(阴性对照以PBS代替一抗); 将切片在PBS中冲洗数次, 并在室温下与二抗(生物素标记羊抗兔IgG)在PBS中按1︰1000稀释孵育30 min。在PBS中漂洗两次后, 将抗生物素蛋白-过氧化物酶-偶联物溶液加入到载玻片中, 并在37℃下孵育30 min。最后, 通过使用二氨基联苯胺(DAB)可视化反应产物, 并用苏木精染色细胞核。然后将切片洗涤、脱水、透明, 使用中性树脂封片, 显微镜下观察并拍照记录。
2 结果与分析 2.1 小黄鱼神经肽FF基因组织表达特异性分析以第Ⅱ期的小黄鱼各个组织为模板进行qRT-PCR荧光定量分析LpNPFF组织差异性情况。如图 1所示, LpNPFF在所有测试的组织中均有表达, 包括脑、肾、性腺、头肾、心脏、肝脏、胃、脾脏、鳃、肠和肌肉。其中, LpNPFF基因在脑组织中高表达, 并且与其他组织比较具有显著性差异。性腺、肌肉和脾脏LpNPFF表达略高于其他外周组织, 在胃、鳃、肠道中LpNPFF的表达相对较少。
 |
| 图 1 LpNPFF基因在小黄鱼不同组织中的相对表达水平 Fig. 1 Relative expression levels of the LpNPFF genes in different tissues of L. polyactis 注:用qRT-PCR对LpNPFF基因的表达水平进行定量, β-actin和18S对其进行归一化。所有数据均以平均值±S.D (n=3)表示。BR.脑; KI.肾脏; SG.性腺; HK.头肾; HE.心脏; LI.肝脏; ST.胃; SP.脾脏; GI.鳃; IN.肠道; MU.肌肉 |
基于LpNPFF基因mRNA的相对表达, 我们选取小黄鱼脑(端脑、中脑、小脑及延脑)和性腺进行原位杂交实验。实验结果表明, 在小黄鱼端脑(图 2b, 2c, 2d, 2e, 2f)、中脑(图 3b, 3c, 3d), 小脑及延脑(图 4b, 4c, 4d)组织中能够清晰观察到LpNPFF基因mRNA的阳性杂交信号, 用正义探针进行对照实验杂交则不能观察到信号(端脑, 图 2a; 中脑, 图 3a; 小脑及延脑, 图 4a)。小黄鱼LpNPFF的mRNA主要分布于小黄鱼的中脑(视叶)以及延脑, 端脑和小脑部分的表达较少。在中脑的视顶盖(OTec)、圆环体(TL)、结节前核(NAT)、外侧结节核(NLT)、下丘脑弥散核(NDLI)以及延脑(MO)中检测到大量表达LpNPFF mRNA的细胞, 这可能暗指LpNPFF调控着不同的生理学功能。并且在小黄鱼未成熟的性腺组织中也能观察到明显的阳性信号(图 5b)。经小黄鱼性腺组织解剖学分析, 此时期性腺为卵巢, 以不规则多角形的稚龄时相的卵母细胞为主要组成部分, 它们之间彼此紧密相连, 核很大, 呈圆形, 核仁可见分布在核的周围。因此在细胞质与核仁部分能观察到明显的LpNPFF基因mRNA的阳性杂交信号。
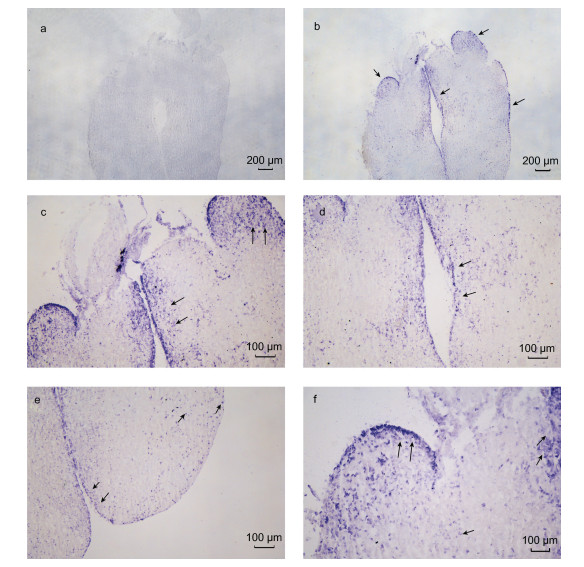 |
| 图 2 LpNPFF基因mRNA端脑原位杂交图 Fig. 2 Localization of LpNPFF mRNA in telencephalon of L. polyactis 注:蓝色区域为反义探针杂交位置。a.正义探针对照组; b, c, d, e, f.反义探针实验组; c, d.端脑(10×); e, f.端脑(20×)。黑色箭头表示阳性信号(蓝色), 标尺显示在图片右下角 |
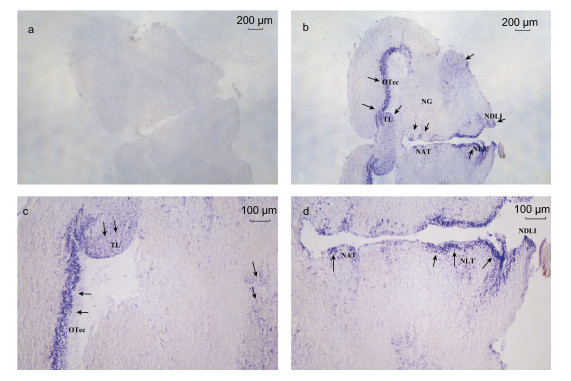 |
| 图 3 LpNPFF基因mRNA中脑原位杂交图 Fig. 3 Localization of LpNPFF mRNA in midbrain of L. polyactis 注:蓝色区域为反义探针杂交位置。a.正义探针对照组; b, c, d.反义探针实验组。c, d.中脑(10×)。黑色箭头表示阳性信号(蓝色), 标尺显示在图片右上方 |
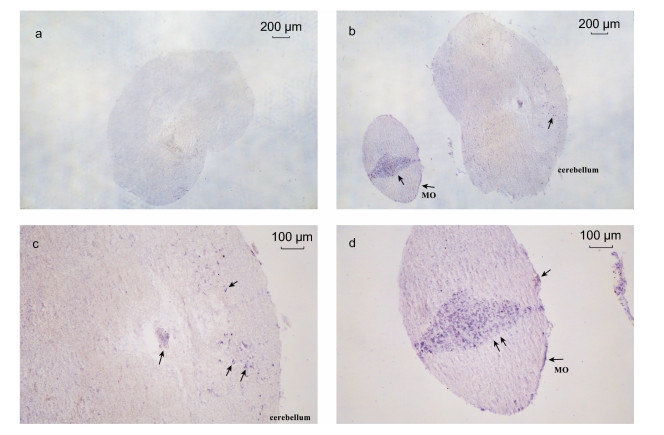 |
| 图 4 LpNPFF基因mRNA小脑及延脑原位杂交图 Fig. 4 Localization of LpNPFF mRNA in cerebellum and medulla oblongata (MO) of L. polyactis 注:蓝色区域为反义探针杂交位置。a.正义探针对照组; b, c, d.反义探针实验组, c为延脑(10×), d为小脑(10×)。黑色箭头表示阳性信号(蓝色), 标尺显示在图片右上方 |
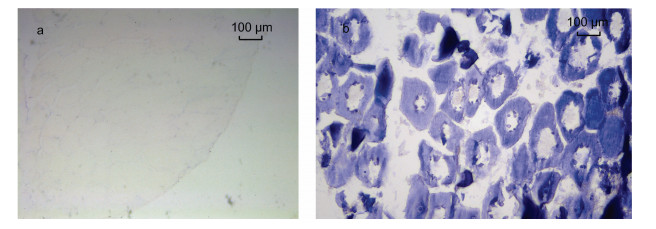 |
| 图 5 LpNPFF基因mRNA性腺原位杂交图 Fig. 5 Localization of LpNPFF mRNA in gonad of L. polyactis 注:蓝色区域为反义探针杂交位置。a.正义探针对照组; b.反义探针实验组(20×)。黑色箭头表示阳性信号(蓝色), 标尺显示在图片右上方 |
免疫组化实验结果表明, 小黄鱼脑组织中的FaRPs的免疫活性的区域为棕色(图 6b, 6c, 6d), 与不具FaRPs免疫活性的细胞核区域形成鲜明的对比(图 6a), 我们在中脑的表层发现了明显密集的FaRPs免疫信号, 而在内部则相对较少。在小黄鱼性腺组织中, FaRPs的免疫活性的区域为棕色(图 7b, 7c, 7d), 与不具FaRPs免疫活性的细胞核区域形成鲜明的对比(图 7a), 并且RFamide主要存在于细胞壁壁或结缔组织周围。我们预测LpNPFF肽作用于性腺壁表层细胞, 可能参与调控性腺发育等。
 |
| 图 6 小黄鱼脑组织中的FaRPs分布图 Fig. 6 Distribution of FaRPs in brain tissue of L. polyactis 注: a.不加一抗的对照组; b.脑组织的FaRPs阳性信号(10×); c, d.脑组织里的FaRPs阳性信号(20×)。黑色箭头表示阳性信号(棕色), 细胞核为蓝色, 标尺显示在图右上方 |
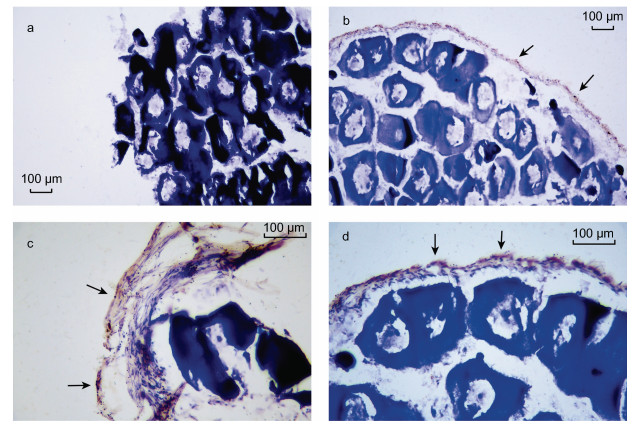 |
| 图 7 小黄性腺组织中的FaRPs分布图 Fig. 7 Distribution of FaRPs in the gonad tissue of L. polyactis 注: a.不加一抗的对照组; b.性腺组织FaRPs阳性信号(10×); c, d.性腺组织FaRPs阳性信号(20×)。黑色箭头表示阳性信号(棕色), 细胞核为蓝色, 标尺显示在图右上方 |
小黄鱼是我国浙江舟山沿海地区的一种主要的经济性物种, 由于其肉质鲜美, 深受人们的喜爱。LpNPFF是RFamide相关肽家族中的一员, 在许多生物学过程中具有重要的调节作用。实时荧光定量分析显示, 小黄鱼神经肽FF mRNA在所有被测组织中均广泛表达, 其中以脑、性腺、肾脏及周围组织肌肉中表达量最高。在花鲈(Lateolabrax maculatus)(Li et al, 2019)和星点东方鲀(Takifugu niphobles)(Shahjahan et al, 2015)中, NPFF在中枢神经系统及周围神经系统(PNS)和性腺中的表达量最高, 提示LpNPFF可能在脑和性腺中发挥重要作用, 这与我们得到的结果一致。在大鼠(Mus musculus)中, NPFF mRNA的最高水平出现在脊髓、垂体和下丘脑(Kivipelto et al, 1991; Majane et al, 1993); 而在人类中, NPFF mRNA的最高水平出现在髓质和脊髓(Nystedt et al, 2002), 这有可能说明不同的表达模式表明不同物种大脑功能的差异性。
NPFF在人(Homo sapiens)和大鼠的细胞定位在中枢神经系统的许多区域被检测到。人类NPFF基因mRNA定位于大脑和脊髓(Vilim et al, 1999)。在大鼠中NPFF基因mRNA高表达于下丘脑室旁核(PVN), 这是一个对神经激素分泌和交感神经流出调节至关重要的自主核(Jhamandas et al, 2006)。与人类和大鼠不同, 在成熟斑马鱼(Danio rerio)和胚胎中确定了表达NPFF基因mRNA的细胞的定位。在端脑的嗅球和嗅视神经核中发现了ZfPQRF神经元表达, 而在下丘脑、脑干和脊髓中则没有ZfPQRF神经元表达(Oehlmann et al, 2002)。这些基因在哺乳动物和硬骨鱼之间的差异定位显示了不同的基因功能。然而, 在我们的研究中, 小黄鱼NPFF基因mRNA在端脑及小脑部分表达量有限, 但在中脑部分区域和延脑(MO)区域有大量表达, 这可能表示LpNPFF通过不同的途径向不同组织传递信号并且行使着不同的生理学功能, 其中包括与生殖相关的NDLI(Kitahashi et al, 2009), 与摄食调节相关的NAT、NLT (Cerdá-Reverter et al, 2000, 2003; Shiraishi et al, 2000)。LpNPFF基因mRNA在中脑的分布主要在组织的边缘, 并且较为集中且呈长条状分布, 如OTec和NLT等。NPFF很可能作为传递信号的途径, 通过不同的途径向不同组织传递信号。根据最近的研究, 在花鲈中发现NPFF及其受体均位于下丘脑, 说明NPFF对下丘脑神经元有直接的调节进食作用(Bechtold et al, 2007; Li et al, 2019)。小黄鱼神经肽FaRPs的免疫阳性信号主要集中于脑部细胞表层和卵巢壁细胞表层, 这与原位杂交结果中LpNPFF mRNA的分布较为集中不同。鉴于原位杂交技术定位的是LpNPFF的mRNA, 基本可以判定有信号区域是可能分泌FaRPs蛋白的细胞。在胚胎斑马鱼中(Pinelli et al, 2000)和鳟鱼(Salmo trutta fario)(Castro et al, 2001)的早期发育阶段也发现了FMRFamide类免疫反应神经元。我们提出一个假设:脑部组织是小黄鱼RFamide神经肽的来源, 由脑部组织细胞分泌的RFa神经肽通过神经纤维向下游传递。我们的免疫组织化学实验证实, 小黄鱼脑部细胞分泌的RFamide可能通过内外细胞颗粒层和结缔组织向下游传递。这说明小黄鱼脑组织中的NPFF是由特定的细胞进行转录翻译, 但在翻译成熟之后, NPFF蛋白将转运至不同的区域发挥作用或进行免疫调节反应。而在小黄鱼卵巢中, 我们发现FaRPs蛋白的分布较为紧密, 与脑组织中的弥散分布有一定的差异。同时卵巢组织中FaRPs蛋白主要存在于结缔组织中, 这说明LpNPFF可能将信号传递给性腺组织, 但LpNPFF蛋白并没有进入到细胞里面, 仅仅是充当一种信号传递的中间媒介。因此, 这些神经元群可能表达其他的RFamide, 与已知的FMRF抗体的广泛反应性一致(Pinelli et al, 2000)。不同组织中NPFF的不同分布情况预示着该蛋白具有不同的生物学功能, NPFF除生殖调控之外, 可能作为一个神经调质调解小黄鱼的更高级的生理活动, 例如摄食、免疫等。
4 结论组织特异性分析结果显示小黄鱼神经肽FF基因在脑和性腺中表达含量较高, 肌肉和脾脏次之。原位杂交实验结果显示, LpNPFF mRNA主要分布于小黄鱼的中脑(视叶)以及延脑, 端脑和小脑部分的表达较少。在中脑的视顶盖(OTec)、圆环体(TL)、结节前核(NAT)、外侧结节核(NLT)、下丘脑弥散核(NDLI)以及延脑(MO)中检测到大量表达LpNPFF mRNA的细胞, 这可能与LpNPFF调控着不同的生理学功能有关。并且在第Ⅱ期的卵巢细胞中也能观察到明显的阳性信号。免疫组织化学结果显示, 小黄鱼神经肽FaRPs的免疫阳性信号主要集中于脑部细胞表层和卵巢壁细胞表层, 这与原位杂交的结果中LpNPFF基因mRNA的分布形成呼应。
严利平, 刘尊雷, 张辉, 等. 2014. 小黄鱼生物学特征与资源数量的演变. 海洋渔业, 36(6): 481-488 DOI:10.3969/j.issn.1004-2490.2014.06.001 |
林浩然. 2000. 神经内分泌因子调控鱼类生殖和生长的相互作用. 动物学研究, 21(1): 12-17 DOI:10.3321/j.issn:0254-5853.2000.01.004 |
蒙子宁, 庄志猛, 金显仁, 等. 2003. 黄海和东海小黄鱼遗传多样性的RAPD分析. 生物多样性, 11(3): 197-203 DOI:10.3321/j.issn:1005-0094.2003.03.003 |
Allard M, Labrouche S, Nosjean A et al, 1995. Mechanisms underlying the cardiovascular responses to peripheral administration of NPFF in the rat. J Pharmacol Exp Ther, 274(1): 577-583 |
Bechtold D A, Luckman S M, 2007. The role of RFamide peptides in feeding. J Endocrinol, 192(1): 3-15 DOI:10.1677/JOE-06-0069 |
Castro A, Becerra M, Anadón R et al, 2001. Distribution and development of FMRFamide-like immunoreactive neuronal systems in the brain of the brown trout, Salmo trutta fario. J Comp Neurol, 440(1): 43-64 DOI:10.1002/cne.1369 |
Cerdá-Reverter J M, Anglade I, Martínez-Rodríguez G et al, 2000. Characterization of neuropeptide Y expression in the brain of a perciform fish, the sea bass (Dicentrarchus labrax). J Chem Neuroanat, 19(4): 197-210 DOI:10.1016/S0891-0618(00)00063-6 |
Cerdá-Reverter J M, Peter R E, 2003. Endogenous melanocortin antagonist in fish:structure, brain mapping, and regulation by fasting of the goldfish agouti-related protein gene. Endocrinology, 144(10): 4552-4561 DOI:10.1210/en.2003-0453 |
Chen D G, Liu Q, Zeng X Q et al, 1997. Catch composition and seasonal variation of setnet fisheries in the Yellow and Bohai Seas. Fish Res, 32(1): 61-68 DOI:10.1016/S0165-7836(97)00043-X |
Decker B, Vadokas B, Kutschenreuter U et al, 1997. Action of FMRFamide-like peptides on porcine gastrointestinal motility in vitro. Peptides, 18(10): 1531-1537 DOI:10.1016/S0196-9781(97)00239-8 |
Fukusumi S, Fujii R, Hinuma S, 2006. Recent advances in mammalian RFamide peptides:the discovery and functional analyses of PrRP, RFRPs and QRFP. Peptides, 27(5): 1073-1086 DOI:10.1016/j.peptides.2005.06.031 |
Jhamandas J H, David M T, Harris K H, 2006. Neuropeptide FF (NPFF) control of magnocellular neurosecretory cells of the rat hypothalamic paraventricular nucleus (PVN). Peptides, 27: 973-979 DOI:10.1016/j.peptides.2005.07.030 |
Jhamandas J H, Goncharuk V, 2013. Role of neuropeptide FF in central cardiovascular and neuroendocrine regulation. Front Endocrinol (Lausanne), 4: 8 |
Kalliomäki M L, Panula P, 2004. Neuropeptide ff, but not prolactin-releasing peptide, mRNA is differentially regulated in the hypothalamic and medullary neurons after salt loading. Neuroscience, 124(1): 81-87 DOI:10.1016/j.neuroscience.2003.10.026 |
Kitahashi T, Ogawa S, Parhar I S et al, 2009. Cloning and expression of kiss2 in the zebrafish and medaka. Endocrinology, 150(2): 821-831 DOI:10.1210/en.2008-0940 |
Kivipelto L, Panula P, 1991. Comparative distribution of neurons containing FLFQPQRFamide-like (morphine-modulating) peptide and related neuropeptides in the rat brain. Eur J Neurosci, 3(2): 175-185 DOI:10.1111/j.1460-9568.1991.tb00078.x |
Laguzzi R, Nosjean A, Mazarguil H et al, 1996. Cardiovascular effects induced by the stimulation of neuropeptide FF receptors in the dorsal vagal complex:an autoradiographic and pharmacological study in the rat. Brain Res, 711(1-2): 193-202 DOI:10.1016/0006-8993(95)01382-2 |
Le M H, Lim H K, Min B H et al, 2011. Semen cryopreservation of yellow croaker Larimichthys polyactis. Rev Fish Biol Fish, 21(4): 789-797 DOI:10.1007/s11160-011-9209-7 |
Lefrère I, De Coppet P, Camelin J C et al, 2002. Neuropeptide AF and FF modulation of adipocyte metabolism. Primary insights from functional genomics and effects on β-adrenergic responsiveness. J Biol Chem, 277(42): 39169-39178 |
Li Q, Wen H S, Li Y et al, 2019. Evidence for the direct effect of the NPFF peptide on the expression of feeding-related factors in spotted sea bass (Lateolabrax maculatus). Front Endocrinol (Lausanne), 10: 545 DOI:10.3389/fendo.2019.00545 |
Lim H K, Le M H, An C M et al, 2010. Reproductive cycle of yellow croaker Larimichthys polyactis in southern waters off Korea. Fish Sci, 76(6): 971-980 DOI:10.1007/s12562-010-0288-5 |
Majane E A, Yang H Y T, 1991. Mammalian FMRF-NH2-like peptide in rat pituitary:decrease by osmotic stimulus. Peptides, 12(6): 1303-1308 DOI:10.1016/0196-9781(91)90211-7 |
Majane E A, Zhu J, Aarnisalo A A et al, 1993. Origin of neurohypophyseal neuropeptide-FF (FLFQPQRF-NH2). Endocrinology, 133(4): 1578-1584 DOI:10.1210/endo.133.4.8404597 |
Moulédous L, Barthas F, Zajac J M, 2010. Opposite control of body temperature by NPFF1 and NPFF2 receptors in mice. Neuropeptides, 44(5): 453-456 DOI:10.1016/j.npep.2010.05.003 |
Nystedt J M, Brandt A M, Mandelin J et al, 2002. Analysis of human neuropeptide FF gene expression. J Neurochem, 82(6): 1330-1342 DOI:10.1046/j.1471-4159.2002.01035.x |
Oehlmann V D, Korte H, Sterner C et al, 2002. A neuropeptide FF-related gene is expressed selectively in neurons of the terminal nerve in Danio rerio. Mech Develop, 117: 357-361 DOI:10.1016/S0925-4773(02)00210-1 |
Park I S, Gil H W, 2019. Karyotypic analysis of chicken grunt, Parapristipoma trilimeatum, small yellow croaker, Larimichthys polyactis, and brown croaker, Miichthys miiuy. Dev Reprod, 23(1): 73-78 DOI:10.12717/DR.2019.23.1.073 |
Pinelli C, D'Aniello B, Sordino P et al, 2000. Comparative immunocytochemical study of FMRFamide neuronal system in the brain of Danio rerio and Acipenser ruthenus during development. Dev Brain Res, 119(2): 195-208 DOI:10.1016/S0165-3806(99)00172-8 |
Shahjahan M, Doi H, Ando H, 2015. Differential expression patterns of PQRFamide peptide and its two receptor genes in the brain and pituitary of grass puffer during the reproductive cycle. Gen Comp Endocrinol, 210: 152-160 DOI:10.1016/j.ygcen.2014.07.005 |
Shiraishi T, Oomura Y, Sasaki K et al, 2000. Effects of leptin and orexin-A on food intake and feeding related hypothalamic neurons. Physiol Behav, 71(3-4): 251-261 DOI:10.1016/S0031-9384(00)00341-3 |
Ubuka T, Tsutsui K, 2018. Comparative and evolutionary aspects of gonadotropin-inhibitory hormone and FMRFamide-like peptide systems. Front Neurosci, 12: 747 DOI:10.3389/fnins.2018.00747 |
Vilim F S, Aarnisalo A A, Nieminen M L et al, 1999. Gene for pain modulatory neuropeptide NPFF:induction in spinal cord by noxious stimuli. Mol Pharmacol, 55: 804-811 |
Wang J Q, Gao X M, Zheng X B et al, 2019. Expression and potential functions of KIF3A/3B to promote nuclear reshaping and tail formation during Larimichthys polyactis spermiogenesis. Dev Genes Evol, 229(5-6): 161-181 DOI:10.1007/s00427-019-00637-5 |
Wang X L, Li D P, Meng X Y et al, 2009. A panel of polymorphic EST-derived microsatellite loci for the small yellow croaker (Larimichthys polyactis). Conserv Genet, 10(5): 1629-1631 DOI:10.1007/s10592-009-9816-1 |
Yang H Y T, Iadarola M J, 2003. Activation of spinal neuropeptide FF and the neuropeptide FF receptor 2 during inflammatory hyperalgesia in rats. Neuroscience, 118(1): 179-187 DOI:10.1016/S0306-4522(02)00931-4 |
 2021, Vol. 52
2021, Vol. 52


