
中国海洋湖沼学会主办。
文章信息
- 张瑞祺, 赵金良. 2021.
- ZHANG Rui-Qi, ZHAO Jin-Liang. 2021.
- 鳜(Siniperca chuatsi)后部侧线系统胚后发育
- POSTEMBRYONIC DEVELOPMENT OF THE POSTERIOR LATERAL LINE SYSTEM OF MANDARINFISH SINIPERCA CHUATSI
- 海洋与湖沼, 52(1): 222-230
- Oceanologia et Limnologia Sinica, 52(1): 222-230.
- http://dx.doi.org/10.11693/hyhz20200400124
文章历史
-
收稿日期:2020-04-21
收修改稿日期:2020-05-24
2. 上海海洋大学 水产动物遗传育种中心上海市协同创新中心 上海 201306
2. Shanghai Collaborative Innovation for Aquatic Animal Genetics and Breeding, Shanghai Ocean University, Shanghai 201306, China
侧线系统是鱼类重要感觉器官, 与鱼类索饵、捕食、集群、洄游和生殖等行为有密切联系(Montgomery et al, 2013; Bird et al, 2014; Butler et al, 2015; Brown et al, 2016; Dow et al, 2018)。大部分硬骨鱼类均具有机械感受侧线系统, 主要由神经丘结构与侧线管道构成, 其中神经丘分为两大类, 管道神经丘(canal neuromast, CN)与表面神经丘(superfical neuromast, SN), 侧线管道因所在位置不同, 分为颅部侧线管道系统与躯干侧线管道系统(Denton et al, 1989; Münz, 1989; Webb, 2013)。对鱼类侧线结构的研究是解读其侧线功能特征、生活习性和对应生境关系的重要手段。
二类神经丘分布于鱼类体表, 其中部分神经丘内含于特定侧线管道中成为管道神经丘, 而完全暴露于外部的神经丘称为表面神经丘(Webb, 2013; Bird et al, 2014)。管道神经丘借由侧线管道配合, 与鱼类周边水体加速度信息的感知有关, 常在鱼类捕食、避敌行为中发挥重要作用, 而表面神经丘与周边水体绝度流速的感知有关, 在对周边水体波动的基本感知与警戒中发挥作用(Denton et al, 1989; Münz, 1989; Webb, 2013)。二类神经丘数量、分布、结构特点及侧线管道结构特征直接反应了鱼类侧线系统的进化与特化程度, 如洞穴鱼(Astyanax mexicanus)在阴暗洞穴中视觉感官严重退化, 侧线系统极为发达, 全身覆盖大量密集排布的神经丘, 侧线感觉极为灵敏(Yoshizawa et al, 2011; Worsham et al, 2019); 又如大头犀孔鲷(Porornitra capito)和大洋黑鳕(Melanonus zugmuyeri), 侧线管道较宽的管径与内含的大型管道神经丘使其在深海底栖生活中对周边捕食目标的感知极为灵敏(Marshall, 1996)。鱼类颅部侧线系统结构较为保守, 同一目、科鱼类颅部侧线系统在神经丘分布与侧线管路结构方面常不具有明显区别, 而后部侧线系统结构形式多样, 常随着生境的变化而发生结构性适应(Webb, 1989a, 2013; Pichon et al, 2004; Bird et al, 2014)。
鳜(Siniperca chuatsi)是我国特有的淡水经济鱼类(Liang et al, 2001; 孙海林等, 2019)。鳜属于凶猛肉食性鱼类, 具有独特的摄食习性, 首先食性特殊, 终身食活鱼, 拒食死饵, 其次捕食行为特殊, 常采取底栖伏击的方式捕食小型鱼类(梁旭方, 1994, 1995a, b; Liang et al, 2001), 而与其他肉食性鱼类如大口黑鲈(Micropterus salmoides)、暗纹东方鲀(Takifugu obscurus)、北美狗鱼(Esox masquinongy)等所采取的主动捕食方式有显著不同(New et al, 2000; 沈辉等, 2010)。为解读鳜特殊捕食习性, 已有部分学者对鳜捕食行为相关感官结构与功能进行了研究, 梁旭方(1995b)利用行为学实验证明鳜主要依靠视觉、侧线感觉进行捕食, 梁旭方(1996)利用组织学方法研究了鳜颅部侧线管道系统, 发现鳜颅部侧线管道属于分枝型, 其结构可能与底栖生活相关。目前, 鳜侧线系统的研究较为薄弱, 颅部侧线管道研究尚不足以诠释鳜侧线系统的结构特征, 同时鳜在早期发育中, 开口必须以其他鱼的初孵仔鱼为食, 仔稚鱼时期主动摄食, 幼鱼至成鱼阶段逐渐采用底栖伏击性捕食方式(魏开建等, 1996; 田文斐等, 2012; Zhang et al, 2019), 对其重要感官——侧线系统发育过程的研究有助于解读鳜早期发育过程捕食习性的变化机制。
为此, 本研究利用DESAPI神经丘染色、组织切片研究了鳜后部侧线系统的发育过程、神经丘数量与排布特征, 利用扫描电镜观察了后部侧线神经丘建立过程与结构特点。本研究是对鳜完整侧线系统研究的重要补充, 后部侧线系统发育过程与结构特点为其生活习性转变提供了重要资料。
1 材料与方法 1.1 实验材料实验用鳜鱼苗取自上海浦东新区孙农水产养殖场。整个采样期间水质情况保持不变(水温25—26℃; 溶氧: 5—8 mg/L; pH 7.0—7.5), 各批样本的具体发育时间记为n dpf (受精后第n天; dpf, days post fertilization)。基于鳜早期发育相关研究(魏开建等, 1996; 田文斐等, 2012; Zhang et al, 2019), 将鳜分为仔鱼(3—9 dpf, SL: 3.5—8.0 mm)、稚鱼(10—23 dpf, SL: 9.0—25.0 mm)、幼鱼(28—58 dpf, SL: 30—100 mm)三个阶段。1—58 dpf期间以天(d)为单位均匀采样, 每次45尾(其中供神经丘染色、组织切片和扫描电镜观察各15尾), 神经丘荧光染色用样本为活体鱼苗, 采样后直接进行处理; 组织切片用样本采样后1×PBS溶液洗净, Bouin固定液固定12 h, 梯度酒精处理(50%→60%→70%→75%, 各梯度40%), 将样本于75%酒精中浸浴, 每次1—2 d, 至样本中残留固定剂褪去后, 将样本于75%酒精中室温保存; 扫描电镜样本采样后1×PBS溶液洗净, 2.5%戊二醛固定18 h, 供后续使用。
1.2 神经丘荧光染色将1.1中处理鳜鱼苗进行浸于神经丘毛细胞标记物DESAPI (2-4-dimethylamino styryl-N-ethylpyridinium iodide; AAT Bioquest Inc)配制的荧光染色溶液中, DASPEI染色浓度分别为0.01% (3—12 dpf, SL: 3—10 mm, 染色时间10 min), 0.05% (16—30 dpf, SL: 10—30 mm, 染色时间15 min), 0.15% (31—58 dpf, SL: 30—100 mm, 染色时间30 min)。染色结束后用蒸馏水将鱼苗体表多余染剂漂洗干净, 置于Nikon SMZ25荧光体视镜下观察, NIS-Elements图像采集系统拍照。神经丘命名同Webb(2013), 管道神经丘在所属管道未闭合时记为前体管道神经丘(presumptive canal neuromast, PCN), 管道闭合后内含神经丘记为管道神经丘(canal neuromast, CN)。
1.3 组织切片取1.1中处理鳜鱼苗梯度酒精脱水(75%→85%→ 90%→95%→100%), 各梯度20 min (95%→100%脱水两次, 每次5 min), 二甲苯透明(具体时间以样本通体透明为完成), 浸入65℃石蜡完成组织包埋。使用Leica RM 2016切片机以5 μm厚度连续切片, HE染色, 中性树胶封片。利用Olympus IX73显微镜观察, Nikon DS-5Mc图像采集系统拍照。
1.4 扫描电镜观察取1.1中处理鳜鱼苗置于1×PBS溶液中将残留固定剂洗净, 后置于1×PBS溶液中漂洗5次将体表黏液洗净, 每次40 min。完成漂洗的样本梯度酒精脱水(75%→85%→90%→95%→100%), 各梯度20 min (95%→100%脱水两次, 每次5 min), Emitech K850干燥仪中临界点干燥, Hitachi E-1010喷金仪中喷金, HITACHI S-3400N扫描电镜观察拍照。神经丘形貌指标测量方法(长、宽与毛细胞数)同Webb(2013)。
1.5 数据处理神经丘形貌指标(长、宽与毛细胞数)均以平均值±标准差表示。使用t-检验(t-test)、单因素方差分析(One-Way ANOVA)与最小显著差异法多重比较(LSD)对各类神经丘形貌参数进行比较。数据比较使用SPSS 22软件(IBM)完成, 数据显著性判定标准为P < 0.05。
2 结果与分析 2.1 后部侧线系统发育 2.1.1 躯干侧线系统4 dpf仔鱼未观察到躯干神经丘(图 1a); 6 dpf时, 在仔鱼躯干观察到一组躯干神经丘(L1—L6)(图 1b)。9 dpf仔鱼在躯干上有一行神经丘(L1—L7), 相邻神经丘间隔约6—7个体节(图 1c); 12 dpf时新增4—5个神经丘位于L1和L2神经丘间隔处, 形成每一体节一个神经丘的排列方式(图 1d); 16 dpf, 新生神经丘生长在早期神经丘(L1—L3)之间(图 1e), 保持每一体节一个的排列(图 1f), 但后方早期神经丘间隔处(L4—L7)尚未出现新生神经丘(图 1g); 23 dpf, 已生成的神经丘逐渐降于水平肌隔之下, 同时以每一体节一个的排列规律由鳃盖后方延伸至尾柄基部(R0)(图 2a), 此时在躯干前部已出现一行神经丘平行于早期神经丘(R1), 2—3个体节分布一个神经丘(图 2b); 在30 dpf时, 躯干神经丘明显分为两行: 2—3个体节分布一个神经丘的上行(R1)和一个体节分布一个的下行(R0) (图 2c, 图 3a); 37 dpf时, R1的神经丘已延伸至尾部, 此时, 躯干侧线管道尚未开始建立(图 2d)。
 |
| 图 1 鳜仔稚鱼期躯干侧线系统发育 Fig. 1 Post-embryonic development of the trunk lateral line system from larvae to juvenile 注: a. 4 dpf; b. 6 dpf, 神经丘(L1—L6); c. 9 dpf, 神经丘(L1—L7); d. 12 dpf, 在神经丘L1和L2之间出现了4—5个神经丘; e. 16 dpf, 神经丘(L1—L3)之间被新生神经丘填满; f. 16 dpf; g. 16 dpf, 大部分样本中(80%)神经丘L3之后并未出现新神经丘。a—d中比例尺=10 mm, e中比例尺=20 mm, f—g中比例尺=50 mm |
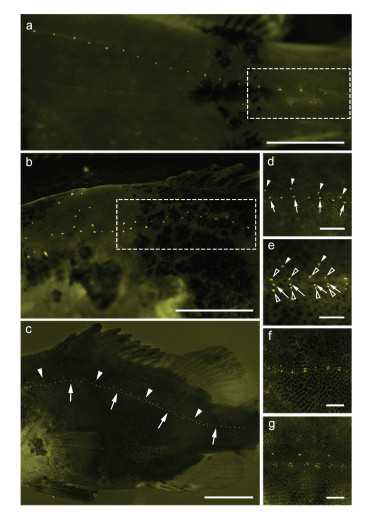 |
| 图 2 鳜稚幼鱼期躯干侧线系统发育 Fig. 2 Development of the trunk lateral line system from juvenile to young fish 注: a. 23 dpf, 每一体节均有一神经丘附于其上(方框所示); b. 23 dpf, 前部新出现一行神经丘(方框所示); c. 30 dpf, 躯干神经丘分为两行:上行(R1) (箭头所示), 两体节分布一个神经丘, 下行(R0) (箭标所示); d. 37 dpf, 侧线管尚未开始建立; e. 44 dpf, 下行基础神经丘(R0)以出芽方式生成附属神经丘(空心箭头), 新生附属神经丘在上下方向垂直R0排列, 位于游离神经丘R1 (箭头)之下; f. 51 dpf, R0神经丘下陷; g. 58 dpf, 躯干侧线管道系统建立。a—c中比例尺=10 mm, d—g中比例尺=2 mm |
 |
| 图 3 躯干侧线系统建立的组织学分析 Fig. 3 Histological analysis of trunk lateral line canal establishment 注: a. 30 dpf.图(a→d)方向一致; b. 42 dpf; c. 45 dpf幼鱼, 躯干上前体管道神经丘周围已出现沟状结构(箭头), 上下部附属神经丘已独立于R0前体管道神经丘; d. 56 dpf, 侧线管道基本愈合。a—d中比例尺=100 μm |
R0的神经丘在侧线发育中经历了两次重要变化, 首先, 基础神经丘(R0)通过出芽的方式在上下方向各生成一个附属神经丘(44 dpf) (图 2e, 图 3b); 其次, 整个R0的神经丘在50—55 dpf时期开始下沉(图 2f, 图 3c), 此时躯干侧线系统管道结构开始建立; 58 dpf, 躯干已出现完整的侧线系统管道系统, 而通过R0的基础神经丘出芽生成的位于R0上方与下方、平行于R0的附属神经丘, 已成为平行于躯干侧线管道的游离神经丘(图 2g, 图 3d)。
2.1.2 尾鳍侧线系统尾鳍部分侧线结构的发育出现于9 dpf, 在尾柄基部出现一终端神经丘(T0) (图 4a), 12 dpf时T0出现下移(图 4b); 16 dpf尾部鳍条出现于尾柄以下, 同时尾部脊轴上翘, T0出现分散, 80%的稚鱼在尾柄处有三个上下排列的神经丘(图 4c); 19 dpf尾柄的脊轴上翘明显, 大部分稚鱼此时在尾部脊轴下方均出现鳍条和沿着脊轴方向的三个终端神经丘(T1, T2, T3) (图 4d); 21 dpf时尾部结构已和成鱼相似, 尾鳍鳍条均匀分布, 尾柄基部由上至下依次排列着神经丘T1, T2, T3 (图 4e); 23 dpf时T1, T2, T3神经丘分别向后出芽生成附属神经丘(图 4f)。37 dpf, 尾鳍神经丘已出现明显排布规律, 在背侧、腹侧方向各出现两列神经丘(背部两列, C1和C2; 腹部两列, C3和C4), 同时一短行神经丘C0位于C2与C3之间(图 4g); 44 dpf时尾鳍神经丘排列特征已趋于稳定(图 4h)。
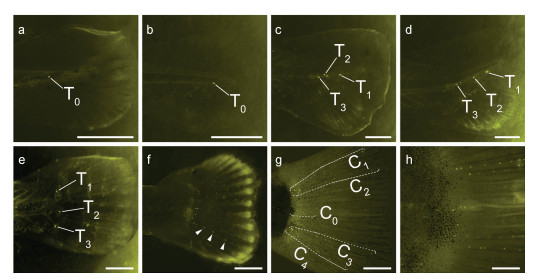 |
| 图 4 尾鳍侧线系统发育 Fig. 4 Post-embryonic development of caudal fin lateral line 注: a. 9 dpf; b. 12 dpf; c. 16 dpf; d. 19 dpf; e. 21 dpf; f. 23 dpf, 箭头为附属神经丘; g. 37 dpf, 尾鳍上下方向各有两行神经丘(背侧为C1和C2, 腹侧为C3和C4), 另有一短行神经丘(C0)平行于脊轴分布于中间; h. 44 dpf。Tn.终末神经丘。a—d中比例尺=500 μm, e—h中比例尺=1 mm |
后部管道神经丘与表面神经丘建立之初形状均为圆形, 此时二类神经丘表面并无明显分区, 感受带与神经丘大小相同(图 5), 初期前体管道神经丘(5—10 dpf)平均长宽均为4—5 μm(表 1), 毛细胞数12—14(表 2); 表面神经丘初期较难识别, 16 dpf躯干观察到表面神经丘, 平均长宽均为6—8 μm, 毛细胞数10—15(图 5, 表 1, 表 2)。23 dpf前体管道神经丘表面出现分区, 以毛细胞组成的感受带分布于神经丘表面中心区域, 以支持细胞与套细胞顶端构成的光滑表面环绕感受带, 延伸至神经丘外缘(图 5), 23 dpf前体管道神经丘成椭圆型, 长15—19 μm, 长宽比1.3—1.4, 神经丘及感受带长、宽均出现显著增长(P < 0.05)毛细胞数增至19—33, 之后前体管道神经丘继续生长, 此时神经丘、感受带大小显著增大(P < 0.05), 毛细胞数显著增长(P < 0.05)(表 1, 表 2); 37 dpf之后前体管道神经丘建立基本完成, 神经丘、感受带大小和毛细胞数已无明显变化(P > 0.05), 至51 dpf躯干侧线管道开始封闭之初, 前体管道神经丘呈长宽比为1.6的椭圆形, 长29—33 μm, 毛细胞数增至30—45(表 1, 表 2)。16—30 dpf表面神经丘生长明显, 神经丘、感受带大小显著增大(P < 0.05), 毛细胞数显著增长(P < 0.05), 30 dpf后发育基本完成, 神经丘、感受带大小和毛细胞数已无明显变化(P > 0.05)(表 1, 表 2), 表面神经丘在发育全过程中均呈圆形, 长宽比为0.9—1.1(图 5)。
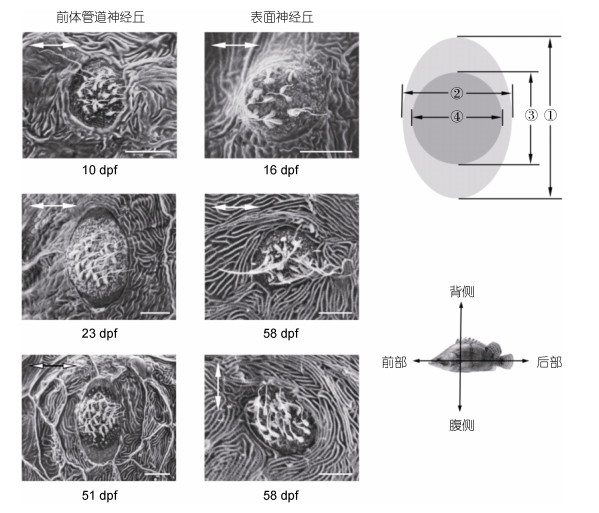 |
| 图 5 不同发育时期神经丘的超微结构 Fig. 5 Ultrastructural structure of neuromast during different developmental stage 注: ①神经丘长度, ②神经丘宽度, ③感受带长度, ④感受带宽度。神经丘方向均与右下角鳜的方向一致, 箭头方向为神经丘毛细胞敏感方向。比例尺=5 μm |
| 时期 | 长度(μm) | 宽度(μm) | 长宽比 | |||||
| 管道神经丘 CN(n=82) |
表面神经丘 SN(n=79) |
管道神经丘 CN(n=82) |
表面神经丘 SN(n=79) |
管道神经丘 CN(n=82) |
表面神经丘 SN(n=79) |
|||
| 6 dpf | 4.4±1.2A | ― | 4.5±0.5A | ― | 1.0±0.1A | ― | ||
| 10 dpf | 4.2±1.1A | ― | 4.5±0.7A | ― | 1.0±0.2A | ― | ||
| 16 dpf | 11.2±1.7Ba | 7.2±0.9Ab | 7.3±1.2Ba | 7.1±1.1Aa | 1.1±0.1Aa | 1.0±0.3Aa | ||
| 23 dpf | 17.2±2.6Ca | 8.0±1.1Ab | 12.3±1.8Ca | 7.2±0.9Ab | 1.4±0.1Ba | 1.1±0.3Ab | ||
| 30 dpf | 24.5±1.9Da | 11.1±1.1Bb | 16.0±2.1Ca | 10.4±1.0Bb | 1.6±0.1Ca | 1.0±0.2Ab | ||
| 37 dpf | 28.4±1.5Ea | 11.4±1.3Bb | 18.8±1.9Ca | 10.6±0.3Bb | 1.5±0.3Ba | 1.1±0.3Ab | ||
| 44 dpf | 30.5±1.3Fa | 12.4±0.8Bb | 19.4±1.6Da | 11.4±0.7Bb | 1.6±0.2Ca | 1.0±0.2Ab | ||
| 51 dpf | 31.4±2.1Fa | 11.6±0.7Bb | 19.8±2.1Da | 10.3±0.8Bb | 1.6±0.3Ca | 1.1±0.1Ab | ||
| 58 dpf | ― | 12.1±0.6B | ― | 11.3±0.4B | ― | 1.1±0.2A | ||
| 注:大写上标字母为同列数据比较(单因素方差分析与多重比较), 小写上标字母为二类神经丘特定形态参数同一时间的比较(t-检验), 字母不同表示具有显著差异(P < 0.05)。各形态参数测量方法如图 5所示 | ||||||||
| 时期 | 长度(μm) | 宽度(μm) | 长宽比 | 毛细胞数 | |||||||
| 管道神经丘 CN(n=82) |
表面神经丘 SN(n=79) |
管道神经丘 CN(n=82) |
表面神经丘 SN(n=79) |
管道神经丘 CN(n=82) |
表面神经丘 SN(n=79) |
管道神经丘 CN(n=82) |
表面神经丘 SN(n=79) |
||||
| 4 dpf | 4.4±1.2A | ― | 4.5±0.5A | ― | 1.0±0.1A | ― | 14.0±2.0A | ― | |||
| 10 dpf | 4.2±1.1A | ― | 4.5±0.7A | ― | 1.0±0.2A | ― | 12.3±3.6A | ― | |||
| 16 dpf | 11.2±1.7Ba | 7.2±0.9Ab | 7.3±1.2Ba | 7.1±1.1Aa | 1.1±0.1Aa | 1.0±0.3Aa | 23.2±11.4Ba | 13.5±2.5Ab | |||
| 23 dpf | 13.1±1.4Ba | 8.0±1.1Ab | 12.3±1.8Ca | 7.2±0.9Ab | 1.0±0.2Aa | 1.1±0.3Aa | 26.3±7.4Ba | 15.2±6.3Bb | |||
| 30 dpf | 17.5±1.8Ca | 11.1±1.1Bb | 14.1±1.2Da | 10.4±1.0Bb | 1.2±0.2Aa | 1.0±0.2Ab | 34.9±11.2Ca | 17.2±3.1Bb | |||
| 37 dpf | 23.4±1.6Da | 11.4±1.3Bb | 18.8±1.9Ea | 10.6±0.3Bb | 1.3±0.2Ba | 1.1±0.3Ab | 35.2±9.6Ca | 16.4±2.2Bb | |||
| 44 dpf | 27.6±1.5Ea | 12.4±0.8Bb | 19.4±1.6Ea | 11.4±0.7Bb | 1.4±0.3Ca | 1.0±0.2Ab | 37.4±11.4Da | 18.3±5.2Bb | |||
| 51 dpf | 27.7±1.6Ea | 11.6±0.7Bb | 19.8±2.1Ea | 10.3±0.8Bb | 1.4±0.2Ba | 1.1±0.1Ab | 36.5±8.9Da | 18.2±3.2Bb | |||
| 58 dpf | ― | 12.1±0.6B | ― | 11.3±0.4B | ― | 1.1±0.2A | ― | 17.9±3.1B | |||
| 注:大写上标字母为同列数据比较(单因素方差分析与多重比较), 小写上标字母为二类神经丘特定形态参数同一时间的比较(t-检验), 字母不同表示具有显著差异(P < 0.05)。各形态参数测量方法如图 5所示 | |||||||||||
管道神经丘建立过程中, 长轴始终垂直于躯干, 同时感受带长轴与神经丘长轴平行, 毛细胞敏感方向始终平行于躯干侧线管道方向(图 5)。表面神经丘毛细胞敏感方向在躯干横轴(前部↔后部)与纵轴(背侧↔腹侧)均具有, 并交替排列在侧线管道周边, 尾鳍上表面神经丘毛细胞敏感方向与躯干相似(图 5)。
3 讨论 3.1 鳜后部侧线系统主要发育过程与特点鳜后部侧线系统胚后发育在6—10 dpf期间躯干已出现前体管道神经丘(L1—L7), 12 dpf以后后续新生神经丘以头部→尾部方向填于L1—L7前体管道神经丘之间形成一行神经丘R0, 23—37 dpf期间R0上方由头部→尾柄方向形成一行神经丘(R1), 44 dpf之后R0神经丘以出芽的方式在上下方向分化出附属神经丘。整个R0神经丘在50—55 dpf时期开始下沉, 躯干侧线管道开始建立, 58 dpf躯干侧线管道建立完成, 而之前来自R0两行附属神经丘与神经丘R1均成为表面神经丘。躯干管道神经丘在5—40 dpf结构逐渐完善, 数量持续上升, 至37 dpf基本发育完成, 在40—45 dpf所有前体管道神经丘布置完成, 后续发育过程中单侧数量稳定在120—140;表面神经丘自出现开始数量持续上升, 至58 dpf后部侧线系统单侧表面神经丘数量已达到380—450(图 6)。由此可知, 鳜后部侧线系统虽然在仔鱼初期已开始发育, 但需要长达两个月的时间完成主要发育(图 7)。鳜稚鱼后期至幼鱼阶段生活、捕食习性发生显著变化, 由仔鱼时期的趋光性主动摄食逐渐转为幼鱼及成鱼阶段底栖伏击型捕食, 而水体底层暗光、无光条件下侧线感觉对其捕食行为较为重要(魏开建等, 1996; 田文斐等, 2012; Zhang et al, 2019), 本研究中鳜仔鱼→幼鱼阶段后部侧线系统发育逐渐完善, 整体发育过程与鲈形目大部分鱼类, 如丽鱼科(Cichlidae)[如眼斑星丽鱼(Astronotus ocellatusl), 奥利亚罗非鱼(Oreochromis aureus), 九间波罗(Cichlasoma nigrofasciatum)](Webb, 1989b, 2013), 鲈科(Percoidea)[如梅花鲈(Acerina cernua)](Sato et al, 2017), 狼鲈科(Moronidae)[如七星鲈(Lateolabrax japonicus)](Sato et al, 2017), 天竺鲷科(Apogonidae)[如僻梭竺鲷(Cercamia eremia)、稻氏天竺鲷(Ostorhinchus doederleini)]等(Sato et al, 2017, 2019), 但鳜在稚鱼后期到幼鱼时期(23→58dpf)后部侧线系统神经丘结构变化、数量增长均较为明显, 同时侧线管道也在这一时期建立完成, 其后部侧线系统的发育为鳜本阶段底栖习性的逐渐形成提供了结构基础。
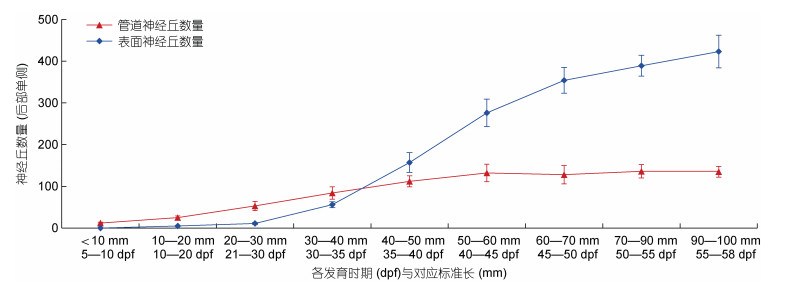 |
| 图 6 不同时期管道神经丘与表面神经丘的数量特点 Fig. 6 Quantitative characteristics of CN and SN at different stages |
 |
| 图 7 鳜后部侧线系统结构特点 Fig. 7 Structural characteristics of the posterior lateral system of mandarinfish 注:以58 dpf鳜幼鱼绘制(SL: 95—100 mm)。箭标. R0基础神经丘; 箭头. R1表面神经丘; 空心箭头.附属神经丘; 红点.管道神经丘; 蓝点.表面神经丘; 灰线.侧线管道; 白点.侧线管道孔 |
硬骨鱼类常通过增加特定感受方向敏感的神经丘数量来增强侧线系统某一方向上的感受能力, 如斑马鱼(Danio rerio), 表面神经丘垂直分布, 在躯干上形成了一道道垂直于体轴的拉链状的短列, 又如金鱼(Carassius auratus)大量毛细胞敏感方向垂直于体轴的表面神经丘分布于躯干表面, 是对垂直方向水体信息感知的结构性适应(Ledent, 2002; Schmitz et al, 2008; Webb, 2013), 同时, 某些鱼类神经丘结构出现特化, 如洞穴鱼(Astyanax mexicanus)神经丘内含大量毛细胞, 明显增大了神经丘感受带的面积, 而神经丘与水体接触的胶质顶大小直接由感受带大小决定, 这使得其具有极为灵敏的流体信息感知能力(Windsor et al, 2009; Yoshizawa et al, 2014)。鲈形目鱼类后部侧线系统常具有大量表面神经丘, 并成行或成列排布体表, 如鲈科(Percoidea)[如梅花鲈(Acerina cernua)](Sato et al, 2017), 狼鲈科(Moronidae)[如七星鲈(Lateolabrax japonicus)](Sato et al, 2017), 天竺鲷科(Apogonidae)[如僻梭竺鲷(Cercamia eremia)、稻氏天竺鲷(Ostorhinchus doederleini)]等(Sato et al, 2017, 2019), 而鳜后部侧线神经丘分布数量较少, 未见二类神经丘结构出现特化; 表面神经丘未见拉链状排列, 仅分布于侧线管道周边, 这点与鲈形目其他鱼类显著不同(图 7); 鳜尾鳍上表面神经丘数量也较少, 但躯干上由水平、垂直方向敏感的表面神经丘交替排列, 使鳜后部侧线系统具备了对水平、垂直方向流体信息感知, 同时, 表面神经丘集中分布于躯干背侧, 使鳜对上方环境的感知较为敏感。
3.3 躯干侧线管道结构特点硬骨鱼类躯干侧线管道结构多变, 随着栖息环境的不同, 在结构上常出现显著变化(Webb, 2013)。表层鱼类常在躯干腹侧形成一条平行于体轴的侧线管道, 如斑马鱼(Danio rerio)、蝴蝶鱼(Pantodon buchholzi)、飞鱼(Exocoetidae)等在躯干腹侧均有一条或几条侧线管道, 这种结构分布与下部流体信息的感知关系密切(Ledent, 2002; Schmitz et al, 2008; Webb, 2013), 底栖鱼类(如鮟鱇科、胆星鱼科)躯干侧线管道分布于背侧, 特定增强了后部侧线系统对上侧流体信息的感知(Marshall, 1996)。参考硬骨鱼类主要躯干侧线系统类型, 鳜躯干侧线管道系统中属于完整弓形结构(图 7), 属于鲈形目(Perciformes)鱼类常见类型, 但背侧方向的布置形式表明了鳜对其上侧水体中捕食目标的感知能力较强。
4 结论鳜后部侧线系统的胚后发育始于4—6 dpf初期仔鱼阶段, 经历长达两月完成主要发育, 而稚鱼后期到幼鱼期(23→58 dpf)后部侧线系统神经丘结构变化、数量增长均较为明显, 同时侧线管道也在这一时期建立完成, 这种结构变化与本阶段鳜逐渐底栖的习性相适应; 同时, 鳜后部侧线系统中, 侧线管道的背侧布置、神经丘结构与背侧分布均增强了其上层水体的感知能力, 上述结构特征与鳜底栖伏击型的捕食习性相适应。
田文斐, 钟俊生, 钱叶洲, 等. 2012. 鳜仔鱼视网膜及口腔齿的发育对摄食的适应. 上海海洋大学学报, 21(2): 190-198 |
孙海林, 孙成飞, 董浚键, 等. 2019. 翘嘴鳜转录组测序及SSR新标记的开发与应用. 基因组学与应用生物学, 38(10): 4413-4421 |
沈辉, 万夕和, 王李宝, 等. 2010. 3种肉食性鱼类的捕食及脊尾白虾防御行为比较. 水产养殖, 31(1): 40-42 DOI:10.3969/j.issn.1004-2091.2010.01.011 |
梁旭方. 1994. 鳜鱼视觉特性及其对捕食习性适应的研究Ⅱ.视网膜结构特性. 水生生物学报, 18(4): 376-377 DOI:10.3321/j.issn:1000-3207.1994.04.009 |
梁旭方. 1995a. 鳜鱼视觉特性及其对捕食习性适应的研究:Ⅲ.视觉对猎物运动和形状的反应. 水生生物学报, 19(1): 70-75 |
梁旭方. 1995b. 鳜捕食行为的研究. 海洋与湖沼, 26(5): 119-125 |
梁旭方. 1996. 鳜侧线管结构和行为反应特性及其对捕食习性的适应. 海洋与湖沼, 27(5): 457-462 DOI:10.3321/j.issn:0029-814X.1996.05.001 |
魏开建, 张海明. 1996. 鳜鱼视网膜发育的组织学研究. 华中农业大学学报, 15(3): 263-269 |
Bird N C, Webb J F, 2014. Heterochrony, modularity, and the functional evolution of the mechanosensory lateral line canal system of fishes. EvoDevo, 5: 21 DOI:10.1186/2041-9139-5-21 |
Brown E E A, Simmons A M, 2016. Variability of rheotaxis behaviors in larval bullfrogs highlights species diversity in lateral line function. PLoS One, 11(11): e0166989 DOI:10.1371/journal.pone.0166989 |
Butler J M, Maruska K P, 2015. The mechanosensory lateral line is used to assess opponents and mediate aggressive behaviors during territorial interactions in an African cichlid fish. Journal of Experimental Biology, 218(20): 3284-3294 DOI:10.1242/jeb.125948 |
Denton E J, Gray J A B, 1989. Some observations on the forces acting on neuromasts in fish lateral line canals. In: Coombs S, Görner P, Münz H eds. The Mechanosensory Lateral Line. New York, USA: Springer, 229-246
|
Dow E, Jacobo A, Hossain S et al, 2018. Connectomics of the zebrafish's lateral-line neuromast reveals wiring and miswiring in a simple microcircuit. eLife, 7: e33988 DOI:10.7554/eLife.33988 |
Ledent V, 2002. Postembryonic development of the posterior lateral line in zebrafish. Development, 129(3): 597-604 |
Liang X F, Oku H, Ogata H Y et al, 2001. Weaning Chinese perch Siniperca chuatsi (Basilewsky) onto artificial diets based upon its specific sensory modality in feeding. Aquaculture Research, 32(S1): 76-82 |
Münz H, 1989. Functional organization of the lateral line periphery. In: Coombs S, Görner P, Münz H eds. The Mechanosensory Lateral Line. New York, USA: Springer, 285-297
|
Marshall N J, 1996. Vision and sensory physiology the lateral line systems of three deep-sea fish. Journal of Fish Biology, 49(sA): 239-258 DOI:10.1111/j.1095-8649.1996.tb06079.x |
Montgomery J, Bleckmann H, Coombs S, 2013. Sensory ecology and neuroethology of the lateral line. In: Coombs S, Bleckmann H, Fay R R et al eds.. The Lateral Line System. New York, USA: Springer, 121-145
|
New J G, Kang P Y, 2000. Multimodal sensory integration in the strike-feeding behaviour of predatory fishes. Philosophical Transactions of the Royal Society B:Biological Sciences, 355(1401): 1321-1324 DOI:10.1098/rstb.2000.0692 |
Pichon F, Ghysen A, 2004. Evolution of posterior lateral line development in fish and amphibians. Evolution & Development, 6(3): 187-193 |
Sato M, Asaoka R, Nakae M et al, 2017. The lateral line system and its innervation in Lateolabrax japonicus (Percoidei incertae sedis) and two apogonids (Apogonidae), with special reference to superficial neuromasts (Teleostei:Percomorpha). Ichthyological Research, 64(3): 308-330 |
Sato M, Nakae M, Sasaki K, 2019. Convergent evolution of the lateral line system in Apogonidae (Teleostei:Percomorpha) determined from innervation. Journal of Morphology, 280(7): 1026-1045 DOI:10.1002/jmor.20998 |
Schmitz A, Bleckmann H, Mogdans J, 2008. Organization of the superficial neuromast system in goldfish, Carassius auratus. Journal of Morphology, 269(6): 751-761 DOI:10.1002/jmor.10621 |
Webb J F, 1989a. Gross morphology and evolution of the Mechanoreceptive lateral-line system in teleost fishes. Brain, Behavior and Evolution, 33(1): 34-53 DOI:10.1159/000115896 |
Webb J F, 1989b. Neuromast morphology and lateral line trunk canal ontogeny in two species of cichlids:An SEM study. Journal of Morphology, 202(1): 53-68 DOI:10.1002/jmor.1052020105 |
Webb J F, 2013. Morphological diversity, development, and evolution of the mechanosensory lateral line system. In: Coombs S, Bleckmann H, Fay R R et al ed. The Lateral Line System. New York, USA: Springer, 17-72
|
Windsor S P, McHenry M J, 2009. The influence of viscous hydrodynamics on the fish lateral-line system. Integrative and Comparative Biology, 49(6): 691-701 DOI:10.1093/icb/icp084 |
Worsham M, Fernandes V F L, Settle A et al, 2019. Behavioral tracking and neuromast imaging of Mexican cavefish. Journal of Visualized Experiments, 146: e59099 |
Yoshizawa M, Jeffery W R, 2011. Evolutionary tuning of an adaptive behavior requires enhancement of the neuromast sensory system. Communicative & Integrative Biology, 4(1): 89-91 |
Yoshizawa M, Jeffery W R, Van Netten S M et al, 2014. The sensitivity of lateral line receptors and their role in the behavior of Mexican blind cavefish (Astyanax mexicanus). Journal of Experimental Biology, 217(6): 886-895 DOI:10.1242/jeb.094599 |
Zhang R Q, Zhao J L, Zhao Y Y et al, 2019. Retinal development in mandarinfish Siniperca chuatsi and morphological analysis of the photoreceptor layer. Journal of Fish Biology, 95(3): 903-917 |
 2021, Vol. 52
2021, Vol. 52


