中国海洋湖沼学会主办。
文章信息
- 李喜莲, 顾志敏, 慎佩晶, 徐洋, 张宇飞, 高强, 程海华, 陈雪峰. 2021.
- LI Xi-Lian, GU Zhi-Min, SHEN Pei-Jing, XU Yang, ZHANG Yu-Fei, GAO Qiang, CHENG Hai-Hua, CHEN Xue-Feng. 2021.
- 基于RNA-seq技术的罗氏沼虾(Macrobrachium rosenbergii)不同组织转录组比较分析
- COMPARATIVE TRANSCRIPTOME ANALYSIS OF DIFFERENT TISSUES IN GIANT FRESHWATER PRAWNS (MACROBRACHIUM ROSENBERGII) BASED ON RNA-SEQ
- 海洋与湖沼, 52(1): 231-241
- Oceanologia et Limnologia Sinica, 52(1): 231-241.
- http://dx.doi.org/10.11693/hyhz20200600181
文章历史
-
收稿日期:2020-06-28
收修改稿日期:2020-07-27
罗氏沼虾(Macrobrachium rosenbergii), 又称淡水长臂大虾、马来西亚大虾, 动物学分类上属于节肢动物门(Arthropoda), 软甲纲(Malacostraca), 十足目(Decapoda), 长臂虾科(Palaemonidae), 沼虾属(Macrobrachium), 在各种类型的淡水和半咸水中都能生活, 易养殖且体型肥大, 肉质鲜美。因其适应能力强、生长速度快, 罗氏沼虾已成为我国重要的淡水养殖虾类之一。
近年来对罗氏沼虾的研究主要包括遗传多样性研究, 性腺发育、基因克隆及生长等方面的研究。其中在多样性研究中, 以微卫星为研究对象的如吕敏等(2019)研究异型雄性罗氏沼虾遗传多样性, 戴习林等(2017)对种群SSR分析中样本量及标记量对遗传多样性指标的影响进行分析; 或对各不同群体进行遗传多样性研究(董丁健等, 2020; 冯艺, 2018; 孙成飞等, 2015); 周晓敏等(2020)选取60个SNP位点对养殖群体和选育群体进行多样性研究。罗氏沼虾雌激素相关受体(Estrogen-related receptor, ERR)成为研究卵巢发育的一个重要基因(赵苗鑫等, 2017; 刘金磊, 2018; 刘金磊等, 2018)。药物对性腺分化及发育的影响研究主要包括壬基酚(薛海波, 2010; 李郁娇, 2011; 朱春华等, 2017; Guo et al, 2019)、十氯酮(Lafontaine et al, 2016, 2017)及三丁基锡(薛海波, 2010; 李郁娇, 2011; 吴维福等, 2013)这三种药物, 以期研究对罗氏沼虾卵黄蛋白原基因表达以及性腺发育的影响。Stalin等(2019)研究了钴-60射线对淡水对虾生殖障碍的影响; Tan等(2019)研究了罗氏沼虾性别逆转与雄激素腺(AG)的关系。罗氏沼虾基因研究集中在免疫相关(刘伟利等, 2017; 江婷佳, 2017; 邱庆庆等, 2019)、性别相关(俞炎琴, 2013; 姜建萍等, 2019; Abayed et al, 2019)、生长相关(叶成凯等, 2019; 邱庆庆, 2019; 杨光等, 2020; Dong et al, 2020)和酶类(田荣等, 2016; 张夏青等, 2016; 卢志杰等, 2019)。罗氏沼虾生长研究集中在药物对生长的影响(程安达等, 2019; 潘忠超等, 2019; Tadese et al, 2020)、微生态制剂(朱光来等, 2019; 赵臣泽, 2019)、生长环境(戴习林等, 2016; 陈建酬等, 2017; 何竺柳, 2018; 朱其建等, 2019; 张俊功, 2019; Chen et al, 2019; Dong et al, 2020; Manickam et al, 2020)、饲料中不同配比(杨树浩等, 2018; 杨景丰等, 2019; 张剑伟等, 2019; 单凡等, 2019; 黄黎明等, 2019; Feng et al, 2019)和不同品系生长对比试验(蒋飞等, 2013, 2014, 2016)。
随着高通量测序技术的发展, 转录组技术也应用于罗氏沼虾的研究中。郭梁等(2018)利用高通量测序技术和数字基因表谱等技术对感染螺原体的罗氏沼虾进行免疫通路相关基因及其差异表达分析, 获得转录本43405个; 严赛峰等(2018)、李俊杰等(2018)和邓泽森等(2018)对感染螺原体的罗氏沼虾高通量测序结果开展了SSR位点、SNP位点和重要免疫通路相关microRNA研究和分析; 李威霖(2018)对罗氏沼虾肢体再生组织进行了转录组及其差异表达基因研究, 得到Unigenes总数目为87783;王传聪等(2018)对罗氏沼虾肝胰腺组织转录组测序结果进行SSR检测与分析, 获得15356个SSR位点; 陈雪峰等(2019)采用Illumina HiSeqTM 4000高通量测序研究罗氏沼虾卵巢发育四个时期卵巢组织的差异, 卵巢发育四个时期共获得95379个Unigenes。Jiang等(2019a)通过高通量测序技术研究了罗氏沼虾雌性(ZW)、雄性(ZZ)和超雌个体(WW)的性腺差异。Pasookhush等(2019)采用转录组技术分析了罗氏沼虾幼虾感染新型冠状病毒的反应。Jiang等(2019b)对未成年雌虾和成年雌虾的眼柄组织进行转录组分析, 共获得53878个Unigenes; Cao等(2017)研究罗氏沼虾正常样本和WSSV感染样本的淋巴组织转录组, 分别获得73658和72374个Unigenes; Rao等(2016)分别研究了罗氏沼虾正常样本和WSSV感染样本的肝胰腺转录组, 共获得63584个Unigenes。
本研究以罗氏沼虾7个组织(眼柄、肝脏、卵巢、鳃、心脏、肌肉、精巢)为研究对象, 采用新一代高通量测序技术进行转录组测序分析, 通过Trinity软件组装、数据库功能注释、基因表达差异分析和SSR、SNP位点筛选, 获得罗氏沼虾分子遗传信息, 以期为进一步研究罗氏沼虾遗传多样性、功能基因及基因表达差异提供理论数据, 同时为深入研究罗氏沼虾生长阻滞现象提供一定的数据基础。
1 材料与方法 1.1 实验材料实验用罗氏沼虾(Macrobrachium rosenbergii)样品取自浙江省淡水水产研究所八里店综合试验基地, 体重为(5.34±1.22) g, 体长为(6.13±0.42) cm。样品经解剖后取各组织(眼柄、肝脏、卵巢、肝脏、心脏、肌肉、精巢), 共7个组织。每个组织取自3个个体(见表 1)。将分装好的样品迅速投入液氮中速冻, 置于–80℃冰箱中保存, 干冰运输。
| 序号 | 组织名称 | 样品命名 | 样品名称 |
| 1 | 眼柄 | Mrck-E | Mrck-E1, Mrck-E2, Mrck-E3 |
| 2 | 肝脏 | Mrck-L | Mrck-L1, Mrck-L2, Mrck-L3 |
| 3 | 卵巢 | Mrck-O | Mrck-O1, Mrck-O2, Mrck-O3 |
| 4 | 鳃 | Mrck-G | Mrck-G1, Mrck-G2, Mrck-G3 |
| 5 | 心脏 | Mrck-H | Mrck-H1, Mrck-H2, Mrck-H3 |
| 6 | 肌肉 | Mrck-M | Mrck-M1, Mrck-M2, Mrck-M3 |
| 7 | 精巢 | Mrck-T | Mrck-T1, Mrck-T2, Mrck-T3 |
各组织样品均选用3个个体的混合样组织, 使用TRIzol®试剂按照制造商的说明从各组织中提取总RNA (Invitrogen), 使用DNase I (TaKaRa)去除基因组DNA。使用Nanodrop ND-2000分光光度计(美国赛默飞)、Aglient 2100分析仪器对总RNA的纯度、浓度和完整性进行检测。RIN值> 7的RNA用于下游实验。
1.2.2 mRNA-seq文库构建和Illumina测序使用mRNA-seq样品制备试剂盒(Illumina, San Diego, CA)按照试剂说明书步骤构建了mRNA-seq文库和Illumina测序文库。
1.2.3 质量控制和从头转录组组装使用Fast QC程序(http://www.bioinformatics.babraham.ac.uk/projects/fastqc/)检查Illumina Hiseq 2500平台在校准前产生的原始序列读取的质量。低质量读数低于阈值质量20;将长度小于50 bp的reads以及包含适配序列、ploy-N和来自原始数据的测序引物的reads去除, 得到干净的reads同时, 对质控数据的误差率%、Q30、GC-含量%和sequence重复水平进行了评价。所有的后续分析和注释都依赖于高质量的clean reads。
使用Trinity (v 2.8.5)软件(https://sourceforge.net/projects/trinityrnaseq/)对质控后的数据进行从头组装, 获得转录本序列和Unigenes序列。最后, 只有长度≥300 bp的unique contigs才能用于组装后的下游研究。
1.2.4 生物信息学分析功能注释。拼接得到的Unigenes序列, 使用BLASTX比对(BLAST+2.7.1, 比对标准: E值不大于1e-5)与非冗余蛋白数据库(Non-Redundant Protein Sequence Database, NR)、SWISS-PROT蛋白质序列数据库(Manually Annotated and Reviewed Protein Sequence Database, SWISS-PROT)、基因本体数据库(Gene Ontology, GO)、直系同源蛋白数据库(Cluster of Orthologous Groups of Proteins, COG), 京都基因和基因组百科全书KEGG数据库比对。使用Trinity软件自带的ORF预测模块进行开发阅读框(ORF)预测。
1.2.5 差异表达分析通过Bowtie2软件将reads映射到组装的Unigenes序列, 使用RSEM软件根据比对结果来计算特定转录本的表达量水平。衡量基因表达水平的标准为RPKM值(Reads per kilobase of exon model per million mapped reads), 即每一百万条序列中, 每个基因以一千个碱基为单位, 比对上的reads个数。
使用DE-Seq软件分析各个组织之间的差异表达, 从而找到差异基因组。以差异倍数(Foldchange) > 2和假发现率(FDR)调整显著性值≤0.05为判断Unigenes表达显著性的阈值。利用GO、egg NOG、KEGG或thology (KO)和KEGG通路富集分析对DEGs进行分类, 并对潜在的生物学途径中的DEGs进行评价。GO和KEGG途径富集分析中P值小于0.05的过程、功能或成分在DEGs中被认为存在显著差异。
2 结果 2.1 原始测序数据质控及统计罗氏沼虾7个不同组织测序共得到344151324条原始序列, 质控后得到有效RNA-seq 311475706条。每个个体的测序量为6.65—9.04 Gb, 平均7.38 Gb。去除接头序列, 截去连续4个碱基平均质量值低于20的部分, 舍去长度少于50 bp的reads。共得到311475706条reads。过滤后每个个体的测序量为5.3—8.45 Gb, 平均6.60 Gb(见表 2)。每个个体的测序量为每4个碱基的平均质量值均大于20。
| 样品名称 | 质控后序列数量 | 质控后序列长度 | Q20(%) | Q30(%) |
| Mrck-E | 36325476 | 5337789559 | 99.26 | 97.60 |
| Mrck-L | 56796932 | 8451248007 | 98.99 | 96.68 |
| Mrck-O | 36328098 | 5342364405 | 98.39 | 94.47 |
| Mrck-G | 51370140 | 7655928756 | 98.36 | 94.31 |
| Mrck-H | 45010606 | 6710024684 | 98.36 | 94.31 |
| Mrck-M | 43240160 | 6439706561 | 98.36 | 94.41 |
| Mrck-T | 42404294 | 6319330011 | 98.34 | 94.33 |
转录本拼接后共获得95220个Unigenes, 总Unigenes长度为101401098 bp。总的转录本数量为145717个, 总的转录本长度为207379988 bp。每个Unigenes的平均长度为1064.9 bp, 最长的Unigenes长为36137 bp, N50值为1553。大部分功能基因长度分布在401—600 bp, 占比达到34.27%(见图 1)。
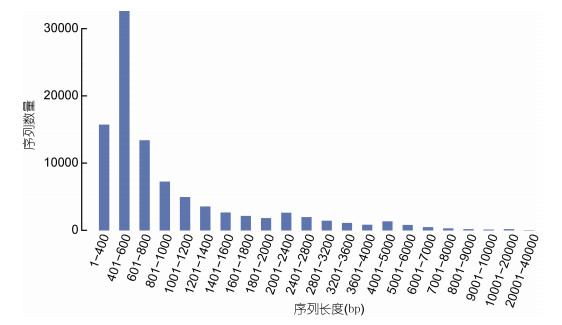 |
| 图 1 组装序列长度分布图 Fig. 1 Assembly sequence length distribution diagram |
在NR、GO、COG、KEGG、SWSS-PROT五个公共数据库中对获得的95220个Unigenes进行功能注释, 其余未在NR数据库中找到的Unigenes可能为新的蛋白。
根据GO数据库, 总共有18485个基因被归类到三个主要的GO类别中:生物过程、分子功能和细胞成分。其中, 以“细胞”(14938)、“细胞部分”(14925)、“细胞器”(10827)、“生物调节”(9861)为主(见图 2)。
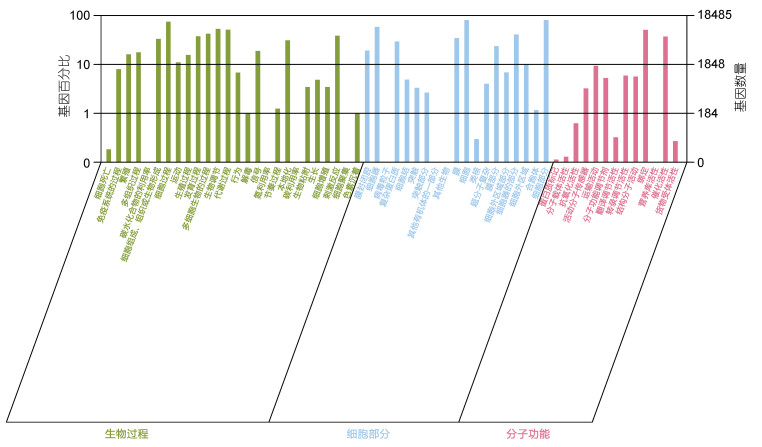 |
| 图 2 GO统计二级统计图 Fig. 2 Secondary chart of GO level 2 |
根据COG功能分类分成26类, 其中数量前三位的为功能未知2172个(13.56%), 信号转导机制2070个(12.92%), 翻译后修饰, 蛋白质转换, 伴侣1660个(10.36%)(见图 3)。
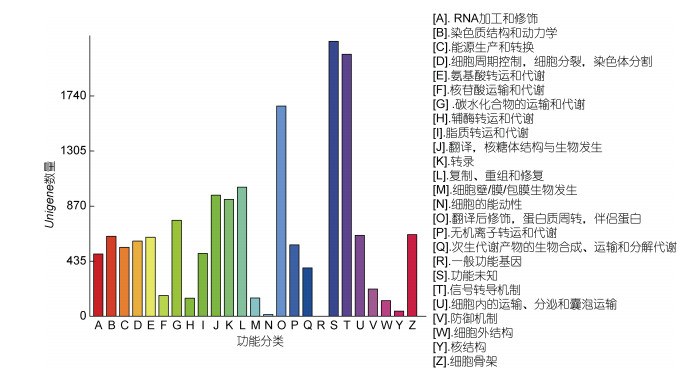 |
| 图 3 COG分类统计图 Fig. 3 COG classification statistical chart |
五个数据库NR、GO、COG、KEGG、SWSS-PROT分别注释到19881、18485、15798、9147、13684个Unigenes, 在NR数据库中比对注释的信息最多, 注释19881个Unigenes, 占比达20.88%。在NR、GO、COG、KEGG、SWSS-PROT五个数据库中都注释到的Unigenes有7848个(见图 4)。
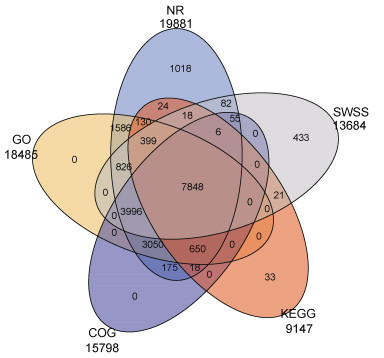 |
| 图 4 注释信息统计韦恩图 Fig. 4 Annotate the information with statistical Venn diagrams |
将基因根据参与的KEGG代谢通路分为5个分支(见图 5):细胞过程(A, Cellular Processes), 环境信息处理(B, Environmental Information Processing), 遗传信息处理(C, Genetic Information Processing), 代谢(D, Metabolism), 有机系统(E, Organismal Systems)。以上5个分支中含量的最多的类型分别为:全局和概率地图(Global and overview maps), 转化(Translation), 单组织过程(Signal transduction), 运输和分解代谢(Transport and catabolism)、内分泌系统(Endocrine system)。
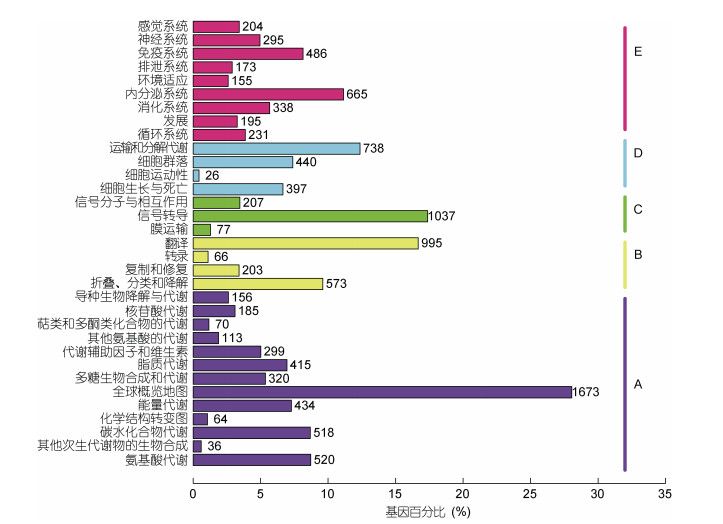 |
| 图 5 KEGG注释 Fig. 5 The KEGG annotation |
7个不同组织鉴定到的mRNA数量由多到少排序为: G(鳃) > T(精巢) > H(心脏) > L(肝脏) > E(眼柄) > O(卵巢) > M(肌肉)(见图 6)。在7个组织中共同表达的基因数为15260个。
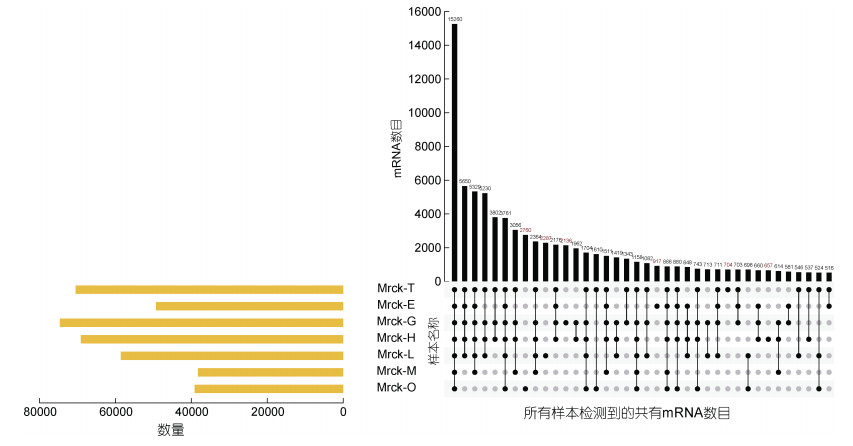 |
| 图 6 每个样本鉴定得到的mRNA Upset图 Fig. 6 The upstate map of mRNA from each sample 注:柱顶数字表示每个样本鉴定到的全部mRNA的数目; 横坐标所有点的连线表示所有样本鉴定到的共有mRNA的数目, 其余的单点或者多个点连线, 均表示相关样本中鉴定到的特有mRNA的数目 |
对罗氏沼虾转录组的KEGG分析显示, 9148个Unigenes被注释到330条KEGG通路中, 其中代谢途径(1578个)、核糖体(540个)、次生代谢物的生物合成(528个)通路数量居前三(见图 7)。
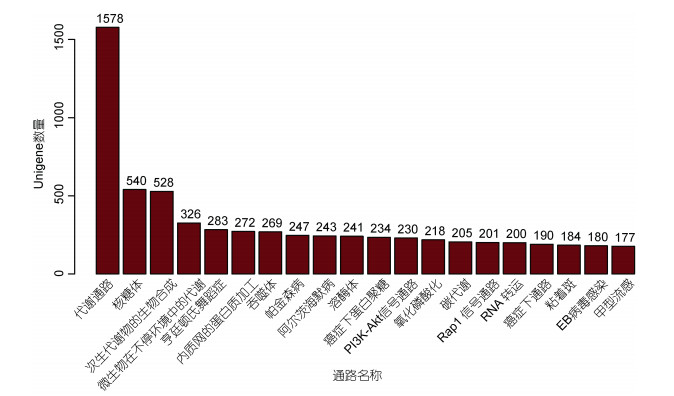 |
| 图 7 KEGG通路列表(前20) Fig. 7 The KEGG pathway list (Top 20) |
330条通路中, 其中信号通路包括: PI3K-Akt信号通路、Rap1信号通路、催产素信号通路、Hippo信号通路、MAPK信号通路、胰岛素信号通路、雌激素信号通路、Ras信号通路、甲状腺激素信号通路、钙信号通路、HIF-1信号通路、FoxO信号通路、生成信号通路、Wnt信号通路、PPAR信号通路、促性腺激素信号通路、趋化因子信号通路、Adipocytokine信号通路、点样受体信号通路、ErbB信号通路、mTOR信号通路、Jak-STAT信号通路、T细胞受体信号通路、p53信号通路、肿瘤坏死因子信号通路、VEGF信号通路、B细胞受体信号通路、Notch信号通路、催乳激素信号通路、NF-kappa B信号通路、Fc epsilon RI信号通路等。
2.6 SSR分析在得到的95220条序列中筛选SSR位点共找到SSR位点37751个, 这些位点存在于25520条序列中, SSR发生频率为26.80%。其中单条序列中含多个SSR位点的序列有7962条, 复合型的SSR位点3384个。SSR位点中单碱基重复、二碱基重复、三碱基重复、四碱基重复、五碱基重复、六碱基重复个数分别为14919(39.52%)、14715(38.98%)、7577、488、32和20, 其中单碱基和二碱基重复含量居第一和第二位(见图 8)。
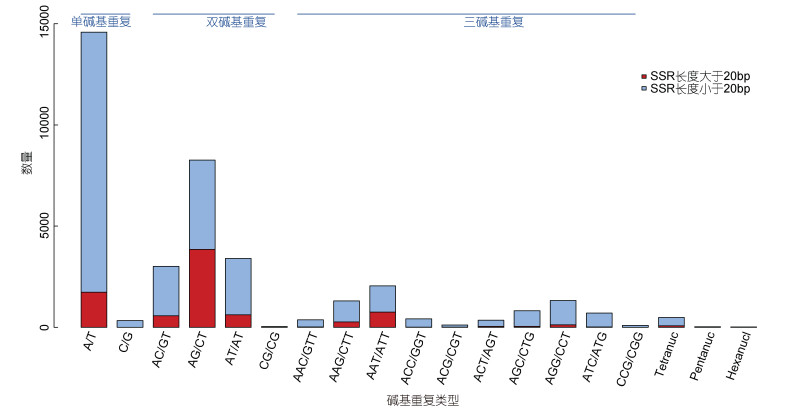 |
| 图 8 SSR位点的分布情况 Fig. 8 The distribution of SSR sites |
对获得的序列进行SNP位点分析, 共发现3228575个SNP标记(见表 3), 其中包括C:G- > A:T、C:G- > G:C、C:G- > T:A、T:A- > A:T、T:A- > C:G、T:A- > G:C6中类型, 其中T:A- > C:G和C:G- > T:A这两种碱基替换占比较高, 分别占总数的33.45%和33.36%。7个不同组织中发现的SNP位点数量在鳃(23.12%)上最高, 其次是心脏(17.89%)、精巢(17.51%)和肝脏(16.28%), 在肌肉组织中的SNP位点数量最少(5.43%)。
| 类型 | Mrck-E | Mrck-G | Mrck-H | Mrck-L | Mrck-M | Mrck-O | Mrck-T | 合计 |
| C:G- > A:T | 24923 | 62549 | 48000 | 42950 | 14379 | 29946 | 46525 | 269272 |
| C:G- > G:C | 16852 | 41514 | 31809 | 28520 | 9995 | 19613 | 31305 | 179608 |
| C:G- > T:A | 100152 | 250593 | 194474 | 178447 | 58143 | 106974 | 188259 | 1077042 |
| T:A- > A:T | 32833 | 81389 | 62392 | 54151 | 19734 | 38621 | 61688 | 350808 |
| T:A- > C:G | 102892 | 247796 | 192971 | 178419 | 58617 | 109014 | 190091 | 1079800 |
| T:A- > G:C | 26037 | 62621 | 47996 | 43274 | 14450 | 30211 | 47456 | 272045 |
| 合计 | 303689 | 746462 | 577642 | 525761 | 175318 | 334379 | 565324 | 3228575 |
随着转录组技术的迅速发展, 转录组技术被应用在水产动物的研究中。其中虾类转录组研究主要集中在差异基因的筛选和候选基因的发掘上。
红、黄和透明3种纯色米虾皮肤组织的转录组获得45434条Unigenes(林师, 2017)。波纹龙虾肝胰腺和卵巢组织进行了转录组测序获得Unigenes共74124个(李斌等, 2016)。脊尾白虾成虾样品及胚胎样品共获得47574条Unigenes(孙政, 2012)。
红螯螯虾肝脏、精巢和卵巢组织共获得了67369个Unigenes(李喜莲等, 2019); 次级卵黄发生时期卵巢组织共得到69261条Unigenes(康鹏飞, 2017)。
日本沼虾正常性成熟的和性早熟的卵巢组织中共获得63336个Unigenes(江红霞, 2017); 感染白斑综合征病毒(WSSV)个体的肝胰腺转录组共获得64049个Unigenes(赵才源等, 2018); 亚硝酸盐胁迫下肝脏共获得19022个Unigenes, 氨氮胁迫下肝脏组织共获得63453个Unigenes (于杰伦, 2019)。
凡纳滨对虾(Litopenaeus vannamei)五个早期发育时期(卵裂期、囊胚期、原肠期、肢芽幼体期发育至膜内无节幼体期)转录组测序, 共得到66815条Unigenes(隗健凯, 2015); 性腺组织获得Unigenes 65218个(韦嫔媛, 2017); 低温胁迫下肝胰腺组织获得50921条Unigenes (董丽君等, 2019)。
本研究从正常个体7个组织转录组文库中共获得99520个Unigenes, 这个数量较前人对于虾类转录组研究得到的Unigenes数量都高, 这可能与分析的组织数量大、覆盖面广有一定的关系。
3.2 功能注释本研究从七个组织共获得Unigenes 99520个, N501553, 平均长度为1064.9 bp。在五个数据库中注释到的Unigenes共有20368个, 占到总数的21.39%, 这比前人研究的转录组结果Unigenes的注释率都低。肝胰腺注释率31%和35.31%, 卵巢31.46%和54.44%, 眼柄29.3%, 淋巴器官29.46%, 再生肢体基部注释率37.23%。估计与本研究中首次对罗氏沼虾的心脏、肌肉、精巢和鳃等组织进行转录组高通量测序, 引入了较多在这几个组织中特异表达的基因, 这些新获得的序列在以上五个数据库中得不到注释, 从而降低了注释率。还有部分序列未能被注释, 可能与序列的长度有关, 过短的序列也会造成无法注释和分类; 无法注释的另一种可能是近缘物种序列信息的缺乏, 导致无法通过同源序列比对得到注释。
3.3 KEGG通路对罗氏沼虾转录组的KEGG分析显示, 9148个Unigeness被注释到KEGG数据库中并分布在330个已知途径中, 与免疫相关的通路如FoxO信号通路和Rap1信号通路。FoxO转录因子家族在细胞生理事件中调控基因的表达, 包括凋亡、细胞周期控制、葡萄糖代谢、氧化应激抵抗和寿命。FoxO蛋白的一个主要调控机制是对磷脂酰肌醇3激酶(PI3K)下游的丝氨酸苏氨酸激酶Akt/蛋白激酶B(Akt/PKB)进行磷酸化, 这是对胰岛素或几种生长因子的反应。FoxO信号通路在本研究结果中涉及93个Unigeness。Rap1是一种小型GTPase, 它控制多种过程, 如细胞黏附, 细胞-细胞连接的形成和细胞极性。Rap1通过调节多种细胞类型中整合素等黏附分子的功能, 在细胞-细胞和细胞-基质相互作用的控制中发挥主导作用。Rap1还以高度依赖于细胞类型的方式调控MAPK活性。Rap1信号通路在本研究中共涉及201个Unigeness。这些结果的获得都将为进一步研究罗氏沼虾抗性相关基因提供科学依据。
4 结论本研究对罗氏沼虾7个不同组织的转录组数据进行分析, 获得99520个Unigenes, 这比单一组织或较少组织受到环境胁迫或细菌、病毒感染获得数据具有较高的可信度, 这一结果将大大丰富罗氏沼虾的基因数据库资源。与此同时, 20368个Unigenes在五大数据库中得到注释。各个组织间差异基因也得到进一步的分析, 本研究还筛选得到大量的SSR位点和SNP位点, 这些分子标记也将在后续罗氏沼虾分析标记的开发中起到重要的作用, 为进一步深入挖掘和开发利用罗氏沼虾功能基因提供参考。
于杰伦, 2019.日本沼虾免疫应答相关基因的筛选与鉴定.泰安: 山东农业大学博士学位论文
|
王传聪, 唐修阳, 项杰, 等. 2018. 罗氏沼虾转录组SSR标记信息分析. 江苏农业科学, 46(22): 56-59 |
韦嫔媛, 2017.凡纳滨对虾(Litopenaeus vannamei)亲虾性腺转录组分析及雌雄性腺差异表达基因鉴定.南宁: 广西大学硕士学位论文
|
邓泽森, 欧江涛, 王资生, 2018.罗氏沼虾重要免疫通路相关microRNA的转录组系统解析.见: 中国生物工程学会第十二届学术年会暨2018年全国生物技术大会论文集.长沙: 中国生物工程学会, 252-253
|
卢志杰, 叶成凯, Sarath Babu V, 等. 2019. 罗氏沼虾谷氨酰胺合成酶基因的克隆与表达. 水产学报, 43(3): 549-562 |
田荣, 许婷, 潘晓艺, 等. 2016. 罗氏沼虾幼体精氨酸激酶基因的cDNA克隆及其在双顺反子病毒感染后的表达特征. 水生生物学报, 40(5): 908-913 |
冯艺, 2018.罗氏沼虾养殖群体的形态学及多样性研究.佛山: 佛山科学技术学院硕士学位论文, 92
|
吕敏, 黄光华, 李旻, 等. 2019. 异型雄性罗氏沼虾遗传多样性的微卫星分析. 水产科学, 38(3): 355-360 |
朱光来, 齐富刚, 王东博, 等. 2019. 益生菌对罗氏沼虾生长性能和水质的影响. 中国饲料, (20): 97-101 |
朱其建, 鞠波, 戴习林. 2019. 亚硝态氮对罗氏沼虾存活率、生长及能量代谢的影响. 水产科技情报, 46(1): 14-18 |
朱春华, 刘金磊, 李郁娇等, 2017.壬基酚对罗氏沼虾卵黄蛋白原基因表达以及性腺发育的影响.见: 2017年中国水产学会学术年会论文摘要集.南昌: 中国水产学会, 205
|
刘伟利, 刘红, 丁福江等, 2017.罗氏沼虾TLRs基因表达差异分析.南方农业学报, 48(4): 721-727
|
刘金磊, 2018.雌激素相关受体(ERR)对雌性罗氏沼虾生殖的影响.湛江: 广东海洋大学硕士学位论文
|
刘金磊, 邓思平, 江东能, 等. 2018. ERR-dsRNA对罗氏沼虾卵巢中ERR及生殖相关基因表达的影响. 广东海洋大学学报, 38(3): 8-16 DOI:10.3969/j.issn.1673-9159.2018.03.002 |
江红霞, 2017.日本沼虾雌性性早熟相关基因的筛选、克隆、表达与功能分析.杨凌: 西北农林科技大学博士学位论文
|
江婷佳, 2017.罗氏沼虾四种不同DnaJ基因克隆及表达分析.杭州: 中国计量大学硕士学位论文
|
孙政, 张晓军, 张继泉等, 2012.脊尾白虾转录组分析及重要功能基因的发掘.见: 中国海洋湖沼学会第十次全国会员代表大会暨学术研讨会.青岛: 中国海洋湖沼学会, 中国科学院海洋研究所, 119
|
孙成飞, 叶星, 董浚键, 等. 2015. 罗氏沼虾6个养殖群体遗传多样性的微卫星分析. 南方水产科学, 11(2): 20-26 DOI:10.3969/j.issn.2095-0780.2015.02.003 |
严赛峰, 欧江涛, 王资生, 2018.利用转录组技术系统挖掘罗氏沼虾免疫相关SNP标记.见: 中国生物工程学会第十二届学术年会暨2018年全国生物技术大会论文集.长沙: 中国生物工程学会, 245-246
|
李斌, 梁华芳, 陈兆明, 2016.波纹龙虾转录组分析与C-型凝集素的初步研究.见: 2016年中国水产学会学术年会论文摘要集.成都: 中国水产学会, 四川省水产学会, 17
|
李郁娇, 2011.壬基酚与三丁基锡对罗氏沼虾免疫因子、卵黄蛋白原基因表达和性腺发育的影响.湛江: 广东海洋大学硕士学位论文
|
李威霖, 2018.罗氏沼虾肢体再生转录组及其差异表达基因的基础研究.湛江: 广东海洋大学硕士学位论文
|
李俊杰, 欧江涛, 王资生, 2018.利用转录组技术系统挖掘罗氏沼虾SSR标记信息.见: 中国生物工程学会第十二届学术年会暨2018年全国生物技术大会.长沙: 中国生物工程学会, 243-244
|
李喜莲, 郭建林, 黄振远, 等. 2019. 红螯螯虾转录组高通量测序及分析. 四川农业大学学报, 37(2): 241-246, 265 |
杨光, 秦真东, 赵丽娟, 等. 2020. 罗氏沼虾细胞色素P450家族CYP302a1基因克隆及其在蜕皮周期中的表达. 水产学报, 44(04): 562-574 |
杨树浩, 冯艺, 陈建酬, 等. 2018. 不同比例的生物饲料对罗氏沼虾生长、消化酶和免疫酶活性的影响. 饲料工业, 39(2): 18-25 |
杨景丰, 郭子好, 蔡修兵, 等. 2019. 大豆抗原蛋白对罗氏沼虾生理生化及免疫的影响. 中国水产科学, 26(2): 322-332 |
吴维福, 李郁娇, 黎东, 等. 2013. 三丁基锡对罗氏沼虾卵黄蛋白原(VTG)表达和性腺发育的影响. 渔业科学进展, 34(4): 77-83 DOI:10.3969/j.issn.1000-7075.2013.04.011 |
邱庆庆, 袁翔, 黄光华, 等. 2019. 罗氏沼虾热休克蛋白HSP90基因的克隆及表达分析. 黑龙江畜牧兽医, (19): 153-157, 185 |
何竺柳, 2018.低盐度胁迫对罗氏沼虾生长和肉质的影响.舟山: 浙江海洋大学硕士学位论文
|
张俊功, 2019.温度及雌雄配比对罗氏沼虾能量代谢和生长的影响.上海: 上海海洋大学硕士学位论文
|
张剑伟, 王恒志, 张新党, 等. 2019. 饲料中添加不同梯度珍珠露水草提取物对罗氏沼虾生长、蛋白质代谢和肌肉营养成分的影响. 中国农学通报, 35(7): 158-164 |
张夏青, 许建和, 潘茜, 等. 2016. 罗氏沼虾组织蛋白酶D基因的克隆及其组织表达分析. 淮海工学院学报(自然科学版), 25(4): 71-77 DOI:10.3969/j.issn.1672-6685.2016.04.016 |
陈建酬, 高腾, 张济培, 等. 2017. 养殖密度和投饵策略对罗氏沼虾幼体生长发育的影响. 江西农业学报, 29(1): 92-95, 101 |
陈雪峰, 王春琳, 顾志敏, 等. 2019. 罗氏沼虾(Macrobrachium rosenbergii)卵巢发育不同时期转录组分析. 海洋与湖沼, 50(2): 398-408 |
林师, 2017.中华锯齿米虾色素沉积相关基因的发掘与证明.厦门: 集美大学硕士学位论文
|
周晓敏, 戴习林, 2020.罗氏沼虾SNP标记筛选及不同群体的遗传多样性.水产学报, https://www.cnki.net/KCMS/detail/31.1283.S.20200331.1205.006.html
|
单凡, 刘波, 孙存鑫, 等. 2019. 饲料维生素E含量对罗氏沼虾生长性能、血清生化指标和肌肉品质的影响. 动物营养学报, 31(1): 214-225 DOI:10.3969/j.issn.1006-267x.2019.01.027 |
赵才源, 钱珺, 傅洪拓等, 2018.白斑综合症病毒(WSSV)侵染日本沼虾肝胰腺的转录组研究.见: 2018年中国水产学会学术年会论文摘要集.西安: 中国水产学会, 199
|
赵臣泽, 2019.微生态制剂对罗氏沼虾生长、免疫及肠道健康的影响研究.扬州: 扬州大学硕士学位论文
|
赵苗鑫, 陈华谱, 刘金磊, 等. 2017. 罗氏沼虾雌激素相关受体(ERR)基因原核表达与纯化. 广东海洋大学学报, 37(1): 108-112 |
姜建萍, 袁翔, 邱庆庆, 等. 2019. 罗氏沼虾性别相关基因研究进展及其单性化养殖现状. 南方农业学报, 50(09): 2111-2118 |
俞炎琴, 2013.罗氏沼虾中性别发育相关基因Sxl和Dmrt基因的分子特征和功能研究.杭州: 浙江大学博士学位论文
|
郭梁, 季文博, 郝军等, 2018.感病罗氏沼虾免疫通路关键基因的转录组分析.见: 中国生物工程学会第十二届学术年会暨2018年全国生物技术大会论文集.长沙: 中国生物工程学会, 中国生物工程学会, 138-148
|
黄黎明, 吕敏, 杨慧赞, 等. 2019. 不同糖源对罗氏沼虾生长性能和糖代谢的影响. 动物营养学报, 31(12): 5635-5644 |
康鹏飞, 2017.克氏原螯虾卵巢转录组分析及RDH13基因在发育过程中的作用.武汉: 华中师范大学硕士学位论文
|
隗健凯, 2015.组学解析凡纳滨对虾早期发育相关重要生物学过程的分子机制.北京: 中国科学院研究生院(海洋研究所)博士学位论文
|
董丁健, 戴习林. 2020. 罗氏沼虾不同群体世代遗传多样性的SSR分析. 南方农业学报, 51(2): 421-428 |
董丽君, 孟宪红, 孔杰, 等. 2019. 基于转录组分析筛选凡纳滨对虾低温胁迫下的差异表达基因. 中国水产科学, 26(1): 161-171 |
蒋飞, 戴习林, 丁福江, 等. 2016. 罗氏沼虾4个不同群体的生长和存活率比较. 河北渔业, (6): 12-14 |
蒋飞, 戴习林, 朱其建等, 2013.罗氏沼虾5个专门化品系选择系F2生长比较及其遗传结构分析.见: 2013年中国水产学会学术年会论文集.合肥: 中国水产学会, 49
|
蒋飞, 戴习林, 朱其建, 等. 2014. 罗氏沼虾5个专门化品系选择系生长比较及其遗传结构分析. 上海海洋大学学报, 23(3): 329-337 |
程安达, 吕慧源, 姚嘉赟, 等. 2019. 一种中药复方制剂在饲料中长期添加对罗氏沼虾生长及免疫功能的影响. 饲料研究, 42(6): 12-16 |
潘忠超, 李志华, 孙凤刚, 等. 2019. 植物甾醇对罗氏沼虾生长性能、消化酶、肌肉品质及氨基酸组成的影响. 江西水产科技, (6): 3-7 |
薛海波, 2010.环境内分泌干扰物对罗氏沼虾生长发育及组织结构的影响.湛江: 广东海洋大学硕士学位论文
|
戴习林, 刘洁, 李晶晶, 等. 2017. 罗氏沼虾种群SSR分析中样本量及标记量对遗传多样性指标的影响. 水产学报, 41(7): 1083-1095 |
戴习林, 周梦颖, 鞠波, 等. 2016. 养殖密度对罗氏沼虾生长、性别分化与性腺发育的影响. 水产学报, 40(12): 1874-1882 |
Abayed F A A, Manor R, Aflalo E D et al, 2019. Screening for Dmrt genes from embryo to mature Macrobrachium rosenbergii prawns. General and Comparative Endocrinology: 282 DOI:10.1016/j.ygcen.2019.06.009 |
Cao J, Wu L, Jin M et al, 2017. Transcriptome profiling of the Macrobrachium rosenbergii lymphoid organ under the white spot syndrome virus challenge. Fish & Shellfish Immunology, 67: 27-39 |
Chen T, Lv M, Wu Y G et al, 2019. A new growth curve model for giant freshwater prawn Macrobrachium rosenbergii in a prawn-plant symbiotic system. Ecological Modelling, 411: 108801 DOI:10.1016/j.ecolmodel.2019.108801 |
Dong X X, Liu Q G, Kan D Q et al, 2020. Effects of ammonia-N exposure on the growth, metabolizing enzymes, and metabolome of Macrobrachium rosenbergii. Ecotoxicology and Environmental Safety, 189: 110046 DOI:10.1016/j.ecoenv.2019.110046 |
Feng P F, He J Z, Lv M et al, 2019. Effect of dietary Tenebrio molitor protein on growth performance and immunological parameters in Macrobrachium rosenbergii. Aquaculture, 511: 734247 DOI:10.1016/j.aquaculture.2019.734247 |
Guo H, Chen L L, Li G L et al, 2019. Accumulation and depuration of nonylphenol and its effect on the expressions of vitellogenin and vitellogenin receptor in freshwater prawn Macrobrachium rosenbergii. Bulletin of Environmental Contamination and Toxicology, 103(5): 729-733 |
Jiang J P, Yuan X, Qiu Q Q et al, 2019a. Comparative transcriptome analysis of gonads for the identification of sex-related genes in giant freshwater prawns (Macrobrachium rosenbergii) using RNA sequencing. Genes, 10(12): 1035 |
Jiang Q, Min Y, Yang H et al, 2019b. De novo transcriptome analysis of eyestalk reveals ovarian maturation related genes in Macrobrachium rosenbergii. Aquaculture, 505: 280-288 |
Lafontaine A, Gismondi E, Dodet N et al, 2017. Bioaccumulation, distribution and elimination of chlordecone in the giant freshwater prawn Macrobrachium rosenbergii:Field and laboratory studies. Chemosphere, 185: 888-898 |
Lafontaine A, Hanikenne M, Boulangé-Lecomte C et al, 2016. Vitellogenin and vitellogenin receptor gene expression and 20-hydroxyecdysone concentration in Macrobrachium rosenbergii exposed to chlordecone. Environmental Science and Pollution Research, 23(20): 20661-20671 |
Manickam N, Bhavan P S, Santhanam P et al, 2020. Influence of wild mixed zooplankton on growth and muscle biochemical composition of the freshwater prawn Macrobrachium rosenbergii post larvae. Aquaculture, 522: 735110 DOI:10.1016/j.aquaculture.2020.735110 |
Pasookhush P, Hindmarch C, Sithigorngul P et al, 2019. Transcriptomic analysis of Macrobrachium rosenbergii (giant fresh water prawn) post-larvae in response to M. rosenbergii nodavirus (MrNV) infection:de novo assembly and functional annotation. BMC Genomics, 20(1): 762 |
Rao R, Bhassu S, Bing R Z Y et al, 2016. A transcriptome study on Macrobrachium rosenbergii hepatopancreas experimentally challenged with white spot syndrome virus (WSSV). Journal of Invertebrate Pathology, 136: 10-22 |
Stalin A, Suganthi P, Mathivani S et al, 2019. Effect of cobalt-60 gamma radiation on reproductive disturbance in freshwater prawn Macrobrachium rosenbergii (De Man, 1879).. Toxicology Reports, 6: 1143-1147 |
Tadese D A, Sun C X, Liu B et al, 2020. Combined effects of emodin and Clostridium butyricum on growth and non-specific immunity of giant freshwater prawns, Macrobrachium rosenbergii. Aquaculture, 525: 735281 DOI:10.1016/j.aquaculture.2020.735281 |
Tan K, Jiang H G, Jiang D H et al, 2019. Sex reversal and the androgenic gland (AG) in Macrobrachium rosenbergii:A review. Aquaculture and Fisheries, 4(6) DOI:10.1016/j.aaf.2019.11.004 |
 2021, Vol. 52
2021, Vol. 52


