中国海洋湖沼学会主办。
文章信息
- 钱宝英, 卢明敏, 钱鸿基, 潘宇奇, 林乐琪, 徐芳英, 施港归, 齐鑫. 2021.
- QIAN Bao-Ying, LU Ming-Min, QIAN Hong-Ji, PAN Yu-Qi, LIN Le-Qi, XU Fang-Ying, SHI Gang-Gui, QI Xin. 2021.
- 急性Pb2+胁迫对大口黑鲈(Micropterus salmoides)幼鱼Hippo信号通路基因表达的影响
- EFFECT OF ACUTE Pb2+ STRESS ON THE EXPRESSION OF GENES INVOLVED IN HIPPO SIGNALING PATHWAY IN JUVENILE LARGEMOUTH BASS MICROPTERUS SALMOIDES
- 海洋与湖沼, 52(1): 242-251
- Oceanologia et Limnologia Sinica, 52(1): 242-251.
- http://dx.doi.org/10.11693/hyhz20200700222
文章历史
-
收稿日期:2020-07-31
收修改稿日期:2020-09-22
铅为生物非必需的蓄积性重金属元素, 可通过食物链的生物级联放大效应在生物体内富集, 损害生物各组织器官, 已成为土壤及水域中的三种主要重金属污染物之一(Rajamanickam et al, 2008; 潘天扬等, 2016)。铅污染在水域表层沉积物中高于相应水相, 当环境条件变化时可缓慢释放至上层水相, 鱼类通过鳃呼吸及摄食底层水生动植物进入鱼体后引起其生长发育和繁殖异常、器官畸变或死亡, 且底栖或处于食物链顶端的水生生物体内铅蓄积程度高于非底栖生物(刘芳芳, 2013; 龙昱等, 2016)。进入鱼体内的铅离子不仅与蛋白质、酶等功能基团巯基结合而干扰其生理生化活动, 而且还在基因水平上诱导染色体失常(Ferraro et al, 2004), 引起DNA链损伤断裂及片段丢失(Hong et al, 2007; Sokolova et al, 2008; Zhang et al, 2008), 关键基因G6PDH、GST、铁蛋白基因以及β-球蛋白基因表达延时、mRNA表达量改变(Mager et al, 2008)。此外, 铅离子在一定程度上可造成鱼类细胞内染色质凝集、周边化、细胞质密度增加进而出现空泡后形成凋亡小体(项黎新等, 2001)。
Hippo信号通路由进化上高度保守的一系列激酶组成, 包括YAP/TAZ、Salvador、Lats1/2、MOB1, 调控细胞分化、增殖和凋亡、组织器官发育、肿瘤发生等(Song et al, 2019; 麻明彪等, 2020)。Hippo信号通路的激活/抑制与细胞生长密度紧密相关, 在高密度生长的细胞中, Hippo通路中激活的Lats1/2 (large tumor suppressor kinases1/2, 大型肿瘤抑制因子1/2)磷酸化转录共激活因子YAP/TAZ (Yes-associated protein/transcriptional coactivator with PDZ-binding motif, Yes相关蛋白/结合PDZ的转录共激活因子), 促使YAP/TAZ与14-3-3蛋白结合后定位于细胞质中, 被抑制转录共激活作用的YAP/TAZ进而导致蛋白质降解及细胞凋亡从而限制组织器官的过度生长(Zhao et al, 2007, 2010; Badouel et al, 2011); 而在低密度生长的细胞中, Hippo通路则呈抑制状态, YAP/TAZ易位进入细胞核与转录增强因子TEAD (TEA domain, TEA结构域)家族结合调控细胞增殖抑制凋亡的基因转录, 从而促进细胞生长和增殖(Zhao et al, 2011; Agarwala et al, 2015; Gibaul et al, 2016)。有研究表明, Lats1/2还可被抑癌蛋白MOB1 (Mps One Binder kinase activator-like1, 多磺酸粘多糖激酶激活剂1)磷酸化, 致使Lats1/2滞留于细胞质(Di Benedetto et al, 2016)。通路中KIBRA蛋白(kidney and brain expressed protein, 肾脑表达蛋白)又称为WWC1, 属WWC蛋白家族, 与FRMD蛋白(FERM domain-containing protein 1, FERM结构域蛋白)上游调节蛋白相互作用, 参与调节细胞增殖和细胞凋亡(Tepass, 2009; 宋林, 2019)。PP2A (protein phosphatase 2A, 蛋白磷酸酶2A)是丝氨酸/苏氨酸磷酸酶家族中其中一个蛋白磷酸酶, 广泛参与调控细胞周期、细胞增殖分化、信号转导、肿瘤细胞增殖转移等(孙奕等, 2018), 在Hippo通路中, PP2A在α-catenin的负调节下, 通过与14-3-3蛋白相互作用控制YAP1的磷酸化(Schlegelmilch et al, 2011)。
大口黑鲈(Micropterus salmoides)又名加州鲈, 为太阳鱼科(Ceutrarchidac)、黑鲈属(Micropterus), 以肉食为主的广温杂食性鱼类, 是我国重要的淡水养殖品种之一(石琼等, 2014), 在食物链中处于较高位置。又因大口黑鲈为底栖鱼类, 在铅污染水体中极易生物富集。水体中的铅离子通过大口黑鲈鳃呼吸进入循环系统, 因此在鳃中的蓄积量较高(阮晓等, 2001; Rogers et al, 2003)。此外, 鱼类在摄取鱼食同时吞咽铅离子, 小肠作为消化和吸收的主要部位, 铅离子极可能在小肠部位被吸收。肝脏是鱼类重要的消化代谢器官, 也是鱼类重要的生理指示器, 进入鱼体内的铅离子可引起肝细胞损伤或畸变。Ribeiro等(2014)发现铅可在Prochilodus lineatus的肝脏、鳃和肌肉组织中检测到铅离子。已有研究表明大口黑鲈幼鱼肝脏组织YAP/TAZ表达量在Pb2+浓度17.8 mg/L下急性胁迫96 h时显著上升(Qian et al, 2020), YAP/TAZ为Hippo信号通路核心基因, 目前对Pb2+胁迫后大口黑鲈Hippo信号通路中的其他关键基因表达变化的研究未见报道。本文在前期研究的基础上分析了96 h Pb2+不同浓度胁迫后的Lats1/2、MOB1、KIBRA、FRMD、14-3-3、TEAD和PP2A在肝脏、肌肉、鳃和小肠组织, 以及YAP/TAZ在肌肉、鳃和小肠组织中的表达变化。研究结果可为大口黑鲈幼鱼对Pb2+胁迫的分子响应机制研究提供一定的理论数据。
1 材料与方法 1.1 材料与取样大口黑鲈幼鱼[平均体重(3.0±0.2) g]购买自湖州淡水鱼苗种场, 随机分成18组养于120 L白色养殖箱, 每箱30尾。经停食适应2 d后, 每天早晚投喂大口黑鲈幼鱼专用饲料, 正常养殖7 d后开始进行胁迫实验。以Pb(NO3)2 (CAS: 10099 74-8, AR: 99%)制备的50 mg/L Pb2+溶液为母液, 稀释至不同的胁迫处理浓度10、17.8、31.6、56.2和100 mg/L, 其中以Pb2+ 0 mg/L为对照组, 每个浓度梯度三个平行, 每个浓度梯度共90尾, 胁迫期间正常投喂。胁迫处理96 h后, 从对照组和各浓度梯度胁迫组各取9尾大口黑鲈幼鱼(每个养殖箱取3尾, 一个浓度梯度共9尾), 经麻醉后取肝脏、肌肉、鳃和小肠组织, 样品保存于RNA组织保存液中, 存于–80℃冰箱备用。
1.2 基因表达分析采用组织总RNA抽提试剂盒6688-1(OMEGA, 广州)并根据试剂盒提供的说明书进行样品总RNA的提取, 1.2%琼脂糖凝胶检测总RNA完整性, 并用紫外分光光度计测定OD260和OD280, 分析总RNA浓度和纯度, 检测合格的总RNA保存于–80℃超低温冰箱备用。用PrimeScriptTM RT Reagent Kit with gDNA Eraser试剂盒(TaKaRa, 大连)并根据说明书进行cDNA第一链合成, 反转录产物保存于–20℃冰箱备用。
根据本实验室前期转录组测序获得的大口黑鲈Lats1/2、MOB1、KIBRA、FRMD、14-3-3、TEAD、PP2A和YAP/TAZ基因部分cDNA序列, 以β-actin(β列肌动蛋白)为内参基因, 用Primer premier 5.0设计引物并送北京六合华大合成。具体引物名称和序列见表 1。
| 基因 | 正向或反向 | 引物序列(5′—3′) |
| β-actin | 正向F | TGTAAGCCAACGCTGGAACA |
| 反向R | GGCTGGAGACCGCTAAACTT | |
| KIBRA | 正向F | AACTACAAGCTGGACGAGGC |
| 反向R | CGAGTAACCCACGGTTCCAA | |
| FRMD | 正向F | CCTCCTGCTGACGACATTCA |
| 反向R | ATTACGGAGGAGACCGTTGC | |
| MOB1 | 正向F | ACACCCGAAACAGACGAGAC |
| 反向R | AATATCGCTGGCAGGACGAG | |
| Lats1/2 | 正向F | GAGTCATGTGTCCAGCGGAA |
| 反向R | TTATCCGGCTCGGCATCTTC | |
| PP2A | 正向F | ACGAAATCAGCGTGGACAGT |
| 反向R | GTTCACAGGACGTCACCCAT | |
| YAP/TAZ | 正向F | GCCAAAGTTTTGGTGTCGCA |
| 反向R | GAGTGTTTCCTCGGCTGTGA | |
| 14-3-3 | 正向F | AGATGGCAGTTTTGGGGACT |
| 反向R | AGTGTGAGCTCATGGAGGTTG | |
| TEAD | 正向F | GAGTGTGTGGACATCAGGCA |
| 反向R | ATTGGCTGGTGACACCGTAG |
实时荧光定量PCR(qPCR)反应体系共20 μL, 包括SYBR Green (FastStart Universal SYBR Green Master, Roche) 9 μL, 10 μmol/L的正向和反向引物各0.6 μL, cDNA模板1 μL, DNase/RNase free的无菌H2O 8.8 μL。qPCR反应条件包括: 50℃ 2 min, 95℃预变性10 min, (95℃变性10 s, 58℃退火30 s, 72℃延伸20 s, 共40个循环), 最后进行熔解曲线分析。目的基因和内参基因扩增效率模板采用不同稀释倍数cDNA(1、10、100和1000倍)。采用2–ΔΔCt方法计算目的基因mRNA表达倍数变化(Schmittgen et al, 2008)。采用SPSS统计分析软件(版本21.0)对数据进行单因素方差分析(One-way ANOVA), 当P < 0.05时差异显著。最后用OriginPro作图软件(版本9.1)作图。
2 结果 2.1 大口黑鲈急性Pb2+胁迫处理后肝脏组织的表达分析以对照组(0 mg/L)各目的基因在大口黑鲈肝脏组织中的表达量作为参照, 96 h不同浓度Pb2+胁迫后, 肝脏组织中各基因表达量出现了不同的变化(图 1a, 1b)。Lats1/2表达量在胁迫浓度100 mg/L时相对对照组上调极显著, 在其他胁迫浓度下表达量变化不显著; MOB1、PP2A和TEAD表达量在不同浓度铅胁迫下总体上调, 在17.8和31.6 mg/L时表达量上升显著; 14-3-3表达量相比对照组总体呈上升, 并在17.8、31.6和56.2 mg/L时显著上调; KIBRA在17.8 mg/L时表达量上调极显著, 其他胁迫浓度下虽有升高但不显著; 基因FRMD mRNA表达量呈先下降后升高又下降的趋势, 在17.8 mg/L时显著上调, 在其他浓度虽有下调和上调趋势, 但与对照组相比变化不显著。
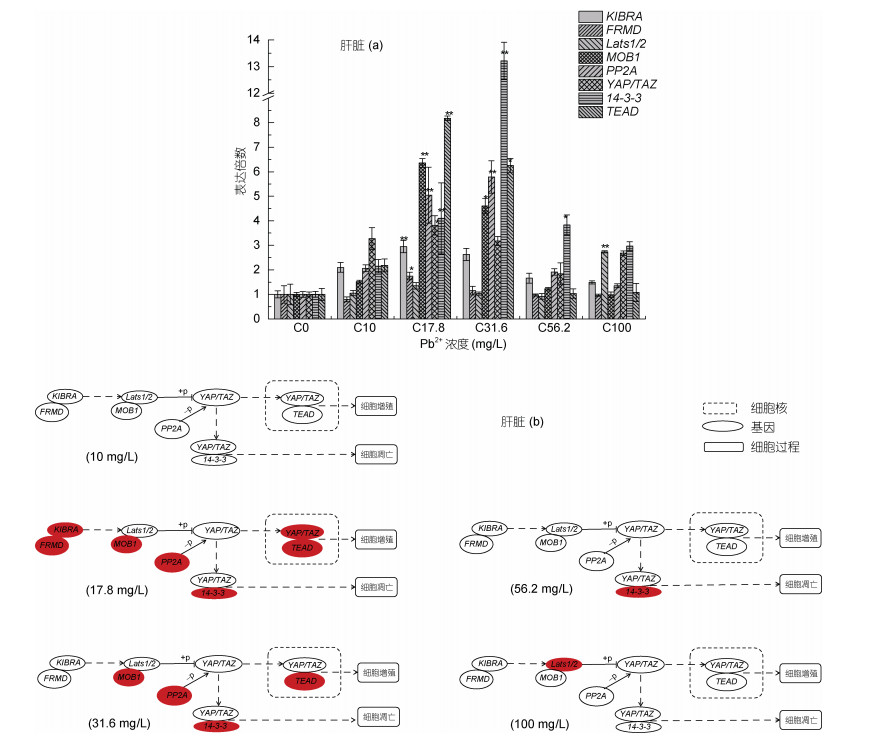 |
| 图 1 基因Lats1/2、MOB1、KIBRA、FRMD、14-3-3、TEAD、PP2A和YAP/TAZ在96h急性Pb2+胁迫后大口黑鲈幼鱼肝脏组织中的qPCR分析 Fig. 1 qPCR analysis of Lats1/2, MOB1, KIBRA, FRMD, 14-3-3, TEAD, PP2A, and YAP/TAZ in the liver of largemouth bass under acute Pb2+ stress for 96h 注:图 1a和图 1b中YAP/TAZ数据来源于参考文献(Qian et al, 2020)。图 1b中红色表示表达量显著上调, 白色表示表达量与对照组相比变化不显著 |
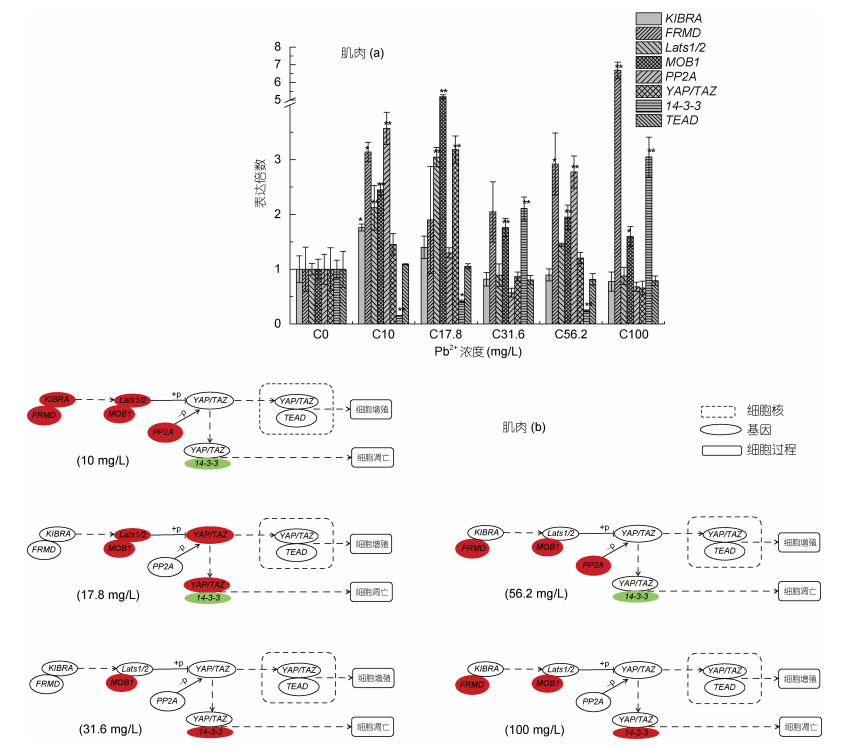
96 h不同浓度Pb2+胁迫后, 肌肉组织中除TEAD外其余各目的基因表达量与对照组(0 mg/L)变化明显(图 2a, 2b)。YAP/TAZ mRNA表达量随着Pb2+胁迫浓度的提高, 在17.8 mg/L时与对照组相比上调极显著, 在恢复至对照组水平(数据来源于参考文献Qian et al, 2020); Lats1/2在10和17.8 mg/L时上调极显著, 随着浓度的升高, 表达量变化不显著; 与对照组相比, 基因MOB1 mRNA表达量在不同胁迫浓度下都呈显著上升, 在17.8 mg/L时达到最高值(表达倍数为5.18); 14-3-3表达量随着Pb2+胁迫浓度的升高, 先显著下调, 在31.6 mg/L时上调极显著, 56.2 mg/L时下调极显著, 在100 mg/L时又极显著上升; PP2A表达量10和56.2 mg/L时上升极显著, 在31.6和100 mg/L时虽较对照组下调, 但变化不显著; KIBRA mRNA表达量在Pb2+胁迫浓度10 mg/L时显著上调, 随着胁迫浓度的升高, 表达量较对照组都无显著变化; 基因FRMD在Pb2+胁迫浓度10、56.2和100 mg/L时显著上调; 而TEAD表达量在所有Pb2+胁迫浓度处理下较对照组变化不显著。
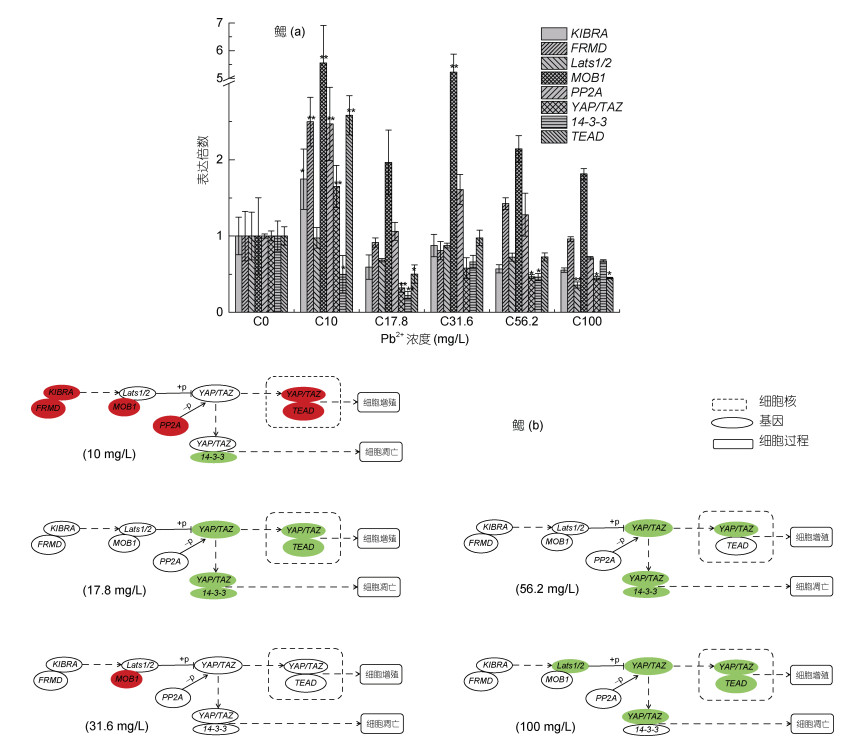
大口黑鲈幼鱼在96 h不同浓度Pb2+胁迫后, 鳃组织中各目的基因表达量与对照组(0 mg/L)有不同的变化(图 3a, 3b)。基因YAP/TAZ表达量随着胁迫浓度的上升呈先上调后下调, 在10 mg/L表达量上调极显著, 在17.8、56.2和100 mg/L时表达量显著下调; Lats1/2 mRNA表达量在100 mg/L时下调极显著, 其他胁迫处理浓度下表达量与对照组相比都无显著变化; 基因MOB1在胁迫浓度10和31.6 mg/L时表达量上调极显著, 其他浓度下与对照组相比变化不显著; 14-3-3 mRNA表达量在所有胁迫处理浓度下都下降, 在17.8 mg/L时下调极显著, 在10和56.2 mg/L呈显著下调; PP2A mRNA表达量随着胁迫浓度的升高先上调极显著, 后恢复至对照组水平; KIBRA在10 mg/L时表达量先显著上升, 随着胁迫浓度的升高, 与对照组相比, 表达量有下降趋势, 但无显著性; FRMD mRNA表达量在10 mg/L时与对照组相比上升极显著, 随着胁迫浓度的升高表达量回复到对照组水平且无显著性差异; TEAD表达量随着Pb2+胁迫浓度的升高先上调后下降, 在10 mg/L上调极显著, 17.8和100 mg/L时表达量显著下调。
除Lats1/2外, 其余目的基因在96 h不同浓度Pb2+胁迫处理后的大口黑鲈幼鱼小肠组织中表达量变化明显(图 4a, 4b)。与其他组织不同, YAP/TAZ基因表达量在不同胁迫浓度下表达量均下降, 17.8、56.2和100 mg/L时相比对照组表达量显著下调; Lats1/2基因在所有Pb2+胁迫浓度下表达量与对照组相比无显著变化; MOB1 mRNA表达量除31.6 mg/L时与对照组没有显著性差异外, 其余胁迫处理浓度下均显著下调; 14-3-3 mRNA表达量在所有胁迫浓度下与对照组相比都显著下调, 并且在10、17.8、56.2和100 mg/L时表达量下调极显著; 随着Pb2+胁迫浓度的升高, PP2A mRNA表达量都下调极显著; KIBRA表达量变化与PP2A类似, 在所有胁迫浓度下表达量与对照组相比均显著下调; FRMD基因表达量随着胁迫浓度的增加, 先上升, 后恢复至对照组水平, 在10 mg/L是相比对照组上升极显著, 在17.8 mg/L时上升显著; TEAD mRNA表达量在10、17.8和31.6时相比对照组无显著变化, 随着胁迫浓度的升高, 在56.2和100 mg/L时表达量较对照组显著降低。
铅是水体中常见的可持续释放的生物非必需重金属污染物, 具生物蓄积性和生物放大作用(Qian et al, 2020)。铅离子在水体中对鱼类有较强的毒性, 损伤鱼体组织, 甚至可致其生长发育产生阻滞。Hippo信号通路通过促进细胞凋亡、分化和抑制增殖来达到控制生物体生长发育过程中器官组织的大小(Agarwala et al, 2015)。在本实验中, 不同铅离子浓度胁迫后大口黑鲈幼鱼Hippo信号通路中Lats1/2、MOB1、KIBRA、FRMD、14-3-3、TEAD、PP2A和YAP/TAZ基因表达量在不同组织中出现了不同程度的变化, 这一结果预示着铅胁迫后大口黑鲈幼鱼生长发育很有可能通过Hippo信号通路中这些主要调节因子来发挥作用。此外, 通路中的基因表达量变化不仅与铅离子胁迫浓度相关, 在不同的组织中表达量也不一致。
前期对浓度为17.8 mg/L铅离子胁迫大口黑鲈幼鱼后发现肝脏组织中YAP/TAZ mRNA表达量相较于对照组显著上升等(Qian et al, 2020)。在Hippo信号通路中, YAP/TAZ蛋白可被Lats1/2磷酸化, 磷酸化的YAP/TAZ蛋白继而与胞质中的14-3-3特异性结合, 使得YAP/TAZ定位于胞质中, 并被胞质中的蛋白酶体泛素化后降解(Zhao et al, 2007; Lei et al, 2008), 进而阻滞细胞核内抑制细胞凋亡相关基因的转录, 促进细胞凋亡。而在Hippo通路异常情况下, 未磷酸化的YAP/TAZ进入细胞核, 与TEAD转录因子共激活和调控促进细胞增殖的相关基因转录表达(胡立桥等, 2017), 且通路的异常激活极可能诱导细胞异常增殖, 并发生组织病变甚至癌变(齐海霞等, 2020)。本实验对不同铅离子浓度胁迫处理后的大口黑鲈幼鱼肝脏组织其他基因表达量研究发现, 10 mg/L时表达量与对照组相比均无显著变化, 而在17.8 mg/L铅离子水体中96 h后, MOB1、KIBRA、FRMD、14-3-3、TEAD、PP2A表达量较对照组均显著升高, 其他浓度如31.6 mg/L时MOB1、PP2A、14-3-3、TEAD表达量显著升高, 随着铅离子浓度的进一步升高, 所研究的大部分基因表达量均无显著变化, 从结果中可看出, 水体中17.8 mg/L铅离子浓度对大口黑鲈幼鱼肝脏组织Hippo信号通路的影响最大, 这可能的原因是在此浓度下, 铅离子极大地促进了KIBRA、FRMD和MOB1的表达, 并升高了KIBRA、FRMD和MOB1蛋白质合成, 且在一定程度上提高了LATS1/2的表达量(与对照组相比表达量升高, 但未达到显著水平), 我们猜测少量合成的LATS1/2在MOB1的协同作用下磷酸化部分YAP/TAZ, 但由于PP2A表达量的显著上升, 可能导致PP2A蛋白合成增加, 使得YAP/TAZ去磷酸化, 因此这少量的YAP/TAZ可能在细胞质中与表达量显著升高的14-3-3特异性结合, 但可能不足以引起细胞凋亡, 而未被磷酸化或被PP2A去磷酸化的YAP/TAZ则进入细胞核作为共激活转录因子与表达量显著升高的TEAD调节抑制细胞凋亡因子的基因转录, 可能导致细胞增殖甚至异常增殖。此外, 在铅离子浓度为31.6 mg/L时, 14-3-3和TEAD虽都显著上升, 但YAP/TAZ表达量上升不显著, 可能的原因是高浓度的铅离子胁迫已经损伤肝细胞。
在本实验中, 肌肉组织中YAP/TAZ表达量只在17.8 mg/L时显著上升, 从实验结果来看, 96 h的铅胁迫提高了Lats1/2和MOB1的表达量, 可能提高了Lats1/2蛋白质的合成, 而在此浓度下, PP2A表达量变化不显著, 合成的YAP/TAZ在Lats1/2的参与下磷酸化。但奇怪的是, 在此铅离子浓度下, 14-3-3基因表达量显著下降, 我们推测, 17.8 mg/L铅离子浓度胁迫下可能不会导致大口黑鲈幼鱼肌肉细胞凋亡。在其他胁迫浓度下, 虽然基因表达量变化与17.8 mg/L时不一致, 但总体上来看, 铅离子胁迫对肌肉细胞的凋亡或增殖可能都没有影响, 如铅胁迫浓度31.6和100 mg/L时, 虽然14-3-3表达量与对照组相比显著上升, 但YAP/TAZ表达量却变化不显著, 此外, TEAD变化也不显著, 这使得14-3-3不能与YAP/TAZ结合, 而即使YAP/TAZ进入细胞核, 由于TEAD表达量变化不显著, YAP/TAZ也不能发挥共激活因子的作用。这些分子水平上的基因表达量变化的结果可能与肌肉组织对铅离子的亲和力较差有关, 大量研究表明, 铅离子在鱼体肌肉组织中的蓄积量小于肝脏组织(阮晓等, 2001; Rogers et al, 2003; Patel et al, 2006)。这说明铅离子对96 h胁迫后的大口黑鲈幼鱼肌肉组织中Hippo信号通路的影响较小。
鳃是鱼类呼吸的主要器官, 是水体中铅离子残留和蓄积的主要部位(阮晓等, 2001; Rogers et al, 2003)。在大口黑鲈幼鱼鳃组织中, 10 mg/L铅离子胁迫96 h对Hippo信号通路影响较大, PP2A表达量相较于对照组显著上升, 可致使YAP/TAZ去磷酸化增加, 从而导致进入鳃细胞核的YAP/TAZ增加, 从实验结果看, 鳃细胞核中YAP/TAZ和TEAD表达量都显著上升, 这可能导致鳃细胞的大量增殖甚至异常增殖。随着铅胁迫浓度的提高, 所研究基因大部分都相较于对照组显著下降, 如在铅离子胁迫浓度17.8 mg/L时, YAP/TAZ、14-3-3和TEAD表达量都显著下降, 在其他胁迫浓度如56.2和100 mg/L时YAP/TAZ也都显著下降。类似的结果还出现在不同浓度铅离子胁迫96 h的大口黑鲈幼鱼小肠组织中, 如在56.2和100 mg/L时, KIBRA、MOB1、PP2A、YAP/TAZ、14-3-3和TEAD基因mRNA表达量相较于对照组都显著下降。目前还不清楚不同浓度铅胁迫后为什么在鳃(除10 mg/L铅离子胁迫外)和小肠组织中会出现这样的结果, 且与肝脏和肌肉组织的表达量变化相差很大, 一种可能的原因是铅离子在大口黑鲈幼鱼肝脏组织中的蓄积大于其他组织, 而腮组织在较低浓度10 mg/L铅离子胁迫处理96 h时蓄积量较大, 从而导致入核的YAP/TAZ量增加, 而在其他胁迫浓度下, 可能在不到96 h时就已经导致鳃组织损伤, 小肠组织亦同理。这应进一步实验来充分了解鳃组织和小肠组织Hippo信号通路在铅胁迫后出现的这种分子机理。
大口黑鲈为底栖性鱼类, 重金属铅对其器官、组织的生长发育影响较大, 严重时会不同程度损伤鱼体组织, 在分子水平上, 则表现为不同组织中相关基因表达量的变化。Hippo信号通路中的相关基因不仅与细胞凋亡相关, 还与促进细胞增殖的基因表达有关。其中, Lats1/2、MOB1是正向调节因子, Lats1/2磷酸化YAP/TAZ后, 可间接促进YAP/TAZ的降解, 最终结果致使细胞凋亡。而PP2A则与Lats1/2作用相反, 使YAP/TAZ去磷酸化, 致使进入细胞核的YAP/TAZ增加, 最终结果致使细胞大量增殖或异常增殖甚至癌变。本实验中, 不同浓度铅离子96 h胁迫处理大口黑鲈幼鱼后, 肝脏组织(胁迫浓度17.8 mg/L)和鳃组织(胁迫浓度10 mg/L)是都出现了YAP/TAZ与TEAD表达量显著上升, 这预示着此时肝脏组织和鳃组织有可能在铅离子的作用下出现了细胞的异常增殖。
4 结论铅胁迫处理显著影响了大口黑鲈幼鱼Hippo信号通路中的部分基因在肝脏、肌肉、鳃和小肠组织中mRNA表达量。通过对Lats1/2、MOB1、KIBRA、FRMD、14-3-3、TEAD、PP2A和YAP/TAZ基因在肝脏、肌肉、鳃和小肠组织中的mRNA表达量变化进分析, 发现所研究基因的mRNA表达量具有组织和浓度特异性, 且在肝脏组织中表达量变化显著的基因都呈上调, 而在肌肉、鳃和小肠组织中, 部分基因在某些铅离子胁迫浓度下呈显著下降。结果显示不同浓度的铅胁迫对大口黑鲈幼鱼肝脏、肌肉、鳃和小肠组织中Hippo信号通路有较大的影响。研究结果可为大口黑鲈对铅离子胁迫后的Hippo信号通路研究提供理论依据, 并可为其他鱼类对铅离子的分子响应机制研究提供一定参考。此外, 结果显示在鳃和小肠组织中KIBRA、MOB1等部分基因mRNA表达量在某些铅离子胁迫浓度下相较于对照组呈显著下降, 与肝脏组织中的表达量变化相反, 可能在不同组织中的表达存在不同的调控机制, 在不同组织中铅离子是如何影响Hippo信号通路的机制还有待进一步研究。
石琼, 范明君, 张勇. 2014. 中国经济鱼类志. 武汉: 华中科技大学出版社, 281-283
|
龙昱, 罗永巨, 肖俊, 等. 2016. 重金属胁迫对鱼类影响的研究进展. 南方农业学报, 47(9): 1608-1614 DOI:10.3969/jissn.2095-1191.2016.09.1608 |
刘芳芳, 2013.淡水鱼类中重金属污染及其与环境相关性分析.长沙: 中南林业科技大学硕士学位论文
|
齐海霞, 柴艳芬. 2020. Hippo信号通路相关分子与肿瘤发生的研究进展. 医学综述, 26(4): 683-689 DOI:10.3969/j.issn.1006-2084.2020.04.012 |
阮晓, 郑春霞, 王强, 等. 2001. 重金属在罗非鱼淡水白鲳和鲤鱼体内的蓄积. 农业环境保护, 20(5): 357-359 |
孙奕, 张晓蓉. 2018. PP2A在成骨细胞和脂肪细胞中的作用. 医学综述, 24(8): 1468-1472 DOI:10.3969/j.issn.1006-2084.2018.08.003 |
宋林, 2019. KIBRA调节外泌体的分泌及其机制研究.山东: 山东大学博士学位论文
|
项黎新, 邵健忠, 孟真. 2001. 六种重金属离子胁迫诱导鱼类细胞凋亡的研究. 生物化学与生物物理进展, 28(6): 866-869 DOI:10.3321/j.issn:1000-3282.2001.06.023 |
胡立桥, 周兆才, 田伟. 2017. Hippo信号通路结构生物学研究进展. 遗传, 39(7): 659-674 |
麻明彪, 杜延义, 陶律延, 等. 2020. Hippo信号通路与炎症的研究进展. 中国免疫学杂志, 36(6): 752-758 DOI:10.3969/j.issn.1000-484X.2020.06.022 |
潘天扬, 房树林, 闫玉莲, 等. 2016. 水体中铅对长江上游6种鱼类的急性中毒效应. 淡水渔业, 46(3): 34-39 DOI:10.3969/j.issn.1000-6907.2016.03.006 |
Agarwala S, Duquesne S, Liu K et al, 2015. Amotl2a interacts with the Hippo effector Yap1 and the Wnt/β-catenin effector Lef1 to control tissue size in zebrafish. eLife, 4: e08201 DOI:10.7554/eLife.08201 |
Badouel C, Mcneill H, 2011. Snapshot:the hippo signaling pathway. Cell, 145(3): 484-484 DOI:10.1016/j.cell.2011.04.009 |
Di Benedetto A, Mottolese M, Sperati F et al, 2016. The Hippo transducers TAZ/YAP and their target CTGF in male breast cancer. Oncotarget, 7(28): 43188-43198 DOI:10.18632/oncotarget.9668 |
Ferraro M V M, Fenocchio A S, Mantovani M S et al, 2004. Mutagenic effects of tributyltin and inorganic lead (Pb Ⅱ) on the fish H. malabaricus as evaluated using the comet assay and the piscine micronucleus and chromosome aberration tests. Genetics and Molecular Biology, 27(1): 103-107 DOI:10.1590/S1415-47572004000100017 |
Gibault F, Corvaisier M, Bailly F et al, 2016. Non-photoinduced biological properties of verteporfin. Current Medicinal Chemistry, 23(11): 1171-1184 DOI:10.2174/0929867323666160316125048 |
Hong F S, Wu C, Liu C et al, 2007. Direct evidence for interaction between lead ions and kidney DNA from silver crucian carp. Chemosphere, 68(8): 1442-1446 DOI:10.1016/j.chemosphere.2007.04.020 |
Lei Q Y, Zhang H, Zhao B et al, 2008. TAZ promotes cell proliferation and epithelial-mesenchymal transition and is inhibited by the hippo pathway. Molecular and Cellular Biology, 28(7): 2426-2436 DOI:10.1128/MCB.01874-07 |
Mager E M, Wintz H, Vulpe C D et al, 2008. Toxicogenomics of water chemistry influence on chronic lead exposure to the fathead minnow (Pimephales promelas). Aquatic Toxicology, 87(3): 200-209 DOI:10.1016/j.aquatox.2008.02.001 |
Patel M, Rogers J T, Pane E F et al, 2006. Renal responses to acute lead waterborne exposure in the freshwater rainbow trout (Oncorhynchus mykiss). Aquatic Toxicology, 80(4): 362-371 DOI:10.1016/j.aquatox.2006.09.012 |
Qian B Y, Xue L Y, Qi X et al, 2020. Gene networks and toxicity/detoxification pathways in juvenile largemouth bass (Micropterus salmoides) liver induced by acute lead stress. Genomics, 112(1): 20-31 DOI:10.1016/j.ygeno.2019.06.023 |
Rajamanickam V, Muthuswamy N, 2008. Effect of heavy metals induced toxicity on metabolic biomarkers in common carp (Cyprinus Carpio L.). Maejo International Journal of Science and Technology, 2(1): 192-200 |
Ribeiro A M, Risso W E, Fernandes M N et al, 2014. Lead accumulation and its effects on the branchial physiology of Prochilodus lineatus. Fish Physiology and Biochemistry, 40(3): 645-657 DOI:10.1007/s10695-013-9873-8 |
Rogers J T, Richards J G, Wood C M, 2003. Ionoregulatory disruption as the acute toxic mechanism for lead in the rainbow trout (Oncorhynchus mykiss). Aquatic Toxicology, 64(2): 215-234 DOI:10.1016/S0166-445X(03)00053-5 |
Schlegelmilch K, Mohseni M, Kirak O et al, 2011. Yap1 acts downstream of α-catenin to control epidermal proliferation. Cell, 144(5): 782-795 DOI:10.1016/j.cell.2011.02.031 |
Schmittgen T D, Livak K J, 2008. Analyzing real-time PCR data by the comparative CT method. Nature Protocols, 3(6): 1101-1108 DOI:10.1038/nprot.2008.73 |
Sokolova I M, Lannig G, 2008. Interactive effects of metal pollution and temperature on metabolism in aquatic ectotherms:implications of global climate change. Climate Research, 37(2-3): 181-201 DOI:10.3354/cr00764 |
Song J G, Wang T Z, Chi X C et al, 2019. Kindlin-2 inhibits the hippo signaling pathway by promoting degradation of MOB1. Cell Reports, 29(11): 3664-3677 DOI:10.1016/j.celrep.2019.11.035 |
Tepass U, 2009. FERM proteins in animal morphogenesis. Current Opinion in Genetics & Development, 19(4): 357-367 |
Zhang Y M, Wang Y J, Yu R L et al, 2008. Effects to heavy metals Cd2+, Pb2+ and Zn2+, on DNA damage of loach Misgurnus anguillicaudatus. Frontiers of Biology in China, 3(1): 50-54 DOI:10.1007/s11515-008-0012-3 |
Zhao B, Li L, Tumaneng K et al, 2010. A coordinated phosphorylation by Lats and CK1 regulates YAP stability through SCFβ-TRCP. Genes & Development, 24(1): 72-85 |
Zhao B, Tumaneng K, Guan K L, 2011. The Hippo pathway in organ size control, tissue regeneration and stem cell self-renewal. Nature Cell Biology, 13(8): 877-883 DOI:10.1038/ncb2303 |
Zhao B, Wei X M, Li W Q et al, 2007. Inactivation of YAP oncoprotein by the Hippo pathway is involved in cell contact inhibition and tissue growth control. Genes & Development, 21(21): 2747-2761 |
 2021, Vol. 52
2021, Vol. 52