中国海洋湖沼学会主办。
文章信息
- 何利军, 任慧敏, 许莎莎, 张经. 2021.
- HE Li-Jun, REN Hui-Min, XU Sha-Sha, ZHANG Jing. 2021.
- 印度洋-西太平洋海洋动物谱系地理演化格局
- PHYLOGEOGRAPHIC PATTERN OF MARINE FAUNA IN THE INDO-WEST PACIFIC
- 海洋与湖沼, 52(2): 468-486
- Oceanologia et Limnologia Sinica, 52(2): 468-486.
- http://dx.doi.org/10.11693/hyhz20200900260
文章历史
-
收稿日期:2020-09-27
收修改稿日期:2021-01-09
2. 华东师范大学崇明生态研究院 上海 202162
2. Institute of Eco-Chongming, East China Normal University, Shanghai 202162, China
印度洋-西太平洋区域中, 印度-欧亚板块碰撞引起的青藏高原隆升和演化过程, 被认为深刻影响了该区域印度河、恒河、湄公河、长江和黄河等入海河流的陆源营养输入(Milliman et al, 1983; Summerfield et al, 1994), 以及大量边缘海和浅海大陆架中海洋生态系统的演变(Tamaki et al, 1991; 谢传礼等, 1996; He et al, 2014)(图 1)。印度洋和西太平洋具有全球初级生产力最高和渔产资源最丰富的边缘海, 如阿拉伯海和中国东海(Longhurst et al, 1995)。东印度三角区(珊瑚三角)作为印度洋-太平洋水交换通道, 以及欧亚板块和澳大利亚板块临接区, 不仅在两大洋物质、能量输送中扮演了枢纽角色(Wang, 2004), 而且相对全球其他区域具有更高的生物多样性, 被认为是红树林、珊瑚和鱼类等海洋物种的起源中心(Briggs, 1999, 2005; Timm et al, 2008)。在板块漂移、古气候变化等地史事件引起的全球海洋环流改变、海面升降背景下, 海洋生物如何形成目前空间分布格局, 海盆之间生物如何联系, 以及海洋渔业种群如何响应, 构成了印度洋-西太平洋区域生物和海洋环境协同演化的重要科学问题。本文将结合地质、物理和化学海洋环境, 分区域讨论印度-西太平洋海洋动物的谱系地理演化格局。
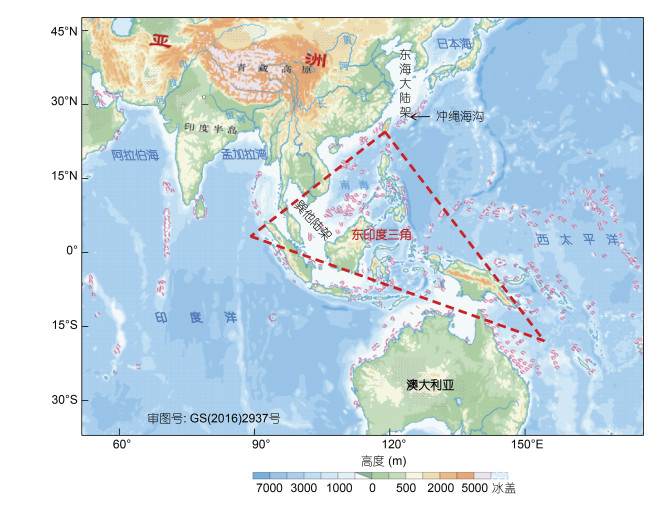 |
| 图 1 印度洋-西太平洋地形图 Fig. 1 Topography of the Indo-West Pacific 注: 红色虚线内为东印度三角(Briggs, 1987) |
渤、黄、东、南海这四个海区(图 2), 在第四纪冰期时受海面下降120—150 m影响(朱永其等, 1981), 南海曾收缩为一个面积为现在五分之四的半封闭海盆, 东海面积缩小为目前二分之一的冲绳海沟, 黄渤海则全面暴露为陆地(谢传礼等, 1996)(图 2a)。南海在距今30 Ma打开(Hall, 1996), 最深达5567 m, 平均水深1212 m, 除东北通过巴士海峡与西太平洋相通外, 北、西、南和东南都被200 m水深以内的大陆架包围, 形成了半封闭海盆, 其南部通过加里曼丹海峡和马六甲海峡, 分别与爪哇海和印度洋相通, 东北部通过台湾海峡连通东海, 南海的主要表层环流是在夏季风影响下的从西南流向东北的西南季风流, 以及冬季风影响下的从东北流向西南的东北季风流(Fang et al, 2005); 东海由一狭长冲绳海沟和宽阔的东海大陆架组成, 相对南海, 东海要年轻得多, 冲绳海沟在距今约10—1.9 Ma打开(Letouzey et al, 1985; Lee et al, 1995), 东海大陆架的沉降发生于距今0.15 Ma (Sun et al, 2003), 东海主要表层环流包括从台湾以东流入的黑潮、台湾海峡流入的台湾暖流, 以及冬季沿浙闵海岸南流、夏季沿浙闵海岸北流的东海沿岸流(Chao, 1990); 而黄、渤海是由平均水深约90 m的大陆架组成, 主要环流包括秋、冬和春季从济州岛和朝鲜半岛西南侧北上的高温高盐黄海暖流(黑潮分支), 以及分别沿山东半岛、江苏海岸、朝鲜半岛西海岸南下的低温低盐黄海沿岸流、朝鲜沿岸流, 夏季黄海暖流消失, 代之以黄海冷水团, 同时江苏海岸的黄海沿岸流和朝鲜沿岸流均北流(Naimie et al, 2001; Ichikawa et al, 2002; Yuan et al, 2008)(图 2b)。
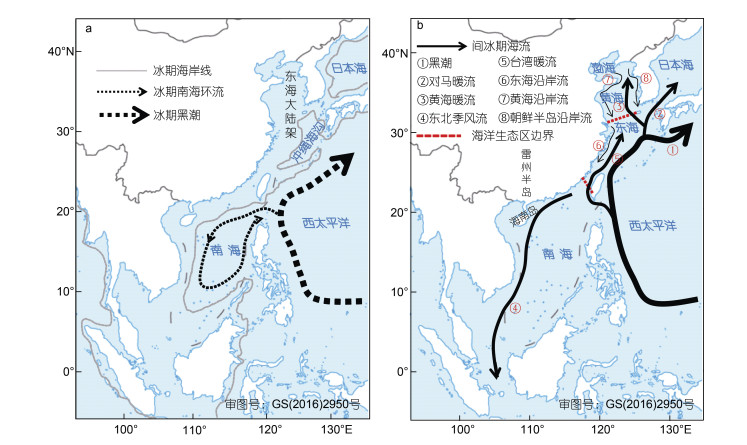 |
| 图 2 冰期(a)和间冰期(b)中国海 Fig. 2 Glacial (a) and interglacial (b) China seas 注: 冰期中国海古岸线(-120 m)和2月海流分别以灰色实线和虚线箭头表示(Wang, 1990), 间冰期/现代中国海2月海流(Xu et al, 1999)和三个海洋生态系统(黄渤海、东海、南海)分界线(Sherman et al, 1999a, b)分别以实线箭头和红色虚线表示; 箭头越粗表示流量越大(余同) |
中国海域的地质、地貌和海洋环流特征, 在海洋生物进化中, 形成了几个天然的生物地理边界(图 3): (1) 南海北部湾, 受到海南岛和雷州半岛隔离的影响, 形成了一个半封闭海湾, 只在琼州海峡存在一个由雷州半岛以东流入的常年西向的海流(Shi et al, 2002), 海洋生物与南海东部基因交流有限, 在很多物种中, 都存在北部湾相对南海东部种群的空间隔离现象(Yu et al, 2006; Zhou et al, 2009; He et al, 2010)(表 1); (2) 南海和东海连通的台湾海峡, 在冰期时会反复暴露, 在绒螯蟹属(Eriocheir)的种上水平和鳞笠藤壶(Tetraclita squamosa)、弹涂鱼(Periophthalmus modestus)等很多物种的种下水平, 都发现了不同海洋物种在南海和东海的特有地理分布(Xu et al, 2009)和海区间谱系隔离分化现象(Chan et al, 2006; He et al, 2015)(表 1); (3)长江冲淡水, 扮演了合浦绒螯蟹(E. hepuensis)和拟穴青蟹(Scylla paramamosain)等暖水种分布北界(Chan et al, 2006; He et al, 2010), 日本菊花螺(Siphonaria Japonica)、花笠螺(Cellana toreuma)、铜藻(Sargassum horneri)等不同物种中, 都发现了以长江口为界的黄海种群和东海种群的显著分化(Wang et al, 2015)(表 1), 但部分东海类群受到夏秋季长江冲淡水北支的影响(Wu et al, 2014)(图 3), 可扩散进入黄海南部(Han et al, 2015a, b); (4)海州湾古黄河口区域(35°N)(图 3), 为北部海岸高盐水和南部海岸低盐水过渡区域(Zhu et al, 2018), 扮演了日本蟳(Charybdis japonica)北方单倍型H2由黄渤海向东海扩散的物理障碍角色。
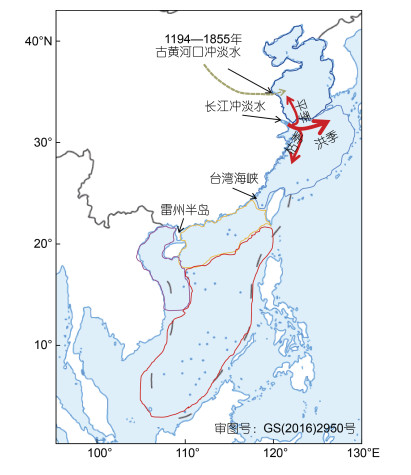 |
| 图 3 中国沿岸海域5个生物地理省及其边界(5种颜色线框) Fig. 3 Five biogeographic provinces and the biogeographic boundaries along the coastal China 注: 红色箭头分别标示了旱季、洪季、平季的长江冲淡水分支(Wu et al, 2014); 箭头越粗表示流量越大(余同); 生物地理省划分据Spalding等(2007) |
| 黄渤海与东海、南海对比 | ||||||||||||
| 不同物种分子标记 | 日本菊花螺 (Siphonaria Japonica)COI |
花笠螺 (Cellana toreuma)COI |
铜藻 (Sargassum horneri)COIII |
|||||||||
| 种群 | 黄海(YS) | 东海(ECS) | 黄海(YS) | 东海(ECS) | 黄海(YS) | 东海(ECS) | ||||||
| 东海(ECS) | 0.3047*** | 0.1898*** | 0.0555*** | |||||||||
| 南海(SCS) | 0.2830*** | -0.0066 | 0.1341*** | 0.0050 | 0.0363* | 0.0302 | ||||||
| 东海与南海和西北太平洋对比 | ||||||||||||
| 不同物种分子标记 | 弹涂鱼(Periophthalmus modestus)ND5 | |||||||||||
| 种群 | 日本四岛沿岸 | 南海中国海岸 | ||||||||||
| 东海中国海岸 | 0.076* | 0.085* | ||||||||||
| 北部湾与南海东部对比 | ||||||||||||
| 不同物种分子标记 | 斑节对虾 (Penaeus monodon)CR |
拟穴青蟹 (Scylla paramamosain)COI/16S rRNA |
马氏珠母贝 (Pinctada fucata)AFLP |
|||||||||
| 种群 | 深圳(SZ) | 三亚(SY) | 汕头(ST) | 三亚(SY) | 大亚湾(DY) | 三亚湾(SY) | ||||||
| 北海(BH) | 0.09836* | 0.12253* | 0.06249* | 0.09872* | 0.0113** | 0.0193** | ||||||
| 注: *: P < 0.05; **: P < 0.01; ***: P < 0.001; CR: control region, 线粒体控制区; AFLP: amplified fragment length polymorphism, 扩增片段长度多态性 | ||||||||||||
与此同时, 特定的海洋环境, 也影响了种群谱系分化格局和种群动态特征。我国四大海区中, 在南海、东海、黄海、渤海广泛分布类群, 一般呈现为一个单一谱系和星形树特征(He et al, 2010; Wang et al, 2013; Ni et al, 2014)(图 4), 而只分布于南海的类群, 多呈现为深度分化的多个遗传谱系(Zhou et al, 2009)(图 5)。而且, 通过歧点分布分析其种群数量动态, 发现海区间广布类群, 多呈现为单峰分布(图 6), 而仅出现于南海的物种多呈现为多峰分布(图 7), 暗示在四大海区广布的物种种群经历过数量扩张和区域扩散, 而仅在南海分布的物种种群处于遗传平衡状态。通过遗传多态性参数分析显示, 这些广布类群, 往往在南海相对东海、黄渤海或日本列岛沿岸, 具有更高遗传多态性和更多祖先单倍型(He et al, 2010, 2015)。造成这一现象的原因, 和我国海洋地质环境和古气候循环密切相关: 一方面在于, 在第四纪海面升降背景下, 冰期海面下降达120—150 m, 黄渤海和东海大陆架暴露(图 2a), 海洋生物栖息地大量萎缩, 只有冲绳海沟和南海海盆, 可能扮演了海洋物种冰期避难区或冰消期扩散起源地, 而且南海海盆(30—15 Ma)比冲绳海盆(10—3 Ma) 形成历史更古老(Wang, 2004), 目前东海大陆架和黄渤海物种, 都来自于冰消期海面上升后的最近1万多年从冲绳海沟或南海海盆的扩散建群, 这可以解释东海和黄渤海广布种单一谱系、多态性低、种群经历数量扩张的种群遗传结构格局(Hewitt, 1999), 而只分布于南海海盆的特有物种, 一般为热带暖水种, 不适应东海或黄渤海的温带冷水环境, 除了极少数广温性物种之外, 多未经历向东海和黄渤海的种群扩散, 因而分布于南海避难区的特有物种相对东海大陆架和黄渤海新建群物种, 具有更古老的种群, 和更长时间累积突变, 并产生种内谱系分化(Hewitt, 1996); 另一方面, 南海水温相对东海和黄渤海更高, 暖水物种代谢率也相对温带冷水种更高, 因而可能导致南海相对东海和黄渤海同一类群或不同类群基因突变速率更快(Rand, 1994), 多样性更高(Briggs, 2005)。
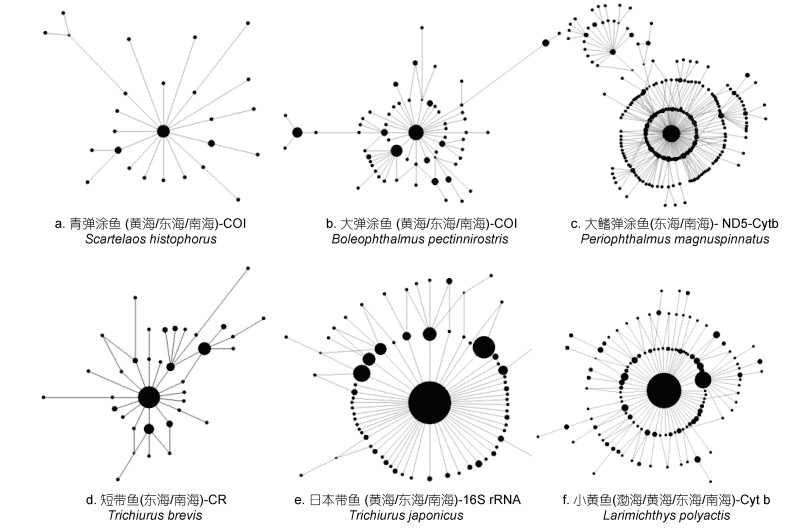 |
| 图 4 基于线粒体基因的中国海区间广布海洋动物进化网络图 Fig. 4 The evolutionary network of widespread marine fauna species in the China seas based on mtDNA sequences 注: 网络中各圆圈的面积大小反映了不同单倍型频率差异, 小黄鱼数据来自Wang等(2013), 其他鱼类数据来自本研究 |
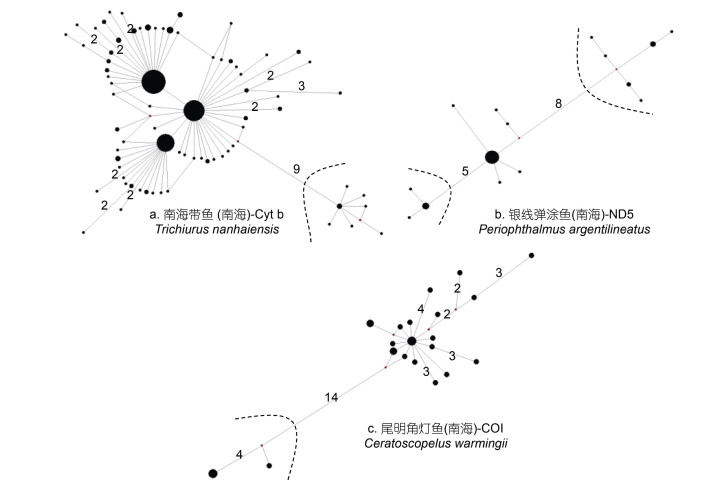 |
| 图 5 基于线粒体基因的南海特有海洋动物进化网络图 Fig. 5 The evolutionary network of endemic marine fauna species in the South China Sea based on mtDNA sequences 注: 网络中各圆圈的面积大小反映了不同单倍型频率差异, 分支上数字表示单倍型间2个以上的位点替代个数, 虚线划分了不同进化谱系, 数据来自本研究 |
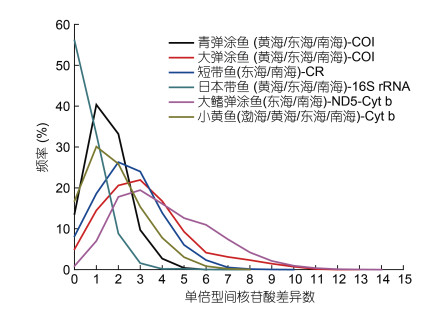 |
| 图 6 中国海域间广布的不同物种歧点分布分析图 Fig. 6 Mismatch distribution analysis of widespread species in the China seas based on mtDNA sequences 注: 小黄鱼数据来自wang等(2013), 其他鱼类数据来自本研究 |
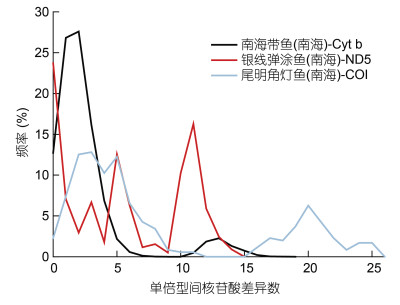 |
| 图 7 中国南海特有分布种歧点分布分析图 Fig. 7 Mismatch distribution analysis of endemic species in the South China Sea based on mtDNA sequences 注: 数据来自本研究 |
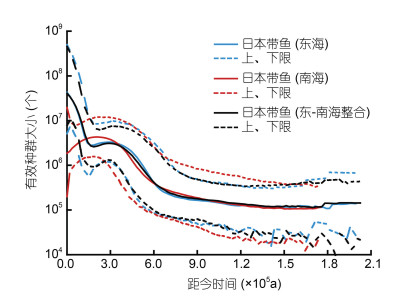
四个中国沿岸海区, 根据海洋物理、化学环境和海洋生物群落成分的差异, 被划分为了三个主要的生态区(黄渤海、东海和南海)(Sherman et al, 1999a, b)(图 2b), 以及5个生物地理省(黄渤海、东海、南海北部大陆架、北部湾、南海深海)(Spalding et al, 2007)(图 3)。这些不同生态区的海洋环境, 在海洋生物种群动态演化过程中, 也留下了遗传信号: 在大陆架栖息的日本带鱼(Trichiurus japonicus)和南海带鱼(Trichiurus nanhaiensis)的种群数量动态演化史对比中, 发现了东海的日本带鱼种群数量受到夏季风和长江入海冲淡水的影响, 而南海的日本带鱼和南海带鱼种群受到冬季风和南海北部陆坡上升流的影响, 导致两个海区带鱼有效种群数量自最近0.03 Ma以来呈现为相反的变化趋势(He et al, 2014), 且东海区日本带鱼目前有效种群数量为南海的20倍(图 8), 这与两个海区捕捞产量差异一致, 东海提供了全国带鱼80%的产量(郑元甲等, 2003)。而在海岸泥滩栖息弹涂鱼的东海和南海有效种群数量对比中, 发现了和带鱼相反的规律, 即弹涂鱼受到夏季风影响, 其目前有效种群数量在南海北部沿岸相对东海沿岸更大(He et al, 2015)。未来, 有必要针对不同生态习性的生物类群, 在五大生物地理省, 进一步比较海洋环境对于有效种群数量动态的影响规律。
东海及邻近海域, 受黑潮海流携带扩散的影响, 中国、琉球群岛、日本列岛和韩国半岛海岸, 均有近缘类群或同一物种分布(Kojima et al, 2005, 2006; Chan et al, 2006), 其扩散方向一般为由中国海岸向琉球群岛扩散(Maekawa et al, 1999), 并进入日本列岛东西沿岸(Yamaguchi, 2003; Ogoh et al, 2005; Han et al, 2008; He et al, 2015)。这一种群扩散方向, 在陆生两栖、爬行动物的研究中也得到了证实(Ota, 2000)。这些在中国、琉球群岛、日本列岛、韩国半岛之间广泛分布的近岸物种, 因为黑潮分支海流的隔离作用, 已导致了物种形成和谱系/种群的遗传分化。如栖息于日本列岛东西海岸的角蝾螺(Turbo cornutus)种群(Kojima et al, 1997), 以及栖息于日本列岛、韩国半岛南部和西部的腹足纲古氏滩栖螺(Batillaria cumingi)种群(Kojima et al, 2004), 分别以线粒体COI基因为遗传标记, 分析其种群遗传结构, 发现了和日本列岛东部的黑潮海流, 以及进入日本海的黑潮分支——对马海流相对应的两个遗传谱系——日本列岛东部黑潮谱系和韩国半岛-日本列岛西岸对马谱系; 以线粒体控制区(Control Region, CR)为遗传标记, 对采集自日本九州岛、韩国南部顺天市和中国浙江海岸的大弹涂鱼(Boleophthalmus pectinirostris)的种群遗传结构分析, 发现了该物种在中国海岸、韩国海岸和日本海岸之间, 已分化为三个深度分歧的遗传谱系(Kanemori et al, 2006); 弹涂鱼的研究中, 也发现了日本海岸、北琉球的种子岛、中琉球的冲绳岛和中国海岸之间的种群分化(Mukai et al, 2006; He et al, 2015); 分布于琉球群岛和日本列岛的发光介形虫——希氏弯喉海萤(Vargula hilgendorfii), 其基于Cyt b基因构建的系统进化树显示, 种群由分布于南琉球的八重山群岛和宫古群岛、中琉球的冲绳岛和奄美岛、北琉球的种子岛-日本列岛5个深度分化的谱系组成(Ogoh et al, 2005), 这些谱系和种群的分化, 是因为琉球群岛的两个较深海沟(庆良间水道和吐噶喇水道)和黑潮分支流的隔离作用, 导致扩散能力有限的近岸生物, 在不同区域出现隔离分化。琉球群岛生物类群, 被海沟和海流隔离作用划分为南琉球、中琉球、北琉球群体(Nakamura et al, 2009), 在拟蟹守螺属(Cerithidea)和陆生物种麝香凤蝶(Byasa alcinous)的亚种分布中也观察到类似现象(Kato et al, 2004; Kojima et al, 2006)。因而, 基于现有研究, 目前东海周边的中国、琉球群岛、日本列岛和韩国海岸物种的生物地理分化格局, 可以归纳为黑潮海流及其分支引起的物种形成和谱系分化模式(图 9)。
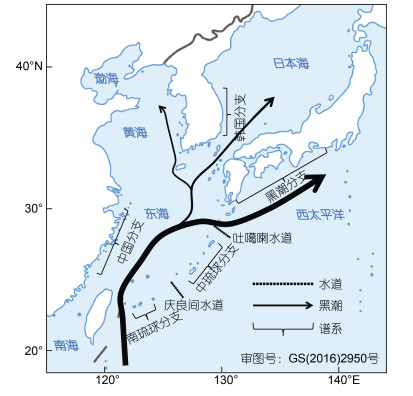 |
| 图 9 黑潮主轴及分支流对西北太平洋沿岸物种的隔离作用 Fig. 9 Biogeographic role of the Kuroshio Current as physical barriers on the coastal species in the northwestern Pacific 注: 据Kojima等(1997, 2004)、Ogoh等(2005)、Kanemori等(2006)、He等(2015) |
东印度三角区, 主要涵盖了台湾岛南部、马来半岛和巴布亚新几内亚-北澳大利亚连线覆盖区域(图 1)(Briggs, 1987), 该区域因相对周边海域具有更高生物多样性, 在全球生物地理学研究中, 具有重要地位。关于该区域生物多样性高的成因, 主要包括如下三种假说: ①起源中心, 东印度三角区因为其复杂的岛屿和环流特征, 导致了大量异质生境的存在, 很多物种因为同域竞争和生殖隔离而短时间内形成新的物种(Ekman, 1953; Stehli et al, 1971; Briggs, 2005), 该区域也被认为是很多物种的冰期避难区或向周边扩散起源地(图 10a)(Briggs, 1999, 2000); ②汇聚中心, 其高生物多样性被认为是周边海洋和陆地生物, 向东印度三角区扩散后汇聚累积形成(图 10b)(Ladd, 1960; Santini et al, 2002); ③边缘效应, 东印度三角区处于两个大洋、三个生物地理省(印度洋、太平洋和印尼群岛)接触地带, 拥有来自两个大洋和印尼群岛海岸的生物群落(图 10c)(Ekman, 1953)。东印度三角起源中心说, 源于很多属、种在印度洋和西太平洋广泛分布, 两大洋被认为是一个生物地理省(Briggs, 1974), 且物种多样性和遗传多态性, 在海洋生物向周边海域扩散过程中, 随距东印度三角距离增大而呈逐渐减小的梯度分布(Palumbi, 1997; Briggs, 1999), 其祖先基因型或单倍型多出现于作为扩散起源地的东印度三角, 而周边的太平洋和印度洋则衍生基因型或单倍型居多(Briggs, 2003); 汇聚中心和边缘效应, 都基于物种生成或起源于隔离栖息地的假设, 差别在于汇聚中心认为东印度三角物种、基因型或单倍型更年轻, 周边太平洋或印度洋的更古老, 而边缘效应认为东印度三角区高物种多样性和遗传多态性只是一个假象(Palumbi, 1996), 因为它们是来自邻近生物地理省的物种重叠分布的结果, 东印度三角区与邻近的印度洋和太平洋洋盆种群无明显的进化年龄差异(图 10c)。
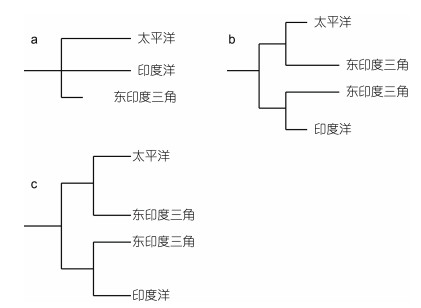 |
| 图 10 东印度三角区生物进化假说概念图 Fig. 10 Schematic graph of evolutionary hypotheses in the East Indies Triangle 注: a: 东印度三角起源中心; b: 从周边海域迁入东印度三角的累积中心; c: 两大洋生物重叠区 |
DNA分子标记的使用, 为检验东印度三角区高生物多样性分布形成假说, 提供了有效工具和线索: (1) 在长海胆属(Echinometra)4个物种的mtDNA多态性分布研究中, 均发现了一致的包括东印度三角区在内的西太平洋多态性高、中太平洋等周边种群多态性低的现象(Palumbi, 1997); 广泛分布于印度洋-西太平洋的锯缘青蟹, 其祖先种群扩散起源地在东印度三角区的西北澳大利亚(He et al, 2011)。(2) 斜长海胆(Echinometra oblonga) 来自东太平洋科科斯岛、中太平洋纽埃岛、夏威夷群岛的mtDNA单倍型处于系统树基部, 而来自西太平洋新几内亚和琉球群岛的单倍型均处于系统树衍生位置(Palumbi, 1997), 这暗示了由东太平洋起源向西太平洋的扩散建群方向。(3) 棘冠海星(Acanthaster planci)、蓝指海星(Linckia laevigata)的等位酶LT和ENOL位点等位基因频率, 以及渔舟蜑螺(Nerita albicilla)、宅泥鱼(Dascyllus aruanus)mtDNA基因谱系的空间分布, 均呈现了印度洋和太平洋的分化(Benzie, 1998, 1999; Crandall, 2008; Liu et al, 2014), 这暗示了东印度三角区所在的印尼群岛, 是印度洋和太平洋两个生物地理省的接触带。因此, 东印度三角区生物多样性分布模式, 在不同物种, 可能呈现为不同的规律, 其形成过程不能由单一机制或假说解释(Palumbi, 1997), 针对不同物种的比较谱系地理学研究, 将有助于揭示东印度三角高生物多样性形成的原因。
由于东印度三角处于欧亚板块和澳洲板块接触区, 该区域成为了东洋界和大洋洲界的陆生物种分布过渡区。根据陆生生物属种分布或谱系分化特征, 发现了两个主要的生物地理边界, 即华莱士线(Wallace’s Line)和赫胥黎线(Huxley’s Line)(图 11)。华莱士线将很多物种划分为南北两个类群, 而赫胥黎线, 将很多物种划分为东西两个类群, 两条线的区别在于华莱士线北方的除巴拉望岛以外的菲律宾, 被划入了赫胥黎线的东部分支。在部分海洋和近岸咸淡水生物谱系地理学的研究中, 发现这两条分界线同样影响了近海生物的种群遗传结构。采用mtDNA控制区(CR)基因, 对于分布于中国东海、南海和东印度三角区的康氏马鲛(Scomberomorus commerson)的种群结构分析表明, 该物种包含由华莱士线划分的两个遗传谱系, 且分布于华莱士线南部的谱系也扩散到了南海南部(Sulaiman et al, 2010)。在咸淡水洄游物种——罗氏沼虾(Macrobrachium rosenbergii)的种群结构分析中, 采用mtDNA16S rRNA基因, 发现了由赫胥黎线划分的东西两个遗传谱系(De Bruyn et al, 2004)。这一东西谱系分化模式, 很可能和该区域陆地板块漂移特征存在一定联系, 西部分支来自欧亚板块, 而东部分支来自澳洲-菲律宾海板块, 澳洲-菲律宾海板块一直在向北漂移, 并于距今5 Ma漂到了目前位置(Hall, 1996)。
 |
| 图 11 东印度三角区生物地理边界(短划线)和冰期暴露的大陆架-海岸线(虚线) Fig. 11 The biogeographic boundary lines (broken lines) and continental shelf-shorelines (dotted lines) during the glacial periods in the East Indies Triangle 注: 不同颜色虚线分别表示三个生物地理边界线, 据Benzie (1999)和Voris (2000) |
另一条生物地理边界(印度洋-太平洋线)在沿马来半岛、马六甲海峡和爪哇岛一线(图 11), 基于等位酶和mtDNA基因的棘冠海星(Acanthaster planci)、蓝指海星(Linckia laevigata)种群遗传结构分析显示, 以马来半岛-苏门答腊岛-爪洼岛-西澳大利亚为界, 这些物种可以划分为印度洋和太平洋两个种群, 且西澳大利亚海岸和东印度三角区被划在太平洋种群范围(Benzie, 1998, 1999), 这也反映了印尼贯穿流影响下的东印度三角区和西澳大利亚的海洋浮游生物联系; 螳螂虾蛄(Haptosquilla pulchella)的mtDNA COI基因网络图显示, 该物种的东印度三角区种群由三个谱系组成, 其中谱系1分布于新几内亚东部, 谱系2分布于爪哇海南部的爪洼岛、巴厘岛、龙目岛和科莫多岛近岸水域, 谱系3在东印度三角区广泛分布(Barber et al, 2002), 虽然缺乏爪哇岛、苏门答腊岛西部的印度洋其他站位样本, 但谱系2在爪洼岛和巴厘岛等东印度三角西部岛屿沿线的分布, 也暗示了这一印度洋-太平洋线作为两大洋盆生物地理边界的影响; 印度洋和太平洋海盆的谱系分化或种群隔离, 也见于其他物种, 如基于mtDNA Cyt b基因和微卫星标记分析发现, 栖息于印度洋和西太平洋珊瑚礁的宅泥鱼(Dascyllus aruanus)种群已分化为两个深度分歧的, 分别分布于印度洋和太平洋的谱系, 其谱系分化可能受到冰期海面下降, 洋盆间基因交流受限的影响(Liu et al, 2014)。
4 西太平洋跨赤道扩散很多研究发现了近海生物在太平洋的跨赤道分布现象。双线魚銜(Diplogrammus goramensis)分布于西南太平洋和南海(Briggs, 1999)。部分具咸淡水洄游生活习性的副匙指虾属(Paratya)种类在西北太平洋的日本列岛和琉球群岛, 以及西南太平洋的新西兰、澳大利亚和新喀里多尼亚均有分布, 其mtDNA基因(COI和16S rRNA)分子数据显示, 各地理群均为单系分支, 日本列岛-琉球群岛群和新西兰群, 分别为西北太平洋和西南太平洋离外群最近类群, 这一咸淡水虾祖先种群在西南和西北太平洋之间可能在距今19—12.5 Ma经历了跨赤道扩散, 或在低海面时期, 沿着东印度三角区的连续岸线扩散(Page et al, 2005)。具咸淡水洄游习性的罗氏沼虾(Macrobrachium rosenbergii), 其赫胥黎线东部谱系在菲律宾和北澳大利亚-新几内亚共享, 且祖先单倍型来自澳大利亚, 菲律宾单倍型更年轻, 暗示了这一跨赤道的南北扩散方向为, 由北澳大利亚向菲律宾群岛的扩散(De Bruyn et al, 2004)。贾瑟琳招潮蟹(Uca jocelynae)跨赤道分布于从西南太平洋(瓦努阿图、新喀里多尼亚、巴布亚新几内亚), 到东印度三角的苏拉威西岛和西北太平洋(菲律宾群岛、台湾岛、琉球群岛和关岛)的海域(Shih et al, 2010), 其基于mtDNA COI基因的网络图显示, 该物种由单一谱系组成, 来自台湾岛、菲律宾和关岛等西北太平洋的单倍型与来自西南太平洋瓦努阿图和巴布亚新几内亚的单倍型只有2—4个位点替代, 进化关系很近(图 12), 暗示该物种经历了最近的西南和西北太平洋之间跨赤道扩散。红豆招潮蟹(Uca crassipes)分布于从西南太平洋(澳大利亚东海岸、巴布亚新几内亚、印尼), 到西北太平洋(包括菲律宾海岸、南海和琉球群岛等)广大海域(Aoki et al, 2013), 基于mtDNA基因(12S rRNA、16S rRNA、CR)的种群结构分析显示, 其东海区的琉球群岛和西南太平洋的茉莉亚岛(Moorea Island)种群展现了密切的遗传关系, 其CR网络进一步表明, 琉球群岛样本处于网络中心, 而西南太平洋样本处于网络末端(图 13), 同样暗示了存在一条由西北太平洋经东印度三角向西南太平洋跨赤道扩散的路线。
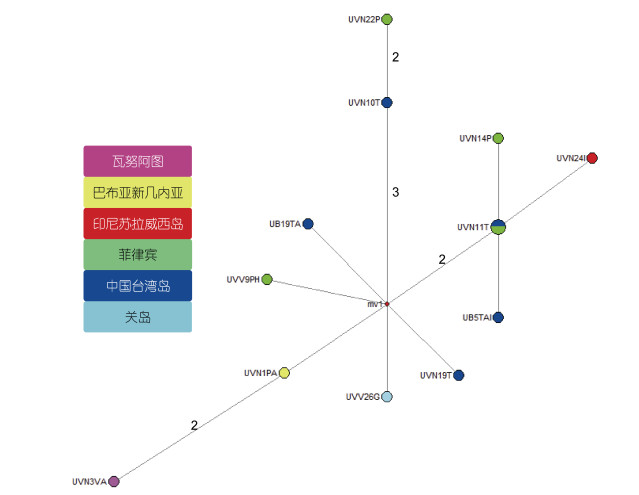 |
| 图 12 贾瑟琳招潮蟹(Uca jocelynae)进化网络图 Fig. 12 The evolutionary network of Uca jocelynae in the East Indies Triangle and West Pacific 注: 圆圈旁字符为单倍型名称, 圆圈面积和单倍型频率成正比, 分支旁数字为2个以上位点替代数, 单倍型采样点以不同颜色区分; 数据来自Shih等(2010) |
 |
| 图 13 红豆招潮蟹(Uca crassipes)进化网络图 Fig. 13 The evolutionary network of Uca crassipes in the Indo-West Pacific 注: 圆圈旁字符为单倍型名称, 圆圈面积和单倍型频率成正比, 分支旁数字暗示了2个以上位点替代数, 单倍型采样点以不同颜色区分; 数据来自Aoki等(2013) |
在上述鱼类和甲壳类不同物种中发现的琉球和南海等西北太平洋区域与西南太平洋的种群跨赤道南北双向基因流现象, 也见于库氏砗磲(Tridacna gigas) (Benzie et al, 1995)和长砗磲(Tridacna maxima) (Benzie et al, 1997), 这一跨赤道种群迁移模式, 可能受到西太平洋北赤道流-黑潮流、季节反转沿岸流和西南太平洋深层海流的影响(Benzie, 1998): 一方面, 西太平洋的表层北赤道流-黑潮流, 可以流入南海(Nan et al, 2015; Liu et al, 2017), 新几内亚表层(< 100 m)的沿岸流夏季流向西北, 而且该区域100—400 m的深层水团, 可以由西南太平洋沿澳洲、巴布亚新几内亚、印尼、菲律宾海岸全年向北流入南海(图 14)(Lukas et al, 1996); 另一方面, 菲律宾东部存在一个常年南流的沿岸流, 流速小于20 cm/s, 其流幅宽度在离岸200 km以内, 覆盖深度主要在0—700 m (丁宗信等, 1993), 且新几内亚表层沿岸流会发生季节性方向反转, 由夏季的西北向转为冬季的东南向(Zhang et al, 2020), 这一表层沿岸海流的流向季节变化, 有利于水团和生物的跨赤道输送。鱼类和甲壳类等浮游幼虫期, 以及具备垂直洄游习性的成体, 可以被表层和深层水团携带, 横跨西太平洋赤道, 这可以解释海洋生物在南海和东海等西北太平洋海区与西南太平洋岛屿之间的跨赤道扩散。
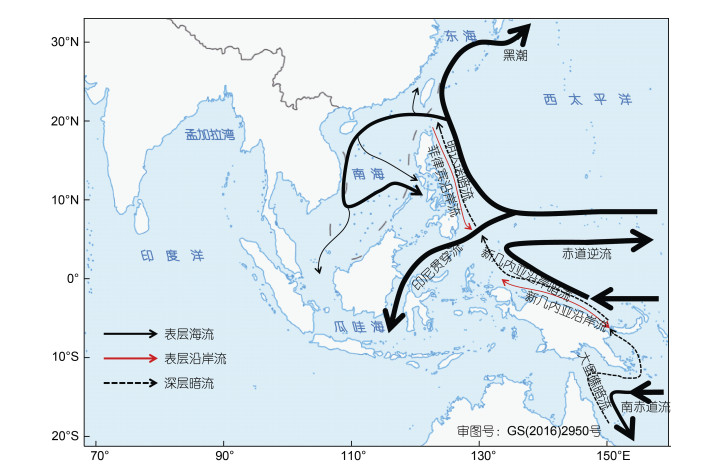 |
| 图 14 西太平洋表层(黑、红实线)和深层海流(断续线) Fig. 14 Surface (black or red solid curves) and subsurface circulations (broken thin curves) in the West Pacific 注: 据Lukas等(1996)、Benzie (1998)、Nan等(2015)、Liu等(2017)和Zhang等(2020) |
大量海洋动物, 广泛分布于印度洋东西海岸。腹足动物小楷笔螺(Mitra triplicata)分布区, 就横跨南海和印度洋东西海岸(Briggs, 1999)。蓝指海星(Linckia laevigata)广泛分布于印度洋和西太平洋, 由三个遗传谱系组成, 其中谱系Ⅱ在东印度三角区和西印度洋沿岸共享, 谱系Ⅰ和Ⅲ分别为西太平洋-东印度三角和西印度洋特有谱系, 暗示一方面产生了印度洋和太平洋的种群隔离分化, 另一方面又存在印度洋东西海岸的跨洋扩散(Otwoma et al, 2016)。背纹双锯鱼(Amphiprion akallopisos) 在东印度三角的爪哇海和苏门答腊岛沿岸, 以及西印度洋海岸分布, CR标记的种群遗传结构分析显示, 其印度洋东部和西部种群遗传分化显著, 无共享单倍型, 且东印度洋种群相对西印度洋种群具有更高的遗传多态性, 暗示其种群扩散起源地在东印度洋(Huyghe et al, 2017)。银线弹涂鱼(Periophthalmus argentilineatus)和卡路弹涂鱼(Periophthalmus kalolo)分布于中国南海、印度洋东西海岸, 采用核基因Rag1为遗传标记, 发现这两个物种的东印度三角区苏拉威西岛种群和西印度洋种群, 形成了多个深度分化的遗传谱系, 无单倍型共享, 且银线弹涂鱼的苏拉威西谱系D相对西印度洋谱系E具有离祖先节点更短的枝长和更古老的年龄, 卡路弹涂鱼的西印度洋谱系A为单系, 嵌套于并系的苏拉威西种群B中(图 15)(Polgar et al, 2014), 暗示这两种弹涂鱼在印度洋东西海岸的广泛分布, 都经历了由东印度洋向西印度洋的跨洋扩散。锯缘青蟹分子数据也支持了该物种由东印度洋的西北澳大利亚起源, 向东非海岸扩散的模式(图 16)(He et al, 2011)。
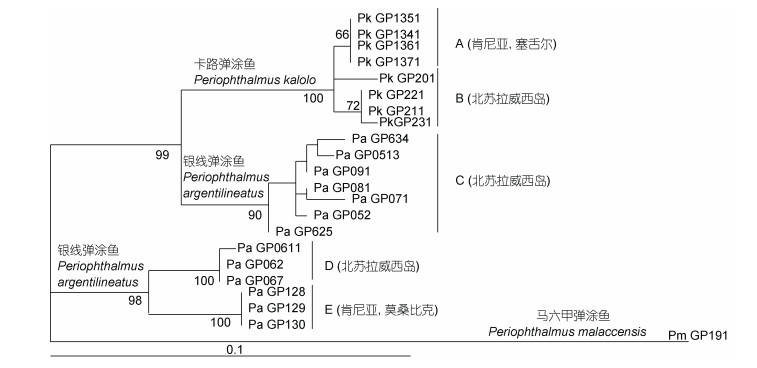 |
| 图 15 东印度三角和西印度洋沿岸银线弹涂鱼和卡路弹涂鱼系统进化树 Fig. 15 Phylogenetic trees of Periophthalmus argentilineatus and Periophthalmus kalolo from the coastal East Indies Triangle and West Indian Ocean 注: 系统发育树中各分支节点旁数值为节点自展支持百分数(%); 数据来自于Polgar等(2014) |
 |
| 图 16 印度洋-西太平洋地区锯缘青蟹(Scylla serrata)谱系分布和种群迁移路线图 Fig. 16 Spatial distribution and migration pathway of mud crab Scylla serrata in the Indo-West Pacific 注: 箭头为种群扩散方向; Ss-Clade Ⅰ和Ⅱ分别为锯缘青蟹两个遗传谱系; 据Keenan等(1998)、He等(2011) |
不同物种的种群遗传结构研究中, 都发现了西印度洋广布种的单一谱系模式。西印招潮蟹(Uca occidentalis)在几千公里的东非海岸, 只有一个星形的遗传谱系, 且不同区域之间未出现种群遗传分化(Silva et al, 2010; Naderloo et al, 2016); 锯缘青蟹(S. serrata)在西印度洋东非海岸广泛分布的种群也是单一的西印度洋谱系Ⅰ (图 16)(He et al, 2011), 这种类似中国东海、黄渤海的种群结构模式, 可能归因于西印度洋海岸的西南季风流和东北季风流(Prell et al, 1980; Pollock, 1993), 促进了近岸动物浮游幼虫在大空间尺度的南北基因交流。通过结合mtDNA基因(12S rRNA, COI)和核基因(H3), 在针对西印度洋潮间带笠藤壶属(Tetraclita)生物地理学研究中, 发现了该属存在分布于不同洋流系统的7个显著进化单元, 且绝大多数显著进化单元, 达到了物种分化的水平, 被定义为有效种(Tsang et al, 2012)。西印度洋同一海域, 进化时间尺度不同的类群, 在物种和谱系分化, 以及种群结构的差异, 可能归因于不同物种或类群进入该区域的时间尺度的差异, 进入更早的物种, 则被异质海洋环境隔离时间更长, 有足够时间分化为不同谱系或显著进化单元, 而较晚进入该区域的物种, 受限于有限进化时间, 尚未积累足够遗传差异和种群分化; 另一可能在于, 不同物种的扩散能力存在差异, 扩散能力强的物种, 海洋环流对其隔离效果, 相对于扩散能力弱的物种影响更小。
7 北、东印度洋和南海的进化联系北印度洋、东印度洋和南海, 共享大量的热带海洋动物, 如锯缘青蟹(S. serrata)、榄绿青蟹(S. olivacea)、紫螯青蟹(S. tranquebarica)和环纹招潮蟹(U. annulipes)等(Keenan et al, 1998; Shih et al, 2009a; Naderloo et al, 2016), 厘清这些物种在不同海区地理种群的进化联系, 对于理解其空间分布形成原因至关重要。根据前期研究结果, 北、东印度洋和南海的种群联系, 存在两个相反的扩散方向: 一方面, 在印度洋和西太平洋广泛分布的锯缘青蟹, 以mtDNA COI基因为标记, 发现其遗传分支Ⅰ, 在红海和南海之间共享, 且红海具有更古老的单倍型, 其迁移方向据此被推断为锯缘青蟹浮游幼虫在北印度洋夏季顺时针环流作用下由红海、北印度洋向南海扩散(图 16)(He et al, 2011); 另一方面, 基于mtDNA COI基因, 马来小藤壶(Chthamalus malayensis)的印度-马来谱系, 在南海和孟加拉湾共享, 且南海具有更古老的单倍型(Tsang et al, 2008), 暗示其孟加拉湾种群可能由南海扩散建群形成。本课题组对分布于南海和东北印度洋的鸢乌贼(Symplectoteuthis oualaniensis)的mtDNA基因标记研究, 也发现南海少数样本为东北印度洋优势谱系、东北印度洋少数样本为南海优势谱系的现象, 暗示了南海和东北印度洋之间虽然存在谱系隔离分化, 但仍然存在双向的遗传交流(未发表)。下一步, 需要进一步采用不同物种对比北印度洋、东印度洋和南海类群之间的种群结构和生物地理演化历史, 弄清海洋生物在南海与印度洋之间的连通性与海洋环流之间的关系。
8 生物进化中的地史信号基于生物和环境的协同演化关系, 地质、洋流和气候等环境事件, 必然影响生物的栖息地变化和种群隔离过程, 导致产生与这些地史事件相应的物种形成、谱系分化或种群数量动态变化。生态系统中由不同物种组成的群落, 如果通过比较谱系地理学研究, 发现了种间类似的普遍进化规律, 则可以用于指示该生态系统中环境事件的存在。
在淡水和陆生动植物蚓螈(Caecilians)、新蛙亚目(Neobatrachia)和节肢动物等的谱系地理进化史研究中, 已发现了印度从非洲大陆分离, 并和亚洲板块碰撞(Wilkinson et al, 2002; Biju et al, 2003; Shih et al, 2009b), 以及夏威夷等火山岛链先后露出海面成岛的信号(Roderick et al, 1998; Cowie et al, 2006)。
海洋动物的进化历史, 同样蕴含了重大地质事件的信息: 通过采用形态特征和mtDNA COI基因为标记, 在紧邻巴拿马地峡两侧的东太平洋和加勒比海海岸, 发现了很多进化上密切相关的鼓虾属(Alpheus)姐妹种(Knowlton et al, 1998), 这些姐妹种的出现, 暗示了3百万年前的巴拿马地峡封闭, 对于海洋生物栖息地的隔离和谱系、种群分化效应。跨洋种群扩散和隔离, 也在鱼类进化中发现了地质事件的线索, 通过mtDNA Cyt b基因, 在毛鳞鱼(Mallotus villosus)中发现了4个遗传谱系(西北大西洋谱系、东北大西洋谱系、东北太平洋谱系和北冰洋谱系), 其中的北冰洋谱系在北大西洋、北冰洋和北太平洋共享(Dodson et al, 2007), 且北冰洋谱系和东北太平洋谱系是一对最近分歧的进化关系最近的姐妹谱系, 暗示白令海峡的多次打开和封闭事件, 已影响了种群的扩散和谱系分化。海峡作为对于生物扩散的通道或物理障碍的影响, 也体现于绒螯蟹属(Eriocheir)的分布模式, 合浦绒螯蟹(E. hepuensis)的分布, 从南海北岸通过台湾海峡扩散到了东海沿岸的瓯江, 而中华绒螯蟹(E. sinensis), 其分布南界却止步于台湾海峡, 未能进入南海北部海岸(Xu et al, 2009), 暗示冰期暴露的台湾海峡, 限制了来自北方黄渤海和东海沿岸的中华绒螯蟹的进一步向南海扩散。此外, 海洋鱼类的进化过程, 也受到了入海河流的影响, 通过以Cyt b基因为分子标记, 重建东海大陆架日本带鱼历史上的有效种群数量, 发现距今15 ka至今, 日本带鱼种群数量一直持续增长, 且比距今30 ka历史上的最高峰增长了10倍(图 8)(He et al, 2014), 这暗示了长江很可能只是在距今15 ka以来的冰消期或全新世才流入东海, 否则, 如长江在末次冰盛期前早已流入东海, 则必会出现上一个间冰期(距今130—70 ka)高海面时和至今相似的有效种群数量, 这一推断和长江衍生的浙闵沿岸泥滩于全新世沉积, 在时间上一致(Hori et al, 2002)。
多数海洋生物的幼虫阶段均为浮游和随波逐流状态, 缺乏自主游泳能力, 因此海洋生物的空间分布和谱系演化历史, 也蕴含了洋流路径信息。前文提到的印度洋背纹双锯鱼、银线弹涂鱼、卡路弹涂鱼和锯缘青蟹的谱系进化历史均经历了从东印度洋向西印度洋的扩散(He et al, 2011; Polgar et al, 2014; Huyghe et al, 2017), 这一扩散路径, 暗示了印度洋常年西向的南赤道流对于海洋生物迁移的普遍影响规律。在目前的东海黑潮主轴暖水团中高丰度存在的浮游有孔虫(Pulleniatina spp.), 在末次冰盛期和距今4.5—3 ka的冲绳海沟沉积化石样本中, 丰度比例最低, 暗示此期存在一个台湾-琉球陆桥的屏障作用, 导致黑潮海流没有流入冲绳海沟, 而很可能在琉球群岛南端向东转向了(Ujiié et al, 1991, 1999); 然而, 黑潮暖流及其分支流在末次冰盛期却可能一直在日本列岛东西海岸稳定存在, 这为日本列岛东西海岸分别出现的暖水种角蝾螺(Turbo cornutus)和古氏滩栖螺(Batillaria cumingi)谱系分化(对马谱系和黑潮谱系)所支持(Kojima et al, 2000, 2004)。尽管上述生物对于洋流的指示研究, 仍然存在一些互相矛盾或争议性结果, 但其原因可能在于微体古生物学研究中, 对于物种的识别, 主要采用了基于传统的显微镜形态特征识别和鉴定的方法, 这一方法对于非同源相似或平行演化, 缺乏辨别能力, 会严重低估物种多样性, 导致物种多样性识别的分辨率低, 甚至错误识别形态相近而生态习性不同的隐存物种(Jarman et al, 2000)。而基于DNA分子标记和谱系生物地理学理论方法, 为我们提高物种、谱系识别的精度, 提供了更可信的手段(Hebert et al, 2003)。
生物进化中, 也留下了海面波动和气候循环的烙印。很多淡水物种来自海洋, 在中国华东和华北广泛分布的日本板跳钩虾(Platorchestia japonica), 其进化关系最近的姐妹种为栖息于西北太平洋海岸的太平洋扁跳虾(P. pacifica), 二者溯祖时间为16.9 Ma (Yang et al, 2013), 这两个物种的分化时间, 暗示中新世(17—10 Ma)高海面海侵事件(Haq et al, 1987), 导致了太平洋扁跳虾和日本板跳钩虾的祖先种群扩散进入中国东部平原地区, 之后随海面下降, 留在中国东部陆地的种群和海洋种群隔离, 分别形成了目前的淡水种日本板跳钩虾和海洋种太平洋扁跳虾。
鱼类的捕获产量和生物量, 与气候变化及其控制的海洋浮游植物初级生产力密切相关, 并随海洋中气候变化, 呈现周期性波动(Finney et al, 2002; Chavez et al, 2003)。而且, 在不同海区, 往往因为大气影响下的区域海洋环境差异, 导致海区间同一物种的生物量/捕获量呈现完全相反的变化规律(Hare et al, 1999)。而基于DNA分子数据的海洋生物种群动态演化, 也揭示了气候事件和区域海洋环境的信号。通过区域种群动态对比研究, 日本带鱼的东海有效种群规模受到了东亚夏季风影响下的长江淡水输入量驱动, 而南海种群的有效规模, 却受到了东亚冬季风影响下的南海北部陆坡上升流强弱控制(He et al, 2014)。
9 未来研究展望 9.1 谱系地理格局 9.1.1 生物地理边界需要继续关注半岛、地峡、海峡、海流、河口冲淡水等物理障碍, 在中国海域、东印度三角、西太、印度洋等海域导致的物种特有分布、谱系分化和种群遗传隔离效应。这对于认识海洋生物多样性和显著进化单元, 并保护好重要物种种质资源具有重要意义。
9.1.2 东印度三角区生物多样性中心尽管最近大量DNA分子数据支持海洋动物的东印度三角起源说, 但Santini等(2002)基于支序生物地理学方法认为, 东印度三角区很多海洋动物起源于西印度洋、澳大利亚和西南太平洋, 并受到冈瓦那古陆分裂和隔离过程影响。未来需要在西南太平洋、东印度三角以及印度洋范围内, 以更多物种的分子数据来验证或分辨东印度三角的起源中心说、汇聚中心说和边缘效应。
9.1.3 海洋生物迁移路线/通道根据已有前期研究线索, 需进一步关注东海和东北太平洋、南海与西南太平洋、南海与印度洋、印度洋和西太平洋之间的共享物种的迁移路线重建。这些迁移历史的研究, 对于我们认识中国海、印度洋和西太平洋生物多样性形成原因、合理利用海洋生物资源, 具有重大价值。
9.1.4 海洋渔业资源产出潜力需要进一步在印度洋和西太平洋海域, 结合分子生态学、化学海洋学和物理海洋学研究方法, 厘清不同海洋生态区或生物地理省初级生产力和动物种群动态变化相关性基础上, 掌握现在及未来相关海域渔业资源产出能力, 为我国远洋渔业资源开发和沿岸国家经济发展提供决策依据, 并服务于“海上丝绸之路”发展。
9.2 地球历史重建采用不同海洋物种为研究对象, 通过剖析其印度洋-西太平洋海域的谱系生物地理进化历史, 可以为古特提斯海的消退(Piccoli et al, 1987; Hou et al, 2011)、青藏高原隆升(施雅风等, 1999; Peng et al, 2006)、入海河流演化(Waters et al, 2001; Rüber et al, 2004)、印度季风-东亚季风演化(Sun et al, 2003; He et al, 2014)和大洋环流的进化(Benzie, 1999; White et al, 2010)等, 提供新的线索。
致谢 本研究得到了吴莹教授、杜金洲教授的鼓励和支持, 印度洋和西太平洋鸢乌贼样本采集中, 得到了朱卓毅和江山博士的帮助, 在此一并致谢!
丁宗信, 白虹. 1993. 菲律宾东部沿岸流. 海洋科学, (2): 48-51 |
朱永其, 曾成开, 金长茂. 1981. 东海大陆架晚更新世以来海面变化. 科学通报, (19): 1195-1198 |
汪品先. 1990. 冰期时的中国海-研究现状与问题. 第四纪研究, (2): 111-124 DOI:10.3321/j.issn:1001-7410.1990.02.002 |
郑元甲, 陈雪忠, 程家骅, 等. 2003. 东海大陆架生物资源与环境. 上海: 上海科技出版社
|
施雅风, 李吉均, 李炳元, 等. 1999. 晚新生代青藏高原的隆升与东亚环境变化. 地理学报, 54(1): 10-21 DOI:10.3321/j.issn:0375-5444.1999.01.002 |
谢传礼, 翦知湣, 赵泉鸿, 等. 1996. 末次盛冰期中国海古地理轮廓及其气候效应. 第四纪研究, (1): 1-10 DOI:10.3321/j.issn:1001-7410.1996.01.001 |
Aoki M, Wada K, 2013. Genetic structure of the wide-ranging fiddler crab Uca crassipes in the west Pacific region. Journal of the Marine Biological Association of the United Kingdom, 93(3): 789-795 DOI:10.1017/S0025315412001178 |
Barber P H, Palumbi S R, Erdmann M V, Moosa M K, 2002. Sharp genetic breaks among populations of Haptosquilla pulchella (Stomatopoda) indicate limits to larval transport: patterns, causes, and consequences. Molecular Ecology, 11: 659-674 DOI:10.1046/j.1365-294X.2002.01468.x |
Benzie J A H, 1998. Genetic structure of marine organisms and SE Asian biogeography. In: Hall R, Holloway J D eds. Biogeography and Geological Evolution of SE Asia. Leiden, The Netherlands: Backhuys Publishers, 197-209
|
Benzie J A H, 1999. Genetic structure of coral reef organisms: ghosts of dispersal past. American Zoologist, 39(1): 131-145 DOI:10.1093/icb/39.1.131 |
Benzie J A H, Williams S T, 1995. Gene flow among giant clam (Tridacna gigas) populations in Pacific does not parallel ocean circulation. Marine Biology, 123(4): 781-787 DOI:10.1007/BF00349121 |
Benzie J A H, Williams S T, 1997. Genetic structure of giant clam (Tridacna maxima) Populations in the west pacific is not consistent with dispersal by present-day ocean currents. Evolution, 51(3): 768-783 |
Biju S D, Bossuyt F, 2003. New frog family from India reveals an ancient biogeographical link with the Seychelles. Nature, 425(6959): 711-714 DOI:10.1038/nature02019 |
Briggs J C, 1974. Marine Zoogeography. New York: McGraw-Hill
|
Briggs J C, 1987. Antitropical distribution and evolution in the Indo-West Pacific Ocean. Systematic Zoology, 36(3): 237-247 DOI:10.2307/2413064 |
Briggs J C, 1999. Coincident Biogeographic patterns: indo-West Pacific Ocean. Evolution, 53(2): 326-353 DOI:10.1111/j.1558-5646.1999.tb03769.x |
Briggs J C, 2000. Centrifugal speciation and centres of origin. Journal of Biogeography, 27(5): 1183-1188 DOI:10.1046/j.1365-2699.2000.00459.x |
Briggs J C, 2003. Marine centres of origin as evolutionary engines. Journal of Biogeography, 30(1): 1-18 DOI:10.1046/j.1365-2699.2003.00810.x |
Briggs J C, 2005. The marine East Indies: diversity and speciation. Journal of Biogeography, 32(9): 1517-1522 DOI:10.1111/j.1365-2699.2005.01266.x |
Chan B K K, Tsang L M, Chu K H, 2006. Morphological and genetic differentiation of the acorn barnacle Tetraclita squamosa (Crustacea, Cirripedia) in East Asia and description of a new species of Tetraclita. Zoologica Scripta, 36(1): 79-91 |
Chao S Y, 1990. Circulation of the East China Sea, a numerical study. Journal of Oceanography, 46(6): 273-295 DOI:10.1007/BF02123503 |
Chavez F P, Ryan J, Lluch-Cota S E et al, 2003. From anchovies to sardines and back: multidecadal change in the Pacific Ocean. Science, 299(5604): 217-221 DOI:10.1126/science.1075880 |
Cowie R H, Holland B S, 2006. Dispersal is fundamental to biogeography and the evolution of biodiversity on oceanic islands. Journal of Biogeography, 33(2): 193-198 DOI:10.1111/j.1365-2699.2005.01383.x |
Crandall E D, Frey M A, Grosberg R K et al, 2008. Contrasting demographic history and phylogeographical patterns in two Indo-Pacific gastropods. Molecular Ecology, 17(2): 611-626 |
De Bruyn M, Wilson J A, Mather P B, 2004. Huxley's line demarcates extensive genetic divergence between eastern and western forms of the giant freshwater prawn, Macrobrachium rosenbergii. Molecular Phylogenetics and Evolution, 30(1): 251-257 DOI:10.1016/S1055-7903(03)00176-3 |
Dodson J J, Tremblay S, Colombani F et al, 2007. Trans-Arctic dispersals and the evolution of a circumpolar marine fish species complex, the capelin (Mallotus villosus). Molecular Ecology, 16(23): 5030-5043 DOI:10.1111/j.1365-294X.2007.03559.x |
Ekman S, 1953. Zoogeography of the Sea. London: Sidgwick & Jackson
|
Fang G H, Susanto D, Soesilo I et al, 2005. A note on the South China Sea shallow interocean circulation. Advances in Atmospheric Sciences, 22(6): 946-954 DOI:10.1007/BF02918693 |
Finney B P, Gregory-Eaves I, Douglas M S V et al, 2002. Fisheries productivity in the northeastern Pacific Ocean over the past 2, 200 years. Nature, 416(6882): 729-733 DOI:10.1038/416729a |
Hall R, 1996. Reconstructing Cenozoic S.E. Asia. In: Hall R, Blundell D J eds. Tectonic Evolution of Southeast Asia. London: Geological Society Special Publication, 153-184
|
Han Z Q, Gao T X, Yanagimoto T et al, 2008. Deep phylogeographic break among white croaker Pennahia argentata (Sciaenidae, Perciformes) populations in North-western Pacific. Fisheries Science, 74(4): 770-780 DOI:10.1111/j.1444-2906.2008.01588.x |
Han Z Q, Zheng W, Zhu W B et al, 2015a. A barrier to gene flow in the Asian paddle crab, Charybdis japonica, in the Yellow Sea. ICES Journal of Marine Science, 72(5): 1440-1448 DOI:10.1093/icesjms/fsv020 |
Han Z Q, Zhu W B, Zheng W et al, 2015b. Significant genetic differentiation between the Yellow Sea and East China Sea populations of cocktail shrimp Trachypenaeus curvirostris revealed by the mitochondrial DNA COI gene. Biochemical Systematics and Ecology, 59: 78-84 DOI:10.1016/j.bse.2014.12.028 |
Haq B U, Hardenbol J, Vail P R, 1987. Chronology of fluctuating sea levels since the Triassic. Science, 235(4793): 1156-1167 DOI:10.1126/science.235.4793.1156 |
Hare S R, Mantua N J, Francis R C, 1999. Inverse production regimes: Alaska and west coast pacific salmon. Fisheries, 24(1): 6-14 DOI:10.1577/1548-8446(1999)024<0006:IPR>2.0.CO;2 |
He L J, Mukai T, Chu K H et al, 2015. Biogeographical role of the Kuroshio Current in the amphibious mudskipper Periophthalmus modestus indicated by mitochondrial DNA data. Scientific Reports, 5: 15645 DOI:10.1038/srep15645 |
He L J, Zhang A B, Weese D et al, 2010. Late Pleistocene population expansion of Scylla paramamosain along the coast of China: a population dynamic response to the Last Interglacial sea level highstand. Journal of Experimental Marine Biology and Ecology, 385(1-2): 20-28 DOI:10.1016/j.jembe.2010.01.019 |
He L J, Zhang A B, Weese D et al, 2014. Demographic response of cutlassfish (Trichiurus japonicus and T. nanhaiensis) to fluctuating palaeo-climate and regional oceanographic conditions in the China seas. Scientific Reports, 4: 6380 |
He L J, Zhang A B, Zhu C D et al, 2011. Phylogeography of the mud crab (Scylla serrata) in the Indo-West Pacific reappraised from mitochondrial molecular and oceanographic clues: transoceanic dispersal and coastal sequential colonization. Marine Ecology, 32(1): 52-64 DOI:10.1111/j.1439-0485.2010.00406.x |
Hebert P D N, Cywinska A, Ball S L et al, 2003. Biological identifications through DNA barcodes. Proceedings of the Royal Society of Londo. Series B: Biological Sciences, 270(1512): 313-321 DOI:10.1098/rspb.2002.2218 |
Hewitt G M, 1996. Some genetic consequences of ice ages, and their role in divergence and speciation. Biological Journal of the Linnean Society, 58(3): 247-276 DOI:10.1006/bijl.1996.0035 |
Hewitt G M, 1999. Post-glacial re-colonization of European biota. Biological Journal of the Linnean Society, 68(1-2): 87-112 DOI:10.1111/j.1095-8312.1999.tb01160.x |
Hori K, Saito Y, Zhao Q H et al, 2002. Architecture and evolution of the tide-dominated Changjiang (Yangtze) River delta, China. Sedimentary Geology, 146(3-4): 249-264 DOI:10.1016/S0037-0738(01)00122-1 |
Hou Z E, Sket B, Fišer C et al, 2011. Eocene habitat shift from saline to freshwater promoted Tethyan amphipod diversification. Proceedings of the National Academy of Sciences of the United States of America, 108(35): 14533-14538 DOI:10.1073/pnas.1104636108 |
Huyghe F, Kochzius M, 2017. Highly restricted gene flow between disjunct populations of the skunk clownfish (Amphiprion akallopisos) in the Indian Ocean. Marine Ecology, 38(1): e12357 DOI:10.1111/maec.12357 |
Ichikawa H, Beardsley R C, 2002. The current system in the Yellow and East China seas. Journal of Oceanography, 58: 77-92 DOI:10.1023/A:1015876701363 |
Jarman S N, Elliott N G, 2000. DNA evidence for morphological and cryptic Cenozoic speciations in the Anaspididae, 'living fossils' from the Triassic. Journal of Evolutionary Biology, 13(4): 624-633 DOI:10.1046/j.1420-9101.2000.00207.x |
Kanemori Y, Takegaki T, Natsukari Y, 2006. Genetic population structure of the mudskipper Boleophthalmus pectinirostris inferred from mitochondrial DNA sequences. Japanese Journal of Ichthyology, 53(2): 133-141 |
Kato Y, Yagi T, 2004. Biogeography of the subspecies of Parides (Byasa) alcinous (Lepidoptera: Papilionidae) based on a phylogenetic analysis of mitochondrial ND5 sequences. Systematic Entomology, 29(1): 1-9 DOI:10.1111/j.1365-3113.2004.00238.x |
Keenan C P, Davie P J F, Mann D L, 1998. A revision of the genus Scylla De Haan, 1833 (Crustacea: Decapoda: Brachyura: Portunidae). The Raffles Bulletin of Zoology, 46: 217-245 |
Knowlton N, Weigt L A, 1998. New dates and new rates for divergence across the Isthmus of Panama. Proceedings of the Royal Society of London. Series B: Biological Sciences, 265(1412): 2257-2263 DOI:10.1098/rspb.1998.0568 |
Kojima S, Hayashi I, Kim D et al, 2004. Phylogeography of an intertidal direct-developing gastropod Batillaria cumingi around the Japanese Islands. Marine Ecology Progress Series, 276: 161-172 DOI:10.3354/meps276161 |
Kojima S, Kamimura S, Iijima A et al, 2005. Phylogeography of the endangered tideland snail Batillaria zonalis in the Japanese and Ryukyu Islands. Ecological Research, 20(6): 686-694 DOI:10.1007/s11284-005-0082-5 |
Kojima S, Kamimura S, Iijima A et al, 2006. Molecular phylogeny and population structure of tideland snails in the genus Cerithidea around Japan. Marine Biology, 149(3): 525-535 DOI:10.1007/s00227-005-0183-2 |
Kojima S, Segawa R, Hayashi I, 1997. Genetic differentiation among populations of the Japanese turban shell Turbo (Batillus) cornutus corresponding to warm currents. Marine Ecology Progress Series, 150: 149-155 DOI:10.3354/meps150149 |
Kojima S, Segawa R, Hayashi I, 2000. Stability of the courses of the warm coastal currents along the Kyushu Island suggested by the population structure of the Japanese Turban shell, Turbo (Batillus) cornutus. Journal of Oceanography, 56(5): 601-604 DOI:10.1023/A:1011113430343 |
Ladd H S, 1960. Origin of the Pacific island molluscan fauna. American Journal of Science, 258: 137-150 |
Lee T Y, Lawver L A, 1995. Cenozoic plate reconstruction of Southeast Asia. Tectonophysics, 251(1-4): 85-138 DOI:10.1016/0040-1951(95)00023-2 |
Letouzey J, Kimura M, 1985. Okinawa Trough genesis: structure and evolution of a backarc basin developed in a continent. Marine and Petroleum Geology, 2(2): 111-130 DOI:10.1016/0264-8172(85)90002-9 |
Liu S Y V, Chang F T, Borsa P et al, 2014. Phylogeography of the humbug damselfish, Dascyllus aruanus (Linnaeus, 1758): evidence of Indo-Pacific vicariance and genetic differentiation of peripheral populations. Biological Journal of the Linnean Society, 113(4): 931-942 DOI:10.1111/bij.12378 |
Liu Z Q, Gan J P, 2017. Three-dimensional pathways of water masses in the South China Sea: a modeling study. Journal of Geophysical Research: Oceans, 122(7): 6039-6054 DOI:10.1002/2016JC012511 |
Longhurst A, Sathyendranath S, Platt T et al, 1995. An estimate of global primary production in the ocean from satellite radiometer data. Journal of Plankton Research, 17(6): 1245-1271 DOI:10.1093/plankt/17.6.1245 |
Lukas R, Yamagata T, McCreary J P, 1996. Pacific low-latitude western boundary currents and the Indonesian throughflow. Journal of Geophysical Research: Oceans, 101(C5): 12209-12216 DOI:10.1029/96JC01204 |
Maekawa K, Lo N, Kitade O et al, 1999. Molecular phylogeny and geographic distribution of wood-feeding cockroaches in East Asian Islands. Molecular Phylogenetics and Evolution, 13(2): 360-376 DOI:10.1006/mpev.1999.0647 |
Milliman J D, Meade R H, 1983. World-wide delivery of river sediment to the oceans. The Journal of Geology, 91(1): 1-21 DOI:10.1086/628741 |
Mukai T, Sugimoto M, 2006. Genetic population structure of the mudskipper, Periophthalmus modestus, in Japan inferred from mitochondrial DNA sequence variations. Japanese Journal of Ichthyology, 53(2): 151-158 |
Naderloo R, Schubart C D, Shih H T, 2016. Genetic and morphological separation of Uca occidentalis, a new East African fiddler crab species, from Uca annulipes (H. Milne Edward, 1837) (Crustacea: Decapoda: Brachyura: Ocypodidae). Zoologischer Anzeiger-A Journal of Comparative Zoology, 262: 10-19 DOI:10.1016/j.jcz.2016.03.010 |
Naimie C E, Blain C A, Lynch D R, 2001. Seasonal mean circulation in the Yellow Sea-a model-generated climatology. Continental Shelf Research, 21(6-7): 667-695 DOI:10.1016/S0278-4343(00)00102-3 |
Nakamura K, Suwa R, Denda T et al, 2009. Geohistorical and current environmental influences on floristic differentiation in the Ryukyu Archipelago, Japan. Journal of Biogeography, 36(5): 919-928 DOI:10.1111/j.1365-2699.2008.02057.x |
Nan F, Xue H J, Yu F, 2015. Kuroshio intrusion into the South China Sea: a review. Progress in Oceanography, 137: 314-333 DOI:10.1016/j.pocean.2014.05.012 |
Ni G, Li Q, Kong L F et al, 2014. Comparative phylogeography in marginal seas of the northwestern Pacific. Molecular Ecology, 23(3): 534-548 DOI:10.1111/mec.12620 |
Ogoh K, Ohmiya Y, 2005. Biogeography of luminous marine ostracod driven irreversibly by the Japan Current. Molecular Biology and Evolution, 22(7): 1543-1545 DOI:10.1093/molbev/msi155 |
Ota H, 2000. The current geographic faunal pattern of reptiles and amphibians of the ryukyu archipelago and adjacent regions. Tropics, 10(1): 51-62 DOI:10.3759/tropics.10.51 |
Otwoma L M, Kochzius M, 2016. Genetic population structure of the coral reef Sea Star Linckia laevigata in the Western Indian Ocean and Indo-West Pacific. PLoS One, 11(10): e0165552 DOI:10.1371/journal.pone.0165552 |
Page T J, Baker A M, Cook B D et al, 2005. Historical transoceanic dispersal of a freshwater shrimp: the colonization of the South Pacific by the genus Paratya (Atyidae). Journal of Biogeography, 32(4): 581-593 DOI:10.1111/j.1365-2699.2004.01226.x |
Palumbi S R, 1996. What can molecular genetics contribute to marine biogeography? An urchin's tale. Journal of Experimental Marine Biology and Ecology, 203(1): 75-92 DOI:10.1016/0022-0981(96)02571-3 |
Palumbi S R, 1997. Molecular biogeography of the Pacific. Coral Reefs, 16(Sl): S47-S52 |
Peng Z G, Ho S Y W, Zhang Y G et al, 2006. Uplift of the Tibetan plateau: evidence from divergence times of glyptosternoid catfishes. Molecular Phylogenetics and Evolution, 39(2): 568-572 DOI:10.1016/j.ympev.2005.10.016 |
Piccoli G, Sartori S, Franchino A, 1987. Benthic molluscs of shallow Tethys and their destiny. In: McKenzie K G ed. Proceedings International Symposium on Shallow Tethys. Rotterdam: A.A. Balkema, 333-373
|
Polgar G, Zane L, Babbucci M et al, 2014. Phylogeography and demographic history of two widespread Indo-Pacific mudskippers (Gobiidae: Periophthalmus). Molecular Phylogenetics and Evolution, 73: 161-176 DOI:10.1016/j.ympev.2014.01.014 |
Pollock D E, 1993. Speciation in spiny lobsters-clues to climatically-induced changes in ocean circulation patterns. Bulletin of Marine Science, 53(3): 937-944 |
Prell W L, Hutson W H, Williams D F et al, 1980. Surface circulation of the Indian Ocean during the last glacial maximum, approximately 18, 000 yr B.P. Quaternary Research, 14(3): 309-336 DOI:10.1016/0033-5894(80)90014-9 |
Rand D M, 1994. Thermal habit, Metabolic rate and the evolution of mitochondrial DNA. Trends in Ecology & Evolution, 9(4): 125-131 |
Roderick G K, Gillespie R G, 1998. Speciation and phylogeography of Hawaiian terrestrial arthropods. Molecular Ecology, 7(4): 519-531 DOI:10.1046/j.1365-294x.1998.00309.x |
Rüber L, Britz R, Kullander S O et al, 2004. Evolutionary and biogeographic patterns of the Badidae (Teleostei: Perciformes) inferred from mitochondrial and nuclear DNA sequence data. Molecular Phylogenetics and Evolution, 32(3): 1010-1022 DOI:10.1016/j.ympev.2004.04.020 |
Santini F, Winterbottom R, 2002. Historical biogeography of Indo-western Pacific coral reef biota: is the Indonesian region a Centre of origin?. Journal of Biogeography, 29(2): 189-205 DOI:10.1046/j.1365-2699.2002.00669.x |
Sherman K, Duda A M, 1999a. An ecosystem approach to global assessment and management of coastal waters. Marine Ecology Progress Series, 190: 271-287 DOI:10.3354/meps190271 |
Sherman K, Duda A M, 1999b. Large marine ecosystems: an emerging paradigm for fishery sustainability. Fisheries, 24(12): 15-26 DOI:10.1577/1548-8446(1999)024<0015:LME>2.0.CO;2 |
Shi M C, Chen C S, Xu Q C et al, 2002. The role of Qiongzhou Strait in the seasonal variation of the South China Sea circulation. Journal of Physical Oceanography, 32(1): 103-121 DOI:10.1175/1520-0485(2002)032<0103:TROQSI>2.0.CO;2 |
Shih H T, Kamrani E, Davie P J F et al, 2009a. Genetic evidence for the recognition of two fiddler crabs, Uca iranica and U. albimana (Crustacea: Brachyura: Ocypodidae), from the northwestern Indian Ocean, with notes on the U. lactea species-complex. Hydrobiologia, 635: 373-382 DOI:10.1007/s10750-009-9930-6 |
Shih H T, Naruse T, Ng P K L, 2010. Uca jocelynae sp. nov., a new species of fiddler crab (Crustacea: Brachyura: Ocypodidae) from the Western Pacific. Zootaxa, 2337: 47-62 DOI:10.11646/zootaxa.2337.1.4 |
Shih H T, Yeo D C J, Ng P K L, 2009b. The collision of the Indian plate with Asia: molecular evidence for its impact on the phylogeny of freshwater crabs (Brachyura: Potamidae). Journal of Biogeography, 36(4): 703-719 DOI:10.1111/j.1365-2699.2008.02024.x |
Silva I C, Mesquita N, Paula J, 2010. Lack of population structure in the fiddler crab Uca annulipes along an East African latitudinal gradient: genetic and morphometric evidence. Marine Biology, 157(5): 1113-1126 DOI:10.1007/s00227-010-1393-9 |
Spalding M D, Fox H E, Allen G R et al, 2007. Marine ecoregions of the world: a bioregionalization of coastal and shelf areas. BioScience, 57(7): 573-583 DOI:10.1641/B570707 |
Stehli F G, Wells J W, 1971. Diversity and age patterns in hermatypic corals. Systematic Biology, 20(2): 115-126 |
Sulaiman Z H, Ovenden J R, 2010. Population genetic evidence for the east-west division of the narrow-barred Spanish mackerel (Scomberomorus commerson, Perciformes: Teleostei) along Wallace's Line. Biodiversity and Conservation, 19(2): 563-574 DOI:10.1007/s10531-009-9699-y |
Summerfield M A, Hulton N J, 1994. Natural controls of fluvial denudation rates in major world drainage basins. Journal of Geophysical Research: Solid Earth, 99(B7): 13871-13883 DOI:10.1029/94JB00715 |
Sun X J, Luo Y L, Huang F et al, 2003. Deep-sea pollen from the South China Sea: pleistocene indicators of East Asian monsoon. Marine Geology, 201(1-3): 97-118 DOI:10.1016/S0025-3227(03)00211-1 |
Tamaki K, Honza E, 1991. Global tectonics and formation of marginal basins: role of the western Pacific. Episodes, 14(3): 224-230 DOI:10.18814/epiiugs/1991/v14i3/005 |
Timm J, Kochzius M, 2008. Geological history and oceanography of the Indo-Malay Archipelago shape the genetic population structure in the false clown anemonefish (Amphiprion ocellaris). Molecular Ecology, 17(18): 3999-4014 DOI:10.1111/j.1365-294X.2008.03881.x |
Tsang L M, Achituv Y, Chu K H et al, 2012. Zoogeography of intertidal communities in the West Indian Ocean as determined by ocean circulation systems: patterns from the Tetraclita barnacles. PLoS One, 7(9): e45120 DOI:10.1371/journal.pone.0045120 |
Tsang L M, Chan B K K, Wu T H et al, 2008. Population differentiation in the barnacle Chthamalus malayensis: postglacial colonization and recent connectivity across the Pacific and Indian Oceans. Marine Ecology Progress Series, 364: 107-118 DOI:10.3354/meps07476 |
Ujiié H, Tanaka Y, Ono T, 1991. Late Quarternary paleoceanographic record from the middle Ryukyu Trench slope, northwest Pacific. Marine Micropaleontology, 18(1-2): 115-128 DOI:10.1016/0377-8398(91)90008-T |
Ujiié H, Ujiié Y, 1999. Late quaternary course changes of the Kuroshio Current in the Ryukyu Arc region, northwestern Pacific Ocean. Marine Micropaleontology, 37(1): 23-40 DOI:10.1016/S0377-8398(99)00010-9 |
Voris H K, 2000. Maps of Pleistocene sea levels in Southeast Asia: shorelines, river systems and time durations. Journal of Biogeography, 27(5): 1153-1167 DOI:10.1046/j.1365-2699.2000.00489.x |
Wang J, Tsang L M, Dong Y W, 2015. Causations of phylogeographic barrier of some rocky shore species along the Chinese coastline. BMC Evolutionary Biology, 15: 114 DOI:10.1186/s12862-015-0387-0 |
Wang L, Liu S F, Zhuang Z M et al, 2013. Population Genetic Studies Revealed Local Adaptation in a High Gene-Flow Marine Fish, the Small Yellow Croaker (Larimichthys polyactis). PLoS One, 8(12): e83493 DOI:10.1371/journal.pone.0083493 |
Wang P X, 2004. Cenozoic deformation and the history of sea-land interactions in Asia. In: Clift P, Kuhnt W, Wang P X et al eds. Continent-Ocean Interactions within East Asian Marginal Seas. Washington, DC, USA: American Geophysical Union, 1-22
|
Waters J M, Craw D, Youngson J H et al, 2001. Genes meet geology: fish phylogeographic pattern reflects ancient, rather than modern, drainage connections. Evolution, 55(9): 1844-1851 DOI:10.1111/j.0014-3820.2001.tb00833.x |
White C, Selkoe K A, Watson J et al, 2010. Ocean currents help explain population genetic structure. Proceedings of the Royal Society B: Biological Sciences, 277(1688): 1685-1694 DOI:10.1098/rspb.2009.2214 |
Wilkinson M, Sheps J A, Oommen O V et al, 2002. Phylogenetic relationships of Indian caecilians (Amphibia: Gymnophiona) inferred from mitochondrial rRNA gene sequences. Molecular Phylogenetics and Evolution, 23(3): 401-407 DOI:10.1016/S1055-7903(02)00031-3 |
Wu H, Shen J, Zhu J R et al, 2014. Characteristics of the Changjiang plume and its extension along the Jiangsu Coast. Continental Shelf Research, 76: 108-123 DOI:10.1016/j.csr.2014.01.007 |
Xu J W, Chan T Y, Tsang L M et al, 2009. Phylogeography of the mitten crab Eriocheir sensu stricto in East Asia: pleistocene isolation, population expansion and secondary contact. Molecular Phylogenetics and Evolution, 52(1): 45-56 DOI:10.1016/j.ympev.2009.02.007 |
Xu X D, Oda M, 1999. Surface-water evolution of the eastern East China Sea during the last 36, 000 years. Marine Geology, 156(1-4): 285-304 DOI:10.1016/S0025-3227(98)00183-2 |
Yamaguchi S, 2003. Biogeographical history and morphological evolution of two closely related ostracod species, Ishizakiella ryukyuensis and I. miurensis. Journal of Crustacean Biology, 23(3): 623-632 DOI:10.1651/C-2345 |
Yang L, Hou Z E, Li S Q, 2013. Marine incursion into East Asia: a forgotten driving force of biodiversity. Proceedings of the Royal Society B: Biological Sciences, 280(1757): 20122892 DOI:10.1098/rspb.2012.2892 |
Yu D H, Chu K H, 2006. Low genetic differentiation among widely separated populations of the pearl oyster Pinctada fucata as revealed by AFLP. Journal of Experimental Marine Biology and Ecology, 333(1): 140-146 DOI:10.1016/j.jembe.2005.12.046 |
Yuan D L, Zhu J R, Li C Y et al, 2008. Cross-shelf circulation in the Yellow and East China Seas indicated by MODIS satellite observations. Journal of Marine Systems, 70(1-2): 134-149 DOI:10.1016/j.jmarsys.2007.04.002 |
Zhang L L, Wu J, Wang F J et al, 2020. Seasonal and interannual variability of the currents off the new guinea coast from mooring measurements. Journal of Geophysical Research: Oceans, 125(12): e2020JC016242 |
Zhou F L, Jiang S G, Jiang Y J et al, 2009. Population genetic structure of the tiger prawn (Penaeus monodon) in the coastal waters of South China, based on mitochondrial DNA control region sequences. Journal of Applied Ichthyology, 25(4): 411-416 DOI:10.1111/j.1439-0426.2009.01228.x |
Zhu P, Wu H, 2018. Origins and transports of the low-salinity coastal water in the southwestern Yellow Sea. Acta Oceanologica Sinica, 37(4): 1-11 DOI:10.1007/s13131-018-1200-x |
 2021, Vol. 52
2021, Vol. 52