中国海洋湖沼学会主办。
文章信息
- 程娇, 沙忠利, 孙邵娥, 惠敏. 2021.
- CHENG Jiao, SHA Zhong-Li, SUN Shao-E, HUI Min. 2021.
- 深海化能生态系统大型生物多样性分布格局及其起源演化研究进展
- PROGRESS ON THE ORIGIN, EVOLUTION AND BIOGEOGRAPHIC PATTERN OF MEGAFAUNA BIODIVERSITY IN DEEP-SEA CHEMOSYNTHETIC ECOSYSTEMS
- 海洋与湖沼, 52(2): 508-521
- Oceanologia et Limnologia Sinica, 52(2): 508-521.
- http://dx.doi.org/10.11693/hyhz20200700209
文章历史
-
收稿日期:2020-07-15
收修改稿日期:2020-12-02
2. 中国科学院海洋大科学研究中心 青岛 266071;
3. 青岛海洋科学与技术试点国家实验室 青岛 266237
2. Center for Ocean Mega-Science, Chinese Academy of Sciences, Qingdao 266071, China;
3. Laboratory for Marine Biology and Biotechnology, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266237, China
地球有“蓝色星球”之称,海洋占地球表面积70%以上,其中约3/4是深度大于1000m的深海。由于调查能力不足,深海一直被视为贫瘠的荒漠。直到20世纪70年代,深海的绚丽多彩才展示于世人面前。1977—1979年,美国、法国和墨西哥联合科研小组利用载人潜水器(阿尔文号)在加拉帕格斯裂谷区和21°N东太平洋海隆热液区首次发现了繁茂的深海生物群落(Weiss et al, 1977; Corliss et al, 1979)。随后,科学家又发现了深海冷泉生态系统。深海热液、冷泉及其生物群落的发现成为20世纪后期最令人瞩目的科学发现之一。
深海化能生态系统黑暗、高压、低氧,常富含硫化氢、甲烷、重金属等物质,具有理化环境独特的极端条件,长期被认为不适合生物生存。随着深海探测技术的不断发展,人类在深海热液、冷泉等极端环境中发现了越来越多的生物类群,这重新定义了生命的边际。因受地质构造、水文动力、复杂地形和特殊理化环境的影响,深海化能生态环境与光照区的浅海海域有着截然不同的群落组成且孕育着特有的生物物种(McArthur et al, 1998),也使其成为研究生命起源与适应性进化的重要场所(Martin et al, 2008)。其次,深海化能生态系统的能量来源和有机质的合成与太阳光支持的生态系统不同,深海化能微生物可以利用氧化甲烷、硫化氢等还原性物质释放的能量合成有机物,为消费者提供食物来源,因此其“黑暗食物链”生命过程成为研究的焦点。大型无脊椎动物-微生物化能营养共生体也成为热液与冷泉生态系统独特而重要的营养方式。这些大型动物包括管状蠕虫类、贝类、甲壳类和环节动物等优势种群,通过与甲烷氧化菌等化能营养微生物形成共生体系(细胞内共生、细胞外共生或者二者兼有)获得生存所需营养物质,同时也为化能菌提供稳定的生存环境和营养物质,进而促进其生长繁衍。第三,深海化能环境具有高压、酸化、低氧、寡营养等特点,大型生物不仅可以在这种极端生境中生存,还可以快速形成群落,并产生了一系列结构新颖、作用机制特殊并具有潜在应用价值的功能蛋白,蕴藏着极其丰富的基因资源,对耐低温、耐高温、重金属解毒等相关功能基因的挖掘与利用将在生物医学、工业、环境、能源等领域产生重要的应用前景与巨大的经济效益。
深潜工具的研发直接影响着各国对深海领域的研究。美国是较早开展载人深潜的国家之一,1964年建造的“阿尔文”号载人潜水器可以下潜到数千米深海,是当今世界上下潜次数最多的载人潜水器;俄罗斯是目前世界上拥有载人潜水器最多的国家,比较著名的是1987年建成的“和平一号”和“和平二号”两艘潜水器;我国2013年建成“蛟龙号”载人深潜器,完成了南海海山区和冷泉区等的调查研究;2020年中国“奋斗者”号载人潜水器成功坐底深度10909 m的马里亚纳海沟,我国的深潜事业取得了巨大进步,《海底两万里》不再是无稽之谈。除载人深潜器HOV(human operated vehicle)外,有缆无人潜器ROV(remotely operated vehicle),无人自主潜器AUV(autonomous underwater vehicle),深拖系统TV(towed vehicle)和水下滑翔机UG(underwater glider)等设备也已广泛应用于深海探测。
40多年来,通过对不同类型深海化能生态系统的研究,人类取得了大量新的科学发现。深海化能生态系统已成为“国际海洋生物普查计划(2000—2010年)”(Census of Marine life, CoML)研究项目之一,旨在提高人们对全球尺度上热液、冷泉和其他还原型生境中物种多样性、丰富度和分布的认识,了解形成和维持这些生态系统及其生物地理格局的非生命和生命过程。本文重点综述了深海化能极端生境生物多样性的特点及其起源演化的研究进展状况,对存在的问题及发展趋势进行了系统分析,以期为我国深海生物学与生态学等研究提供参考借鉴与新思路。
1 深海化能生态系统的生物多样性特点 1.1 主要物种组成及其特点与其他海洋生态系统一致,节肢动物甲壳纲,软体动物双壳纲、腹足纲以及环节动物构成了深海化能生态系统动物的优势类群。热液生物群落是深海化能生态系统的重要组成部分,至2006年,已描述并明确分类地位的典型热液口大型动物共540种(Desbruyères et al, 2006b),隶属于10门,24纲,55目/类,166科,314属。节肢动物门、软体动物门和环节动物门是热液区的最优势门类,占所有热液生物种类的85%以上。节肢动物门是最大的门,有2纲,11目/类,71科,121属,202种;最大的纲是甲壳纲,有10目/类,70科,118属,197种;最大的目/类是桡足类,有19科,36属,75种(表 1)。调查发现热液动物区系具有低物种数,高优势度的特点,即热液动物区系物种多样性低,但是某一种的个体数量高,密度大(Van Dover et al, 2002; Ramirez-Llodra et al, 2007)。研究还发现深海热液区动物拥有大量特有种,平均每个热液口接近10个特有种(Jeng et al, 2004; Tarasov et al, 2005)。
| 门 | 纲 | 目/类 | 科 | 属 | 种 |
| 多孔动物门(Porifera) | 2 | 2 | 3 | 6 | 10 |
| 刺胞动物门(Cnidaria) | 3 | 5 | 13 | 22 | 24 |
| 软体动物门(Mollusca) | 5 | 14 | 35 | 73 | 163 |
| 线虫动物门(Nematoda) | 2 | 3 | 3 | 5 | 7 |
| 棘头动物门(Acanthocephala) | 1 | 1 | 1 | 1 | 1 |
| 纽形动物门(Nemertini) | 1 | 1 | 1 | 1 | 1 |
| 环节动物门(Annelida) | 2 | 7 | 22 | 61 | 104 |
| 节肢动物门(Arthropoda) | 2 | 11 | 71 | 121 | 202 |
| 棘皮动物门(Echinodermata) | 4 | 5 | 7 | 9 | 9 |
| 脊索动物门(Chordata) | 2 | 6 | 10 | 15 | 19 |
冷泉生态系统与热液生态系统中的生物群落相似,科学家已经发现的冷泉生物有600多种(German et al, 2011)。相较于热液,冷泉生态系统中的物种生物量高,但多样性更低。例如,“贻贝-潜铠虾群落”是典型的冷泉生态系统组分,在这个系统中,贻贝和潜铠虾生物量巨大,形成生物床。其次,冷泉和热液生态系统的生物生长速率不同,热液生物一般生长速度快,如热液巨型管虫Riftia pachyptila是地球上生长最快的无脊椎动物之一,而冷泉生物生长速度较慢,如管状蠕虫Lamellibrachia sp.可以存活250 a(Bergquist et al, 2000)。此外,在Costa Rica太平洋沿岸调查发现,Jaco Scarp存在新的生境:热泉(Hydrothermal seep),即甲烷渗流和热液喷口混合出现,该区域管状蠕虫Lamellibrachia sp.、贻贝、帽贝Lepetodrilus sp.和铠甲虾生物量巨大。热泉动物区系的发现揭示了热液和冷泉动物区系间的密切联系,并推测该区域可能成为来自已经消亡的热液和冷泉物种的迁移和基因交流的理想区域(Levin et al, 2012)。
1.2 生态系统结构特点热液生态系统以化能自养细菌为基础,主要通过化能营养繁衍,与陆地和浅海生命形式迥然不同,并且热液喷口化学成分对其生物群落的分布影响显著(Luther et al, 2001)。热液流体温度可高达400℃,其中富含多种从围岩中淋滤出来的金属元素(如Fe、Mn、Cu、Pb、Zn等)、无机组分以及挥发性组分(CH4、H2S、CO及H2)等。以热液喷口为中心向四周形成了温度和化学两个梯度带:海底喷出的热液在与周围的低温海水混合后,形成一个以喷口为中心,向四周渐低的温度梯度带;同时热液在形成、喷发和扩散过程中,与经过的岩石和周围的低温海水发生反应,使热液流体含有大量金属元素,在喷发后形成了以喷口为中心,喷出物质的浓度向四周渐低的化学梯度带。这两个梯度带的存在促使了生物以喷口为中心,向四周呈环带状分布。喷口附近水温可达100℃以上,以古细菌和嗜热细菌为主,它们附在烟囱壁、沉积物或玄武岩表面;热液口周围,在温度20—40℃的区域,以嗜热的多毛类为主,如庞贝虫Alvinella pompejana;远离热液口,温度在2—15℃的区域,生物种类繁多,以管状蠕虫Ridgeia piscesae为代表,其他还有双壳类、腹足类、管水母类、腕足动物、虾蟹类和棘皮类等,鱼类和头足类则可以在热液喷口周围较大范围内活动(Baross et al, 1985; Reysenbach et al, 2002)。然而由于热液喷口外围水体温度较低,尽管喷口中心水温较高,但热量交换很快,在离开喷口很短的距离水温急速下降,上述喷口生物的环带状分布只是一般模式,更多的情况是不同生物门类之间的“混生”。
深海化能生态系统中的无脊椎动物大都与化能合成型微生物形成共生关系,海水中大量的还原性物质是这些微生物的能量来源,并成为驱动化能生态系统发展的动力。2011年Petersen等发现大西洋海岭热液区深海贻贝Gigantidas的共生微生物可氧化热液喷口中的氢,作为初级生产者提供能量(Petersen et al, 2011)。对相同量的热液而言,氢氧化过程产生的能量是甲烷氧化过程的7倍,而相比硫氧化过程产生的能量则高达18倍。通过透射电子显微镜观察发现深海贻贝内共生微生物存在于鳃细胞中(Wentrup et al, 2014),原位杂交显示γ-变形菌纲的硫氧化菌和甲烷氧化菌是两种主要共生菌(Duperron et al, 2006),并贯穿深海贻贝整个生活史。此外,参与氢氧化过程的关键吸氢酶hupL(Uptake hydrogenase large subunit)基因也被发现存在于巨型管虫R. pachyptila和盲虾Rimicaris exoculata等其他热液区动物的共生微生物中(Hügler et al, 2011),表明氢是重要能量来源之一。由此可见,深海无脊椎动物与共生菌在漫长的演化过程中建立的互利共生关系无疑是深海化能生态系统的重要特点之一,是其走向繁荣最为关键的一步。
1.3 食物链和食物网结构特点万物生长靠太阳,没有阳光,地球上万物就不能生长,而深海化能生态系统的发现改变了千古不变的生命定律。深海热液、冷泉生态系统在食物链结构特别是食物链初级环节与普通生物群落截然不同,形成独特的“黑暗食物链”。微生物是化能生态系统中种类最为丰富的生物类群,它们作为食物链的底端,与异养微生物和藤壶、海葵、蠕虫、鱼、虾等大型生物共同构成了化能生物群落。细菌(尤其化能自养菌)被认为是海底热液生态系统的基础。变形菌门(Proteobacteria)是热液区的优势细菌类群,其中尤以ε-变形菌分布最广、丰度最高,它们均为化能自养菌,是热液喷口硫循环的主要参与者。这类细菌对热液区复杂多变环境的广泛适应性得益于其多样化的代谢途径,它们能通过氧化热液喷发出的大量还原性无机物而获取能量,并将无机碳固定为有机碳。
冷泉环境中存在的微生物类型主要为自由生活的甲烷氧化菌、硫酸盐还原菌和共生的甲烷氧化菌、硫酸盐还原菌,它们构成了冷泉生态系统的初级生产者。管状蠕虫、蛤类、贻贝类、多毛类动物以及海星、海胆、虾等为一级消费者,鱼、螃蟹、冷水珊瑚等为二级消费者,它们最终被线虫类动物分解而回归自然,形成了一套完整的冷泉生态系统食物链网(图 1)。Barry等(1996)根据营养源来源于内共生细菌的比例,提出了专性种(obligate species)概念,并将墨西哥湾典型冷泉的生态群落划分为:(1) 专性种:如菌席、管状蠕虫、贻贝类和蛤类,它们构建了栖息环境,维系其他物种繁衍;(2) 潜在专性种:如部分腹足动物、帽贝和蟹;(3) 非专性种:如海葵、部分短尾类甲壳动物、腹足动物和冷泉珊瑚。菌席是冷泉生态系统动物群落的食物链基础,主要分布于硫化物与沉积物界面附近,形成数厘米甚至数百米的斑块。菌席通常由混合菌群组成,生物量主要受纤丝状硫酸盐还原菌控制。冷泉菌席一般呈白色、黄色和橙色,其颜色主要与硫化物氧化的活性水平相关(Nikolaus et al, 2003)。研究认为地质流体是将深部生物圈微生物从地下运送到地上环境的载体,从而形成并维持冷泉生态系统中的微生物群落(Chakraborty et al, 2020)。
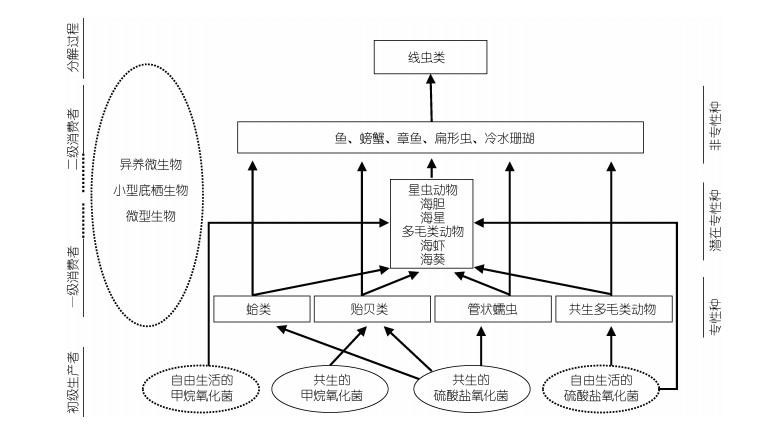 |
| 图 1 冷泉生态系统结构及食物链特征(陈忠等,2007) Fig. 1 The characters of ecosystem structure and food chain in cold seep areas (from Chen et al, 2007) |
由于海底热液区与地球早期的环境极为相似,而且地球上最早的食物链被认为是以化能合成为基础,科学家由此推测地球上最早的生命起源于与深海热液相似的环境,也引起了人们对生命起源各种理论的讨论。Bult等(1996)的分子系统学研究表明从现代海底热液喷口环境中分离得到的极端嗜热的古菌和细菌位于系统发育树根部,是地球上最接近“共同祖先”的类群。嗜热应该是目前这些生物从“最终的共同祖先”继承下来的最原始的生理特性之一,是生命起源于海底热液喷口的重要证据。
由于要依靠化能食物来源,深海热液和冷泉等化能生态系统中的大型生物一般被认为具有独立的演化历史(Tunnicliffe, 1992; McArthur et al, 1998)。目前关于热液生物的起源存在两种假说:“古老假说” (the antiquity hypothesis)和“灭绝/重生假说” (the extinction/repopulation hypothesis)。“古老假说”认为现代热液区物种是中生代甚至于更远的年代就生活在热液区生物的遗存,它们避开了全球性灭绝事件后延续至今。由于海底热液远离地表环境,可能为这些远古生物提供了一个可以躲避周期性全球生物大灭绝的避难所,它所特有的生物是“活化石”,记录着亿万年来的连续进化历史。“古老假说”主要基于在古生代发现的热液区生物化石证据及热液物种的形态学数据(Newman, 1985)。例如在冲绳海槽中部伊平屋热液区发现的3种蔓足类生物,其中有2种仍保持着原始体形(马军英等, 1996)。
“灭绝/重生假说”认为热液生物进化不是连续的,而是经历过至少一次灭绝事件,然后通过浅海区生物迁徙而重新繁荣起来,目前基于分子数据重建的热液口重要生物类群的系统进化关系及分子钟推算的分歧时间结果多支持该假说。研究认为,现今的热液物种大多起源于晚白垩纪到早第三纪之间,即晚中生代与早新生代之间,这一时期发生了全球深海缺氧/低氧事件。深海化能合成生物类群的生存也需要一定的氧气界面(Vrijenhoek, 2013),而在古新世/始新世地球温度升高,使得深海温度在57 Ma时急剧上升,相应地深海氧气浓度降至最低,从而导致深海底栖生物大量灭绝(Kennett et al, 1991)。晚白垩纪/早第三纪之间是一个生物演化的活跃期,该时期还发生了几次与区域海洋缺氧事件、海洋酸化和剧烈环境变化有关的小规模灭绝事件(Jacobs et al, 1998; Rogers, 2000; Harnik et al, 2012)。深海动物类群的大规模灭绝为后来热液生物的入侵创造了机会。例如Lorion等(2013)利用多分子标记构建了深海贻贝的系统发育关系并重建了其进化历史,结果显示深海贻贝起源于近海,分化时间约在白垩纪晚期,后期的生境分化推动了深海贻贝物种多样性的分化。Sun等(2018)利用线粒体与核基因标记系统开展了十足目真虾下目的分子系统学研究,结果表明热液化能生态系统的标志性物种-阿尔文虾(Alvinocarididae)的祖先首先由浅海入侵到深海,然后入侵到热液,具有“浅海-深海-热液”进化模式;进一步对十足目的分子系统发生分析显示多个热液类群均处于系统树较进化的位置,证实热液大型甲壳动物极有可能从非热液环境迁徙而来,并非热液古老物种的遗存,支持“灭绝/重生”假说(Sun et al, 2019)。分子钟结果显示热液类群Alvinocarididae,Bythograeidae和Galatheoidea分别起源于白垩纪与早中新世,这些入侵化能生态系统事件可能与当时全球深海缺氧事件有关。
目前对于深海化能生态系统无脊椎动物类群的近海起源得到了初步共识,即现生深海类群多起源于白垩纪晚期,近海生物以鲸落、冷泉为“跳板”扩散到深海大洋等主要化能环境中(Van Dover et al, 2002; Yang et al, 2013; Sun et al, 2018, 2019)。但值得注意的是,热液受地质活动影响强烈,其生命周期短暂,与多数深海区域稳定的环境特征并不一致,海山和海底平原与近海生物的连通性是否与热液生物存在差异尚不清晰。关于深海热液生物的起源争议以及与近海生物的源汇关系需要基于更多的生物类群、更全面的化石证据以及更高分辨率的系统发育研究才能完整解析。
2.2 深海化能生态系统生物的地理分布格局自从1977年美国科学家在东太平洋加拉帕斯裂谷发现了第一个现代热液喷口以来,越来越多的科学家加入到了海底热液活动的研究中,全球冷泉也越来越多地被发现,已报道完成了约250多个热液和冷泉区的生物多样性调查(German et al, 2011; Suess, 2014)。其中,对海底热液研究更为系统全面,据Inter Ridge Global Database of Active Submarine Hydrothermal Vent Fields (https://vents-data.interridge.org/)统计,截至目前全球共发现721个海洋热液口,大多分布在海底地壳板块交接区,主要位于太平洋、大西洋、印度洋和北冰洋的大洋中脊和西太平洋的弧后盆地,其中太平洋中数量最多,达到452个。随着热液区调查资料的积累,研究发现热液生物区系通常呈现出独特的生物多样性(Boetius, 2005)。例如东太平洋加拉帕戈斯裂谷和东太平洋海隆区具有相似的生物群落,但与胡安·德富卡海岭热液区的生物群落明显不同(Tunnicliffe et al, 1998)。在东太平洋海隆热液区可见散布或呈灌木状聚集分布的管状蠕虫,而在中部大西洋海脊热液流体周围却是密集分布的盲虾(Van Dover, 2000)。在中印度洋脊的Kairei和Edmond热液区孕育了独特的无脊椎动物群落,如海葵、盲虾、贻贝、腹足动物和蟹等都是印度洋热液底栖生物的标志种类(Van Dover et al, 2001)。而西南印度洋北部的“天成”热液区生物组成与中印度洋脊更接近,南部的“龙旂”和“断桥”热液区虽总体仍与中印度洋脊生物组成接近,但兼具北大西洋脊、东斯科舍脊和中印度洋脊热液区的部分特征,可能是上述三个洋脊之间的过渡区(Zhou et al, 2018)。研究南大洋的东斯科舍脊热液区则发现该区域雪蟹、藤壶、帽贝、腹足动物等较多,而多毛类西伯达虫、贻贝和阿尔文虾等在其他海域热液区丰富的物种在该热液区不存在,这些类群除了西伯达虫,大都具有浮游幼虫期,但却极少存在于南极海域,因此认为南大洋海洋环境可能成为了热液物种的扩散筛选屏障(Rogers et al, 2012)。
因成体大多营底栖生活,热液无脊椎动物主要通过深海洋流将幼体运送到合适的栖息地来生长繁殖以实现在不同热液区的扩张,深海的极端环境和地质构造对热液生物的扩散产生了重要影响(Tunnicliffe et al, 1996)。此外,热液浮力羽流的携带作用以及生物幼体潜在的扩散能力对热液生物的扩散也起到一定的作用(Bachraty et al, 2009; Lunina et al, 2014)。一般相比于不同热液区间跨越海底的距离,生物群落的相似性与连通它们的洋脊长度的相关性更高,因为近底层洋流往往因洋脊地形的影响而使幼体沿着洋脊扩散(Tunnicliffe et al, 1996; Vrijenhoek, 2010)。Van Dover等(2001)通过划分区系的方法来研究全球热液区生物多样性,并通过分子生物学方法研究不同区系生物之间的联系,发现印度洋热液生物区系和太平洋热液生物区系在进化关系上更为紧密;Van Dover等(2002)进一步总结了全球热液区无脊椎动物的多样性情况,将全球的热液后生动物划分为西太平洋区系、东北太平洋区系、东太平洋山脊区系、亚速尔群岛区系、中大西洋山脊区系和印度洋区系,指出不同的区系有着特有的物种组成。Bachraty等(2009)进一步统计了三大洋63个热液区共332属592种热液生物的分布情况,将全球热液区划分为了六个热液生物地理区系:西北太平洋区系,西南太平洋与中印度洋脊区系,东北太平洋区系,北部东太平洋海隆区系,东南太平洋海隆区系和大西洋中脊。在此基础上建立了一个全球热液生物起源与扩散模型,该模型认为东太平洋海隆区是热液生物扩散的枢纽,并通过7条途径进行扩散。然而Moalic等(2012)基于网络理论(networktheory)对Bachraty等(2009)所研究的63个热液区数据进行了重新分析,提出了西太平洋更可能是现代热液生物起源中心的观点。与大洋中脊相比,西太平洋由复杂的弧后盆地组成(Desbruyères et al, 2006a),并且热液口通常伴有最大的水深变化(Moalic et al, 2012)。此外,在弧后盆地通常是热液与冷泉共存(Sibuet et al, 2002),已有研究表明弧后盆地的热液生态系统是由浅水物种以冷泉为“跳板”入侵后繁荣起来的。因此,热液口水深的不均匀性、与冷泉的密切联系及其生境的复杂性使得西太平洋更有可能成为热液生物的地理起源中心(Moalic et al, 2012)。Kiel(2016)进一步综合79个热液、冷泉和鲸落化能区域生物群落进行网络分析,将全球深海热液和冷泉划分为8个区系:(1) 印度洋脊区,(2) 热带西太平洋区,(3) 太平洋东北部胡安·德富卡海岭区,(4) 东太平洋海隆与加拉帕戈斯海岭区,(5) 中大西洋脊与南极南大西洋东斯科舍洋脊区,(6) 东北太平洋弧后盆地热液区与冷泉区,(7) 美洲西海岸墨西哥湾冷泉区(又称作大西洋赤道带区),以及(8) 地中海冷泉区。研究还发现被沉积物覆盖的喷口是连接其他化能生态系统的纽带,而太平洋中被沉积物覆盖的喷口较多,大西洋中却很少,因此大西洋中热液、冷泉动物组成差别较大,而太平洋中则较小。最近,基于科级阶元的生物多样性数据分析表明西北太平洋、西南太平洋与南大洋热液区系生物多样性高,北部东太平洋海隆、中大西洋脊与印度洋热液生物多样性处于中等水平,而中开曼扩张中心被认为是低生物多样性(Thaler et al, 2019)。
上述热液生物起源中心观点主要依据热液生物区系物种组成与分布等资料,尚未得到系统发生结果的验证。Herrera等(2015)对三大洋分布的热液藤壶进行了分子系统学研究,结果指出热液藤壶起源于西太平洋,随后通过南半球向东进行扩散,最终形成目前的地理分布格局。该结果与Bachraty等(2009)提出的东太平洋海隆作为热液生物起源中心的观点不一致。阿尔文虾(Alvinocarididae)是热液的标志性物种,目前全世界已发现阿尔文虾科9属32种,均分布在热液和冷泉等化能生态系统,在太平洋、大西洋和印度洋热液区均有分布,且拥有较高的喷口特有种比例,不同的热液区孕育着独特的阿尔文虾种属(Lunina et al, 2014),揭示其生物地理分布格局有助于认识整个热液动物分布模式及其形成过程。Sun等(2018)对热液阿尔文虾科的生物地理学研究结果揭示出阿尔文虾起源于西太平洋的弧后盆地热液区,先后于3.80 Ma和8.84 Ma经由西南印度洋中脊进入大西洋,并于2.85 Ma通过太平洋-南极海岭进入东太平洋。研究者认为阿尔文虾最有可能起源于西太平洋的弧后盆地,这与深海热液藤壶的起源地一致(Herrera et al, 2015),同时也印证了Moalic等(2012)提出的西太平洋是现代热液生物起源中心的观点。Wu等(2019)对全球热液分布的多鳞虫(Polynoidae)的分布情况进行了统计,划分了七个热液多鳞虫生物地理区系,发现西太平洋比东太平洋海隆有更高的多鳞虫物种多样性,指出西太平洋可能是热液多鳞虫的起源中心。因此,目前的研究结果大多支持热液生物西太平洋起源的观点,但仍需开展更多热液生物类群的生物地理学研究,在进化尺度上为解释全球热液区生物多样性的形成演变过程提供数据支撑。
2.3 深海热液和冷泉区大型动物的种群连通性关于热液、冷泉生物的种群遗传学研究,多集中在热液区域,主要包括甲壳类、双壳类、腹足类等(Beedessee et al, 2013; Yahagi et al, 2015; Jang et al, 2016; Roterman et al, 2016; Sun et al, 2020a),对热液、冷泉不同生态系统间的连通性和基因交流研究相对较少。
已有应用线粒体基因对热液、冷泉均有分布的柯氏潜铠虾Shinkaia crosnieri和平端深海偏顶蛤G. platifrons的比较种群遗传学研究发现,柯氏潜铠虾群体的遗传分化程度显著高于平端深海偏顶蛤,因为两个物种的采样区域完全一致,研究者推测造成二者种群扩散分布和进化的内在因素可能不同(Shen et al, 2016)。然而利用简化基因组测序技术对平端深海偏顶蛤开展的种群遗传学研究结果却发现热液、冷泉群体间存在显著遗传分化,且筛选到多个高离散位点(outlier)(Xu et al, 2017)。应用单核苷酸多态性SNP(single nucleotide polymorphism)标记及线粒体基因对大西洋中脊同属两种深海贻贝的群体进化分析发现两近缘种发生了广泛的基因杂交渐渗(Breusing et al, 2017)。在柯氏潜铠虾的研究中,Yang等(2016a)发现热液、冷泉群体在线粒体细胞色素氧化酶COI (cytochrome c oxidase subunit I)序列上存在显著的遗传分化,在单个核基因上分化程度却很低,提示该物种在线粒体基因上可能受到选择作用。Cheng等(2020)利用简化基因组测序技术对柯氏潜铠虾冲绳热液和南海冷泉群体进行了全基因组位点扫描,分析结果却显示两地理群体发生显著遗传分化。研究者分析造成柯氏潜铠虾种群产生分化的原因可能如下:首先,柯氏潜铠虾成体营底栖生活,主要依靠幼体进行扩散以实现不同种群间的联系,其营卵黄营养的幼体扩散能力较弱,可能不利于长距离扩散;其次,处于东海海盆的冲绳热液区与处于南海海盆的冷泉区地理距离较远(约800 km),且吕宋海峡在一定程度上对柯氏潜铠虾种群间基因交流造成了地理屏障;第三,热液和冷泉在理化环境参数上的差异,如甲烷、硫化氢浓度以及微生物的种类和丰度可能都对两种群间遗传分化的产生具有促进作用。研究者进一步对筛选得到的高分化位点进行功能注释,发现这些高分化位点所在的基因功能涉及免疫、转座以及多种代谢过程,初步揭示出其本地适应性的遗传基础。此外,在长角阿尔文虾Alvinocaris longirostris中则发现相距甚远的不同热液、冷泉间的个体COI单倍型相近,基因交流频繁(Tokuda et al, 2006),推断可能与其较长的浮游幼虫期和较强的游泳扩散能力有关。
以上研究表明,热液、冷泉分布的不同物种显示出的基因交流状况存在差异,且应用高分辨率、高覆盖度的遗传标记进行种群遗传学研究势在必行。基于全基因组层面数据的种群基因组学(population genomics)研究方法不仅能获得全基因组范围内大量的SNP变异信息,还可以结合基因组参考序列挖掘与适应性相关的功能基因,进而阐释种群适应环境微进化的分子机制。
3 深海化能生态系统生物的适应性演化机制 3.1 深海化能生态系统大型生物对环境的适应机制在近海到深海的演替过程中,深海大型生物展现出一系列适应性演化特征以适应深海环境条件,包括眼睛、消化道的退化,营养体或鳃组织的特化,特殊的血红蛋白等(Van Dover et al, 1989; Duperron et al, 2005; Projecto-Garcia et al, 2010)。深海热液喷口处水温高达400℃以上,随后迅速衰减至深海的背景温度(2—4℃),盲虾R. kairei、庞贝虫A. pompejana等深海无脊椎动物分布在极近热液口处,其中庞贝蠕虫是目前所知地球上最耐高温、耐温差的后生动物,耐高温可达105℃ (Chevaldonné et al, 1992)。通过与热液喷口周边生活的巨型管虫R. pachyptila及近海沙烛Arenicola marina比较,研究者发现庞贝虫可以通过提高纤维胶原蛋白螺旋区域的脯氨酸含量和稳定性高的氨基酸三聚体的数目来提高高温耐受性(Sicot et al, 2000)。除了温度变化大,深海热液喷口附近的海水还富含硫化物、重金属等剧毒物质,其浓度甚至高到液体喷出后迅速形成晶体,足以破坏多数蛋白质的结构,造成蛋白质变性(Danovaro et al, 2014)。巨型管虫则具有发达的羽毛状触手,触手中的血红蛋白具有携带并运送O2和H2S的能力,H2S通过血红蛋白运输到营养体中由共生菌转化为硫酸盐并提供合成有机物所需要的能量(Van Dover et al, 2004)。
对于深海生物演化的关键过程和演化机制研究是当前国际深海研究的前沿方向,多组学数据的解析可以为深海生物的适应性演化机制提供证据。目前已发表的深海化能极端生境物种基因组有深海冷泉贻贝G. platifrons (Sun et al, 2017),管虫L. luymesi (Li et al, 2019),笠贝Bathyacmaea lacteal (Liu et al, 2020)和囊螂蛤Archivesica marissinica (Ip et al, 2020)的全基因组测序,但深海热液动物中仅见对鳞足螺Chrysomallon squamiferuma的全基因组报道,研究发掘出其基因组中与生物矿化相关的多个转录因子,并揭示出其生物矿化的古老起源(Sun et al, 2020b)。与其他类群相比,对深海化能生态系统中贝类的适应性研究报道较多。研究者对热液、冷泉两种深海贻贝G. azoricus和G. platifrons不同组织的转录组进行测定,并应用荧光定量和原位杂交等技术,研究了其适应环境的免疫响应(Bettencourt et al, 2010; Barros et al, 2015; Wong et al, 2015; Détrée et al, 2017)。Sun等(2017)通过对深海贻贝和近海贻贝比较基因组分析发现有稳定蛋白结构作用的热休克蛋白HSP70 (heat shock protein)以及参与物质运输的转运蛋白ABC transporter在深海贻贝基因组中发生显著扩张,前者可能有助于修复深海贻贝在深海化能极端环境下的蛋白质结构损伤,而后者可能有助于深海贻贝通过鳃表皮细胞排出有毒物质。已有研究还发现深海贻贝生物节律与潮汐有关,但实验室驯养后呈现出一定的昼夜节律,研究认为其生物节律的变化可能是一种对环境刺激的反应,也可能是由于内源生物钟的调节作用导致(Mat et al, 2020)。在甲壳动物中,研究者对分布于热液区的奥氏蟹Austinograea alayseae与浅海蟹进行比较转录组分析,发现多个免疫相关基因受到正向选择,但与对深海贻贝的研究结果相似(Hardivillier et al, 2004),研究未发现区别于非化能生态物种的特殊金属硫蛋白基因类型(Hui et al, 2017)。Hui等(2018a)对深海热液、冷泉优势物种长角阿尔文虾A. longirostris进行了转录组测定和进化分析,研究发现与浅海物种相比,长角阿尔文虾部分基因(如视蛋白基因)位点受到选择作用或呈现高表达(如冷激蛋白编码基因),特定解毒相关酶类显示可能存在基因复制或多拷贝,这些组学特征可能与长角阿尔文虾适应深海化能极端环境相关。Hui等(2018b)进一步对长角阿尔文虾蛋白乙酰化修饰组进行了分析,发现乙酰化修饰蛋白在线粒体和过氧化物酶体中富集,并揭示出多个可能与深海压力适应及代谢调节相关的乙酰化蛋白,筛选得到的特异血蓝蛋白乙酰化位点可能参与长角阿尔文虾对深海低氧环境的适应。在多毛类环节动物中,同样通过与浅海物种进行比较转录组分析发现两种热液蠕虫Branchipolynoe pettiboneae、Lepidonotopodium sp.分别通过提高血红蛋白表达量及tetra-domain血红蛋白的快速进化等不同策略来应对深海低氧环境(Zhang et al, 2017b)。
尽管已开展了部分类群深海生物及其浅海近缘物种的比较研究,目前仍然缺乏对深海生物演化的关键过程与内在机制的系统认知。此外,不同生物类群的深海适应性演化是彼此割裂的独立进化事件还是在强选择压力驱动下的趋同进化事件尚不明确。通过多类群相互印证,开展对深海与近海共有典型代表类群间的多组学(形态组、生理组、转录组、基因组等)比较研究,是明晰深海生物适应性演化过程与机制的重要途径。
3.2 深海化能生态系统中共生体系与极端环境适应深海化能生态系统中存在着大量微生物,大型生物除了自身具有特殊的生理构造外,与化能自养微生物形成共生关系是大型生物适应深海化能极端环境的关键(Duperron et al, 2013)。然而由于深海生物尤其是很多微生物不可培养,共生关系的研究进展缓慢。核糖体16S扩增子测序与宏基因组等技术的发展为研究不可培养微生物的遗传多样性、进化及其与宿主的共生关系提供了良好的工具。对深海微生物共生现象的研究主要集中在双壳贝类、多毛类、腹足类及大型甲壳类中(Kim et al, 2000; Roy et al, 2004; Urakawa et al, 2005)。
在内共生方面,研究发现共生微生物不仅为大型生物提供必需的物质和能量,同时也参与到环境胁迫的适应中。对深海贻贝G. azoricus重金属刺激实验结果显示与重金属解毒相关的基因表达量与体内共生菌含量成正比,表明共生菌可能在深海贻贝应对重金属胁迫中发挥作用(Bougerol et al, 2015)。另外深海贻贝鳃中富集的重金属含量明显高于外套膜中的含量,且相较冷泉区,热液区贻贝富集的Fe、Cr、Cd与Pb等的浓度更高(Zhou et al, 2020)。通过测定两种深海贻贝中共生的硫氧化菌基因组并结合转录组与蛋白组的测定分析,研究者发现相对其近缘种,深海贻贝共生菌发生了明显的基因重排,且大量基因是通过基因的水平转移获得,并在宿主体内表达毒素相关的基因,可能参与协同宿主免疫防御(Sayavedra et al, 2015)。已有研究还发现在同一宿主的生活史中共生菌的动态变化过程对共生菌的群体结构与基因组进化起重要作用,不仅垂直共生传输影响贻贝共生菌的地理与遗传隔离,且共生菌的水平传输也造成了共生菌的遗传分化(Picazo et al, 2019)。然而,尽管通过全基因组测序分析,微生物与深海贻贝的共生关系模型得到初步构建(Sun et al. 2017),但是具体分子调控机制仍未得到透彻解析。此外,在深海管虫的营养体中也发现了内共生自养微生物,但其如何从共生菌获取营养尚未可知(Liao et al, 2014; Zimmermann et al, 2014)。通过对冷泉管状管虫L. luymesi的全基因组测定与分析发现其基因组中缺失与重要氨基酸合成相关的关键基因,由共生微生物予以补充,而宿主的血红蛋白B1(Hemoglobin B1)基因则显著扩张,有利于促进H2S向内共生硫氧化菌的运输。此外,研究者发现宿主Toll-like receptor信号通路则可能在识别、兼容共生菌中起重要作用(Li et al, 2019)。近期在对深海冷泉海绵的研究中还发现其共生菌可能是垂直传输,且主要由甲烷氧化菌提供营养物质(Rubin-Blum et al, 2019)。
在外共生方面,对深海贻贝外共生弯曲杆菌的研究表明该菌可以通过贻贝其他共生菌的基因水平转移获得卡尔文循环的相关基因,从而进行碳固定(Assié et al, 2020)。在十足目甲壳类长角阿尔文虾A. longirostris和盲虾R. exoculata中通过16SV3-V4区扩增子分析发现γ-和ε-变形菌纲中的硫氧化菌为鳃部主要共生菌(Tokuda et al, 2008; Petersen et al, 2010)。进一步研究发现长角阿尔文虾鳃和肠道至少同时存在两条固碳途径,且鳃内微生物可能有更高的自养生产力(Sun et al, 2016)。而盲虾不同发育时期共生优势菌种类不同(Guri et al, 2012),成体共生菌通过鳃直接将营养物质传递给宿主(Ponsard et al, 2013)。在对浅海热液乌龟怪方蟹Xenograpsus testudinatus (Yang et al, 2016b)和深海热液奥氏蟹Austinograea sp.(Zhang et al, 2017a)的研究中则均发现共生菌群落组成存在组织差异。在柯氏潜铠虾中也发现了外共生微生物(Watsuji et al, 2010, 2014),主要共生菌类群为γ-变形菌、硫氧化菌、黄杆菌门(Konishi et al, 2013),硫氧化菌在鳃和肠道中比在刚毛中丰度高(Zhang et al, 2018)。然而大部分研究局限于对同一环境下共生菌群落组成的研究,且只对16S部分短片段进行分析,物种分类信息准确性不够高。
新型三代测序平台PacBio由于序列读长长,可完整覆盖16S全长,能将更多的微生物种类鉴定到种,近来已被应用于揭示样品中微生物种类、相对丰度和进化关系等相关研究(Myer et al, 2016; Wagner et al, 2016; Pootakham et al, 2017; Yang et al, 2018)。此外,尽管已有研究发现共生菌种类对化能生态系统中大型生物的分布有显著影响(Fujiwara et al, 2000),但对热液、冷泉不同生态系统的共生微生物群落结构比较、生物地理学研究以及大型动物与共生微生物的协同进化关系研究相对匮乏,亟需进一步深入探究。
4 展望随着深海探测技术的不断发展,人类发现了包含热液、冷泉在内不同类型的极端环境生命形式,在提高对特殊生境下生物多样性认知的同时,也认识到深海生物在长期进化过程中也演化出独特的适应特征,然而对这些生物深海演化的关键过程与演化机制尚不明确,深海生物适应极端环境的关键机制尚未得到系统解析。亚欧、印度洋和太平洋三大板块在印太交汇区碰撞,形成了海底平原、海山、热液、冷泉等丰富的生境类型,在演化过程中伴生了板块移动、海平面升降、地热活动变异、溶氧浓度变迁等重大环境与地质事件(Jacobs et al, 1998; Jones et al, 2013; Zhang et al, 2014),加速了该区域的生物灭绝、生境分化和物种形成,是研究深海界面过程与生命演化前沿问题的理想区域。同时,印太交汇区珊瑚礁大三角是全球海洋生物多样性最高的海域,所孕育的造礁珊瑚、红树林占全球比例均超过75%,是全球生物多样性热点区域(Brooks et al, 2006; Briggs et al, 2013)。印太交汇区极高的浅海物种多样性是否塑造了该海域深海生物,包括深海化能生物多样性地理区系?二者的源汇关系如何?要回答上述问题,首先需要加强该海域深海生物系统调查,查清典型生境生物物种组成、群落结构和区系特点及其与环境因子的关系。其次,开展分子系统学、比较谱系地理学研究,通过浅海和深海生物多样性的协同比较,查明二者的遗传进化关系和连通性,重现深海生物多样性形成过程和演化路径,从深海生物进化历史揭示现代分布规律,探究与近海的源汇关系。最后,地质构造事件、气候变化与环流演变会引起海洋生物之间的隔离、分化,必定会在现存物种的遗传信息上留下印记。今后研究应注重多学科交叉融合,在印太交汇区系统研究深海生物多样性与环境气候变化及地质历史事件的协同演化关系,从多圈层相互作用层面入手将有助于加深对印太交汇区深海生物多样性形成和演化过程的理解。
马军英, 翟世奎. 1996. 冲绳海槽伊平屋海底热液活动区的生物群. 海洋科学, (2): 30-34 |
陈忠, 杨华平, 黄奇瑜, 等. 2007. 海底甲烷冷泉特征与冷泉生态系统的群落结构. 热带海洋学报, 26(6): 73-82 DOI:10.3969/j.issn.1009-5470.2007.06.013 |
Assié A, Leisch N, Meier D V et al, 2020. Horizontal acquisition of a patchwork Calvin cycle by symbiotic and free-living Campylobacterota (formerly Epsilonproteobacteria). The ISME Journal, 14: 104-122 DOI:10.1038/s41396-019-0508-7 |
Bachraty C, Legendre P, Desbruyères D, 2009. Biogeographic relationships among deep-sea hydrothermal vent faunas at global scale. Deep Sea Research Part Ⅰ: Oceanographic Research Papers, 56(8): 1371-1378 DOI:10.1016/j.dsr.2009.01.009 |
Baross J A, Hoffman S E, 1985. Submarine hydrothermal vents and associated gradient environments as sites for the origin and evolution of life. Origins of Life and Evolution of the Biosphere, 15: 327-345 DOI:10.1007/BF01808177 |
Barros I, Divya B, Martins I et al, 2015. Post-capture immune gene expression studies in the deep-sea hydrothermal vent mussel Bathymodiolus azoricus acclimatized to atmospheric pressure. Fish and Shellfish Immunology, 42(1): 159-170 DOI:10.1016/j.fsi.2014.10.018 |
Barry J P, Greene H G, Orange D L et al, 1996. Biologic and geologic characteristics of cold seeps in Monterey Bay, California. Deep Sea Research Part Ⅰ: Oceanographic Research Papers, 43(11-12): 1739-1755, 1757-1762 DOI:10.1016/S0967-0637(96)00075-1 |
Beedessee G, Watanabe H, Ogura T et al, 2013. High connectivity of animal populations in deep-sea hydrothermal vent fields in the Central Indian Ridge relevant to its geological setting. PLoS One, 8(12): e81570 DOI:10.1371/journal.pone.0081570 |
Bergquist D C, Williams F M, Fisher C R, 2000. Longevity record for deep-sea invertebrate. Nature, 403(6769): 499-500 DOI:10.1038/35000647 |
Bettencourt R, Pinheiro M, Egas C et al, 2010. High-throughput sequencing and analysis of the gill tissue transcriptome from the deep-sea hydrothermal vent mussel Bathymodiolus azoricus. BMC Genomics, 11: 559 DOI:10.1186/1471-2164-11-559 |
Boetius A, 2005. Lost city life. Science, 307(5714): 1420-1422 DOI:10.1126/science.1109849 |
Bougerol M, Boutet I, LeGuen D et al, 2015. Transcriptomic response of the hydrothermal mussel Bathymodiolus azoricus in experimental exposure to heavy metals is modulated by the Pgm genotype and symbiont content. Marine Genomics, 21: 63-73 DOI:10.1016/j.margen.2014.11.010 |
Breusing C, Vrijenhoek R C, Reusch T B H, 2017. Widespread introgression in deep-sea hydrothermal vent mussels. BMC Evolutionary Biology, 17: 13 DOI:10.1186/s12862-016-0862-2 |
Briggs J C, Bowen B W, 2013. Marine shelf habitat: biogeography and evolution. Journal of Biogeography, 40(6): 1023-1035 DOI:10.1111/jbi.12082 |
Brooks T M, Mittermeier R A, da Fonseca G A B et al, 2006. Global biodiversity conservation priorities. Science, 313(5783): 58-61 DOI:10.1126/science.1127609 |
Bult C J, White O, Olsen G J et al, 1996. Complete genome sequence of the methanogenic archaeon, Methanococcus jannaschii. Science, 273(5278): 1058-1073 DOI:10.1126/science.273.5278.1058 |
Chakrabortya A, Ruffb S E, Dong X Y et al, 2020. Hydrocarbon seepage in the deep seabed links subsurface and seafloor biospheres. Proceedings of the National Academy of Sciences of the United States of America, 117(20): 11029-11037 DOI:10.1073/pnas.2002289117 |
Cheng J, Hui M, Li Y L et al, 2020. Genomic evidence of population genetic differentiation in deep-sea squat lobster Shinkaia crosnieri (Crustacea: Decapoda: Anomura) from Northwestern Pacific hydrothermal vent and cold seep. Deep Sea Research Part Ⅰ: Oceanographic Research Papers, 156: 103188 DOI:10.1016/j.dsr.2019.103188 |
Chevaldonné P, Desbruyéres D, Childress J J, 1992. ... and some even hotter. Nature, 359(6396): 593-594 |
Corliss J B, Dymond J, Goirdon L I et al, 1979. Submarine thermal springs on the galapagos rift. Science, 203(4385): 1073-1083 DOI:10.1126/science.203.4385.1073 |
Danovaro R, Snelgrove P V R, Tyler P, 2014. Challenging the paradigms of deep-sea ecology. Trends in Ecology and Evolution, 29(8): 465-475 DOI:10.1016/j.tree.2014.06.002 |
Desbruyères D, Hashimoto J, Fabri M C, 2006a. Composition and biogeography of hydrothermal vent communities in Western Pacific back-arc basins. Geophysical Monograph Series, 166: 215-234 |
Desbruyères D, Segonzac M, Bright M, 2006b. Handbook of Deep-Sea Hydrothermal Vent Fauna. 2nd ed. Linz, Austria: State Museum of Upper Austria, 544
|
Détrée C, Lallier F H, Tanguy A et al, 2017. Identification and gene expression of multiple peptidoglycan recognition proteins (PGRPs) in the deep-sea mussel Bathymodiolus azoricus, involvement in symbiosis?. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 207: 1-8 DOI:10.1016/j.cbpb.2017.02.002 |
Duperron S, Bergin C, Zielinski F et al, 2006. A dual symbiosis shared by two mussel species, Bathymodiolus azoricus and Bathymodiolus puteoserpentis (Bivalvia: Mytilidae), from hydrothermal vents along the northern Mid-Atlantic Ridge. Environmental Microbiology, 8(8): 1441-1447 DOI:10.1111/j.1462-2920.2006.01038.x |
Duperron S, Gaudron S M, Rodrigues C F et al, 2013. An overview of chemosynthetic symbioses in bivalves from the North Atlantic and Mediterranean Sea. Biogeosciences, 10: 3241-3267 DOI:10.5194/bg-10-3241-2013 |
Duperron S, Nadalig T, Caprais J C et al, 2005. Dual symbiosis in a Bathymodiolus sp. mussel from a methane seep on the Gabon continental margin (southeast Atlantic): 16S rRNA phylogeny and distribution of the symbionts in gills. Applied and Environmental Microbiology, 71(4): 1694-1700 DOI:10.1128/AEM.71.4.1694-1700.2005 |
Fujiwara Y, Takai K, Uematsu K et al, 2000. Phylogenetic characterization of endosymbionts in three hydrothermal vent mussels: Influence on host distributions. Marine Ecology Progress, 208: 147-155 DOI:10.3354/meps208147 |
German C R, Ramirez-Llodra E, Baker M C et al, 2011. Deep-water chemosynthetic ecosystem research during the census of marine life decade and beyond: A proposed deep-ocean road map. PLoS One, 6: e23259 DOI:10.1371/journal.pone.0023259 |
Guri M, Durand L, Cueff-Gauchard V et al, 2012. Acquisition of epibiotic bacteria along the life cycle of the hydrothermal shrimp Rimicaris exoculata. The ISME Journal, 6: 597-609 DOI:10.1038/ismej.2011.133 |
Hardivillier Y, Leignel V, Denis F et al, 2004. Do organisms living around hydrothermal vent sites contain specific metallothioneins? The case of the genus Bathymodiolus (Bivalvia, Mytilidae). Comparative Biochemistry and Physiology Part C: Toxicology and Pharmacology, 139(1-3): 111-118 DOI:10.1016/j.cca.2004.09.012 |
Harnik P G, Lotze H K, Anderson S C et al, 2012. Extinctions in ancient and modern seas. Trends in Ecology and Evolution, 27(11): 608-617 DOI:10.1016/j.tree.2012.07.010 |
Herrera S, Watanabe H, Shank T M, 2015. Evolutionary and biogeographical patterns of barnacles from deep-sea hydrothermal vents. Molecular Ecology, 24(3): 673-689 DOI:10.1111/mec.13054 |
Hügler M, Petersen J M, Dubilier N et al, 2011. Pathways of carbon and energy metabolism of the epibiotic community associated with the deep-sea hydrothermal vent shrimp Rimicaris exoculata. PLoS One, 6: e16018 DOI:10.1371/journal.pone.0016018 |
Hui M, Cheng J, Sha Z L, 2018a. Adaptation to the deep-sea hydrothermal vents and cold seeps: Insights from the transcriptomes of Alvinocaris longirostris in both environments. Deep Sea Research Part Ⅰ: Oceanographic Research Papers, 135: 23-33 DOI:10.1016/j.dsr.2018.03.014 |
Hui M, Cheng J, Sha Z L, 2018b. First comprehensive analysis of lysine acetylation in Alvinocaris longirostris from the deep-sea hydrothermal vents. BMC Genomics, 19: 352 DOI:10.1186/s12864-018-4745-3 |
Hui M, Song C W, Liu Y et al, 2017. Exploring the molecular basis of adaptive evolution in hydrothermal vent crab Austinograea alayseae by transcriptome analysis. PLoS One, 12(5): e0178417 DOI:10.1371/journal.pone.0178417 |
Ip J C H, Xu T, Sun J et al, 2020. Host-endosymbiont genome integration in a deep-sea chemosymbiotic clam. Molecular Biology and Evolution, doi: 10.1093/molbev/msaa241
|
Jacobs D K, Lindberg D R, 1998. Oxygen and evolutionary patterns in the sea: onshore/offshore trends and recent recruitment of deep-sea faunas. Proceedings of the National Academy of Sciences of the United States of America, 95(16): 9396-9401 DOI:10.1073/pnas.95.16.9396 |
Jang S J, Park E, Lee W K et al, 2016. Population subdivision of hydrothermal vent polychaete Alvinella pompejana across equatorial and Easter Microplate boundaries. BMC Evolutionary Biology, 16: 235 DOI:10.1186/s12862-016-0807-9 |
Jeng M S, Ng N K, Ng P K L, 2004. Hydrothermal vent crabs feast on sea 'snow'. Nature, 432: 969 DOI:10.1038/432969a |
JonesT D, Lunt D J, Schmidt D N et al, 2013. Climate model and proxy data constraints on ocean warming across the Paleocene-Eocene Thermal Maximum. Earth-Science Reviews, 125: 123-145 DOI:10.1016/j.earscirev.2013.07.004 |
Kennett J P, Stott L D, 1991. Abrupt deep-sea warming, palaeoceanographic changes and benthic extinctions at the end of the Palaeocene. Nature, 353(6341): 225-229 DOI:10.1038/353225a0 |
Kiel S, 2016. A biogeographic network reveals evolutionary links between deep-sea hydrothermal vent and methane seep faunas. Proceedings of the Royal Society B: Biological Sciences, 283(1844): 20162337 DOI:10.1098/rspb.2016.2337 |
Kim D S, Ohta S, 2000. TEM Observation studies on the chemoautotrophic symbiotic bacteria of invertebrates inhabiting at vents and seeps. Ocean and Polar Research, 22(1): 1-13 DOI:10.1016/S0141-1187(99)00027-9 |
Konishi M, Watsuji T, Nakagawa S et al, 2013. Effects of Hydrogen sulfide on bacterial communities on the surface of galatheid crab, Shinkaia crosnieri, and in a bacterial mat cultured in rearing tanks. Microbes and Environments, 28(1): 25-32 DOI:10.1264/jsme2.ME12070 |
Levin L A, Orphan V J, Rouse G W et al, 2012. A hydrothermal seep on the Costa Rica margin: middle ground in a continuum of reducing ecosystems. Proceedings of the Royal Society B: Biological Sciences, 279: 2580-2588 DOI:10.1098/rspb.2012.0205 |
Li Y N, Tassia M G, Waits D S et al, 2019. Genomic adaptations to chemosymbiosis in the deep-sea seep-dwelling tubeworm Lamellibrachia luymesi. BMC Biology, 17: 91 DOI:10.1186/s12915-019-0713-x |
Liao L, Wankel S D, Wu M et al, 2014. Characterizing the plasticity of nitrogen metabolism by the host and symbionts of the hydrothermal vent chemoautotrophic symbioses Ridgeia piscesae. Molecular Ecology, 23(6): 1544-1557 DOI:10.1111/mec.12460 |
Liu R Y, Wang K, Liu J et al, 2020. De novo genome assembly of limpet Bathyacmaea lactea (Gastropoda: Pectinodontidae): The first reference genome of a deep-sea gastropod endemic to cold seeps. Genome Biology and Evolution, 12(6): 905-910 DOI:10.1093/gbe/evaa100 |
Lorion J, Kiel S, Faure B et al, 2013. Adaptive radiation of chemosymbiotic deep-sea mussels. Proceedings of the Royal Society B: Biological Sciences, 281(1770): 20131243 |
Lunina A A, Vereshchaka A L, 2014. Distribution of hydrothermal alvinocaridid shrimps: effect of geomorphology and specialization to extreme biotopes. PLoS One, 9(3): e92802 DOI:10.1371/journal.pone.0092802 |
Luther G W 3rd, Rozan T F, Taillefert M et al, 2001. Chemical speciation drives hydrothermal vent ecology. Nature, 410(6830): 813-816 DOI:10.1038/35071069 |
Martin W, Baross J, Kelley D et al, 2008. Hydrothermal vents and the origin of life. Nature Reviews Microbiology, 6: 805-814 DOI:10.1038/nrmicro1991 |
Mat A M, Sarrazin J, Markov G V et al, 2020. Biological rhythms in the deep-sea hydrothermal mussel Bathymodiolus azoricus. Nature Communications, 11: 3454 DOI:10.1038/s41467-020-17284-4 |
McArthur A G, Tunnicliffe V, 1998. Relics and antiquity revisited in the modern vent fauna. In: Mills R A, Harrison K eds. Modern Ocean Floor Processes and the Geological Record. Special Publication of the Geological Society of London, 271-291
|
Moalic Y, Desbruyères D, Duarte C M et al, 2012. Biogeography revisited with network theory: retracing the history of hydrothermal vent communities. Systematic Biology, 61(1): 127-137 DOI:10.1093/sysbio/syr088 |
Myer P R, Kim M S, Freetly H C et al, 2016. Evaluation of 16S rRNA amplicon sequencing using two next-generation sequencing technologies for phylogenetic analysis of the rumen bacterial community in steers. Journal of Microbiological Methods, 127: 132-140 DOI:10.1016/j.mimet.2016.06.004 |
Newman W A, 1985. The abyssal hydrothermal vent invertebrate fauna: A glimpse of antiquity? In: Jones M L ed. The Hydrothermal Vents of the Eastern Pacific: An Overview. Bulletin of the Biological Society of Washington, 6: 231-242
|
Nikolaus R, Ammmerman J W, MacDonald I R, 2003. Distinct pigmentation and trophic modes in Beggiatoa from hydrocarbon seeps in the Gulf of Mexico. Aquatic Microbial Ecology, 32(1): 85-93 |
Petersen J M, Ramette A, Lott C et al, 2010. Dual symbiosis of the vent shrimp Rimicaris exoculata with filamentous gamma- and epsilonproteobacteria at four Mid-Atlantic Ridge hydrothermal vent fields. Environmental Microbiology, 12(8): 2204-2218 |
Petersen J M, Zielinski F U, Pape T et al, 2011. Hydrogen is an energy source for hydrothermal vent symbioses. Nature, 476(7359): 176-180 DOI:10.1038/nature10325 |
Picazo D R, Dagan T, Ansorge R et al, 2019. Horizontally transmitted symbiont populations in deep-sea mussels are genetically isolated. The ISME Journal, 13: 2954-2968 DOI:10.1038/s41396-019-0475-z |
Ponsard J, Cambon-Bonavita M A, Zbinden M et al, 2013. Inorganic carbon fixation by chemosynthetic ectosymbionts and nutritional transfers to the hydrothermal vent host-shrimp Rimicaris exoculata. The ISME Journal, 7(1): 96-109 DOI:10.1038/ismej.2012.87 |
Pootakham W, Mhuantong W, Yoocha T et al, 2017. High resolution profiling of coral-associated bacterial communities using full-length 16S rRNA sequence data from PacBio SMRT sequencing system. Scientific Reports, 7: 2774 DOI:10.1038/s41598-017-03139-4 |
Projecto-Garcia J, Zorn N, Jollivet D et al, 2010. Origin and evolution of the unique tetra-domain hemoglobin from the hydrothermal vent scale worm Branchipolynoe. Molecular Biology and Evolution, 27(1): 143-152 DOI:10.1093/molbev/msp218 |
Ramirez-Llodra E, Shank T M, German C R, 2007. Biodiversity and biogeography of hydrothermal vent Species: thirty years of discovery and investigations. Oceanography, 20(1): 30-41 DOI:10.5670/oceanog.2007.78 |
Reysenbach A L, Shock E, 2002. Merging genomes with geochemistry in hydrothermal ecosystems. Science, 296(5570): 1077-1082 DOI:10.1126/science.1072483 |
Rogers A D, 2000. The role of the oceanic oxygen minima in generating biodiversity in the deep sea. Deep Sea Research Part Ⅱ: Topical Studies in Oceanography, 47(1-2): 119-148 DOI:10.1016/S0967-0645(99)00107-1 |
Rogers A D, Tyler P A, Connelly D P et al, 2012. The discovery of new deep-sea hydrothermal vent communities in the Southern Ocean and implications for biogeography. PLoS Biology, 10(1): e1001234 DOI:10.1371/journal.pbio.1001234 |
Roterman C N, Copley J T, Linse K T et al, 2016. Connectivity in the cold: the comparative population genetics of vent-endemic fauna in the Scotia Sea, Southern Ocean. Molecular Ecology, 25(5): 1073-1088 DOI:10.1111/mec.13541 |
Roy K O L, Sibuet M, Fiala-Médioni A et al, 2004. Cold seep communities in the deep eastern Mediterranean Sea: composition, symbiosis and spatial distribution on mud volcanoes. Deep Sea Research Part Ⅰ: Oceanographic Research Papers, 51(12): 1915-1936 DOI:10.1016/j.dsr.2004.07.004 |
Rubin-Blum M, Antony C P, Sayavedra L et al, 2019. Fueled by methane: deep-sea sponges from asphalt seeps gain their nutrition from methane-oxidizing symbionts. The ISME Journal, 13: 1209-1225 DOI:10.1038/s41396-019-0346-7 |
Sayavedra L, Kleiner M, Ponnudurai R et al, 2015. Abundant toxin-related genes in the genomes of beneficial symbionts from deep-sea hydrothermal vent mussels. eLife, 4: e07966 DOI:10.7554/eLife.07966 |
Shen Y J, Kou Q, Chen W T et al, 2016. Comparative population structure of two dominant species, Shinkaia crosnieri (Munidopsidae: Shinkaia) and Bathymodiolus platifrons (Mytilidae: Bathymodiolus), inhabiting both deep-sea vent and cold seep inferred from mitochondrial multi-genes. Ecology and Evolution, 6(11): 3571-3582 DOI:10.1002/ece3.2132 |
Sibuet M, Roy K O L, 2002. Cold seep communities on continental margins: structure and quantitative distribution relative to geological and fluid venting patterns. In: Wefer G, Billett D, Hebbeln D et al eds. Ocean Margin Systems. Berlin, Heidelberg: Springer, 235-251
|
Sicot F X, Mesnage M, Masselot M et al, 2000. Molecular adaptation to an extreme environment: origin of the thermal stability of the Pompeii worm collagen. Journal of Molecular Biology, 302(4): 811-820 DOI:10.1006/jmbi.2000.4505 |
Suess E, 2014. Marine cold seeps and their manifestations: geological control, biogeochemical criteria and environmental conditions. International Journal of Earth Sciences, 103: 1889-1916 DOI:10.1007/s00531-014-1010-0 |
Sun J, Chen C, Miyamoto N et al, 2020b. The scaly-foot snail genome and implications for the origins of biomineralised armour. Nature Communications, 11: 1657 DOI:10.1038/s41467-020-15522-3 |
Sun J, Zhang Y, Xu T et al, 2017. Adaptation to deep-sea chemosynthetic environments as revealed by mussel genomes. Nature Ecology and Evolution, 1: 0121 DOI:10.1038/s41559-017-0121 |
Sun J, Zhou Y D, Chen C et al, 2020a. Nearest vent, dearest friend: biodiversity of Tiancheng vent field reveals cross-ridge similarities in the Indian Ocean. Royal Society Open Science, 7(3): 200110 DOI:10.1098/rsos.200110 |
Sun Q L, Zeng Z G, Chen S et al, 2016. First Comparative analysis of the community structures and carbon metabolic pathways of the bacteria associated with Alvinocaris longirostris in a hydrothermal vent of Okinawa Trough. PLoS One, 11(4): e0154359 DOI:10.1371/journal.pone.0154359 |
Sun S E, Sha Z L, Wang Y R, 2018. Phylogenetic position of Alvinocarididae (Crustacea: Decapoda: Caridea): New insights into the origin and evolutionary history of the hydrothermal vent alvinocarid shrimps. Deep Sea Research Part Ⅰ: Oceanographic Research Papers, 141: 93-105 DOI:10.1016/j.dsr.2018.10.001 |
Sun S E, Sha Z L, Wang Y R, 2019. Divergence history and hydrothermal vent adaptation of decapod crustaceans: A mitogenomic perspective. PLoS One, 14(10): e0224373 DOI:10.1371/journal.pone.0224373 |
Tarasov V G, Gebruk A V, Mironov A N et al, 2005. Deep-sea and shallow-water hydrothermal vent communities: Two different phenomena?. Chemical Geology, 224(1-3): 5-39 DOI:10.1016/j.chemgeo.2005.07.021 |
Thaler A D, Amon D, 2019. 262 Voyages Beneath the Sea: a global assessment of macro- and megafaunal biodiversity and research effort at deep-sea hydrothermal vents. PeerJ, 7: e7397 DOI:10.7717/peerj.7397 |
Tokuda G, Yamada A, Nakano K et al, 2006. Occurrence and recent long-distance dispersal of deep-sea hydrothermal vent shrimps. Biology Letters, 2(2): 257-260 DOI:10.1098/rsbl.2005.0420 |
Tokuda G, Yamada A, Nakano K et al, 2008. Colonization of Sulfurovum sp. on the gill surfaces of Alvinocaris longirostris, a deep-sea hydrothermal vent shrimp. Marine Ecology, 29(1): 106-114 DOI:10.1111/j.1439-0485.2007.00211.x |
Tunnicliffe V, 1992. The nature and origin of the modern hydrothermal vent fauna. Palaios, 7(4): 338-350 DOI:10.2307/3514820 |
Tunnicliffe V, Fowler C M R, 1996. Influence of sea-floor spreading on the global hydrothermal vent fauna. Nature, 379(6565): 531-533 DOI:10.1038/379531a0 |
Tunnicliffe V, McArthur A G, McHugh D, 1998. A biogeographical perspective of the deep-sea hydrothermal vent fauna. Advances in Marine Biology, 34: 353-442 |
Urakawa H, Dubilier N, Fujiwara Y et al, 2005. Hydrothermal vent gastropods from the same family (Provannidae) harbour ε- and γ-proteobacterial endosymbionts. Environmental Microbiology, 7(5): 750-754 DOI:10.1111/j.1462-2920.2005.00753.x |
Van Dover C L, 2000. The Ecology of Deep-Sea Hydrothermal Vents. Princeton, USA: Princeton University Press, 1412
|
Van Dover C L, German C R, Speer K G et al, 2002. Evolution and biogeography of deep-sea vent and seep invertebrates. Science, 295(5558): 1253-1257 DOI:10.1126/science.1067361 |
Van Dover C L, Humphris S E, Fornari D et al, 2001. Biogeography and ecological setting of Indian Ocean hydrothermal vents. Science, 294(5543): 818-823 DOI:10.1126/science.1064574 |
Van Dover C L, Lutz R A, 2004. Experimental ecology at deep-sea hydrothermal vents: a perspective. Journal of Experimental Marine Biology and Ecology, 300(1-2): 273-307 DOI:10.1016/j.jembe.2003.12.024 |
Van Dover C L, Szuts E Z, Chamberlain S C et al, 1989. A novel eye in 'eyeless' shrimp from hydrothermal vents of the Mid-Atlantic Ridge. Nature, 337: 458-460 DOI:10.1038/337458a0 |
Vrijenhoek R C, 2010. Genetic diversity and connectivity of deep-sea hydrothermal vent metapopulations. Molecular Ecology, 19(20): 4391-4411 DOI:10.1111/j.1365-294X.2010.04789.x |
Vrijenhoek R C, 2013. On the instability and evolutionary age of deep-sea chemosynthetic communities. Deep Sea Research Part Ⅱ: Topical Studies in Oceanography, 92: 189-200 DOI:10.1016/j.dsr2.2012.12.004 |
Wagner J, Coupland P, Browne H P et al, 2016. Evaluation of PacBio sequencing for full-length bacterial 16S rRNA gene classification. BMC Microbiology, 16: 274 DOI:10.1186/s12866-016-0891-4 |
Watsuji T O, Nakagawa S, Tsuchida S et al, 2010. Diversity and function of epibiotic microbial communities on the galatheid crab, Shinkaia crosnieri. Microbes and Environments, 25(4): 288-294 DOI:10.1264/jsme2.ME10135 |
Watsuji T O, Yamamoto A, Takaki Y et al, 2014. Diversity and methane oxidation of active epibiotic methanotrophs on live Shinkaia crosnieri. The ISME Journal, 8: 1020-1031 DOI:10.1038/ismej.2013.226 |
Weiss R F, Lonsdale P, Lupton J E et al, 1977. Hydrothermal plumes in the Galapagos Rift. Nature, 267(5612): 600-603 DOI:10.1038/267600a0 |
Wentrup C, Wendeberg A, Schimak M et al, 2014. Forever competent: deep-sea bivalves are colonized by their chemosynthetic symbionts throughout their lifetime. Environmental Microbiology, 16(12): 3699-3713 DOI:10.1111/1462-2920.12597 |
Wong Y H, Sun J, He L S et al, 2015. High-throughput transcriptome sequencing of the cold seep mussel Bathymodiolus platifrons. Scientific Reports, 5: 16597 DOI:10.1038/srep16597 |
Wu X W, Zhan Z F, Xu K D, 2019. Two new and two rarely known species of Branchinotogluma (Annelida: Polynoidae) from deep-sea hydrothermal vents of the Manus Back-Arc basin, with remarks on the diversity and biogeography of vent polynoids. Deep Sea Research Part Ⅰ: Oceanographic Research Papers, 149: 103051 DOI:10.1016/j.dsr.2019.05.011 |
Xu T, Sun J, Lv J et al, 2017. Genome-wide discovery of single nucleotide polymorphisms (SNPs) and single nucleotide variants (SNVs) in deep-sea mussels: Potential use in population genomics and cross-species application. Deep Sea Research Part Ⅱ: Topical Studies in Oceanography, 137: 318-326 DOI:10.1016/j.dsr2.2016.03.011 |
Yahagi T, Watanabe H, Ishibashi J et al, 2015. Genetic population structure of four hydrothermal vent shrimp species (Alvinocarididae) in the Okinawa Trough, Northwest Pacific. Marine Ecology Progress Series, 529: 159-169 DOI:10.3354/meps11267 |
Yang C H, Tsuchida S, Fujikura K et al, 2016a. Connectivity of the squat lobsters Shinkaia crosnieri (Crustacea: Decapoda: Galatheidae) between cold seep and hydrothermal vent habitats. Bulletin of Marine Science, 92(1): 17-31 DOI:10.5343/bms.2015.1031 |
Yang J S, Lu B, Chen D F et al, 2013. When did decapods invade hydrothermal vents? Clues from the Western Pacific and Indian Oceans. Molecular Biology and Evolution, 30(2): 305-309 |
Yang J X, Cao J L, Xu H Y et al, 2018. Bacterial diversity and community structure in Chongqing radish paocai brines revealed using PacBio single-molecule real-time sequencing technology. Journal of the Science of Food and Agriculture, 98(9): 3234-3245 DOI:10.1002/jsfa.8935 |
Yang S H, Chiang P W, Hsu T C et al, 2016b. Bacterial community associated with organs of shallow hydrothermal vent crab Xenograpsus testudinatus near Kuishan Island, Taiwan. PLoS One, 11(3): e0150597 DOI:10.1371/journal.pone.0150597 |
Zhang J, Zeng Z G, Chen S et al, 2018. Bacterial communities associated with Shinkaia crosnieri from the Iheya North, Okinawa Trough: Microbial diversity and metabolic potentials. Journal of Marine Systems, 180: 228-236 DOI:10.1016/j.jmarsys.2017.02.011 |
Zhang N, Song C W, Wang M X et al, 2017a. Diversity and characterization of bacteria associated with the deep-sea hydrothermal vent crab Austinograea sp. comparing with those of two shallow-water crabs by 16S ribosomal DNA analysis. PLoS One, 12(11): e0187842 DOI:10.1371/journal.pone.0187842 |
Zhang Y G, Pagani M, Liu Z H, 2014. A 12-million-year temperature history of the tropical Pacific Ocean. Science, 344(6179): 84-87 |
Zhang Y J, Sun J, Chen C et al, 2017b. Adaptation and evolution of deep-sea scale worms (Annelida: Polynoidae): insights from transcriptome comparison with a shallow-water species. Scientific Reports, 7: 46205 DOI:10.1038/srep46205 |
Zhou L, Cao L, Wang X C et al, 2020. Metal adaptation strategies of deep-sea Bathymodiolus mussels from a cold seep and three hydrothermal vents in the West Pacific. Science of the Total Environment, 707: 136046 DOI:10.1016/j.scitotenv.2019.136046 |
Zhou Y D, Zhang D S, Zhang R Y et al, 2018. Characterization of vent fauna at three hydrothermal vent fields on the Southwest Indian Ridge: Implications for biogeography and interannual dynamics on ultraslow-spreading ridges. Deep Sea Research Part Ⅰ: Oceanographic Research Papers, 137: 1-12 DOI:10.1016/j.dsr.2018.05.001 |
Zimmermann J, Lott C, Weber M et al, 2014. Dual symbiosis with co-occurring sulfur-oxidizing symbionts in vestimentiferan tubeworms from a Mediterranean hydrothermal vent. Environmental Microbiology, 16(12): 3638-3656 DOI:10.1111/1462-2920.12427 |
 2021, Vol. 52
2021, Vol. 52


