中国海洋湖沼学会主办。
文章信息
- 王敏晓, 李超伦, 李梦娜, 钟兆山. 2021.
- WANG Min-Xiao, LI Chao-Lun, LI Meng-Na, ZHONG Zhao-Shan. 2021.
- 深海化能生态系统双壳纲共生体系互作机制研究进展
- RESEARCH PROGRESS ON THE INTERACTION MECHANISM OF BIVALVE SYMBIOSIS SYSTEM IN DEEP-SEA CHEMOSYNTHETIC ECOSYSTEM
- 海洋与湖沼, 52(2): 522-536
- Oceanologia et Limnologia Sinica, 52(2): 522-536.
- http://dx.doi.org/10.11693/hyhz20200900265
文章历史
-
收稿日期:2020-09-28
收修改稿日期:2020-11-28
2. 中国科学院海洋生态与环境科学重点实验室 青岛 266071;
3. 中国科学院海洋大科学研究中心 青岛 266071;
4. 青岛海洋科学与技术试点国家实验室 海洋生态与环境科学功能实验室 青岛 266237;
5. 中国科学院大学 北京 100049
2. Key Laboratory of Marine Ecology & Environmental Sciences, Institute of Oceanology, Chinese Academy of Sciences, Qingdao 266071, China;
3. Center for Ocean Mega-Science, Chinese Academy of Sciences, Qingdao 266071, China;
4. Laboratory for Marine Ecology and Environmental Science, Pilot National Laboratory for Marine Science and Technology(Qingdao), Qingdao 266237, China;
5. University of Chinese Academy of Sciences, Beijing 100049, China
20世纪70年代, 科学家利用载人深潜器(Human Occupied Vehicle, HOV)阿尔文号对东太平洋加拉帕戈斯裂谷的科学考察时, 发现海底的异常温度波动。进一步的探查颠覆了人们对深海荒漠的传统认知, 在热液喷口羽状流周边, 活跃着高密度的生物群落, 呈现一片欣欣向荣的场景: 主要包括微生物菌席, 鱼类, 软体动物门双壳纲、腹足纲类生物, 环节动物门的管状蠕虫, 节肢动物门的虾、蟹等(Lonsdale, 1977; Weiss et al, 1977; Corliss et al, 1979)。随着深海科学考察的深入, 其他特殊的深海化能生境也逐步被发现, 最为典型的包括热液、冷泉、鲸落及沉木生态系统等(Martin et al, 2008; Bienhold et al, 2013; Smith et al, 2015; Ceramicola et al, 2018)。
这些生态系统往往分布于水深超过500 m的深海海域, 远离真光层, 黑暗是这里的常态, 光合作用合成的有机物匮乏。与万物生长靠太阳的陆地、浅海生态系统不同, 化能生态系统众多化能微生物是这里的主要初级生产力贡献者, 它们氧化热液、冷泉流体中的还原性物质(硫化氢H2S、元素硫S、甲烷CH4和氢气H2等)获取所需的能量, 进行固碳, 并通过黑暗食物网将物质能量传递到整个生态系统, 因此化能微生物及其行使的化能合成作用是深海化能生态系统存在的基础(Felbeck et al, 1981; Childress et al, 1986; Fisher, 1990; Stewart et al, 2005; Petersen et al, 2011; Zhou et al, 2020)(图 1a, b)。而在漫长的演化过程中, 为了更加高效的获取这些化能细菌产生的有机物, 深海化能生态系统中的无脊椎动物与化能合成菌建立了形式多样的共生关系, 而双壳纲是其中最典型的示例, 它们形成了深海生物群落中的优势物种(Dubilier et al, 2008) (图 1b)。根据文献调研, 以及最新的世界海洋生物名录(WoRMS)的记录, 有超过500种双壳纲生物被报道体内共生有化能合成细菌(Duperron, 2010; Decker et al, 2012; Roeselers et al, 2012; Johnson et al, 2017)。
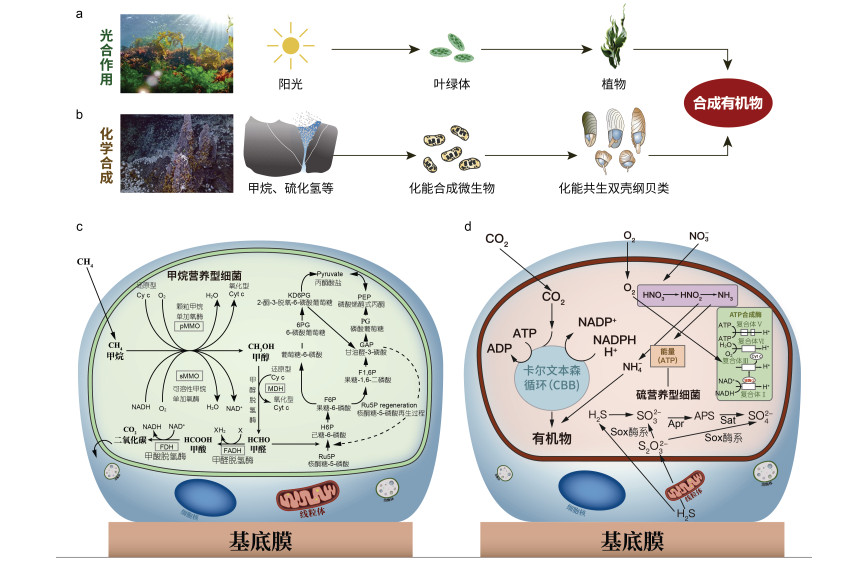 |
| 图 1 光合生态系统与化能生态系统对比及双壳纲中两种常见的内共生菌 Fig. 1 Comparison of photosynthetic and chemosynthetic ecosystems and two kinds of chemosynthetic endosymbionts of bivalve 注: a: 光合生态系统; b: 深海化能生态系统; c: 甲烷营养型内共生菌及其代谢通路; d: 硫营养型内共生菌及其代谢通路 |
在此, 我们对已有的研究深海化能生态系统中的双壳纲贝类的深海物种相关文献进行综述, 总结其中含有共生菌的5个主要类群的宿主(图 1b中化能共生双壳纲贝类)与共生菌相互作用, 包括贻贝科(Mytilidae)、囊螂科(Vesicomyidae)、蛏螂科(Solemyidae)、索足蛤科(Thyasiridae)和满月蛤科(Lucinidae)。其中, 贻贝科中的一支深海偏顶蛤亚科(Bathymodiolinae)已经成功地定殖于深海化能生态系统中, 在全球的热液、冷泉、鲸落、沉木生态系统中均有其广泛分布, 至今为止共发现深海偏顶蛤亚科物种8属60种(Xu et al, 2019); 囊螂科包含两个亚科分别为Pliocardiinae亚科与Vesicomyinae亚科, 在热液、冷泉和鲸落等其他还原性生境中均有分布, 物种有记录的超过百种(Krylova et al, 2010; Kharlamenko et al, 2019); 蛏螂科也含有2个亚科, 分别为Acharacinae和Solemyinae, 每个亚科下各包含1个属, 共2个属分别为Acharax和Solemya属, 现共有34种, 在系统进化关系上, 蛏螂科属于早期分化的物种, 而囊螂科则属于后来分化出的一支(Taylor et al, 2008; Lemer et al, 2019; Ip et al, 2020); 索足蛤科物种同样约有超过100种被发现, 全球分布极为广泛(Taylor et al, 2007); 满月蛤科是至今为止已知的含有化能共生细菌双壳纲贝类中全球分布最广, 多样性最高的门类, 迄今为止物种记录有超过400种(Taylor et al, 2013)。上述类群广泛分布于潮间带到深海, 除了贻贝科和囊螂科仅深海类群具备共生菌(Krylova et al, 2010; Miyazaki et al, 2010; Johnson et al, 2017), 其他类群中不同深度的种类均与变形菌纲细菌建立了共生关系(Felbeck, 1983; Gros et al, 1996; Fujiwara et al, 2001; Taylor et al, 2013, 2006; Batstone et al, 2014)。系统梳理这些双壳纲共生体系的组成方式、营养互作模式、及共生建立与维持的机制, 对进一步研究深海化能生态系统的组成、群落结构、物种多样性具有重要意义。
1 深海双壳纲共生体系的组成与传递 1.1 共生的方式含有共生菌的双壳纲5科贝类的共生方式多种多样, 从共生的位置来看, 双壳纲中共生菌主要分布于特化的鳃组织中, 但可以细分为两类, 一类是内共生, 即共生菌分布于宿主鳃上皮细胞内部, 宿主形成特殊的含菌细胞, 主要包括贻贝科深海偏顶蛤亚科、囊螂科、蛏螂科和满月蛤科; 另外一类是共生菌分布于鳃细胞外侧, 主要在鳃细胞纤毛之间, 称为外共生或表共生(图 2), 主要为索足蛤科和少数贻贝科(Benthomodiolus、Idas、Adipicola属等)物种(Fiala-Médioni et al, 1986a, b; Gros et al, 2007; Fujiwara et al, 2010; Oliver, 2015)。以上两类皆存在特例, 比如在深海偏顶蛤亚科(Bathymodiolinae)的小型深海偏顶蛤Idas属中, 存在鳃部完全不含有共生菌的物种Idas argenteus, 这与其生活环境中富含有机颗粒物相关, 充足的食物来源使得I. argenteus通过滤食作用即可满足自身营养需求, 因此推测其在进化过程中共生菌逐渐丢失(Rodrigues et al, 2015); 在索足蛤科中也存在含有内共生菌的物种Maorithyas hadalis(Fujikura et al, 1999; Fujiwara et al, 2001)。
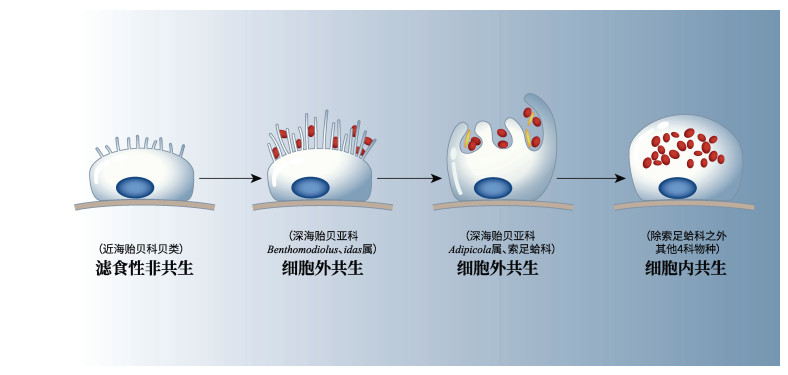 |
| 图 2 双壳纲物种鳃上皮细胞中常见的共生菌分布方式 Fig. 2 The distribution patterns of symbiotic bacteria in the gill epithelia of deep-sea bivalves 注: 从左至右刻画进化尺度上共生菌与宿主细胞建立共生关系的过程, 图片修改自Miyazaki等(2010) |
双壳纲鳃部的优势共生菌均属于γ-变形菌纲的细菌(Dubilier et al, 2008)。根据共生菌的营养型划分, 主要分为两大支, 一支为硫营养型(Thiotrophic)细菌(Felbeck et al, 1981; Felbeck, 1983; Fiala-Médioni et al, 1986a, b), 另一支为甲烷营养型(Methanotrophic)细菌(Streams et al, 1997; Barry et al, 2002; Petersen et al, 2010), 除上述两大类细菌外, 在双壳纲贝类鳃中还发现可以利用甲基类化合物、短烷烃类和氢气的内共生菌(Cavanaugh et al, 1987; Wood et al, 1989; Petersen et al, 2011)。
甲烷营养型细菌(图 1c)主要在深海偏顶蛤亚科物种鳃内被发现, 在其他4科双壳纲宿主含菌细胞内鲜有报道, 研究表明, 甲烷营养型细菌进行化能合成固碳时, 一碳化合物甲烷(CH4)既被当作电子供体也被用作碳源, O2作为电子受体进行反应。深海偏顶蛤亚科物种鳃部含菌细胞中的甲烷营养型细菌一般为Ⅰ型甲烷营养型细菌, 该菌主要通过核酮糖单磷酸(RuMP)途径进行一碳化合物的同化, 首先CH4在细菌细胞膜上颗粒甲烷单加氧酶(pMMO)或者细胞质中可溶性甲烷单加氧酶(sMMO)的作用下氧化为甲醇CH3OH, 然后在甲醇脱氢酶(MDH)的作用下氧化为甲醛, 甲醛可以与核酮糖-5-磷酸(Ru5P)反应生成己糖-6-磷酸(G6P), 甲醛通过多种酶的氧化成为甲酸, 氧化的过程取决于不同类型的甲烷营养型细菌, 最终甲酸在甲酸脱氢酶作用下被氧化成CO2(DeChaine et al, 2005)。
硫营养型细菌(图 1d)利用的还原性物质包括硫化氢(H2S)、硫代硫酸盐(S2O32-)、硫单质(S0)等, 硫营养型内共生菌主要通过卡尔文-本森-巴萨姆(Calvin-Benson-Bassham, CBB)循环进行二氧化碳(CO2)的固定, CBB循环中最关键的酶是核酮糖-1, 5-二磷酸羧化加氧酶(RubisCO)。沉积物孔隙水中的还原性硫化物(H2S)与氨氮化合物(NH3: NH4+和NH3)以及CO2和O2进入组织内后, 高毒的硫化氢在宿主细胞的线粒体和共生菌内硫醌氧化还原酶(Sqr)的作用下被氧化为低毒的硫代硫化物(S2O32-), 并产生三磷酸腺苷(ATP)(Powell et al, 1985, 1986; Anderson et al, 1987)。低毒的硫代硫酸盐在含菌细胞中继续发生氧化反应。共生菌可以通过SOX酶系将硫代硫酸盐氧化为亚硫化物(SO32-), 最终SO32-通过5′-磷酰硫酸腺苷酸途径(APS)经过5′-磷酰硫酸腺苷酸还原酶和ATP硫酸化酶催化形成SO32-, 并且在此过程中通过底物水平磷酸化产生1分子ATP, 同时在还原性硫化物氧化过程形成的自由电子可以通过电子传递链驱动O2消耗产生ATP和NADPH(Chen et al, 1987), 并通过CBB途径固碳。此外, 硫营养型细菌也可以通过反向异化亚硫酸盐还原酶(rDsr)途径直接将硫化氢氧化为硫酸盐获取ATP和NADH(刘阳等, 2018)。
在同一种双壳纲宿主中, 内共生菌的类型若仅为1种则称为单一共生, 若为2种至多种则称为双共生和多共生。通过形态学的显微观察、酶学、16S rRNA序列分析以及荧光原位杂交(fluorescence in situ hybridization, FISH)等方法发现多个深海偏顶蛤物种鳃内含菌细胞的同一个上皮细胞中存在甲烷营养型细菌和硫营养型细菌两种共生菌(Fisher et al, 1993; Distel et al, 1995; Duperron et al, 2005, 2006), 后续随着分子技术及测序技术的发展, 原先根据共生菌形态学发现的只有两种内共生菌的深海偏顶蛤Bathymodiolus heckerae被发现含有四种不同的内共生菌, 其中两种为硫营养型细菌, 一种为甲烷营养型细菌, 另外一种为甲基营养型细菌(Duperron et al, 2007), 而在冷泉区分布的Idas属物种被报道含有6种内共生菌, 其中4种内共生菌和B. heckerae相似, 另外两种与已知的内共生菌谱系均不相同(Duperron et al, 2008)。除了在贻贝科深海偏顶蛤亚科中存在双共生或多共生现象外, 在索足蛤科物种M. hadalis中也报道含有两种内共生菌, 其中1种和囊螂科物种中的硫营养型细菌类似, 另外一种内共生菌在之前并未有报道, 但也属于γ-变形菌纲(Fujiwara et al, 2001)。值得注意的是, 即便在多共生的共生体系中, 宿主与共生菌仍然具有严格的共生专一性, 即同种宿主与特定的共生菌形成共生关系。即便在同一贻贝滩中的不同深海偏顶蛤近缘物种, 共生菌的种类也不相同, 二者如何建立严格的对应关系是目前深海双壳纲共生互作研究的热点问题之一。
1.2 共生菌的传递方式深海双壳纲生物主要通过两种方式进行共生菌的传递: 一种是垂直传递, 主要表现形式是共生菌通过宿主母系的配子细胞传递给后代, 双壳纲宿主在全生活史过程中均含有内共生菌, 另一种是水平传递, 主要表现形式是宿主新产生子代在一定时期内体内不含有共生菌, 而在后期生长发育过程中从环境中重新获取共生菌(Dubilier et al, 2008; Bright et al, 2010), 深海双壳纲贝类的共生菌类型与传递方式不尽相同(图 3)。
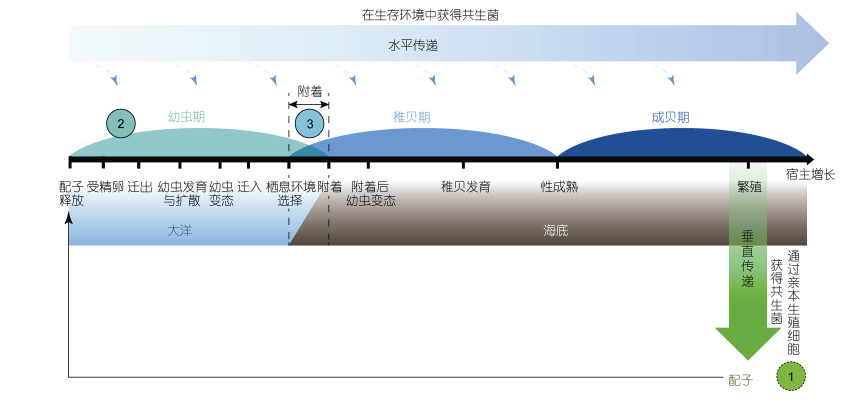 |
| 图 3 共生菌的水平传递与垂直传递示意图 Fig. 3 Schematic diagram of horizontal and vertical transmission of symbiotic bacteria 注: 对于垂直传递的物种来说, 共生菌从亲本的配子细胞中传递给子代, 因此在全生活史阶段始终存在共生菌①; 对于水平传递的物种来说, 共生菌从周围环境中获得自体其他含有共生菌的组织中获得, 因此共生菌可能在源②或汇③处获得; 当在源②处获得共生菌, 则个体生活史中仅有很短时期不含有共生菌, 如果在汇③处获得, 则在附着前很长时间的浮游期皆可能是非共生状态, 在幼虫扩散的大洋浮游过程中则被认为不能获得共生菌, 因为大洋环境中缺乏共生菌生活的环境; 图片根据Laming(2014)修改 |
关于共生菌传递方式的研究主要利用分子生物学手段和显微观察的方式对宿主的性腺组织或者配子进行共生菌信号的检测。针对深海偏顶蛤亚科开展的一系列研究表明, 已调查的物种性腺中均未发现共生菌证据, 而水体中则检出了与共生菌相同的菌株(Fontanez et al, 2014)。而深海偏顶蛤的个体从环境中重新获取共生菌的能力也得到了实验的证实(Kádár et al, 2005; Wang, 2019)。与贻贝科深海偏顶蛤亚科共生菌传递方式相同的双壳纲贝类是索足蛤科(Thyasiridae)和满月蛤科(Lucinidae), 研究发现在满月蛤科物种在卵巢、精巢、卵细胞、面盘幼虫以及附着变态的稚贝中缺少共生菌, 利用菌特异性PCR引物同样在精巢和卵巢中未扩增出细菌信号, 通过透射电镜也没有在满月蛤的性腺组织中观察到细菌样物质(Gros et al, 1996, 1999)。除了上述直接证据, 大量间接证据同样支持以上三种双壳纲宿主中共生菌通过水平传递方式获得。基于分子生物学的手段对宿主内共生菌和线粒体偶联关系进行研究发现后代如果从母系卵细胞中获取内共生菌, 则体内共生菌与线粒体会存在一一对应的偶联关系, 如果发现后代中共生菌类型与线粒体之间不存在稳定的偶联关系, 则表明后代体内共生菌并非来自于母系个体卵细胞。而在水平传递的深海偏顶蛤、满月蛤和索足蛤科相关研究中, 共生菌和宿主并未表现出稳定的共进化模式(Gros et al, 2012; Johnson et al, 2013; Batstone et al, 2016; Ho et al, 2017)。
关于以上三科双壳纲贝类通过水平传递获取共生菌的生活史具体时期存在两种假说, 一种是共生菌只能在生活史中稚贝期中较短的一个时间窗口获取环境中的共生菌, 之后的生长发育过程中, 只能通过接触贝体中含有共生菌的组织完成自我感染获取共生菌, 而另外一种假说推测贝体在整个生活史阶段均可以从环境中获取共生菌, 不受贝体发育阶段的限制(Ansorge et al, 2019; Picazo et al, 2019), 这两个假说还需要后续进一步研究讨论。
与贻贝科深海偏顶蛤亚科、索足蛤科和满月蛤科共生菌通过水平传递方式不同, 囊螂科(Vesicomyidae)和蛏螂科(Solemyidae)的共生菌来源于母系的卵细胞, 在生活史全阶段皆含有共生菌(Endow et al, 1990; Cary, 1994; Krueger et al, 1996)。研究主要集中于通过电子显微镜对含有共生菌的双壳纲贝类的卵巢组织进行观察, 在囊螂科Calyptogena soyoae卵巢组织的超薄切片观察中发现, 在一个初级卵母细胞的切片视野中可以发现多达6个硫营养型细菌, 这些在卵细胞内发现的细菌和鳃部的内共生菌形态相似, 大小相近, 并且也有鳃内硫营养型细菌周质中特有的电子致密物沉积和电子透明空泡(Endow et al, 1990)。同样在蛏螂科物种Solemya reidi中利用电镜技术对性腺组织超薄切片观察, 发现了共生菌通过宿主母系卵细胞在亲子代传递, 而且通过电镜对S. reidi的后期幼虫外套腔观察同样发现大量共生菌细胞, 但有趣的是, 在稚贝的鳃中和配子发育部位中均无共生菌。关于这种现象的解释是这些细菌代表了共生菌垂直传递的一个阶段, 这些共生菌存在于成体S. reidi的鳃中, 而在稚贝中, 虽然也存在共生菌, 但共生菌被颗粒状囊泡包裹, 所以在稚贝鳃中或性腺配子中不明显(Gustafson et al, 1988a)。
在垂直传递的囊螂科中, 也有某些物种被报道出现有水平传递的现象, 绝对的母系遗传会始终保持宿主线粒体与共生菌16S rRNA的系统进化一致性, 但是在囊螂科物种中也有少许的宿主线粒体与共生菌不一致的现象发生(Stewart et al, 2009)。在囊螂科物种中出现的宿主线粒体与共生菌不一致的现象表明在以母系遗传共生菌为主的囊螂科物种中同样存在少量的共生菌水平传递现象。有不同的假说来解释共生菌在囊螂科物种的水平传递机制, 其中包括可能不同囊螂科物种间存在杂交, 或者是从稳定的自养共生菌群体中获得, 或者是直接通过宿主间的转移, 比如通过不同囊螂科物种卵细胞间的接触, 或者濒死的囊螂科蛤类释放出鳃中的共生菌被其他物种接触(Stewart et al, 2008; Decker et al, 2013)。
两种传递模式对于生态环境的适应各有利弊, 对于垂直传递来说, 虽然可以保证后代无缝衔接的获取内共生菌, 但是连续多代的传递过程会导致内共生菌群体出现瓶颈效应, 即内共生菌的遗传多样性降低, 遗传漂变对共生菌群体或者宿主产生的负面影响增加。而对于水平传递策略来说, 后代宿主均要及时重新从环境中获取内共生菌, 如果不能迅速建立共生体系, 则难以适应深海化能生态系统, 但有利之处是后代可以获取的内共生菌的多样性会明显高于垂直传递的宿主, 这种共生菌的多样性是否是导致宿主体内可以进行双共生或多共生的原因还需要进一步研究, 但更高的遗传多样性有利于适应热液冷泉复杂的微环境(Duperron et al, 2006, 2007, 2008)。水平传递的深海偏顶蛤鳃上皮细胞中共生菌具有非常高的遗传多样性, 通过菌株的代谢和适应性互补, 使得该共生体系可以适应高变的热液环境(Ansorge et al, 2019)。此外, 从进化的角度, 垂直传递往往意味着更加紧密的共生联系, 垂直传递的共生菌往往倾向于减小基因组, 因此更多依赖于宿主的酶系统, 往往出现于协同演化历程更长的共生体系中(Fisher et al, 2017)。
2 深海双壳纲共生生活方式的适应性特征 2.1 形态适应由于共生菌的供给, 共生体系的双壳纲滤食能量贡献显著降低, 深海共生双壳纲生物这方面尤其明显; 从形态学和解剖结构来看, 其形态特征发生了适应深海环境的众多特化, 这些组织器官的特化有利于为贝体内共生菌提供充足的化能合成反应的原料, 反过来, 有利于宿主自身的营养获取, 是一种进化上的适应。其中最直观的特点呈现在宿主滤食性行为及消化系统的变化。从深海双壳纲解剖结构和超微结构看, 其鳃部食物沟明显退化, 唇瓣缩小或消失, 肠道缩短变直回环减少或肠道消失(Page, 1991; Pile et al, 1999; Von Cosel, 2002), 这些特征与滤食贡献的下降密切相关, 而鳃的表面积则明显增大, 从而可以寄宿更多的共生菌(Duperron et al, 2016); 通过同位素的研究也发现, 宿主体内大部分能量来源于内共生菌的化能合成作用, 而非滤食性营养过程(Dando et al, 1993; Van Dover et al, 2003; Yamanaka et al, 2003; 王孝程, 2018)。虽然不同科双壳贝共生的方式有差异, 比如在深海偏顶蛤亚科其共生菌主要以内共生为主, 而在索足蛤科其共生菌主要以鳃上皮细胞外表共生为主, 但这两科物种鳃部均明显扩大增生, 在深海偏顶蛤B. boomerang中, 其鳃部长度约占77%的壳长(Von Cosel et al, 1998), 除了表面积的扩增之外, 深海偏顶蛤亚科物种的单一鳃丝厚度明显加厚, 这种增生以及加厚极有可能是有利于更多共生菌进行附着和共生, 反过来讲, 也有可能是由于细菌的共生导致, 膨大增生的鳃丝有利于宿主和共生菌间高效的水气等交换(Kenk et al, 1985; Dufour, 2005; Piquet et al, 2019)。在宿主的行为适应方面主要体现宿主对生存环境的主动选择方面, 这种选择在囊螂科、蛏螂科、索足蛤科和满月蛤物种表现较为突出, 囊螂科物种可以用足挖掘使贝体深入沉积物或热液、冷泉区流体释放形成的裂缝中, 同时将其虹吸管留在含氧较高的海水中, 这种行为特性保证了还原性硫化物和O2同时充足的供给(Childress et al, 1991), 在蛏螂科物种, 为了获取足够的还原性硫化物和O2, 蛏螂在沉积物挖掘形成Y型或U型的通道(Stewart et al, 2006), 在通道底部获取还原性硫化物, 在通道的上方口O2, 并且蛏螂科物种在鳃内含有的血红蛋白可以同时结合O2和还原性硫化物, 为鳃内共生菌的化能反应提供便利(Doeller et al, 1988)。在索足蛤科和满月蛤科物种中, 在足部直径保持不变或缩小的情况下蛤的足部具有非常灵活的可伸展性和柔韧性, 其足可以伸长至收缩状态下的30倍长, 在伸长的条件下, 来自沉积物或孔隙水中的硫化物很容易扩散到足部的血液中, 当足部缩回至外套腔中, 或随着血液循环过程中, 足部的硫化物就会运送到蛤鳃部的内共生菌中(Dufour et al, 2003)。蛏螂科的宿主还可以通过特殊的蛋白携带H2S和O2传递给共生菌, 包括蛏螂科Solemya velum中H2S和O2分别通过胞质中两种不同的血红蛋白进行运输传递给鳃内的共生菌(Doeller et al, 1988), 而S. velum和S. reidi体内的O2除了可以通过血红蛋白运输外, 也可以通过血蓝蛋白运输(Sanders et al, 1998)。
2.2 营养互作深海化能双壳纲贝类通过共生菌直接或者间接提供营养, 主要存在两种假说, 分别为“奶牛”和“牧场”(图 4)。“奶牛”假说主要内容为共生菌通过分泌代谢产物, 为宿主持续地提供所需的物质和能量, 主要的支持证据是研究人员通过细胞酶学和X射线微区分析技术发现细胞内共生菌的消化不是在溶酶体中, 衰老的共生菌会在细菌酸性磷酸酶的作用下发生自溶, 共生菌产生的小分子代谢物转移到宿主细胞内完成营养物质的传递(Kádár et al, 2008); “牧场”假说描述为宿主为共生菌提供了合适的生长环境, 同时宿主可以通过细胞内消化共生菌的方式获取所需的物质能量, 在此过程中含菌细胞内溶酶体起到重要作用, 溶酶体可以与含菌细胞内包裹共生菌的囊泡结合, 在消化酶的作用下将共生菌分解为小分子(Nelson et al, 1995; Fiala-Médioni et al, 2002)。
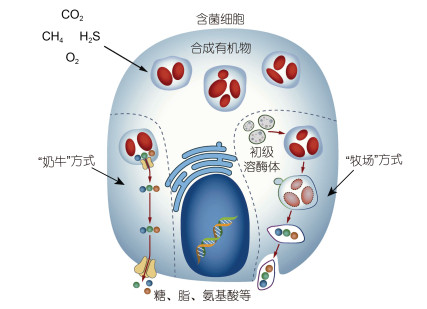 |
| 图 4 宿主获取共生菌营养物质的两种解说 Fig. 4 Two hypotheses (milking and farming) stating how the hosts obtain nutrients from symbiotic bacteria 注: 含菌细胞中左面表示“奶牛”方式, 内共生菌分泌营养物质传递给宿主, 右面所示“牧场”方式, 宿主通过含菌细胞内溶酶体将内共生菌直接消化获取营养 |
在深海偏顶蛤亚科中, 最先是通过电子显微镜观察以及细胞酶学实验发现鳃部含菌细胞内存在“髓磷脂样物”, 这种形状的物质被认为是细菌被溶酶体分解后形成的残留物, 后来通过检测溶酶体标志性酶—酸性磷酸酶(EC 3.1.3.2)的活性来反映溶酶体的活性, 如果在细菌周围检测到高的酸性磷酸酶活性即可推测细菌正在被溶酶体消化。对墨西哥湾深海偏顶蛤Gigantidas childressi的鳃部含菌细胞酶学观察中并没有发现大量的酸性磷酸酶活性, 但后续通过14C标记甲烷进行培养观察到至少1 d后其他非共生的组织才有14C标记物被检测到, 而且含有14C标记的组织增量缓慢, 证明共生菌固定的有机物转移到宿主的时间缓慢, 即共生菌并非通过“奶牛”分泌有机物的方式供给宿主而是被溶酶体分解供给宿主能量(Streams et al, 1997), 但在深海偏顶蛤亚科其他种属物种中也观察到不同的营养转移方式, 比如在Bathymodiolus azoricus观察到细菌通过自我裂解的方式将营养物质转移到宿主(Kádár et al, 2008)。
在蛏螂科(Solemyidae)研究的模式物种S. reidi中, 被报道共生菌通过“奶牛”方式将营养物质传递给宿主(Fisher et al, 1986); 索足蛤科(Thyasiridae)相关物种研究中发现宿主通过“牧场”方式获取共生菌的营养物质(Dufour et al, 2006); 满月蛤科(Lucinidae)物种中, 有报道Lucina pectinata通过“牧场”方式从鳃内共生菌中获取营养物质(Liberge et al, 2001)。
通过比较组学研究, 对于囊螂科和贻贝科的营养互作机制有了初步的认知。在囊螂科的Archivesica marissinica中, 与气体交换(碳酸酐酶、血红蛋白等)、代谢物交换相关的基因扩张, 从而有利于共生菌代谢底物的传递转运以及共生菌产生有机物的运出(Ip et al, 2020)。而碳酸酐酶、通道蛋白、内吞、溶酶体相关基因在深海偏顶蛤中也显著扩张并表达(Sun et al, 2017)。更深入的基于转录组的研究发现在鳃细胞中与三羧酸循环(TCA)相关基因、Rab基因家族及溶菌酶基因具有高表达, 而且与囊泡运输、溶酶体、线粒体和能量代谢相关的基因也受到正向选择; 在鳃部内共生菌中发现参与硫氧化、氧化磷酸化、ATP合成相关的基因高度表达。这些研究表明囊螂科物种为其共生菌提供了重要的能量代谢及有机物合成的中间体, 反过来, 共生菌合成的有机物可以通过囊泡运输或者直接在含菌细胞中被溶酶体降解为宿主提供能量。这些与囊泡运输及能量代谢相关基因的正向选择表明了囊螂科物种从其共生体系中获益的分子适应机制(Lan et al, 2019)。类似的机制在深海偏顶蛤的相关研究中也有所报道, 细胞骨架介导的细胞内运输、通道蛋白、溶酶体以及消化酶相关基因在深海偏顶蛤种同样高表达或者受到选择(Ponnudurai et al, 2017a, 2020; Zheng et al, 2017), 因此双壳纲宿主与共生菌的营养互作分子机制可能存在趋同进化。
在共生体系中, 最重要的体现就是共生的双方或多方进行物质的互补, 简单来看, 双壳纲宿主可以通过接触还原性物质和O2为内共生菌提供化能合成反应的原材料, 内共生菌反过来将合成的有机物提供给宿主。相关研究首先在墨西哥湾冷泉区的深海偏顶蛤G. childressi中被报道, 通过同位素研究发现宿主体内的胆固醇由内共生的甲烷营养型细菌产生(Jahnke et al, 1995), 该结果也得到了后续分子生物学证据的支持, 通过对内共生菌进行基因组测序发现了细菌中含有利用甲烷合成胆固醇生物合成所需中间物的基因, 另外, 转录组的证据也表明冷泉区生活的深海偏顶蛤中含有利用细菌产生的固醇中间物合成固醇的一系列下游酶系统, 证实共生菌为宿主提供固醇合成的甾醇中间体(Takishita et al, 2017); 利用高空间分辨率的质谱成像开展宿主和共生菌代谢互作研究, 结果发现甘油三脂及其他脂类物质是重要的物质传递载体分子(Geier et al, 2020)。在与甲烷营养型菌细单一共生的深海偏顶蛤中, 共生菌通过氨固定途径合成谷氨酰胺, 并提供给宿主以满足有机氮需求(Sun et al, 2017)。在含有双共生的深海偏顶蛤中, 共生菌可以合成宿主需要的氨基酸, 通过ABC转运体转运到含菌细胞中, 宿主也可以通过提供合成氨基酸、辅酶等的原料通过转运体转运至细菌细胞内, 这种生理过程中氨基酸的合成与转运体现了共生体系内两者的高度协作(Zheng et al, 2017; Ponnudurai et al, 2020)。宿主与共生菌在氨基酸合成协作的示例在深海囊螂科与共生菌中得到了充分展示, 共生菌基因组中缺乏氨基酸合成所需的转录因子, 而上述转录因子存在于宿主基因组中(Ip et al, 2020)。同样共生菌之间, 甲烷营养型细菌和硫营养型细菌也可以进行物质传递, 例如, B. azoricus鳃含菌细胞内共生的甲烷营养型细菌产生的CO2可以直接作为另外一类内共生的硫营养型细菌碳固定的原料, 另外, 硫营养型细菌缺少TCA循环中的关键酶(草酰乙酸脱氢酶、苹果酸脱氢酶和琥珀酸脱氢酶), 而甲烷营养型细菌有完整的TCA循环途径, 产生的中间产物或可作为硫营养型细菌TCA循环的补充, 这种利用共生伴侣产生代谢物完成生命过程的现象在深海含有共生菌的生物体内普遍存在(Ponnudurai et al, 2017a, 2020; Li et al, 2020b)。
3 深海双壳纲共生体系的建立与维持不管是以垂直传递获取共生菌的囊螂科与蛏螂科还是水平传递获得共生菌的深海偏顶蛤亚科、索足蛤科和满月蛤科, 深海双壳纲贝类与共生菌的相互识别是共生建立的第一步, 共生双方相互识别与共生建立过程的研究在贻贝科深海偏顶蛤亚科物种中研究较为充分(图 5)。
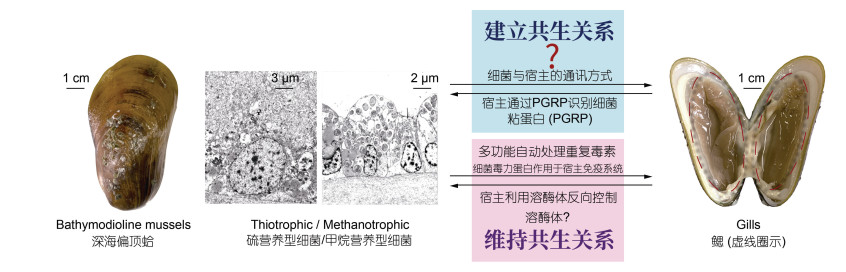 |
| 图 5 深海偏顶蛤与鳃内共生菌的可能相互作用机制 Fig. 5 Possible interaction between Bathymodioline mussels and gill endosymbionts that contributes to the establishment and maintaining of symbiosis 注: 硫营养型细菌与甲烷营养型细菌分别来自于冲绳热液区深海偏顶蛤Bathymodiolus sp.及台西南冷泉区深海偏顶蛤Gigantidas platifrons的鳃丝透射电镜照片(未发表数据)。关于深海偏顶蛤与共生菌的相互作用存在以下未知过程: 在建立共生关系过程中细菌是否释放特殊物质, 与宿主进行通讯, 促进宿主释放黏液进而富集共生菌; 宿主通过什么模式识别受体肽聚糖识别蛋白(PGRP)识别共生菌, 如何介导上皮细胞对共生菌的特异胞吞; 在维持共生关系过程中, 共生菌分泌的毒力蛋白是否作用于宿主免疫系统, 进行免疫屏蔽; 而宿主的溶酶体也可以对内共生菌进行反向控制, 调控共生菌的数量与代谢过程 |
以深海偏顶蛤亚科为例, 在演化历程中, 深海偏顶蛤与共生菌的联系逐渐紧密。白垩纪晚期时进入深海的沉木生境, 并与γ-变形菌纲硫营养型细菌建立了共生关系(Lorion et al, 2013)。在早期分化的物种中(Benthomodiolus属), 共生菌主要分布于细胞外的微绒毛间隙中, 属于细胞外共生。在始新世中期, 随着适宜生境范围的不断扩大, 深海偏顶蛤逐渐扩展, 进入鲸落、冷泉、热液等化能生态系统(Miyazaki et al, 2010), 此时共生菌与深海偏顶蛤(Idas属和Adipicola属等)的联系更加紧密, 共生菌被细胞膜部分包被(Duperron et al, 2016); 但对比内共生的大型深海偏顶蛤, 外共生模式的小型深海偏顶蛤(Idas属等)与共生菌的物种特异性更为宽松(Laming et al, 2015; Rodrigues et al, 2015), 共生菌的类群也更加多样化(Duperron et al, 2016, 2008), 个别种类的共生菌甚至丢失(Rodrigues et al, 2015); 中新世后, 深海偏顶蛤(Bathymodiolus和Gigantidas属)逐渐成功占据热液、冷泉的生态位, 形成了现今的生物格局(Thubaut et al, 2013)。它们在热液冷泉生境的快速扩散是基于这一共生系统多次独立演化的结果, 在贻贝种群扩散过程中, 共生菌由胞外进入到细胞内, 建立了内共生关系(Lorion et al, 2013)。同时, 共生菌和宿主交互约束作用加强, 绝大大多数内共生型深海偏顶蛤种类与共生菌具有高度共生专一性, 同一种深海偏顶蛤不同个体中的甲烷营养型细菌和硫营养型细菌都是同一种类(Ponnudurai et al, 2020)。同时, 而共生菌在环境水体菌群中的相对丰度通常不足1%, 并非优势菌群, 如何实现共生体双方的相互选择, 目前尚缺少深入的研究(Fontanez et al, 2014)。以西北太平洋的热液和冷泉系统为例, 同一贻贝滩中交错分布的深海偏顶蛤(G. platifrons, G. japanicus和G. securifomis)鳃上皮细胞内共生有不同的甲烷营养型细菌, 因此深海偏顶蛤共生菌种类组成的特异性无法用环境中菌群差异解释, 更多的是宿主和共生菌相互选择的结果。
3.2 宿主与共生菌的互作与调控机制伴随着双壳纲宿主的发育, 共生菌的范围也会逐渐聚焦, 最终在鳃组织定生。以深海偏顶蛤亚科物种为例, 共生菌存在的位置会随着宿主的生长发育而发生明显的转移, 在深海偏顶蛤幼虫由浮游期转变为附着生活时, 共生菌在宿主全身的上皮细胞中均有发现, 但在稚贝后期, 共生菌的分布位置逐渐单一, 仅在鳃中可以发现共生菌的分布, 而在身体其他上皮细胞中无法检出共生菌的分布(Streams et al, 1997; Salerno et al, 2005; Wentrup et al, 2013; 钟兆山, 2020)。在垂直传递的物种中, 比如囊螂科与蛏螂科物种中, 共生菌分布在胚胎外壳上, 在发育过程中逐渐被幼体摄入并且转运到前肠, 消化系统分解吸收含有细菌胚胎外壳, 使细菌定殖于外套腔中(Gustafson et al, 1988a, b), 与水平传递的深海偏顶蛤亚科物种类似, 细菌如何转移到鳃中还缺乏清晰的路径解析, 这种内共生菌分布与再分布过程中涉及宿主与内共生菌的相互作用对于理解双壳纲共生体系的建立与维持具有重要作用。综上, 共生的建立与维持是宿主与共生菌动态互作的结果, 其中涉及以下几个关键问题: 内共生菌如何应对宿主的免疫攻击, 宿主如何特异识别共生菌, 二者互作的关键调控分子是什么?上述共生领域的核心问题在深海共生体系中尚缺少系统的结论(Bettencourt et al, 2017)。
为了研究共生菌与宿主之间的相互关系, 对共生菌进行纯培养是常规的方法, 虽然经过科学家多年尝试, 至今为止, 少有化能共生菌被成功人工培养, 因此通过传统的微生物学方法难以实现化能共生菌与宿主的互作关系, 双壳纲贝类的内共生菌的一些生理生化特点也难以被表征, 分子生物学技术的快速发展为认知深海共生互作机制打开了一扇窗口。随着新一代测序技术的发展, 构建文库及测序费用的降低, 使得大规模地平行测序得以实现, 在内共生微生物的区分, 以及微生物和宿主之间相互作用关系方面应用广泛, 其中关于内共生菌在共生体系中的生理适应方面也通过基因组学、比较基因组学和宏转录组等手段陆续开展, 其中代表性的研究成果有深海偏顶蛤亚科平端深海偏顶蛤Gigantidas platifrons (之前被命名为Bathymodiolus platifrons)的基因组信息已被测序完成, 结果发现平端深海偏顶蛤的内源性免疫系统较近海偏顶蛤物种相比更加复杂, 与内吞作用和凋亡抑制相关的基因家族明显扩张并且表达量也较高, 这些基因组层面的信息表明了平端深海偏顶蛤对深海化能生态系统以及化能合成细菌的适应(Sun et al, 2017)。然而与深海偏顶蛤不同, 囊螂科物种基因组中免疫相关基因家族显著收缩(Ip et al, 2020), 同为双壳纲的两个共生生物似乎采用了不同的免疫策略适应共生。对比两种共生体系, 深海偏顶蛤(水平传递)与囊螂科物种(垂直传递)的共生菌传递方式截然不同。相比于从受精卵获得共生菌的囊螂科, 贻贝需要与环境中的共生菌进行广泛互作, 通过富集、内吞等一系列过程获取共生菌, 因此需要更加复杂的免疫系统。而垂直传递的囊螂蛤, 免疫系统的弱化可能有利于共生菌在宿主体内的维持。两者具有一个共同点, 凋亡抑制相关基因家族菌显著扩张, 提示凋亡抑制在含菌细胞功能维持中可能发挥重要作用, 相关基因也被发现在含菌组织中显著高表达(Sun et al, 2017; Zheng et al, 2017; 郑平, 2018)。
通过比较平端深海偏顶蛤与其近海近缘物种的转录组发现, 在深海偏顶蛤鳃中只有特定的免疫基因类型扩张和受到正向选择(TLRs与C1QDC蛋白), 但是模式识别受体相关基因收缩、表达量减少, 这些结果表明平端深海偏顶蛤与其内共生菌之间有着非常协调的相互识别机制, 通过整体弱化免疫系统、增强胞吞作用, 调控具有附着和富集作用的细胞外基质、增强重要底物的主动运输, 为共生的建立提供有利条件(Zheng et al, 2017; 郑平, 2018)。随着研究的逐步深入众多与共生菌识别以及与维持共生体系稳定相关的基因被鉴定, 相关基因在深海偏顶蛤含菌细胞中的定位与功能也被逐渐认知(Chen et al, 2019; Wang et al, 2019; Li et al, 2020a), TLR和LRR可能是深海偏顶蛤共生菌识别的主要免疫受体, 而LPS是主要靶标(Chen et al, 2019)。
除了宿主的基因组信息被测序完成之外, 关于内共生菌的基因组信息研究发现在大西洋中脊热液区的两种深海偏顶蛤B. azoricus和B. sp.内共生硫营养型细菌的基因组中与毒素相关的基因家族发生了特异的扩张, 后续通过转录组和蛋白质组研究发现, 共生菌的毒素相关基因在宿主中表达量较高, 推测高表达量的毒素蛋白可以防止宿主被其他病原微生物感染(Sayavedra et al, 2015), 另外, 在Bathymodiolus thermophilus基因组中也发现了大量与细菌毒性和噬菌体免疫相关的基因, 除此之外, 也发现了与细胞黏附相关的基因, 推测与共生体系双方特异性识别相关(Ponnudurai et al, 2017b), 在双共生或多共生体系中, 内共生菌间分泌的毒素组成和数量存在物种特异性, 这可能与含有多共生体系中内共生菌间的相互选择有关(Sayavedra et al, 2019)。通过B. azoricus去共生前后的组学比较研究, 发现共生菌不仅为宿主细胞提供物质和能量, 还可以调控宿主鳃的代谢形式、免疫应答和凋亡(Détrée et al, 2019)。囊螂蛤基因组中发现多个祖先共生菌的水平转移基因, 其中包括潜在的转录因子, 提示水平转移基因可能在共生互作中发挥作用(Ip et al, 2020)。
4 总结与展望细菌与真核生物的共生关系在自然界广泛存在, 是生物生存环境与演化更新的基础。在深海无光的化能生态系统中, 双壳纲生物与化能合成菌形成的共生体是深海化能生态系统中大型生物区系的代表, 稳定共生体系的形成也是宿主适应深海化能环境的重要基础, 同时, 这些共生体为复杂的深海化能生态提供了主要的初级营养。本文中提及的化能合成细菌主要包括硫营养型细菌和甲烷营养型细菌, 这两类细菌可以与双壳贝类形成紧密的共生关系, 将CO2或CH4转化成有机物, 提供宿主生存的主要营养物质, 比如氨基酸、固醇等。关于双壳纲宿主鳃部对内共生菌的营养获取的两种假说“奶牛”和“牧场”还未得到直观的验证, 有可能两种方式均存在于鳃部含菌细胞中。综上, 具体的传递方式和介质是什么缺少系统研究, 目前的结果更多基于组学数据的推断, 在将来的实验研究中需要通过标记培养、单细胞原位观测的手段继续明确共生菌为宿主提供的物质种类和传递途径、效率和方式。
至今为止, 报道的深海化能双壳贝类主要分布在5科中, 但这5科生物与化能合成细菌间的互作关系各有异同, 从共生的方式来说, 内共生的方式占5科生物的主导地位, 除了索足蛤科大部分物种主要以鳃表共生为主外, 其他4科物种中多以鳃部上皮细胞内共生为主, 这些共生菌以化能合成方式固定有机碳传递给宿主, 支撑宿主的繁衍。除了以内共生方式为主的双壳纲生物在其鳃表面同样含有大量附生的细菌, 附生菌是否也在双壳纲物种的深海适应性中发挥重要作用有待深入研究。
从共生菌的传递方式来看, 5科双壳贝中贻贝科、满月蛤科以水平传递方式从环境中获取共生菌, 即生活史的早期阶段存在以非共生生活的方式, 后期逐步与环境中的共生菌建立共生关系; 囊螂科、蛏螂科以垂直传递方式从母系卵细胞中获取共生菌, 即生活史中没有不含共生菌的阶段; 索足蛤科物种与上述4科物种相比, 宿主与共生菌间的关系非常灵活, 本科物种中有的含有共生菌, 有的无共生菌, 但共生菌的获取方式为水平传递。多种类型的共生菌传递过程是不同演化过程适应性进化的产物, 因此, 将来系统地采样加上综合比较研究, 将为揭示共生的建立过程和协同演化研究提供有力支撑。
宿主与内共生菌相互识别是建立和维持共生关系的基石, 认知共生菌与宿主深海偏顶蛤的协同演化, 解析共生互作的关键机制, 对于理解深海共生和共生体系的极端环境适应具有重要意义。通过组学比较研究, 深海偏顶蛤和囊螂科的共生菌–宿主互作识别机制已经有了初步认知, 但是在其他深海双壳纲生物中研究几近空白。相比较于海洋无脊椎动物–微生物共生体系中研究最为成熟的头足纲鱿鱼–发光弧菌共生体系, 深海共生中有许多亟待解决的科学问题。以深海偏顶蛤–化能细菌共生体系为例, 主要包括: (1)宿主通过什么化学、物理方式富集共生菌?(2)共生菌如何诱导上皮细胞进行胞吞, 完成环境中低丰度共生菌的胞内定殖?(3)细菌进入细胞内后, 如何避免宿主的免疫攻击?(4)宿主如何监测共生菌状态并进行有效调控?由于深海生物缺少合适的遗传工具, 因此目前深海共生的研究更多需要集中在组学大数据的筛查中。相似性状近缘物种比较基因组是快速筛选共生互作备选基因最为有效的途径, 以趋同进化的视角研究双壳纲生物与共生菌互作的一般性规律, 将为揭示深海双壳纲生物共生互作机制提供最初的理论假设。特别是同栖息地但具有不同共生菌的姊妹种为揭示专一共生的关键识别和互作机制提供了有利模型。除了基于组学比较的静态分析, 随着深海研究装备和技术水平的不断提升, 原位条件下的共生过程动态研究已成为可能。深海原位培养设备以及岸基深海模拟装置正逐渐用于深海共生体系的相关研究。中国科学院海洋研究所已经尝试开展了包括深海去共生和共生复染实验(Wang et al, 2019), 在宿主与共生菌的动态互作过程中揭示识别、调控机制。未来还需继续开展不同宿主和与近缘物种共生菌的交叉侵染研究, 筛选宿主共生菌识别、互作的关键分子。此外, 关注其繁殖发育的不同阶段与环境中共生菌的相互作用, 准确确定共生关系建立的生活史阶段以及绘制清晰的共生菌分布转移路径也是未来有关共生互作相关研究的重点。
王孝程, 2018. 深海化能生态系统大型生物营养来源分析及对重金属的富集作用. 青岛: 中国科学院大学(中国科学院海洋研究所)博士学位论文, 28-34
|
刘阳, 姜丽晶, 邵宗泽. 2018. 硫氧化细菌的种类及硫氧化途径的研究进展. 微生物学报, 58(2): 191-201 |
郑平, 2018. 深海偏顶蛤(Bathymodiolus platifrons)对深海环境的适应性机制. 青岛: 中国科学院大学(中国科学院海洋研究所)博士学位论文, 93-112
|
钟兆山, 2020. 中国南海福尔摩沙冷泉区平端深海偏顶蛤Gigantidas platifrons繁殖生物学的初步研究. 青岛: 中国科学院大学(中国科学院海洋研究所)博士学位论文, 66-91
|
Anderson A E, Childress J J, Favuzzi J A, 1987. Net uptake of CO2 driven by sulphide and thiosulphate oxidation in the bacterial symbiont-containing clam Solemya reidi. Journal of Experimental Biology, 133(1): 1-31 |
Ansorge R, Romano S, Sayavedra L et al, 2019. Functional diversity enables multiple symbiont strains to coexist in deep-sea mussels. Nature Microbiology, 4(12): 2487-2497 DOI:10.1038/s41564-019-0572-9 |
Barry J P, Buck K R, Kochevar R K et al, 2002. Methane-based symbiosis in a mussel, Bathymodiolus platifrons, from cold seeps in Sagami Bay, Japan. Invertebrate Biology, 121(1): 47-54 |
Batstone R T, Dufour S C, 2016. Closely related thyasirid bivalves associate with multiple symbiont phylotypes. Marine Ecology, 37(5): 988-997 DOI:10.1111/maec.12310 |
Batstone R T, Laurich J R, Salvo F et al, 2014. Divergent chemosymbiosis-related characters in Thyasira cf. gouldi (Bivalvia: Thyasiridae). PLoS One, 9(3): e92856 DOI:10.1371/journal.pone.0092856 |
Bettencourt R, Barros I, Martins E et al, 2017. An insightful model to study innate immunity and stress response in deep-sea vent animals: profiling the mussel Bathymodiolus azoricus. In: Ray S ed. Organismal and Molecular Malacology. Rijeka: Intech
|
Bienhold C, Pop Ristova P, Wenzhöfer F et al, 2013. How deep-sea wood falls sustain chemosynthetic life. PLoS One, 8(1): e53590 DOI:10.1371/journal.pone.0053590 |
Bright M, Bulgheresi S, 2010. A complex journey: transmission of microbial symbionts. Nature Reviews Microbiology, 8(3): 218 DOI:10.1038/nrmicro2262 |
Cary S C, 1994. Vertical transmission of a chemoautotrophic symbiont in the protobranch bivalve, Solemya reidi. Molecular Marine Biology and Biotechnology, 3(3): 121-130 |
Cavanaugh C M, Levering P R, Maki J S et al, 1987. Symbiosis of methylotrophic bacteria and deep-sea mussels. Nature, 325(6102): 346-348 DOI:10.1038/325346a0 |
Ceramicola S, Dupré S, Somoza L et al, 2018. Cold seep systems. In: Micallef A, Krastel S, Savini A eds. Submarine Geomorphology. Cham: Springer, 367-387
|
Chen C, Rabourdin B, Hammen C S, 1987. The effect of hydrogen sulfide on the metabolism of Solemya velum and enzymes of sulfide oxidation in gill tissue. Comparative Biochemistry and Physiology Part B: Comparative Biochemistry, 88(3): 949-952 DOI:10.1016/0305-0491(87)90269-0 |
Chen H, Wang M X, Zhang H et al, 2019. An LRR-domain containing protein identified in Bathymodiolus platifrons serves as intracellular recognition receptor for the endosymbiotic methane-oxidation bacteria. Fish & Shellfish Immunology, 93: 354-360 |
Childress J J, Fisher C R, Brooks J M et al, 1986. A methanotrophic marine molluscan (Bivalvia, Mytilidae) symbiosis: mussels fueled by gas. Science, 233(4770): 1306-1308 DOI:10.1126/science.233.4770.1306 |
Childress J J, Fisher C R, Favuzzi J A et al, 1991. Sulfide and carbon dioxide uptake by the hydrothermal vent clam, Calyptogena magnifica, and its chemoautotrophic symbionts. Physiological Zoology, 64(6): 1444-1470 DOI:10.1086/physzool.64.6.30158224 |
Corliss J B, Dymond J, Gordon L I et al, 1979. Submarine thermal springs on the Galápagos Rift. Science, 203(4385): 1073-1083 DOI:10.1126/science.203.4385.1073 |
Dando P R, Spiro B, 1993. Varying nutritional dependence of the thyasirid bivalves Thyasira sarsi and T. equalis on chemoautotrophic symbiotic bacteria, demonstrated by isotope ratios of tissue carbon and shell carbonate. Marine Ecology Progress Series, 92: 151-158 DOI:10.3354/meps092151 |
DeChaine E G, Cavanaugh C M, 2005. Symbioses of methanotrophs and deep-sea mussels (Mytilidae: Bathymodiolinae). In: Overmann J ed. Molecular Basis of Symbiosis. Berlin, Heidelberg: Springer, 227-249
|
Decker C, Olu K, Arnaud-Haond S et al, 2013. Physical proximity may promote lateral acquisition of bacterial symbionts in vesicomyid clams. PLoS One, 8(7): e64830 DOI:10.1371/journal.pone.0064830 |
Decker C, Olu K, Cunha R L et al, 2012. Phylogeny and diversification patterns among vesicomyid bivalves. PLoS One, 7(4): e33359 DOI:10.1371/journal.pone.0033359 |
Détrée C, Haddad I, Demey-Thomas E et al, 2019. Global host molecular perturbations upon in situ loss of bacterial endosymbionts in the deep-sea mussel Bathymodiolus azoricus assessed using proteomics and transcriptomics. BMC Genomics, 20(1): 109 DOI:10.1186/s12864-019-5456-0 |
Distel D L, Lee H K, Cavanaugh C M, 1995. Intracellular coexistence of methano- and thioautotrophic bacteria in a hydrothermal vent mussel. Proceedings of the National Academy of Sciences of the United States of America, 92(21): 9598-9602 DOI:10.1073/pnas.92.21.9598 |
Doeller J E, Kraus D W, Colacino J M et al, 1988. Gill hemoglobin may deliver sulfide to bacterial symbionts of Solemya velum (Bivalvia, Mollusca). The Biological Bulletin, 175(3): 388-396 DOI:10.2307/1541730 |
Dubilier N, Bergin C, Lott C, 2008. Symbiotic diversity in marine animals: the art of harnessing chemosynthesis. Nature Reviews Microbiology, 6(10): 725-740 DOI:10.1038/nrmicro1992 |
Dufour S C, 2005. Gill anatomy and the evolution of symbiosis in the bivalve family thyasiridae. The Biological Bulletin, 208(3): 200-212 DOI:10.2307/3593152 |
Dufour S C, Felbeck H, 2003. Sulphide mining by the superextensile foot of symbiotic thyasirid bivalves. Nature, 426(6962): 65-67 DOI:10.1038/nature02095 |
Dufour S C, Felbeck H, 2006. Symbiont abundance in thyasirids (Bivalvia) is related to particulate food and sulphide availability. Marine Ecology Progress Series, 320: 185-194 DOI:10.3354/meps320185 |
Duperron S, 2010. The diversity of deep-sea mussels and their bacterial symbioses. In: Kiel S ed. The Vent and Seep Biota: Aspects from Microbes to Ecosystems. Dordrecht: Springer, 137-167
|
Duperron S, Bergin C, Zielinski F et al, 2006. A dual symbiosis shared by two mussel species, Bathymodiolus azoricus and Bathymodiolus puteoserpentis (Bivalvia: Mytilidae), from hydrothermal vents along the northern Mid-Atlantic Ridge. Environmental Microbiology, 8(8): 1441-1447 DOI:10.1111/j.1462-2920.2006.01038.x |
Duperron S, Gros O, 2016. Colwellia and sulfur-oxidizing bacteria: an unusual dual symbiosis in a Terua mussel (Mytilidae: Bathymodiolinae) from whale falls in the Antilles arc. Deep Sea Research Part Ⅰ: Oceanographic Research Papers, 115: 112-122 DOI:10.1016/j.dsr.2016.05.012 |
Duperron S, Halary S, Lorion J et al, 2008. Unexpected co-occurrence of six bacterial symbionts in the gills of the cold seep mussel Idas sp. (Bivalvia: Mytilidae). Environmental Microbiology, 10(2): 433-445 DOI:10.1111/j.1462-2920.2007.01465.x |
Duperron S, Nadalig T, Caprais J C et al, 2005. Dual symbiosis in a Bathymodiolus sp. mussel from a methane seep on the Gabon continental margin (Southeast Atlantic): 16S rRNA phylogeny and distribution of the symbionts in gills. Applied and Environmental Microbiology, 71(4): 1694-1700 DOI:10.1128/AEM.71.4.1694-1700.2005 |
Duperron S, Quiles A, Szafranski K M et al, 2016. Estimating symbiont abundances and gill surface areas in specimens of the hydrothermal vent mussel Bathymodiolus puteoserpentis maintained in pressure vessels. Frontiers in Marine Science, 3: 16 |
Duperron S, Sibuet M, MacGregor B J et al, 2007. Diversity, relative abundance and metabolic potential of bacterial endosymbionts in three Bathymodiolus mussel species from cold seeps in the Gulf of Mexico. Environmental Microbiology, 9(6): 1423-1438 DOI:10.1111/j.1462-2920.2007.01259.x |
Endow K, Ohta S, 1990. Occurrence of bacteria in the primary oocytes of vesicomyid clam Calyptogena soyoae. Marine Ecology Progress Series, 64: 309-311 DOI:10.3354/meps064309 |
Felbeck H, 1983. Sulfide oxidation and carbon fixation by the gutless clam Solemya reidi: an animal-bacteria symbiosis. Journal of Comparative Physiology, 152: 3-11 DOI:10.1007/BF00689721 |
Felbeck H, Childress J J, Somero G N, 1981. Calvin-Benson cycle and sulphide oxidation enzymes in animals from sulphide-rich habitats. Nature, 293(5390): 291-293 |
Fiala-Médioni A, Métivier C, 1986a. Ultrastructure of the gill of the hydrothermal vent bivalve Calyptogena magnifica, with a discussion of its nutrition. Marine Biology, 90(2): 215-222 DOI:10.1007/BF00569130 |
Fiala-Médioni A, Métivier C, Herry A et al, 1986b. Ultrastructure of the gill of the hydrothermal-vent mytilid Bathymodiolus sp. Marine Biology, 92(1): 65-72 DOI:10.1007/BF00392747 |
Fiala-Médioni A, McKiness Z, Dando P et al, 2002. Ultrastructural, biochemical, and immunological characterization of two populations of the mytilid mussel Bathymodiolus azoricus from the mid-Atlantic ridge: evidence for a dual symbiosis. Marine Biology, 141(6): 1035-1043 DOI:10.1007/s00227-002-0903-9 |
Fisher C R, 1990. Chemoautotrophic and methanotrophic symbioses in marine invertebrates. Reviews in Aquatic Sciences, 2: 399-436 |
Fisher C R, Brooks J M, Vodenichar J S et al, 1993. The co-occurrence of methanotrophic and chemoautotrophic sulfur-oxidizing bacterial symbionts in a deep-sea mussel. Marine Ecology, 14(4): 277-289 DOI:10.1111/j.1439-0485.1993.tb00001.x |
Fisher C R, Childress J J, 1986. Translocation of fixed carbon from symbiotic bacteria to host tissues in the gutless bivalve Solemya reidi. Marine Biology, 93(1): 59-68 DOI:10.1007/BF00428655 |
Fisher R M, Henry L M, Cornwallis C K et al, 2017. The evolution of host-symbiont dependence. Nature Communications, 8: 15973 DOI:10.1038/ncomms15973 |
Fontanez K M, Cavanaugh C M, 2014. Evidence for horizontal transmission from multilocus phylogeny of deep-sea mussel (Mytilidae) symbionts. Environmental Microbiology, 16(12): 3608-3621 DOI:10.1111/1462-2920.12379 |
Fujikura K, Kojima S, Tamaki K et al, 1999. The deepest chemosynthesis-based community yet discovered from the hadal zone, 7326 m deep, in the Japan Trench. Marine Ecology Progress Series, 190: 17-26 DOI:10.3354/meps190017 |
Fujiwara Y, Kato C, Masui N et al, 2001. Dual symbiosis in the cold-seep thyasirid clam Maorithyas hadalis from the hadal zone in the Japan Trench, western Pacific. Marine Ecology Progress Series, 214: 151-159 DOI:10.3354/meps214151 |
Fujiwara Y, Kawato M, Noda C et al, 2010. Extracellular and mixotrophic symbiosis in the whale-fall mussel Adipicola pacifica: a trend in evolution from extra- to intracellular symbiosis. PLoS One, 5(7): e11808 DOI:10.1371/journal.pone.0011808 |
Geier B, Sogin E M, Michellod D et al, 2020. Spatial metabolomics of in situ host-microbe interactions at the micrometre scale. Nature Microbiology, 5(3): 498-510 DOI:10.1038/s41564-019-0664-6 |
Gros O, Darrasse A, Durand P et al, 1996. Environmental transmission of a sulfur-oxidizing bacterial gill endosymbiont in the tropical lucinid bivalve Codakia orbicularis. Applied and Environmental Microbiology, 62(7): 2324-2330 DOI:10.1128/AEM.62.7.2324-2330.1996 |
Gros O, Duplessis M R, Felbeck H, 1999. Embryonic development and endosymbiont transmission mode in the symbiotic clam Lucinoma aequizonata (Bivalvia: Lucinidae). Invertebrate Reproduction & Development, 36(1-3): 93-103 |
Gros O, Elisabeth N H, Gustave S D D et al, 2012. Plasticity of symbiont acquisition throughout the life cycle of the shallow-water tropical lucinid Codakia orbiculata (Mollusca: Bivalvia). Environmental Microbiology, 14(6): 1584-1595 DOI:10.1111/j.1462-2920.2012.02748.x |
Gros O, Gaill F, 2007. Extracellular bacterial association in gills of «wood mussels». Cahiers de Biologie Marine, 48: 103-109 |
Gustafson R G, Reid R G B, 1988a. Association of bacteria with larvae of the gutless protobranch bivalve Solemya reidi (Cryptodonta: Solemyidae). Marine Biology, 97(3): 389-401 DOI:10.1007/BF00397769 |
Gustafson R G, Reid R G B, 1988b. Larval and post-larval morphogenesis in the gutless protobranch bivalve Solemya reidi (Cryptodonta: Solemyidae). Marine Biology, 97(3): 373-387 DOI:10.1007/BF00397768 |
Ho P T, Park E, Hong S G et al, 2017. Geographical structure of endosymbiotic bacteria hosted by Bathymodiolus mussels at eastern Pacific hydrothermal vents. BMC Evolutionary Biology, 17: 121 DOI:10.1186/s12862-017-0966-3 |
Ip J C H, Xu T, Sun J et al, 2020. Host-endosymbiont genome integration in a deep-sea chemosymbiotic clam. Molecular Biology and Evolution, doi: 10.1093/molbev/msaa241
|
Jahnke L L, Summons R E, Dowling L M et al, 1995. Identification of methanotrophic lipid biomarkers in cold-seep mussel gills: chemical and isotopic analysis. Applied and Environmental Microbiology, 61(2): 576-582 DOI:10.1128/AEM.61.2.576-582.1995 |
Johnson S B, Krylova E M, Audzijonyte A et al, 2017. Phylogeny and origins of chemosynthetic vesicomyid clams. Systematics and Biodiversity, 15(4): 346-360 DOI:10.1080/14772000.2016.1252438 |
Johnson S B, Won Y J, Harvey J B J et al, 2013. A hybrid zone between Bathymodiolus mussel lineages from eastern Pacific hydrothermal vents. BMC Evolutionary Biology, 13: 21 DOI:10.1186/1471-2148-13-21 |
Kádár E, Bettencourt R, Costa V et al, 2005. Experimentally induced endosymbiont loss and re-acquirement in the hydrothermal vent bivalve Bathymodiolus azoricus. Journal of Experimental Marine Biology and Ecology, 318(1): 99-110 DOI:10.1016/j.jembe.2004.12.025 |
Kádár E, Davis S A, Lobo-da-Cunha A, 2008. Cytoenzymatic investigation of intracellular digestion in the symbiont-bearing hydrothZermal bivalve Bathymodiolus azoricus. Marine Biology, 153(5): 995-1004 DOI:10.1007/s00227-007-0872-0 |
Kenk V C, Wilson B R, 1985. A new mussel (Bivalvia, Mytilidae) from hydrothermal vents in the Galapagos Rift zone. Malacologia, 26: 253-271 |
Kharlamenko V I, Kiyashko S I, Sharina S N et al, 2019. An ecological study of two species of chemosymbiotrophic bivalve molluscs (Bivalvia: Vesicomyidae: Pliocardiinae) from the Deryugin Basin of the Sea of Okhotsk using analyses of the stable isotope ratios and fatty acid compositions. Deep Sea Research Part Ⅰ: Oceanographic Research Papers, 150: 103058 DOI:10.1016/j.dsr.2019.06.004 |
Krueger D M, Gustafson R G, Cavanaugh C M, 1996. Vertical transmission of chemoautotrophic symbionts in the bivalve Solemya velum (Bivalvia: Protobranchia). The Biological Bulletin, 190(2): 195-202 DOI:10.2307/1542539 |
Krylova E M, Sahling H, 2010. Vesicomyidae (Bivalvia): current taxonomy and distribution. PLoS One, 5(4): e9957 DOI:10.1371/journal.pone.0009957 |
Laming S R, Duperron S, Cunha M R et al, 2014. Settled, symbiotic, then sexually mature: adaptive developmental anatomy in the deep-sea, chemosymbiotic mussel Idas modiolaeformis. Marine biology, 161(6): 1319-1333 DOI:10.1007/s00227-014-2421-y |
Laming S R, Duperron S, Gaudron S M et al, 2015. Adapted to change: the rapid development of symbiosis in newly settled, fast-maturing chemosymbiotic mussels in the deep sea. Marine Environmental Research, 112: 100-112 DOI:10.1016/j.marenvres.2015.07.014 |
Lan Y, Sun J, Zhang W P et al, 2019. Host-symbiont interactions in deep-sea chemosymbiotic vesicomyid clams: insights from transcriptome sequencing. Frontiers in Marine Science, 6: 680 DOI:10.3389/fmars.2019.00680 |
Lemer S, Bieler R, Giribet G, 2019. Resolving the relationships of clams and cockles: dense transcriptome sampling drastically improves the bivalve tree of life. Proceedings of the Royal Society B, 286(1896): 20182684 DOI:10.1098/rspb.2018.2684 |
Li L L, Wang M X, Li L F et al, 2020b. Endosymbionts of metazoans dwelling in the PACManus hydrothermal vent: diversity and potential adaptive features revealed by genome analysis. Applied and Environmental Microbiology, 86(21): e00815-00820 |
Li M N, Chen H, Wang M X et al, 2020a. Identification and characterization of endosymbiosis-related immune genes in deep-sea mussels Gigantidas platifrons. Journal of Oceanology and Limnology, 38(4): 1292-1303 DOI:10.1007/s00343-020-0040-7 |
Liberge M, Gros O, Frenkiel L, 2001. Lysosomes and sulfide-oxidizing bodies in the bacteriocytes of Lucina pectinata, a cytochemical and microanalysis approach. Marine Biology, 139(3): 401-409 DOI:10.1007/s002270000526 |
Lonsdale P, 1977. Clustering of suspension-feeding macrobenthos near abyssal hydrothermal vents at oceanic spreading centers. Deep Sea Research, 24(9): 857-858, IN3-IN4, 859-863
|
Lorion J, Kiel S, Faure B et al, 2013. Adaptive radiation of chemosymbiotic deep-sea mussels. Proceedings of the Royal Society B, 280(1770): 20131243 DOI:10.1098/rspb.2013.1243 |
Martin W, Baross J, Kelley D et al, 2008. Hydrothermal vents and the origin of life. Nature Reviews Microbiology, 6(11): 805-814 DOI:10.1038/nrmicro1991 |
Miyazaki J, de Oliveira Martins L, Fujita Y et al, 2010. Evolutionary process of deep-sea Bathymodiolus mussels. PLoS One, 5(4): e10363 DOI:10.1371/journal.pone.0010363 |
Nelson D C, Hagen K D, Edwards D B, 1995. The gill symbiont of the hydrothermal vent mussel Bathymodiolus thermophilus is a psychrophilic, chemoautotrophic, sulfur bacterium. Marine Biology, 121(2): 487-495 DOI:10.1007/BF00349457 |
Oliver P G, 2015. Description and morphology of the "Juan de Fuca vent mussel", Benthomodiolus erebus sp. n. (Bivalvia, Mytilidae, Bathymodiolinae): "phylogenetically basal but morphologically advanced". Zoosystematics and Evolution, 91(2): 151-165 DOI:10.3897/zse.91.5417 |
Page H M, Fiala-Medioni A, Fisher C R et al, 1991. Experimental evidence for filter-feeding by the hydrothermal vent mussel, Bathymodiolus thermophilus. Deep Sea Research Part A. Oceanographic Research Papers, 38(12): 1455-1461 DOI:10.1016/0198-0149(91)90084-S |
Petersen J M, Dubilier N, 2010. Symbiotic methane oxidizers. In: Timmis K N ed. Handbook of Hydrocarbon and Lipid Microbiology. Berlin, Heidelberg: Springer, 1977-1996
|
Petersen J M, Zielinski F U, Pape T et al, 2011. Hydrogen is an energy source for hydrothermal vent symbioses. Nature, 476(7359): 176-180 DOI:10.1038/nature10325 |
Picazo D R, Dagan T, Ansorge R et al, 2019. Horizontally transmitted symbiont populations in deep-sea mussels are genetically isolated. The ISME Journal, 13(12): 2954-2968 DOI:10.1038/s41396-019-0475-z |
Pile A J, Young C M, 1999. Plankton availability and retention efficiencies of cold-seep symbiotic mussels. Limnology and Oceanography, 44(7): 1833-1839 DOI:10.4319/lo.1999.44.7.1833 |
Piquet B, Shillito B, Lallier F H et al, 2019. High rates of apoptosis visualized in the symbiont-bearing gills of deep-sea Bathymodiolus mussels. PLoS One, 14(2): e0211499 DOI:10.1371/journal.pone.0211499 |
Ponnudurai R, Heiden S E, Sayavedra L et al, 2020. Comparative proteomics of related symbiotic mussel species reveals high variability of host-symbiont interactions. The ISME Journal, 14(2): 649-656 DOI:10.1038/s41396-019-0517-6 |
Ponnudurai R, Kleiner M, Sayavedra L et al, 2017a. Metabolic and physiological interdependencies in the Bathymodiolus azoricus symbiosis. The ISME Journal, 11(2): 463-477 DOI:10.1038/ismej.2016.124 |
Ponnudurai R, Sayavedra L, Kleiner M et al, 2017b. Genome sequence of the sulfur-oxidizing Bathymodiolus thermophilus gill endosymbiont. Standards in Genomic Sciences, 12(1): 50 DOI:10.1186/s40793-017-0266-y |
Powell M A, Somero G N, 1985. Sulfide oxidation occurs in the animal tissue of the gutless clam, Solemya reidi. The Biological Bulletin, 169(1): 164-181 DOI:10.2307/1541396 |
Powell M A, Somero G N, 1986. Hydrogen sulfide oxidation is coupled to oxidative phosphorylation in mitochondria of Solemya reidi. Science, 233(4763): 563-566 DOI:10.1126/science.233.4763.563 |
Rodrigues C F, Laming S R, Gaudron S M et al, 2015. A sad tale: has the small mussel Idas argenteus lost its symbionts?. Biological Journal of the Linnean Society, 114(2): 398-405 DOI:10.1111/bij.12431 |
Roeselers G, Newton I L G, 2012. On the evolutionary ecology of symbioses between chemosynthetic bacteria and bivalves. Applied Microbiology and Biotechnology, 94(1): 1-10 DOI:10.1007/s00253-011-3819-9 |
Salerno J L, Macko S A, Hallam S J et al, 2005. Characterization of symbiont populations in life-history stages of mussels from chemosynthetic environments. The Biological Bulletin, 208(2): 145-155 DOI:10.2307/3593123 |
Sanders N, Childress J J, McMahon B R, 1998. Oxygen transport by the hemocyanin of the protobranch mollusc Solemya reidi. Marine Biology, 131(2): 293-299 DOI:10.1007/s002270050322 |
Sayavedra L, Ansorge R, Rubin-Blum M et al, 2019. Horizontal acquisition followed by expansion and diversification of toxin-related genes in deep-sea bivalve symbionts. Biorxiv: 605386 |
Sayavedra L, Kleiner M, Ponnudurai R et al, 2015. Abundant toxin-related genes in the genomes of beneficial symbionts from deep-sea hydrothermal vent mussels. eLife, 4: e07966 DOI:10.7554/eLife.07966 |
Smith C R, Glover A G, Treude T et al, 2015. Whale-fall ecosystems: recent insights into ecology, paleoecology, and evolution. Annual Review of Marine Science, 7: 571-596 DOI:10.1146/annurev-marine-010213-135144 |
Stewart F J, Cavanaugh C M, 2006. Bacterial endosymbioses in Solemya (Mollusca: Bivalvia)-Model systems for studies of symbiont-host adaptation. Antonie van Leeuwenhoek, 90(4): 343-360 DOI:10.1007/s10482-006-9086-6 |
Stewart F J, Cavanaugh C M, 2009. Pyrosequencing analysis of endosymbiont population structure: co-occurrence of divergent symbiont lineages in a single vesicomyid host clam. Environmental Microbiology, 11(8): 2136-2147 DOI:10.1111/j.1462-2920.2009.01933.x |
Stewart F J, Newton I L G, Cavanaugh C M, 2005. Chemosynthetic endosymbioses: adaptations to oxic-anoxic interfaces. Trends in Microbiology, 13(9): 439-448 DOI:10.1016/j.tim.2005.07.007 |
Stewart F J, Young C R, Cavanaugh C M, 2008. Lateral symbiont acquisition in a maternally transmitted chemosynthetic clam endosymbiosis. Molecular Biology and Evolution, 25(4): 673-687 DOI:10.1093/molbev/msn010 |
Streams M E, Fisher C R, Fiala-Médioni A, 1997. Methanotrophic symbiont location and fate of carbon incorporated from methane in a hydrocarbon seep mussel. Marine Biology, 129(3): 465-476 DOI:10.1007/s002270050187 |
Sun J, Zhang Y, Xu T et al, 2017. Adaptation to deep-sea chemosynthetic environments as revealed by mussel genomes. Nature Ecology & Evolution, 1(5): 0121 |
Takishita K, Takaki Y, Chikaraishi Y et al, 2017. Genomic evidence that methanotrophic endosymbionts likely provide deep-sea Bathymodiolus mussels with a sterol intermediate in cholesterol biosynthesis. Genome Biology and Evolution, 9(5): 1148-1160 DOI:10.1093/gbe/evx082 |
Taylor J D, Glover E A, 2006. Lucinidae (Bivalvia)-the most diverse group of chemosymbiotic molluscs. Zoological Journal of the Linnean Society, 148(3): 421-438 DOI:10.1111/j.1096-3642.2006.00261.x |
Taylor J D, Glover E A, 2013. New lucinid bivalves from shallow and deeper water of the Indian and West Pacific Oceans (Mollusca, Bivalvia, Lucinidae). ZooKeys, 326: 69-90 DOI:10.3897/zookeys.326.5786 |
Taylor J D, Glover E A, Williams S T, 2008. Ancient chemosynthetic bivalves: Systematics of Solemyidae from eastern and southern Australia (Mollusca: Bivalvia). Memoirs of the Queensland Museum, 54(1): 75-104 |
Taylor J D, Williams S T, Glover E A, 2007. Evolutionary relationships of the bivalve family Thyasiridae (Mollusca: Bivalvia), monophyly and superfamily status. Marine Biological Association of the United Kingdom. Journal of the Marine Biological Association of the United Kingdom, 87(2): 565-574 DOI:10.1017/S0025315407054409 |
Thubaut J, Puillandre N, Faure B et al, 2013. The contrasted evolutionary fates of deep-sea chemosynthetic mussels (Bivalvia, Bathymodiolinae). Ecology and Evolution, 3(14): 4748-4766 DOI:10.1002/ece3.749 |
Van Dover C L, Aharon P, Bernhard J M et al, 2003. Blake Ridge methane seeps: characterization of a soft-sediment, chemosynthetically based ecosystem. Deep Sea Research Part Ⅰ: Oceanographic Research Papers, 50(2): 281-300 DOI:10.1016/S0967-0637(02)00162-0 |
Von Cosel R, 2002. A new species of bathymodioline mussel (Mollusca, Bivalvia, Mytilidae) from Mauritania (West Africa), with comments on the genus Bathymodiolus Kenk & Wilson, 1985. Zoosystema, 24(2): 259-272 |
Von Cosel R, Olu K, 1998. Gigantism in mytilidae. a new bathymodiolus from cold seep areas on the barbados accretionary prism. Comptes Rendus de l'Académie des Sciences-Series Ⅲ-Sciences de la Vie, 321: 655-663 DOI:10.1016/S0764-4469(98)80005-X |
Wang H, Zhang H, Wang M X et al, 2019. Comparative transcriptomic analysis illuminates the host-symbiont interactions in the deep-sea mussel Bathymodiolus platifrons. Deep Sea Research Part Ⅰ: Oceanographic Research Papers, 151: 103082 DOI:10.1016/j.dsr.2019.103082 |
Weiss R F, Lonsdale P, Lupton J E et al, 1977. Hydrothermal plumes in the Galapagos Rift. Nature, 267(5612): 600-603 DOI:10.1038/267600a0 |
Wentrup C, Wendeberg A, Huang J Y et al, 2013. Shift from widespread symbiont infection of host tissues to specific colonization of gills in juvenile deep-sea mussels. The ISME Journal, 7(6): 1244-1247 DOI:10.1038/ismej.2013.5 |
Wood A P, Kelly D P, 1989. Methylotrophic and autotrophic bacteria isolated from lucinid and thyasirid bivalves containing symbiotic bacteria in their gills. Journal of the Marine Biological Association of the United Kingdom, 69(1): 165-179 DOI:10.1017/S0025315400049171 |
Xu T, Feng D, Tao J et al, 2019. A new species of deep-sea mussel (Bivalvia: Mytilidae: Gigantidas) from the South China Sea: morphology, phylogenetic position, and gill-associated microbes. Deep Sea Research Part Ⅰ: Oceanographic Research Papers, 146: 79-90 DOI:10.1016/j.dsr.2019.03.001 |
Yamanaka T, Mizota C, Fujiwara Y et al, 2003. Sulphur-isotopic composition of the deep-sea mussel Bathymodiolus marisindicus from currently active hydrothermal vents in the Indian Ocean. Journal of the Marine Biological Association of the United Kingdom, 83(4): 841-848 DOI:10.1017/S0025315403007872h |
Zheng P, Wang M X, Li C L et al, 2017. Insights into deep-sea adaptations and host-symbiont interactions: a comparative transcriptome study on Bathymodiolus mussels and their coastal relatives. Molecular Ecology, 26(19): 5133-5148 DOI:10.1111/mec.14160 |
Zhou L, Cao L, Wang X C et al, 2020. Metal adaptation strategies of deep-sea Bathymodiolus mussels from a cold seep and three hydrothermal vents in the West Pacific. Science of the Total Environment, 707: 136046 DOI:10.1016/j.scitotenv.2019.136046 |
 2021, Vol. 52
2021, Vol. 52


