
中国海洋湖沼学会主办。
文章信息
- 赵昕, 陈宏威, 李文朋, 李芯芯. 2021.
- ZHAO Xin, CHEN Hong-Wei, LI Wen-Peng, LI Xin-Xin. 2021.
- 阿塔卡马海沟表层水颗粒有机碳与微生物群落呼吸作用的时空变化研究
- TEMPORAL AND SPATIAL DISTRIBUTION OF PARTICULATE ORGANIC CARBON AND MICROBIAL COMMUNITY RESPIRATION OF ATACAMA TRENCH SURFACE WATER, CHILE
- 海洋与湖沼, 52(3): 648-656
- Oceanologia et Limnologia Sinica, 52(3): 648-656.
- http://dx.doi.org/10.11693/hyhz20200600163
文章历史
-
收稿日期:2020-06-08
收修改稿日期:2020-10-09
2. 南方科技大学深圳海洋地球古菌组学重点实验室 深圳 518055;
3. 南方海洋科学与工程广东省实验室(广州) 广州 511458
2. Shenzhen Key Laboratory of Marine Archaea Geo-Omics, Southern University of Science and Technology, Shenzhen 518055, China;
3. Southern Marine Science and Engineering Guangdong Laboratory (Guangzhou), Guangzhou 511458, China
近年来海沟领域的相关研究飞速发展, 海沟沟底沉积物被认为是有机碳(organic carbon, OC)的汇聚中心(depocenter), 聚集了来自海源、陆源和横向搬运的OC, 平均含量可达临近深海平原沉积物的两倍(Glud et al, 2013; Luo et al, 2019; Xiao et al, 2020)。有研究表明, 海沟表层水体的初级生产力对海沟沉积物埋藏的有机碳性质具有重要影响(Glud et al, 2013; Wenzhöfer et al, 2016; Luo et al, 2018), 但海沟体系生产力状态各不相同(Jamieson et al, 2010), 海沟表层水体与下层沉积物的距离大于6000 m, 之间的物质传输关系尚未明确, 例如关于微生物呼吸速率(microbial community respiration rate, MCR)的研究极少, 直接影响了我们对海沟表层初级生产力与沉积物有机碳关系的认识。
海洋微生物在不同水层中对颗粒有机碳(particulate organic carbon, POC)的呼吸降解作用对揭示水体-沉积物耦合作用以及其中复杂的碳循环过程尤为重要。基于全球数据, del Giorgio等(2002)于Nature上发表了关于开放大洋呼吸速率估算的综述, 整个开放大洋水体的呼吸作用速率在55.8—76.1 Gt C/a之间, 其中超过一半(32—42 Gt C/a)的呼吸作用发生在真光层, 另有近三分之一(21—28 Gt C/a)的过程发生在海洋中层。而总的初级生产力估算值则在41.4—77 Gt C/a之间。如果真光层平均深度为200 m、全球开放大洋面积为2.9×108 km2, 开放大洋的日呼吸作用速率当在1.5—2.0 mg C/(m3·d)之间, 而初级生产力则处于2.0—3.7 mg C/(m3·d)之间, 表明海洋整体为净固碳过程, 进而沉积物中潜在埋藏初级生产力沉降的有机碳。但Duarte等(2013)和Williams等(2013)就寡营养海域的碳收支能力发表过不同的见解, 前者认为从目前总结的观测数据来看, 寡营养海域的呼吸消耗量高于初级生产力的阈值。他们认为陆源物质的输入可以补充初级生产力生产量不足造成的缺口, 同时也提示化能自养过程可能在开放海域对有机物的生产具有贡献。所以初级生产力与沉积物埋藏有机碳的性质没有必要的关联性。针对区域化的研究, Wilson等(2014)曾使用滑翔机(Gliders)对太平洋的东西走向、南北走向两个断面进行连续观测, 尝试构建该区域微生物群落呼吸速率的模式。该研究发现呼吸作用与温度关系较弱, 但与叶绿素的含量和浊度的大小存在着正相关关系。但是仅靠温度、浊度、叶绿素等参数进行多元自适性回归分析, 并不能完全解释该研究获得的呼吸作用的数据(解释度低于10%)。同时, 不同海区在空间上不存在明显统一的模式, 这表明有机碳生产-呼吸过程仍需深入理解。作为极端环境, 了解海沟表层水体的碳呼吸代谢及循环过程对认识海沟整体OC循环研究具有重要意义, 但目前在海沟研究中尚未见报道。
阿塔卡马海沟位于东太平洋, 沿智利-秘鲁西部海岸分布, 距离其约160 km, 海沟长约5900 km, 宽64 km (Fujii et al, 2013)。此处东太平洋上升流作用明显, 是世界上初级生产力第二大的海沟环境[269 g C/(m2·a)]。表层海水的碳循环研究对我们了解海沟的碳循环过程具有特别影响, 因此对表层水体MCR及POC分布的研究将有助于我们理解海沟水体的OC循环过程, 从而对海沟内部甚至沉积物中碳循环提供参考。因此本研究利用2018年春“太阳号” SO261阿塔卡马海沟国际联合航次, 进行表层水体MCR测试以及POC来源及组成的研究, 研究目标为: (1) POC的元素性质; (2) 不同粒径MCR的时空分布模式; (3) MCR与POC性质的相互关系。本研究通过衡量阿塔卡马海沟表层水体微生物群落对POC的呼吸和降解作用, 对全面理解海沟表层POC向下层水体及沉积物的传输提供数据支持。
1 材料与方法 1.1 样品来源在2018年春季“太阳号”SO261国际阿塔卡马海沟调查航次中, 于地理坐标21.5°—24.5°S, 70.5°—72.0°W内采集站位S1—S7阿塔卡马海沟表层(5 m以浅)海水样品, 主要进行POC样品采集和MCR培养实验(图 1, 表 1), 为避免采样时间上导致的误差, 样品采集均在20—21点进行。同时在站位3进行24 h时间序列采样。其中S2—S6站位水深超过6000 m, 为海沟站位, S1和S7为较浅水深的非海沟站位。
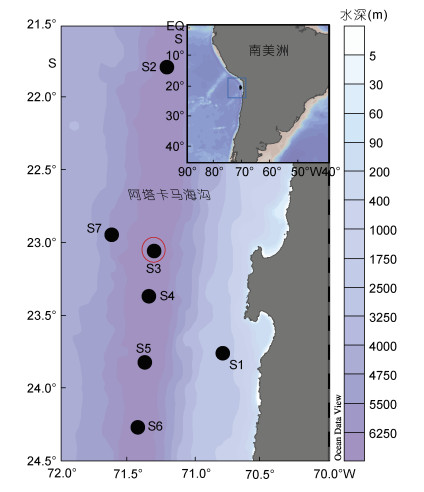 |
| 图 1 阿塔卡马海沟表层海水采样站位 Fig. 1 Sampling sites in the Atacama Trench 注: 红圈标识的站位S3为时间序列实验站 |
| 站位 | 纬度(S) | 经度(W) | 水深(m) | 备注 |
| 1 | 23°48.72′ | 70°50.04′ | 2560 | 非海沟站位 |
| 2 | 21°46.86′ | 71°12.48′ | 7995 | |
| 3 | 23°02.94′ | 71°18.12′ | 7915 | 时间序列实验 |
| 4 | 23°21.78′ | 71°20.60′ | 8085 | |
| 5 | 23°49.02′ | 71°22.32′ | 7770 | |
| 6 | 24°15.96′ | 71°25.38′ | 7720 | |
| 7 | 22°56.22′ | 71°37.08′ | 5500 | 非海沟站位 |
在各站位, 采集表层海水约1 L。经高温灼烧的GF/F (Whatman, 直径47 mm, 孔径为0.7 µm)滤膜过滤后, -80 ℃冰箱保存直至分析。
在实验室内, POC滤膜经盐酸蒸汽酸化去除无机碳之后, 由银箔包裹, 在美国加州大学戴维斯分校稳定同位素实验室(UC-Davis Stable Isotope Facility, USA)利用元素分析-同位素比值质谱仪(EA-irMA)进行POC (%)、颗粒氮(PN, %)、13C (δ13C同位素, ‰)、15N (δ15N同位素, ‰)分析。δ13C同位素以V-PDB (Vienna PeeDee Belemnite)为标准, δ15N同位素以空气为标准, 测试精密度分别为±0.1‰和±0.4‰。
1.2.2 MCR的测量MCR的测量实验方法详见Martínez-García等(2009)。该方法基于测定培养的样品中体内电子传递体系(electron transport system, ETS)中反应速率来估算呼吸速率, 碘硝基氯化四氮唑蓝(tetrazolium salt 2-para (iodo-phenyl)- 3(nitrophenyl)-5(phenyl) tetrazolium chloride, INT)作为反应中的电子受体, 加入培养体系后会进入细胞内, 被ETS中的脱氢酶还原为碘硝基四唑甲臢(INT-Formazan, INT-F), 而INT-F具有不溶于水, 有色, 稳定等特点, 能够使用分光光度计进行测试。简言之, 对筛绢过滤后的表层海水分为对照组和实验组培养, 对照组预先加入甲醛(37%)对微生物进行固定, 作为实验空白。15 min后, 与实验组进行一致的培养实验, 即向对照组和实验组各加入7.9 mmol/L的INT维持原位温度避光培养1 h。培养完成后, 加入甲醛固定。分别使用孔径为3.0、0.8、0.2 μm PC膜(PALL, 直径47 mm)低压过滤。过滤完后的0.2—0.8 μm(小粒径)、0.8—3.0 μm(中粒径)、> 3.0 μm(大粒径)样品置于离心管中, -20 ℃保存。返回实验室后, 样品膜用正丙醇超声提取, 震荡离心后, 利用分光光度计(UV-2600, 岛津)在485 nm波长处测试上述离心液并记录数据, 根据电子传递速率与呼吸耗氧速率的典型转换参数12.8 (Martínez-García et al, 2009)来计算每个样品中的MCR, 单位为mmol C/(m3·d)。
1.2.3 时间序列实验在S3站位进行时间序列采样和光照强度测量, 即3月16日23时至3月17日19时, 每隔2 h采POC样品并测量光强(20:00—5:00光强设为0), 每隔4 h采集MCR样品并培养; 并在3月17日20时最后一次采POC样品。数位式照度计(TES 1332A)用来记录采样时该站位的光照强度(单位: lx)。
实验过程中实验用水均为Milli-Q超纯水。实验试剂均为国药集团化学试剂有限公司分析纯试剂。
1.3 呼吸对初级生产力消耗的估算本文使用VGPM模型(vertically generalized production model)(Behrenfeld et al, 1997)及该海域2018年3月叶绿素的遥感数据[来自美国航空航天局Goddard航天飞行中心的海洋生物学处理组, MODIS (Moderate-resolution Imaging Spectroradiometer)传感器]对表层海水初级生产力进行了大致的估算, 得到每个站位的初级生产力的值, 单位为mg C/(m2·d)。并按照下式估算呼吸对初级生产力的消耗(R):
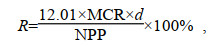 (1)
(1)式中, 12.01为碳的摩尔质量, 单位为g/mol, MCR为总的微生物呼吸速率, 单位为mmol C/(m3·d), d为深度, 单位为m, NPP为估算得到的海洋表层初级生产力。假设海洋表层(<5 m)呼吸速率变化不大, 因此将呼吸速率按5 m的深度积分后除以初级生产力的值即可估算出表层海水中微生物呼吸消耗掉的初级生产力的比例。
1.4 统计分析为探讨POC与不同粒径MCR的相互作用关系, 对S3时间序列及不同站位的所有数据进行主成分分析(PCA)。
2 结果 2.1 不同粒径MCR的时空分布 2.1.1 不同粒径MCR的日变化在S3站位的呼吸作用日变化过程中, 阿塔卡马海沟表层水体总MCR夜间(19:00—3:00)相对日间(7:00—15:00)显著增高(74.3%, 图 2)。23时的MCR甚至超过日间均值(0.39, n=4)的一倍以上。白昼时期MCR变化总体比较平稳[(0.39±0.025) mmol C/(m3·d)], 整个白天MCR最强的时间为11时, 早晨和午后MCR维持在相对较低的水平。傍晚以后MCR逐渐增加, 最终在午夜时期达到的全天最高值。而进入后半夜, MCR有所降低, 直至清晨达到全天的最低值。同时, 整个白昼时期MCR变化不大, 特别是中午光照最强的时候, 也未出现MCR的最低值。而到了夜晚, 光强度降低, 表层海水逐渐降温, 微生物呼吸速率随之上升, 并在23时附近达到峰值, 随着表层海水温度进一步降低, 到凌晨时(3时), MCR逐渐降低。
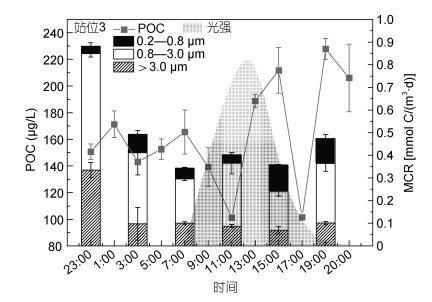 |
| 图 2 S3站位的POC浓度、总MCR及不同粒径MCR的日变化 Fig. 2 Time-series of POC, total MCR and size fractionated MCR at S3 over a day 注: 总MCR为大中小MCR之和 |
S3站位不同粒径的MCR如图 2所示。在24 h内, 中粒径MCR在一天中的所有时段均显著高于小粒径和大粒径的MCR。同时, 中粒径MCR在在后半夜至午间较为波动, 其最低值出现在15时; 随后开始升高, 其最大值出现在23时, 此时光照强度已衰减为零。大粒径MCR大部分时间较为稳定, 基本维持在0.1 mmol C/(m3·d)左右, 与中粒径微生物情况较为相似的是, 大粒径MCR在15时达到最低值, 随后至23时的呼吸强度明显快速上升, 远离0.1 mmol C/(m3·d)的值, 最大值达到0.33 mmol C/(m3·d), 增大了三倍。小粒径MCR总体来说略低于大粒径MCR, 与另外两组不同的是, 其最大值出现在15时, 而最小值出现在23时; 对于小粒径MCR来说, 午后至夜间的值逐渐降低, 这与大粒径和中粒径两组的变化趋势恰好相反。
总体来说, 大、中、小粒径范围的微生物群落具有明显不同的MCR, 表明不同粒径的微生物群落在同一片海域不同时间对POC存在不同程度的呼吸降解关系(图 2)。在该区域(S3站位附近), 中粒径MCR占主导作用, 其贡献率大于50%。剩下两种粒径的微生物群落呼吸强度各不相同。
2.1.2 MCR的空间分布在阿塔卡马海沟表层水体MCR的空间分布上(图 3), 发现MCR最高的站位是S5, 比最低值(S7)高出近十倍。另外, 对比海沟站位和非海沟站位, 海沟站位表层水体中MCR明显高于非海沟站位表层水(82.8%)。而海沟各站位的MCR变化相对平缓, 但仍然出现了S5这样的高值。相比下, 非海沟站位的MCR则较为平稳地维持在较低的强度。
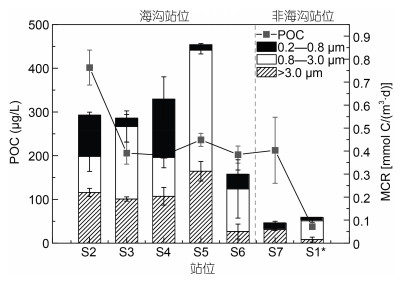 |
| 图 3 不同站位POC浓度、总MCR及三种粒径范围MCR的分布 Fig. 3 Distribution of POC, total MCR and size fractionated MCR at different sites 注: S1*站位的采样深度为50 m, 其余各站位的采样深度均为5 m, 下同 |
大、中和小粒径三个范围内的MCR在空间上呈现出与日变化类似的结果(图 3)。平均而言, 中粒径的MCR大于大粒径和小粒径, 但是在某些站位(S2、S4), 中粒径的MCR并没有占据主导地位。中粒径MCR由北(S2)向南(S6)没有呈现出明显的模式, 不同站位之间的数值波动非常大, 海沟站位中最大>0.5 mmol C/(m3·d), 最小值约为0.15 mmol C/(m3·d), 并且所有海沟站位的中粒径MCR都大于非海沟站位(S1*)值。在海沟站位, 大粒径MCR比较稳定, 其值由北向南先略有上升, 然后下降, 最大MCR为S5站位, 最小值出现在S6站位, 其值近乎0。小粒径MCR同样波动较大, S4站位的值小粒径MCR占主导地位, 但S3、S5站位的数值表明其群体呼吸强度十分微弱; 平均而言, 小粒径MCR在三种粒径范围内属于最低的一类。
总之, 不同站位难以发现明显的空间变化模式, 但海沟站位的MCR普遍高于非海沟站位。另外, 总体来说, 中粒径的MCR有明显优势, 小粒径的MCR则最弱, 这一点与日变化数据基本一致, 但是在涉及具体站位的情况时, 各粒径MCR相对大小则略有不同。
2.2 POC的时空分布S3站位的水体POC浓度值日变化见图 2, 其值在24 h内波动巨大, 最低值(101.2 μg/L)出现在11时, 最高值[(227.8±7.9) μg/L]出现在19时, 最大值与最小值之间相差约两倍。POC浓度虽然在11时和17时有所降低, 但在白天(5—19时)整体呈上升趋势, 而在夜间则出现明显的下降。POC浓度在24 h内的变化趋势与三种不同粒径微生物群落呼吸强度值存在一定联系, 表现出与大、中粒径的MCR趋势相反, 而与小粒径的MCR相一致的分布。
S3站位POC的δ13C的值变化范围为-24.4‰— -21.0‰(图 4a)。与POC不同, δ13C的值从午夜(23时)的最高值(-21.0‰±0.5‰)开始下降, 至11时达最低值(-24.4‰), 而后略微升高, 并保持相对稳定的状态。δ15N的值变化趋势与δ13C一致, 最高值在23时(10.0‰±0.4‰), 而后逐渐降低, 但在早上7时左右略升高, 并同样在11时达到最低(4.1‰)随后逐渐升高。C/N值则与δ13C、δ15N变化一致。三者的变化趋势较统一, 都具有夜间高, 白天偏低的趋势, 同时在正午光强最大时达最低值, 与光强成反比(R=-0.84, P<0.05)。
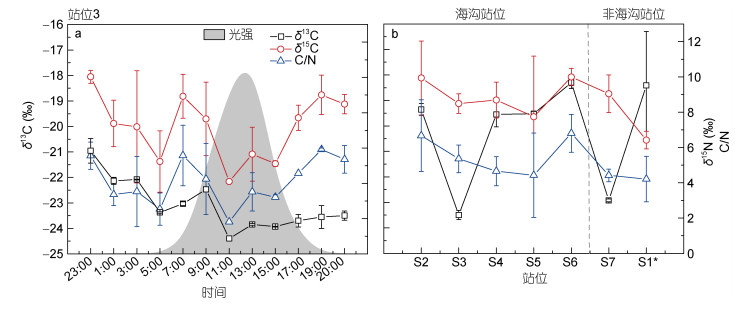 |
| 图 4 各测试站位的POC参数: S3站位的δ13C、δ15N、C/N值与光照强度日变化(a); 不同站位POC的δ13C、δ15N、C/N值(b) Fig. 4 δ13C, δ15N, C/N ratio and light intensity at site S3 over a day (a); δ13C and δ15N, C/N ratio at different sites (b) |
| 研究区域 | 浓度(μg/L) | 来源 |
| 泰晤士河口 | ~3500 | (Abril et al, 2002) |
| 黄河口 | 70—27470 | (张向上, 2004) |
| 长江口 | 4704 | (林晶, 2007) |
| 切萨皮克湾 | 1812±636 | (Fisher et al, 1998) |
| 台湾海峡 | 120±9 | (Liu et al, 2000) |
| 墨西哥湾 | 12—60 | (Guo, 1995) |
| 西地中海 | 48—960 | (Cauwet et al, 1997) |
| 黑潮地区 | 60—80 | (Parsons, 1975) |
| 大西洋 | 15—230 | (Rasse et al, 2017) |
| 南印度洋 | 18±164 | (Tréguer et al, 1988) |
| 秘鲁流区域 | 125—250 | (Parsons, 1975) |
| 833—2777 | (Becker et al, 2020) | |
| 阿塔卡马海沟表层水 | 38—402 | 本文 |
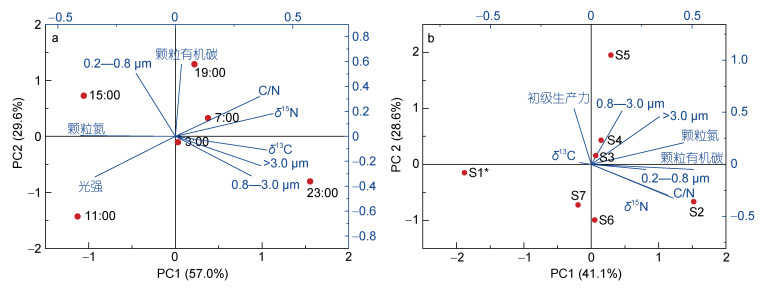 |
| 图 5 测试参数的PCA分析: S3时间序列实验(a); 各站位实验(b) Fig. 5 Principal component analysis of POC and size fractionated MCR: Time-series site of S3 (a); Different sites (b) |
不同站位水体样品中的POC浓度值变化较为均一(图 3), 大致维持在200 μg/L的浓度附近, 但S2站位的高值达到了450 μg/L; 两个非海沟站位的POC浓度值变化比较大, 其中S7站位的值约为(212.5±75.6) μg/L, S1*站位的值约为(38.0±2.4) μg/L。但是总体海沟站位的POC浓度高于非海沟站位, 这与微生物的呼吸作用趋势一致。
不同站位的δ13C值变化不大(-19.0‰±0.6‰, S3和S7两个站位除外, 图 4b), S3和S7两个站位POC的δ13C值分别为-23.5‰、-22.9‰。δ15N和C/N值则与POC变化趋势相似, 海沟站位的值(δ15N为9.0‰±1.0‰, C/N为4.6±0.8)高于非海沟站位(δ15N为7.7‰±1.9‰, C/N为3.7±0.1), 且从北向南(S2—S5)逐渐降低, S6站位的值较其他站位要高。
3 讨论 3.1 时间序列实验POC与MCR的关系本研究中表层海水POC浓度值平均为185.5 μg/L (表 2), 与Parsons (1975)在秘鲁暖流区域得出的值相近(Jamieson et al, 2010)。站位S3一天内的MCR呈“M”模式, 且在白天变化不大, 考虑到表层海水温度较高且较恒定, 微生物也可能存在的垂向运动(Forward Jr, 1976; Bianchi et al, 2013), 同时表层阳光较强烈, 一般为某些抗光性比较强的类群活动区域(Turon et al, 1992; López-Legentil et al, 2016), 因此MCR总体比较稳定且较低。一方面, 充足适量的光照能够为表层的光合微生物提供能量, 使其体内的生物酶活性保持在正常水平, 以维持正常的生命活动(Casey et al, 2017)。另一方面, 过强的紫外线一定程度上会抑制微生物正常代谢及酶活性, 从而导致生物活动减弱(Alonso-Sáez et al, 2006), 即常见的白天的光合作用大于表层海水的MCR这一现象。作为海洋微生物潜在的可利用资源之一, POC与MCR呈现潜在的关系, 在本研究中, POC浓度与不同粒径的MCR在时间序列上有一定联系。但是POC浓度和MCR并没有空间分布上的明显关系。这可能由于有限的站位数据导致, 也可能与不同站位在空间上表现出复杂的POC来源和微生物群落结构有关。
从日变化的趋势和PCA分析结果来看(图 2, 图 5a), 午夜(23:00)和正午(11:00)的MCR主要受光强影响, 而其他时间段不同粒径的MCR则与POC的浓度及元素组成有着密切的关系。小粒径MCR与POC浓度值的正相关性比较强(R=0.8, P<0.01), 说明小粒径的微生物代谢活性主要受POC浓度的影响; 而大粒径和中粒径MCR与POC浓度的相关性不明显(R=-0.27, P<0.01), 并在午后呈现相反的变化趋势。考虑到微生物存在附着相和悬浮相两种状态(Paerl, 1975; Liu et al, 2018), 小粒径范围内的微生物更加可能附着于POC以保证充足的物质能量供应来进行代谢活动(张乃星等, 2006); 而中粒径和大粒径MCR在某些时段与POC浓度变化趋势相反, 说明较大的微生物群体可能更倾向于悬浮自由的生存方式, 可以直接将部分POC颗粒以及小粒径微生物作为代谢的物质来源(Legendre et al, 2002)。小粒径和大中粒径MCR呈现相反的趋势也从某种程度上暗示了小粒径微生物与较大粒径微生物之间存在的捕食或者竞争关系(Calbet et al, 2004)。同时, 大中粒径MCR与δ13C具有一定的正相关关系, 随着大中粒径MCR的增大(例如23时), 含较轻C同位素的POC组分被首先利用, 导致δ13C值增大, 相反, 当MCR变小时(例如15时), POC的δ13C值分馏作用不明显。由此可见, δ13C值在一天之内有规律的波动从侧面反映了MCR在一天之中的变化情况, 以及大中粒径微生物群落的呼吸作用对该海域POC产生的同位素分馏作用。δ15N的变化规律与δ13C相似。
3.2 不同站位MCR与POC的空间变化利用同位素来表征物质来源是一种比较常用的地球化学方法。一般而言, δ13C越亏损, 表明其组分越惰性, 越接近陆相, 反之则更接近海相(Hobson et al, 1995; Rogers et al, 2019)。而在不同站位中, δ13C的变化(图 4b)与对应的MCR(图 3)既有符合上述日变化规律的, 即δ13C值变化与MCR变化相反, 如海沟站位中的S2、S3、S4; 而S6、S5等站位二者则没有明显关联。整体上, δ13C的值变化不大(S3和S7除外)。所以, 在空间分布上, MCR对δ13C、δ15N的同位素分馏作用不显著。
相较于日变化, MCR在不同站位的变化趋势并不单一由POC控制。从变量的角度来看, 不同站位的MCR反映的是较大尺度上对某区域POC的代谢与降解; 从PCA的分析结果看, 这种大尺度区域性的POC的代谢与降解与NPP有关, 表现在大中粒径的MCR随着不同站位NPP的增大而增大(图 5b), 这种正相关性在中粒径的MCR更为明显, 所以NPP为微生物提供了呼吸的能量来源。对于小粒径微生物而言, 不同站位的MCR与POC浓度密切相关, 这与日变化规律一致。所以在初级生产力较高的阿塔卡玛海沟区域, MCR对POC的代谢与其浓度的变化更密切。
从C/N的角度看, C/N值对区域内的微生物代谢活性具有潜在的控制作用(Avnimelech, 1999; Robidart et al, 2019)。根据Redfield值C: N: P=106:16:1 (Atkinson et al, 1983), 假设同一区域N、P输入是按同样比例的, 则可用C/N简单代表三者之间的关系, 即C/N处于6—7之间时该区域元素处于平衡状态, 此时微生物代谢的效率比较高, 而C/N更高或者较低都会因为N或者C元素的不足限制微生物代谢(Marañón et al, 2018), 而本研究中C/N普遍低于7, 故在MCR日变化中, MCR峰值应该出现在C/N较高的时段(7时, 23时), 这与上述δ13C和δ15N值对应的推测相同。但在不同站位上, 输入的N、P比例都不同, C/N及δ15N的值在PCA分析中与小粒径的MCR有一定影响, 因此C/N的值并不能直接反映潜在的MCR, 因而不同站位C/N值变化与对应站位MCR变化不一致是可以理解的。比如海沟站位中S4、S5站位的C/N值大致和S9、S7、S1*相近, 但几者间的MCR相差较大, 这说明不同站位的MCR可能还与距陆地的距离、海水深度、海流等有关(Kim et al, 2017), 尚待获得更充分的数据作进一步研究。
利用遥感数据估算出该海域初级生产力在844—1592 mg C/(m2·d) [169-318 mg C/(m3·d)], 这个结果与其他研究中(Longhurst et al, 1995)大洋的初级生产力处于相同数量级, 但是值相对较高(表 3)。这与阿塔卡马海沟区域拥有较高的初级生产力的特点相吻合。基于上述数据, 阿塔卡马海沟表层水MCR对NPP的消耗大约为0.5%—4.6%。在某些研究中, 研究区域的微生物呼吸能够消耗掉NPP的10%—30% (Hashimoto et al, 2005; Carvalho et al, 2017)。相对而言本研究的结果偏低, 一方面由于本研究数据只考虑5 m水深的状况, 因此可能会低估此区域的整体结果。另外, 本研究对象位于上升流区域, 初级生产力偏高; 最后, 也可能与营养盐偏离Redfield比值后抑制了MCR有关。虽然相关研究需要进一步完善, 但本结果为海沟水体-沉积物的耦合作用提供了数据支持。
| 地区 | 初级生产力[mg C/(m3·d)] |
| 海岸区(coastal domain) | 220 |
| 印度洋 | 80 |
| 大西洋 | 100 |
| 215a | |
| 太平洋 | 80 |
| 165b | |
| 上升流(upwelling provinces) | 220 |
| 340a | |
| 阿塔卡马海沟(本文) | 169—318 |
| 注: *改自Longhurst等(1995); a来自Tilstone等(2017); b来自Matsumoto等(2016) | |
本研究利用阿塔卡马海沟表层不同站位样品以及同一站位(S3)在一天之内的时间序列样品, 来探究该海域不同粒径微生物群落对POC的呼吸速率在时间和空间上的变化规律以及潜在原因。首先, 阿塔卡马海沟表层水体中MCR的日变化呈现“M”型曲线的双峰变化模式, 但空间上变化模式并不显著。此外, 不同粒径颗粒范围内的MCR在空间和日变化中表现出不同的特点, 其中中粒径MCR贡献最大, 且在短时间内(24 h)会对研究区内的POC元素组成和同位素产生一定的分馏作用, 而空间上则与初级生产力密切相关。阿塔卡马海沟表层水体的MCR大约为该区域初级生产力的0.5%—4.6%, 比大洋平均水平偏低, 这与该区域较高的初级生产力导致的高输出生产力有关。这为海沟沉积物有机碳部分源于初级生产力提供了一定证据。本研究进一步工作可以从样品微生物的种类以及环境水样中POC的组成出发, 进一部探讨不同微生物与不同活性有机碳之间的相互关系。
张乃星, 宋金明, 贺志鹏. 2006. 海水颗粒有机碳(POC)变化的生物地球化学机制. 生态学报, 26(7): 2328-2339 DOI:10.3321/j.issn:1000-0933.2006.07.037 |
张向上, 2004. 黄河口有机碳的时空分布及影响因素研究. 青岛: 中国海洋大学硕士学位论文, 55-60
|
林晶, 2007. 长江口及其毗邻海区溶解有机碳和颗粒有机碳的分布. 上海: 华东师范大学硕士学位论文, 36-41
|
Abril G, Nogueira M, Etcheber H et al, 2002. Behaviour of organic carbon in nine contrasting european estuaries. Estuarine, Coastal and Shelf Science, 54(2): 241-262 DOI:10.1006/ecss.2001.0844 |
Alonso-Sáez L, Gasol J M, Lefort T et al, 2006. Effect of natural sunlight on bacterial activity and differential sensitivity of natural bacterioplankton groups in northwestern mediterranean coastal waters. Applied and Environmental Microbiology, 72(9): 5806-5813 DOI:10.1128/AEM.00597-06 |
Atkinson M J, Smith S V, 1983. C: N: P ratios of benthic marine plants. Limnology and Oceanography, 28(3): 568-574 DOI:10.4319/lo.1983.28.3.0568 |
Avnimelech Y, 1999. Carbon/nitrogen ratio as a control element in aquaculture systems. Aquaculture, 176(3-4): 227-235 DOI:10.1016/S0044-8486(99)00085-X |
Becker S, Tebben J, Coffinet S et al, 2020. Laminarin is a major molecule in the marine carbon cycle. Proceedings of the National Academy of Sciences of the United States of America, 117(12): 6599-6607 DOI:10.1073/pnas.1917001117 |
Behrenfeld M J, Falkowski P G, 1997. Photosynthetic rates derived from satellite-based chlorophyll concentration. Limnology and Oceanography, 42(1): 1-20 DOI:10.4319/lo.1997.42.1.0001 |
Bianchi D, Stock C, Galbraith E D et al, 2013. Diel vertical migration: ecological controls and impacts on the biological pump in a one-dimensional ocean model. Global Biogeochemical Cycles, 27(2): 478-491 DOI:10.1002/gbc.20031 |
Calbet A, Landry M R, 2004. Phytoplankton growth, microzooplankton grazing, and carbon cycling in marine systems. Limnology and Oceanography, 49(1): 51-57 DOI:10.4319/lo.2004.49.1.0051 |
Carvalho M C, Schulz K G, Eyre B D, 2017. Respiration of new and old carbon in the surface ocean: implications for estimates of global oceanic gross primary productivity. Global Biogeochemical Cycles, 31(6): 975-984 DOI:10.1002/2016GB005583 |
Casey J R, Ferrón S, Karl D M, 2017. Light-enhanced microbial organic carbon yield. Frontiers in Microbiology, 8: 2157 DOI:10.3389/fmicb.2017.02157 |
Cauwet G, Miller A, Brasse S et al, 1997. Dissolved and particulate organic carbon in the western Mediterranean Sea. Deep Sea Research Part Ⅱ: Topical Studies in Oceanography, 44(3-4): 769-779 DOI:10.1016/S0967-0645(96)00085-9 |
del Giorgio P A, Duarte C M, 2002. Respiration in the open ocean. Nature, 420(6914): 379-384 DOI:10.1038/nature01165 |
Duarte C M, Regaudie-de-Gioux A, Arrieta J M et al, 2013. The oligotrophic ocean is heterotrophic. Annual Review of Marine Science, 5: 551-569 DOI:10.1146/annurev-marine-121211-172337 |
Fisher T R, Hagy J D, Rochelle-Newall E, 1998. Dissolved and particulate organic carbon in Chesapeake bay. Estuaries, 21(2): 215-229 DOI:10.2307/1352470 |
Forward Jr R B, 1976. Light and diurnal vertical migration: photobehavior and photophysiology of plankton. In: Smith K C ed. Photochemical and Photobiological Reviews Volume 1. Boston, MA: Springer
|
Fujii T, Kilgallen N M, Rowden A A et al, 2013. Deep-sea amphipod community structure across abyssal to hadal depths in the peru-chile and kermadec trenches. Marine Ecology Progress Series, 492: 125-138 DOI:10.3354/meps10489 |
Glud R N, Wenzhöfer F, Middelboe M et al, 2013. High rates of microbial carbon turnover in sediments in the deepest oceanic trench on earth. Nature Geoscience, 6(4): 284-288 DOI:10.1038/ngeo1773 |
Guo L, 1995. Cycling of dissolved and colloidal organic matter in oceanic environments as revealed by carbon and thorium isotopes. Texas. Texas A & M University, 177-205.
|
Hashimoto S, Horimoto N, Yamaguchi Y et al, 2005. Relationship between net and gross primary production in the Sagami Bay, Japan. Limnology and Oceanography, 50(6): 1830-1835 DOI:10.4319/lo.2005.50.6.1830 |
Hobson K A, Ambrose Jr W G, Renaud P E, 1995. Sources of primary production, benthic-pelagic coupling, and trophic relationships within the Northeast Water Polynya: insights from δ13C and δ15N analysis. Marine Ecology Progress Series, 128: 1-10 DOI:10.3354/meps128001 |
Jamieson A J, Fujii T, Mayor D J et al, 2010. Hadal trenches: the ecology of the deepest places on earth. Trends in Ecology & Evolution, 25(3): 190-197 |
Kim B, Kim S H, Kwak J H et al, 2017. Heterotrophic bacterial production, respiration, and growth efficiency associated with upwelling intensity in the Ulleung Basin, East Sea. Deep Sea Research Part Ⅱ: Topical Studies in Oceanography, 143: 24-35 DOI:10.1016/j.dsr2.2017.07.002 |
Legendre L, Rivkin R B, 2002. Fluxes of carbon in the upper ocean: regulation by food-web control nodes. Marine Ecology Progress Series, 242: 95-109 DOI:10.3354/meps242095 |
Liu R L, Wang L, Liu Q F et al, 2018. Depth-resolved distribution of particle-attached and free-living bacterial communities in the water column of the new britain trench. Frontiers in Microbiology, 9: 625 DOI:10.3389/fmicb.2018.00625 |
Liu Z F, Peng X Y, Li X et al, 2000. Particulate organic carbon (POC) in Taiwan Strait during two cruses in summer 1997 and winter 1998. Journal of Oceanography in Taiwan Strait, 19(1): 95-101 |
Longhurst A, Sathyendranath S, Platt T et al, 1995. An estimate of global primary production in the ocean from satellite radiometer data. Journal of Plankton Research, 17(6): 1245-1271 DOI:10.1093/plankt/17.6.1245 |
López-Legentil S, Turon X, Erwin P M, 2016. Feeding cessation alters host morphology and bacterial communities in the ascidian Pseudodistoma crucigaster. Frontiers in Zoology, 13: 2 DOI:10.1186/s12983-016-0134-4 |
Luo M, Gieskes J, Chen L Y et al, 2019. Sources, degradation, and transport of organic matter in the new britain shelf-trench continuum, papua new guinea. Journal of Geophysical Research: Biogeosciences, 124(6): 1680-1695 DOI:10.1029/2018JG004691 |
Luo M, Glud R N, Pan B B et al, 2018. Benthic carbon mineralization in hadal trenches: insights from in situ determination of benthic oxygen consumption. Geophysical Research Letters, 45(6): 2752-2760 DOI:10.1002/2017GL076232 |
Marañón E, Lorenzo M P, Cermeño P et al, 2018. Nutrient limitation suppresses the temperature dependence of phytoplankton metabolic rates. The ISME Journal, 12(7): 1836-1845 DOI:10.1038/s41396-018-0105-1 |
Martínez-García S, Fernández E, Aranguren-Gassis M et al, 2009. In vivo electron transport system activity: a method to estimate respiration in natural marine microbial planktonic communities. Limnology and Oceanography: Methods, 7(6): 459-469 DOI:10.4319/lom.2009.7.459 |
Matsumoto K, Abe O, Fujiki T et al, 2016. Primary productivity at the time-series stations in the northwestern Pacific Ocean: is the subtropical station unproductive?. Journal of Oceanography, 72(3): 359-371 DOI:10.1007/s10872-016-0354-4 |
Paerl H W, 1975. Microbial attachment to particles in marine and freshwater ecosystems. Microbial Ecology, 2(1): 73-83 DOI:10.1007/BF02010382 |
Parsons T R, 1975. Particulate organic carbon in the Sea. In: Riley J P, Skirrow G eds. Chemical Oceanography. London, UK: Academic Press, 365-383
|
Rasse R, Dall'Olmo G, Graff J et al, 2017. Evaluating optical proxies of particulate organic carbon across the surface atlantic ocean. Frontiers in Marine Science, 4: 367 DOI:10.3389/fmars.2017.00367 |
Robidart J C, Magasin J D, Shilova I N et al, 2019. Effects of nutrient enrichment on surface microbial community gene expression in the oligotrophic North Pacific Subtropical Gyre. The ISME Journal, 13(2): 374-387 DOI:10.1038/s41396-018-0280-0 |
Rogers K L, Bosman S H, Weber S et al, 2019. Sources of carbon to suspended particulate organic matter in the northern Gulf of Mexico. Elementa: Science of the Anthropocene, 7: 51 DOI:10.1525/elementa.389 |
Tilstone G H, Lange P K, Misra A et al, 2017. Micro-phytoplankton photosynthesis, primary production and potential export production in the Atlantic Ocean. Progress in Oceanography, 158: 109-129 DOI:10.1016/j.pocean.2017.01.006 |
Tréguer P, Gueneley S, Kamatani A, 1988. Biogenic silica and particulate organic matter from the indian sector of the Southern Ocean. Marine Chemistry, 23(1-2): 167-180 DOI:10.1016/0304-4203(88)90030-8 |
Turon X, Becerro M A, 1992. Growth and survival of several asoidian species from the northwestern Mediterranean. Marine Ecology Progress Series, 82: 235-247 DOI:10.3354/meps082235 |
Wenzhöfer F, Oguri K, Middelboe M et al, 2016. Benthic carbon mineralization in hadal trenches: assessment by in situ O2 microprofile measurements. Deep Sea Research Part Ⅰ: Oceanographic Research Papers, 116: 276-286 DOI:10.1016/j.dsr.2016.08.013 |
Williams P J L B, Quay P D, Westberry T K et al, 2013. The oligotrophic ocean is autotrophic. Annual Review of Marine Science, 5: 535-549 DOI:10.1146/annurev-marine-121211-172335 |
Wilson J M, Rodney S, Beman J M et al, 2014. Ocean-scale patterns in community respiration rates along continuous transects across the pacific ocean. PLoS One, 9(7): e99821 DOI:10.1371/journal.pone.0099821 |
Xiao W J, Xu Y P, Haghipour N et al, 2020. Efficient sequestration of terrigenous organic carbon in the New Britain Trench. Chemical Geology, 533: 119446 DOI:10.1016/j.chemgeo.2019.119446 |
 2021, Vol. 52
2021, Vol. 52


